Ацинетобактерии вызывающие инфекции мочевых путей
Обновлено: 24.04.2024

Про ацинетобактер знают все, кто в том или ином виде работает в стационарах. Ацинетка очень быстро заместила собой всю предыдущую внутрибольничную микрофлору и фактически вышла на первый план самых проблемных внутрибольничных микробов.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Если еще каких-то 7 лет назад ацинетобактер была зверем, о котором знали реаниматологи крупных больниц да клинические фармакологи, то менее пяти лет назад ситуация кардинально изменилась – теперь про ацинетку знают все, кто в том или ином виде работает в стационарах. Она очень быстро заместила собой всю предыдущую внутрибольничную микрофлору и фактически вышла на первый план самых проблемных внутрибольничных микробов, заняв чуть ли не основную нишу ВБИ.
Автор сразу хотел бы предупредить, что речь здесь пойдет не столько об Acinetobacter baumannii, сколько о семействе ацинетобактеров, ибо клиническую значимость имеет не только вышеупомянутый возбудитель.

Ацинетобактеры являются представителями тройки основных опасных возбудителей согласно определению ВОЗ. Двух других представителей из этого списка мы уже обсудили: это синегнойная палочка и энтеробактерии (клебсиелла, кишечная палочка, энтерококки). Именно для этой могучей тройки в первую очередь и должны разрабатываться новые антибиотики, но пока с этим как-то не очень.
Микробиологические аспекты
Поэтому будем изучать врага в лицо
Теперь посмотрим на, можно сказать, типичных представителей семейства Acinetobacter spp. Необходимо отметить, что продемонстрированные ниже возбудители выделены из ран, полученных в результате ДТП в летнее время, причем у пациентов, которые длительное время не лечились антибиотиками, то есть оба зверя являются дикими.
На первом фото лечащему врачу повезло, так как ему достался возбудитель, чувствительный ко всему возможному арсеналу антибиотиков, которые в принципе могут повлиять на данный микроб.
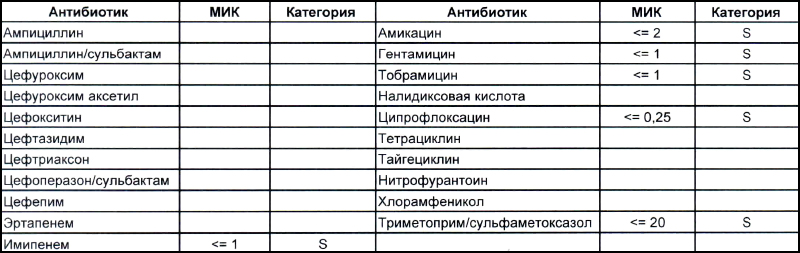
На второй антибиотикограмме возбудитель тоже получен из раны, ни разу не леченной антибиотиками, а также сам больной длительное время ничего антибактериального не употреблял. Данный случай очень хорошо демонстрирует то, что мы обсудили раньше, – только по антибиотикограмме в случае ацинеток трудно сказать, внутрибольничный возбудитель вызвал гнойно-воспалительный процесс или дикий уличный.
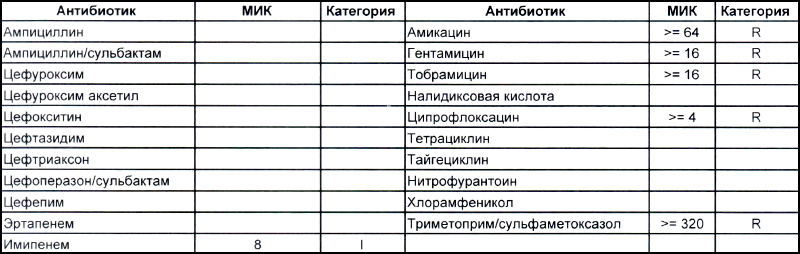
В научно-исследовательском институте, который может провести генетическое исследование возбудителя, смогут выяснить полностью, дикий это штамм или внутрибольничный, а мы, работающие на земле, скорее всего, не ответим на этот вопрос. Правда, у нас теперь СК все про всех знает, и автор уже давно ждет, когда очередного несчастного еще и в такого рода заражении обвинят.
Следует отметить, что обе эти картинки не отменяют факта наличия внутрибольничного заражения как первым штаммом (горшки с цветами помним?), так и вторым, в который под действием использующихся в больнице антибиотиков может выродиться первый. Ациентка, как и предыдущие обсуждаемые возбудители ВБИ, так же не имеет крылышек и ножек, ее точно так же переносят на руках и плохо обработанном медицинском оборудовании (эндоскопы, точнее, бронхоскопы, это просто бич крупных стационаров). Поэтому только внутриведомственный микробиологический надзор и работа над соблюдением санэпидрежима помогает удержать и эту зверюгу в хоть каких-то приемлемых рамках.
Клинические аспекты
Что способен вызвать ацинетобактер?
- Раневую инфекцию
- Инфекции кровотока
- Инфекции дыхательных путей – в первую очередь, внутрибольничную пневмонию, часто вентилятор-ассоциированную, особенно так называемую позднюю (более семи суток на ИВЛ). Здесь он делит пальму первенства с синегнойкой и MRSA
- Внутрибольничные менингиты
- Инфекции мочевыводящих путей, чаще всего ассоциированные с использованием эндоскопического оборудования
- Перитониты у пациентов на перитонеальном диализе
- Почти полный набор инфекций, связанных с установкой имплантов или протезов
В общем, как вы можете видеть, ацинетка способна загубить на корню любой врачебный труд, так как инфекции, ей вызванные, имеют высокий процент летальности у пациентов, имеющих факторы риска развития подобной инфекции.
К факторам риска относятся:
Чем лечить?
Как вы могли убедиться, лечить ацинетку эмпирически (а это возможно только при тщательном внутрибольничном мониторинге), и даже с использованием диско-диффузионного метода, не очень-то и получится. Точнее, не получится совсем. Нужны аппаратные методы диагностики, чтобы точно знать, с чем вы имеете дело. И внутрибольничный мониторинг тоже крайне необходим, особенно если неферментеры сеются массово, чтобы знать — заполз ли возбудитель с улицы или уже свой зверинец развели. Во втором случае только мыть-мыть и еще раз мыть всю больницу полностью, а не только одно отделение, а также переходить на полностью одноразовые расходники, и к аппаратам ИВЛ тоже. Автор понимает, что при этих словах или в монитор захочется плюнуть, или помидором тухлым швырнуть, благо сезон пока не закончен.
Так как лечить?
В рамках клинических рекомендаций по той нозологии, которая у вашего пациента имеется, выложенных здесь, всегда только комиссионно, с привлечением клинических фармакологов и клинических микробиологов. И мойте руки после каждого подобного пациента очень тщательно — это ваша личная техника безопасности.

Мы уже поговорили о внебольничных инфекциях мочевыводящих путей, сегодня пришла очередь поговорить о нозокомиальных и так называемых осложненных (хотя нозокомиальные являются их частным случаем).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Мы уже поговорили о внебольничных инфекциях мочевыводящих путей, сегодня пришла очередь поговорить о нозокомиальных и так называемых осложненных (хотя нозокомиальные являются их частным случаем). Конечно, лечение всех этих состояний находится в ведении профильных специалистов (коим эта статья, скорее всего, неактуальна), но, увы, не в каждой больнице они есть, да и предварительный диагноз ставить все равно нужно нам. Актуальность темы также вызвана и тем, что сейчас лето, и оно на редкость жаркое на европейской территории нашей страны, а потому все это безобразие попало в максимально комфортные для себя условия, когда тепло, темно и сыро.
Для начала определимся в терминологии, чтобы в дальнейшем не запутаться.
Вспомним, что внебольничные инфекции мы разобрали тут. Они, как мы помним, относятся к довольно быстро, при должном навыке, излечимым состояниям. Лечить их относительно несложно, так как флора дикая и непуганая, а схемы антибактериальной терапии относятся к справочному материалу.
Другое дело осложненные инфекции мочевыводящих путей и их частный случай – нозокомиальные. Тут все сразу все сложно, начиная с возбудителей, заканчивая методами лечения. Начнем традиционно с микробиологических аспектов.
Если вы помните, то основными возбудителями внебольничных уроинфекций были кишечные палочки. Назначаешь практически не глядя антибиотик, к которому данная палка чувствительна, пара-тройка дней – и пациент практически здоров, но тут начинается война за длительность обязательного приема препарата. И вот эта самая война, в случае проигрыша врача и некоторых обстоятельств со стороны пациента, доводит последнего до осложнений. Но обо всем по порядку.
Итак, главными возбудителями осложненных уроинфекций являются:
- Семейство Enterobacteriaceae (Proteus spp., Klebsiella spp., Morganella spp., Serratia spp.)
- Pseudomonasaeruginosa, она же синегнойная палочка
- Семейство Acinetobacter
На вторых ролях находятся:
- Метициллин-резистентные стафилококки (MRSA), хотя в случае развития карбункула почки он играет главнейшую роль
- Семейство Enterococcus (включая ванкомицин-резистентные)
- Семейство Candida
Но главное, что необходимо помнить, – чаще всего случаи осложненных инфекций, и особенно нозокомиальных, носят полимикробный характер, особенно когда пациенту установлен постоянный мочевой катетер.
Клинические аспекты
Что влияет на возможность развития осложнений? Все как везде – особенности со стороны пациента, особенности со стороны оказания медицинской помощи, особенности окружающей пациента среды.
Особенностями со стороны пациента являются:
- Возраст – чем старше пациент, тем риск осложнений выше.
- Пол – у мужчин все сильно сложнее в виду анатомии мочевыводящих путей, а также с возрастом и с развитием аденомы простаты.
- Наличие сопутствующих заболеваний – сахарный диабет, ВИЧ, онкозаболевание или аутоиммунное заболевание с применением иммуносупрессивной терапии.
- Наличие конкрементов, стриктур и т. п. в мочевыводящих путях, ведущее к трудностям в консервативной терапии и требующее хирургического лечения.
- Наличие заболеваний, которые поддерживают персистирование возбудителей, но не могут быть полностью удалены, – постоянный мочевой катетер, аномалии почки и т. п.
Со стороны окружающей среды – тепло, темно и сыро, то есть подгузники, прокладки, одноразовые пеленки и тому подобные предметы ухода, не меняющиеся в нормативные интервалы времени. И вот тут-то и выходят на первый план представители семейства Enterobacteriaceae, хотя синегнойка это все тоже очень любит. Кроме того, надо обязательно запомнить, что имеют место локальные факторы. Возбудители осложненных, особенно внутрибольничных, уроинфекций будут разными даже в разных корпусах одного и того же стационара (если, конечно, между ними не ходит один и тот же сотрудник, выполняющий одни и те же манипуляции, но тут отловить и победить, точнее, убедить руки мыть, станет намного проще), не говоря уж о разных больницах одного города и уж тем более разных городов, областей и тому подобных административных образований. А потому нужно что? Правильно, проводить локальный микробиологический мониторинг, тем более что сейчас, не прошло и 15 лет, появились автоматизированные, в том числе и облачные системы, упрощающие эту деятельность – и не надо ничего самим придумывать, например, Excel’евские таблички размером километр на километр рисовать. Частным примером является продукт, который представили на прошлом, еще осеннем, МАКМАХ 2020 – AMRCloud, оно же AntiMicrobial Resistance Cloud. Подробности можно прочитать здесь.
Как проявляются осложненные уроинфекции:
- Острый осложненный цистит как следствие установки катетера, в том числе постоянного, или диагностический исследований (то есть как результат нарушений правил асептики и антисептики при выполнении манипуляций).
- Осложненный пиелонефрит как следствие мочекаменной болезни (камни всегда являются инфицированными, более того, носителями биопленок), аденомы простаты и опухолей. Выше мы уже говорили, что данные обстоятельства затрудняют отток мочи, и особенно сей факт актуален для мужчин и лиц пожилого возраста. Основным возбудителем будет наша любимая E.coli, правда, уже вооруженная некоторыми факторами резистентности, и в дальнейшем все будет зависеть от длительности проводимой терапии, ее успешности и устранения факторов, препятствующих оттоку мочи.
- Хронический пиелонефрит является логическим продолжением осложненного, у него даже возбудитель тот же самый – E.coli, которая в этой ситуации уже вооружена до зубов всеми возможными факторами резистентности, так как пациент прошел не два и даже не пять курсов антимикробной терапии. Плохо то, что помимо возникающих обострений хронический пиелонефрит умеет переходить в уросепсис, и чаще всего такой переход бывает у лежачих или ограниченных в движении больных. Этот больной либо не в состоянии чувствовать происходящие с ним изменения, либо не в состоянии об этом сказать, и тогда на выручку придут невербальные признаки боли, например, развитие сгибательных контрактур нижних конечностей. Так что как только вы заметили, что пациент изменил положение в кровати, причем настолько длительно, что ноги разогнуть практически невозможно, необходимо взять полный набор анализов, хотя бы ради подстраховки, тем более что чаще всего данное состояние развивается очень медленно, а развернутая картина может появиться за дни, если не часы до летального исхода.
- Инфекции, связанные с медицинским вмешательством (они же нозокомиальные, они же внутрибольничные, они же госпитальные)– всегда связаны с нарушением правил асептики и антисептики при проведении процедур или манипуляций, а также с использованием открытых дренажных систем для отвода мочи. Возбудители могут быть самыми разными – что на руках принесем, то и будет, но впереди планеты всей, конечно, синегнойка и Enterobacteriaceaespp. Про руки написали уже два раза, повторяться не будем, а про катетеры все же упомянем. Использование открытой системы почти гарантированно приведет к развитию инфекции максимум через неделю после ее установки (минимальные сроки – это 3-4 дня), все придется удалять, лечить, снова устанавливать, что ужасно неудобно как больному, так и его родственникам, поэтому в общих интересах использовать закрытые системы, а в случае длительной их установки крайне тщательно обучать родственников уходу за оными.
Что делать, если все же такой пациент появился? Чтобы не инфицировать всех остальных, потребуется изоляция, которая в первую очередь нас будет мотивировать более тщательно соблюдать меры по асептике и антисептике.
Диагностические аспекты
- Локальный микробиологический мониторинг. Учитывая довольно высокий уровень смертности от уросепсиса, особенно нозокомиального, его проще предупредить, чем с ним бороться, а для этого надо знать врагов в лицо и на старте предполагать, кто это может быть.
- Лабораторная диагностика – ищем признаки воспаления, либо его усиления всеми доступными и возможными методами – общие анализы, C-реактивный белок, прокальцитонин, и т. д. и т. п., всем, чем владеете, то и надо использовать.
- Микробиологическая диагностика должна проводиться в идеале автоматизированными методами, так как чем дольше пациент получает не тот препарат, тем хуже для него и его микрофлоры. А чтобы эмпирику назначить верно, смотрим пункт первый – локальный мониторинг.
Терапевтические аспекты
- Если есть факторы, усложняющие эвакуацию мочи, и они устранимы – обязательно устраняем, иначе все пойдет на второй и третий круг, далее хронизация процесса, а потом… Но не будем повторяться.
- Препаратами выбора остаются фторхинолоны, цефалоспорины четвертого поколения и карбопенемы. В случае панрезистентности включаем тяжелую артиллерию в виде препаратов глубочайшего резерва, таких как цефтазидим/авибактам и тому подобных монстров, хотя самостоятельно этого делать не советуем, сразу зовите клин. фарма.
- В случае развития обструкции мочевых путей переводим пациента в хирургическое отделение для решения вопроса об оперативном лечении.
Подводя итоги, повторим, что в случае развития внутрибольничных инфекций мы всегда обязаны опираться на данные локального мониторинга, мероприятия по асептике и антисептике удваивать, а то и утраивать, но вообще-то призывать уполномоченных разбираться со всем этим лиц в лице эпидемиолога и клинического фармаколога, а самим не забывать мыть руки и максимально четко исполнять требования СанПина, так как все эти правила написаны кровью.

Сегодня мы закончим разговор о микроорганизмах из семейства Enterobacteriaceae, которое, как мы помним, является одним из самых проблематичных источников внутрибольничных инфекций, потому что возбудители умеют делиться и передавать в рамках почти всего семейства свои механизмы резистентности, и это при том, что изначально почти каждый представитель имеет природную устойчивость к целым классам антибиотиков.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Сегодня мы закончим разговор о микроорганизмах из семейства Enterobacteriaceae, которое, как мы помним, является одним из самых проблематичных источников внутрибольничных инфекций, потому что возбудители умеют делиться и передавать в рамках почти всего семейства свои механизмы резистентности, и это при том, что изначально почти каждый представитель имеет природную устойчивость к целым классам антибиотиков.
Героями сегодняшнего разговора станут энтеробактеры, серрации, морганеллы. Конечно, есть и другие представители и, возможно, в постковид они начнут встречаться намного чаще, но пока нам в рамках Азбуки достаточно вышеперечисленных плюс кишечные палки и клебсиеллы, о которых мы говорили ранее.
Enterobacter spp.
Микробиологические аспекты
Род энтеробактера включает несколько видов, но наиболее клинически значимыми из них являются:
Очень важно помнить, что энтеробактеры проявляют природную устойчивость к большому спектру антибиотиков, таким как бета-лактамы, к которым они продуцируют хромосомные AmpC бета-лактамазы, плазмидные бета-лактамазы расширенного спектра, а также карбапенемазы. Так как клинически значимые представители Enterobacter spp. обитают в желудочно-кишечном тракте человека, то основным источником инфицирования для пациента становится медицинский персонал, который просто по факту своей ежедневной работы в больнице с антибиотиками является резервуаром всевозможных антибиотикорезистентностей.
Клинически значимые аспекты
Enterobacter spp. является причиной:
- Инфекций мочевыводящих путей: катетер – или инструментально-ассоциированных (как результат эндоскопических манипуляций контаминированным инструментарием).
- Внутрибольничных пневмоний, в том числе вентилятор-ассоциированных.
- Инфекций кожи и мягких тканей, таких как раневые инфекции, инфицирование пролежней, ожоговые инфекции и послеоперационные инфекции. Кроме того в случае полимикробного характера инфицирования пролежней возможно развитие сепсиса как исхода раневой инфекции.
- Инфекций кровотока – катетер – и инструмент-ассоциированные.
- Инфекций центральной нервной системы — менингиты, чаще всего внутрибольничные, как следствие нейрохирургических вмешательств.
- Неонатальных инфекций, таких как некротический энтероколит, сепсис и менингит.
Чем лечить?
Ответ будет традиционным – лучше вообще не инфицировать, тогда не придется ломать голову, чем все это лечить. В основе терапии лежит обязательное микробиологическое исследование с определением антибиотикочувствительности.
В случае выявления представителей Enterobacter spp. при лечении тяжелых инфекций предпочтение следует отдавать комбинированной терапии, и самыми подходящими будут пиперациллин-тазобактам в комбинации с аминогликозидами или фторхинолонами. А для преодоления резистентности, вызванной бета-лактамазами расширенного спектра, можно использовать карбопенемы.
Для лечения инфекций мочевыводящих путей самым первым и наиважнейшим является удаление мочевого катетера до момента прекращения пиурии. Далее лечим либо исходя из профиля антибиотикограммы, либо ципрофлоксацином в правильно подобранной дозе, либо, как было указано выше, рассматриваем назначение нитрофуранов и фосфомицина.
Serratia spp.
Клинические аспекты
Что вызывает?
- Катетер-ассоциированные инфекции и как их исход – сепсис.
- Инфекции мочевыводящих путей как следствие медицинских манипуляций необработанным инструментом.
- Раневые инфекции в послеоперационном периоде.
- Нозокомиальные пневмонии как следствие интубации.
- Септические артриты.
- Конъюнктивиты и кератиты.
- И редко вызывали остеомиелиты и эндокардиты
Терапевтические аспекты
В первую очередь про серрацию надо узнать, а значит, необходимо микробиологическое исследование. Во-вторую, вспомнить о природной устойчивости. В-третью, держать в уме то, что очень часто цефалоспорины третьего и четвертого поколения тоже не будут работать, так как посредством плазмид получают устойчивость от родственников по семейству Enterobacteriaceae, например, от родной сестры – клебсиеллы. Точно таким же образом серрация может оказаться устойчивой и к карбопенемам. К фторхинолонам резистентность так же уже давно описана.
Так чем лечить?
Лучше вообще не заражать – потому что если бак. лаборатория дает серрацию, то ниоткуда кроме как с наших рук она появиться не может, так как ни ходить, ни летать сия зверюшка до сих пор не научилась.
В случае развития тяжелых инфекций – сепсиса, вентилятор-ассоциированной пневмонии и т. п., и только при документированной чувствительности, препаратами выбора могут быть цефепим или меропенем, или ципрофлоксацин в вену в стандартных дозировках. Если чувствительность утеряна, то зовем клинического фармаколога, а если такового нет, то смотрим в сторону амикацина, пиперациллина-тазобактама и азтреонама, только помним об их побочных эффектах. Курс лечения соблюдать жизненно необходимо, чтобы зверюшка еще куда-нибудь не мутировала и новыми механизмами защиты не обзавелась. Обычно речь идет о 10-14 днях (но так как польза превышает вред, то нефротоксичность аминогликозидов со временем отступит, а ототоксичность – тут уж как повезет).
Инфекции мочеполового тракта лечим так же с учетом чувствительности, и если таковая располагает, то препаратом выбора становятся фторхинолоны, либо комбинация двух антибиотиков, например фторхинолон с карбапенемом или бета-лактам с аминогликозидом.
Эндокардиты с остеомиелитами бывают хоть и редко, но крайне метко, а потому снова сначала исследуем чувствительность, потом индивидуально в каждом случае подбираем антибиотики (а лучше зовем клинического фармаколога, пусть он мучается). И снова крайне важно соблюдение сроков лечения, для эндокардита это порядка четырех, а то и шести недель внутривенной антибактериальной терапии, а для остеомиелита не менее двух недель. Почему нельзя меньше? Потому что последует мутация и новый рецидив, а антибиотиков просто может не хватить, ибо, как и сестра-клебсиелла, серрация тоже умеет в панрезистентность.
В заключении хочется повторить, что и в этом случае проще помыть руки, чем разгребать последствия инфицирования серрацией. Мытье рук и проще, и дешевле, и, что самое главное, спокойнее.
Morganella spp.
Морганеллы будут последними представителями семейства Enterobacteriaceae, которых мы обсуждаем в рамках нашей Азбуки. Если кому-то станет интересно покопаться дальше, то к их услугам всегда будет четырехтомник по медицинской микробиологии под редакцией Лабинской, конкретно второй и третий том, в которых все очень подробно расписано, правда, чтение это для неподготовленного человека будет довольно сложным. Но вернемся к нашей морганелле.
Микробиологические аспекты
Морганелла существует только одна – M.morganii, но имеет два подвида – M.morganii и M.sibonii, которые отличаются только по ферментации треалозы, и никакого клинического значения данное отличие не имеет.
Конечно, и морганелла умеет в природную устойчивость к антибиотикам, а именно к пенициллинам, цефалоспоринам первого и второго поколения, макролидам и ко-тримоксазолу. При этом сохраняет высочайшую чувствительность к аминогликозидам, пиперациллину, цефалоспоринам третьего и четвертого поколения, фторхинолонам и карбопенемам. То есть данную зверюшку есть чем победить.
Клинические аспекты
Морганелла является представителем нормальной микрофлоры человека и самостоятельно крайне редко что-то вызывает. Этим крайне редким являются инфекции мочевыводящих путей, чему способствуют крайне пожилой возраст, длительная госпитализация, мочевой катетер и иммунодефицит любой этиологии.
В плане приобретенной антибиотикорезистентности морганелла обзавелась факторами устойчивости к фторхинолонам, что и понятно, учитывая какие именно заболевания она вызывает и чем их чаще всего лечат.
Что еще может вызывать?
- Крайне редко – сепсис, как исход инфекции мочевыводящих путей.
- Раневую хирургическую инфекцию.
- Септический артрит.
- Неонатальный сепсис и хореоамнионит.
- Менингит.
- Перикардит.
Но стоит иметь в виду, что данные ситуации крайне редки, и стоит изначально подумать не об этом возбудителе, а о том, какой за ним может прятаться в виду контаминации материала, и лучше бы все еще раз пересеять и перепроверить.
Терапевтические аспекты
Если результат микробиологического исследования сомнений не вызывает и вы убеждены, что имеете дело с морганеллами, то препаратами выбора становятся карбопенемы, и только в случае их недоступности и документированной бактериологом чувствительности, можно посмотреть в сторону цефалоспоринов, например, цефтазидима (для которого нужна отдельная цефалоспориназа, чтобы он был инактивирован), а лучше цефтазидим-авибактама. Хотя если недоступны карбопенемы, то и Завицефте, скорее всего, взяться будет неоткуда.
Какие препараты могут быть использованы в качестве резервных? Решать этот вопрос также необходимо только после получения результата микробиологии и чувствительности в идеале по МПК, и только после этого рассматривать назначение цефепима или ципрофлоксацина, или аминогликозидов (они, к слову, в случае морганеллы могут обоснованно выступать в качестве монотерапии инфекций мочевыводящих путей).

Ацинетобактер – род строго аэробных, грамотрицательных неферментирующих бактерий, которые не образуют спор. Это очень распространенная бактерия, которая широко встречается у здоровых людей (выделяется из кишечника, находится на поверхности кожи). Их особенность в возможности выживать в течение месяца на сухой поверхности.
Болезни вызываемые ацинетобактером
Род включает несколько десятков наименований бактерий, которые могут вызвать заболевание у человека (порядка 80% случаев приходится на долю Acinetobacter baumannii). Наиболее распространены респираторные инфекции, которые обычно развиваются у пациентов, находящихся в критическом состоянии в больнице. Внебольничные проявления обычно возникают в тропических широтах.
Бактерия при поражении дыхательных путей колонизирует в местах трахеостомы и может вызвать у людей с ослабленным иммунитетом, детей бронхиолит, трахеобронхит. Если развилась пневмония, то часто она имеет осложненный характер. Для заболевания характерно многодолевое поражение, септический шок и другие проблемы, что обуславливает неблагоприятный общий прогноз (уровень смертности находится в диапазоне 19-54%).
Дополнительно ацинетобактер могут вызывать следующие заболевания:
- абсцессы и другие гнойные инфекции в любых системах, включая кожу, легкие, мочевыводящие пути, мягкие ткани человека, печени, поджелудочной железы;
- менингит (возникает обычно после нейрохирургического вмешательства);
- флебит или флегнома (у пациентов с венозным катетером);
- эндокардит;
- глазные инфекции;
- септический артрит.
В одном из последних исследований в США была установлена связь между содержанием микробиоты в толстой кишке и развитием рассеянного склероза. В итоге было установлено изменение флоры, включая повышенное содержание Acinetobacter calcoaceticus. Это позволило сделать предположение, что некоторые виды бактерий могут стимулировать иммунный ответ для подавления или наоборот развития заболевания.
Лечение ассоциированных с ацинетобактер заболеваний
При наличии установленного инородного тела (катетер) показано его удаление с последующей местной обработкой. После проведения интубации часто достаточно одной гигиены легких, а если течение заболевания осложнено, то используют антибиотики.
Особенность ацинетобактера в наличии серьезной резистентности к ряду действующих препаратов. Речь, например, рокситромицин. В зависимости от конкретного вида бактерии могут быть назначены:
- нифурател;
- офлаксацин;
- левофлоксацин;
- нофлоксацин;
- тетрациклин;
- доксициклин.
При тяжелом течении заболевания используют комбинированную терапию, которая обычно включает аминогликозид вместе с карбапенемами или ампицилинном. При выявленной устойчивости к лекарственным средствам используют комбинацию из миноциклина и колистина, тигециклин. Также обязательно проводят перед началом терапии тестирование на чувствительность колонии к конкретным антибактериальным препаратам.
Дополнительно при лечении необходимо сократить потенциальные контакта, что обеспечит регулярная ручная стирка, формирование барьеров. Важную роль играет общая гигиена и проветривание в помещениях, где находятся пациенты с инфекциями подобного плана.

Один из самых точных и информативных лабораторных исследований качества мочи (урины) — бактериологический анализ мочи (бакпосев, посев на микрофлору). Этот метод диагностики выявляет патогенные микроорганизмы и определяет их чувствительность к антибактикам. Это позволяет сэкономить время и сразу назначить эффективное лечение.
Прием уролога, гинеколога — 1000 руб. Комплексное УЗИ малого таза — 1000 руб. Прием по результатам УЗИ или анализов — 500 руб (по желанию)
Недостатком анализа можно назвать особые требования к сбору материала и длительность теста. Однако лишь при посеве мочи врач получает точную уникальную информацию, которую часто не способны показать другие лабораторные исследования.

Показания для назначения бакпосева мочи
Анализ мочи на посев может быть назначен терапевтом, гинекологом , урологом или педиатром в следующих случаях:
- при инфекциях мочевыделительной системы (рецидивирующий цистит , пиелонефрит , урологические патологии, мочекаменная болезнь );
- при болезнях органов ЖКТ (энтерококк и дизентерия);
- при сахарном диабете , беременности и бесплодии , иммунодефиците, туберкулёзе, ВИЧ;
- для контроля эффективности проведённого лечения инфекции ;
- для уточнения диагноза при неоднозначной симптоматике;
- для выявления устойчивости микроорганизмов к антибактериальной терапии.
Также бакпосев мочи может назначаться при наличии следующих симптомов:
-
(наблюдается при цистите);
- нарушение частоты мочеиспусканий (может свидетельствовать о поражении почек, простатите );
- тошнота, рвота, общая слабость, повышение температуры (симптомы заболевания почек);
- боль в пояснице (сигнал возможного развития бактерий в почечных канальцах);
- изменение цвета мочи.
Какие патологии выявляет бактериологический анализ мочи
Бакпосев на патогенную флору поможет диагностировать такие заболевания, как:
- хронический уретрит ;
- рецидивирующий цистит;
- пиелонефрит;
- паранефрит.
Бактериологический анализ мочи выявляет следующие инфекции в зависимости от возбудителя:
- Стафилококки и стрептококки . Выявляет все виды патогенных микроорганизмов, опасных при беременности для ребёнка; . Патогенные микроорганизмы в урине подтверждают сомнительный диагноз; . Назначается пациенту, если его партнёр — носитель вируса;
- Бациллу Коха . Степень бактериурии определяет наличие туберкулёза и насколько поражены почки и мочевыводящие пути при таком заболевании;
- Протеи . Протейная инфекция вызывает воспаление почек и мочевыводящих путей, может привести к острому пиелонефриту;
- Энтерококки . Эти кишечные бактерии могут быть губительными для мочевыводящей системы;
- Синегнойную палочку. Эта бактерия является причиной циститов, уретритов и пиелонефритов;
- Коклюш . Анализ выявит болезнь даже на ранней стадии и при начальных
- симптомах;
- Клебсиеллы . Опасная бактерия, устойчивая к большинству антибиотиков. Вызывает воспалительные заболевания мочевыводящих путей и может привести к различным тяжёлым последствиям;
- Дизентерийные соединения . Способен выявить сальмонеллез и дизентерию у пациентов любого возраста.
Методика исследования мочи на инфекции
Для идентификации инфекционного возбудителя анализ урины на посев проводится по следующему алгоритму:
- Первичное исследование осадка мочевой жидкости под микроскопом (проводится не всегда).
- Первичный посев мочи на стерильность для выявления типа возбудителя.
- Накопление собранной в посеве культуры.
- Изучение особенностей выявленных бактерий.
- Окончательная идентификация возбудителя.
Для теста — посев мочи — необходим подбор определённой среды: для стафилококков – кровяной агар, стрептококков – сахарный раствор и т.д. Однако могут проводить посев и в нескольких средах (максимум 3-4).
Бактериологический анализ мочи в целом занимает 7-10 дней. Полученный результат будет содержать описание величины, формы, прозрачности, оттенка, структуры поверхности, роста колонии в высоту.
Методика определения чувствительности возбудителей к антибиотикам
Для определения чувствительности микроорганизмов к антибиотикам (антибиотикограмма) анализ урины на посев проводится по следующему алгоритму:
- Деление чаши Петри на несколько секторов и помещение в каждый из них полоски с антибиотиком.
- Маркировка цветом каждого участка и засев выделенной культурой.
- Помещение чаши в термостат с температурой 36,6.
- Ведение ежедневного контроля. Отсутствие роста и размножения бактерий означает, что антибиотик их подавляет, а значит подобран верно.
В противном случае возбудитель устойчив к действию данного антибиотика, и его нужно заменить.
Антибиотикограмма проводится только при обнаружении бактерий более, чем 104 КОЕ/мл. Длительность такого анализа составляет 4-5 дней. Современные экспресс-методики позволяют получить результат уже через 2 дня. В экстренных случаях, когда результат необходим для лечения тяжелобольного пациента, предварительные данные могут быть предоставлены уже спустя 4 часа.
Подготовка к процедуре и сбор мочи на посев
Для получения реальной картины состояния внутренней микрофлоры крайне важно соблюсти все требования относительно подготовки и сбора мочи:
Анализ посев мочи при беременности
В период беременности женщина ещё больше, чем обычно, уязвима для различных болезней. К ним относятся и инфекции различного генеза, включая передающиеся половым путём. К тому же, исследованиями доказано, что 45% всех смертей плода ( замирание беременности , выкидыш ) случилось из-за внутриутробного инфицирования.
Бактериологический анализ мочи во время беременности обязателен, даже при отсутствии признаков инфекции. Инфекция длительно и бессимптомно могла протекать в организме женщины и активизироваться при наступлении беременности (до 6% беременных имеют скрытую бактериурию).
Важность проведения анализа мочи на посев во время беременности подтверждается следующим:
- выявление и идентификация возбудителей инфекции;
- проведение возможного лечения с учётом срока беременности;
- предупреждение заражения плода и нанесения ему непоправимых органных изменений, несовместимых с жизнью.
Проводить бакпосев мочи нужно дважды за беременность – в 1 триместре и практически перед самыми родами (на 36 неделе). При наличии соответствующих показаний это значение может увеличиться. Врач может назначить беременной дополнительные бакпосевы мочи, если она страдает заболеваниями мочевого пузыря и почек, или при общем анализе мочи были обнаружены лейкоциты и белок.
Правила подготовки и сбора материала для беременной общие. На поздних сроках беременности плод давит на мочевой пузырь, поэтому женщине порой трудно дотерпеть до утра. Рекомендуется сходить в туалет по будильнику в 1-2 часа ночи, а затем уже утром собрать мочу для анализа.
Расшифровка результатов бакпосева мочи: норма и патология
Результат анализов выводится в КОЕ на 1 мл мочи. КОЕ (колониеобразующие единицы) – это абсолютное значение, показывающее количество клеток бактерий в 1 мл урины.
Лаборатория выдаст распечатку результатов, в которой будут указаны все виды микроорганизмов, их количество, измеренное в КОЕ/мл, и антибиотикограмма – группы препаратов, к которым чувствителен каждый вид бактерий.
Результат бакпосева не всегда однозначно положительный или отрицательный. Он имеет референсные значения, которые указывают на степень воспаления.
| Менее 1000 КОЕ/мл | Норма, лечение не требуется. |
| 1000-100000 КОЕ/мл | Требуется повторное исследование. Возможно, результат искажён из-за нарушения правил подготовки или сбора мочи. |
| Более 100000 КОЕ/мл | Наличие инфекции, необходимо срочно начинать лечение. |
На бланке антибиотикограммы проставляются значки:
| Обозначение | Уровень чувствительности к антибиотикотерапии |
| S | высокий |
| I | умеренный |
| R | полная резистентность (устойчивость) к антибиотикам |
Где сдать анализ мочи на инфекции и сделать расшифровку бакпосева в СПБ?
Такое обследование в Санкт-Петербурге проводится в специализированной уролого — гинекологической клинике Диана. Здесь же можно пройти все виды экспертного УЗИ (стоимость 1000 руб), сдать все анализы и получить консультацию гинеколога, уролога, эндокринолога , онколога и дерматолога . Стоимость консультации любого специалиста — 1000 руб.
Читайте также:

