Аденовирусы птиц передаются через
Обновлено: 18.04.2024
Чума уток. Вирусный энтерит уток. Ринотрахеит кошек.
Чума уток (вирусный энтерит уток) - остропротекающая болезнь водоплавающих птиц, характеризующаяся лихорадкой, геморрагическим диатезом и обильной диареей. Источником возбудителя, вероятно, являются дикие утки. Болеют утки всех возрастов. При остром течении заболевания гибель наступает внезапно. Болезнь регистрируется в странах Европы, Азии и Америке. Переболевание сопровождается напряженным иммунитетом, передаваемым трансовариально потомству. Материнский иммунитет продолжается 2-3 недели. С целью специфической профилактики применяют живые вакцины. Для получения аттенуированных штаммов вирус пассируют в утиных (УЭ) и куриных эмбрионах (КЭ). Для полной аттенуации вируса при сохранении выраженной иммуногенности обычно достаточно 5—10 пассажей в УЭ и 20 - в КЭ. Эмбриональные и культуральные варианты аттенуированных штаммов вируса ЧУ используют для вакцинации уток.
Аттенуированные штаммы не реактогенны для уток различного возраста, обладают выраженными протективными свойствами, не передаются горизонтально и не обладают риверсибельностью. Они хорошо переносят лиофилизацию и при длительном хранении сохраняют активность. Однократное внутримышечное введение вакцин (4,0 lgТЦД50) через три дня защищает практически всех привитых уток от экспериментальной летальной инфекции вирулентным штаммом вируса. В организме вакцинированных утят через 20 дней после не удавалось обнаружить вирулентный штамм вируса. Длительность иммунитета зависит от возраста вакцинированной птицы и обычно составляет 3—5 мес. Напряженный иммунитет быстро восстанавливается после ревакцинации. Материнские антитела подавляют активный иммунитет у утят в течение первых 2—3 недель жизни. Применение живой вакцины оказалось весьма эффективным средством профилактики чумы уток. Аэрозольная иммунизация живой вакциной против чумы уток оказалась неэффективной.
Ринотрахеит кошек
Ринотрахеит, вызываемый герпесвирусом типа 1 кошек (ГВК-1), - основное респираторное заболевание кошек, встречающееся у 50-75% животных данного вида. Заболевание клинически напоминает калицивирусную инфекцию. Наблюдают некротические изменения эпителия верхних дыхательных путей и в отдельных случаях бронхопневмонию. Хотя аборты имеют место, но трансплацентарное инфицирование плодов не происходит. Для профилактики заболевания предложены живые и инактивированные вакцины. Первые готовят из аттенуи-рованного штамма вируса, размноженного в культуре клеток почек котят. Для аттенуации вирулентного штамма вируса требовалось не менее 50 пассажей при температуре 33-35°С. Живая сухая вакцина, полученная из такого штамма, безопасна и высокоэффективна.
Аттенуированный штамм сохранял выраженную антигенность и пригодность в качестве вакцинного после 300 и более пассажей в культуре клеток. Кошки, привитые интраназально живой вакциной (Katavak-СН) из термочувствительного штамма (0,5 lgTIXH,50), становились устойчивыми к интраназальному заражению вирулентным штаммом (7,0 lgTim50). Вакцинация сопровождалась незначительной реакцией и выделением вакцинного вируса в течение шести дней. Устойчивость к экспериментальному заражению обнаружена через четыре дня. Экскреция вирулентного вируса была низкой. Инактивированую вакцину получали из культурального ГВК-1 с помощью БПЛ. Напряженный иммунитет и высокий титр гуморальных антител отмечали после двукратного введения вакцин. Антитела сохранялись в крови в течение 10 мес. и в это же время имел место бустерный эффект на повторную вакцинацию, а также обнаружена антителозависимая цитотоксичность, обусловленная лейкоцитами.
Аденовирусы
Аденовирусы впервые были выделены в 1953 г. из аденоидов человека и получили соответствующее название. Семейство аденовирусов включает два рода Mastadenoviras и Aviadenovirus. В состав рода мастаденовирусы входят аденовирусы млекопитающих: человека (более 50 серотипов), обезьян (24 серотипа), крупного рогатого скота (10 серотипов), лошадей (2 серотипа), овец (6 серотипов), коз (2 серотипа), свиней (4 серотипа), собак (2 серотипа), мышей (1 серотип), кроликов (1 серотип).
Род авиаденовирусы включает аденовирусы кур (12 серотипов), индеек (4 серотипа), гусей (3 серотипа), уток (2 серотипа) и фазанов (1 серотип).
Патогенные аденовирусы известны у 13 видов домашних животных. Высказано предположение, что млекопитающие и птицы могут заражаться аденовирусом, относящимся к разным родам. Аденовирусы вызывают заболевания, характеризующиеся легким поражением органов дыхания, пищеварения и конъюнктивы. Некоторые из них вызывают злокачественные опухоли у новорожденных хомячков и трансформацию клеток, культивируемых in vitro, но не вызывают опухолей у естественных хозяев.
Аденовирусы птиц серотипа 11 вызывают геморрагический энтерит индюков и мраморную болезнь селезенки фазанов, а серотипа 8 — острый вирусный гепатит цыплят.
Аденовирусы представляют собой частицы кубической симметрии диаметром 70-100 нм. Вирионы содержат ДНК (13% массы) и белок (87% массы), не имеют оболочки, липидов и содержат следовые количества углеводов в белке отростка, модифицированном включением глюкозамина. Вирионы имеют белковое покрытие, окружающее ДНК-содержащую сердцевину. Белковое покрытие (капсид) состоит из 252 субъединиц (капсомеров), из которых 240 гексонов и 12 пентонов. В структуре вириона содержится, по-видимому, 11 белков (м.м. 2-120 кД). Наружный слой вириона (капсид) содержит 7 белков. В сердцевине вириона находятся 4 белка (в том числе концевой белок 55 кД), который ковалентно связан с 5'-концами вирусной ДНК.
240 гексонов образуют 20 поверхностей в виде равносторонних треугольников. На вершинах икосаэдра расположены 12 капсомеров (пентонов), каждый из которых граничит с пятью соседними невершинными капсомерами (гексонами). От вершин пентонов отходят булавовидные отростки диаметром 2 нм и длиной 20-50 нм. На вершине отростка имеется утолщение диаметром 4 нм. Эти капсомеры вместе с отростками (фибрами) называют пентонами. Сердцевина вириона имеет сферическую форму диаметром 60-65 нм и представляет собой правильно организованную структуру из 12 петель, вершины которых совпадают с вершинами капсида и на срезе вириона образуют фигуру, подобную цветку. Петли образованы ДНК и белками VII и V. В сердцевине находятся также белки VI и X.
Геном аденовирусов представлен одной линейной молекулой двуцепочечной ДНК размером 36-44 тпн с инвертированными концевыми повторами. Вирусный геном кодирует около 40 белков и транскрибируется после сложного сплайсинга РНК. Около 1/3 вирусных белков являются структурными белками. Вирусные частицы присоединяются к клетке рецепторами пентоновых отростков и проникают внутрь ее путем эндоцитоза. Затем удаляется наружный белковый слой (капсид) и сердцевина вириона (вирусный геном и связанные с ним гистоны) проникает в ядро клетки, где происходит полный цикл репликации вируса от транскрипции мРНК до образования зрелых вирионов. В ядре клетки вирусный геном транскрибируется клеточной полимеразой II, в соответствии с комплексной программой, закодированной в обеих цепях вирусной ДНК. В результате образуется 5 продуктов ранней (Е) транскрипции: Е1 А, Е1 В, Е2, ЕЗ и Е4, два - промежуточной: IX и IVa2 и один - поздней (L) транскрипции. На матрице последнего из них транскрибируется семейство из 5 поздних мРНК (L1-L5). Все ранние кодирующие области вирусного генома транскрибируются от отдельных промоторов, тогда как поздние области от одного - главного позднего промотора. Ранние мРНК транслируются в ранние белки, которые изменяют клеточный цикл, блокируют клеточный защитный механизм, выключают транспорт мРНК и участвуют в репликации вирусной ДНК.
Вирусная ДНК реплицируется, используя 5'-концевой белок 55кД в качестве праймера, и продолжается от обоих концов с помощью замещающего механизма. Вслед за репликацией ДНК транскрибируются поздние мРНК, которые затем транслируются в структурные белки в избыточном количестве. Первичные транскрипты имеют размер около 29 kb; по крайней мере 18 мРНК образуются альтернативным сплайсингом поздних первичных транскриптов. Во второй половине репликативного цикла вируса происходит остановка макромолекулярного синтеза клетки. Вирионы формируются в ядре, где они образуют кристаллоподобные скопления. Продукты трансляции поздних мРНК участвуют в сборке вирионов и лизисе клеток. Продукты генов Е1А и Е1В ответственны за клеточную трансформацию.
Область ЕЗ несущественна для репликации аденовируса in vitro и может быть использована для вставки чужеродной ДНК при конструировании аденовирусных векторов и рекомбинантных вакцин.
Основные структурные белки аденовирусов представлены в таблице. Полипептид II с молекулярной массой 120 кД входит в состав гексонов, причем в каждом из них содержится три молекулы этого белка. Таким образом, 240 гексоно-вых капсомеров вириона содержат 720 молекул белка II. Гексонные белки составляют основную массу (53%) вирионных белков.
Основание пентона содержит пять молекул полипептида III, его отросток — три молекулы полипептида IV, то есть всего соответственно по 60 и 36 копий на вирион. Отросток вместе с основанием пентона формируют комплекс пентона. Основная роль в антигенной активности аденовирусов принадлежит гексонам, пентонам и их отросткам.
В структуре гексона обнаружены две антигенные детерминанты: группоспецифическая (а) и типоспецифическая (е). Антитела против очищенных гексонов нейтрализуют инфекционность вируса данного серотипа.
Многие аденовирусы обладают гемагглютинирующими свойствами. Верхушки пентоновых отростков присоединяются к рецепторам клеток и соединяют их между собой. Антигенная детерминанта отростка пентона, по-видимому, идентична типоспецифическому гемагглютинину
Вирусы внутри рода различают на основе антигенных и геномных характеристик. При идентификации вирусных штаммов используют рестрикци-онное эндонуклеазное картирование и секвенирование геномной ДНК.
Родоспецифические эпитопы расположены на пентонах, т.е. структурных единицах, расположенных на поверхности капсида. Типоспецифические антигены, которые идентифицированы в реакциях нейтрализации и РТГА, находятся на поверхности гексонов. Пентоновые отростки содержат другие типоспецифические эпитопы, которые также играют важную роль в нейтрализации. Хотя утолщения на пентоновых отростках содержат лиганды, ответственные за прикрепление вируса к специфическим клеточным рецепторам, антитела к ним играют лишь слабую роль в нейтрализации вируса. Серологическая структуризация семейства в основном основана на относительной доминантности некоторых эпитопов в серологических тестах, нежели на их расположении в вирионах.
За индукцию типоспецифических ВН антител ответственны аминокислотные последовательности 393—398 и 536—547 белка гексона. Пептид, образуемый аминокислотными остатками 20—35 белка гексона, обладает комплементсвязывающей активностью. Антитела к гексону и отростку пентона обладают нейтрализующей способностью. Смесь этих антител нейтрализует вирус при меньшей концентрации. Отмечено участие в нейтрализации инфекционности аденовируса антител к гексонам гетерологичных типов вируса. Комплемент усиливает действие ВН-антител. Антитела к гексоновым и фиберным белкам нейтрализуют инфекционность и ассоциированы с устойчивостью организма к инфекции. В составе аденовируса человека различают четыре комплементсвязывающих антигена (КСА), которые обозначают буквами А, В, С и Р. А-антиген связан с гексоном, В-антиген — с основанием пентона, С-антиген — с отростками (пептона), Р-антиген является внутренним антигеном. А- и Р-антигены — группоспецифические комплементсвязывающие антигены, общие для всех аденовирусов человека. По В-антигену все аденовирусы человека разделены на три подгруппы. С-антиген — типоспецифическии комплементсвязывающии антиген. В опытах на животных установлена иммуногенность вакцин, полученных из очищенных гексонов и отростков пентонов. Однако вакцины из капсидных белков аденовирусов обладают более низкой иммуногенностью, чем цельновирионные вакцины. Иммуногенность белков гексонов и отростков пентонов значительно повышалась после их включения в состав липосом.
Аденовирусы интенсивно использовали в качестве векторов для введения чужеродных ДНК различных вирусов. Экспрессия чужеродных вирусных генов в рекомбинантных аденовирусных векторах была продемонстрирована на многочисленных примерах. Таким образом были экспрессированы гликопротеин Д вируса болезни Ауески, гликопротеин 340/220 вируса Эпштейн-Барр, структур ный гликопротеин вируса везикулярного стоматита, белок VP4 ротавируса, гликопротеин вируса бешенства, гликопротеин вируса парагриппа-3, гликопротеин оболочки вируса иммунодефицита кошек, гликопротеин вируса респираторного и репродуктивного синдрома свиней, поверхностный антиген вируса гепатита В человека, Т-антиген вируса полиомы и белок слияния вируса кори.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Изначально естественными хозяевами вируса ССЯ были водоплавающие птицы, но затем в семидесятых годах вирус адаптировался к курам посредством зараженных вакцин против болезни Марека, полученных с помощью культур фибробластов утиных эмбрионов (EDS 76).
Аденовирусая болезнь птицы (FAdV)

Аденовирусная болезнь птицы (FAdV) широко распространена во всем мире и носит эндемический характер. Во многих случаях отсутствуют какие-либо клинические признаки заболевания. Многие родительские стада и стада несушек имеют положительную серологическую реакцию на антитела к FAdV.
Только определенные серотипы вызывают заболевания у кур. На основе молекулярной структуры было выделено 5 видов (A–D) рода Aviadenovirus; преимущественно на основе анализа перекрестной нейтрализации было выделено 12 серотипов.
Поскольку существуют большие различия между американской и европейской номенклатурой штаммов FAdV, настоятельно рекомендуется использовать классификацию ICTV (Международный комитет по таксономии вирусов).
Клинические заболевания, вызываемые аденовирусом птиц
К клиническим заболеваниям, вызванным аденовирусом птиц, относятся инфекционная гепатомиелопоэтическая болезнь птиц (IBH), синдром гидроперикарда (HPS) и эрозия желудка птиц (AGE).
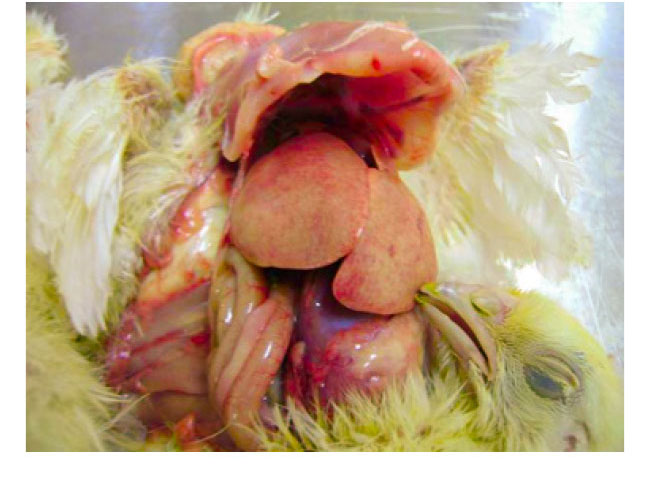
Инфекционная гепатомиелопоэтическая болезнь птиц
Синдром гидроперикарда
- Синдром гидроперикарда был впервые описан в 1987 г. в Пакистане, в районе Ангара Гот (ангарская болезнь), а позже эта болезнь была диагностирована в Индии, Ираке, Кувейте и Латинской Америке (Эквадор, Перу, Чили, Мексика). HPS вызывается вирусами FAdV серотипа 4. Патологоанатомическое исследование показывает гидроперикард, гиперемию печени с тельцами включения и атрофию тимуса.
- Это заболевание чаще всего проявляется в возрасте 3–5 недель, оно передается горизонтальным путем и часто протекает совместно с иммуно супрессивными инфекциями, такими как инфекционная бурсальная болезнь (ИББ) или инфекционная анемия цыплят (ИАЦ), либо микотоксикозами.
- Падеж может составлять 12–75% как у цыплят бройлеров, так и у цыплят несушки.
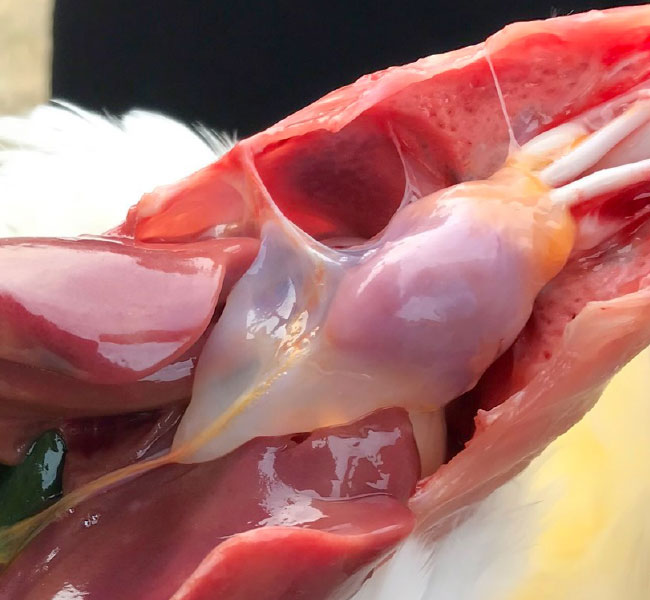
Аденовирусная эрозия желудка (AЭЖ)
- Эрозия желудка связана с дефицитом витамина B6 или потреблением гистамина, гиззерозина и микотоксинов. Еще в 1981 г. аденовирусную эрозию желудка (AЭЖ) связали с поражением мускульного желудка; в основном она вызывается FAdV серотипа 1.
- Патологоанатомическое исследование показывает очаговые эрозии коилинового слоя желудка, воспаление слизистой оболочки желудка и провентрикулит. О заболевании острого гастроэнтерита сообщается у бройлеров, но иногда AЭЖ также наблюдается у цыплят несушек. Клинические признаки отмечаются редко, так как поражения часто видны только при патологоанатомическом исследовании или после убоя.
- Падеж варьируется в диапазоне от 5 до 15% у цыплят в возрасте 10–21 дня; такие случаи заболевания у очень молодых цыплят свидетельствуют о вертикальной передаче вируса.
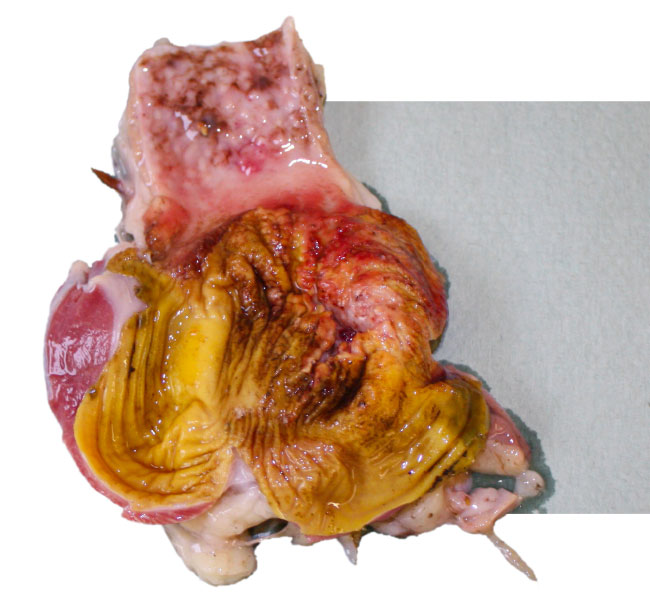
Первоначальнаядиагностика аденовирусных инфекций птиц основывается на результатах патологоанатомических и гистопатологических исследований (преимущественно внутриклеточные тельца включения) и оценке первичных анамнестических данных (например, клинических признаков, показателей заболеваемости и смертности, возраста птиц).
Для правильной диагностики также чрезвычайно важно использовать серологический метод выявления антител и определение возбудителей с помощью вирусологии и молекулярной биологии.
Рис. 1. Показана гуморальная реакция через 28 дней после вакцинации двумя различными аутогенными вакцинами против FAdV (партия 006, содержащая серотипы 2, 8b и 11, и партия 015, содержащая серотипы 4, 8a и 11).
Для выявления антител к FAdV имеются различные лабораторные тесты.
Их делят на тесты, выявляющие антитела ко всем серотипам, как например, группоспецифический тест преципитации в агаровом геле, тест методом иммуноферментного анализа (ИФА) и тесты на нейтрализацию серотип специфического вируса (VN).
Иммунофлуоресцентный тест (IFT) может выявлять и антигены, и антитела.
Для измерения титров антител к FAdV часто используются лабораторные и промышленные тест-наборы ИФА, однако они не могут дифференцировать антитела к FAdV различных серотипов.
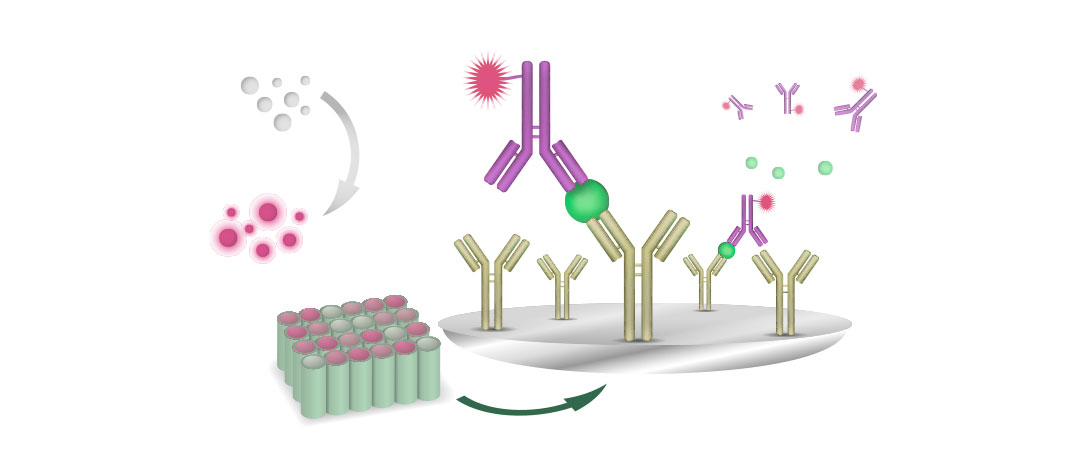
Единственная система, выявляющая серотип-специфические антитела, — это тест VN, в котором используются культуры клеток печени куриного эмбриона; этот диагностический тест имеется только в некоторых лабораториях.
VN является важным инструментом для определения серотипа FAdV в полевых условиях, когда невозможно получить изоляты вируса. Тест VN также рекомендуется для контроля серологической реакции после вакцинации.
Определение возбудителя путем выделения вируса в клетках печени куриного эмбриона применяется только в некоторых лабораториях; при этом выявляют цитопатическое действие аденовирусов, проводят флуоресцентное окрашивание антител или последующее ПЦР-тестирование.
В настоящее время широко используются молекулярно-биологические методы, поскольку они требуют меньше времени и не включают методы культивирования тканей. ПЦР-тестирование с последующим секвенированием ДНК или высокоразрешающим анализом кривых плавления ДНК (HRM) позволяет не только обнаруживать, но и определять подтип патогенов FAdV в полевых условиях.
Для этого берут:
Типирование соответствующих полевых штаммов FAdV играет важную роль в выборе штаммов для производства аутогенных вакцин. Кроме того, создание филогенетических деревьев (смотрите рис. 2) может помочь понять эпидемиологическое родство различных полевых изолятов и определить возможные пути передачи.
Профилактика аденовирусных инфекций птиц
Строгие протоколы биобезопасности племенных стад в период выращивания ремонтного молодняка могут оказать негативное влияние на профилактику аденовирусных инфекций птиц: чем больше изолируют племенные стада в этот период, тем выше вероятность заражения FAdV в период продуктивности с последующей вертикальной передачей вируса в течение 4–6 недель после заражения, пока у племенной птицы не выработается достаточное количество антител для предотвращения вертикальной передачи вируса.
Хотя в продаже имеются инактивированные вакцины для борьбы с синдромом снижения яйценоскости, в большинстве стран мира отсутствуют лицензированные вакцины против аденовируса птиц, производимые в промышленных масштабах.
В странах с клиническими симптомами FAdV и экономическими последствиями этого вируса профилактика аденовирусных инфекций птиц проводится только с использованием аутогенных вакцин..
Целью вакцинации является в первую очередь предотвращение вертикальной передачи вируса и защита суточных цыплят с помощью материнских антител. В период выращивания ремонтного молодняка рекомендуется вакцинация племенного стада в два этапа: в возрасте 10–12 и 16–18 недель.
Эффективность используемых вакцин можно оценить путем серологического мониторинга титров антител к FAdV с использованием тестов ELISA. Тест VN позволит дополнительно измерить ответ серотип-специфических антител после вакцинации, а также определить наличие других серотипов FAdV в полевых условиях. В конечном счете оптимизация продуктивности племенной птицы и ее потомства является наиболее важным аспектом защиты птицы путем вакцинации.
Аденовирусная инфекция крупного рогатого скота. Аденовирусные инфекции птиц.
Аденовирусная инфекция крупного рогатого скота вызывает у телят остро-протекающие заболевания слизистых оболочек дыхательных путей и пищеварительного тракта. Смешанные инфекции приводят к хроническому воспалению легких. У взрослого крупного рогатого скота аденовирусная инфекция большей частью протекает латентно. Выделение аденовируса из плодов свидетельствует о возможности трансплацентарной передачи возбудителя. Выявлено девять серотипов аденовирусов крупного рогатого скота. На основании наличия общего комплементсвязывающего антигена все аденовирусы крупного рогатого скота подразделяют на две антигенные подгруппы. Первые три типа имеют общий комплементсвязывающий антиген, отличающийся от такового остальных серотипов, также имеющих общий антиген.
Естественное или экспериментальное заражение аденовирусами вызывает у животных образование специфических антител. В течение первых 14 дней заболевания вначале появляются типоспецифические нейтрализующие и тормозящие гемагглютинацию антитела. Группоспецифические, комплементсвязывающие и преципитирующие антитела образуются спустя 25—30 дней после начала заболевания.
Пока еще неясно, в какой мере вакцинация против одного типа аденовируса защищает от заражения другими типами и происходит ли подавление иммунного ответа на фоне гетерологических антител. По-видимому, для защиты против инфекции особое значение имеют секреторные антитела. Колостральные антитела в сыворотке крови телят выявляют на протяжении 4 мес. после рождения. Однако в практических условиях заражаются телята даже с высоким титром материнских антител.
В специфической профилактике аденовирусной инфекции телят предпочтение отдается применению инактивированных вакцин. Вакцинация стельных коров — одно из направлений профилактики аденовирусной инфекции у новорожденных телят. Естественно, что выраженность пассивного иммунитета у телят зависит от исходного уровня антител в молозиве и его количества, потребленного в первые 24 ч жизни. В то же время было установлено, что пассивные антитела препятствуют активной иммунизации телят. Учитывая важность секреторных антител для защиты телят от аденовирусной инфекции, большое значение приобретает назальная иммунизация живыми вакцинами. Формолвакцина, в отличие от естественного заражения и живой вакцины, не вызывает образования КС-антител.
Инактивированная вакцина вызывает гуморальный ответ у стельных коров и телят, привитых в возрасте 10-15 дней и старше. У вакцинированных коров антитела сохранялись в течение 6 мес после отёла, а у телят — 4 мес. после вакцинации. Колостральные антитела сохраняются у телят 2,5 мес. Колостральные антитела подавляют иммунную реакцию на введение вакцины.

Аденовирусные инфекции птиц
Среди аденовирусов птиц различают: обычные аденовирусы, гемагглютини-рующие, связанные с синдромом снижения яйценоскости кур и вызывающие геморрагический энтерит индеек и мраморную болезнь селезенки.
Обычные аденовирусы птиц имеют один групповой антиген, отличающийся от такового человека, выявляемого в РИД и ИФА. Пользуясь реакцией нейтрализации аденовирусы кур можно разделить по крайней мере на 12 серотипов. У аденовирусов индеек и гусей обнаружено по три серотипа, а уток — один. Обычные аденовирусы размножаются в пищеварительном тракте птиц и менее интенсивно — в слизистой оболочке носа и глаз. Виремию обычно наблюдают при наличии клинических признаков болезни. Однако неясно, являются ли обычные аденовирусы первичной причиной болезни или играют роль вторичного агента. Птица, инфицированная аденовирусом, является потенциальным вирусоносителем в течение всей жизни и, возможно, периодически выделяет его с секретами и экскретами, а также через яйца. Вирус передается горизонтально и вертикально — трансовариально. Обычные аденовирусы широко распространены у клинически здоровой птицы. Выделение аденовируса от больной птицы еще не указывает на его этиологическую роль.
Синдром снижения яйценоскости (ССЯ 76). Заболевание характеризуется тем, что птица не может достичь ожидаемого уровня яйценоскости или, достигнув, удержать его. Первыми признаками являются потеря пигмента скорлупой и снесение яиц с тонкой или мягкой скорлупой либо вовсе без нее. ССЯ обычно наблюдается в период пика яичной продуктивности, с которым связана активация латентной вирусной инфекции. Вирусные антигены обнаруживали только в яичниках и яйцеводах, а типичные поражения — в яйцеводах.
Возбудителем синдрома ССЯ является аденовирус ВС-14. Это природный аденовирус уток, который заражает кур. Он значительно лучше размножается в эмбрионах и культурах клеток утиного, чем куриного происхождения. Размножается в пищеварительном тракте и выделяется с пометом, может передаваться трансовариально.
Болезнь (ССЯ) регистрируют у кур, уток и гусей. Заболевание вызывается тремя аденовирусами, которые агглютинируют эритроциты кур. Один из них вызывает классический ССЯ во многих странах, другой — у уток в Англии, третий — ССЯ в Австралии. Вирус размножается с высоким титром в КЭ и в культурах клеток кур, уток и гусей (культуры клеток почек цыплят или печени эмбрионов). Главный путь распространения вируса — зараженные яйца.
Обычно соотношение зараженных и незараженных эмбрионов низкое. У цыплят, выведенных из зараженных яиц, обычно не образуется антител, однако они могут выделять вирус в течение нескольких дней, заражая других цыплят. Во взрослом состоянии у них не наблюдается синдрома снижения яйценоскости. Когда у таких особей начинается период яйценоскости, они становятся вирусо-носителями и выделяют вирус. Клиническая картина болезни зависит от иммунной прослойки. Если в стаде она мала, то возникает довольно острая вспышка заболевания. Если в стаде у многих особей имеются антитела, то поголовье окажется устойчивым к повторному возникновению заболевания.
Инактивированную вакцину применяют до периода яйцекладки. Однако она скорее снижает заболеваемость, но не ликвидирует болезнь. Иммуногенность вакцины зависит от содержания ГА-антигена. Вакцина с ГА-активностью 10-13 log2 обладала выраженным протективным действием для 3,5 месячных цыплят.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Аденовирусная инфекция. Причины и клиника аденовирусных болезней
Аденовирусные заболевания (Pharyngoconjunctival fever - англ ) - острые инфекционные болезни, характеризующиеся преимущественным поражением дыхательных путей и глаз, а также кишечника, лимфатических узлов,печени и селезенки
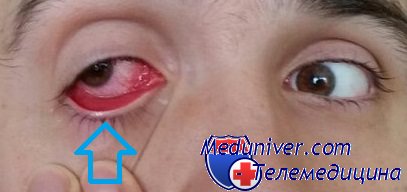
Внедрение аденовирусов в восприимчивый организм происходит через дыхательные пути, глаза и кишечник. В пораженных эпителиальных клетках нарушается структура ядер с образованием в них включений ДНК-содержащих вирусов. Вызываемое ими воспаление проявляется экссудацией, некрозом и выпадением фибрина. Размножение вирусов в лимфоидной ткани ведет к множественному увеличению ЛУ, включая мезентериальные (аденовирусный мезаденит). Общетоксическое действие сопровождается лихорадкой и симптомами нерезко выраженной общей интоксикации При гематогенной диссеминации (виремии) развивается полиадения, поражение других органов, богатых лимфоидной тканью; иногда появляется кожная сыпь. Присоединение вторичной бактериальной микрофлоры обусловливает развитие острых пневмоний и других осложнений со стороны органов дыхательной системы (синуситы, отиты и др.).
Инкубационный период - от 1-3 до 12 дней, чаще 5-9 дней. Особенностью аденовирусной инфекции является последовательное развитие клинических симптомов. Выраженной интоксикации, за исключением тяжелых форм болезни, обычно не наблюдается. Начало болезни почти всегда острое с повышения температуры, озноба, ломоты в теле, головной боли, режущей боли в глазах, иногда с появлением рвоты, поноса. Основными клиническими формами являются: острое респираторное заболевание (ринофарингит, ринофаринготонзиллит, ринофарингобронхит; фарингоконъюнктивальная лихорадка; изолированное поражение глаз (конъюнктивит, кератоконъюнктивит, кератит); аденовирусная инфекция, протекающая с диареей.
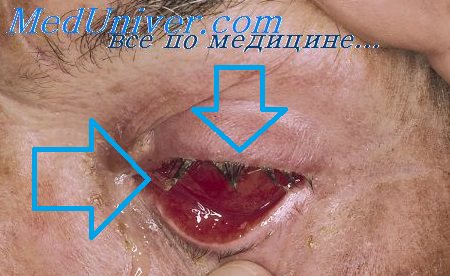
В младшем детском возрасте острый ларинготрахеобронхит нередко протекает с астматическим синдромом, типичный круп возникает редко. Аденовирусно-стафилококковая пневмония склонна к абсцедированию. Аденовирусный мезаденит, протекающий с выраженной болью в животе, рвотой, может симулировать острые хирургические заболевания органов брюшной полости. Течение даже неосложненных форм аденовирусной инфекции может быть длительным, рецидивирующим
В крови - небольшой лейкоцитоз или лейкопения, РОЭ нормальная или слегка ускорена.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

