Африканская лихорадка от человека к человеку
Обновлено: 12.05.2024
Вирусные тропические лихорадки: диагностика, лечение, профилактика
В роли возбудителей энцефалита и геморрагической лихорадки могут выступать свыше сотни различных вирусов. Практически все они избирают человека в качестве хозяина случайно, при вторжении последнего в их жизненный цикл. Передача осуществляется при прямом контакте с заражённой кровью или физиологическими жидкостями, а также при укусах членистоногих (комаров, клещей и мошек). Некоторые инфекции характеризуются достаточно высокой смертностью пациентов.
Желтая лихорадка. Возбудитель жёлтой лихорадки — оболочечный однонитевой плюс-РНК-вирус. Заражение происходит при укусе комара Aedes aegypti. Жёлтая лихорадка — зоонозная инфекция, при этом человек становится случайным хозяином (джунглевая форма). Вспышки возникают периодически также при проникновении возбудителя в городскую среду (городская форма).
Методы диагностики — культивирование вируса, серологическое исследование. Профилактика — введение живой аттенуированной (ослабленной) вакцины и контроль над распространением переносчиков (комаров).
Лихорадка Денге
Переносчики лихорадки Денге — комары рода Aedes. Возбудитель — флавиви-рус, похожий по своим свойствам на вирус жёлтой лихорадки. Установлено 4 серотипа вируса. Инкубационный период 2—15 дней. При возникновении лихорадки наблюдают виремию, продолжающуюся несколько дней. Вирус лихорадки Денге распространён на территории стран тропической зоны и Ближнего Востока. Эпидемии возникают при появлении нового серотипа либо при массовом попадании неиммунных людей в места обитания вируса; в городах распространяются очень быстро, заболевание протекает тяжело.
После внезапного возникновения жара, головной боли и общего недомогания пациенты начинают жаловаться на боли в суставах и костях. Лихорадка может быть двухволновой. В некоторых случаях отмечают небольшую сыпь. Наиболее тяжёлая и опасная форма заболевания сопровождается геморрагическим синдромом, характеризующимся развитием шока и геморрагического диатеза (геморрагическая форма денге). Смертность 5—10%.
Методы диагностики — серологическое исследование, культивирование вируса, молекулярно-генетические методы. Единственный способ профилактики заболевания — количественный контроль переносчиков. Лечение симптоматическое.
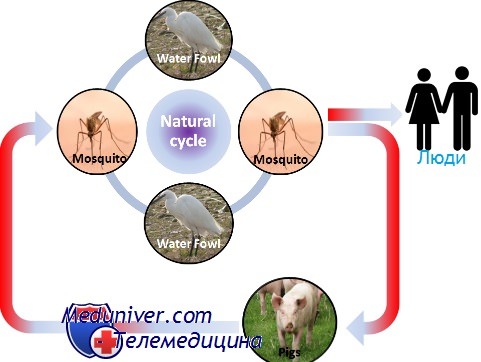
Эпидемиология японского энцефалита
Японский энцефалит В
Возбудитель японского энцефалита В — флавивирус; переносчики — комары. Природным источником вируса являются свиньи. В клинической картине доминируют симптомы тяжёлого энцефалита с высокой летальностью. Болезнь начинается остро с лихорадки, сильной головной боли, тошноты и рвоты.
В некоторых случаях отмечают судороги. При обследовании обнаруживают поражение черепных нервов и пирамидного пути. Для профилактики применяют вакцину.
Вирус лихорадки западного Нила
Заражение вирусом лихорадки западного Нила происходит так же, как при лихорадке Денге и японском энцефалите В. Вирус впервые был обнаружен в Северной Америке в 1999 г. и быстро проник на территорию Канады, Латинской Америки и Карибского бассейна.
Геморрагическая лихорадка Ласса
Ласская лихорадка — тяжёлая геморрагическая лихорадка, вызываемая аренавирусом. Передача инфекции осуществляется посредством контактного механизма от крыс к человеку, а затем и от человека к человеку. Вирус поражает все органы и системы организма. Пациенты жалуются на лихорадку, изъязвления в ротовой полости, мышечную боль и геморрагическую сыпь. Диагноз устанавливают на основании данных клинической картины и анамнеза заражения пациента.
Для его подтверждения применяют молекулярно-генетический метод с использованием обратной транскриптазы или серологические методы. На ранних стадиях заболевания и после контакта с инфицированными людьми назначают рибавирин.
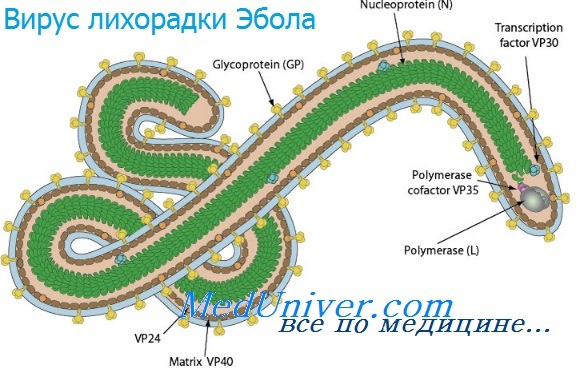
Инфекции вирусов лихорадки Эбола и марбургской болезни
Инфекции вирусов лихорадки Эбола и марбургской болезни - филовирусные инфекции распространены на территории Африки и передаются человеку от приматов и грызунов. Они характеризуются развитием тяжёлой геморрагической лихорадки и высоким уровнем смертности. Инфекция также передаётся при тесном контакте с инфицированными (особенно во внутрибольничной среде). Основной метод лечения — поддерживающая терапия и введение гипериммунной сыворотки.
Профилактику внебольничных инфекций затрудняет отсутствие возможности изоляции источника заболевания. Для предотвращения распространения внутри-больничной инфекции необходимо соблюдать строгие меры предосторожности при контакте с кровью и физиологическими жидкостями больных пациентов. Вакцина на основе вируса везикулярного стоматита, кодирующего антигены вируса лихорадки Марбург, способна защитить приматов даже при введении после заражения.
Хантавирус - хантавирусная лихорадка
Возбудитель передаётся человеку от грызунов, относится к группе буньявирусов. Инфекция, вызванная им, характеризуется геморрагической лихорадкой с почечным синдромом или хантавирусным лёгочным синдромом. Вирус широко распространён во всём мире. Передача от человека к человеку невозможна. По окончании инкубационного периода (2—3 нед) возникают лихорадка, головная боль, боль в спине, поражение конъюнктивы и нёба, а позднее — гипотензия, шок, олигурия, почечная недостаточность. Смертность около 5%.
Методы диагностики — серологическое исследование, молекулярно-генетические с использованием обратной транскриптазы. Предполагают, что рибавирин способен уменьшать вероятность смертельного исхода, но необходимые клинические исследования проведены не были.
Вирус Нипах
Парамиксовирус Нипах — возбудитель тяжёлых инфекций у людей и животных. Впервые выделен в Малайзии; обнаруживают на территории многих азиатских стран. Вызываемое им заболевание сопровождается развитием лихорадки и энцефалита и характеризуется высоким уровнем смертности. Источник инфекции — летучие мыши, питающиеся фруктами. Заражение происходит при контакте с мышами или промежуточными хозяевами (свиньями). Кроме того, возможна передача инфекции от человека к человеку.
Родственный вирусу Нипах вирус Хендра встречают реже. Переносчиками также служат летучие мыши. В клинической картине доминирует гриппоподобный синдром или энцефалит.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Африканский трипаносомоз человека, также известный как сонная болезнь, относится к трансмиссивным паразитарным заболеваниям. Его возбудителям являются паразитирующие простейшие, принадлежащие к роду трипаносом. Они передаются человеку при укусе мухи цеце (род Glossina), инфицированной от людей или животных, выступающих в роли хозяев этих патогенных для человека паразитов.
Муха цеце обитает только в Африке к югу от Сахары, и передавать болезнь могут лишь некоторые ее виды. По неизвестным на сегодняшний день причинам во многих районах ареала обитания мухи цеце случаи сонной болезни не отмечаются. Наиболее подвержены укусам мухи цеце и, следовательно, данной болезни жители эндемичных сельских районов, занимающиеся сельским хозяйством, рыболовством, животноводством и охотой. Случаи болезни могут отмечаться как на территории отдельных деревень, так и в целом регионе. В пределах отдельно взятого инфицированного района интенсивность распространения болезни может сильно варьироваться от одного сельского поселения к другому.
Формы африканского трипаносомоза человека
Африканский трипаносомоз человека имеет две формы в зависимости от вида возбудителя:
Существует еще одна форма трипаносомоза, которая встречается преимущественно в Латинской Америке. Она известна как американский трипаносомоз, или болезнь Шагаса. Возбудитель болезни Шагаса относится к другому подроду Trypanosoma, передается другими переносчиками и вызывает заболевание, клинические проявления которого отличаются от африканского трипаносомоза человека.
Трипаносомоз животных
Другие виды и подвиды паразитов рода Trypanosoma являются патогенными для животных и вызывают трипаносомоз у некоторых видов диких и домашних животных. Трипаносомоз крупного рогатого скота называют нагана. Трипаносомоз домашних животных, особенно крупного рогатого скота, серьезно подрывает экономическое развитие инфицированных сельских районов.
Животные могут быть носителями патогенных для человека паразитов, особенно T.b. rhodesiense, причем домашние и дикие животные являются важным резервуаром последнего. Животные могут быть также инфицированы T.b. gambiense и, вероятно, могут также выступать в качестве его резервуара, хотя и в меньшей степени. Тем не менее реальная роль животного резервуара в эпидемиологии гамбийской формы болезни до сих пор недостаточно изучена.
Крупные эпидемии
За последнее столетие в Африке произошло несколько эпидемий:
- эпидемия 1896-1906 гг., преимущественно затронувшая Уганду и бассейн реки Конго;
- эпидемия 1920 г., затронувшая ряд африканских стран; и
- последняя по времени эпидемия, начавшаяся в 1970 г. и продолжавшаяся до конца 1990-х гг.
В 1920 г. борьба с эпидемией велась силами передвижных бригад, которые выполняли скрининг миллионов людей, проживающих в районах высокого риска. К середине 1960-х гг. распространение болезни было взято под контроль, и на всем континенте регистрировалось менее 5 000 случаев заболевания. После такого успеха эпиднадзор был ослаблен, в связи с чем болезнь вернулась, и к 1970 г. в нескольких регионах ее вспышки разрослись до эпидемии. В 1990-е гг. и в начале XXI века благодаря усилиям ВОЗ, осуществлению национальных программ по борьбе с болезнью, двустороннему сотрудничеству и деятельности неправительственных организаций (НПО) тенденция к росту заболеваемости была остановлена.
Поскольку число новых случаев заболевания африканским трипаносомозом человека за период с 2000 по 2012 г. значительно сократилось в результате международных координированных усилий, в Дорожной карте ВОЗ по борьбе с забытыми тропическими болезнями была поставлена цель по его элиминации как проблемы общественного здравоохранения к 2020 г. и ликвидации передачи инфекции (сведение числа случаев к нулю) к 2030 г.
Бремя болезни
Сонная болезнь угрожает здоровью миллионов людей в 36 странах Африки к югу от Сахары. Многие из них проживают в отдаленных районах с ограниченным доступом к необходимой медицинской помощи, что затрудняет эпиднадзор и, следовательно, диагностику и лечение больных. Кроме того, важными факторами, способствующими передаче инфекции, являются перемещение населения, вооруженные конфликты и нищета.
Текущий ареал распространения заболевания
Показатели распространенности болезни варьируются между странами, а также между районами на территории отдельно взятой страны.
Механизм передачи и симптомы
Болезнь передается главным образом при укусе инфицированной мухи цеце, однако известны и другие механизмы передачи инфекции:
- передача инфекции от матери ребенку: трипаносомы могут проходить через плаценту и инфицировать плод;
- возможна механическая передача через других кровососущих насекомых, однако эпидемиологическая значимость этого пути передачи инфекции неизвестна;
- известны случаи случайного инфицирования персонала лабораторий в результате травмы зараженной иглой;
- есть сведения о передаче паразита половым путем.
На первой стадии инфекции трипаносомы размножаются в подкожных тканях, крови и лимфе. Эта стадия известна как гемолимфатическая фаза болезни, для которой характерны приступы лихорадки, головная боль, увеличение лимфоузлов, боль в суставах и зуд.
На второй стадии паразиты проходят гематоэнцефалический барьер и инфицируют центральную нервную систему. Эта стадия известна как неврологическая, или менингоэнцефалитическая. В целом на этой стадии появляются наиболее очевидные признаки и симптомы болезни: изменение поведения, спутанность сознания, сенсорные расстройства и нарушение координации движений. Важным клиническим признаком на этой стадии является нарушение цикла сна, которое и дало название этой болезни. Без лечения сонная болезнь считается смертельной, хотя известны случаи здорового носительства инфекции.
Ведение болезни: постановка диагноза
Ведение болезни осуществляется в три этапа:
- Скрининг на предмет выявления вероятной инфекции. Он включает серологическое исследование (возможно только в отношении T.b. gambiense) и проверку на наличие клинических признаков, в частности увеличения шейных лимфатических узлов.
- Поиск паразита в биологических жидкостях.
- Определение стадии болезни. Для этого выполняется клиническое обследование пациента и в некоторых случаях исследование спинномозговой жидкости, полученной путем люмбальной пункции.
Во избежание необходимости применения сложных и тяжелых методов лечения диагностика должна выполняться как можно раньше до развития неврологической стадии заболевания.
Ввиду длительного и бессимптомного течения первой стадии сонной болезни, вызванной T. b. gambiense, рекомендуется организация тщательного и активного скрининга групп риска с целью выявления пациентов на ранней стадии заболевания и ограничения дальнейшего распространения инфекции посредством их лечения, после которого они перестают выступать в качестве резервуара. Всесторонний скрининг населения требует серьезных финансовых вложений в кадровые и материальные ресурсы. В Африке, особенно в отдаленных районах с наибольшей распространенностью заболевания, этих ресурсов часто не хватает. В результате часть инфицированных умирает еще до постановки диагноза и получения лечения.
Лечение
Тип лечения зависит от формы и стадии заболевания. Раннее выявление болезни повышает шансы на успешное излечение. Ввиду того что паразит может сохранять жизнеспособность в течение длительного времени и вызывать рецидивы через много месяцев после окончания терапии, для оценки результатов лечения пациенты должны оставаться под наблюдением в течение периода продолжительностью до 24 месяцев, в рамках которого следует проводить клиническое обследование пациентов и выполнять лабораторные исследования физиологических жидкостей, в том числе в некоторых случаях спинномозговой жидкости, полученной путем люмбальной пункции.
Для успешного лечения болезни на второй стадии необходимо применение лекарственных препаратов, способных преодолевать гематоэнцефалический барьер и нейтрализовать паразита в центральной нервной системе.
Препараты для лечения болезни на первой стадии:
- Пентамидин: впервые получен в 1940 г., используется для лечения сонной болезни, вызванной T.b. gambiense, на первой стадии. Несмотря на наличие серьезных побочных эффектов, препарат в целом хорошо переносится.
- Сурамин: впервые получен в 1920 г., используется для лечения болезни, вызванной T.b. rhodesiense, на первой стадии. Препарат имеет ряд нежелательных побочных эффектов, включая нефротоксическое действие и аллергические реакции.
Препараты для лечения болезни на второй стадии:
Препараты для лечения заболевания на обеих стадиях:
Фексинидазол – пероральный препарат для лечения гамбийской формы африканского трипаносомоза человека. В 2019 г. препарат был включен в Перечень основных лекарственных средств ВОЗ и рекомендован в руководстве ВОЗ по лечению африканского трипаносомоза человека. Препарат показан в качестве терапии первой линии на первой и нетяжелой второй стадии заболевания. Он принимается в течение 10 дней через 30 минут после приема твердой пищи под наблюдением квалифицированного медицинского персонала. В настоящее время проводятся клинические испытания этого препарата для лечения родезийской формы трипаносомоза.
Частно-государственные партнерства
В 2000 и 2001 гг. ВОЗ учредила частно-государственное партнерство с компаниями Aventis Pharma (в настоящее время Sanofi) и Bayer HealthCare, в результате чего была создана программа по эпиднадзору и борьбе с данным заболеванием под руководством ВОЗ, в рамках которой эндемичным странам предоставляется поддержка в осуществлении противоэпидемических мероприятий и бесплатно поставляются лекарственные препараты.
Партнерство неоднократно продлевалось в 2006, 2011, 2016 и 2021 г. Успехи в сокращении числа случаев сонной болезни и появление реальной перспективы ее элиминации побудили ряд других партнеров из частного сектора поддержать инициативу ВОЗ по элиминации болезни как проблемы общественного здравоохранения и обеспечению ликвидации передачи инфекции к 2030 г.
Деятельность ВОЗ
ВОЗ оказывает содействие и техническую поддержку национальным программам по борьбе с сонной болезнью.
Для содействия разработке новых и недорогостоящих средств диагностики ВОЗ в 2009 г. создала банк образцов биоматериалов, которыми могут пользоваться исследователи. В банке, размещенном в Институте Пастера в Париже, хранятся образцы крови, сыворотки, спинномозговой жидкости, слюны и мочи, взятые у пациентов, инфицированных обеими формами болезни, а также образцы, взятые у неинфицированных людей из эндемичных районов.
В 2014 г. в целях активизации и поддержки усилий по элиминации болезни по инициативе ВОЗ была создана координационная сеть по африканскому трипаносомозу человека. В число партнеров этой сети вошли национальные программы по борьбе с сонной болезнью, организации, занимающиеся созданием новых лекарственных и диагностических средств, международные и неправительственные организации, а также организации-доноры.
Сонная болезнь – протозооз, возбудителем которого выступают простейшие рода Trypanosoma, а переносчиками - кровососущие мухи цеце. Симптоматика сонной болезни характеризуется образованием на месте укуса первичного аффекта (трипаносомного шанкра), волнообразной лихорадкой, лимфаденитом, кожными высыпаниями, местными отеками, нарастающей сонливостью, параличами, психическими расстройствами, комой. Диагностика сонной болезни основана на обнаружении трипаносом в биологическом материале (пунктате шанкра, лимфоузлов, крови, спинномозговой жидкости). Терапия сонной болезни проводится препаратами пентамидин, сурамин, меларсопрол, эфлорнитин.
Общие сведения
Сонная болезнь (африканский трипаносомоз) – заболевание из группы трансмиссивных трипаносомозов, протекающее с лихорадкой, поражением лимфатической и центральной нервной системы. Выделяют 2 формы сонной болезни: гамбийский (западноафриканский) и родезийский (восточноафриканский) трипаносомозы, вызываемые различными видами возбудителей. Сонная болезнь является эндемичной для 36 стран тропической Африки, где водятся переносчики болезни - мухи цеце. Самые крупные эпидемии сонной болезни были зафиксированы в 1896-1906, 1920 и 1970 годах. Ежегодно на Африканском континенте регистрируется 7-10 тыс. новых случаев заболевания сонной болезнью. В наибольшей степени заболевание распространено среди сельских жителей занимающихся земледелием, животноводством, рыболовством или охотой. Кроме африканского трипаносомоза, опасность для человека представляет американский трипаносомоз (болезнь Шагаса).

Причины сонной болезни
Известны два морфологически идентичных вида возбудителя сонной болезни человека: Trypanosoma brucei gambiense, вызывающий гамбийскую форму и Trypanosoma brucei rhodesiense, вызывающий родезийскую форму африканского трипаносомоза. Паразиты имеют продолговато-веретенообразную, плоскую форму, длину 12-35 мкм и ширину 1,5-3,5 мкм. Оба вида трипаносом передаются через слюну во время укуса мухи цеце (Glossina palpalis), которая служит переносчиком заболевания и после заражения способна передавать трипаносомы в течение всей жизни. Для заражения человека сонной болезнью достаточно одного укуса инвазированной мухи, которая выделяет со слюной около 400 тыс. паразитов, в то время как минимальная инвазирующая доза составляет 300-400 трипаносом.
При кровососании инвазированных позвоночных животных или человека в организм насекомого попадают кровяные трипомастиготы, которые размножаются путем бинарного деления в просвете кишечника мухи цеце. К 3-4 дню трипомастиготные формы проникают в слюнные железы, где трансформируются в эпимастиготы. В слюнных железах эпимастиготные формы претерпевают многократное деление и сложные морфологические изменения, в результате чего превращаются в метациклические трипомастиготы, представляющие собой инвазионную стадию трипаносом. При повторном укусе вместе со слюной муха цеце вводит под кожу человека метациклические трипомастиготы, которые через несколько дней проникают в кровь и лимфу, разносятся по организму, превращаясь в кровяные трипомастиготы.
После укуса инфицированной мухи в месте входных ворот развивается местно-воспалительная реакция в виде болезненного зудящего шанкра и регионарный лимфаденит. Через 1-3 недели, после проникновения трипаносом в кровяную и лимфатическую систему развивается гемолимфатическая стадия сонной болезни. Поздняя (менингоэнцефалитическая) стадия африканского трипаносомоза обусловлена проникновением паразита в ЦНС. В ответ на инвазию иммунная система реагирует выработкой специфических антител класса IgM, позволяющих некоторое время сдерживать паразитемию. Однако высокая антигенная изменчивость трипаносом нарушает формирование специфического иммунитета, обусловливая непрерывное прогрессирование и возвратно-рецидивирующий характер сонной болезни.
Симптомы сонной болезни
Ранняя (гематолимфатическая) стадия сонной болезни длится около 1 года (иногда от нескольких месяцев до 5 лет). Примерно через неделю после укуса мухи цеце на коже образуется первичный аффект – трипанома, или трипаносомный шанкр, представляющий собой болезненный эритематозный узелок диаметром 1-2 см, напоминающий фурункул. Этот элемент чаще всего локализуется на голове или конечностях, нередко изъязвляется, однако через 2-3 недели обычно спонтанно заживает, оставляя после себя пигментированный рубец. Одновременно с образованием трипаносомного шанкра на туловище и конечностях появляются пятна розового или фиолетового цвета диаметром 5-7 см (трипаниды), а также отеки лица, кистей, стоп.
Дальнейшее развитие сонной болезни связано с выходом паразитов в кровь, что сопровождается возникновением лихорадки неправильного типа. Лихорадочные периоды с температурными пиками до 38,5-40°С чередуются с апирексическими периодами. Характерным признаком сонной болезни служит увеличение регионарных лимфоузлов, особенно заднешейных (симптом Уинтерботтома), которые становятся плотными и могут достигать размеров голубиного яйца. Течение гемолимфатической стадии сонной болезни характеризуется нарастающей слабостью и апатией, тахикардией, артралгиями, потерей массы тела, увеличением печени и селезенки. У 30% пациентов появляются уртикарные высыпания на коже, развивается отек век. Возможно поражение органа зрения в виде кератита, иридоциклита, кровоизлияния в радужку, помутнения или рубцевания роговицы.
Длительность гемолимфатической стадии сонной болезни может составлять несколько месяцев или лет, после чего заболевание переходит в позднюю (менингоэнцефалитическую, или терминальную) стадию. В этот период на первый план в клиническом течении выходят симптомы менингоэнцефалита и лептоменингита, обусловленные проникновением трипаносомы через гематоэнцефалический барьер и поражением головного мозга. Наиболее типичным проявлением африканского трипаносомоза служит нарастающая дневная сонливость, приводящая к тому, что пациент может уснуть, например, во время еды.
Прогрессирование сонной болезни сопровождается развитием атаксической походки, невнятной речи (дизартрии), саливации, тремора языка и конечностей. Больной становится безразличен к происходящему, заторможен, жалуется на головную боль. Отмечается нарушение психического статуса в виде депрессивных или маниакальных состояний. В позднем периоде сонной болезни присоединяются судороги, параличи, эпилептический статус, развивается кома.
Родезийская форма сонной болезни имеет более тяжелое и скоротечное развитие. Лихорадка и интоксикация выражены сильнее, быстрее наступает истощение, часто возникает поражение сердца (аритмия, миокардит). Гибель больного может наступить уже в течение первого года заболевания еще до перехода трипаносомоза в менингоэнцефалитическую стадию. Причиной смерти больных чаще всего служат интеркуррентные инфекции: малярия, дизентерия, пневмония и др.
Диагностика и лечение сонной болезни
Предварительная диагностика сонной болезни осуществляется на основании клинико-эпидемиологических данных, важнейшими из которых служат пребывание в эндемичных районах Африки, наличие длительной, рецидивирующей лихорадки, первичного аффекта, шейного лимфаденита, отеков, сонливости и др. Неопровержимым доказательством заражения африканским трипаносомозом служит обнаружение трипаносом при лабораторных исследованиях нативного и окрашенного по Романовскому-Гимзе биологического материала. С целью обнаружения паразита анализу может подвергаться пунктат трипаносомного шанкра, измененных лимфоузлов, кровь, цереброспинальная жидкость.
В ряде случаев для распознавания сонной болезни проводится биологическая проба с внутрибрюшинным введением крови или спинномозговой жидкости больного морским свинкам. Из иммунологических реакций применяются РИФ, ИФА. Гамбийскую форму сонной болезни следует дифференцировать с малярией, токсоплазмозом, лимфогранулематозом, туберкулезом, менингитом, энцефалитом и др.; родезийскую форму, кроме этого, – с брюшным тифом, септицемией.
Специфическая терапия сонной болезни наиболее эффективна в раннюю стадию, до развития церебральной симптоматики. При гамбийской форме сонной болезни на гемолимфатической стадии назначается сурамин, пентамидин или эфлорнитин; на менингоэнцефалитической стадии эффективен только эфлорнитин. В раннем периоде родезийской формы сонной болезни применяется сурамин; в позднем – меларсопрол. Дополнительно проводится дезинтоксикационная, гипосенсибилизирующая, симптоматическая терапия.
Прогноз и профилактика сонной болезни
Без лечения летальность от сонной болезни близка к 100%. В случае начала специфической терапии в раннюю стадию африканского трипаносомоза возможно полное выздоровление; при поздно начатом лечении прогноз значительно хуже. Кроме сроков начала лечения, на исход влияет форма сонной болезни: при родезийском варианте трипаносомоза прогноз всегда серьезнее.
В профилактике сонной болезни главную роль играет истребление мух цеце с помощью инсектицидных препаратов, вырубки кустарниковых зарослей близ населенных пунктов, использование средств индивидуальной защиты от укусов кровососущих насекомых в эндемичных районах Африки. В периоды эпидемических вспышек сонной болезни среди местных жителей и приезжих проводится массовая химиопрофилактика пентамидином. Иммунопрофилактика африканского трипаносомоза не разработана.
Лихорадка Эбола - особо опасная вирусная инфекция, вызываемая вирусом Эбола и протекающая с тяжелым геморрагическим синдромом. Начальные клинические признаки лихорадки Эбола включают высокую температуру и выраженную интоксикацию, катаральные явления; в период разгара присоединяются неукротимая рвота, диарея, боли в животе, геморрагии в виде кожных кровоизлияний, наружных и внутренних кровотечений. Специфическая диагностика лихорадки Эбола осуществляется с помощью вирусологических и серологических методов. Этиотропная терапия лихорадки Эбола не разработана; получен положительный эффект от введения больным плазмы реконвалесцентов. Патогенетические мероприятия направлены на борьбу с инфекционно-токсическим шоком, дегидратацией, геморрагическим синдромом.
Общие сведения
Последняя вспышка лихорадки Эбола в Западной Африке, начавшаяся в марте 2014 г., является самой массовой и тяжелой со времени обнаружения вируса. В течение этой эпидемии заболело и умерло людей больше, чем во все предыдущие годы. Кроме этого, впервые вирус пересек не только сухопутные, но и водные границы, оказавшись на территории Северной Америки и Европы. Летальность при эпидемических вспышках лихорадки Эбола достигает 90%. В августе 2014 г. ВОЗ признала лихорадку Эбола угрозой всемирного масштаба.

Причины лихорадки Эбола
Вирус Эбола (Ebolavirus) принадлежит к семейству филовирусов и по своим морфологическим признакам схож с вирусом, вызывающим геморрагическую лихорадку Марбург, однако отличается от последнего в антигенном отношении. Всего известно 5 видов вируса Эбола: Zaire ebolavirus (Заир), Sudan ebolavirus (Судан), Tai Forest ebolavirus (Таи форест), Bundibugyo ebolavirus (Бундибуджио), Reston ebolavirus (Рестон). Крупные вспышки лихорадки Эбола в Африке ассоциируются с эболавирусами Заир, Судан и Бундибуджио; эпидемия 2014 года вызвана вирусом вида Заир. Рестонский эболавирус не представляет опасности для человека.
Предполагается, что естественным резервуаром вируса Эбола служат летучие мыши, шимпанзе, гориллы, лесные антилопы, дикобразы и другие животные, обитающие в экваториальных лесах. Первичное заражение человека происходит при контакте с кровью, выделениями или трупами инфицированных животных. Дальнейшее распространение вируса от человека к человеку возможно контактным, инъекционным, половым путем. Чаще всего заражение лихорадкой Эбола происходит при прямом контакте с биологическим материалом больных людей, загрязненными постельными принадлежностями и предметами ухода, с телом умершего при погребальных обрядах, совместном питании с больным, реже – при половых контактах и т. д. Больные лихорадкой Эбола представляют высокую опасность для окружающих примерно в течение 3-х недель от начала заболевания, выделяя вирус со слюной, носоглоточной слизью, кровью, мочой, спермой и др.
Повышенному риску заражения лихорадкой Эбола подвержены члены семьи и медицинский персонал, ухаживающий за больными, а также лица, занимающиеся отловом и транспортировкой обезьян. После перенесенной лихорадки Эбола формируется устойчивый постинфекционный иммунитет; случаи повторного заражения редки (не более 5%).
Сиптомы лихорадки Эбола
Примерно с 5-7 суток, в период разгара клинического течения лихорадке Эбола, возникают боли в грудной клетке, мучительный сухой кашель. Усиливаются абдоминальные боли, понос становится профузным и кровавым, развивается острый панкреатит. С 6-7 дня на коже нижней половины туловища, разгибательных поверхностях конечностей появляется кореподобная сыпь. Часто возникают язвенные вульвиты, орхиты. Одновременно развивается геморрагический синдром, характеризующийся кровоизлияниями в местах инъекций, носовыми, маточными, желудочно-кишечными кровотечениями. Массивная кровопотеря, инфекционно-токсический и гиповолемический шок становятся причиной гибели больных лихорадкой Эбола в начале 2-й недели заболевания.
В благоприятных случаях через 2-3 недели наступает клиническое выздоровление, однако период реконвалесценции растягивается на 2-3 месяца. В это время выражен астенический синдром, плохой аппетит, кахексия, боли в животе, выпадение волос, иногда развиваются тугоухость, потеря зрения, психические нарушения.
Диагностика
Лихорадка Эбола может быть заподозрена у лиц с характерными клиническими симптомами, находящихся в эпидемиологически неблагополучных регионах Африки или контактировавших с больными. Специфическая диагностика инфекции проводятся в специальных вирусологических лабораториях с соблюдением требований биологической безопасности повышенного уровня. Эболавирус может быть выделен из слюны, мочи, крови, носоглоточной слизи и других биологических жидкостей с помощью заражения клеточных культур, ОТ-ПЦР, электронной микроскопии биоптатов кожи и внутренних органов. Серологическая диагностика лихорадки Эбола основана на обнаружении антител к вирусу методами ИФА, РНГА, РСК и др.
Неспецифические изменения в общем анализе крови включают анемию, лейкопению (позже – лейкоцитоз), тромбоцитопению; в общем анализе мочи – выраженную протеинурию. Биохимические изменения крови характеризуются азотемией, увеличением активности трансфераз и амилазы; при исследовании коагулограммы выявляются признаки гипокоагуляции; КОС крови - признаки метаболического ацидоза. С целью оценки тяжести течения и прогноза лихорадки Эбола больным может потребоваться проведение рентгенографии органов грудной клетки, ЭКГ, УЗИ органов брюшной полости, ФГДС. Дифференциальная диагностика проводится с малярией, септицемией, тифом, другими геморрагическими лихорадками, прежде всего, с лихорадкой Марбург, Ласса, желтой лихорадкой. Больным могут быть показаны консультации инфекциониста, гастроэнтеролога, невролога, гематолога и других специалистов.
Лечение лихорадки Эбола
Транспортировка и лечение пациентов с лихорадкой Эбола осуществляется в специальных боксах-изоляторах. Весь ухаживающий персонал должен пройти специальный инструктаж, использовать барьерные средства защиты (специальные костюмы, очки, респираторы перчатки, обувь и т. д.), рекомендуемые при таких особо опасных инфекциях, как чума и натуральная оспа. Пациенту организуется строгий постельный режим и круглосуточное медицинское наблюдение.
На сегодняшний день вакцины от лихорадки Эбола не существует; сразу в нескольких странах мира проходят испытания экспериментальные образцы. Лечение сводится, главным образом, к симптоматическим мероприятиям: дезинтоксикационной терапии, борьбе с обезвоживанием, геморрагическим синдромом, шоком. В некоторых случаях положительный эффект дает введение плазмы выздоровевших людей.
Прогноз и профилактика
Летальность от лихорадки Эбола, вызванной штаммом вируса Заир достигает почти 90%, штаммом Судан – 50%. Критериями выздоровления считаются нормализация общего состояния пациента и трехкратные отрицательные результаты вирусологических исследований. Пресечь распространение лихорадки Эбола позволяет отслеживание контактов больных, соблюдение мер индивидуальной защиты, безопасное захоронение умерших, обеззараживание биологических материалов от больных геморрагическими лихорадками. В аэропортах различных стран усилен санитарно-карантинный контроль пассажиров, прибывающих из Африки. Контактные лица подлежат обсервации в течение 21 дня. При подозрении на заражение вирусом лихорадки Эбола пациенту вводится специфический иммуноглобулин из сыворотки крови лошадей.
Лихорадка Западного Нила – это острое инфекционное вирусное заболевание с преимущественно трансмиссивным заражением человека. Специфическими симптомами являются поражение центральной нервной системы, сосудов, слизистых оболочек. Характерны цефалгии, длительная лихорадка с потрясающими ознобами, выраженные мышечные боли, артралгии. Диагностика предусматривает обнаружение возбудителя и антител к нему в крови и ликворе больного. Специфическое этиотропное лечение не разработано, проводится симптоматическая терапия (жаропонижающие средства, инфузионная, оральная дезинтоксикация, вазопротекторы и др.).
МКБ-10
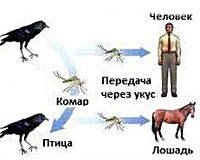
Общие сведения
Лихорадка Западного Нила является патологией с частым бессимптомным течением и воспалительным поражением оболочек головного мозга. Реже сопровождается менингоэнцефалитом. Открытие вируса и описание болезни датируются 1937 годом, стали результатом исследования в Уганде. Сезонность заболевания обусловлена временем выплода переносчиков (комаров и клещей), который приходится на конец июля – октябрь. Гендерные особенности отсутствуют. Отмечается тенденция к большей восприимчивости у детей в эндемичных районах (Северо-Восточная Африка, Азия, Израиль, Египет), у взрослых – на территориях с низкой распространенностью (южные регионы России, Украина, Европа, США).

Причины
Возбудителем является РНК-содержащий одноименный флавивирус. Выделяют 7 видов вируса, наиболее распространен первый генотип. Источниками и резервуарами инфекции в природе служат птицы (врановые, воробьиные), реже – млекопитающие (грызуны, непарнокопытные). Переносчиками возбудителя становятся кровососущие комары рода Culex, Aedes, иксодовые и аргасовые клещи. В организме переносчика (обычно – комара) вирус поражает нервную систему и слюнные железы, поэтому при укусе передается вместе со слюной. Гораздо реже встречается гемоконтактный путь передачи лихорадки, связанный с переливанием зараженной крови, трансплантацией органов зараженного донора, работой с культурой вируса в исследовательских лабораториях, грудным вскармливанием, совместным использованием нестерильных шприцов для внутривенного введения наркотиков, разделкой туш умерших животных.
В группу риска по заболеванию (особенно развитию менингита) входят пациенты с делецией в гене CCR5, лица старше 60 лет, больные сахарным диабетом, артериальной гипертензией, хроническим вирусным гепатитом С, почечной, сердечно-сосудистой патологией, ВИЧ-инфекцией, проходящие курс химиотерапии по поводу злокачественных новообразований, злоупотребляющие алкоголем, реципиенты донорских органов. К потенциально подверженным заражению профессиям можно отнести медицинских работников, лаборантов, ветеринаров, служащих скотобоен, егерей, фермеров. Возбудитель погибает при кипячении, воздействии обычных доз дезинфицирующих веществ.
Патогенез
После проникновения вируса в организм во время укуса комара возбудитель поражает дендритные клетки кожи, попадая с ними в лимфатические узлы. При последующей виремии флавивирус диссеминирует в паренхиматозные органы (в том числе почки и селезенку). После 6 дня от момента заражения инфекционный агент исчезает из периферической крови и аксональным путем проникает через гематоэнцефалический барьер в нервную ткань головного мозга. Данное явление наблюдается не всегда, при нормальном состоянии иммунной системы виремия купируется без поражения ЦНС. Возбудитель инфицирует нейроны, запуская процессы апоптоза, в результате формируются участки некроза. Размножение и накопление вируса происходит преимущественно в гиппокампе, стволе и мозжечке, передних рогах мотонейронов спинного мозга.
Установлено, что мутации гена CCR5 CD8 + -лимфоцитов приводят к замедленной миграции лейкоцитов в пораженные участки ЦНС, поскольку их направленное движение регулируется данным хемокиновым рецептором. В нейронах, лишенных рецепторов к интерферону-альфа и бета (белкам противовирусной защиты), практически сразу после интракраниального проникновения вируса запускается апоптоз. Эти факторы в экспериментах на мышах приводили к повышению вероятности летального исхода. Вирус проявляет тропность к эндотелию сосудов, может персистировать в организме 1-2 месяца и более.
Классификация
Клиническая систематизация подразумевает деление на группы с учетом наличия тех или иных проявлений лихорадки. Возможно трехволновое течение заболевания с последовательным преобладанием поражения головного мозга и сердца, воспалительных явлений в области респираторного тракта. Считается, что на долю нейроинвазивных форм приходится до 50% клинически выраженных случаев инфекции. Практическое значение с учетом необходимости проведения лечебных мероприятий имеет классификация, включающая две формы:
- Бессимптомная. По данным ВОЗ, в 80% случаев патология протекает без каких-либо проявлений, может быть выявлена только ретроспективно при наличии антител к определенному штамму возбудителя.
- Манифестная. Подразделяется на лихорадку Западного Нила с вовлечением ЦНС (менингит, менингоэнцефалит) и гриппоподобную форму. Среди иммунокомпетентных лиц преобладает последняя. Нейроинвазивные симптомы могут включать хориоретинит, окклюзивный васкулит и неврит глазного нерва.
Симптомы
Для нейроинвазивной формы лихорадки характерно нарастание температуры и головной боли, фонтанирующая рвота на пике болевых ощущений, не приносящая облегчения, усугубляющиеся нарушения сознания, повышенная сонливость или, напротив, возбуждение, фото- и фонофобия, судороги, затруднение контакта с больным, прогрессирующая мышечная слабость (до полного отсутствия произвольных движений при сохраненной чувствительности), поперхивание жидкой пищей, асимметрия глазных щелей, двоение в глазах. Сыпь и катаральные явления при данной форме почти всегда отсутствуют.
Осложнения
Наиболее частыми причинами осложнений являются коморбидная патология и позднее обращение за медицинской помощью. Основными угрожающими состояниями, развивающимися при лихорадке, считаются отек и набухание головного мозга, церебральные кровоизлияния, острая сердечно-сосудистая недостаточность, гипостатическая пневмония и другие вторичные бактериальные гнойные осложнения. Активная репликация вируса в стволе головного мозга может приводить к острой дыхательной недостаточности, остановке сердечной деятельности, неконтролируемой гиперпирексии. После перенесенного заболевания могут наблюдаться атаксические явления.
Диагностика
Требуется консультация инфекциониста. При наличии симптомов поражения ЦНС показан осмотр невролога, при высыпаниях – дерматовенеролога. Существенную роль в диагностике играет сбор эпидемиологического анамнеза с обязательным уточнением эпизодов посещения эндемичных зон России и мира. Методы лабораторно-инструментальной диагностики данной лихорадки включают:
- Объективный осмотр. Физикально определяется гиперемия кожных покровов, сыпь, инъекция сосудов склер, увеличение лимфоузлов, печени и селезёнки, зернистость зева. Может выявляться снижение остроты зрения, артериальная гипотензия, глухость сердечных тонов, менингеальные симптомы (ригидность затылочных мышц, симптомы Кернига, Брудзинского), рассеянная неврологическая симптоматика (снижение сухожильных рефлексов, горизонтальный нистагм, хоботковый рефлекс и пр.). При наличии очаговых симптомов и признаков раздражения мозговых оболочек показано проведение люмбальной пункции с макроскопической оценкой прозрачности, цвета ликвора, скорости его вытекания.
- Лабораторные исследования. Примерно в 30% случаев в анализе крови обнаруживается лейкопения, реже лимфопения, тромбоцитопения. Биохимические показатели обычно соответствуют норме, возможно незначительное повышение активности АСТ, АЛТ, креатинина, мочевины. При исследовании ликвора спинномозговая жидкость прозрачная, бесцветная, отмечается выраженный лимфоцитарный плеоцитоз, незначительное увеличение содержания белка. Уровень глюкозы, хлоридов остается в пределах нормы. В анализе мочи специфические изменения отсутствуют, при длительной лихорадке возможно нахождение следовых количеств белка.
- Выявление инфекционных агентов. Выделение вируса из крови методом ПЦР возможно уже на 4-9 сутки от начала болезни. В спинномозговой жидкости антитела к антигенам возбудителя определяют с помощью ИФА. Метод ПЦР для поиска вируса в ликворе применяется реже из-за низкой чувствительности, высокой специфичности. Существует возможность ПЦР-определения возбудителя в моче. ИФА для серологической диагностики значим только при контроле парных сывороток на 1-8 и 14-21 день заболевания и одномоментном исследовании на антитела к другим флавивирусам (во избежание перекрестных реакций). Для установления штамма вируса применяется секвенирование генома, при исследовании секционного материала назначаются иммуногистохимические анализы.
- Лучевые методы, ЭКГ, ЭЭГ. Для дифференциальной диагностики выполняется рентгенография легких, компьютерная, магнитно-резонансная томография головного мозга с контрастированием, при необходимости – ПЭТ-КТ. На ЭКГ могут выявляться признаки гипоксии миокарда, снижения атриовентрикулярной проводимости. При проведении ЭЭГ в 50-80% случаев отмечается снижение активности пораженных участков мозга. УЗИ брюшной полости позволяет определить увеличение размеров селезенки, печени; обязательным является осмотр лимфоузлов, щитовидной железы, забрюшинного пространства и малого таза.
Дифференциальная диагностика
Дифференциальную диагностику осуществляют с обширным кругом болезней:
- общими инфекциями: листериозом, ОРВИ, гриппом, туберкулезом, лептоспирозом, орнитозом, герпетической инфекцией, энтеровирусной инфекцией;
- другими геморрагическими лихорадками (желтая, Ласса, Эбола, чикунгунья, Марбурга, Рифт-Валли, крымская, ГЛПС),
- сепсисом;
- поражением головного мозга: клещевым энцефалитом, церебральным токсоплазмозом, ВИЧ-энцефалитом, менингококковой инфекцией,острым лимфоцитарным хориоменингитом, японским энцефалитом;
- сифилисом;
- прионными болезнями.
Возможными причинами подобного симптомокомплекса могут служить онкологические заболевания крови, дебют диффузных болезней соединительной ткани, тиреотоксикоз, травмы головы, геморрагические инсульты, инфаркты головного мозга, злокачественные новообразования ЦНС.
Лечение лихорадки Западного Нила
Всем пациентам с подозрением на данное заболевание показана госпитализация. При прогрессировании неврологической симптоматики лечение проводится в реанимационном отделении либо в палате интенсивной терапии. Необходим строгий постельный режим до устойчивого исчезновения лихорадки в течение 3-4 дней, купирования острых неврологических симптомов и появления возможности самостоятельного передвижения в пределах палаты. Диета не разработана, рекомендовано употреблять легкие питательные блюда, принимать достаточное количество жидкости. При угрозе отека мозга водный режим ограничивается и тщательно контролируется.
Специфического метода лечения лихорадки не существует. В некоторых исследованиях хорошо зарекомендовало себя применение препаратов альфа-интерферона, вируснейтрализующих моноклональных антител. Рибавирин для терапии инфекции не рекомендован, поскольку при вспышке в Израиле было установлено, что смертность пациентов с поражением ЦНС в группе лиц, получавших рибавирин, оказалась выше, чем среди остальных. Назначается симптоматическая терапия. Используются жаропонижающие (парацетамол, целекоксиб), вазопротекторы (рутозид), седативные (барбитураты, диазепам), мочегонные (фуросемид) препараты, осуществляется инфузионная дезинтоксикация (глюкозо-солевые, сукцинатсодержащие растворы).
Прогноз и профилактика
Своевременное обращение и лечение снижает риски осложнений и способствует полному выздоровлению в течение 10 дней. При наличии неврологических поражений срок реконвалесценции увеличивается до 30 и более дней. Летальность при нейроинвазивной лихорадке Западного Нила достигает 20%, обычно связана с параличом дыхательной мускулатуры. Описаны длительные (свыше 1 года) депрессивные эпизоды у 33% пациентов, перенесших заболевание. Период сохранения астеновегетативных проявлений в среднем составляет 36 недель, неврологических симптомов – более 8 месяцев.
Специфическая профилактика для людей не разработана, существует лишь эффективный препарат для вакцинации лошадей. Одной из причин отсутствия человеческой вакцины является высокая изменчивость вируса; в настоящее время проходят клинические испытания живые аттенуированные и рекомбинантные субстанции, а также ДНК-вакцина. К методам неспецифической профилактики болезни относятся своевременное выявление и изоляция больных, ветеринарный контроль над популяциями диких птиц и домашних животных, борьба с комарами (дезинсекция, противомоскитные сетки, спецодежда, репелленты).
1. Лихорадка Западного Нила (клиника, эпидемиология, диагностика, патоморфология и лечение): Автореферат диссертации/ Петров В.А. - 2004.
2. Клинико-эпидемиологические аспекты и вопросы лечения лихорадки Западного Нила/ Е.А. Иоанниди, В.Г. Божко, В.П. Смелянский, Е.Т. Божко. - Лекарственный вестник. - 2015 - Т.9, №3(59).
3. Диагностика и лечение лихорадки Западного Нила: метод. рекомендации для студентов медицинских ВУЗов / Н.И. Мамедова, Ю.М. Амбалов. – 2013.
4. Геморрагические лихорадки у туристов и мигрантов (медицина путешествий). Ч.4/ под ред. Ю.В. Лобзина. - 2015.
Читайте также:

