Алгоритм профилактики инфекции при ивл
Обновлено: 24.04.2024
Отключение больного от респиратора. Уход за больными, находящимися на ИВЛ.
Отключение больного от респиратора и экстубацию трахеи целесообразно начинать в утренние часы, т. к. вечером pi ночью "бдительность" персонала отделения интенсивной терапии несколько притупляется.
При ИВЛ менее суток основаниями для отключения больного от респиратора являются восстановление сознания, мышечного тонуса, стабильные показатели гемодинамики, отсутствие выраженной гиповолемии и других метаболических нарушений.
В случае проведения длительной ИВЛ вентиляция прекращается при наличии стабильного состояния больного pi устранения причины, приведшей к ИВЛ. Кроме этого, необходимыми являются восстановление сознания пациента, отсутствие значительного количества мокроты в дыхательных путях, частота дыхания менее 35 в минуту, проведение дыхания над всеми легочными полями, возможность произвольного увеличения больным дыхательного объема вдвое, инспираторное усилие более 15 см Н20, Ра02 более 60 мм рт.ст. при Fi02 менее 0,6, ДО более 5 мл/кг, ЖЕЛ более 10 мл/кг, МОД менее 10 л/мин, а также стабильность показателей гемодинамики (СИ не менее 2,8 л/мин • м , ЧСС менее 120 в мин.) и отсутствие выраженной гиповолемии.
Перевод больного на самостоятельное дыхание осуществляется через вспомогательную вентиляцию с постепенным и плавным прекращением респираторной поддержки.
При восстановлении спонтанного дыхания вентиляцию больному проводят в режиме СРАР. Между конектором интубационной трубки и Y-образным конектором респиратора устанавливается тройник. Увлажненная кислородно-воздушная смесь (Fi02 >0,4) подается в легкие, выдох осуществляется через трубку, присоединенную к тройнику и погруженную в воду на 3-5 см (ПДКВ 3-5 см №0). Сеансов такого дыхания может быть несколько в течение суток. В первые сутки после экстубации трахеи вентиляция в режиме СРАР с ПДКВ 3-4 см Н2О и FiO2 > 0,4 проводится по 20-30 минут через 2-4 часа.

Уход за больными, находящимися на ИВЛ.
В течение всего времени проведения ИВЛ больного следует поворачивать на бок в дневное время каждый час, в ночное - каждые 3 часа. При отсутствии противопоказаний (ЧМТ, ОНМК, травма позвоночника, отек легких, выраженный парез кишечника) 2-3 раза в сутки больному необходимо придавать положение постурального дренажа путем подъема ножного конца кровати на 30°.
Перед санацией трахео-бронхиального дерева целесообразно выполнение перкуссионного массажа, который проводится в фазе выдоха путем легкого поколачивания кулаком правой руки по кисти левой, положенной на грудную клетку больного. Левая ладонь перемещается по всей доступной площади грудной клетки, исключая область сердца.
При наличии у больного густой и вязкой мокроты в трахео-бронхиальное дерево через интубационную трубку вводят 5-10 мл раствора, разжижающего секрет, который состоит из антибиотика, 50 мг гидрокортизона, 25 мг тиамина хлорида, 10 мл димексида, 70 мл 0,25% раствора новокаина и изотонического раствора хлорида натрия до 150 мл.
Санация трахео-бронхиального дерева выполняется после ИВЛ в течение 2-3 минут с увеличенными на 20% дыхательным объемом и Fi02 = 1,0 или перевода больного на режим высокочастотной ИВЛ на 5-10 минут.
Санацию выполняют специальным пластиковым катетером (использование самодельных катетеров из инфузионных систем недопустимо), который присоединяется через тройник к шлангу аспиратора. При введении катетера в трахею свободное отверстие тройника должно быть открытым. Голову больного поворачивают в сторону, противоположную тому главному бронху, в который вводится катетер. После закрытия свободного отверстия тройника пальцем катетер медленно извлекают вращая.
Обычно выполняется 3-4 санации с продолжительностью каждой 15-20 секунд (не более!).
По окончании процедуры дыхательный объем и FiO2 постепенно снижают до исходного уровня.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
1. При возможности, лучше производите ИВЛ через S-образный воздуховод, или воздуховод любой другой конструкции (см. рис. 25, 26).
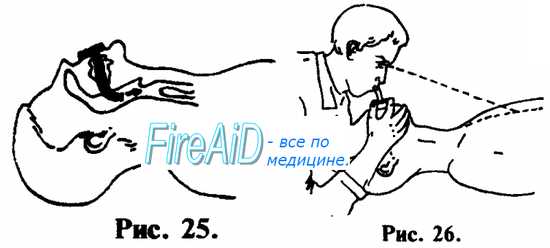
2. Если нет воздуховода, используйте прокладку из 2-х слоев марли, но не более. При 3—4 и более слоях марли, проведение ИВЛ будет затруднительно чисто физически. То же самое можно сказать и в отношении попыток производить ИВЛ, используя в качестве прокладки носовой платок или любую другую материю.

Если реаниматор действует в одиночку, отношение частоты сдавливаний грудной клетки к темпу ИВЛ должно составлять 15:2. В этих случаях проверяют пульс после завершения четырех циклов ИВЛ, а затем каждые 2—3 мин. Не стремитесь делать ИВЛ в режиме максимальных вдохов и выдохов в сочетании с большой частотой. Это чревато возникновением осложнений уже у реаниматора.
На фоне усиленной искусственной гипервентиляции, да еще в сочетании с естественным волнением за судьбу больного, может очень быстро развиться декомпенсированный дыхательный алкалоз с кратковременной потерей сознания, что создаст дополнительные трудности членам реанимационной бригады.
При проведении ИВЛ у детей, учитывая небольшое расстояние между носом и ртом, следует сразу захватывать своими губами рот и нос пострадавшего, частота дыхания должна быть не менее 18—20 в 1 мин., с соответствующим уменьшением дыхательного обьема (ориентиром частоты дыхания и дыхательного объема могут служить величины нормы для конкретного возраста).

Предотвращению раздувания желудка при отсутствии интубации трахеи способствует поддержание дыхательных путей в открытом состоянии не только во время вдоха (медленное выполнение которого обеспечивает реаниматор), но и во время пассивного выдоха. Несмотря на это, раздувание желудка все же возможно, особенно если реаниматор один (в одиночку непрерывно поддерживать дыхательные пути в открытом состоянии невозможно).
В стремлении уменьшить растяжение желудка нельзя надавливать на область эпигастрия (это вызывает рвоту, если желудок наполнен). Вместо этого продолжают основные реанимационные мероприятия, уделяя особое внимание правильному проведению ИВЛ. Для проведения ИВЛ можно использовать дыхательный мех (мешок Амбу). Он улучшает физиологические параметры ИВЛ (пострадавший получает атмосферный воздух, не выдыхаемый; бесспорно, этот способ более гигиеничен). Трахеостомия ургентно не выполняется, т. к. даже самый высококлассный специалист быстрее, чем за 3 мин., ее не сделает.
Малкова О.Г.,Купренков А.В, Демещенко В.А., Руднов В.А., Левит А.Л.
Больные, нуждающиеся в продолжительной вентиляции:
∙ ИВЛ > 7 суток - 5 % от всех случаев механической вентиляции
∙ Летальность - от 36 до 59 %
∙ Стоимость обеспечения ИВЛ - более 1,5 % общебольничных затрат без учета физических сил и эмоционального вклада медицинского персонала
(Make B.J., Hill N.S., Goldberg A.I. Et al. Mechanical Ventilaition Beyond the ICU. Report of a Consensus Conference of the American College of Chest Physicians . Chest 1998 (Vol 113); N 5 - P. 289-344)
Больные, нуждающиеся в продолжительной вентиляции (данные ОРИТ СОКБ № 1):
∙ ИВЛ > 7 суток - 13,9 % от всех реанимационных пациентов
(средний срок госпитализации - 14,3±0,85 суток)
∙ ИВЛ > 14 суток √ 8,6 %
(средний срок госпитализации - 22,02±1,48 дня)
- при ИВЛ > 7 суток - 7,05 %
- при ИВЛ >14 суток - 2,09 %
Факторы, от которых зависит успешность продолжительной ИВЛ:
Предупреждение инфицирования легких:
- микробиологический мониторинг и рациональная антибактериальная терапия [1]
- профилактика экзогенного инфицирования (использование закрытых аспирационных и мочевых систем, фиксирующих повязок, протоколов, регулирующих правила гигиены персонала ОРИТ) [2]
- положение с поднятым головным концом снижает частоту ВАП и длительность пребывания в ОРИТ [3]
- корректное использование антацидов [4]
- нутритивная поддержка [5]
[1] DrAmico et al Effectiveness of antibiotic prophylaxis in critically ill adult patients: systematic review of randomized controled trials//BMJ 1998; 316; 1275-1285;.
[2] Bischoff W.E. et al Handwashing compliance by health care workers: the impact of introducing an accessible, alcohol-based hand antiseptic Arch Intern Med 2000; 160; 1017- 1021;
[3] Draculovic M.B.et al. Supin body position as a risk factor for nosocomial pneumonia in mechanically ventilated patients: a randomized trial. Lancet 1999; 354; 1851-1858;
[4] Cook D. et al. A comparison of Sucralfate and Ranitidine for the prevention of upper gastrointestinal bleeding in patients requiring mechanical ventilation// N Engl J Med 1998; 338; 791-797;
[5] Taylor S.J et al Prospectiv, randomized, controlled trial to determine the effect of early enhanced enteral nutrition clinical outcome in mechanically ventilated patients suffering head injury. Crit Care Med 1999; 27; 2525-2531
Факторы, от которых зависит успешность продолжительной ИВЛ:
2. Профилактика коллабирования и/или консолидации легких (вентилятор-ассоциированного повреждения легких):
- фибробронхоскопия
- адекватный гидробаланс [1]
- корректное проведение ИВЛ (контролируемые и вспомогательные режимы, профилактические приемы рекрутмента и ПДКВ, использование позиции на животе и др.) [2,3]
[1] York J., Arrillaga A., Graham R. Et al. J Nrauma 2000; 48; 376-380
[2] П.Пелози, Д.Д Онофрио, Д.Чиумелло. ИВЛ у пациентов с ЧМТ // Освежающий курс лекций. - Архангельск, 2004. √ с.190-195
[3] Beuret P., Carton M.J., Nurdint K.. et al Int. Care Med 2002; 28; 564-569
Микробиологический мониторинг и рациональная антибактериальная терапия
С 2002 года в СОКБ №1 организована система инфекционного контроля, важнейшей частью которого является ежегодный мониторинг микробного пейзажа отделений стационара с одновременным проведением мониторинга антибиотикорезистетности выявленных микроорганизмов.
Динамика заболеваемости НИ
(показатель на 1000 пролеченных пациентов)
Территория
2003
2004
РФ
0,92
0,95
Свердловская область
1,67
2,13
СОКБ №1
0,44
3,3
Микробиологический мониторинг СОКБ №1
Год
Количество исследований
% положительных результатов
2000
13056
23
2001
9907
21
2002
9945
32
2003
11285
43,3
2004
14184
53
Особенности микробного пейзажа у пациентов
с НИ в СОКБ № 1 (%)
Частота НИ в ОРИТ СОКБ № 1 (%)
Микробиологический мониторинг НИ в ОРИТ СОКБ №1 (%)
1 место - НГОБ √ 30 % (Ps.aeruginosa √ 70,5 %, Acinetobacter √ 16,7 %)
2 место - Грибы √ 26,5 % (Candida spp. √ 83,1 %)
3 место - Грам + кокки (Staph.epidermidis+Staph.aureus √ 42,4 %, Enterococcus faecium√ 44,6 %)
Наиболее часто встречающиеся возбудители
НИ в ОРИТ СОКБ №1
Гемокультура
Наиболее часто встречающиеся возбудители в гемокультуре (%)
Микробиология мокроты у пациентов ОРИТ СОКБ № 1
Структура микроорганизмов, встречающихся в мокроте
Возбудители НИ мочевыводящих путей (%)
Наиболее часто встречающиеся возбудители инфекций мочевыводящих путей
Динамика выявления микробных ассоциаций (%)
Количество
микроорганизмов
2004
2005
1
62,5
82,8
2
26,8
15,1
3
10,7
2,1
Чаще всего микробные ассоциации выявляются при исследовании инфекций мочевыводящих путей - 30,9%
Результаты микробиологического мониторинга:
1. За последние годы отмечается увеличение случаев НИ в СОКБ № 1 в 7,5 раза и в 2,6 раза в ОРИТ
2. За период с 1998 по 2005 год выявлена смена микробиологического пейзажа ОРИТ с преобладанием грибковой инфекции и уменьшением количества случаев микробных ассоциаций
Антибиотикорезистентность и антибактериальная терапия
Мониторинг антибиотикорзистентности выделенных микроорганизмов позволяет проводить рациональную этиотропную терапию и контролировать циркуляцию полирезистентных штаммов √ источников НИ.
Антибиотикорезистентность штаммов Ps.aeruginosa (%)
Антибиотик
2002
2003
2004
2005
цефтазидим
56
97
95
88
цефоперазон
70
84
91
амикацин
47
46
60
86
офлоксацин
82
83
86
имипенем
24
30
43
65
меропенем
53
53
61
73
Антибиотикорезистентность штаммов St.aureus (%)
антибиотик
2002
2003
2004
2005
Пенициллин
83
82
83
Оксациллин
80
39
42
Цефазолин
27
18
30
Амоксиклав
35
48
46
Ванкомицин
0
0
0
0
Политика применения антибиотиков в стационаре
Планирование антибиотикотерапии (разработка режимов антибактериальной терапии) должно осуществляться на основании локального мониторинга антибиотикорезистентности с учетом структуры реанимационной патологии
Профилактика экзогенного инфицирования
Современная медицинская и судебная практика показывают, что время пренебрежительного отношения к инструментам пособия кануло в лету.
У врачей формируется щепетильное отношение к расходным материалам и аксессуарам, как высокотехнологичному оборудованию.
Требовательность к качеству изделий и рациональному их применению гарантируют увеличение количества успешной продолжительной ИВЛ.
Эпидемиология госпитальных инфекций в ОРИТ
∙ Госпитальные инфекции (НИ) составляют 44,2 % от всех инфекций в ОРИТ
∙ У 18,9 % больных НИ является приобретенной в ОРИТ (2,3 √ 49,2 %)
∙ По локализации НИ:
82,9 % - легкие
8,2 % - мочевыводящие пути
11,3 % - кровь
6,5 % - кожа
Alberti C.et al. Epidemiology of sepsis and infection in ICU patients from an IMCS/ICM, 2002
Направления профилактики НИ (рекомендации HICPAC)
∙ Прерывание механизмов передачи инфекции
∙ Предупреждение переноса бактерий персоналом
∙ Ограничение использования сопутствующих ЛС, способствующих повышению риска эндогенного инфицирования
Профилактика катетер-ассоциированных инфекций:
Распространенность КАИ составляет 4 - 18 %
(Cramp J., Collignon P. Intravascular catheter-associated infection. Eur J Clin Microbial Infect Dis 2000; 19; 1-8)
∙ Обучение персонала работе с катетерами, приборами и правила ухода за ними
∙Катетеризация сосудов строго по показаниям
∙ Обеспечение максимальной стерильности в месте стояния катетера с применением стерильных фиксирующих повязок
∙ Использование передовых технологий: катетеров с антиинфекционным покрытием, использование павильонов особых конструкций, исключающих контаминацию и т.п.
Исследование эффективности фиксирующих стерильных повязок CENTRAL-GARD в профилактике КАИ
∙ в группе у неотложных пациентов, где не использовались фиксирующие повязки CENTRAL-GARD :
- у 76,5 % пациентов имелись признаки воспаления места стояния катетера
- у 58,8 % - положительные результаты микробиологического иссследования
- в одном случае (5,6 %) √ катетер-ассоциированный сепсис
∙ в группе у плановых пациентов, где не применялись повязки CENTRALGARD:
- признаки воспаления развивались на 5-е сутки у 17 % больных
- у 20 % - положительные результаты микробиологического исследования
∙ в группе с использованием повязок CENTRAL-GARD признаков воспаления кожи не отмечалось, результаты бактериалогоческого исследования отрицательны Карпун Н.А. Профилактика катетер-ассоциированных инфекций кожи и кровотока.
материалы сателлитного симпозиума 9-го съезда Общероссийского общества организации ╚Федерация анестезиологов и реаниматологов, Иркутск, 2004
Профилактика инфекции мочевыводящих путей
95% всех инфекций мочевыводящих путей у пациентов отделений интенсивной терапии связаны с мочевыми катетерами.
Richards M, еt al Nosocomial infections in medical intensive care units in the United States. Crit Care Med. 1999; 27:887-892
Нозокомиальная бактериурия и/или кандидурия возникает у 25% пациентов при катетеризации мочевого пузыря продолжительностью более 7 дней.
Риск инфицирования возрастает ежедневно на 5%.
Stark RP, Maki DG. Bacteriuria in the catheterized patient. Engi J Med 1984:311:560-4.
Закрытая дренажная система, предложенная ещё в 1928 году, остаётся наиболее эффективным методом профилактики катетер-ассоциированных инфекций мочевыводящих путей.
Она снижает частоту случаев бактериурии до 50% за 14 дней катетеризации (в сравнении с 95% за 96 часов при открытой дренажной системе).
Kunin C, McCormick R. Prevention of catheter-associated urinary tract infection by sterile closed drainage. NEngl J Med. 1966;274:1154-1161
Почему закрытые мочеприемные системы ?
∙ Предупреждение восходящей уроинфекции:
- снижение койко-дня тяжелого больного
- уменьшение стоимости койки на 1 больного
- снижение расходов на дорогостоящие антибиотики
∙ Безопасность для пациента и медицинского персонала
∙ Оптимальное функционирование
∙ надежность,
∙ возможность взятия проб на исследования,
∙ достаточная емкость,
∙ быстрый и удобный слив
∙ Больший комфорт для пациента
Исследование эффективности закрытых стерильных мочеприемников в профилактике восходящей уроинфекции у пациентов ОРИТ
(А.В.Купренков, А.Л.Левит, 2005)
Критерии включения: первичная установка постоянного мочевого катетера и мочеприемника
Критерии исключения: положительные результаты первичного микробиологического иследования мочи
Критерий инфекционной безопасности пациента от восходящей уроинфекции √ оценка длительности неинфицирования мочи
Результаты исследования эффективности использования закрытых мочевых систем:
1. Закрытые стерильные мочевыводящие системы обеспечивают высокую инфекционнуюбезопасность пациентам с установленным мочевым катетером
2. Высокая протективная способность мочеприемников подтверждается тем, что в 70% случаев выявления микроорганизмов не был превышен порог титра инфекционного заболевания 10*6 колоний в мл
3. Для обеспечения полной инфекционной безопасности пациента от внутрипросветного восходящего пути уроинфекции смена закрытых стерильных мочеприемников модели А4 (Уномедикал) должна производиться на 4-е сутки их использования у пациента.
4. Закрытые стерильные системы модели А6 (Уномедикал) обеспечивают надежнуюзащиту пациента в течение минимум 6 суток и могут быть рекомендованы к замене на 7 сутки их использования.
Частота развития НП у пациентов на ИВЛ:
1.По данным Никифорова Ю.В.:
( Никифоров Ю.В. Клинико-экономическиий анализ применения одноразового расходного материала в ОАР // Материалы сателлитного симпозиума 9-го съезда Общероссийского общества организации "Федерация анестезиологов и реаниматологов", Иркутск, 2004)
на 3 сутки - 30 %,
на 7 сутки - 60 %,
на 14-15 сутки - 90 - 100 %
∙ летальность:
при ИВЛ до 5 суток - 68 %
при ИВЛ до 15 суток - 66 %
при ИВЛ более 30 суток - 42,5 %
2. По данным Климовой Г.М. с соавт.:
(Г.М.Климова, В.М.Клюжев, В.Г.Акимкин, Н.А.Карпун и др. Эпидемиология и профилактика септических инфекционных осложнений у больных отделений реанимации и интенсивной терапии хирургического профиля //"Эпидемиология и Вакцинопрофилактика" №3 (28), 2006, стр.33-37)
- НП - от 6 % до 32,2 √ 38,4 %
- ВАП в структуре НП - от 16,6 % до 68 %
Профилактика инфекций нижних дыхательных путеи и НП
(В.А. Демещенко, В.А.Руднов, 2006)
∙ Использование закрытой аспирационной системы Cathy снижает риск бактериальной колонизации и последующего развития инфекционного процесса нижних дыхательных путей на 26,2 % и ВАП на 28,4 % по сравнению с открытой санацией трахеи
∙ Время развития гнойного трахеобронхита с 4,4±2,3 суток при открытой санации трахеи увеличивается до 7,25±2,4 суток при использовании Cathy, ВАП - с 8 до 14 суток
∙ Оптимальный срок смены системы - 48 часов
∙ Экономические преимущества закрытых систем прежде всего должны проявиться у пациентов с высоким риском развития ВАП Закрытые аспирационные системы наиболее показаны при прогнозируемой ИВЛ более 4 суток, с наличием факторов риска ВАП и в ОРИТ с высокой распространенностью полирезистентных возбудителей НИ
Общие принципы ухода и профилактика инфекционных осложнений у пациентов с продолжительной ИВЛ:
1. Использование стерильных одноразовых расходных материалов и бактериальных фильтров
2. Манжеточная манометрия и своевременная замена эндотрахеальных и трахеостомических трубок и дыхательных контуров 3. Применение легочно-протективной ИВЛ
4. Санация дыхательных путей: аспирация бронхиального и надманжеточного секрета, изменение реологии мокроты, постуральный дренаж, вибромассаж грудной клетки
5. Общий уход: профилактика и лечение пролежней, предупреждение сателлитных инфекционных осложнений (катетерный сепсис, мочевая инфекция и т.д.), энтеральной питание, опорожнение кишечника
Выводы:
1. Увеличение случаев НИ связано с исходной тяжестью состояния реанимационных больных, предшествующей антибактериальной терапией и отсутствием системного подхода к профилактике экзогенного инфицирования
2. Изменение микробного пейзажа и рост полирезистентной флоры обусловлено нерациональным использованием антибиотиков
3. Инфекционная безопасность больного является основой профилактики НИ в ОРИТ
Известно, что отделения реанимации и интенсивной терапии характеризуются чрезвычайно высоким риском возникновения внутрибольничных инфекций (ВБИ), которые являются одной из самых актуальных проблем в современной медицине.

Основными причинами высокой заболеваемости ВБИ в отделениях реанимации являются следующие:
- Высокая восприимчивость пациентов. Пациентами отделений реанимации являются люди, ослабленные основным заболеванием, тяжесть которого делает невозможным жизнь пациента без применения искусственной вентиляции легких, парентерального питания и пр. Применение антибиотиков широкого спектра, которое в большинстве случаев начинается сразу после поступления больного в отделение, повышает риск колонизации пациентов антибиотикорезистентными штаммами микроорганизмов.
- Высокая концентрация медицинского персонала и тесный контакт медицинских работников с пациентами. Пациенты здесь нуждаются в более интенсивном и квалифицированном уходе, чем пациенты других отделений, что определяет интенсивность контактов.
- Высокая частота использования инвазивных лечебно-диагностических манипуляций и процедур. Для лечения и диагностики в отделениях реанимации используются методы, являющиеся факторами риска возникновения госпитальных инфекций. Искусственная вентиляция легких, частая санация трахеобронхиального дерева предопределяют возможность колонизации дыхательных путей условно-патогенными микроорганизмами с последующим развитием поствентиляционных трахеобронхитов и пневмоний, которые являются ведущей формой госпитальных инфекций в отделениях реанимации. С массивной инфузионной терапией и длительной катетеризацией центральных вен и артерий часто связано возникновение бактериемий. С частой и длительной катетеризацией мочевого пузыря связано возникновение мочевой инфекции.
В нашем отделении предусмотрена возможность непрерывного наблюдения за каждым больным с поста медицинской сестры, свободного доступа к койке каждого больного со всех сторон, возможность проведения тщательной уборки и дезинфекции.
В отделениях интенсивной терапии и реанимации используется компактное, удобное в обращении и отвечающее повышенным требованиям гигиены, современное оборудование. Мебель изготовлена из материалов, легко поддающихся дезинфекции. Для стен и пола используются легко моющиеся покрытия из специальных облицовочных материалов.
Отделения реанимации, при необходимости, может быть разделено на 2 сектора — для больных с уже имеющейся инфекцией и для “чистых” больных.
Предусмотрена возможность проведения изоляционно-ограничительных мероприятий в отношении пациентов с манифестной формой ВБИ, а также пациентов — носителей эпидемически опасных штаммов, которые наиболее часто вызывают вспышки ВБИ в отделениях реанимации, а также антибиотикорезистентных штаммов любых условно-патогенных микроорганизмов.
Помимо внутрибольничных инфекций, вызванных возбудителями, которые были переданы пациентам в стационаре (экзогенные инфекции), существует большая группа так называемых эндогенных инфекций, т.е. инфекций, вызванных собственной флорой пациента (условно-патогенными микроорганизмами, вегетирующими на кожных покровах и слизистых и в пищеварительном тракте) или микроорганизмами, колонизирующими пациента. Чем тяжелее состояние больного, тем больше микроорганизмов поселяется на кожных покровах и слизистых. В связи с этим тщательный уход за тяжелыми больными реанимационных отделений имеет чрезвычайно важное значение.
Уход за кожей. Наружные покровы служат средой обитания множества микроорганизмов, которые в обычных условиях из-за мощных барьерных функций кожи редко вызывают патологию. Опасность постоянных обитателей кожи проявляется при нарушении целостности кожных покровов, а также при трофических изменениях кожи, наблюдающихся у тяжелых больных. В связи с этим, каждому тяжелому больному ежедневно проводится обтирание тела теплой водой, в которую добавляют спирт, уксус. Под больного подкладывают клеенку или специальную гигиеническую подкладную. Больным с непроизвольным мочеиспусканием и дефекацией обтирание производят после каждого загрязнения кожи. Несвоевременная смена постельного белья приводит к образованию пролежней, их инфицированию и таким образом способствует присоединению еще более серьезных госпитальных инфекций, утяжеляющих состояние больных; для профилактики возникновения опрелостей тело обрабатывается 3% камфарным спиртом или 3% уксусной кислотой.
Уход за полостью рта, промывание глаз. Эти меры являются средством профилактики стоматитов, гнойных конъюнктивитов, паротитов. Глаза промываются теплым раствором фурациллина; в порядке профилактики используют раствор альбуцида.
Для лечения пациентов отделений реанимации и интенсивной терапии требуется массивная инфузионная терапия, при которой незаменимы внутрисосудистые катетеры. Они используются для внутривенного введения жидкостей, лекарственных средств, производных крови, парентеральных питательных растворов, а также для наблюдения за состоянием гемодинамики у больных в критическом состоянии. Однако, использование внутрисосудистых катетеров часто осложняется развитием местных или системных инфекций, включая септические тромбофлебиты, эндокардиты, инфекции крови, метастатические инфекции, развивающиеся в результате переноса инфекции гематогенным путем от места установки катетера к другим участкам тела и местные воспалительные изменения (нагноения в месте катетера). Инфекции, связанные с катетеризацией, в особенности, инфекции кровотока, повышают заболеваемость и смертность на 10-20%, удлиняют сроки госпитализации (в среднем на 7 дней) и увеличивают затраты на лечение.
При инфекциях, связанных с катетеризацией, наиболее частыми возбудителями являются коагулазонегативные стафилококки, в основном, Staphylococcus epidermidis, St. aureus, грибы рода Candida, а также грамотрицательные микроорганизмы, такие как Enterobacter, Acinetobakter, Serratia marcescens.
Факторы риска развития сепсиса, связанного с катетерами, могут быть обусловлены следующими обстоятельствами:
1. Материал, из которого изготовлен катетер: предпочтительным материалом является полиуретан.
2. Размер катетера: центральные катетеры с тремя отверстиями несут больший риск, по сравнению с одинарными.
3. Использование сосудов нижних конечностей опаснее из-за повышенного риска инфекции.
4. Техника введения катетеров: постановка катетеров должна проводиться в асептических условиях. Нарушение техники асептики при постановке катетера — неадекватная обработка рук, использование нестерильных перчаток, неправильная обработка кожи больного в месте катетеризации и др. — приводит к возникновению гнойных осложнений.
5. Длительность нахождения катетера в месте введения: чем дольше катетер находится в сосуде, тем вероятнее развитие инфузионных флебитов и других осложнений.
6. Состав вводимых жидкостей.
7. Частота смены перевязочного материала.
8. Опыт персонала, устанавливавшего катетер.
9. Подготовка кожи.
10. Индивидуальные особенности больного.
Факторы заражения внутрисосудистых устройств:
- руки медицинского персонала,
- микрофлора кожи больного,
- инфицирование поршня,
- обсеменение при введении катетера,
- обсеменение жидкостей.
Основным средством профилактики осложнений, связанных с катетеризацией, является ограничение использования внутрисосудистых катетеров: установку катетера следует назначать только в случае необходимости.
Показаниями для катетеризации центральных вен являются:
- отсутствие выраженных периферических вен;
- необходимость массивной инфузионной терапии;
- измерение центрально-венозного давления;
- проведение гемодиализа, гемосорбции, плазмофереза;
- внутрисердечное введение электродов.
Правила работы с подключичными катетерами.
- Соблюдение асептики при постановке катетера. Барьерные меры предосторожности (стерильный халат, перчатки, индивидуальный стерильный набор для подключичного катетера);
- Адекватная обработка кожи в месте установки катетера, использование кожных антисептиков (раствор АХД-2000, 70% спирт, иодонат);
- Ограничение манипуляций с катетером;
- Ежедневная смена лейкопластырной наклейки по специальному образцу;
- Ежедневная обработка кожи вокруг катетера 70% раствором спирта, водными или спиртовыми растворами хлоргексидина. Перед началом работы с катетером и по ее окончании производится промывание его просвета физиологическим раствором с гепарином; в катетере не должно быть крови. Раствор — гепариновый замок лучше вводить через прокол резиновой заглушки тонкой иглой. Катетер не должен перегибаться и скручиваться. Смена катетера производится 1 раз в 10 дней при отсутствии инфекции крови;
- При появлении признаков воспаления или инфекции крови катетер должен быть удален. При удалении катетера место пункции прижать шариком со спиртом и удерживать 10 минут, затем накладывается асептическая повязка. При замене катетера — смена места катетеризации.
- Обязательное микробиологическое исследование отделяемого из места воспаления;
- При отсутствии центральных венозных катетеров вливание растворов в периферические вены не должно производиться более 12 часов в связи с возможным развитием флебитов.
Особое внимание уделяется инфузионным растворам, при этом стерильные растворы должны быть фабричного изготовления или изготовлены в аптеке с соблюдением правил асептики. Для вскрытия флаконов с жидкостями необходимо использовать стерильный инструментарий. Флаконы с растворами используются строго индивидуально на каждое вливание, расфасовка растворов в аптеках больниц должна соответствовать количеству переливаемого раствора. Срок стерильности растворов, завальцованных в больничных аптеках, не более 30 дней.

Успех реанимации во многом зависит от времени, прошедшего с момента остановки кровообращения до начала реанимации.
Показанием к проведению реанимационных мероприятий является состояние клинической смерти. Среди основных причин клинической смерти, требующих проведения реанимации ведущими являются: внезапная остановка кровообращения, обтурация дыхательных путей, гиповентиляция, апноэ, кровопотеря и повреждение мозга. Клиническая смерть — это период между жизнью и смертью, когда нет видимых признаков жизни, но еще продолжаются жизненные процессы, дающие возможность оживления организма. Длительность этого периода при обычной температуре тела составляет 5 – 6 минут, после чего развиваются необратимые изменения в тканях организма. В особых условиях (гипотермия, фармакологическая защита) этот период продлевается до 15—16 минут.
Признаками клинической смерти являются:
1. Остановка кровообращения (отсутствие пульсации на магистральных артериях) ;
2. Отсутствие самостоятельного дыхания (нет экскурсий грудной клетки) ;
3. Отсутствие сознания;
4. Широкие зрачки;
5. Арефлексия (нет корнеального рефлекса и реакции зрачков на свет):
6. Вид трупа (бледность, акроцианоз).
При проведении реанимации выделяется 3 стадии и 9 этапов. Символичная аббревиатура реанимационных мероприятий – первые буквы английского алфавита – подчеркивает принципиальную важность методичного и последовательного выполнения всех этапов.
Стадия I — элементарное поддержание жизни. Состоит из трех этапов:
A (airway open) — восстановление проходимости дыхательных путей;
В (breath for victim) — экстренная искусственная вентиляция легких и оксигенация;
С (circulation his blood) — поддержание кровообращения.
Стадия II — дальнейшее поддержание жизни. Заключается в восстановлении самостоятельного кровообращения, нормализации и стабилизации показателей кровообращения и дыхания. Стадия II включает в себя три этапа:
D (drug) — медикаментозные средства и инфузионная терапия;
Е (ECG) — электрокардиоскопия и кардиография;
F (fibrillation) — дефибрилляция.
Стадия III — длительное поддержание жизни в постреанимационном периоде. Заключается в послереанимационной интенсивной терапии и включает этапы:
G (gauging) — оценка состояния;
Н (human mentation) восстановление сознания;
I — коррекция недостаточности функций органов.
В настоящем пособии мы подробно разберем лишь I стадию реанимационных мероприятий (А, В, С), оставив остальные стадии и этапы для подробного изучения на следующих курсах.
Итак, этап А – восстановление проходимости дыхательных путей. При возникновении неотложных состояний проходимость дыхательных путей часто нарушена из-за западения языка, который прикрывает вход в гортань и воздух не может попасть в легкие. Кроме того, у больного в бессознательном состоянии всегда существует опасность аспирации и закупорки дыхательных путей инородными телами и рвотными массами.
1) запрокидывание (гиперэкстензия) головы,
2) выдвижение нижней челюсти вперед,
3) открывание рта. Для этого II— V пальцами обеих рук захватывают восходящую ветвь нижней челюсти больного около ушной раковины и выдвигают ее с силой вперед (вверх), смещая нижнюю челюсть таким образом, чтобы нижние зубы выступали впереди верхних зубов. При этой манипуляции происходит растяжение передних мышц шеи, за счет чего корень языка приподнимается над задней стенкой глотки.
При обструкции дыхательных путей инородным телом пострадавшему следует придать положение лежа на боку и в межлопаточной области произвести 3—5 резких ударов нижней частью ладони. Пальцем очищают ротоглотку, пытаясь удалить инородное тело, затем делают попытку искусственного дыхания. Если нет эффекта, производят попытку восстановления дыхательных путей приемом Греймлиха – форсированным надавливанием на живот. При этом ладонь одной руки прикладывают к животу по средней линии между пупком и мечевидным отростком. Вторую руку кладут поверх первой и надавливают на живот быстрыми движениями вверх по средней линии. После обеспечения проходимости дыхательных путей приступают к следующему этапу реанимации.
Этап В – искусственное дыхание. Искусственное дыхание — это вдувание воздуха или обогащенной кислородом смеси в легкие пациента, выполняемое без или с применением специальных устройств, то есть временное замещение функции внешнего дыхания. Выдыхаемый человеком воздух содержит от 16 до 18% кислорода, что позволяет его использовать для искусственного дыхания при проведении реанимации. Следует отметить, что у больных с остановкой дыхания и сердечной деятельности происходит спадение легочной ткани, чему в значительной степени способствует проведение непрямого массажа сердца. Поэтому необходимо проводить при массаже сердца адекватную вентиляцию легких. Каждое вдувание должно занимать 1—2 секунды, поскольку при более длительном форсированном вдувании воздух может попасть в желудок. Вдувание надо производить резко и до тех пор, пока грудная клетка пациента не начнет заметно подниматься. Выдох у пострадавшего при этом происходит пассивно, благодаря создавшемуся повышенному давлению в легких, их эластичности и массе грудной клетки. Пассивный выдох должен быть полным. Частота дыхательных движений должна составлять 12—16 в минуту. Адекватность искусственного дыхания оценивается по периодическому расширению грудной клетки и пассивному выдыханию воздуха.
Вспомогательную вентиляцию используют на фоне сохраненного самостоятельного, но неадекватного дыхания у больного. Синхронно вдоху больного через 1—3 дыхательных движения производится дополнительное вдувание воздуха. Вдох должен быть плавным и по времени соответствовать вдоху больного. Надо отметить, что восстановление самостоятельного дыхания быстро восстанавливает все остальные функции. Это связано с тем, что дыхательный центр является водителем ритма для мозга.
Этап С – поддержание кровообращения. После остановки кровообращения в течение 20 – 30 минут в сердце сохранены функции автоматизма и проводимости, что позволяет восстановить его насосную функцию. Независимо от механизма остановки сердечной деятельности, немедленно должна быть начата сердечно-легочная реанимация для предупреждения развития необратимого поражения тканей организма (мозга, печени, сердца и др. ) и наступления биологической смерти. Основной целью массажа сердца является создание искусственного кровотока. Следует понимать, что сердечный выброс и кровоток, создаваемый наружным массажем сердца, составляет не более 30% от нормы и только 5% нормального мозгового кровотока. Но, как правило, этого бывает достаточно для поддержания жизнеспособности центральной нервной системы во время сердечно-легочной и церебральной реанимации при условии достижения достаточной оксигенации организма на протяжении нескольких десятков минут. На догоспитальном этапе применяют только непрямой, или закрытый, массаж сердца (т. е. без вскрытия грудной клетки). Резкое надавливание на грудину ведет к сжиманию сердца между позвоночником и грудиной, уменьшению его объема и выбросу крови в аорту и легочную артерию, т. е. является искусственной систолой. В момент прекращения давления грудная клетка расправляется, сердце принимает объем, соответствующий диастоле, и кровь из полых и легочных вен поступает в предсердия и желудочки сердца. Ритмичное чередование сжатий и расслаблений в какой-то мере заменяет работу сердца, т. е. выполняется один из видов искусственного кровообращения. Техника проведения непрямого массажа сердца состоит в следующем. Больного укладывают на твердую ровную горизонтальную поверхность на спину (рис. 50). Проведение непрямого массажа сердца на панцирной кровати не имеет смысла – больной должен быть уложен на пол. Проводящий массаж
располагается сбоку от больного и кладет свои ладони (одну на другую) на нижнюю треть грудины выше основания мечевидного отростка на 2 – 3 см.
Следует обращать внимание на то, что на грудине располагается не вся ладонь, а только ее проксимальная часть в непосредственной близости к запястью (рис. 51). Собственно непрямой массаж сердца заключается в ритмичном (80 в минуту) надавливании на грудину пациента. При этом грудина должна опускаться не менее чем на 5 – 6 см.
Следует обращать внимание на то, что для правильного выполнения массажа руки следует почти полностью распрямить в локтевых суставах и давление на грудину производить всей массой туловища. Во многих руководствах рекомендуется начинать непрямой массаж сердца однократным сильным ударом в грудину больного, поскольку часто причиной нарушения сократимости миокарда является фибрилляция и прекардиальный удар способен купировать аритмию.
Собственно последовательность действий при сердечно-легочной реанимации следующая. Вариант I – реанимация проводится одним человеком:
- если пострадавший без сознания, ему максимально запрокидывают голову, поддерживая подбородок, чтобы рот был слегка приоткрыт. В случае необходимости выдвигают нижнюю челюсть. При подозрении на повреждение шейного отдела позвоночника используют умеренное запрокидывание головы только для поддержания проходимости дыхательных путей. Проверяют наличие самостоятельного дыхания (прослушивание и ощущение потока воздуха у рта, носа пострадавшего, наблюдение за экскурсией грудной клетки) ;
- если пострадавший не дышит, производят два глубоких раздувания легких (грудная клетка должна подняться). Каждое раздувание производят сравнительно медленно с течение 1-2 сек, затем делают паузу для осуществления полного пассивного выдоха;
- прощупывают пульс на сонной артерии (5-10с). При наличии пульса продолжают вентиляцию с частотой около 12 раздуваний в 1 мин у взрослых (одно раздувание каждые 5 с), 15 вдуваний в 1 мин у детей (около 4 с) и 20 вдуваний в 1 мин (одно каждые 3 с) у младенцев;
- если пульс отсутствует, приступают к непрямому массажу сердца;
- осуществляют 15 сдавлений грудины с частотой 80-100 в 1 мин. После 15 сдавлений производят два раздувания легких и продолжают чередовать 15 надавливаний на грудину с двумя раздуваниями легких;
- грудину прижимают к позвоночнику примерно на 4-5 см у взрослых, 2, 5-4 см у детей младшего возраста и 1-2 см у младенцев. Через каждые 1-3 мин проверяют восстановление спонтанного пульса.
Вариант II – реанимацию проводят два человека:
Реанимирующим следует находится с противоположных сторон пострадавшего, чтобы легче меняться ролями, не прерывая реанимации.
- если пострадавший без сознания, реаниматор (производящий вентиляцию) запрокидывает ему голову;
- если пострадавший не дышит, первый реаниматор делает два глубоких раздувания легких;
- проверяет пульс на сонной артерии;
- если пульс отсутствует, второй реаниматор начинает сдавление грудины с частотой 80-100 в 1 мин, первый реаниматор, проводящий вентиляцию, делает одно глубокое раздувание легких после каждых 5 компрессий грудины; во время раздувания легких второй реаниматор делает кратковременную паузу;
- затем продолжают чередование 5 надавливаний на грудину с одним раздуванием легких до появления самостоятельного пульса.
Признаками эффективности проводимого массажа являются сужение ранее расширенных зрачков, исчезновение бледности и уменьшение цианоза, пульсация крупных артерий (прежде всего сонной) соответственно частоте массажа, появление самостоятельных дыхательных движений. Непрямой массаж сердца не прекращают на срок более 5 с, проводить его следует до момента восстановления самостоятельных сердечных сокращений, обеспечивающих достаточное кровообращение. Показателем этого будут определяемый на лучевых артериях пульс и повышение систолического АД до 80-90 мм. рт. ст. Отсутствие самостоятельной деятельности сердца при несомненных признаках эффективности проводимого массажа есть показание к продолжению реанимации. Проведение массажа сердца требует достаточной выносливости; желательна смена массирующего каждые 5-7 мин, проводимая быстро, без нарушения ритмичности массажа сердца.
Читайте также:

