Американское лекарство от туберкулеза
Обновлено: 28.04.2024
Согласно данным Всемирной Организации Здравоохранения (ВОЗ) заболеваемость туберкулезом в 2012 году составила 8.6 миллионов случаев с 1.3 миллионов летальных исходов. [1] Несмотря на то, что за последние 20 лет наблюдается небольшое снижение заболеваемости, на первый план выходит проблема мультирезистентного туберкулеза (лекарственная устойчивость как минимум к изониазиду и рифампицину). Так в 2012 году, было зафиксировано 450 000 случаев мультирезистентного туберкулеза, что представляет собой глобальную проблему здравоохранения. [1]
Лечение данной формы туберкулеза – сложный и очень долгий путь, требующий назначения старых препаратов, по большей части, бактериостатиков с большим спектром нежелательных лекарственных реакций. [2] В 2012 году широко лекарственно устойчивый туберкулез (дополнительная резистентность к инъекционной терапии второй линии и фторхинолонам) был диагностирован в 92 странах мира, и количество случаев составляет 9.6% всех пациентов с мультирезистентным туберкулезом. [1]
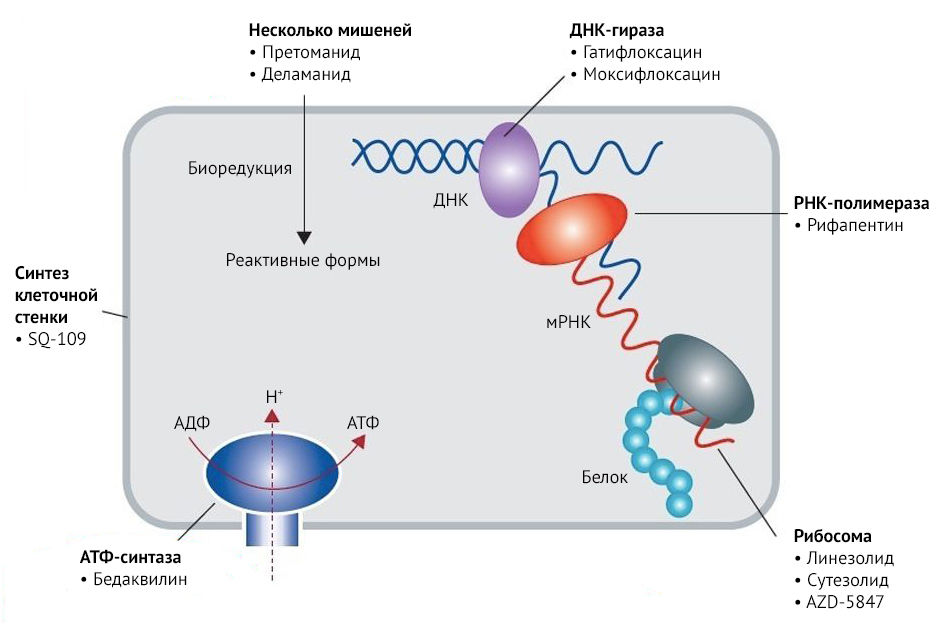
Бедаквилин (Сиртуро, TMC207) представляет собой диарилхинолин, который ингибирует микобактериальную АТФ-синтазу – фермент, играющий ключевую роль в процессе клеточного дыхания. [3] Это первый противотуберкулезный препарат с принципиально новым механизмом действия, который одобрен для лечения мультирезистентного туберкулеза за последние 40 лет.
Препарат уже доказал свою эффективность in vitro и на мышиных моделях, что позволило продолжить его исследования на пациентах.
Цель.
Оценить эффективность и безопасность бедаквилина в лечении мультирезистентного туберкулеза.
Материалы и методы.
В рандомизированное двойное слепое плацебо-контролируемое клиническое исследование TMC207-C208 были включены пациенты в возрасте от 18 до 65 лет с недавно диагностированным, активным (наличие возбудителя в мокроте), легочным, мультирезистентным туберкулезом. Критериями исключения являлись: предшествующее лечение по поводу мультирезистентного туберкулеза, положительный анализ на ВИЧ с количеством CD4+ лимфоцитов менее 300 на мл3, тяжелые внелегочные и неврологические проявления туберкулеза, тяжелая сердечная аритмия, требующая лекарственной терапии, указание в анамнезе на повышенный риск развития аритмий по типу torsades de pointes, злоупотребление алкоголем и наркотиками, беременность или грудное вскармливание и предшествующее применение бедаквилина. Также было запрещено использование моксифлоксацина, гатифлоксацина и системных ингибиторов цитохрома P-450 3A4 в период исследования и в течение 1 месяца после его завершения.
Исследование проводилось с включением пациентов из Бразилии, Индии, Латвии, Перу, Филиппин, России, ЮАР и Таиланда.
Пациенты были разделены на 2 группы: первая получала бедаквилин в дозе 400 мг 1 раз в день после завтрака в течение первых двух недель, затем по 200 мг 3 раза в неделю в течение 22 недель), вторая - плацебо + все пациенты получали 5-компонентную антитуберкулезную терапию второй линии (этионамид, пиразинамид, офлоксацин, канамицин и циклосерин). При этом внесение изменений в вышеописанную схему разрешалось при наличии данных о серьезных побочных эффектах, низкой чувствительности к препаратам и их отсутствию в стране.
После 24-недельного курса лечения бедаквилин пациенты получали еще в течение 96 недель базовую терапию. Те, кто был исключен из исследования из-за развития нежелательных лекарственных реакций, также продолжались наблюдаться.
Первичной конечной точкой исследования являлось время, необходимое для исчезновения возбудителя из мокроты, которое подтверждалось наличием двух отрицательных анализов мокроты с интервалом не менее 25 дней. Вторичной конечной точкой служило отсутствие микобактерии в культуре через 24 недели и через 120 недель.
Результаты.
В конечный анализ были включены 160 пациентов (64% мужчины): 79 получали бедаквилин и 81 – плацебо.
В первой группе среднее время до исчезновения возбудителя в мокроте было меньше, чем в группе плацебо - 83 дня по сравнению со 125 (HR=2.44, 95% CI, 1.57-3.80; P
14 августа 2019 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило новый препарат Претоманид для лечения лекарственно устойчивых форм туберкулеза (ТБ). Это лекарство следует применять в сочетании с уже имеющимися на рынке препаратами: Бедаквалином и Линезолидом. В 2012 году ТБ с широкой лекарственной устойчивостью (ШЛУ-ТБ) убивал примерно 3 из 4 больных. Это было до утверждения Бедаквалина. Лечение занимало 2 года и требовало болезненных ежедневных инъекций. В 2017 году исследователи впервые сообщили о предварительных результатах исследования, в котором они тестировали применение трех препаратов в таблетках. Курс лечения составил 6 месяцев. Однако некоторые эксперты по лечению ТБ всерьез обеспокоены одобрением FDA Претоманида, так как неясно, способствовал ли конкретно он достижению 89 % успеха в небольшом исследовании (107 человек) по лечению ТБ с применением комбинации из трех препаратов. Группа контроля проходила лечение по традиционной схеме. Другие комбинации препаратов, содержащих бедаквалин, имели аналогичный успех, что еще больше затрудняет оценку вклада Претоманида. Претоманид производится некоммерческой организацией TB Alliance в Нью-Йорке.
Известно, что ШЛУ-ТБ приводит к смерти более чем 70 % больных. Частота распространения ШЛУ-ТБ среди ВИЧ-инфицированных увеличивается в настоящее время. Современное лечение ТБ очень длительное и токсичное, из-за чего многие пациенты просто не могут его проходить. Недавнее небольшое исследование показывает, что есть более простая и безопасная схема лечения ТБ.
В исследовании, названном Nix-TB, участвовало 34 больных из Южной Африки с ШЛУ-ТБ. Лечение проводилось по новой схеме с использованием Бедаквалина, Претоманида и Линезолида. Бедаквалин появился на рынке в 2012 году, но мало использовался в лечении ТБ. Претоманид был на тот момент еще экспериментальным препаратом. Линезолид в основном используется для лечения кожных инфекций и пневмонии.
К сожалению, в самом начале исследования 4 человека умерли от распространенного ТБ.
.
В этом исследовании применялись препараты, которые ранее редко использовали при ТБ, что сводит к минимуму вероятность развития лекарственной устойчивости. Лекарства принимали в форме таблеток. Они также обладают токсичностью, однако ни один человек не вышел из исследования.
По словам Спигельмана, протокол Nix-TB предназначен для лечения ШЛУ-ТБ, но его можно использовать для лечения МЛУ-ТБ, если будущие исследования покажут, что более низкие и менее токсичные дозы Линезолида могут работать. Стоимость лечения остается еще одной большой загадкой. Например, компания Janssen Therapeutics из Титусвилла, штат Нью-Джерси, которая производит Бедаквилин, пообещала пожертвовать 30 000 доз бедным странам, которые также смогут купить этот препарат по цене 900 долларов за 6-месячный курс. Этот же курс продается за 30 000 долларов в странах с высоким уровнем дохода.
Несри Падаятчи, врач по борьбе с туберкулезом в Центре по исследованию СПИДа в Дурбане, Южная Африка, с энтузиазмом относится к новым результатам. Но она предупреждает, что, поскольку многие пациенты с МЛУ- ТБ и ШЛУ-ТБ коинфицированы ВИЧ, исследования должны тщательно оценить взаимодействие между антиретровирусными препаратами и новой комбинацией лекарств от туберкулеза.
Ключевые слова
Статья
Материалы и методы. Лечение проводилось в соответствии с действующими нормативными документами [3, 6]. Оценка динамики специфического процесса осуществлялась в сроки, регламентированные в законодательстве (исследование мокроты на наличие бактериовыделения методом бактериоскопии и посева, крови, мочи, рентгенологическое обследование).
Результаты.
Больной Т., 32 года, поступил на лечение в областной клинический противотуберкулезный диспансер (ОКПТД) г. Саратова 10 октября 2013 года.
На момент поступления больной предъявлял жалобы на кашель со слизисто-гнойной мокротой, умеренную слабость, одышку при физической нагрузке, потливость в ночное время.
Объективный статус при поступлении: Состояние относительно удовлетворительное. Пониженного питания. Выявлены увеличенные подмышечные лимфоузлы до 1 см. в диаметре, подвижные, безболезненные, не спаянные с окружающими тканями. Надключичные ямки выражены. Со стороны органов дыхания: перкуторно легочный звук с коробочным оттенком на верхушке правого легкого, аускультативно на верхушке правого легкого амфорическое дыхание, единичные среднепузырчатые влажные хрипы. ЧДД 20 в минуту. По остальным органам и системам без видимой патологии.
Рентгенологически: верхняя доля правого легкого инфильтрирована, уменьшена в объеме, междолевая плевра втянута, на фоне массивной инфильтрации в верхней доле правого легкого определяется каверна овальной формы 4,0×3,5 см, в нижележащей легочной ткани очаговые тени. Заключение: Фиброзно-кавернозный туберкулез правого легкого в фазе инфильтрации и обсеменения. Ателектаз верхней доли правого легкого.
В общем анализе крови: ускоренное СОЭ до 45 мм/час, остальные параметры в пределах нормы. Исследование ФВД: ДН1 по рестриктивному типу.
Учитывая данные анамнеза, объективного осмотра, инструментальных и лабораторных методов исследования поставлен диагноз: Фиброзно-кавернозный туберкулез правого легкого в фазе инфильтрации и обсеменения МБТ(+) МЛУ(HRS), ателектаз верхней доли правого легкого. В соответствии с современными подходами назначено лечение по 4 режиму химиотерапии: Z, E, протионамид (Pt), левофлоксацин (Lfx), аминосалициловая кислота (PAS), капреомицин (Cm).
Учитывая неуклонное прогрессирование туберкулеза, сохранение бактериовыделения в мокроте всеми методами, ШЛУ МБТ (HRSКOflCapE) к лечению было решено добавить препараты 3 ряда. Таким образом, терапия проводилась следующим набором лекарственных средств: ZPtLfxPas, бедаквилин (Bq) 400 мг 1 р/сут первые 14 дней, затем по 200 мг 3 р/нед per os +кларитромицин (Clr) 500 мг 1 р/сут per os.
На фоне изменения схемы ХТ в течении месяца наблюдалось клиническое улучшение состояния: значительное уменьшение симптомов интоксикации, кашля, повышение аппетита, улучшение самочувствия. В июле впервые за несколько месяцев методом микроскопии получен отрицательный результат исследования мокроты на МБТ, которое в последующем подтверждено многократным исследованием мокроты методом Циля-Нельсена. В общем анализе крови СОЭ снизилось с 26 до 15 мм/час, лейкоцитоз с 11,7 до 7,8×10 9 /л. Произошло восстановление функции внешнего дыхания по данным спирографии (Табл.).
При проведении рентгенологического обследования в августе 2014 г. через 2 месяца лечения Бедаквилином зафиксировано значительное уменьшение инфильтрации и полостей распада в S1,2,6 правого легкого в 2 раза.
Переносимость препаратов в схеме лечения с Бедаквилином – удовлетворительная. Для динамического контроля за интервалом QT больному выполнено ЭКГ-исследование на момент поступления, через 2, 4, 8 недель от начала лечения. Отклонений не выявлено.
В связи со стабилизацией туберкулезного процесса больной с диагнозом: Фиброзно – кавернозный туберкулез правого легкого МБТ(+) ШЛУ(H,S,K,R,Ofl,Cap,E), фиброателектаз верхней доли правого легкого был направлен на хирургическое лечение в клиническую больницу фтизиопульмонологии ММА им. И.М. Сеченова, где 19.09.14 г. выполнена операция: видеоассистированная (ВАТС) верхняя лобэктомия с резекцией S6,10 правого легкого. Гистологически: фиброзно-кавернозный туберкулез правого легкого. 10.10.14 выполнена ВАТС 3-х реберная торакопластика справа.
В настоящее время больной получает терапию в условиях санатория. Клинико-рентгенологическая картина стабильна на протяжении 4 месяцев.
Заключение.
Литература
1. Нечаева О.Б., Скачкова Е.И., Кучерявая Д.А. Мониторинг туберкулеза в Российской Федерации// Туберкулез и болезни легких. - 2013. - №12. – С. 40-49.
5. Туберкулез в Российской Федерации 2011 г. Аналитический обзор статистических показателей, используемых в Российской Федерации и в мире. – М., 2013. – 280 с.
Таблицы
Функциональные показатели,
ед. измерения.
Октябрь 2013 г.
Декабрь 2013 г.
Февраль 2014 г.
Апрель 2014 г.
Июнь 2014 г. (в схему ХТ добавлен бедаквилин)
Август 2014 г. (через 2 мес. ХТ с бедаквилином)
Поражения печени (15-20%) у больных туберкулезом свидетельствуют о высокой частоте патологии печени при туберкулезе, обусловленной различными факторами (воздействием туберкулезной интоксикации, длительным приемом гепатотоксичных туберкулостатических препаратов, хроническим алкоголизмом, употреблением наркотиков, наличием сопутствующих заболеваний, в том числе и вирусных гепатитов). Печень представляет собой центральную лабораторию химического гомеостаза организма, где создается единый обменный и энергетический комплекс для метаболизма белков, жиров и углеводов.
Ключевые слова
Статья
Туберкулез - глобальная медицинская и социальная проблема во многих странах мира. Пациенты с ранее существовавшим заболеванием печени имеют повышенный риск развития лекарственного поражения печени (ЛПП) при противотуберкулезной терапии. Алкоголизм и алкогольная болезнь печени являются независимыми факторами, связанными с повреждением
печени при применении большинства противотуберкулезных препаратов (ПТП), в том числе из-за снижения уровня глутатиона в плазме и печени [2]. Вирусные гепатиты В и С также в значительной степени способствуют повышению ЛПП при применении ПТП [7]. По данным А. А. Возненко среди больных туберкулезом органов дыхания с сопутствующим хроническим вирусным гепатитом В отмечается высокая распространённость ЛПП–до 80,8% [10].
участвующих в биотрансформации рассматриваемого вещества. При первом воздействии возникает патологическая реакция, также возможна зависимость от дозы препарата. Большинство противотуберкулезных препаратов являются липофильными, и для их устранения требуется биотрансформация в более водорастворимые соединения в фазах I и II, обычно осуществляемая цитохромом P450 (CYP450). Транспортные молекулы (P-гликопротеин) и ядерные рецепторы (рецептор прегнана X) также могут играть важную роль в выведении лекарств и их метаболитов [7]. Следует отметить, что патогенетические механизмы ЛПП чрезвычайно многообразны и включают активацию перекисного окисления липидов, генерацию активных форм кислорода, истощение антиоксидантных систем гепатоцитов, митохондриальную дисфункцию, активацию различных факторов врожденного и адаптивного иммунитета, нарушение регуляции апоптоза, некроза гепатоцитов и аутофагии [8]. Развитие гепатотоксических реакций возможно при применении любых противотуберкулезных препаратов, чаще всего ЛПП ассоциируется с применением изониазида, рифампицина, пиразинамида, этамбутола, протионамида и этионамида, наиболее характерные особенности которых приведены ниже.
и генетические факторы (полиморфизм NAT-2) [18, 26]. Кроме того, токсичные метаболиты изониазида ковалентно связываются с биологическими макромолекулами. Экспериментальные исследования указывают на усиление перекисного окисления липидов, снижение уровня антиоксидантов (каталазы, супероксиддисмутазы, глутатионпероксидазы, глутатионредуктазы и др.) в тканях печени. Кроме того, высокие дозы изониазида могут вызвать периферическую полинейропатию, для которой необходим пиридоксин.
Пиразинамид (PZA) - препарат метаболизируется в печени, его метаболитами являются пиразиновая кислота и 5-гидроксипиразиновая кислота (5-OHPA), с которыми связывают гепатотоксические эффекты данного лекарственного средства. Комбинированное лечение
туберкулеза с пиразинамидом обычно связано с умеренным и бессимптомным повышением уровня аминотрансферазы в сыворотке крови. Поскольку пиразинамид используется только в сочетании с другими противотуберкулезными препаратами, его вклад в повышение уровня ферментов в сыворотке не совсем ясен, но часто именно этот препарат обвиняют в развитии ЛПП [6]. Описаны случаи развития фульминантной печеночной недостаточности при назначении рифампицина и пиразинамида, потребовавшие трансплантации печени [3]. Начало ЛПП, вызванное пиразинамидом, обычно происходит через 4-8 недель и иногда становится очевидным только после отмены пиразинамида. Как правило, наблюдается гепатоцеллюлярный тип гепатотоксичности, а клиническая картина напоминает острый вирусный гепатит. Проявления гиперчувствительности (сыпь, лихорадка и эозинофилия) редки, как и образование аутоантител [6].
Тиоамиды (протионамид, этионамид) - препараты данной группы вызывают лекарственные поражения печени менее чем в 5% случаев, однако в комбинации с пиразинамидом риск развития гепатотоксических эффектов увеличивается в несколько раз, особенно при длительном применении у пациентов с заболеваниями печени в анамнезе [7]. С меньшей частотой описаны случаи ЛПП и при применении других лекарственных средств, используемых во фтизиатрии: парааминосалициловой кислоты, аминогликозидов, фторхинолонов, циклосерина и др. [7]
Диагностика ЛПП в любой клинической ситуации основывается на хорошо известных принципах: тщательный сбор анамнеза, включая информацию о дозировке, продолжительности и факте повторного приема препарата; исключение других заболеваний печени и патологических состояний, требующих применения комплекса всех лабораторных и инструментальных методов диагностики [9]. В этом случае всегда стоит помнить о возможности наложения действия препарата на ранее существовавшее заболевание печени, что требует необходимого исследования для уточнения диагноза для всех пациентов перед
Показано, что включение этого препарата в комплексное лечение больных инфильтрирующим туберкулезом легких в дезинтегрирующей фазе повышает эффективность лечения, что приводит к снижению гепатотоксичности этиотропных препаратов, уменьшению выраженности диспротеинемии, ускорение регресса разрушения туберкулезных инфильтратов с последующим уменьшением потребности в фтизиохирургической помощи [6].
Таким образом, гепатотоксичность лекарств - актуальная проблема современной фтизиатрии. При длительном применении противотуберкулезных препаратов ЛПП возникает с высокой частотой, может иметь тяжелое течение и влиять на эффективность лечения туберкулеза. При химиотерапии туберкулеза рекомендуется экспресс-диагностика заболевания печени, определение факторов риска гепатотоксичности и мониторинг клинических и лабораторных показателей. Текущий опыт использования различных гепатопротекторов открывает широкие перспективы для дальнейшего изучения их эффективности у больных туберкулезом
Литература
1. Васильева И.А., Белиловский Е. М., Борисов С. Е., Стерликов С. А. Глобальные отчеты всемирной организации здравоохранения по туберкулезу: формирование и интерпретация // Туберкулез и болезни легких. – 2017. – № 5.– С. 7–16.
2. Шилова, М. В. Туберкулез в России в 2016 г./ М. В. Шилова.– Воронеж, 2016. – 108с.
3. Здравоохранение в России. 2017: Стат. сб./Росстат.– М., 2017. – 170 с.
4. Нечаева О. Б. Эпидемическая ситуация по туберкулезу среди лиц с ВИЧ- инфекцией в Российской Федерации // Туберкулез и болезни легких. – 2017. – № 3.– С. 13–19.
6. Сухова Е.В., Барсукова В. Н., Сухов В. М., Зайнуллин Н. Р. Факторы, снижающие дисциплину лечения у больных туберкулезом легких, и возможности повышения мотивации к лечению // Пульмонология. –2007. – № 2.– С. 50–55.
7. Баласанянц Г.С., Суханов Д. С. Побочные действия противотуберкулезных препаратов и методы их устранения: учебное пособие// Санкт-Петербург: Тактик-Студио, 2015. – 86с.
8. Мордык А.В., Кондря А. В., Гапоненко Г. Е. Частота неблагоприятных побочных реакций на противотуберкулезные препараты у впервые выявленных больных туберкулезом органов
дыхания старше 18 лет и факторы, влияющие на их развитие // Туберкулез и болезни легких. – 2010.
9. Иванова Д.А., Борисов С. Е., Рыжов А. М. и соавт. Частота и риск развития тяжелых нежелательных реакций при лечении впервые выявленных больных туберкулезом // Туберкулез и болезни легких. – 2012. – № 12.– С. 15–22.
10. Возненко A.A., Аксёнова В. А., Одинец B. C. Опыт применения Урсосана в качестве гепатопротекторного средства у больных туберкулёзом органов дыхания. // Клинические перспективы гастроэнтерологии, гепатологии. – 2011. – № 5.– С. 26–32.
Туберкулез представляет собой заболевание, вызванное микобактериями, наиболее часто поражающее легкие в виде инфильтративных или деструктивных изменений паренхимы или бронхов; встречаются и внелегочные формы туберкулеза – туберкулез костей, кишечника и др. Заболевание это крайне распространено и остается одной из главных причин смерти в мире. По оценкам Всемирной Организации Здравоохранения в 2012 году отмечено 8,6 миллионов новых случаев заражения туберкулезом и 1,3 миллиона смертей. обусловленных этим заболеванием. При этом у 450 000 больных выявлены микобактерии туберкулеза, характеризующиеся мультирезистентностью, то есть устойчивостью к двум и более медикаментам, применяющихся в лечении этой патологии; чаще это изониазид и рифампицин. Появляются формы, устойчивые и к фторхинолонам и второй линии терапии. Несмотря на то, что в прошлые десятилетия отмечался значительный прогресс в диагностике туберкулеза и появлении новых средств для его лечения, многие медикаменты не прошли последние стадии клинических испытаний, а создание заявленной как важнейшее средство профилактики новой вакцины потерпело неудачу.
В начале 2014 года в журнале Lancet Respiratory Medicine прозвучало предложение о лечении больных с резистентными формами туберкулеза собственными стволовыми клетками пациента в дополнение к антибиотикотерапии. R. J.Wilkinson et al. из Императорского Колледжа Лондона, Великобритания, совместно с A. Skrahin et al. из Республиканского исследовательского центра пульмонологии и туберкулеза, Минск, Беларусь представили результаты первой фазы клинических испытаний стволовых клеток в лечении туберкулеза, согласно которым исходы заболевания улучшались.
В открытом исследовании указанная группа ученых в течение 4 недель проводила инфузии 30 пациентам в возрасте от 21 до 65 лет, страдающим мультирезистентным туберкулезом легких, примерно 10 миллионов их собственных мезенхимальных стволовых клеток, забранных из костного мозга и размноженных in vitro. Пациенты с сопутствующим гепатитом В или С, а также с ВИЧ-инфекцией исключались из исследования.
Сначала у больных наблюдалось ухудшение течения туберкулеза. Данное явление отмечалось в пределах первых шести месяцев. Затем иммунная система демонстрировала улучшенный ответ на инфекцию. В итоге, среди всех участников, 16 больных из 30 продемонстрировали отсутствие клинических и лабораторных следов туберкулезной инфекции через 18 месяцев от начала терапии стволовыми клетками. В сравнение, лишь у 5 из 30 больных, получавших стандартное лечение, то есть лишь антибиотикотерапии, обнаруживался такой же результат. Побочными эффектами добавления к обычной терапии стволовых клеток были повышение уровня холестерина сыворотки крови (14 из 30 больных), тошнота (11 больных), лимфопения (10 больных) и диарея (10 больных). Снижение иммунной функции у них не отмечалось.
Robert J. Wilkinson et al. Host-directed therapies against tuberculosis. The Lancet Respiratory Medicine. S2213-2600(13)
Читайте также:

