Анаэробная инфекция после кесарева
Обновлено: 18.04.2024
Несмотря на внедрение в акушерскую практику современных методов диагностики, профилактики и терапии послеродовых заболеваний, отчетливой тенденции к снижению их частоты не наблюдается.
Это связано с рядом факторов, составляющих особенности современной медицины и расширяющих пути инфицирования беременных и родильниц: широкое использование современных инвазивных методов диагностики и терапии, значительное увеличение частоты оперативных вмешательств при родоразрешении, нерациональное применение антибактериальных препаратов, приводящее к накоплению в клиниках антибиотикорезистентных видов и штаммов микроорганизмов, применение лекарственных препаратов, в том числе кортикостероидов, обладающих иммунодепрессивным действием и т.д.
Кроме того, изменился контингент беременных и родильниц – преобладают пациентки с экстрагенитальными заболеваниями, с различными формами бесплодия, после гормональной и/или хирургической коррекции невынашивания беременности, со смешанной вирусно–бактериальной инфекцией, относящиеся к группе высокого риска инфекционных осложнений. Также отмечается высокий уровень урогенитальных инфекций, что может привести к серьезным проблемам во время беременности и в послеродовом периоде, а также внутриутробному инфицированию плода и новорожденного.
Одной из наиболее распространенных форм гнойно–воспалительных заболеваний пуэрперия является послеродовой эндометрит. Частота его после самопроизвольных родов составляет 3–5%, после кесарева сечения – свыше 10–20%. Из 100 послеродовых эндометритов 80 сопряжены с операцией кесарева сечения.
Изучение клинических особенностей, этиологии, патогенеза эндометрита после родов и кесарева сечения, разработка методов его диагностики и адекватной терапии имеют большое значение, так как эндометрит является начальным локализованным проявлением динамически развивающегося септического процесса. Запоздалая его диагностика и нерациональное лечение могут привести к дальнейшему распространению инфекции, вплоть до возникновения ее генерализованных форм. В ряде случаев послеродовой эндометрит имеет стертое или бессимптомное течение. В этих случаях прогрессирование воспалительного процесса в матке может наступить после выписки родильницы из стационара.
Эндометрит – полимикробное заболевание, которое может быть вызвано условно–патогенными бактериями, микоплазмами, хламидиями, вирусами и т.д. Основными возбудителями эндометрита после самопроизвольных родов и кесарева сечения являются условно–патогенные аэробные и анаэробные бактерии, составляющие нормальную (индигенную) микрофлору нижних половых путей женщины. В современных условиях ведущее место в этиологии заболевания принадлежит смешанной вирусно–бактериальной инфекции.
Основными путями распространения инфекции при эндометрите являются: а) восходящий, что связано с повышающейся ролью в этиологии гнойно–воспалительных заболеваний условно–патогенных микроорганизмов, обитающих во влагалище беременной женщины; б) гематогенный; в) лимфогенный; г) интраамниальный, связанный с внедрением в акушерскую практику инвазивных методов исследования (амниоскопия, амниоцентез, кордоцентез, редукция эмбрионов при многоплодной беременности и др.).
Существенная роль в возникновении и течении инфекционного процесса в послеродовом периоде принадлежит защитным механизмам и, в частности, состоянию иммунитета. Установлено, что даже у здоровых женщин во время беременности и в ранние сроки послеродового периода наблюдается транзиторный частичный иммунодефицит. Отмечается угнетение Т–клеточного (Т–лимфоцитопения, снижение пролиферативной активности лимфоцитов, повышение активности Т–супрессоров) и гуморальных звеньев иммунитета.
По своей сути эндометрит – это проявление раневой инфекции. Внутренняя поверхность матки после отделения последа представляет собой обширную рану, заживление которой протекает согласно общебиологическим законам заживления любой раны. При этом на первом этапе происходит очищение внутренней поверхности матки через воспаление (I фаза раневого процесса) с последующей эпителизацией и регенерацией эндометрия (II фаза раневого процесса). Различают три клинические формы эндометрита (легкую, средней тяжести и тяжелую), отличающиеся друг от друга выраженностью отдельных симптомов (лихорадка, интоксикация, локальные проявления), изменениями лабораторных показателей, продолжительностью заболевания.
Основными компонентами лечения эндометрита являются антибактериальная, инфузионная, десенсибилизирующая, утеротоническая, местная, при необходимости – антикоагулянтная, гормональная, иммуностимулирующая терапия, а также немедикаментозные методы.
Для общего лечения следует применять антибиотики или их комбинации, действующие на аэробные и анаэробные бактерии. Выбор препаратов необходимо проводить на основании определения чувствительности возбудителей, фармакокинетики антибиотиков с учетом их побочного действия на организм. Длительность терапии определяется тяжестью клинического течения заболевания и продолжается до стойкого закрепления терапевтического эффекта. Так как микробиологическое исследование содержимого полости матки продолжается 3–7 дней, то при выборе антибиотика можно руководствоваться существующими данными о возбудителях и их чувствительности к антибиотикам.
Принципиальным в лечении послеродового эндометрита является применение комбинации антибактериальных препаратов, действующих на аэробную и анаэробную микрофлору. При легкой или средне–тяжелой степени антибактериальное лечение в ряде случаев может быть ограничено монотерапией. Целесообразно назначать внутривенно препараты, обладающие широким спектром действия: цефалоспорины или полусинтетические пенициллины широкого спектра действия. При тяжелой форме эндометрита, особенно после кесарева сечения, необходимо чаще всего проводить комбинированную терапию с учетом воздействия на аэробную и анаэробную микрофлору.
Наиболее рациональные комбинации препаратов:
2. Метрогил по 500 мг каждые 12 часов внутривенно + гентамицин по 1,5 мг/кг каждые 12 часов внутримышечно + цефалоспорины II–III поколений по 1–2 г через 8–12 часов внутривенно.
3. Метрогил по 500 мг каждые 12 часов внутривенно + ампициллин по 2 г через 6 часов внутримышечно + гентамицин по 1,5 мг/кг каждые 12 часов внутримышечно.
Также применяются линкомицин (по 600 мг каждые 8 часов в/м) или клиндамицин (по 600 мг каждые 8 часов внутривенно) в комбинации с гентамицином или цефалоспоринами II–III поколений.
Выбор той или иной комбинации препаратов определяется тяжестью течения заболевания и спектром возбудителей.
Указанные выше комбинации антибактериальных препаратов целесообразно применять и при других клинических формах заболевания с соответствующей коррекцией способа введения и суточной дозы. Эффективны при лечении тяжелой формы эндометрита и цефалоспорины III поколения – цефтазидим, цефтриаксон, цефоперазон и др., а также имипенем/циластатин и меропенем, обладающие сверхшироким спектром антимикробного действия. Использование этих препаратов позволяет проводить полноценную монотерапию, заменяющую комбинированное лечение.
При адекватной антибактериальной терапии эндометрита после родов или кесарева сечения примерно у 90% больных температура нормализуется в течение 48–72 часов. Длительность лечения определяется тяжестью клинического течения заболевания и продолжается до стойкого закрепления терапевтического эффекта.
С профилактической целью антибактериальные препараты целесообразно использовать у женщин с высоким риском развития гнойно–воспалительных заболеваний после кесарева сечения.
Практически все препараты, которые применяются для лечения эндометрита, могут быть рекомендованы и для профилактики инфекционных осложнений после кесарева сечения. Наиболее обоснованно применение с профилактической целью при абдоминальном родоразрешении метрогила, цефалоспоринов II–III поколений, пенициллина с ингибиторами бета–лактамаз, имипенема/циластатина внутривенно трижды (после пережатия пуповины, через 12 и 24 часа после операции).
В зависимости от степени риска инфекционных осложнений после операции кесарева сечения целесообразно проводить антибиотикопрофилактику следующим образом.
I. Низкий или умеренный риск послеоперационных осложнений:
метрогил внутривенно капельно + 1 доза цефалоспоринов I–II поколения (внутривенно после пережатия пуповины);
1 доза а) амоксициллин/клавуланат; б) ампициллин/сульбактам.
II. Высокий риск инфекционных осложнений:
метрогил внутривенно капельно + 1 доза цефалоспоринов I–II поколения;
1 доза амоксициллина/клавуланата, ампициллина/сульбактама, имипенема/циластатина.
III. Наличие инфекции во время операции:
метрогил внутривенно капельно + цефалоспорины II–III поколения по 1 дозе 3 раза в сутки с интервалом 8 часов;
по 1 дозе 3 раза в сутки: амоксициллин/клавуланат, ампициллин/сульбактам, имипенем/циластатин.
Выбор указанных антибактериальных препаратов для профилактики инфекционных осложнений после кесарева сечения представляется оптимальным, поскольку они эффективны против аэробных и анаэробных бактерий, имеют бактерицидный тип действия, хорошо диффундируют в ткани, не вызывают серьезных побочных осложнений.
Помимо антибактериальных препаратов, терапия эндометрита включает комплекс других лечебных мероприятий: инфузионные среды, антикоагулянты, утеротонические и десенсибилизирующие средства, иммунокорригирующие препараты. Для инфузионной терапии используются следующие жидкости: 1) плазмозаменители (реополиглюкин, полиглюкин, гемодез и др.); 2) белковые препараты (альбумин, желатиноль, протеин и др.); 3) солевые растворы (дисоль, хлосоль, трисоль, физиологический раствор и др.). Целесообразно использовать озонированные инфузионные среды (физиологический раствор).
Для улучшения сократительной активности матки показано применение утеротонических средств – окситоцин по 5 ЕД 2 раза в сутки после предварительного введения 2 мл Но–шпы. Это способствует улучшению оттока лохий, сокращению площади раневой поверхности и уменьшению всасывания продуктов распада при воспалительном процессе в полости матки. Кроме медикаментозных средств, для улучшения сократительной активности матки в послеродовом периоде могут быть использованы физические методы. Из иммунокорригирующих препаратов при смешанной вирусно–бактериальной инфекции целесообразно применять интерфероновые препараты – кипферон или виферон, а также инфузии нормального человеческого иммуноглобулина по 25 мл внутривенно капельно через день 3 раза. Всем родильницам со смешанной вирусно–бактериальной инфекцией показана терапия, направленная на коррекцию энергетического обмена, путем проведения курсов метаболической терапии на протяжении стационарного лечения и в течение трех последующих месяцев. При обострении сопутствующей вирусной инфекции показана противовирусная терапия.
В комплексной терапии эндометрита одно из ведущих мест принадлежит местной терапии. По показаниям необходимо производить вакуум–аспирацию содержимого полости матки для удаления некротических тканей. Эту манипуляцию необходимо проводить и в тех случаях, когда по данным ультразвукового исследования отсутствуют патологические включения в полости матки, но содержание продуктов деструкции тканей в лохиях превышает верхнюю границу доверительного интервала нормы. Местная терапия эндометрита значительно снижает уровень бактериальной обсемененности внутренней поверхности матки. Вследствие удаления нежизнеспособных тканей достоверно снижается уровень продуктов деструкции тканей в лохиях и крови. При цитологическом исследовании метроаспирата через 2–3 дня от начала лечения отмечается уменьшение количества нейтрофилов, увеличение числа лимфоцитов, фибробластов и макрофагов, что свидетельствует о значительном ускорении процесса очищения внутренней поверхности матки.
При тяжелых формах эндометрита рекомендуется применение эфферентных методов лечения: плазмаферез, лазерное облучение крови. С помощью этих методов достигается детоксикация, реологическая и иммунокоррекция. Происходит экстракорпоральная элиминация токсических субстанций, антигенов, снижение вязкости крови, улучшение микроциркуляции, нормализация измененного тканевого метаболизма. Дополнительные эффекты обусловлены искусственной управляемой гемодилюцией путем введения инфузионных медикаментозных средств направленного действия.
Таким образом, проведение профилактики и комплексного, своевременного лечения гнойно–воспалительных заболеваний пуэрперия способствует значительному уменьшению частоты тяжелых форм послеродовой инфекции.
Послеродовые инфекции – группа заболеваний инфекционной этиологии, развивающихся в течение 6-ти недель после родов и непосредственно связанных с ними. Включают в себя локальные раневые инфекции, инфекции органов малого таза, генерализованные септические инфекции. В диагностике послеродовых инфекций первостепенное значение имеет время их развития и связь с родами, картина периферической крови, данные гинекологического осмотра, УЗИ, бактериологического исследования. Лечение послеродовых инфекций включает антибиотикотерапию, иммуностимулирующую и инфузионную терапию, экстракорпоральную детоксикацию, санацию первичного очага и др.
Общие сведения
Послеродовые (пуэрперальные) инфекции - гнойно-воспалительные заболевания, патогенетически обусловленные беременностью и родами. Включают в себя раневые инфекции (послеродовые язвы, эндометрит), инфекции, ограниченные полостью малого таза (метрит, параметрит, сальпингоофорит, пельвиоперитонит, метротромбофлебит и др.), разлитые инфекции (перитонит, прогрессирующий тромбофлебит) и генерализованные инфекции (септический шок, сепсис). Временные рамки, в течение которых могут развиваться данные осложнения - от момента выделения последа до окончания шестой недели послеродового периода. Пуэрперальные заболевания инфекционной этиологии встречаются у 2-10% родильниц. Септические осложнения играют ведущую роль в структуре материнской смертности, что ставит их в ряд приоритетных проблем акушерства и гинекологии.

Причины послеродовых инфекций
Этиологическая структура послеродовых инфекций весьма динамична и вариабельна. Из условно-патогенных микроорганизмов преобладают аэробные бактерии (энтерококки, кишечная палочка, стафилококки, стрептококки группы В, клебсиелла, протей), однако довольно часто встречаются и анаэробы (фузобактерии, бактероиды, пептострептококки, пептококки). Велика значимость специфических возбудителей - хламидий, микоплазм, грибов, гонококков, трихомонад. Особенностью послеродовых инфекций является их полиэтиологичность: более чем в 80% наблюдений высеваются микробные ассоциации, которые обладают большей патогенностью и устойчивостью к антибиотикотерапии.
Риск развития послеродовых инфекций существенно повышен у женщин с патологией беременности (анемия, токсикоз) и родов (раннее отхождение вод, слабая родовая деятельность, пролонгированные роды, кровотечение, задержка частей плаценты, лохиометра и др.), экстрагенитальной патологией (туберкулез, ожирение, сахарный диабет). Эндогенными факторами, предрасполагающими к микробному обсеменению родовых путей, могут служить вульвовагиниты, кольпиты, цервициты, пиелонефрит, тонзиллит, синуситы у родильницы. При инфицировании высоковирулентной флорой либо значительном снижении иммунных механизмов у родильницы инфекция может распространяться за пределы первичного очага гематогенным, лимфогенным, интраканаликулярным, периневральным путем.
Классификация послеродовых инфекций
На основании анатомо-топографического и клинического подхода выделяют 4 этапа прогрессирования послеродовой инфекции (авторы - С. В. Сазонова, А. В. Бартельс).
- 1-й этап – местная инфекция, не распространяющаяся за область раневой поверхности (послеродовая язва промежности, влагалища и стенки матки, нагноение швов, нагноение гематом, послеродовой эндометрит)
- 2-й этап – послеродовая инфекция, выходящая за границы раневой поверхности, но ограниченная полостью малого таза (метроэндометрит, аднексит, параметрит, метротромбофлебит, ограниченный тазовый тромбофлебит, пельвиоперитонит)
- 3-й этап – разлитая послеродовая инфекция (перитонит, прогрессирующий тромбофлебит)
- 4-й этап – генерализованная септическая инфекция (сепсис, инфекционно-токсический шок).
В качестве отдельной формы послеродовой инфекции выделяют лактационный мастит. Тяжесть инфекционных осложнений после родов зависит от вирулентности микрофлоры и реактивности макроорганизма, поэтому течение заболеваний варьирует от легких и стертых форм до тяжелых и летальных случаев.
Симптомы послеродовых инфекций
Послеродовая язва образуется в результате инфицирования ссадин, трещин и разрывов кожи промежности, слизистой влагалища и шейки матки. В клинической картине данного послеродового осложнения преобладают местные симптомы, общее состояние обычно не нарушается, температура не превышает субфебрильных цифр. Родильница жалуется на боли в области швов, иногда зуд и дизурические явления. При осмотре родовых путей обнаруживается язва с четкими границами, локальный отек и воспалительная гиперемия. На дне язвы определяется серовато-желтый налет, участки некроза, слизисто-гнойное отделяемое. Язвенный дефект легко кровоточит при контакте.
Послеродовой параметрит развивается на 10–12 день при переходе инфекции на параметрий - околоматочную клетчатку. Типичная клиника включает озноб, фебрильную лихорадку, которая длится 7-10 дней, интоксикацию. Родильницу беспокоят боли в подвздошной области на стороне воспаления, которые постепенно нарастают, иррадиируют в поясницу и крестец. Через несколько дней от начала послеродовой инфекции в области боковой поверхности матки пальпируется болезненный инфильтрат сначала мягковатой, а затем плотной консистенции, спаянный с маткой. Исходами послеродового параметрита может быть рассасывание инфильтрата или его нагноение с формированием абсцесса. Самопроизвольное вскрытие гнойника может произойти во влагалище, мочевой пузырь, матку, прямую кишку, брюшную полость.
Послеродовые тромбофлебиты могут затрагивать поверхностные и глубокие вены. В последнем случае возможно развитие метротромбофлебита, тромбофлебита вен нижних конечностей и вен таза. Обычно проявляются в течение 2-3 недель после родов. Клиническими предвестниками послеродовых осложнений данного типа служат длительная лихорадка; стойкое ступенеобразное учащение пульса; боли в ногах при движении и надавливании на мягкие ткани; отеки в области лодыжек, голени или бедра; цианоз нижних конечностей. На развитие метротромбофлебита указывает тахикардия до 100 уд./мин., субинволюция матки, длительные кровяные выделения, пальпация болезненных тяжей по боковым поверхностям матки. Тромбофлебит вен таза опасен развитием илеофеморального венозного тромбоза и тромбоэмболии легочной артерии.
Послеродовой пельвиоперитонит, или воспаление брюшины малого таза, развивается на 3-4 день после родов. Манифестация острая: температура тела быстро нарастает до 39-40°С, появляются резкие боли внизу живота. Может возникать рвота, метеоризм, болезненная дефекация. Передняя брюшная стенка напряжена, матка увеличена. Послеродовая инфекция разрешается рассасыванием инфильтрата в малом тазу или образованием абсцесса дугласова пространства.
Диагностика послеродовых инфекций
Факторами, указывающими на развитие послеродовых инфекций, служат признаки инфекционно-гнойного воспаления в области родовой раны или органов малого таза, а также общие септические реакции, возникшие в ранний период после родов (до 6-8 недель). Такие осложнения, как послеродовая язва, нагноение швов или гематомы диагностируются на основании визуального осмотра родовых путей. Заподозрить послеродовые инфекции органов малого таза гинекологу позволяет влагалищное исследование. В этих случаях обычно обнаруживается замедленное сокращение матки, ее болезненность, пастозность околоматочного пространства, инфильтраты в малом тазу, мутные зловонные выделения из половых путей.
Дополнительные данные получают при проведении гинекологического УЗИ. В случае подозрения на тромбофлебит показана допплерография органов малого таза, УЗДГ вен нижних конечностей. При послеродовом эндометрите информативна гистероскопия; при гнойном параметрите - пункция заднего свода влагалища. По показаниям применяют лучевые способы диагностики: флебографию, гистерографию, радиоизотопное исследование.
Для всех клинических форм послеродовой инфекции характерно изменение картины периферической крови: значительный лейкоцитоз с нейтрофильным сдвигом влево, резкое увеличение СОЭ. С целью идентификации инфекционных агентов производится бакпосев отделяемого половых путей и содержимого матки. Гистологическое исследование последа может указывать на признаки воспаления и, следовательно, высокую вероятность развития послеродовых инфекций. Важную роль в планировании терапии и оценке тяжести течения осложнений имеет исследование биохимии крови, КЩС, электролитов крови, коагулограммы.
Лечение послеродовых инфекций
Весь комплекс лечебных мероприятий при послеродовых инфекциях делится на местные и общие. Постельный режим и прикладывание льда к животу помогает остановить дальнейшее распространение инфекции из полости таза.
Локальные процедуры включают обработку ран антисептиками, перевязки, мазевые аппликации, снятие швов и раскрытие раны при ее нагноении, удаление некротизированных тканей, местное применение протеолитических ферментов. При послеродовом эндометрите может потребоваться проведение кюретажа или вакуум-аспирации полости матки (при задержке в ней плацентарной ткани и других патологических включений), расширение цервикального канала, аспирационно-промывное дренирование. При формировании абсцесса параметрия производится его вскрытие через влагалище или путем лапаротомии и дренирование околоматочной клетчатки.
Местные мероприятия при послеродовых инфекциях проводятся на фоне интенсивной общей терапии. В первую очередь, подбираются антибактериальные средства, активные в отношении всех выделенных возбудителей (пенициллины широкого спектра действия, цефалоспорины, аминогликозиды и другие), которые вводятся внутримышечно или внутривенно в сочетании в метронидазолом. На время лечения целесообразно прервать грудное вскармливание. С целью дезинтоксикации и устранения водно-солевого дисбаланса используются инфузии коллоидных, белковых, солевых растворов. Возможно проведение экстракорпоральной детоксикации: гемосорбции, лимфосорбции, плазмафереза.
При послеродовых инфекциях стафилококковой этиологии с целью повышения специфической иммунологической реактивности применяется антистафилококковый гамма-глобулин, стафилококковый анатоксин, антистафилококковая плазма. С целью профилактики тромбозов назначают антикоагулянты, тромболитики, антиагреганты под контролем коагулограммы. В комплексе медикаментозной терапии широко используются антигистаминные препараты, витамины, глюкокортикоиды. На этапе реабилитации назначают лазеротерапию, местное УФО, УВЧ-терапию, ультразвук, электростимуляцию матки, бальнеотерапию и другие методы физиотерапевтического воздействия.
В отдельных случаях может потребоваться хирургическая помощь – удаление матки (гистерэктомия) при ее гнойном расплавлении; тромбэктомия, эмболэктомия или флебэктомия - при тромбофлебитах.
Прогноз и профилактика
При раневых инфекциях и инфекциях, ограниченных областью малого таза, прогноз удовлетворительный. Своевременная и адекватная терапия позволяет остановить дальнейшее прогрессирование послеродовых инфекций. Однако в отдаленном периоде прогноз в отношении репродуктивной функции может быть вариабельным. Наиболее тяжелые последствия для здоровья и жизни родильницы влекут за собой разлитой перитонит, сепсис и септический шок.
Профилактика послеродовых инфекций обеспечивается строгим и неукоснительным соблюдением санитарно-гигиенического режима в родовспомогательных учреждениях, правил асептики и антисептики, личной гигиены персонала. Важное значение имеет санация эндогенной инфекции на этапе планирования беременности.
Профилактика послеродовых гнойно-септических осложнений у беременных с планируемым абдоминальным родоразрешением представляет актуальную проблему современного акушерства [3,4,8].
К сожалению, при планировании кесарева сечения врач руководствуется только теми положениями клинического протокола, которые обязывают врача действовать согласно программе подготовки к предстоящему родоразрешению. В план этой подготовки не входит исследование видовой и количественной характеристики микробного спектра влагалищного содержимого, связанной с облигатно-анаэробной инфекцией (Gardnarella vagin., Eubacterium spp., Fusobacterium spp., Megasphera spp., Lachnobacterium spp., Mobiluncus spp., Peptostreptococcus spp., Atopobium vaginae)[1,5,7,12].
Многие авторы [2,6,9,13] четко относят наличие этой инфекции к факторам риска осложнений после кесарева сечения, как то, субинволюция матки, послеродовый эндометрит и др., и полагают необходимым обязательно диагностировать эту инфекцию и провести лечение инфекции, как важнейшее звено профилактики гнойно-септических осложнений.
Нами проведены комплексные исследования 55 женщин, из которых 35 составили исследуемую группу и были родоразрешены в плановом порядке, в качестве же контроля исследованы 20 беременных, перенесших кесарево сечение в ургентном порядке.
Статистическая обработка данных проведена с использованием компьютерных программ EXCEL, STATISTICA 6,0. Различия считались статистически значимыми при р< 0,05.
Исследуемую группу составили 35 беременных с выраженным анаэробным влагалищным дисбиозом, которым в сроке 36-38 недель проводилась этиотропная коррекция дисбиоза с помощью влагалищных свечей содержащих клиндамицин (Далацин С, Милагин) 100 мг в течении 3-5 дней. В дальнейшем назначался пробиотик, содержащий комбинацию Lactobacillus rhamnosus GR-1 и Lactobacillus reuteri RC-14 (Вагисан) перорально в течении 10 дней. При обнаружении дрожжеподобных грибов рода Candida spp. lg>10 3 КОЕ/мл назначался однократно перорально препарат, содержащий флуконазол 0,15 мг, а в послеоперационном периоде – с первых суток хлоргексидиновые свечи (Гексикон) местно в течении 10 дней однократно на ночь.
Группу контроля составили 20 беременных, родоразрешенных путем операции кесаревого сечения, у которых установлен анаэробный влагалищный дисбиоз до оперативного родоразрешения и этиотропная терапия до родов не проводилась по разным причинам.
Отягощенный гинекологический анамнез был выявлен в анамнезе у 23 (66,0%) родильниц исследуемой группы, т.е. у каждой второй. Эрозия шейки матки наблюдалась у 10 (28,6%) женщин, хронический сальпингоофорит – у 4 (11,4%). В анамнезе артифициальные аборты выполнены – 11 (31,4%) пациенткам, неразвивающася беременность отмечалась у 1 (2,8%) пациентки.
В группе контроля отягощенный гинекологический анамнез выявлен у 12 (60,0%) беременных. Эрозия шейки матки установлена до беременности у 4 (20,0%) пациенток. В анамнезе артифициальные аборты выполнены – у 4 (20,0%), неразвивающаяся беременность наблюдалась – у 3 (15,0%) пациенток, самопроизвольный аборт в анамнезе – у 1 (5,0%) женщины.
У 10 беременных исследуемой группы (28,5%) из 35, установленная патология шейки матки была пролечена до наступления настоящей беременности методом криодеструкции, в контрольной группе – данную процедуру выполнено у 6 (30,0%).
В основной группе подготовку к повторному оперативному родоразрешению проводили 23 (65,7%) беременным. В акушерском анамнезе показаниями к кесареву сечению у них отмечены: слабость родовой деятельности (СРД), не поддающаяся медикаментозной коррекции – у 11 (31,4%) беременных, тазовое предлежание плода – у 4 (11,4%), крупный плод– у 3 (8,6%), дистресс плода в родах- у 4 (11,4%), врожденные пороки развития плода – у 1 (2,9%) пациентки.
В группе контроля 5 (25,0%) беременных перенесли оперативное родоразрешение путем операции кесаревого сечения. Показаниями к оперативному родоразрешению были: СРД – у 2 (10,0%), тазовое предлежание плода – у 2 (10,0%) пациенток.
В исследуемой группе у 19 (54,3%) настоящая беременность протекала на фоне экстрагенитальной патологии. Из них: сердечно-сосудистые заболевания установлены у 7 (20,0%) пациенток, заболевания щитовидной железы – у 1 (2,9%), гестационная анемия легкой и средней степени тяжести – у 3 (8,6%), нейроциркуляторная дистония (НЦД) по гипотоническому типу – у 2 (5,7%), миопия разной степени тяжести – у 5 (14,3%), хронический колит – у 1 (2,9%) беременной.
В группе контроля: сердечно-сосудистые заболевания установлены – у 3 (15,0%), заболевания щитовидной железы – у 2 (10,0%), гестационная анемия легкой и средней степени тяжести – у 3 (15,0%), НЦД по гипотоническому типу – у 2 (10,0%), миопия средней и высокой степени – у 2 (10,0%), хронический бронхит установлен у 1 (5,0%).
Т.о., у беременных обеих групп имелась выраженная предрасположенность к развитию гнойно-септических осложнений после операции кесарева сечения.
Показаниями для планового абдоминального родоразрешения путем операции кесарева сечения в исследуемой группе явились: рубец на матке с признаками несостоятельности – у 26 (74,3%) беременных; тазовое предлежание плода – у 8 (22,9%); поперечное положение плода – у 1 (2,9%) пациентки. В контрольной группе беременных – показаниями явились: дистресс плода – 4 (20,0%) случая; рубец на матке с признаками несостоятельности – 8 (40,0%); тазовое предлежание плода – 3 (15,0%); заболевания органов зрения – (5,0%); лицевое предлежание плода – 1 (5,0%); остеопороз позвоночника средней степени тяжести с болевым синдромом – 1 (5,0%); предлежание плаценты – 1 (5,0%); анпмалия развития матки (угроза разрыва рога матки) – 1 (5,0%) пациентка.
Течение настоящей беременности, у женщин исследуемой группы, осложнялось: рвота беременных – 3 (8,6%) случая; угрожающий аборт – 4 (11,4%); угроза преждевременных родов – 2 (5,7%); бактериальный вагиноз с повторяющимися обострениями неспецифического кольпита – 7 (20,0%); гестационная анемия легкой степени – 10 (28,6%); острые респираторные вирусные инфекции (ОРВИ) – 9 (25,7%); гестационный пиелонефрит – 3 (8,6%); бессимптомная бактериурия – 1 (2,9%); гестационная гипертензия – 1 (2,9%); гестационные отеки без протеинурии – 4 (11,4%); ВСД по гипотоническому типу – 2 (5,7%); вертеброгенная люмбалгия с болевым синдромом – 1 (2,9%); острый бронхит – 2 (5,7%); острый отит – 1 (2,9%); острый геморрой – 1 (2,9%); маловодие – 1 (2,9%) случай.
В группе контроля отмечались следующие осложнения во время беременности: рвота беременных – 3 (15,0%); угрожающий аборт – 5 (25,0%); бактериальный вагиноз с повторяющейся клиникой неспецифического кольпита – 2 (10,0%); гестационная анемия легкой степени – 6 (30,0%); ОРВИ – 2 (10,0%); гестационная гипертензия – 1 (5,0%); гестационные отеки без протеинурии – 3 (15,0%); тромбоцитопения – 1 (5,0%); остеопороз позвоночника с выраженным болевым синдромом – 1 (5,0%); ВСД по гипотоническому типу – 1 (5,0%); многоводие – 1 (5,0%) случай.
Во время операции у 2 (5,7%) беременных исследуемой группы произведены энуклеации лейоматозных узлов; висцеролиз – у 1 (2,9%); перевязка маточных труб по Мадленеру – у 1 (2,9%); иссечение старого послеоперационного рубца – у 4 (11,4%) пациенток. В группе контроля во время операции у 1 (5,0%) произведена энуклеация лейоматозного узла; висцеролиз – у 3 (15,0%); иссечение старого послеоперационного рубца на коже передней брюшной стенки – у 1 (5,0%) пациентки.
Средняя кровопотеря во время операции у женщин исследуемой группы составила 590,4±9,07 мл, в группе контроля – 580,7±8,3мл (р>0,05). Родилось 35 детей со средней массой тела 3348,6±0,2гр. В исследуемой группе и 3492,5±0,2гр. – в группе контроля. Оценка по шкале Апгар на первой и пятой минутах составила 7,9±0,02 и 8,1±0,03 балла в исследуемой группе и 7,06±0,08 и 7,88±0,03 – в группе контроля. Шесть новорожденных (30,0%) в группе контроля родились со сниженной оценкой по шкале Апгар (6-8) баллов.
С учетом классификации влагалищного дисбиоза предложенной Болдыревой М.Н. (2010) [7], видовая и количественная характеристика микробного спектра влагалищных выделений у беременных исследуемой и контрольной групп до лечения оценены следующим образом: нормоценоз – у 5 (9,0%), умеренный дисбиоз – у 13 (23,6%), выраженный – у 37 (67,3%).
Анализ результатов предложенной профилактической терапии анаэробного влагалищного дисбиоза (табл.1) показал:
1.снижение количества условно-патогенных облигатно-анаэробных микроорганизмов (Gardnarella vagin., Eubacterium spp., Megasphera spp., Atopobium vaginae, Ureaplasma spp.);
2. изменение процентного соотношения типа биоценозов - нормоценоз у 11 (20,0%), умеренный влагалищный дисбаланс – у 25 (45,4%) и выраженный – у 19 (34,5%) пациенток, причем с выявлением меньших характеристик микробного спектра влагалищного содержимого у беременных исследуемой группы.
Данные из табл. 1 на рис.1 представлены графически.
При бактериологическом исследовании влагалищного содержимого беременных исследуемой группы в 1 (2,9%) случае получен рост St. Haemolyticus и в 1 (5,0%) случае у беременной группы контроля – умеренный рост K. pneumouniae. При бактериологическом исследовании околоплодных вод не установлен рост микрофлоры в обеих группах беременных.
Таблица 1. Результаты ДНК-диагностики микробного спектра влагалищного содержимого у беременных исследуемой и контрольной групп

Бактериологическое исследование плацентарной ткани установило рост Е.Coli 10 2 КОЕ/мл, Ps. Cepacia 10 2 КОЕ/млу 2 (5,7%) беременных исследуемой группы и у 2 (10,0%) пациенток в контрольной группе (K.pneumouniae – единичный рост, S.Haemolyticus
Цитологический аспират на 3 сутки после операции характеризовался стадией процесса заживления раневой поверхности матки в физиологическом режиме (нейтрофилы – 60-80%, лимфоциты – 25%, макрофаги и моноциты – 10-15%) у 33 родильниц (94,3%) исследуемой группы и у 14 родильниц (70,0%) контрольной группы.
Воспалительный тип мазка (лейкоциты – до 90% в п.зр., нейтрофилы – до 21%, лимфоциты – до 2-4%, моноциты – 1-2%, макрофаги – 5%) установлен у 1 родильницы исследуемой группы (2,9%) и у 6 родильниц контрольной группы (30,0%) (р<0,05).

Рис.1. Микробный спектр влагалищного отделяемого у беременных сопоставимых групп
При гистологическом исследовании плаценты у 5 родильниц (14,2%) исследуемой группы выявлена хроническая компенсированная недостаточность, в контрольной группе данная патология установлена у 4 (20,0%) пациенток. В исследуемой группе у 1 (2,9%) родильницы установлен хориоамнионит, в контрольной группе хориоамнионит определялся у 5 (25,0%) пациенток, т.е. у каждой 4 родильницы.
Проведенный анализ результатов лабораторных и инструментальных методов обследования, особенностей течения послеродового периода у родильниц исследуемой и контрольной группы определил четкую взаимосвязь увеличения частоты осложнений послеродового периода у беременных с наличием анаэробного влагалищного дисбиоза. Так, субинволюция матки развилась у каждой 6 родильницы контрольной группы, воспалительный тип аспирата маточного содержимого выявлен у каждой 3 родильницы, восходящая инфекция (хориоамнионит) выявлен у каждой 4.
Заключение
Предварительные результаты проведенного исследования четко свидетельствуют о необходимости изучения микробного спектра влагалищных выделений и проведения этиотропного лечения влагалищного дисбиоза, что и определяет реальные возможности профилактики гнойно-септических осложнений у беременных с планируемым кесаревым сечением.
Выводы
2. Этиотропная коррекция анаэробного влагалищного дисбиоза и санация влагалища после операции значительно улучшила течение послеоперационного периода, снизила частоту субинволюции матки, частоту встречаемости хориоамнионита, как проявления восходящей инфекции.
Список использованных источников:
1. Austin M.N., Beigi R.H., Meyn L.A., Hillier S.L. Microbiologic response to treatment of bacterial vaginosis with topical clindamycin or metronidazole// J Clin Microbiol 2005, 43:4492-4497.
2. Bacterial vaginosis in early pregnancy may predispose for preterm birthand postpartum endometritis / B. Jacobsson, P. Pernevi, L. Chidekel [et al.] // Acta Obstet. Gynecol. Scand. — 2002. — Vol. 81, N 11. — P. 1006-1010
3. Complications of cesarean deliveries: rates аМ risk factors/ R.M. Hager, A.K. Daltveit, D. Hofoss,S.T. Nilsen et al. // Am. J. Obstet. Gynec.- 2004.-Vol. 190,N 2.- Р.428—434.
5. Faro S. Postpartum endometritis // Clin. Perinatol. – 2005. – Vol. 32, N 3. – P. 803-814.
6. Schwebke J.R., Lawing L.F. Prevalence of Mobiluncus spp among women with and without bacterial vaginosis as detected by polymerase chain reaction// Sex Transm Dis 2001;28:195–9.
7. Болдырева М.Н. "Фемофлор" исследование биоценоза урогенитального тракта у женщин репродуктивного возраста методом ПЦР с детекцией результатов в режиме реального времени: метод.пособие для врачей. - М., 2010. – 12 с.
9. Кесарево сечение/ В.И. Кулаков, Е.А. Чернуха, Л.М. Комиссарова.- М., 2004.- 320 с.
10. Куперт М.А. Эндометрит после родов (группы риска, особенности клиники и диагностики) / М.А. Куперт, П.В. Солодун, А.Ф. Куперт // Российский вестник акушера-гинеколога. - 2003. - № 4. - С. 42-46
12. Эндометрит и раневая инфекция у родильниц. Проблемы и пути их решения / Н.В. Орджоникидзе, Т.А.Федорова, С.Ж. Данелян // Акушерство и гинекология. - 2004. -№ 5. – С. 3-5.
13. Серов В.Н., Гуртовой Б.Л., Емельянова А.И., Касабулатов Н.М. Эндометрит после родов (в помощь практическому врачу)/ Под ред. В .И. Кулакова. М., 2001.
Подписано в печать: 01.02.2015
Акушерский сепсис – это системное осложнение инфекций женской мочеполовой системы и молочной железы, развившееся во время беременности, изгнания плода и в послеродовом (послеабортном) периоде. Проявляется тяжёлым общим состоянием, нарастающей слабостью, лихорадкой, сердцебиением, одышкой, снижением артериального давления. По мере прогрессирования присоединяются помутнение сознания, выраженное затруднение дыхания, резкое уменьшение объёма отделяемой мочи. Диагноз устанавливается на основании данных физикального осмотра, УЗИ, лабораторных исследований крови. Лечение комплексное: хирургическая санация гнойников, антибиотикотерапия, интенсивная терапия.
МКБ-10
Общие сведения

Причины
Акушерский сепсис всегда вторичен, его источником является локальная инфекция. Основные возбудители гнойно-воспалительных заболеваний – представители оппортунистической флоры (пиогенный стрептококк, стрептококк группы B, золотистый стафилококк, кишечная палочка, клебсиелла, протей, пептококк, пептострептококк, бактероид, грибок кандида), чаще всего населяют нижние отделы мочеполовой сферы и кишечника и приводят к патологии только под воздействием определённых факторов. К основным причинам и источникам инфицирования относятся:
- Хирургические операции и травмы тканей. Раневая поверхность служит воротами инфекции и способствует значительному снижению местного иммунитета. Гнойный процесс может стать исходом кесарева сечения, раннего отхождения околоплодных вод (при неправильном положении плода, многоплодии), полученных в родах разрывов и оперативных вмешательств на промежности.
- Лечебно-диагностические манипуляции. Возбудитель передаётся при контакте с обсеменённым инструментом, кроме того, микротравмы, полученные при исследовании, создают благоприятные условия для лимфо- и гематогенного заражения. В группе факторов риска - цервикальный серкляж, амниоцентез, кордоцентез, уретральная катетеризация, экстракорпоральное оплодотворение, многократные влагалищные исследования в ходе родов.
- Физиологические изменения, вызванные беременностью. Растущая матка сдавливает и смещает окружающие анатомические структуры, а прогестерон снижает тонус гладкой мускулатуры. Эти факторы приводят к нарушению уродинамики и создают предпосылки для развития гестационного пиелонефрита и уросепсиса.
- Застой грудного молока. В результате лактостаза происходит активный рост стафилококков, вызывающих мастит. Нарушение оттока молока – основная причина послеродовых абсцессов и флегмон.
С другой стороны, гнойные процессы могут осложниться сепсисом лишь при условии гипо- или гиперреактивности иммунного ответа. Функциональные расстройства иммунной системы приводят к усилению активности оппортунистических микроорганизмов и формированию патологической реакции на гнойное воспаление. К факторам риска относятся ожирение, сахарный диабет, анемия, острые и хронические воспаления (генитальные и экстрагенитальные), недостаток питания, возраст старше 35 лет.
Патогенез
Массивное поражение ткани инфекцией сопровождается перманентным или периодическим выбросом в кровоток медиаторов воспалительного ответа, что истощает регуляторную функцию иммунной системы и запускает ряд неконтролируемых реакций в дистантных органах и тканях. В результате повреждается эндотелий, ухудшается микроциркуляция (перфузия), снижается транспорт кислорода. Эти изменения приводят к нарушениям гомеостатической регуляции, развитию синдрома острой полиорганной недостаточности (СПОН) и ДВС-синдрома.
Желудочки сердца расширяются, происходит снижение сердечного выброса, нарушается сосудистый тонус. В лёгких образуются ателектазы, развивается респираторный дистресс-синдром. В результате снижения объёма циркулирующей крови (ОЦК) и гемостатических нарушений ухудшается микроциркуляция почечной ткани и кровоснабжение коркового слоя с последующей острой функциональной недостаточностью. В печени нарушаются обменные процессы, а недостаток кровоснабжения влечёт формирование некротических участков. Гипоперфузия приводит к патологической проницаемости слизистой оболочки кишечника с выбросом токсинов и микроорганизмов в лимфатическую систему, в результате ишемии на стенках органов ЖКТ образуются стрессовые язвы. Нарушение обменных процессов и микроциркуляции головного мозга обусловливает неврологические расстройства.
Классификация
Акушерский сепсис классифицируют по разным критериям: по возбудителю, по метастатическому распространению (септицемия, характеризующаяся наличием лишь первичного очага, и септикопиемия – наличие гнойных отсевов в других тканях и органах) или по клиническому течению. В современном акушерстве принята классификация, отражающая последовательные этапы формирования системной воспалительной реакции:
- Синдром системного воспалительного ответа (ССВО). Предвестник септического состояния – системная реакция на воспалительный процесс любой этиологии. Устанавливается при наличии воспалительного заболевания и на основании не менее двух клинических проявлений ССВО: тахикардии, тахипноэ или гипервентиляции, гипо- или гипертермии, лейкоцитоза (лейкопении) или повышения доли незрелых нейтрофилов. У 12% больных сепсисом признаки ССВО отсутствуют.
- Сепсис. Патологический системный ответ на первичную или присоединившуюся инфекцию. Диагноз выставляется при наличии инфекционного очага или на основании верифицированной бактериемии и остро развившихся признаков функциональной недостаточности двух и более органов (СПОН).
- Септический шок. Крайняя форма патологической реакции. Сопровождается выраженными, стойкими, плохо поддающимися медикаментозной коррекции гипотензией и нарушением перфузии.
Симптомы акушерского сепсиса
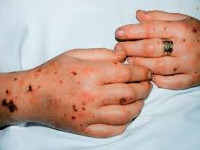
Послеродовый сепсис манифестирует на второй-третий день после изгнания плода сукровично-гнойными выделениями, явлениями общей интоксикации (тахикардией, одышкой, слабостью, потерей аппетита, иногда рвотой и диареей) и повышением температуры до 39-40°C с ознобами. Гипертермия обычно устойчивая, однако могут наблюдаться формы с постепенным повышением или большим разбросом суточной температуры и редкими приступами ознобов. Отмечаются боли в животе или молочных железах, могут регистрироваться генерализованные высыпания. Выраженность симптомов и длительность заболевания различны в зависимости от формы клинического течения.
Для молниеносного акушерского сепсиса нарастание симптоматики характерно в течение суток, при острой форме клиническая картина разворачивается в течение нескольких дней. При подострой форме признаки выражены менее ярко, процесс развивается неделями. Хрониосепсис характеризуется слабо выраженными изменениями (субфебрилитетом, повышенным потоотделением, головной болью и головокружениями, сонливостью, диареей) и вялым течением в течение многих месяцев. Рецидивирующая форма представляет череду затуханий (периодов ремиссии без заметных проявлений) и обострений (периодов с яркой симптоматикой) и характерна для септикопиемии, когда ухудшение состояния обусловлено повторными эпизодами образования вторичных гнойников.
Особенно тяжёлым течением и рядом специфических признаков отличается анаэробный сепсис, ассоциированный с гангреной матки. Заболевание протекает молниеносно или остро, сопровождается интенсивной некупируемой болью внизу живота, крепитацией и усилением боли при пальпации матки, выделением из влагалища газа и зловонной жидкости с пузырьками воздуха, бронзовой окраской кожи, бурым цветом мочи. Явления септического шока проявляются уже в самом начале болезни.
Осложнения
У больных, переживших острый период, может развиться тяжёлое, нередко летальное осложнение – суперинфекция. Значительное ухудшение качества жизни или гибель пациентки часто влекут другие последствия сепсиса: сопряжённые с ишемией или гнойным метастазированием необратимые органные изменения почек, печени, лёгких, сердца, головного мозга, прободение и кровотечения из гастроэнтеральных стресс-язв, артериальная тромбоэмболия и флеботромбоз. Сепсис у беременных может вызвать преждевременные роды, гибель плода, энцефалопатию и ДЦП рожденного ребенка.
Диагностика
В диагностике акушерского сепсиса участвуют акушер-гинеколог, терапевт, реаниматолог, микробиолог, осложнённые формы требуют привлечения нефролога, кардиолога, невролога, гепатолога. В ходе гинекологического исследования и общего осмотра по наличию очага гнойного воспаления в органах малого таза или молочной железе, а также признакам ССВО можно заподозрить септическое состояние. Проводятся следующие исследования:
- Определение возбудителя. Культуральный анализ крови и влагалищного мазка позволяют выявить инфекционный агент и подобрать эффективный препарат для лечения инфекции. Бактериемия подтверждает наличие септического процесса. При отсутствии бактериемии для дифференцирования локальной и генерализованной инфекции проводится тест на прокальцитонин.
- Инструментальные исследования. УЗИ малого таза и почек подтверждает (выявляет) наличие первичного гнойного очага в мочеполовых органах. УЗИ органов брюшной полости, рентгенография органов грудной клетки, ЭхоКГ позволяют обнаружить вторичные абсцессы в печени, лёгких, сердце.
- Клинико-биохимические анализы крови. Общий анализ крови обнаруживает лейкоцитоз, лейкопению, сдвиг лейкоцитарной формулы влево – значения, косвенно подтверждающие септическое состояние. Данные биохимического исследования говорят о нарушениях водно-электролитного баланса и функций почек, печени. Анализ газов крови выявляет нарушения КЩС и дыхательную недостаточность. По результатам коагулограммы определяются нарушения свёртывания крови. Тестирование уровня лактата в плазме позволяет обнаружить тканевую гипоперфузию и оценить тяжесть шока. Иммунограмма свидетельствует о расстройствах иммунной активности.
Акушерский сепсис следует дифференцировать с гестозами, амниотической эмболией и тромбоэмболией лёгочной артерии, острыми инфекциями (тяжёлым гриппом, бруцеллёзом, тифом, малярией, милиарным туберкулёзом), острым панкреатитом, лейкозами, лимфогранулематозом. Для дифференциальной диагностики может потребоваться консультация кардиохирурга, инфекциониста, фтизиатра, онкогематолога.
Лечение акушерского сепсиса
Лечебные мероприятия проводятся в условиях гинекологического или обсервационного акушерского отделения, больные с тяжёлыми формами сепсиса переводятся в отделение реанимации и интенсивной терапии. Лечение комплексное, включает хирургические и консервативные методы и направлено на борьбу с инфекцией и коррекцию витальных функций:
- Инфузионная терапия. Лечение предусматривает коррекцию гомеостатических расстройств (гипотонии, коагулопатии, нарушений кислотно-щелочного и водно-солевого и обмена, дефицита ОЦК), восстановление тканевой перфузии, дезинтоксикацию. С этими целями вводятся солевые и коллоидные растворы, альбумин, криоплазма, инотропы и вазопрессоры.
- Антибактериальная терапия. Направлена на уничтожение инфекционного агента с целью блокировки воспалительного каскада. Стартовое лечение включает внутривенное введение комбинации препаратов широкого спектра. После выделения возбудителя приступают к этиотропной антибиотикотерапии.
- Хирургическое лечение. Ликвидация гнойных очагов повышает эффективность интенсивной терапии и улучшает прогноз. Лечение предполагает санацию первичного и вторичных очагов – вскрытие и опорожнение абсцессов, кюретаж, вакуум-аспирацию или удаление матки (гистерэктомию).
В случае необходимости проводится искусственная вентиляция лёгких, энтеральное питание пациентки. Дополнительные методы интенсивной терапии включают применение кортикостероидов, выполнение хирургической детоксикации (плазмаферез, гемосорбция, гемофильтрация) после оперативного лечения нагноений, иммунотерапию.
Прогноз и профилактика
На ранних стадиях, когда не развились выраженные признаки СПОН, устойчивая гипотензия и ДВС-синдром, прогноз благоприятный. При развитии септического шока смертность может достигать 65% (в среднем – 45%). Профилактические мероприятия состоят в своевременном лечении воспалительных заболеваний (как на этапе планирования, так и в течение беременности), борьбе с внебольничными вмешательствами (внутриматочными и вагинальными манипуляциями, криминальными абортами, домашними родами), рациональной превентивной антибиотикотерапии при оперативных вмешательствах, полноценном питании, стабилизации уровня глюкозы в крови при сахарном диабете.
3. Клинические рекомендации по диагностике и лечению тяжелого сепсиса и септического шока в лечебно-профилактических организациях Санкт-Петербурга. – 2016.
4. Гнойно-воспалительные заболевания и сепсис в акушерстве. Клинические рекомендации (протокол лечения)/ Коллектив авторов. – 2015.
Анаэробная инфекция – это инфекционный процесс, вызываемый спорообразующими или неспорообразующими микроорганизмами в условиях, благоприятных для их жизнедеятельности. Характерными клиническими признаками анаэробной инфекции служат преобладание симптомов эндогенной интоксикации над местными проявлениями, гнилостный характер экссудата, газообразующие процессы в ране, быстро прогрессирующий некроз тканей. Анаэробная инфекция распознается на основании клинической картины, подтвержденной результатами микробиологической диагностики, газожидкостной хроматографии, масс-спектрометрии, иммуноэлектрофореза, ПЦР, ИФА и др. Лечение анаэробной инфекции предполагает радикальную хирургическую обработку гнойного очага, интенсивную дезинтоксикационную и антибактериальную терапию.
МКБ-10
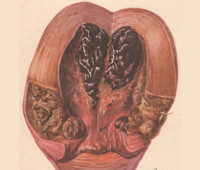
Общие сведения
Анаэробная инфекция – патологический процесс, возбудителями которого выступают анаэробные бактерии, развивающиеся в условиях аноксии (отсутствия кислорода) или гипоксии (низкого напряжения кислорода). Анаэробная инфекция представляет собой тяжелую форму инфекционного процесса, сопровождающуюся поражением жизненно важных органов и высоким процентом летальности. В клинической практике с анаэробной инфекцией приходится сталкиваться специалистам в области хирургии, травматологии, педиатрии, нейрохиругии, отоларингологии, стоматологии, пульмонологии, гинекологии и других медицинских направлений. Анаэробная инфекция может возникнуть у пациентов любого возраста. Доля заболеваний, вызываемых анаэробной инфекцией, точно не известна; из гнойных очагов в мягких тканях, костях или суставах анаэробы высеваются примерно в 30% случаев; анаэробная бактериемия подтверждается в 2-5% случаев.

Причины
Анаэробы входят в состав нормальной микрофлоры кожи, слизистых оболочек, желудочно-кишечного тракта, органов мочеполовой системы и по своим вирулентным свойствам являются условно-патогенными. При определенных условиях они становятся возбудителями эндогенной анаэробной инфекции. Экзогенные анаэробы присутствуют в почве и разлагающихся органических массах и вызывают патологический процесс при попадании в рану извне. Анаэробные микроорганизмы делятся на:
- Факультативные. Способны выживать как в отсутствии, так и в присутствии кислорода. К ним принадлежат кишечная палочка, шигеллы, иерсинии, стрептококки, стафилококки и др.
- Облигатные. Их развитие и размножение осуществляется в бескислородной среде. Облигатные возбудители делятся на две группы:
- спорообразующие (клостридии) - являются возбудителями клостридиозов экзогенного происхождения (столбняка, газовой гангрены, ботулизма, пищевых токсикоинфекций и др.);
- неспорообразующие (неклостридиальные) анаэробы (фузобактерии, бактероиды, вейллонеллы, пропионибактерии, пептострептококки и др.). В большинстве случаев вызывают гнойно-воспалительные процессы эндогенной природы (абсцессы внутренних органов, перитонит, пневмонию, флегмоны челюстно-лицевой области, отит, сепсис и др.).
Факторы риска
Условиями, благоприятствующими развитию анаэробной инфекции, являются повреждение анатомических барьеров с проникновением анаэробов в ткани и кровеносное русло, а также снижение окислительно-восстановительного потенциала тканей (ишемия, кровотечение, некроз). Попадание анаэробов в ткани может происходить при оперативных вмешательствах, инвазивных манипуляциях (пункциях, биопсии, экстракции зуба и др.), перфорации внутренних органов, открытых травмах, ранениях, ожогах, укусах животных, синдроме длительного сдавления, криминальных абортах и т. д. Факторами, способствующими возникновению анаэробной инфекции, выступают:
- массивное загрязнение ран землей;
- наличие инородных тел в ране;
- гиповолемический и травматический шок;
- сопутствующие заболевания (коллагенозы, сахарный диабет, опухоли);
- иммунодефицит.
Кроме этого, большое значение имеет нерациональная антибиотикотерапия, направленная на подавление сопутствующей аэробной микрофлоры.
Патогенез
Основными факторами патогенности анаэробных микроорганизмов служат их количество в патологическом очаге, биологические свойства возбудителей, наличие бактерий-ассоциантов. В патогенезе анаэробной инфекции ведущая роль принадлежит продуцируемым микроорганизмами ферментам, эндо- и экзотоксинам, неспецифическим факторам метаболизма. Так, ферменты (гепариназа, гиалуронидаза, коллагеназа, дезоксирибонуклеаза) способны усиливать вирулентность анаэробов, деструкцию мышечной и соединительной тканей.
Эндо- и экзотоксины вызывают повреждение эндотелия сосудов, внутрисосудистый гемолиз и тромбоз. Кроме этого, некоторые клостридиальные токисины обладают нефротропным, нейротропным, кардиотропным действием. Также токсическое влияние на организм оказывают и неспецифические факторы метаболизма анаэробов - индол, жирные кислоты, сероводород, аммиак.
Классификация
В зависимости от локализации различают анаэробную инфекцию:
- центральной нервной системы (абсцесс мозга, менингит, субдуральная эмпиема и др.)
- головы и шеи (пародонтальный абсцесс, ангина Людвига, средний отит, синусит, флегмона шеи и т. д.)
- дыхательных путей и плевры (аспирационная пневмония, абсцесс легкого, эмпиема плевры и пр.)
- женской половой системы (сальпингит, аднексит, эндометрит, пельвиоперитонит)
- брюшной полости (абсцесс брюшной полости, перитонит)
- кожи и мягких тканей (клостридиальный целлюлит, газовая гангрена, некротизирующий фасциит, абсцессы и др.)
- костей и суставов (остеомиелит, гнойный артрит)
- бактериемию.
Течение анаэробной инфекции может быть молниеносным (в течение 1 суток с момента операции или травмы), острым (в течение 3-4 суток), подострым (более 4 суток).
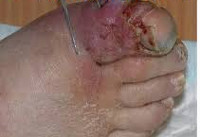
Симптомы анаэробной инфекции
Независимо от вида возбудителя и локализации инфекционного очага, различным клиническим формам свойственны некоторые общие черты. В большинстве случаев анаэробная инфекция имеет острое начало и характеризуется сочетанием местных и общих симптомов. Инкубационный период может составлять от нескольких часов до нескольких суток (в среднем около 3-х дней).
Типичным признаком анаэробной инфекции служит преобладание симптомов общей интоксикации над местными воспалительными явлениями. Резкое ухудшение общего состояния больного обычно наступает еще до возникновения локальных симптомов. Проявлением тяжелого эндотоксикоза служит высокая лихорадка с ознобами, выраженная слабость, тошнота, головная боль, заторможенность. Характерны артериальная гипотония, тахипноэ, тахикардия, гемолитическая анемия, иктеричность кожи и склер, акроцианоз.
При раневой анаэробной инфекции ранним местным симптомом выступает сильная, нарастающая боль распирающего характера, эмфизема и крепитация мягких тканей, обусловленные газообразующими процессами в ране. К числу постоянных признаков относится зловонный ихорозный запах экссудата, связанный с выделением азота, водорода и метана при анаэробном окислении белкового субстрата. Экссудат имеет жидкую консистенцию, серозно-геморрагический, гнойно-геморрагический или гнойный характер, неоднородную окраску с вкраплениями жира и наличием пузырьков газа. На гнилостный характер воспаления также указывает внешний вид раны, содержащей ткани серо-зеленого или серо-коричневого цвета, иногда струпы черного цвета.
Осложнения
Анаэробная инфекция часто сопровождается развитием полиорганной недостаточности (почечной, печеночной, сердечно-легочной), инфекционно-токсического шока, тяжелого сепсиса, являющихся причиной летального исхода.
Диагностика
Для своевременной диагностики анаэробной инфекции большое значение имеет правильная оценка клинических симптомов, позволяющая своевременно оказать необходимую медицинскую помощь. В зависимости от локализации инфекционного очага диагностикой и лечением анаэробной инфекции могут заниматься клиницисты различных специальностей – общие хирурги, травматологи, нейрохирурги, гинекологи, отоларингологи, челюстно-лицевые и торакальные хирурги. С целью определения патогенного агента и тяжести инфекционного процесса используют:
- Методы детекции возбудителя. Методы экспресс-диагностики анаэробной инфекции включают бактериоскопию раневого отделяемого с окраской мазка по Грамму и газожидкостную хроматографию. В верификации возбудителя ведущая роль принадлежит бактериологическому посеву отделяемого раны или содержимого абсцесса, анализу плевральной жидкости, посеву крови на аэробные и анаэробные бактерии, иммуноферментному анализу, ПЦР.
- Другие анализы. В биохимических показателях крови при анаэробной инфекции обнаруживается снижение концентрации белков, увеличение уровня креатинина, мочевины, билирубина, активности трансаминаз и щелочной фосфатазы.
- Инструментальную диагностику. Наряду с клиническими и лабораторными исследования, выполняется рентгенография, при которой обнаруживается скопление газа в пораженных тканях или полостях.
Анаэробную инфекцию необходимо дифференцировать от рожистого воспаления мягких тканей, полиморфной экссудативной эритемы, тромбоза глубоких вен, пневмоторакса, пневмоперитонеума, перфорации полых органов брюшной полости.
Лечение анаэробной инфекции
Комплексный подход к лечению анаэробной инфекции предполагает проведение радикальной хирургической обработки гнойного очага, интенсивной дезинтоксикационной и антибактериальной терапии. Хирургический этап должен быть выполнен как можно раньше – от этого зависит жизнь больного. Как правило, он заключается в широком рассечении очага поражения с удалением некротизированных тканей, декомпрессии окружающих тканей, открытом дренировании с промыванием полостей и ран растворами антисептиков. Особенности течения анаэробной инфекции нередко требуют проведения повторных некрэктомий, раскрытия гнойных карманов, обработки ран ультразвуком и лазером, озонотерапии и т. д. При обширной деструкции тканей может быть показана ампутация или экзартикуляция конечности.
Важнейшими составляющими лечения анаэробной инфекции являются интенсивная инфузионная терапия и антибиотикотерапия препаратами широкого спектра действия, высокотропными к анаэробам. В рамках комплексного лечения анаэробной инфекции находят свое применение гипербарическая оксигенация, УФОК, экстракорпоральная гемокоррекция (гемосорбция, плазмаферез и др.). При необходимости пациенту вводится антитоксическая противогангренозная сыворотка.
Прогноз и профилактика
Исход анаэробной инфекции во многом зависит от клинической формы патологического процесса, преморбидного фона, своевременности установления диагноза и начала лечения. Уровень летальности при некоторых формах анаэробной инфекции превышает 20%. Профилактика анаэробной инфекции заключается в своевременной и адекватной ПХО ран, удалении инородных тел мягких тканей, соблюдении требований асептики и антисептики при проведении операций. При обширных раневых повреждениях и высоком риске развития анаэробной инфекции необходимо проведение специфической иммунизации и противомикробной профилактики.
Читайте также:

