Анализ бактек на туберкулез
Обновлено: 19.04.2024
Для данного исследования лаборатория принимает следующий биоматериал:
- Спинномозговая жидкость
- Плевральная жидкость
- Мокрота
- Синовиальная жидкость
- Бронхоальвеолярный лаваж
Подготовка к исследованию
Бронхоальвеолярный лаваж. Условия подготовки определяются лечащим врачом.
Мокрота. После предварительного полоскания полости рта водой.
Плевральная жидкость. Условия подготовки определяются лечащим врачом.
Синовиальная жидкость. Условия подготовки определяются лечащим врачом.
Спинномозговая жидкость. Условия подготовки определяются лечащим врачом.
Метод исследования
Туберкулез – широко распространенное в мире хроническое инфекционное заболевание, вызываемое различными видами микобактерий из группы Mycobacterium tuberculosis complex. При туберкулезе чаще поражаются органы дыхания, но могут быть вовлечены в процесс и другие органы и системы организма - суставы, кости, мочеполовая система, кожа и т.д. В группу Mycobacterium tuberculosis complex, вызывающую инфекционное заболевание у человека, объединены: M.tuberculosis, M.bovis, M.africanum, M.microti, M.canettii, M.caprae, M.pinnipedii, M.mungi. Источником инфекции является больной человек, основной путь заражения – воздушно-капельный. В развитии инфекционного процесса большую роль играют неблагоприятные условия жизни, труда, а также факторы, влияющие на снижение иммунитета. При попадании микобактерий в организм, происходит их транспорт в региональные лимфатические узлы и формирование первичных туберкулезных комплексов с развитием гранулем, наиболее часто в легочной ткани. В ряде случаев возможно формирование очагов в почках, половых органах, костях. Клинически реактивный туберкулез характеризуется кашлем, часто с кровохарканием, субфебрильной температурой, снижением массы тела, слабостью.
Анализ на микобактерии туберкулеза методом ПЦР включает определение ДНК Mycobacterium tuberculosis complex (M.tuberculosis, M.bovis, M.africanum, M.microti).
Показания к исследованию:
- Обследование лиц с подозрением на туберкулез.
Референсные значения: не обнаружено
Интерпретация: выявление ДНК Mycobacterium tuberculosis complex свидетельствует о наличии инфекционного процесса.
При единовременном заказе нескольких услуг, услуга по сбору биоматериала оплачивается только один раз.
В соответствии с современными программами ВОЗ, основой выявления туберкулёза за рубежом считают проведение микроскопии мазков мокроты, полученной от кашляющих больных, обратившихся к врачам общей практики; мазки окрашивают по Цилю-Нильсену. Эта методика входит в отечественный поликлинический и клинический минимум обследования пациента, выделяющего мокроту. В 1995 г. Минздравмедпром России в приказе № 8 "О развитии и совершенствовании деятельности лабораторной клинической микробиологии (бактериологии) лечебно-профилактических учреждений" подтвердил эту обязанность клинико-диагностических лабораторий. Обязательное бактериологическое исследование мокроты на М. tuberculosis должно быть организовано для нетранспортабельных больных, больных хроническими заболеваниями органов дыхания и мочевыводящей системы, а также для работников неблагополучных по туберкулёзу животноводческих хозяйств. Этот старейший метод полностью сохраняет свое значение вследствие доступности для практических клинико-диагностических лабораторий, низкой стоимости и быстроты выполнения.
При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии, что и является большим минусом этого метода. Только при идеальном выполнении всех требуемых условий, указанных в Приказе № 109 МЗ РФ,-исследование не менее трех проб диагностического материала, правильный сбор мокроты, наличие современного бинокулярного микроскопа и высококачественных реактивов, просмотр до 300 полей зрения - возможно повышение чувствительности до 10000 микробных клеток.
Микобактерии туберкулёза имеют вид тонких, слегка изогнутых палочек различной длины с утолщениями на концах или посередине, располагаются группами и поодиночке (рисунок 1,а) Окрашенные по Цилю-Нильсену мазки микроскопируют с иммерсионной системой не менее 10 мин.
Люминесцентная микроскопия
Метод основан на проникновении в микробную клетку карболового производного флюоресцентного красителя (аурамина, родамина). При окраске флюоресцентным красителем аурамином-родамином микобактерии можно видеть при неиммерсионном 100-кратном увеличении. Более точен результат при окраске по Цилю-Нильсену карболфуксином и иммерсионной микроскопии при 1000-кратном увеличении. Именно окраска мазка по Цилю-Нильсену рекомендована при применении технологий DOTS. Микобактерии в этом случае выглядят светящимися желтыми палочками (рисунок 1, б). Метод имеет неоспоримые преимущества, так как позволяет при меньшем увеличении микроскопа просмотреть фактически весь мазок, так же этот метод экономически более эффективен, так как уменьшается время, затрачиваемое на просмотр мазков.
К недостаткам метода ЛМ следует отнести значительно более высокую стоимость люминесцентного микроскопа, при процедуре окрашивания- соблюдение и коррекция pH мазка, а также освобождение микобактерий в диагностическом материале (особенно в мокроте) от окружающей их слизи, которая препятствует проникновению флуоресцентного красителя в микробную клетку. Поэтому нецелесообразно использование ЛМ для нативной мокроты, но применять этот метод рекомендуется при исследовании мазков, приготовленных после центрифугирования из осадка материала, обработанного для культурального исследования и нейтрализованного после деконтаминации. Поэтому метод ЛМ следует применять в бактериологических лабораториях, где культуральное и микроскопическое исследование может быть произведено из одной и той же порции диагностического материала.
При гистологическом или цитологическом исследовании иногда можно обнаружить характерные для туберкулёза клетки, являющиеся результатом защитной реакции организма на внедрение туберкулёзной палочки. Наличие в цитограмме гигантских клеток Лангханса с несомненностью решает диагноз туберкулёза. Эти клетки имеют очень большие размеры (80 - 90 мкм и более в диаметре). Цитоплазма окрашена в серо-голубой цвет. По её периферии расположено в ряд большое количество ядер (до 20), расположенных в форме кольца (рисунок 1, в).
Другим признаком туберкулёза является присутствие в препарате так называемых эпителиоидных клеток, из которых и развиваются клетки Лангханса. Это происходит при увеличении количества ядер без разделения цитоплазмы, которая только увеличивается в размерах (рисунок 1, г).
Микроскопия позволяет быстро получить результат, но обладает низкой чувствительностью и специфичностью, невозможностью дифференциации кислотоустойчивых микобактерий.
Рисунок 1
Микобактерии туберкулеза
а - метод окраски по Цилю-Нельсену
б - метод люминисцентной микроскопии
в - клетки Лангхаса
г - эпителиоидные клетки
Культуральный метод
Исторически сложилось, что питательные среды на яичной основе (Левенштейна-Йенсена, Финна-2, Огавы, Аникина, "Новая", Попеску) получили наибольшее распространение среди плотных питательных сред, применяемых для выделения МБТ. Посев материала на среду Левенштайна-Йенсена проводят в бактериологической лаборатории. Рост первых колоний на классических средах отмечают через 4 - 8 недель. Однако появившиеся в последние годы агаровые среды Миддлбрука (7Н10, 7Н11) позволяют быстрее обнаружить рост микобактерий (от двух до четырех недель) и обеспечивают лучшие возможности для изучения морфологии колоний, чем на яичных средах. Недостатком агаризованных питательных сред является необходимость инкубации посевного материала в термостате с углекислым газом, поэтому агаризованные среды в России практически не применяются.
Следует отметить, что в связи с высокой избирательностью различных штаммов микобактерий и потребностью в полноценных белках до сих пор нет универсальной питательной среды, способной заменить все остальные. В Приказе № 109МЗ РФ для посева диагностического материала на МБТ рекомендуется использовать по одной пробирке международной питательной среды Левенштейна-Йенсена и Финна-2. Однако практика показывает, что кроме указанных сред целесообразно использовать и какую-либо из дополнительных, а посев на три пробирки питательной среды также повышает эффективность культуральной диагностики.
Для полноценной культуральной диагностики туберкулеза необходимо иметь соответствующие помещения и оборудование. Особенно важно наличие центрифуги и антиаэрозольной защитой и способностью обеспечить ускорение 3000g. А также шкафов биологической безопасности для предотвращения внутрилабораторного инфицирования.
Основным недостатком культуральной диагностики туберкулеза является длительность исследования - от трех недель до трех месяцев. Поэтому остаются актуальными дальнейшие исследования по разработке методов ускорения роста микобактерий.
Системы BACTEC
Культуральная диагностика туберкулеза переживает в настоящее время принципиальные изменения, связанные с внедрением в практику полностью автоматизированных систем культивирования МБТ. Главное отличие этих методов - применение жидких питательных сред для культивирования с последующей радиометрической (BACTEC 460), колорометрической (Mb-Bact, Вас- tALERT) и люминесцентной детекцией роста (BACTEC MGIT 960). Рост МБТ на жидкой питательной среде в этих системах удается обнаружить уже через 1 - 2 недели в зависимости от их исходного количества в диагностическом материале. Частота выявления микобактерий так же несколько выше, чем на плотных питательных средах. Автоматизированные системы BACTEC с использованием соответствующих флаконов, содержащих различные противотуберкулезные препараты, позволяют сократить время исследования лекарственной устойчивости микобактерий до 10 - 14 суток.
Из перечисленных автоматизированных систем наиболее эффективна в настоящее время система BACTEC MGIT 960BD. Флаконы MGIT с жидкой питательной средой 7Н9 содержат в придонной части под силиконом флуоресцентный индикатор, "погашенный" высокими концентрациями кислорода. При наличии роста микобактерий в процессе поглощения кислорода индикатор начинает светиться, регистрация флуоресценции в сисиеме BACTEC MGIT производится автоматически. Использование флаконов MGIT возможно и "вручную", тогда регистрацию свечения производят с помощью трансиллюминатора на флаконах MGIT составляет 11 суток.
Основным недостатком BACTEC MGIT, как и других систем BACTEC, является высокая стоимость оборудования (до 100000 долларов США) и флаконов с питательной средой - посев одной пробы диагностического материала стоит до 400 рублей.
Посев на L -формы микобактерий
Так называемые дефектные по клеточной стенке L-формы микобактерий и других инфекционных патогенов являются результатом изменчивости и основным видом персистирования, то есть переживания в неблагоприятных условиях. Посев на L-формы особенно эффективен при внелегочном туберкулезе, поскольку вегетация МБТ в очагах ВЛТ при повышенном ацидозе и анаэробиозе приводит к снижению их жизнеспособности и ферментативной активности.
Диагноз не может быть поставлен только на основании выявления L-форм микобактерий, но их обнаружение, особенно при верификации методом ПЦР, является весомым аргументом в пользу туберкулезной природы заболевания. В очагах внелегочного туберкулеза наблюдается ранняя L-трансформация микобактерий, поэтому их обнаружение позволяет поставить диагноз на начальных стадиях заболевания.
Лабораторная диагностика туберкулеза. Выявление бактерий туберкулеза.
В распознавании и дифференциальной диагностике туберкулеза, а также в определении эффективности проводимого лечения важную роль играют лабораторные методы исследования. Среди них большое значение имеют прежде всего способы обнаружения микобактерии туберкулеза в различных выделениях, воспалительных экссудатах, жидкостях и тканях организма больного.
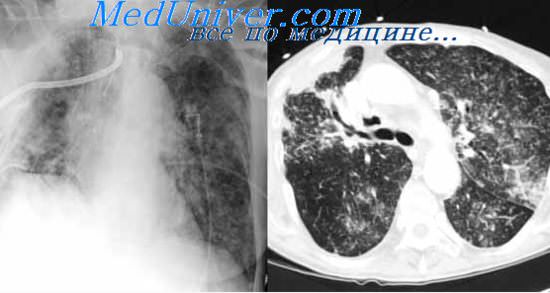
При туберкулезе легких микобактерии находят прежде всего в мокроте. Частота, массивность и постоянство бацилловыделения зависят от формы процесса. Оно часто имеет место при инфильтративном и особенно деструктивном туберкулезе легких. Реже или периодически выделяют микобактерии больные очаговыми, диссеминированными и цирротическими формами туберкулеза без явного распада легочной ткани. Существенное значение имеет при этом состояние бронхов. При их специфическом поражении, но сохраненной дренажной функции микобактерии выявляются с мокротой сравнительно чаще и с большим постоянством, чем при нормальном состоянии бронхов или при их стенозе, вызывающем блокаду каверны.
Микобактерии туберкулеза находят в большом количестве в обильно выделяющейся мокроте, а в скудном отделяемом, наоборот, они встречаются реже и в виде единичных экземпляров. У больных, не выделяющих мокроту, лучшие результаты дает применение раздражающих аэрозольных ингаля пий 10—15% раствора поваренной соли в 1% растворе питьевой соды Н. М. Рудой и соавт. (1971) применяют с этой целью смесь, состоящую из 5 мл 10% раствора хлорида натрия, 1 мл химопсина, растворенного в физиологическом растворе, и 20 капель солутана.
Второе место по эффективности выявления бацилловыделения у больных, не выделяющих мокроту, занимает исследование промывных вод трахеи и бронхов, которое предложил Я. С. Зобин (1939). В настоящее время для анестезии гортани у взрослых применяют 0,25% раствор дикаина, разведенный в 10% растворе новокаина. Этот раствор наливают во время фонации на голосовые связки в количестве 0,5—1 мл. У больных с повышенным глоточным рефлексом этим раствором смазывают заднюю стенку глотки. Затем в трахею шприцем с напаянной канюлей вводят 10—20 мл физиологического раствора комнатной температуры.
При этом в результате раздражения слизистой оболочки бронхов возникает кашель, при котором из глубоких дыхательных путей вместе с введенной жидкостью выделяются слизь и мокрота. Это отделяемое исследуют на присутствие микобактерии туберкулеза или другой микробной флоры.
Исследование промывных вод бронхов редко сопровождается серьезными осложнениями. Только при сильном, длительном и приступообразном кашле иногда появляется кровохарканье, может аспирироваться инфекционный материал в здоровые участки легочной ткани, нарастает сердечная недостаточность. Такие явления отмечаются главным образом у больных с сопутствующей бронхиальной астмой, пороком сердца, гипертонией. В подобных случаях, очевидно, не следует прибегать к данному методу исследования. При отсутствии таких противопоказаний, особенно у больных с ограниченными формами процесса, у которых чаще всего и возникает необходимость в исследовании промывных вод бронхов, обычно не наблюдается каких-либо осложнений, и поэтому его можно производить не только в клинических, но и в амбулаторных условиях.
Менее эффективно производимое натощак исследование промывных вод желудка, в которых может содержаться бациллярная мокрота или бронхиальная слизь, чаще заглатываемая детьми, а иногда и взрослыми (Аrmand-Dellille, 1927). Кроме того, микобактерии могут проникать в желудок через его слизистую оболочку при гематогенном распространении инфекции в организме, а также при забрасывании бациоллосодержащей желчи (М. Д. Розанова, 1950). Пользоваться этим методом рекомендуется в тех случаях, когда не удается получить мокроту при раздражающих ингаляциях, при противопоказаниях к применению промывания бронхов или при невозможности их проведения по другим причинам.
Наименее информативно определение бацилловыделения с помощью исследований мазков слизи из гортани, а также промывания только верхних отделов дыхательных путей.
У части больных можно выделить микобактерии из крови. По наблюдениям 49 авторов, обобщенным в 1954 г. Dalencour, бациллемия отмечалась в среднем у 5,3% больных различными формами туберкулеза. П. И. Беневоленский (1945) установил ее у 3,7% больных туберкулезом легких (исключая страдающих гематогенным процессом). Чаще обнаруживают микобактерии в крови при туберкулезе кожи, обширных гематогенных диссеминациях в легких, при менингите. Однако, по сводным данным Kallos (1937). основанным на изучении гемокультур, выделенных от 14 502 больных, туберкулезная бациллемия имела место всего лишь у 1,13% из них.
Частота выявления микобактерии зависит не только от формы заболевания, метода получения материала, но и от способа его исследования (бактериоскопия, посев, заражение животных). Микобактерии туберкулеза обнаруживают при прямой бактериоскопии мазков мокроты, окрашенных по Цилю—Нельсену, при микроскопии с использованием метода обогащения — флотации и люминесцентного способа исследования. Методы обогащения повышают частоту обнаружения микобактерии туберкулеза в мокроте, промывных водах желудка и бронхов, в экссудате, спинномозговой жидкости, в каловых массах на 10—20% по сравнению с результатами прямой бактериоскопии.
Среди бактериоскопических методов выявления бацилловыделения наиболее чувствительным является люминесцентная микроскопия, повышающая возможность обнаружения в мокроте микобактерии на 15—20% по сравнению с обычной бактериоскопией, а при исследовании мазков из флотационных колец — на 8—10%. При этом облегчается изучение некоторых биологических свойств возбудителя — старения культур, аутолиза клеток и др.
Некоторые авторы утверждают, что при флюоресцентной (люминесцентной) микроскопии микобактерии туберкулеза можно выявить даже чаще, чем при посевах мокроты и других материалов на различные питательные среды. Kolbel (1955) обнаружил их при простой бактериоскопии у 39,7% больных, при бактериологическом методе — у 52,1%, а при люминесцентной микроскопии — у 73,6%. На преимущество последнего метода указывают Т. Н. Ященко и И. С. Мечева (1973), Н. С. Страхов и соавт. (1973).
Для суждения об эффективности проводимой антибактериальной терапии придают прогностическое значение уменьшению (или сохранению) в динамике массивности бацилловыделения. Поэтому целесообразно не только констатировать бацилловыделение, но и оценивать его количественный показатель. При этом при бактериоскопии бацилловыделение оценивается как обильное, если находят микобактерии в каждом поле зрения, умеренное — при наличии «единичных микробов в 40—50 полях зрения и скудное — при нахождении их единичных экземпляров в препарате.
Бактериологический метод диагностики туберкулеза. Влияние химиотерапии на диагностику туберкулеза.
Наилучшие результаты получают при одновременном использовании двух различных плотных сред. При этом не следует ограничиваться однократным или даже повторным исследованием, а необходимо последовательно, через известные интервалы производить посевы мокроты или промывных вод бронхов. Целесообразность такой диагностической тактики подтверждается повседневным опытом и, в частности, наблюдениями, проведенными в Институте туберкулеза в Будапеште. При троекратном исследовании методом посева мокроты у значительной группы больных туберкулезом легких микобактерии были обнаружены у 70,3% из них, после 5 анализов — у 80,7%, а после 10 — у 97,9%.
При бактериологическом способе исследования удается не только выявить и подсчитать количество выросших колоний микобактерии туберкулеза, но и изучить их различные свойства, дифференцировать от кислотоупорных сапрофитов и атипичных штаммов, определить типовую принадлежность, ферментативную активность, лекарственную чувствительность и др.
Успехи различных способов культивирования микобактерии, естественно, ограничили сферу применения биологического метода исследования, т. е. заражения животных исследуемым материалом. Но они ни в какой мере пе исключают его. Путем заражения высокочувствительных к туберкулезу лабораторных животных, главным образом морских свинок, можно обнаружить микобактерий, даже если они содержатся в исследуемом материале в небольшом количестве. Это обстоятельство приобретает, конечно, весьма важное диагностическое значение. Тем же способом удается лучше дифференцировать вирулентные и атипичные штаммы от сапрофитов, определить тип микробов, к которым одни виды животных чувствительны, а другие устойчивы, а также установить патогенность и вирулентность микобактерий туберкулеза.
Следует подчеркнуть, что при специфической химиотерапии затрудняется обнаружение микобактерий в различных выделениях, жидкостях и тканях организма больного. Это явление связано с тем, что под влиянием антибактериальных препаратов, особенно при длительной терапии, понижается жизнеспособность микобактерий и изменяются их морфологические свойства и химический состав, что отражается на тинкториальной способности, так как может вести к снижению или утрате присущей микобактериям кислотоустойчивости. Мертвые микобактерий по Цилю—Нельсену окрашиваются так же, как и живые. Для их дифференциации применяют специальные методы окраски. Так, живые микобактерий, в которых содержится нативная дезоксирибонуклеиновая кислота, окрашиваются метиловым зеленым. Погибшие микробы лучше окрашиваются пиронином в розовый цвет, а сафранином — в красный. При докраске карболовым фуксином живые микобактерий окрашиваются в зеленый цвет, а погибшие — в красный.
Распознавание таких биологически и морфологически измененных форм возбудителя туберкулеза, особенно в условиях повседневной практики, естественно, встречает затруднения. Этим отчасти можно объяснить, что у некоторых больных даже деструктивным туберкулезом легких не находят микобактерий туберкулеза в мокроте уже вскоре после начатой химиотерапии. Нет сомнения, что только у части из них произошло стойкое и полное морфологическое и биологическое оздоровление стенок туберкулезных каверн. У остальных имеет место мнимая абациллярность, что подтверждается возможностью обострения процесса при динамическом наблюдении, а также обнаружением микобактерий в полости или стенках каверны при специальном исследовании. В этом можно убедиться, если произвести пункцию, казалось бы, излеченной каверны и исследовать ее содержимое после промывания физиологическим раствором. Пользуясь таким методом, Neef (1966) из 49 больных с остаточными, большей частью небольшими (до 0,5 см в диаметре), посттуберкулезными полостями в легких у 11 больных, т. е. почти в 1/4 случаев, обнаружил микобактерий, которые не удавалось найти в мокроте или в промывных водах бронхов всеми доступными способами.
Таким образом, в условиях современной химиотерапии возникает необходимость дальнейшего усовершенствования методов обнаружения микобактерий туберкулеза. В то же время обязательным условием является одновременное динамическое комплексное применение различных лабораторных способов исследования патологического материала: бактериоскопии, посева, по возможности заражения лабораторных животных. Необходимо, кроме того, использование ряда специальных методов для выявления не только классических, но и других вариантов возбудителя.
Так, применяя новые питательные среды, а также пенициллин и дигидрострептомицин, можно выделить из мокроты, спинномозговой жидкости, мочи и тканей больных туберкулезом L-формы микобактерий в виде мелких зерен и шаровидных тел.
При дифференциации типичных и атипичных микобактерий используют комплекс многих методов исследования: определяют кислотно- и спиртоустойчивость микобактерий; изучают особенности их роста при различной температуре, на отдельных питательных средах, при наличии и отсутствии солнечного света; исследуют морфологию культур и способность образовывать пигмент; устанавливают степень чувствительности к туберкулостатическим препаратам. Существенное диагностическое значение имеют некоторые биохимические тесты: амидазный и ниациновый, определение каталазной, дегидрогеназной, пероксидазной, уреазной и липазной активности и реакция восстановления нитратов. О вирулентности тех или иных штаммов микробов судят по результатам определения корд-фактора и цитохимическим тестам. Их патогенность устанавливают при заражении морских свинок, белых мышей, кроликов, кур. Эти исследования дополняются изучением антигенных структур, а также аллергическими пробами с туберкулином и сенситинами, серологическими реакциями у больных.
Определенную роль в клинике туберкулеза органов дыхания играет вторичная — смешанная — инфекция, что связано прежде всего с тем что при нем нередко отмечаются хронический бронхит и пневмония, пневмосклероз, бронхоэктазы. Эти изменения могут сопутствовать туберкулезу или становятся его осложнением, особенно при длительном течении. В том и другом случае, отмечают Н. В. Татарский и А. Я. Цигельник (1968), создаются условия для проявления активности вторичной флоры и развития ряда клинических симптомов: повышения температуры, увеличения количества мокроты, нарастания катаральных явлений в легких, амилоидоза и т. д. При бактериологическом исследовании при этом обнаруживают различного вида стрептококки и стафилококки, грамположительные и грамотрицательные кокки, кишечную палочку и т. д. Все они имеют различную степень чувствительности к отдельным антибиотикам. При этом обязательным является выделение чистых культур и определение их патогенности.
При дифференциальной диагностике туберкулеза и глубоких микозов— аспергиллеза, гистоплазмоза, актиномикоза, кокцидиомикоза, нокаридиоза, кандидомикоза и т. д. — важно не только тщательно исследовать нативные и окрашенные препараты мокроты на присутствие дрожжеподобных грибов рода Candida, Coccidoides immitis, Histoplasma capsulatum, Aspergillus fumigatus и т. д., но и производить посевы на специальные питательные среды, главным образом на среду Сабуро с агаром или без него. Положительные результаты приобретают большее диагностическое значение, если одновременно у больных выявляются кожные реакции на кокцидиоидин, гистоплазмин, аспергиллин, бластомицин и др., а также серологические реакции с соответствующими антигенами (реакция преципитации, связывания комплемента).
Диагностика туберкулеза. Принципы микробиологической диагностики туберкулеза. Выделение возбудителя туберкулеза.
Для диагностики туберкулёза применяют бактериоскопические, бактериологические, биологические, серологические и аллергологические методы, входящие в обязательный диагностический минимум. Материалом для исследований служат мокрота, отделяемое свищей, моча, СМЖ, испражнения.
Микроскопия возбудителя туберкулеза в патологическом материале. В мазках, окрашенных по Цилю-Нильсену, обнаруживают кислотоустойчивые палочки возбудителя туберкулеза.
Нередко материал содержит мало бактерий туберкулеза и для повышения вероятности их обнаружения используют методы обогащения: центрифугирование и флотацию. В первом случае исследуемый материал обрабатывают смесью растворов NaCl и NaOH, центрифугируют и микроскопируют осадок. Второй метод включает обработку материала смесью NaOH, дистиллированной воды и ксилола (или бензола). Образец энергично встряхивают; образующаяся пена всплывает и захватывает микобактерии. Пену отсасывают и готовят мазки.
Наиболее результативна люминесцентная микросколия возбудителя туберкулеза. Материал обрабатывают аурамин-родамином и бактерии окрашиваются в бело-жёлтый цвет. Для выявления L-форм применяют AT, меченные флюорохромами.
Выделение возбудителя туберкулеза
Достоинство метода — возможность получения чистой культуры туберкулеза, позволяющая её идентифицировать, оценить вирулентные свойства и определить чувствительность к ЛС. Материал засевают, тщательно втирая, на твёрдые питательные среды.
Для повышения эффективности выделения возбудителя туберкулеза и уничтожения контаминирующей микрофлоры применяют методы обогащения или обрабатывают материал 6-12% серной кислотой. Основной недостаток бактериологического метода — длительность получения результата (от 2 до 12 нед). В связи с этим разработаны ускоренные микрометоды выделения возбудителя туберкулеза.
Один из распространённых методов выделения возбудителя туберкулеза, метод Прайса, заключается в следующем. Материал помещают на предметное стекло, обрабатывают серной кислотой, отмывают физиологическим раствором и вносят в питательную среду, дополненную цитратной лизированной кровью.
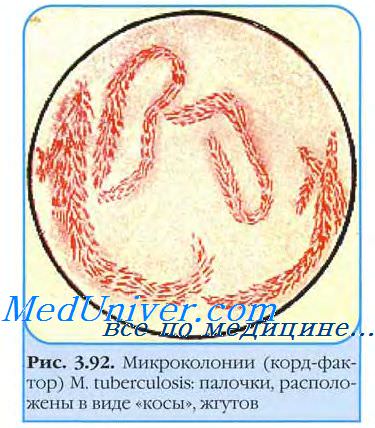
Стекло вынимают через 3-4 сут и окрашивают но Цилю-Нильсену. При микроскопии обнаруживают микроколонии микобактерии возбудителя туберкулеза. Вирулентные бактерии образуют змеевидные (рис. 22-2), а невирулентные — аморфные микроколонии. Культуры L-форм выделяют посевом в столбик полужидкой среды и инкубируют при 37 °С 1-2 мес.
Рост проявляется в виде облачка помутнения с мелкими вкраплениями. Вирулентность выделенной культуры возбудителя туберкулеза определяют заражением лабораторных животных и по наличию корд-фактора. Последний легко идентифицируют по способности микобактерии связывать нейтральный красный и нильский голубой и удерживать их после добавления щелочи. Вирулентные штаммы возбудителя туберкулеза удерживают красители, авирулентные — нет.
Читайте также:

