Анализ на определения вич в сперме
Обновлено: 18.04.2024
Внимание. При положительных и сомнительных реакциях, срок выдачи результата может быть увеличен до 10 рабочих дней.
Синонимы: Анализ крови на антитела к ВИЧ1 и 2 и антиген ВИЧ1 и 2; ВИЧ-1 p24; ВИЧ-1-антиген, p24-антиген; ВИЧ 1 и 2 антитела и антиген p24/25, ВИЧ тест-системы 4-го поколения; Одновременное качественное определение антигена р24 ВИЧ и антител к антигенам ВИЧ типов 1 и 2. Anti-HIV, HIV antibodies, human immunodeficiency virus antibodies; HIV-1 p24, HIV-1 Ag, p24-antigen; HIV-1 and HIV-2 Antibody and Antigen Evaluation; HIV Screening Tests; AIDS Test; AIDS Screen; HIV Serology.
Краткое описание исследования на Антитела к ВИЧ1 и 2 и антиген ВИЧ1 и 2
Антитела к ВИЧ могут появиться, начиная со второй недели после инфицирования; их содержание увеличивается в течение 2-4 недель и сохраняется на протяжении многих лет. У 90-95% инфицированных они появляются в первые три месяца после заражения, у 5-9% – в период от трех до шести месяцев, у 0,5-1% – в более поздние сроки. После инфицирования ВИЧ, еще до появления антител (сероконверсии), в образцах сыворотки или плазмы крови могут быть выявлены антигены ВИЧ. Структурный ядерный белок ВИЧ р24, который появляется в крови через две недели после инфицирования, исчезает только через два месяца. Тест-система 4-го поколения, с использованием которой выполняется данный тест позволяет, помимо выявления антител к ВИЧ-1 и 2, обнаруживать антиген р24 ВИЧ. Таким образом, исследование может быть информативным и до сероконверсии. Подобный подход в лабораторной диагностике ВИЧ позволяет проводить самое раннее определение инфекции. К особым характеристикам применяемого в лаборатории ИНВИТРО теста для выявления ВИЧ-инфекции стоит отнести высокую специфичность исследования: > 99,5%; 100% чувствительность анализа к антителам, характерным для периода сероконверсии, и чувствительность теста к антигену р24 порядка 18 пг/мл.
У большинства людей с антителами к ВИЧ клинические признаки заболевания (СПИД) могут не проявляться от двух до десяти лет и более. Порядок проведения лабораторного обследования на наличие антигенов ВИЧ и антител к ВИЧ строго регламентирован приказами МЗ РФ и включает в себя этап скринингового (отборочного) исследования иммуноферментными (ИФА) методами, разрешенными к использованию, и этап верификационного (подтверждающего) исследования методом иммуноблота в лаборатории городского центра СПИД.
Следует отметить, что даже лучшие диагностические ИФА-системы не имеют 100% специфичности, то есть существует некоторая вероятность получения неспецифических, ложноположительных результатов, связанных с особенностями сыворотки крови пациента. Поэтому положительный результат скринингового ИФА обследования может не подтвердиться в подтверждающем тесте, после чего пациенту выдадут отрицательный результат. При получении неопределенных результатов в подтверждающем исследовании тестирование повторяют в динамике. Рекомендуется проводить повторные исследования через 2-3 недели.
Лабораторная диагностика ВИЧ-инфекции у детей, рожденных от ВИЧ-инфицированных матерей, имеет свои особенности. В их крови до 18 месяцев с момента рождения могут циркулировать материнские антитела к ВИЧ (класса IgG). Отсутствие антител к ВИЧ у новорожденных не означает, что вирус не проник через плацентарный барьер. Дети ВИЧ-инфицированных матерей подлежат лабораторно-диагностическому обследованию в течение 36 месяцев после рождения.
С какой целью проводят исследование на Антитела к ВИЧ1 и 2 и антиген ВИЧ1 и 2
Исследование используется для выявления ВИЧ, в том числе и на доклинической стадии заболевания. Комбинированное определение специфических антител к ВИЧ типов 1 и 2 и антигена р24 ВИЧ в крови применяется в качестве анализа на наличие инфицирования вирусом иммунодефицита человека. Своевременная диагностика инфекционного процесса может предотвратить распространение вируса в популяции и позволит начать специфическую терапию в максимально короткие сроки.
Что может повлиять на результат исследования на Антитела к ВИЧ1 и 2 и антиген ВИЧ1 и 2
В редких случаях возможен ложноположительный результат, если в крови обследуемого присутствуют антитела к вирусу Эпштейна-Барр, ревматоидному фактору, главному комплексу гистосовместимости HLA или антитела после введения вакцины против ВИЧ.
ПЦР-анализ на сегодняшний день является одним из высокотехнологичных, доступных и эффективных методов молекулярной диагностики, применяемый в разных областях медицины. Чаще всего он используется для лабораторной диагностики инфекционных заболеваний человека, в том числе инфекций, передаваемых половым путём (ИППП), и выявления возбудителей урогенитальных инфекций, которые могут вызывать различные воспалительные заболевания органов мочеполовой системы у мужчин и женщин.
В этой статье речь пойдет о методе ПЦР для диагностики инфекций, передаваемых половым путем, при анализе спермы (эякулята). Какие инфекции можно определить в сперме, а какие нельзя? Какие еще материалы можно использовать для диагностики инфекций половой системы?
Среди преимуществ ПЦР как метода в сравнении с другими, традиционно используемыми для диагностики инфекционных заболеваний человека (иммуноферментный анализ, бактериологический посев, микроскопия), стоит отметить непосредственное обнаружение инфекционного агента в результате выявления специфического фрагмента ДНК или РНК возбудителя в исследуемом образце, а потому - возможность напрямую идентифицировать возбудителя инфекции, осуществлять раннюю диагностику, например, в инкубационном периоде, диагностировать заболевание не только в острой и хронической формах, но и выявлять скрытые (латентные) формы инфекций, протекающие без выраженных симптомов или бессимптомно, а также проводить скрининговые исследования, направленные как на определение уже имеющейся инфекционной патологии, так и выявление возможного носительства инфекций для оценки принадлежности пациента к группе риска.
Спектр возбудителей, выявляемых методом ПЦР, чрезвычайно широк, в связи с чем наибольшее распространение ПЦР-диагностика получила в гинекологической и урологической практике, в дерматовенерологии. Для диагностики большинства бактериальных и вирусных инфекций, выявления возбудителей ИППП, вызывающих заболевания, передаваемые половым путём (ЗППП), материалом для исследования служит, в основном, соскобное отделяемое слизистых оболочек мочеполовых органов: соскоб эпителиальных клеток из цервикального канала и поверхности шейки матки у женщин, соскоб из уретры (мочеиспускательного канала), выделения из половых органов - у мужчин и женщин. При обследовании на некоторые виды инфекций (ВИЧ, гепатиты В и С, вирус Эпштейна-Барр и др.) для анализа берут кровь. Для выявления цитомегаловирусной и герпетической инфекций можно исследовать мочу. Клиническим материалом для ПЦР-диагностики ИППП у мужчин может служить секрет предстательной железы и эякулят (сперма). В каждом конкретном случае выбор исследуемого биоматериала определяется диагностической задачей исследования.
В данной статье мы подробнее остановимся на диагностике ИППП у мужчин и возможности выявления возбудителей ЗППП и урогенитальных инфекций в эякуляте.
Инфекционно-воспалительные заболевания органов мужской репродуктивной системы могут явиться одной из возможных причин снижения мужской фертильности (способности к воспроизведению потомства), а урогенитальные инфекции их вызывающие - быть ассоциированы с мужским бесплодием.
К органам мужской репродуктивной системы относятся наружные и внутренние половые органы. К числу наружных относят половой член и мошонку. Внутренние половые органы представлены яичками с их оболочками и придатками, расположенными в мошонке, семявыносящими протоками и добавочными половыми железами, в числе которых предстательная железа (простата) - железисто-мышечный орган, охватывающий мочеиспускательный канал ниже мочевого пузыря, семенные пузырьки - парный железистый орган, расположенный над предстательной железой, и бульбоуретральные (Куперовы) железы - парные округлые железы небольшой величины, расположенные между пучками мышц мочеполовой диафрагмы. В яичках, являющихся парной половой железой, происходит образование мужских половых клеток - сперматозоидов и выработка мужских половых гормонов. Продукты секреции добавочных половых желез образуют семенную жидкость (семенную плазму, или спермоплазму), которая при смешении со сперматозоидами образует сперму. Придаток яичка (эпидидимис) тесно связан с яичком и служит резервуаром накопления спермы и созревания сперматозоидов, являясь частью семявыводящих путей. Семявыносящий проток представляет собой парный трубчатый орган, служащий для транспортировки сперматозоидов из эпидидимиса в семявыбрасывающий проток. При эякуляции (семяизвержении) происходит сокращение продольных мышечных волокон семявыносящего протока, сперматозоиды поступают в семявыносящий проток и смываются содержимым семенных пузырьков в уретру. Вклад секрета семенных пузырьков и предстательной железы в общий объём семенной жидкости составляет около 95% (примерно 35% приходится на секрет предстательной железы, 60% - на секрет семенных пузырьков), поэтому колебания объёма эякулята, в первую очередь, зависят от секрета добавочных половых желез. Тесная функциональная взаимосвязь всех органов мужской половой системы позволяет оценивать её состояние путём исследования эякулята. Среди лабораторных методов исследования анализ эякулята является важнейшим и, зачастую, - достаточным не только для оценки мужской фертильности, например, при анализе спермограммы, но и диагностики наиболее распространённых, репродуктивно значимых урогенитальных инфекций.
Наиболее частыми возбудителями инфекций мужского урогенитального тракта являются бактерии: гонококк (Neisseria gonorrhoea) - возбудитель гонореи, хламидии (Chlamydia trachomatis) - возбудитель урогенитального хламидиоза, трахомы и венерической лимфогранулемы, бледная трепонема (Treponema pallidum) - возбудитель сифилиса, микоплазмы (Mycoplasma genitalium и Mycoplasma hominis) и уреаплазмы (Ureaplasma urealyticum, Ureaplasma parvum), являющиеся инфекционными агентами воспалительных процессов в мочеполовых органах, а также простейшие, например, трихомонада (Trichomonas vaginalis) - возбудитель урогенитального трихомониаза, грибы, например, рода Candida, вызывающие урогенитальный кандидоз, и различные вирусы, среди которых вирусы простого герпеса 1 и 2 типов (ВПГ, Herpes simplex virus, HSV1 и HSV2) - возбудители генитального герпеса, цитомегаловирус (CMV), вирус папилломы человека (ВПЧ, HPV, Human papillomavirus), вирусы гепатита В (HBV), гепатита С (HCV), ВИЧ (HIV) и другие. Некоторые из перечисленных бактериальных возбудителей (гонококк, хламидии, бледная трепонема, генитальная микоплазма) являются патогенами, другие (уреаплазмы, энтерококки, стафилококки и ряд других) - принадлежат к группе условно-патогенных микроорганизмов, способных вызывать воспаление в половых органах при снижении иммунной защиты.
Вирусы и бактерии могут напрямую поражать сперматозоиды, приводя к изменению их подвижности. Так, например, известно, что Mycoplasma genitalium и Ureaplasma urealyticum, прикрепившиеся к головке и средней части сперматозоидов, негативно влияют не только на их подвижность, но и способность к оплодотворению яйцеклетки, проводимому в экспериментальных (in vitro) условиях. Повреждающее действие могут оказывать и продуцируемые микроорганизмами токсины. В ответ на инфекционный процесс развивается вторичное воспалительное повреждение, сопровождаемое образованием свободных радикалов и цитокинов, способных оказывать цитотоксическое воздействие на половые клетки. Кроме того, инфекции являются одним из факторов риска образования антиспермальных антител (АСАТ), направленных против различных частей сперматозоидов. Механизмом образования АСАТ на фоне воспалительного процесса является всё та же способность бактерий, вирусов и грибов прикрепляться к мембране сперматозоидов, вследствие чего происходит запуск аутоиммунных реакций. Присутствие АСАТ в эякуляте приводит к снижению его качественных и количественных характеристик: уменьшению концентрации и подвижности сперматозоидов, изменению морфологии половых клеток, их агглютинации, к изменению значений pH и вязкости семенной плазмы. Тем самым инфекции мочеполовых органов могут снижать репродуктивную функцию у мужчин.
Большинство возбудителей ИППП попадают в организм преимущественно половым путём. Наиболее часто инфекции выявляются у лиц молодого возраста, особенно тех, кто имеет большое число половых партнёров. При незащищенном половом акте высок риск заражения хламидиозом, гонореей, сифилисом, трихомониазом, гепатитами В и С, ВИЧ, герпесом, ВПЧ. Всего в настоящее время насчитывается более двадцати инфекций, которые передаются половым путём. Многие из них характеризуются высокой контагиозностью, а потому - быстрым распространением среди населения. К примеру, ежегодно в мире регистрируется около 90 миллионов новых случаев хламидийной инфекции, а восприимчивость к урогенитальному хламидиозу приближается к 100%. Следует помнить, что заражение ИППП может происходить при любом виде сексуальных контактов: анальном и оральном сексе, генитальном контакте без проникновения. Коварство этих инфекций заключается и в их возможности протекать без клинически выраженных симптомов. Согласно данным Всемирной организации здравоохранения (ВОЗ), 50 - 80% населения инфицировано вирусом папилломы человека, но лишь 1 - 2% лиц имеют клинические проявления этой инфекции. Бессимптомное вирусоносительство играет ключевую роль в распространении генитального герпеса: до 70% случаев передачи этого вируса и заражения им здоровых лиц происходит при бессимптомном характере болезни и наличии вируса герпеса у больного. Скрытый характер течения инфекции затрудняет возможность её выявления. Отсутствие со стороны мужчины должного внимания на появление у себя некоторых из признаков или симптомов начинающегося заболевания, несвоевременное обращение к врачу или неадекватное лечение, например, в случае предпринимаемого самолечения, могут способствовать переходу инфекции в хроническу форму и развитию хронического заболевания. Хроническую инфекцию труднее диагностировать, тяжелее лечить, к тому же последствия хронического инфекционно-воспалительного процесса в мочеполовых органах оказываются более тяжкими для мужского здоровья.
В зависимости от локализации инфекционного процесса чаще всего у мужчин развиваются уретрит (воспаление мочеиспускательного канала), цистит (воспаление мочевого пузыря), простатит (воспаление предстательной железы), эпидидимит (воспаление придатка яичка) и орхит (воспаление яичка). Острый эпидидимит может распространиться и на яички (эпидидимоорхит). Симптомы или признаки заболевания напрямую зависят от того, какой именно возбудитель инфекции попал в мужской организм и каково состояние иммунитета в целом. Наиболее частыми возбудителями инфекций, вызывающих уретрит, являются Chlamydia trachomatis, Neisseria gonorrhoea, Mycoplasma genitalium и Ureaplasma urealyticum. Среди сексуально активных молодых мужчин эпидидимит чаще вызывается Chlamydia trachomatis, Neisseria gonorrhoea и Trichomonas vaginalis. У мужчин старшего возраста и пожилых чаще обнаруживают условно-патогенную микрофлору (Mycoplasma hominis, Ureaplasma parvum и др.).
Симптомы урогенитальных заболеваний, вызываемых различными возбудителями ИППП, чаще всего не являются специфичными. При остром характере инфекционного-воспалительного процесса клиническая картина ИППП у мужчин может выражаться такими симптомами, как дискомфорт, зуд и жжение в области уретры, боль в промежности, нижней части живота и в области мошонки, болезненность при мочеиспускании (дизурия) и половых контактах (диспареуния), гиперемия и отёчность кожных покровов в области поражения, слизистые или гнойные выделения из уретры. В случае скрытой формы инфекции признаками заражения могут являться редкие, незначительные выделения из уретры. Сходство клинических проявлений многих урогенитальных инфекций вовсе не означает, что существует их одинаковое лечение, каждая инфекция требует индивидуальной медикаментозной терапии. Это диктует необходимость проведения лабораторного исследования, направленного на выявление и идентификацию возбудителей ИППП.
Одним из таких видов исследования, предлагаемых в нашей клинике для мужчин, является анализ эякулята с помощью молекулярно-биологического метода ПЦР. Исследование является скрининговым и представляет собой блок анализов ПЦР на инфекции в сперме. Предназначен для обнаружения в биоматериале специфических фрагментов ДНК основных возбудителей ИППП и урогенитальных инфекций мочеполового тракта у мужчин: Neisseria gonorrhoeae, Clamydia trachomatis, Trichomonas vaginalis, Mycoplasma genitalium, Mycoplasma hominis и Ureaplasma spp. Обследование не требует применения каких-либо инвазивных процедур, а потому может быть выполнено в кратчайшие сроки. Использование для этих целей современного высокочувствительного и высокоточного диагностического метода, каким является ПЦР-анализ, представляется в настоящее время неотъемлемой частью комплексного подхода в лабораторной оценке мужского репродуктивного здоровья.
Высокое содержание вируса в сперме людей, инфицированных ВИЧ-1, выявляют на всех стадиях заболевания, и оно соответствует содержанию вируса в плазме. Определенной зависимости между содержанием вируса в сперме и количеством CD4+-клеток в крови не выявлено. В некоторых исследованиях наблюдали корреляцию между этими параметрами; в других обнаруживали только слабую зависимость.
Изучение во времени больных, у которых произошло развитие СПИДа, показало, что концентрация вируса в сперме в большинстве случаев существенно увеличивается по мере прогрессирования заболевания. Более высокая эффективность выделения вируса из спермы по мере уменьшения количества CD4+-клеток также подтверждает эти результаты. Более того, исследование динамики во времени показало, что у большинства ВИЧ-1-инфицированных людей вирус периодически появляется в сперме, и такое периодическое появление отражает перераспределение ВИЧ-1 между спермой и кровью.
Как отмечали выше в отношении содержания вируса в плазме, появление наибольшего количества инфекционного вируса в генитальных выделениях ожидается во время острой фазы инфицирования и после появления симптомов заболевания. В этом случае риск передачи вируса увеличивается, если мужчина с симптомами заболевания или с высоким содержанием вирусной РНК вступает в гетеросексуальные или гомосексуальные контакты. Из спермы выделяются как вызывающие образование синцития (SI) варианты вируса (Х4), так и не вызывающие образования синцития (NSI) варианты вируса (R5).
Большинство найденных вирусов, по-видимому, относятся к типу R5. В некоторых исследованиях РНК ВИЧ, связанная с клетками спермы, была обнаружена более чем в 80% исследованных образцов спермы, и содержание вируса там было ниже, чем в плазме. При наличии воспаления в половых путях или заболеваний, передающихся половым путем, концентрация ВИЧ в сперме увеличивается.
Другие исследования показали, что количество ВИЧ в сперме может не зависеть от степени вирусемии в плазме. Эти данные были получены при исследовании небольшой группы мужчин с высоким содержанием вируса в крови. Концентрация РНК в жидкой части спермы была сопоставима или превосходила таковую в плазме крови. Такие люди могут быть источником активного распространения вируса.
Количество вируса, выделяемого из спермы, было выше у мужчин с небольшим количеством CD4+-клеток. Тем не менее результаты различных исследований указывают на то, что наличие инфекционных вирусов, преимущественно восстановленных из инфицированных клеток, в семенной жидкости не обязательно соответствует клиническому состоянию больного.
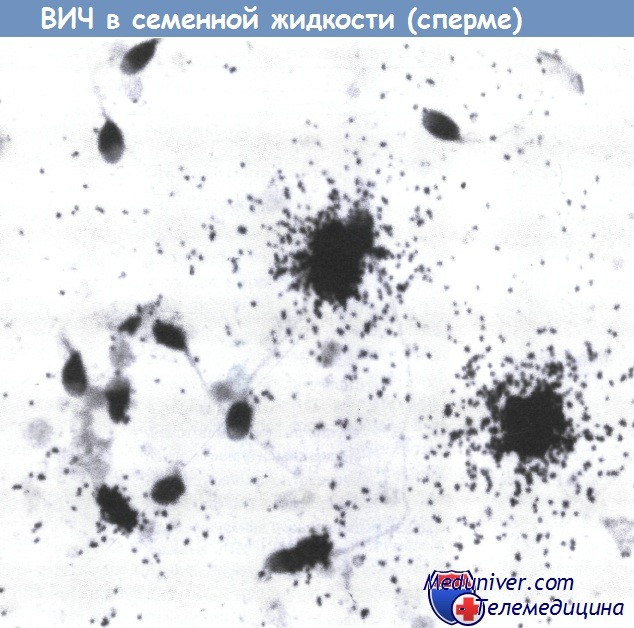
ВИЧ-инфицированные клетки, обнаруженные в семенной жидкости с помощью метода гибридизации in situ. Увеличение, х40.
Кроме того, концентрация РНК ВИЧ в сперме не коррелирует с количеством ВИЧ-специфичных CD8+ клеток. Эти и другие данные указывают на существование отдельного компартмента для ВИЧ в ткани семенников, где вирусы продуцируются некими другими клетками мужской половой системы. Существование компартмента ВИЧ-инфекции в семенниках подтверждается тем, что вирус, обнаруживаемый в сперме, не всегда совпадает по биологическому фенотипу или генотипу с вирусом, выделяемым из крови (например, R5 и Х4) у одного и того же инфицированного человека.
Кроме того, в одном исследовании было показано, что при еженедельном измерении в течение 10 недель концентрации ВИЧ у 28% исследованных мужчин вирус в сперме не удавалось определить, у других 28% пациентов вирус постоянно присутствовал в сперме, и у 44% лиц он периодически появлялся. При этом в период исследований концентрация вируса в плазме не изменялась. Сходным образом не обнаружили корреляции между вирусемией в плазме и концентрацией вируса (измеренной с помощью ПЦР с обратной транскрипцией) в сперме и слюне при одновременном исследовании всех трех жидкостей.
Очевидно прямое инфицирование или местное воспаление в различных тканях организма могут существенно влиять на количество обнаруживаемого там вируса. Реактивация цитомегаловирусной инфекции может увеличивать выброс ВИЧ в сперму. Наконец с помощью культуральных методов или ПЦР вирус находят в сперме пациентов, несмотря на проведение противовирусной терапии, даже при низком содержании вируса в плазме, вплоть до неопределяемого.
Эти данные, возможно, связаны с неспособностью некоторых лекарственных препаратов проникать через гематотестикулярный барьер и подчеркивают возможность передачи ВИЧ от инфицированного человека даже на фоне слабо выраженной вирусемии.
ВИЧ-инфицированные клетки в сперме
Очевидно, важной характеристикой генитальных выделений является наличие в них инфицированных вирусом клеток. В семенной жидкости их количество может варьировать от 0,01 до 5%. Сперма здоровых неинфицированных мужчин обычно содержит более 1 миллиона лейкоцитов/эякулят, но содержание и качественный состав клеток может существенно различаться в разные дни у одного и того же человека (D. Phillips, личная беседа).
Тем не менее ВИЧ-инфицированные клетки (>10 4 клеток/эякулят в некоторых случаях), по-видимому, являются более активным источником передачи, чем свободный инфекционный вирус. Кроме того, при наличии венерических заболеваний в семенной и вагинальной жидкостях обнаруживают значительно большее количество клеток воспалительного экссудата и, следовательно, клеток, инфицированных вирусом.
В одном исследовании ДНК провируса ВИЧ была обнаружена в клетках уретры при гонококковом уретрите, и количество зараженных клеток уменьшилось после лечения антибиотиками. К тому же в сперме, как и в крови, после длительной антиретровирусной терапии постоянно обнаруживают латентно инфицированные клетки. Необходимо выяснить их потенциальное значение в передаче заболевания.
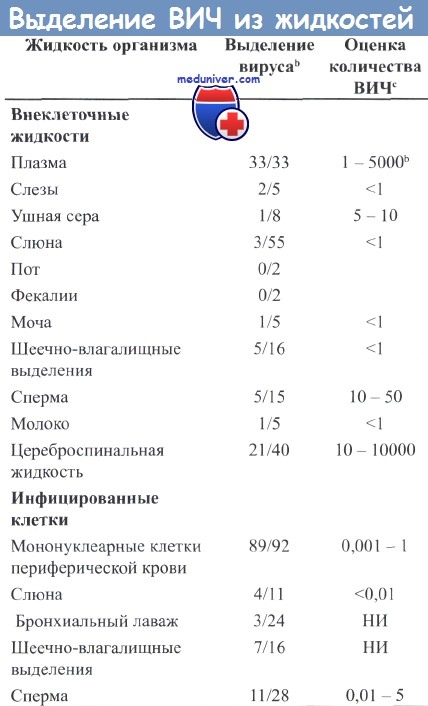
Для внеклеточных жидкостей значения соответствуют количеству инфекционных частиц на миллилитр; для инфицированных клеток значения представлены в виде процента от общего числа клеток. НИ - не известно.
b Количество случаев обнаружения инфекционных вирусов или инфицированных клеток на общее количество исследованных образцов.
с Высокое содержание соответствует симптомам развитого заболевания.
Статья посвящена исследованию современных эпидемиологических и клинических особенностей острой ВИЧ-инфекции, анализу эффективности лабораторной диагностики. Представлен обзор литературы в сопоставлении с данными собственных наблюдений за 200 пациентами с
Clinical manifestations and challenges of diagnostics of acute HIV infection in adults Yа. S. Ulyanova, E. I. Krasnova, V. V. Provorova, N. I. Khokhlova, O. V. Melnikova, I. Ya. Izvekova
The article covers the study of modern epidemiological and clinical features of acute HIV-infection, as well as analysis of efficiency of laboratory diagnostics. The literature review was presented, in comparison with the data of our own observations of 200 patients who were diagnosed with acute HIV-infection in hospital in 2017–2018. ?
Острая ВИЧ-инфекция (острый ретровирусный синдром, стадия первичных проявлений ВИЧ-инфекции) развивается после инкубационного периода, который продолжается от 3 недель до 3 месяцев после заражения. При диагностике инфекции в эти сроки предоставляется уникальная возможность для раннего начала антиретровирусной терапии (АРВТ) с целью уменьшения вирусной нагрузки, предотвращения развития прогрессирующего иммунодефицита и ограничения дальнейшего распространения инфекции в популяции. Однако диагностика острой ВИЧ-инфекции представляет определенные сложности ввиду отсутствия у нее патогномоничных симптомов, возможных отрицательных результатов иммуноблота в первые недели болезни, и часто инфекция остается нераспознанной врачами.
ВИЧ-инфекция — медленно, неуклонно прогрессирующая антропонозная болезнь, вызываемая вирусом иммунодефицита человека, с контактным механизмом передачи, характеризующаяся прогрессирующим поражением иммунной системы с развитием синдрома приобретенного иммунодефицита.
С начала пандемии ВИЧ-инфекции, т. е. в течение 40 лет, почти 78 млн человек были инфицированы, из них около 39 млн человек умерли [1]. Эпидемиологическая ситуация по ВИЧ-инфекции в Российской Федерации (РФ) в последние годы продолжает оставаться напряженной. В течение последнего десятилетия показатели заболеваемости в РФ росли: если в 2008 г. показатель заболеваемости составил 31,8 на 100 тыс. населения [14], то в 2017 г. — 61,16, в 2018 г. — 59,74 [2]. Показатель пораженности ВИЧ-инфекцией в 2018 г. составил 686,2 на 100 тыс. населения России. Регистрируется рост числа регионов РФ с высокой пораженностью населения ВИЧ-инфекцией (более 0,5% от численности населения): с 22 регионов в 2014 г. до 35 в 2018 г., при этом в них проживает более половины всего населения страны — 59,0%. К наиболее пораженным ВИЧ-инфекцией регионам относится и Новосибирская область. В 2018 г. она заняла 3-е место по уровню заболеваемости в России (135,4 на 100 тыс. населения). В 2017 г., по данным Росстата, ВИЧ-инфекция была причиной более половины всех смертей от инфекционных болезней (57,2%), умирают ВИЧ-инфицированные в молодом возрасте (в среднем — в 38 лет). Ведущей причиной летальных исходов у ВИЧ-инфицированных остается туберкулез [2].
Раннее назначение АРВТ позволяет не допустить развития оппортунистических инфекций, существенно продлить жизнь ВИЧ-инфицированного, улучшить качество жизни больного и профилактировать дальнейшую передачу инфекции [4, 6, 7, 19, 20].
Диагностика ОВИ представляет определенные сложности. Спектр типичных симптомов болезни известен, но патогномоничных среди них нет. Кроме того, в ряде случаев клинические проявления ОВИ могут значительно отличаться от типичного течения как по спектру симптомов, так и по тяжести клинических проявлений [5].
Стадия первичных проявлений ВИЧ следует непосредственно за инкубационным периодом. В это время репликация ВИЧ продолжается, и уже может быть обнаружен первичный ответ на внедрение возбудителя в виде клинических проявлений и/или выработки антител. У большинства пациентов эта стадия ограничивается лишь выработкой специфических антител без клинических признаков инфекции (бессимптомная сероконверсия), но при исследовании крови можно выявить снижение числа CD4-лимфоцитов (Т-хелперов), лейкопению, гипергаммаглобулинемию [7, 9].
Реже первичная инфекция проявляется острым ретровирусным синдромом, напоминающим симптомы гриппа, другой острой респираторной вирусной инфекции (ОРВИ) или инфекционного мононуклеоза [7]. Так, П. Г. Филиппов и соавт. (2017) отметили, что пациенты с ОВИ направлялись и поступали в инфекционный стационар со следующими клиническими диагнозами: острая кишечная инфекция, геморрагическая лихорадка с почечным синдромом, лептоспироз, корь, ОРВИ, ветряная оспа, инфекционный мононуклеоз, токсикодермия. Ни у одного из пациентов на догоспитальном этапе и в приемном отделении стационара не была заподозрена ОВИ [5].
По данным D. L. Braun и соавт. (2015) пациентам с ОВИ при первичном обращении к врачу острый ретровирусный синдром был диагностирован лишь в 38% случаев, остальным больным выставлялись диагнозы: вирусная инфекция, отличная от ВИЧ (например, инфекционный мононуклеоз, ОРВИ), — в 17%, бактериальная инфекция (например, стрептококковый фарингит) — в 6%, гастроэнтерит — в 4%, инфекция, передаваемая половым путем (например, сифилис), — в 3%, другие диагнозы — в 19% [29]. В странах Африки пациенты с ОВИ составляют 1–3% от числа пациентов, поступивших с подозрением на малярию [22].
Материал и методы исследования
В исследование было включено 200 пациентов в возрасте от 18 до 52 лет, поступивших в Государственное бюджетное учреждение здравоохранения городскую инфекционную клиническую больницу № 1 (ГБУЗ ГИКБ № 1) г. Новосибирск в 2017–2018 гг. Обследованы 104 мужчины (52%) и 96 женщин (49%). Диагноз ОВИ верифицировали на основании положительных результатов иммуноферментного анализа (ИФА) на антитела к ВИЧ при отрицательном или сомнительном результате иммуноблота, а также определения в крови количественного содержания РНК ВИЧ методом полимеразной цепной реакции (ПЦР) (вирусной нагрузки, ВН). При постановке диагноза ВИЧ-инфекции учитывалась совокупность клинико-эпидемиологических и лабораторных данных.
Результаты и их обсуждение
В результате проведенного исследования было установлено, что на догоспитальном этапе больным выставлялись различные диагнозы: псевдотуберкулез (35,0%), инфекционный мононуклеоз (14,8%), аллергический дерматит (17,0%), острая кишечная инфекция (12,6%), ОРВИ или грипп (20,6%). В инфекционном стационаре трети этих больных диагноз ОВИ был выставлен лишь по результатам лабораторного обследования, так как проявления и продолжительность имеющихся у них лихорадочного, катарального и диарейного синдромов не выходили за рамки типичных для острых кишечных инфекций или ОРВИ и лишь введенное с 2017 г. обязательное обследование на ВИЧ-инфекцию всех поступающих в ГИКБ № 1 пациентов после присоединения к ней Центра СПИДа позволило диагностировать у них ОВИ.
Манифестное течение ОВИ — неблагоприятный признак быстрого прогрессирования заболевания. В сравнительных когортных исследованиях, оценивающих течение заболевания у пациентов с бессимптомным острым периодом ВИЧ-инфекции и у пациентов с клиническими признаками острого ретровирусного синдрома или неврологическими нарушениями, развитие СПИДа наблюдалось в 4,6 раза чаще при наличии клинической картины инфекционного заболевания [10].
Исследователи отмечают разную частоту симптомов при ОВИ. D. L. Braun и соавт. (2015) выделили 17 типичных для ОВИ симптомов и признаков [29]. По их данным, лихорадка регистрировалась у 88% больных, недомогание/усталость — у 60%, фарингит — у 51%, сыпь — у 47%, лимфаденопатия — у 45%, потеря веса — у 39%, головная боль — у 37%, диарея — у 35%, ночные поты — у 34%, миалгия — у 28%, тошнота — у 26%, артралгия — у 22%, кашель — у 16%, рвота — у 12%, афтозный стоматит — у 12%, неврологические симптомы — у 11%, генитальные язвы — у 3%, повышение сывороточных трансаминаз — у 61%, тромбоцитопения — у 37%. C. S. Wong и совт. (2011) выявляли лихорадку в 91% случаев, сыпь — в 56%, диарею — в 53%, лимфаденопатию — в 41%, головную боль — в 24%, миалгию — в 44%, артралгию — в 29%, потерю веса — в 26%, анорексию — в 21%, фарингит — в 26%, кашель — в 24%, рвоту — в 18%, тонзиллит — в 12%, менингизм — в 6% случаев [23]. По нашим данным, частыми симптомами у госпитализированных в ГИКБ № 1 взрослых 200 больных с ОВИ в 2017–2018 гг. были: лихорадка (99%), экзантема (65,5%), полилимфаденопатия (54,0%). Реже регистрировались диарея (36,0%), фаринготонзиллит (23,0%), афтозный стоматит (6,5%), гепатомегалия или гепатоспленомегалия (8,5%). У 26,5% больных были выявлены вторичные заболевания: у 2 больных — сепсис, у 2 — серозный менингит, у 3 — реактивация цитомегаловирусной инфекции, у 5 — реактивация Эпштейна–Барр-вирусной инфекции, у 2 — проявления Herpes Zoster, у 12 — внебольничная пневмония стрептококковой и стафилококковой этиологии, у 5 — различные формы туберкулеза легких, у 22 — орофарингеальный кандидоз.
Таким образом, по мнению всех авторов, наиболее частым клиническим симптомом у больных ОВИ является лихорадка (88–99%), сопровождающаяся у большинства больных интоксикационным синдромом. Ее продолжительность, по нашим данным, варьировала от 2 до 32 дней (в среднем — 8,6 ± 2,93 суток). Высокая лихорадка регистрировалась у 65,0%, умеренная — у 31,0%, у незначительной доли больных она была субфебрильная (4,0%).
Почти у половины больных ОВИ отмечалась генерализованная лимфаденопатия. По нашим наблюдениям, у больных ОВИ лимфоузлы были увеличены умеренно, не спаяны с окружающими тканями, плотноэластической консистенции, кожа над ними не изменена. Более чем у трети больных отмечалась диарея, она была чаще водянистая, реже кашицеобразный стул, без патологических примесей, от 3 до 15 раз в день.
Редкими проявлениями ОВИ являются разнообразные неврологические проявления. E. Fortin и соавт. описывают двусторонний неврит зрительного нерва при ОВИ [21]. M. A. Ferrada и соавт. — лимбический энцефалит и рабдомиолиз [24]. D. L. Braun и соавт. отмечали тяжелый энцефалит, герпетический менингит, парезы (например, парез лицевого нерва, парез плечевого сплетения), длительное головокружение, острое психическое расстройство, дистальные парестезии, афазию [29], Г. А. Прянишникова — асептический менингит, менингоэнцефалит, острую воспалительную демиелинизирующую полирадикулонейропатию или синдром Гийена–Барре, дистальную сенсорную полинейропатию, нейропатию лицевого нерва [7]. Это единичные случаи при ОВИ, описанные в литературе.
Заключение
Литература
Я. С. Ульянова*
Е. И. Краснова* , 1 , доктор медицинских наук
В. В. Проворова*
Н. И. Хохлова*
О. В. Мельникова**
И. Я. Извекова*, доктор медицинских наук
* ФГБОУ ВО НГМУ Минздрава России, Новосибирск
** ГБУЗ НСО ГИКБ № 1, Новосибирск
Клинико-лабораторные проявления и сложности диагностики острой ВИЧ-инфекции у взрослых/ Я. С. Ульянова, Е И. Краснова, В. В. Проворова, Н. И. Хохлова, О. В. Мельникова, И. Я. Извекова
Для цитирования: Лечащий врач № 9/2019; Номера страниц в выпуске: 70-73
Теги: острый ретровирусный синдром, приобретенный иммунодефицит, диагностика
19498 04 Сентября
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
ВИЧ: причины появления, симптомы, диагностика и способы лечения.
Определение
ВИЧ (вирус иммунодефицита человека) – инфекционное хроническое заболевание, передающееся контактным путем, медленно прогрессирующее и характеризующееся поражением иммунной системы с развитием синдрома приобретенного иммунодефицита (СПИДа). СПИД – это финальная стадия ВИЧ-инфекции, когда из-за ослабленной иммунной системы человек становится беззащитным перед любыми инфекциями и некоторыми видами рака. Опасность представляют так называемые оппортунистические инфекции – заболевания, вызываемые условно-патогенной или непатогенной флорой: вирусами, бактериями, грибами, которые у здоровых людей не приводят к серьезным последствиям или протекают легко и излечиваются самостоятельно. При СПИДе они наслаиваются друг на друга, имеют затяжное течение, плохо поддаются терапии и могут стать причиной летального исхода.
Причины появления ВИЧ
Источником инфекции является человек, инфицированный ВИЧ, на любых стадиях заболевания. Вирус передается через кровь, сперму, секрет влагалища, грудное молоко.
Половой путь (незащищенный секс с инфицированным партнером) – доминирующий фактор распространения ВИЧ-инфекции.
Передача ВИЧ от матери ребенку может произойти на любом сроке беременности (через плаценту), во время родов (при прохождении через родовые пути) и грудного вскармливания (при наличии язвочек, трещин на сосках матери и во рту ребенка).
Высокий риск инфицирования существует при внутривенном введении наркотических веществ нестерильными шприцами, при переливании ВИЧ-инфицированной крови и ее препаратов, использовании медицинского и немедицинского инструментария, загрязненного биологическими жидкостями человека, инфицированного ВИЧ. Кроме того, опасность могут представлять органы и ткани доноров, используемые для трансплантации.

Попадая в кровоток, вирус проникает в Т-лимфоциты хелперы, или CD-4 клетки (рановидность лейкоцитов), которые помогают организму бороться с инфекциями. Т-хелперы имеют на поверхности так называемые CD4-рецепторы. ВИЧ связывается с этими рецепторами, проникает в клетку, размножается в ней и в конечном счете уничтожает ее. Со временем вирусная нагрузка увеличивается, а количество Т-хелперов снижается.
При отсутствии лечения через несколько лет из-за значительного снижения числа Т-хелперов появляются связанные со СПИДом состояния и симптомы.
Классификация заболевания
- Стадия инкубации - от момента заражения до появления реакции организма в виде клинических проявлений острой инфекции и/или выработки антител (специфических белков, продуцируемых в ответ на проникновение антигена, в данном случае – вируса).
- Стадия первичных проявлений клинических симптомов:
В дальнейшем продолжается активное размножение вируса и разрушение Т-лимфоцитов, развивается стадия вторичных изменений, для которой характерно прогрессирующее снижение веса, общая слабость, стойкое повышение температуры, озноб, выраженная потливость. Клинические проявления оппортунистических заболеваний обусловливают клиническую картину этой стадии: пациентов беспокоят кашель и одышка, тошнота, рвота, боли в животе, тяжелая диарея, кожные высыпания, сильные головные боли, снижение памяти и внимания и др.
Диагностика ВИЧ
Лабораторные методы исследования:
Скрининг (обследование здоровых людей) на ВИЧ должен быть проведен любому человеку, который считает, что может быть заражен, а также перед любой госпитализацией и операцией, всем беременным женщинам и их половым партнерам.
Обследование целесообразно проходить людям с высоким риском заражения ВИЧ, например, при наличии заболеваний, имеющих одинаковый с ВИЧ-инфекцией механизм передачи (вирусные гепатиты В и С, заболевания, передающиеся половым путем), лицам, имеющим регулярные незащищенные половые контакты, инъекционным наркоманам, детям, рожденным от матерей с ВИЧ-инфекцией, медицинским работникам, напрямую контактирующим с кровью на работе и др.
Существуют экспресс-тесты для скрининга ВИЧ, которые можно делать в домашних условиях. Для определения специфических антител/антигенов к ВИЧ (ВИЧ-1, 2, антиген p24) используют кровь, слюну или мочу. Точность любого экспресс-теста ниже, чем теста, проводимого в лаборатории.
Для стандартного скринингового обследования определяют антитела к ВИЧ 1 и 2 и антиген ВИЧ 1 и 2 (HIV Ag/Ab Combo) в крови с помощью иммуноферментного анализа (ИФА).
Внимание. При положительных и сомнительных реакциях, срок выдачи результата может быть увеличен до 10 рабочих дней. Синонимы: Анализ крови на антитела к ВИЧ1 и 2 и антиген ВИЧ1 и 2; ВИЧ-1 p24; ВИЧ-1-антиген, p24-антиген; ВИЧ 1 и 2 антитела и антиген p24/25, ВИЧ тест-системы 4-г.
Читайте также:

