Анемии при отравлении гемолитическими ядами
Обновлено: 23.04.2024
В настоящее время токсическая гемолитическая анемия является одним из самых редко встречаемых видов анемий, и, как следствие этого, одним из наименее изученных. В последнее время данная патология приобретает все большие масштабы в связи с увеличением количества профессиональных факторов отрицательного влияния на организм, как следствие развития многих видов современной промышленности. Также немаловажными провоцирующими факторами, ведущими к развитию токсической гемолитической анемии, являются загрязнение окружающей среды и выпуск новых фармацевтических препаратов. Поиск новых этиологических факторов, изучение механизмов формирования данной патологии, принципов и способов ее диагностики имеет большое значение для предотвращения развития тяжелых последствий заболевания. Негативное воздействие токсикантов на организм человека ведет к преобладанию процессов кроверазрушения над процессами кровообразования. Изучение аспектов данной проблемы имеет большое значение для сохранения здоровья населения во всем мире.

5. Леонова Е.В. Патофизиология системы крови: учеб. пособие / Е.В. Леонова, А.В. Чантурия, Ф.И. Висмонт. – Минск: БГМУ, 2009. – 128 с.
6. Bollotte A., Vial T., Bricca P., Bernard C., Broussolle C., Seve P. Drug-induced hemolytic anemia: A retrospective study of 10 cases // Rev Med Interne. – 2014. – 35(12): 779–89.
Гемолитическая анемия объединяет группу заболеваний красной крови наследственного и приобретенного характера, основным признаком которых является выраженный гемолиз. Это может быть связано с двумя причинами: 1 – с воздействием на эритроциты внешних факторов, которые либо непосредственно повреждают клетки, либо так изменяют их свойства, что эритроциты быстро разрушаются (приобретенные гемолитические анемии), 2 – с наследственными дефектами эритроцитов (наследственные гемолитические анемии) [1, с. 562].
Токсическая гемолитическая анемия – вид анемии, вызванный воздействием лекарственных препаратов или химических веществ. Возможные вещества, которые вызывают этот вид анемии: противомалярийные препараты (с хинином), металлы, нитриты, некоторые антибактериальные и противовирусные средства, змеиный яд, сульфаниламиды и другие вещества.
Доказано, что бензол, его гомологи и соединения при длительном воздействии на организм в концентрациях, превышающих предельно допустимую концентрацию, могут вызывать угнетение костномозгового кроветворения с развитием гипопластической, апластической анемии, метгемоглобинемию, гемолитическую анемию и способствовать развитию лейкозов.
Гемолитические анемии представлены большой группой разнородных по механизму и происхождению анемических состояний. Их объединяющим признаком является преобладание процессов кроверазрушения над процессами кровообразования. Кроверазрушение может происходить преимущественно внутри сосудов или вне их. Причины внутрисосудистого гемолиза: гемолитические яды, тяжелые ожоги, малярия, сепсис, переливание несовместимой крови, нарушения в работе иммунной системы, вирусные инфекции, хронический лимфолейкоз, системная красная волчанка. Внутриклеточный гемолиз происходит в некоторых внутренних органах, преимущественно в селезенке, сопровождается увеличением селезенки. Вследствие повышенного разрушения эритроцитов в крови нарастает количество непрямого билирубина. Кроверазрушение сопровождается уменьшением общего количества эритроцитов и повышением количества ретикулоцитов в крови, а также увеличением количества эритробластов в костном мозге. Уровень железа в сыворотке крови может быть повышен. При ряде нарушений характерно снижение стойкости эритроцитов, что способствует их быстрому разрушению. [2, с.67–68]
Среди анемий химической этиологии гемолитические встречаются наиболее часто. Вещества, вызывающие внутрисосудистый гемолиз, можно разделить на три группы:
1. Разрушающие эритроциты (при определенной дозе): яд змей и пауков, сульфоны, фенол, бензол, толуол, хлороформ.
2. Гемолизирующие все форменные элементы у лиц с врожденной недостаточностью Г-6Ф-ДГ: ацетилсалициловая кислота, аскорбиновая кислота, хлорамфеникол, сульфаниламиды.
3. Вызывающие иммунные гемолитические анемии: пенициллин и ряд других антибактериальных препаратов, некоторые НПВС.
Часть веществ, относящихся к первой группе, такие как бензол, толуол, хлороформ, действуют непосредственно на мембрану эритроцитов, разрушая ее. Другие – являются метгемоглобинообразователями, и развивающийся при интоксикации ими гемолиз является вторичным явлением. Особенно чувствительны к таким токсикантам лица с дефицитом глутатионредуктазы и Г-6Ф-ДГ, что объединяет их с веществами, составляющими вторую группу. Действуя в высоких дозах, препараты второй группы вызывают гемолиз и у лиц без дефектов энзимов. Таким образом, различие между группами достаточно условно.
Механизмы лекарственно-индуцированных иммунных гемолитических анемий могут быть разными. Некоторые препараты (пенициллин) ковалентно связываются с белками мембраны эритроцитов. Гемолиз развивается вследствие атаки изменённых мембран эритроцитов антителами (обычно IgG) в присутствии комплемента.
Таким образом, гаптеновый механизм развития лекарственно-обусловленных гемолитических анемий заключается в том, что лекарственное средство присоединяется к мембране эритроцита. В последующем вырабатываются аутоантитела против данного комплекса. Прямая проба Кумбса при этом положительная. При фиксации к комплексу комплемента возможно развитие внутрисосудистого гемолиза.
Иммунокомплексный механизм развития лекарственно-обусловленных гемолитических анемий заключается в следующем. Такие лекарственные препараты, как, например, хинидин, вызывают образование антител IgM. В результате образуются иммунные комплексы, оседающие на поверхности эритроцитов. После отмены лекарственных препаратов отмечается, как правило, положительная динамика.
Образующиеся антитела класса IgM или IgG часто фиксируют комплемент. При этом элиминация иммунного комплекса происходит на мембране эритроцита с его повреждением.
Также к механизмам развития лекарственно-обусловленных гемолитических анемий относится аутоиммунный. Лекарственные средства (метилдопа и др.) способны индуцировать выработку аутоантител прямого действия против эритроцитов с развитием заболевания, схожего с идиопатической АИГА с тепловыми агглютининами [3, с. 189].
Гемолитики разрушают эритроциты, и гемоглобин выходит в плазму крови. Растворенный в плазме гемоглобин способен связывать кислород в такой же степени, как и заключенный в эритроциты. Поэтому в первые часы после острого воздействия токсикантов клиническая картина гипоксии практически не выражена.
Важными элементами патогенеза острых интоксикаций гемолитиками являются:
– существенное повышение коллоидно- осмотических свойств крови (содержание белка в плазме крови возрастает с 7 до 20 %);
– ускоренное разрушение гемоглобина (в эритроцитах гемоглобин сохраняется в среднем около 100 дней, т. е. весь период жизни клетки, а в случае тяжелого гемолиза уже через сутки уровень Hb может составлять менее 30 % от нормы);
– затруднение диссоциации оксигемоглобина и, как следствие, ухудшение оксигенации тканей (одна из причин явления – существенно более низкое содержание в плазме крови, в сравнении с эритроцитами, основного биорегулятора сродства кислорода к гемоглобину 2,3–дифосфоглицерата);
– нефротоксическое действие гемоглобина, свободно циркулирующего в плазме крови [4, с.551–553].
Общий механизм гемолиза эритроцитов заключается в дезорганизации фосфолипидно-белковой структуры их мембраны. [5, с.49] Повреждающий фактор вызывает повышение проницаемости мембраны эритроидных клеток и накопление в их гиалоплазме избытка осмотически активных веществ (Na+, K+, Ca2+ и др.). Это, в свою очередь, способствует гиперосмии цитозоля. Развиваются гипергидратация и набухание эритроидных клеток. Способность эритроцитов к деформациям в синусах селезенки снижается. Плазмолемма эритроидных клеток разрушается, то есть развивается гемолиз.
Наиболее объективным критерием тяжести гемолитического процесса следует считать определение содержания свободного гемоглобина в плазме крови, концентрация которого может достигать 10 г/л и более. Гемоглобинурия обычно отмечается при концентрации свободного гемоглобина в крови 0,8 – 1,0 г/л. При этом возможно изменение окраски мочи в характерный красно-бурый цвет, вплоть до чёрного.
Определение формы гемолитической анемии на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Спленомегалия и гепатомегалия подтверждаются при проведении УЗИ печени и селезенки.
В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. У части больных отмечается положительный прямой антиглобулиновый тест: появление IgG или IgG и комплемента [6].
Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина [7, с. 30–62].
Также для постановки диагноза используются данные миелограммы. Для цитологического подтверждения выполняется стернальная пункция. При исследовании пунктата костного мозга выявляется гиперплазия эритроидного ростка.
В последнее время увеличивается роль приобретенных гемолитических анемий (как аутоиммунных, так и токсических) в связи с постоянно возрастающими антигенными, в том числе, лекарственными нагрузками. Гемолиз представляет собой преждевременное разрушение эритроцитов, приводящее к гемолитической анемии, когда активность костного мозга не может компенсировать потери эритроцитов. Этиология и патогенез преждевременного разрушения эритроцитов могут быть связаны с дефектами мембраны эритроцитов, нарушением нормальной структуры гемоглобина, дефектами ферментативных систем эритроцитов и их иммунного разрушения. Актуальными методами диагностики являются общий и биохимический анализы крови, прямой антиглобулиновый тест, исследование мочи, а также миелограмма.
Гемолитическая анемия из-за сенсибилизации к лекарствам - клиника, диагостика, лечение
Гемолитическая анемия за счет сенсибилизации к лекарственным препаратам составляет обособленную группу и хотя заболевание рассматривается как анемия за счет иммунологического расстройства, тем не менее аутоиммунная характеристика отсутствует. Болезнь развивается в результате сенсибилизации организма к лекарственным препаратам, начинается процесс расплавления крови за счет антител, которые, однако, не представляют собой антиэритроцитные аутоантитела.
Современные этиопатогенетические данные уточнили эту обособленную группу, механизм и течение которой отличаются от иммунологической гемолитической анемии.
Патогенез гемолиза за счет сенсибилизации лекарственными препаратами впервые был объяснен Ackroyd (1953—1956) на аутоиммуной почве. С тех пор был выявлен ряд иных механизмов, среди которых наиболее обоснованным представляется механизм Shulmann, выдвинувшего гипотезу о гемолитическом действии иммуных комплексов. Однако не исключается возможность, что отдельные группы лекарственных препаратов обусловливают различные механизмы сенсибилизации, а следовательно, и определенные патогенетические группы гемолитической анемии за сенсибилизации к лекарственным препаратам.
Хотя с клинической точки зрения разница между ними невелика, тем не менее иммуносерологические исследования специфичны каждой группе в отдельности.
Так, в гемолитической анемии за счет седормида, первой исследованной Ackroyd (1954—1962) сенсибилизирующий лекарственный препарат действует как гаптен, соединяется с антигенными структурами оболочки эритроцитов и образует иммуногенный комплекс. Последний обусловливает первичную иммунологическую реакцию или через короткий срок после скрытых предыдущих сенсибилизации — вторичный иммуный ответ и выработку антител.
По мнению Ackroyd антитела специфичны комплексу эритроциты+лекарственный препарат, причем подобно аутоантителам аутоиммунной гемолитической анемии, они действуют на обложенные медикаментозным препаратом гематии и определяют процесс расплавления путем нанесения поражений II типа. Неполные антитела, дающие положительную реакцию Кумбса с сывороткой антигамма, закреплены на красных кровяных тельцах, но находятся и в сыворотке; в таких условиях сенсибилизированные в пробирке данным лекарственным препаратом гематии дают косвенную реакцию Кумбса.
Однако дальнейшие исследования выявили, что этот вид гаптеновой сенсибилизации наблюдается, в основном, при продолжительном применении пенициллина (Levine и сотр., Petz и сотр.), в то время как при сенсибилизации седормидом хотя и существует гаптеновый механизм, все же антитела не имеют специфического действия в отношении комплекса лекарственный препарат + красная кровяная клетка, о чем будет говориться в дальнейшем.
При сенсибилизации к пенициллину видимо разрабатываются оба вида гаптеновой сенсибилизации, причем один — результат закрепления лекарственного препарата на гематиях, а другой — на белках плазмы. Первый вид — это тот, в котором антитела специфичны в отношении иммуного комплекса эритроцит+пенициллин, при этом антигенное свойство последнего объясняется наличием бензилпенициллоидной и безнилпенальдиевой групп.
Первая группа обусловливает иммуную реакцию с антителами IgM, однако не известно какой из этих двух антигенов создает антитела гемолитического действия. Вместе с тем доказано, что гематии, сенсибилизированные пенициллином в пробирке и затем введенные в кровообращение больного в активный период гемолиза, отличаются такой же непродолжительностью жизни, как и гематии больного.
Прижизненно гемолитические антитела - это IgG, причем их можно смыть с красных кровяных телец больного. Однако они не расплавляют эритроциты в норме, а это свидетельствует о том, что речь идет не о аутоиммунных антителах, а о антителах, специфического противопенициллинного действия, которые поражают покрытые медикаментозным препаратом красные кровяные тельца. Вот аргументы, говорящие в пользу той мысли, что сенсибилизация к пенициллину вооружает антитела не против иммунного комплекса лекарственный препарат+гематия, как это предполагал Ackroyd, а против собственно данного медикамента.
Их воздействие в пробирке, равно как и прижизненно требует неуклонного присутствия закрепленного на красном кровяном тельце медикаментозного препарата (Swanson и сотр., Levine и Redmond, Davies и сотр.).
Как отмечалось ранее, отдельные антигенные фракции пенициллина вырабатывают также антитела IgM и IgA, однако их роль в механизме расплавления крови еще не определена. В принципе результат реакции Кумбса с сывороткой антикомплемент — отрицательный, следовательно связывающий комплемент IgM не вступает в иммунные, зависимые от комплемента реакции.
Серологическая диагностика использует реакцию Кумбса с сывороткой антинонгамма (антикомплемент) (Shulmann, Croft и сотр.).
Косвенная реакция Кумбса отрицательная; тест положителен при использовании сыворотки антикомплемент, но при условии чтобы она была свеже отобранной у больного, содержавшего иммунные комплексы+комплемент; реакция положительна и в дальнейшем, после выделения лекарственного препарата, когда еще сохраняются антитела и в реакцию вводится специфическое лекарственное вещество. Слвдовательно, реакция остается положительной, поскольку в сыворотке больного сохраняются противолекарственные, закрепляющие комплемент антитела.
С патогенетической точки зрения не доказан исходно описанный Ackroyd механизм, поскольку лекарственные препараты более сродствены к белковым комплексам и антителам, чем к оболочке красных кровяных клеток. На симпозиуме по проблеме патологии путем сенсибилизации к лекарственным препаратам (Клуж-Напока) был уточнен этот механизм, который составляет методологическую основу диагноза (Берчану).
В исключительно редких случаях сенсибилизации, например хлорпропамидом, как отмечает Swisher, механизм не меняется, но противолекарственные антитела принадлежат виду IgG
Третий вид сенсибилизации — помимо механизмов Ackroyd и Shulmann — это собственно аутоиммунный тип. При этом, сенсибилизирующий медикаментозный препарат — характерным является альфаметилдопа (альдомет) — обусловливает развитие аутоантител, отличающихся непосредственным специфическим антиэритроцитным действием. При подобной сенсибилизации данный медикамент оказывает неспецифическое действие нарушения иммунологической переносимости после длительного 3—б-месячного применения. Гемолитическая болезнь развивается реже, однако аутоиммунные антитела вида антирезус, как и при генуинной аутоиммунной гемиолитической анемии, развиваются у 10—30% больных, леченных альфаметилдопа.
Серологическое диагностирование проводится так же, как при аутоиммунной гемиолитической анемии с тепловыми антителами, т.е. посредством прямой или косвенной реакции Кумбса с сывороткой антигамма, при этом реакция в пробирке, равно как и прижизненный гемолитический эффект не требуют наличия медикаментозного препарата (Feldkamp и сотр., Lobuglio и Jandl, Bakemeyer и Leddy). Явление наблюдается и после назначения иных медикаментов, в том числе L-допа, мафенаминовой кислоты и прочих, отмеченных в ниже по Swisher. Также выявлено развитие противобелковых антител.
Медикаменты, оказывающие сенсибилизирующее действие при гемолитической анемии (по Swisher)
1. Антибиотики, противобактерицидные и противопротозойные средства:
Пенициллин
Стрептомицин
Цефалотин
Цефалоридин
Стилбофен
Изониазид
Парааминосалицилат
2. Противоопухолевые и болеутоляющие препараты:
Индометацин
Фенилбутазон
Фенацетин
Мефенаминовая кислота
Флюфенаминовая кислота
3. Противосудорожные и успокаивающие средства:
Мезантонин
Дилантин
Хлорпромазин
Хлордиазэпоксид
4. Прочие медикаментозные препараты:
Хинидин
Хинин
Альфаметилдопа
Допа
Хлорпропамид
С клинической точки зрения расплавление крови — явление непродолжительное, оно исчезает с прекращением приема данного медикамента; тем не менее присутствие антител наблюдается еще долгое время. В условиях случайно проведенной давшей положительный результат реакции пренебрежение составления точного анамнеза способствует постановке ошибочного диагноза аутоиммунной генуинной гемолитической болезни.
Иногда встречаются сочетания с развитием противоядерных антител, когда наблюдаемые явления положительной РКВ объясняются тем же механизмом.
Среди отмеченных, в таблице Swisher, сенсибилизирующих препаратов значатся и некоторые антибиотики, в том числе цефалотин и цефалоридии, которые, хотя и не вызывают клиническое расплавление крови, тем не менее, непосредственно после введения медикамента, способствуют развитию гемолитических антител. Видимо речь идет об определенных неспецифических перекрестных реакциях (Maltham и сотр., Gralrrick и сотр.).
Однако следует не упускать из виду непосредственное гемолитическое действие отдельных медикаментозных препаратов в связи с их токсическим влиянием на оболочку эритроцита, особенно на внутриэритроцитную структуру. Ранее рассматривалось непосредственное действие медикаментозных препаратов на набор ферментов и на гемоглобин, у здоровых людей, равно как и их влияние у носителей ферментативных отягчений.
Наиболее важную проблему дифференциальной диагностики составляет возможность отличить гемолитическую болезнь, за сенсибилизации к медикаментозному препарату, от генуинной или вторичной аутоиммунной гемолитической анемии. Преходящий клинический характер, эриологическая взаимосвязь с медикаментом и набор серологических реакций с положительным результатом, в присутствии данного медикаментозного препарата, составляют элементы диагноза, характеризующие гемолитическую болезнь за счет сенсибилизации к медикаменту.
Преходящий характер болезни при ее известной этиологии и краткосрочном течении оправдывают хороший прогноз и в принципе не требуют специального лечения. Прекратить медикамент как противопоказанный и запретить применение иных сенсибилизирующих препаратов в целях профилактики возвратного течения гемолитического процесса.
Кортикотерапия представляется целесообразной лишь в редких случаях продолжительного наличия гемолитических аутоантител после применения альфа-метилдопа. Следует предполагать, что, в определенных случаях, подобное положение может привести к развитию аутоиммунной гемолитической анемии, приобретающей генуинный характер в результате нарушения иммунной переносимости.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Вторичная сидеробластическая анемия - анемии, вызываемые изониазидотерапией и отравлением свинцом
Вторичная сидеробластическая анемия. Наблюдения многих лет привели к заключению, что сидеробластическая анемия развивается при различных заболеваниях (ревматоидном артрите, синдроме неполноценного поглощения, карциноме, алкоголизме, лечении изониазидом, сатурнизме и пр.).
Характеристика вторичной сидеробластической анемии одинакова с описанной выше. Однако, в противоположность первичным формам, при которых клеймо болезни — кольчатые сидеробласты — остается даже после положительного терапевтического воздействия, вторичная анемия отличается восстановлением нормальных функций костного мозга по удалении причины.
Наиболее частыми формами вторичной сидеробластической анемии считаются обусловленные изониазидотерапией и отравлением свинцом.
Анемия, вызываемая изониазидотерапией
Анемия, вызываемая изониазидотерапией (ГИНК) (Бутояну, McCurdy, Wintrobe) обычно проявляется на 4—6 месяце лечения; развивается также после лечения циклосерином или пиразинамидом.
Для устранения анемии следует прекратить лечение данным медикаментом или назначить больному пиридоксин.
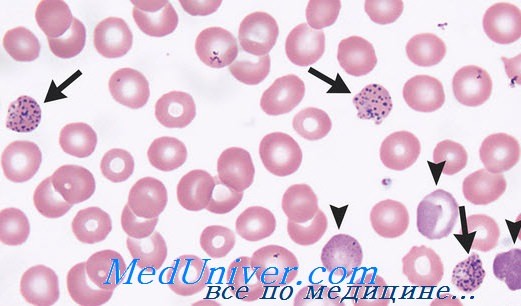
Сидеробластическая анемия от отравления свинцом
Анемия, вызываемая отравлением свинцом
Морфологическая характеристика анемии вызванной отравленим свинцом соответствует гипохромной анемии с кольчатыми сидеробластами и неполноценным кроветворением. Дополнительно отмечается и характеристика гемолитической анемии (превышающий норму ретикулоцитоз, повышенный показатель косвенного билирубина в крови и пр.) в связи с сокращением продолжительности жизни эритроцитов (Буторяну, Wintrobe).
Другая весьма важная характеристика, представляющая диагностическую ценность, заключается в базофильно-пунктированном аспекте значительного числа эритроцитов (чаще, чем при других видах сидеробластической анемии).
Диагноз анемии, обусловленной отравлением свинцом основывается на клиническую и выше описанную морфологическую картины (рези в животе, свинцовая кайма на деснах), на определение свинца в моче (нормальный показатель составляет 90 мкг/сутки), равно как и на выделение с мочой увеличенного количества дельта-аминолевулиновой кислоты (норма 3 мг/л) и копропорфирина (норма 50 мкг/сутки) (Haeger-Aronsen).
Видимо патогенез эти изменений довольно сложный. Предполагается, что свинец поражает эритробласты, оболочку эритроцитов и синтез протопорфирина.
Терапия заключается в удалении больного из загрязненной свинцом среды и назначении этилендиамина четырехуксуснокислого, как фактор, комплексирующий свинец, и тем самым способствующий его выделению (0,5—1 г/сутки).
Однако более важной представляется профилактика этого заболевания, заключающаяся в целесообразных мероприятиях охраны труда и периодическом контроле подвергающихся влиянию свинца рабочих. Периодический контроль состоит из исследования мазка периферической крови и определения показателя свинца в моче.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Токсическая гемолитическая анемия - причины, клиника, диагостика, лечение
Токсическая гемолитическая анемия (ТГА) относится к группе гемолитических анемий, обусловливаемых действием химических или медикаментозных агентов на эритроциты. С патологической точки зрения, равно как и в отношении клинических проявлений группа токсическая гемолитическая анемия не представляет собой обособленную нозологическую форму.
Тем не менее практические соображения побуждают нас рассмотреть, в отдельной статье, ряд гемолитических анемий по критерию их этиологии за счет клеточных токсических факторов.
Хотя токсическая гемолитическая анемия значительно реже иных видов гемолитических анемий (например АИГА) (Wintrobe и сотр.) в последнее время она приобретает все больший удельный вес в связи с увеличением профессиональных факторов отрицательного воздействия все растущего загрязнения среды и выпуска новых фармацевтических препаратов.
Ниже приведены этиологические факторы, способствующие развитию токсической гемолитической анемии.
Основные этиологические факторы, обусловливающие развитие токсической гемолитической анемии (ТГА):
1. Токсические для оболочки вещества:
Хлороформ, четыреххлористый углерод, бензол, толуол, тотрадецилсульфат, дигитонин, сапонин, катионное мыло, яд кобры.
2. Токсические вещества в отношении клеточных ферментов и/или гемоглобина:
Анилин, ацетанилид, нитриты, нитраты, хлораты, нитробензол, нитротолуол, фенацетин, антипирин, пирамидон, сульфонамиды, примахин, памахин, квинакрин, хинин, хинидин, нитрофурантоин, изониазид, синтетические заменители витамина К, фенилгидразин, пробенецид, хлорамфеникол, растительные вещества (Vicia faba), свинец.
В общих чертах воздействие токсических гемолитических (химических и медикаментозных) факторов на красные кроявные тельца осуществляется следующими тремя путями:
а) непосредственным действием на составные элементы клеточной оболочки;
б) взаимодействием с отдельными клеточными ферментативными механизмами и/или их чрезмерной нагрузкой;
в) иммунологическими механизмами.
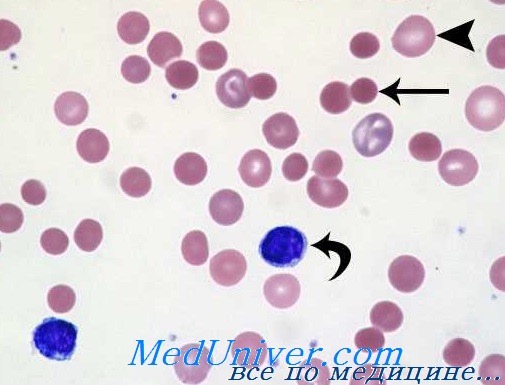
Процесс расплавления крови, вызываемый токсическими веществами оболочки прямо пропорционален дозе и длительности воздействия. Субстрат, на который действует гемолитический фактор, был уточнен в нескольких случаях (Douste-Blazy). Так, хлороформ, четыреххлористый углерод, бензол, толуол действуют на полюсные группы жировых цепей; анионовые детергенты (тетрадецилсульфат) закрепляются на цефалине; растительные вещества (дигитонин, сапонин) и отдельные катионовые мыла вступают в комбинацию с холестерином; змеиный яд (кобры) преобразовывает лецитин в лизолецитин.
Отдельные вещества вызывают расплавление крови у лиц с врожденным недостатком Г-6-ФД (Wintrobe и сотр.), в том числе, примахин, памахин, хинакрин, хинин, сульфонамиды, сульфоны, нитрофурантоин, фуразолидон, ацетанилид, фенацетин, антипирин, пирамидон, пробенецид, синтетические заместители витамина К, фенилгидразин, изониазид, хлорамфеникол, хинидин, нафталин, тринитротолуол, метиленблау, растительные вещества (фасоль "Vicia faba"). Следует отметить, что некоторые медикаментозные препараты, вызывающие метгемоглобинизанию обусловливают расплавление крови и у лиц с недостатком Г-6-ФД.
Объяснение этого явления следует искать в том, что Г-6-ФД действует в качестве донора восстановленного НАДФ для цепи реакций, нацеленных на борьбу с излишним образованием внутриклеточных окисленных соединений.
Развивающаяся при сатурнизме анемия по комплексности и специфичности обусловливающего ее механизма занимает особое место. Свинец нарушает синтез гемоглобина на всех трех основных уровнях этого процесса — угнетает синтез гема, соединение железа с протопорфирином и синтез глобина. Влияя на синтез гема блокированием активности отдельных, богатых сульфгидрильными группами митохондриальных ферментов, таких как, дегидраза дельта-амино-левулиновой кислоты (ДДАЛК) и гемсинтетаза (Albahary) свинец обусловливает нарушение метаболизма порфиринов.
Угнетение активности дегидразы ДАЛК препятствует синтезу содержащегося в последней порфобилиногена (ПБГ). Избыток ДДАЛК выделяется с мочой. Угнетение активности гемсинтетазы препятствует включению железа в протопорфирин. В таких условиях в эритроцитах скопляется значительное количество свободного протопорфирина (500—600 мкг/100 мл) (Кондаксе и сотр.), в то время как в митохондриях — нейтрализованного железа. Отравление свинцом обусловливает также выделение с мочой значительного количества копропорфирина III (1—2 мг в сутки) (Кондаксе и сотр.), видимо в связи с неиспользованием этого предшественника. Влияние свинца на глобин отражается в нарушениях, подобных наблюдаемым при легкой форме талассемии — примерно у 15% больных повышается процент гемоглобина А2 и F (Albahary).
Отравление свинцом — болезнь не редкая. Ею заболевают наборщики, типографы, красильщики, шахтеры, потребители спиртных напитков, перегоняемых в самодельных установках и пр. К ведущим клиническим признакам относятся бледность, рези в желудке и неврологические проявления (полиневрит, нарушение поведения, энцефалопатия). Гематологические признаки определяет анемия, которая носит гипохромный и слегка микроцитный характер (Wintrobe и сотр.). Отмечается наличие точечно-базофильных эритроцитов. Показатель частоты последних не связан с интенсивностью воздействия токсического вещества. Число ретикулоцитов повышено, в частности при резко развившемся отравлении.
На мазках периферической крови обнаруживаются также нормобласты, эритроциты с тельцами Жолли или кольцами Кабо. В костном мозге наблюдается эритроидная гиперплазия. В отдельных случаях отмечено наличие мнегоядерных эритробластов (Moore) или кольцевых сидеробластов (Wintrobe). Продолжительность жизни эритроцитов несколько меньше (Albahary). Интенсивность и скорость обмена железа плазмы занижены. Наблюдается рост показателя выделения желчных пигментов. Отмеченные аспекты могут подсказать мысль о неэффективности эритропоеза (Wintrobe). По мнению отдельных авторов анемию, вызываемую отравлением свинцом можно отнести к группе сидеробластических анемий (Moore).
Уточнению диагноза способствуют обнаружение высокого показателя выделения АЛК и копропорфирина III с мочой (тест разборки) и нормальной концентрации свинца в крови и моче. При скрытом отравлении, когда наличие токсического вещества в крови и моче не выявимо постановке диагноза способствует исследование протопорфирина эритроцитов, при этом нормальный уровень исключает возможность отравления (Кондаксе и сотр.). Определение свинца в моче после введения стандартного количества ЭДТА—-еще один способ уточнения диагноза (Albahary).
После введения комплексонов (БАЛ, ЭДТА) отмечается быстрая нормализация нарушенного метаболизма порфиринов, однако продолжительность жизни эритроцитов восстанавливается лишь после замены неполноценных эритроцитов нормальными (Wintrobe). Показатель гемоглобина нормализуется спустя несколько недель после назначения лечения.
Изложенное приводит к следующему выводу большого практического значения: ряд химических веществ, оказывающих токсическое влияние на красную кровяную клетку обусловливают гемолитический эффект различными механизмами. Соединения бензола и толуола вызывают метгемоглобинемию и гемолиз, а иногда и аплазию, определяя развитие процесса относительной костномозговой недостаточности. В последнем случае анемия, хотя и представляется как результат гемолитического процесса, тем не менее не сопровождается численным ростом ретикулоцитоза. Ретикулоцитоз выявляется лишь после прекращения воздействия токсического вещества и восстановления костномозговой способности вырабатывать клетки, пропорционально интенсивности анемии.
Подобно этому некоторые медикаменты, в том числе сульфонамиды, хинидин, фенацетин и пр., обусловливают расплавление крови либо посредством ферментного механизма, либо путем иммунологической агрессии.
Выявление механизма, определяющего расплавление крови путем токсических веществ составляет решающий этап в процессе уточнения терапевтического подхода. Так, например, выявление телец Гейнца подсказывает мысль о возможной анемии под влиянием окисляющих метгемоглобинизирующих токсических веществ, или о наличии скрытого недостатжа Г-6-ФД и тем самым дает соответствующее направление исследованиям.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Среди разнообразных промышленных ядов выделяют группу токсичных веществ, обладающих способностью вызывать повреждение эритроцитов, т.е. оказывать гемолитическое действие.
Гемолитические анемии — разнообразная группа заболеваний, объединяемая одним общим признаком — укорочением продолжительности жизни эритроцитов или эритрокариоцитов.
Следствием этих изменений является та или иная степень анемии, раздражение эритропоэза, ретикулоцитоз.
Гемолитические анемии делятся на наследственные и приобретенные.
Наследственные гемолитические анемии можно дифференцировать по локализации поражения: мембраны эритроцита, его ферментов, структуры гемоглобина [Идельсон Л.И., 1985].
Приобретенные гемолитические анемии разделяются по принципу уточнения фактора, вызывающего гемолиз:
- наличие антител,
- механическая травма эритроцитов,
- химические яды.
Среди последних выделяют вещества, оказывающие прямое непосредственное гемолитическое действие, выраженность которых определяется уровнем временем воздействия, путями проникновения в организм.
Приобретенные гемолитические анемии вследствие интоксикации химическими веществами.
Мышьяковистый водород:
тяжелый бесцветный газ, в производственных условиях его образование происходит при воздействии технических кислот на металлы и соединения, содержащие мышьяк.
водород, образующийся в ходе реакции, восстанавливает элементарный мышьяк, при его распаде образуется диэтиларсин, вследствие чего появляется характерный чесночный запах.
ПДК мышьяковистого водорода 0,3 мг/м3.
основной путь поступления в организм — ингаляционный
Фенилгидразин:
используют в фармацевтической промышленности для изготовления препаратов (пирамидон).
ПДК производных гидразина 0,1 мг/м3.
Толуилендиамин:
в производстве красителей и некоторых полимерных соединений.
ПДК 2 мг/м.
Гидроперекись изопропилбензола (гипериз):
катализатор в производстве полиэфирных и эпоксидных смол, каучуков, стеклопластиков и др.;
промежуточный продукт в производстве фенола и ацетона.
ПДК 1 мг/м3.
Острый внутрисосудистый гемолиз могут вызвать при приеме внутрь:
- уксусная эссенция,
- бертолетова соль,
- ядовитые грибы
- функциональными и структурными изменениям гемоглобина,
- необратимым сдвигам в липидах мембран эритроцита
- ингибированию активности сульфгидрильных групп
Патологическая анатомия
Наиболее выраженные микроскопические изменения обнаруживаются в почках, что обусловлено гемоглобин- и гемосидеринурией и скоплением больших масс распавшихся эритроцитов.
Кожа приобретает различной интенсивности желтовато-бронзовую окраску, желтушность менее выражена в более поздние сроки смерти.
Кровь имеет темно-красный цвет (действие гемолитического яда).
Отмечается различной степени выраженности отек слизистых оболочек полости рта, гортани, отек легких, вещества мозга.
В печени и селезенке - значительное отложение железа.
В случае смерти в подостром периоде, помимо отека и дистрофических изменений в нервных клетках, обнаруживаются мелкие кровоизлияния, выраженная нейронофагия.
Клиника острых внутрисосудистых гемолитических анемий при интоксикации наиболее типичным представителем этой группы – мышьяковистым водородом.
Скрытый период - 2—8 ч, хотя гемолиз начинается сразу после поступления яда в организм.
Легкие формы интоксикации АrНз характеризуются скудной клинической симптоматикой:
слабость, головная боль, тошнота, небольшой озноб; возможна легкая желтушность склер.
затем следует период прогрессирующего гемолиза:
нарастание общей слабости, головной боли,
боли в эпигастральной области и правом подреберье, в пояснице с тошнотой, рвотой, лихорадкой
моча приобретает темно-красный цвет (гемоглобин- и гемосидеринурии) - гемоглобинурия является первым признаком отравления
Как правило, при этих формах больные в стационар поступают только в случае групповых интоксикаций.
При развитии выраженного гемолиза:
Лихорадка (38—39 °С).
Кровь:
снижение кол-ва Эр и Нв,
ретикулоцитоз до 200-300%,
увеличение Эр с базоффильной зернистостью,
нейтрофильный лейкоцитоз со сдвигом влево,
иногда лимфо- и эозинопения
изменения в моче:
гемоглобинурия,
значительная протеинурия.
На 2—3-е сутки появляется желтуха, нарастает билирубинемия, на 3—5-е сутки – симптомы печеночной недостаточности (гепатомегалия, ферментемия)
В те же сроки развивается ОПН (олигурия, вплоть до анурии, азотемия с нарушением фильтрации, реабсорбции, экскреторной функции). В периоде нефропатии моча светлая, определяется только микрогематурия
При своевременном лечении отмечается регрессия симптомов почечной недостаточности и наступает период выздоровления, который продолжается от 4 до 6—8 нед.
Особенностью интоксикации АrНз является довольно длительное сохранение (иногда до полугода) некоторых нарушений:
- анемизация,
- полиневритический синдром,
- со стороны почек нарушение некоторых функциональных проб, иногда вплоть до развития пиелонефрита.
- на данных о загрязнении воздуха рабочей зоны АrНз
- характерной клинико-лабораторной симптоматике.
- имеет значение обнаружение мышьяка в биосредах и диализируемой жидкости.
В качестве антидотов к мышьяковистому водороду используют тиоловые соединения:
мекаптид 40 % раствор 1—2 мл внутримышечно до 5—7 мл/сут;
антарсин 5 % раствор 1 мл внутримышечно;
унитиол 5 % раствор внутривенно капельно на 10% растворе глюкозы от 50 до 150 мл в сутки
Для лечения гемолиза используют введение гипертонического (10—20 %) раствора глюкозы и 4 % раствора гидрокарбоната натрия для коррекции ацидоза.
- маннитола, мочевины,
- лазикса.
- полиглюкин,
- гемодез,
- кокарбоксилазу, витамины группы В.
При тяжелых формах отравления, когда наблюдаются остаточные явления интоксикации (симптомы функциональной недостаточности печени, почек, анемия), необходимо прекращение контакта с веществами гемолитического действия.
На срок переквалификации возможно пенсионирование по профессиональной группе
Читайте также:

