Anti toxo lgg что это за инфекция
Обновлено: 23.04.2024
Развёрнутый комплекс лабораторных маркёров, позволяющий оценить наличие иммунитета к потенциально опасным для плода TORCH-инфекциям, выявить острую инфекцию.
Подготовка
Содержание
В данный профиль входят следующие анализы:
Важно!
TORCH-инфекции (название образовано начальными буквами в латинских наименованиях — Toxoplasma, Rubella, Cytomegalovirus, Herpes) считаются потенциально опасными для развития ребёнка. В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2-3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
Anti-Toxo-IgG (Антитела класса IgG к Тoxoplasma gondii)
Антитела класса G к Токсоплазме гондии (Т. gondii).
Антитела класса G вырабатываются на антиген токсоплазмы при острой, подострой, хронической и латентной формах токсоплазмоза по истечении 3 - 4 недель с момента инфицирования. Антитела класса G обычно сохраняются пожизненно. Они выполняют защитную функцию и предотвращают в подавляющем большинстве случаев повторное инфицирование.
Особенности инфекции. Возбудитель — Toxoplasma gondii — относится к простейшим. Жизненный цикл возбудителя проходит внутри клеток организма-хозяина. Окончательный хозяин паразита — заражённые кошки и прочие представители семейства кошачьих выделяют с испражнениями особую форму токсоплазм — ооцисты. Ооцисты устойчивы во внешней среде. Попавшие в организм промежуточного хозяина (грызуны, птицы, скот, человек) ооцисты продолжают жизненный цикл, в мышечной и других тканях организма, где образуются псевдо- и истинные цисты.
Anti-Toxo-IgM (Антитела класса IgM к Тoxoplasma gondii)
Антитела класса М к Toxoplasma gondii.
Анти-Toxo-IgM появляются в течение 2 недель после инфицирования и могут сохраняться до года и более. Их присутствие не является, таким образом, строгим показателем острой инфекции. Но обнаружение у ранее серонегативных (то есть не имевших антител к Toxoplasma gondii) женщин при беременности анти-Toxo-IgM антител указывает на свежую инфекцию, которая может приводить к врождённому токсоплазмозу.
Особенности инфекции. Возбудитель токсоплазмоза — токсоплазма (Toxoplasma gondii) — относится к простейшим. Жизненный цикл возбудителя проходит внутри клеток организма-хозяина. Окончательный хозяин паразита — заражённые кошки и прочие представители семейства кошачьих выделяют с испражнениями особую форму токсоплазм — ооциты. Ооцисты устойчивы во внешней среде. Попавшие в организм промежуточного хозяина (грызуны, птицы, скот, человек) ооцисты продолжают жизненный цикл, в мышечной и других тканях организма, где образуются псевдо- и истинные цисты.
Anti-CMV-IgG (Антитела класса IgG к цитомегаловирусу, ЦМВ)
Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ).
В ответ на внедрение в организм цитомегаловируса (ЦМВ) развивается иммунная перестройка организма. Инкубационный период колеблется от 15 дней до 3 месяцев. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВИ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ) указывают на текущую или имевшую место в прошлом цитомегаловирусную инфекцию.
Anti-CMV-IgM (Антитела класса IgM к цитомегаловирусу, ЦМВ)
Антитела класса IgM к цитомегаловирусу (CMV, ЦМВ).
В ответ на внедрение в организм цитомегаловируса (ЦМВ) развивается иммунная перестройка организма. Инкубационный период колеблется от 15 дней до 3 месяцев. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Специфические антитела отвечают за лизис внутриклеточного вируса, а также ингибируют его внутриклеточную репликацию или распространение от клетки к клетке. Сыворотки пациентов после первичной инфекции содержат антитела, реагирующие с внутренними протеинами ЦМВ (р28, р65, р150). В сыворотке выздоровевших людей содержатся в основном антитела, реагирующие с гликопротеинами оболочки.
Наибольшее диагностическое значение имеет определение IgM, как показателя активности процесса, что может свидетельствовать об остро текущем заболевании, реинфекции, суперинфекции или реактивации. Появление анти-CMV IgM антител у ранее серонегативного пациента свидетельствует о первичной инфекции. При эндогенной реактивации инфекции IgM-антитела образуются нерегулярно (обычно в довольно низких концентрациях) или могут вообще отсутствовать. Выявление иммуноглобулинов класса G также позволяет определить первичную цитомегаловирусную инфекцию (ЦМВИ), проводить наблюдение в динамике за лицами с клиническими проявлениями инфекции и помогать при ретроспективной диагностике. При тяжелой ЦМВИ, а также у беременных и детей раннего возраста выработка антител к ЦМВ замедлена. Это проявляется обнаружением специфических антител в низкой концентрации или отсутствием положительной динамики антител.
Anti-Rubella-IgG (Антитела класса IgG к вирусу краснухи)
Индикатор наличия иммунитета к вирусу краснухи.
Антитела класса IgG к вирусу краснухи начинают вырабатываться через 3 - 4 недели с момента инфицирования и выявляются после окончания острого заболевания пожизненно, обеспечивая защиту от повторной инфекции. Выявление аnti-Rubella-IgG в концентрации менее 10 Ед/мл говорит об их недостаточном уровне для предохранения от клинических проявлений заболевания при экспозиции к вирусу краснухи или отсутствии.
Уровень аnti-Rubella-IgG более 10 Ед/мл рекомендован как показатель наличия иммунитета к данному вирусу. Определение титров аnti-Rubella-IgG в динамике (в парных исследованиях с интервалом 2 - 3 недели) используют при необходимости для подтверждения недавней инфекции вирусом краснухи (дополнительно к определению аnti-Rubella-IgМ). Достоверный рост титров IgG говорит об остроте процесса. Положительные результаты определения аnti-Rubella-IgG при тестировании пуповинной крови или крови новорожденных надо трактовать с осторожностью, поскольку специфические IgG могут передаваться плоду от матери через плаценту.
Anti-Rubella-IgM (Антитела класса IgM к вирусу краснухи)
Антитела класса IgМ к вирусу краснухи.
Определение IgM антител к вирусу краснухи используют в целях диагностики первичной инфекции вирусом краснухи (Rubella). Они могут быть обнаружены уже через 1 - 3 дня после появления клинических симптомов, и в большинстве случаев их концентрация быстро снижается за 6 - 8 недель от начала заболевания. Присутствие IgM антител к вирусу краснухи указывает на недавнюю инфекцию. Лабораторная диагностика этой инфекции у беременных женщин предпринимается для оценки риска инфицирования плода. Определение IgM важно также для диагностики врождённой краснухи у новорожденных детей.
Anti-HSV-IgG (Антитела класса IgG к вирусу простого герпеса 1 и 2 типов)
Антитела класса G к вирусу простого герпеса 1 и 2 типов (ВПГ, HSV), свидетельствующие о предшествующей или текущей инфекции вирусом простого герпеса 1 или 2 типов.
Антитела класса G вырабатываются в период хронической инфекции вирусом простого герпеса первого или второго типа.
Anti-HSV-IgМ (Антитела класса IgМ к вирусу простого герпеса 1 и 2 типов)
Антитела класса М к вирусу простого герпеса 1 и 2 типов (ВПГ, HSV). Маркёр первичного инфицирования вирусом простого герпеса.
Антитела к вирусу герпеса класса М - первые антитела, формирующиеся после инфицирования вирусом герпеса, появляющиеся в крови в течение 1 - 2 недель от начала инфекции. Антитела IgM к вирусу герпеса - преимущественно маркёр первичной инфекции. У 10 - 30% людей с реактивацией старой инфекции также могут быть обнаружены антитела класса IgM.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Определение авидности anti-Toxo-IgG антител и определение авидности anti-CMV-IgG антител даёт дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на токсоплазмоз и цитомегаловирусную инфекции, в особенности во время беременности или планировании беременности.
В лаборатории ИНВИТРО определение авидности антител класса IgG проводится в составе серологических тестов для диагностики токсоплазмоза и цитомегаловирусной инфекции
Антитела класса G к Токсоплазме гондии (Т. gondii). Антитела класса G вырабатываются на антиген токсоплазмы при острой, подострой, хронической и латентной формах токсоплазмоза по истечении 3 - 4 недель с момента инфицирования. Антитела класса G обычно сохраняются пожизненно. Они выпо.
Антитела класса М к Toxoplasma gondii. Анти-Toxo-IgM появляются в течение 2 недель после инфицирования и могут сохраняться до года и более. Их присутствие не является, таким образом, строгим показателем острой инфекции. Но обнаружение у ранее серонегативных (то есть не имевших ант.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgМ; цитомегаловирусная инфекция; ЦМВ-инфекция; специфические иммуноглобулины класса М к цитомегаловирусу. Cytomegalovirus; CMV Antibody; IgM; CMV infection; CMV-specific IgM. Краткое описание исследования Anti-CMV.
в качестве дополнительных подтверждающих тестов, которые выполняются бесплатно для пациента при выявлении комбинации результатов:
- anti-Toxo-IgG > 6 Ед/мл (больше порогового значения), anti-Toxo-IgM положительно или сомнительно;
- anti-CMV-IgG > 0,7 Ед/мл, anti-CMV-IgM положительно или сомнительно.
Подтверждение или исключение факта недавнего первичного инфицирования Toxoplasma gondii и Сytomegalovirus особенно важно при обследовании беременных женщин, поскольку риск патологии развития плода существенно увеличен при остром первичном инфицировании во время беременности, по сравнению с хронической инфекцией и реактивацией латентной инфекции. Поэтому постоянно идёт поиск новых диагностических подходов, позволяющих максимально достоверно оценить стадию и форму инфекционного процесса. Использование авидности IgG-антител в качестве индикатора срока первичного инфицирования, впервые предложенное финскими исследователями (Hedman K. M. с соавт.,1989), в настоящее время в ряде стран введено в практику серологических исследований на TORCH-инфекции. Так, во Франции, где, как и в России, проблема токсоплазмоза по-прежнему актуальна, этот тест входит в обязательный алгоритм обследования при подозрении на токсоплазмоз у беременных женщин.
Выявление в сыворотке присутствия одновременно IgG- и IgM-антител к инфекционному агенту можно трактовать как свидетельство недавнего первичного инфицирования, поскольку, как известно, срок исчезновения IgM-антител обычно составляет около 3 месяцев от начала инфекционного процесса. Но период циркуляции IgM антител может значительно варьировать в зависимости от инфекционного возбудителя и индивидуальных особенностей иммунного ответа организма. При инфицировании Toxoplasma gondii и Сytomegalovirus, следовые количества IgM-антител к этим инфекционным агентам в некоторых случаях выявляются в течение 1 - 2 и более лет.
Таким образом, их присутствие в крови беременной женщины не всегда является подтверждением первичного инфицирования в период беременности. Кроме того, специфичность даже лучших коммерческих тест-систем для обнаружения IgM-антител не абсолютна. В некоторых ситуациях, как следствие очень высокой чувствительности тестов, возможны неспецифические ложноположительные результаты. Выявление в крови высокоавидных IgG антител в этой ситуации позволяет исключить недавнее первичное инфицирование. Низкоавидные IgG-антитела, в среднем, выявляются в течение 3 - 5 месяцев от начала инфекции (это может в определённой степени зависеть от метода определения), но иногда вырабатываются и в течение более длительного срока. Само по себе выявление низкоавидных IgG-антител не является безусловным подтверждением факта свежего инфицирования, но служит дополнительным подтверждающим свидетельством в ряду остальных серологических тестов. При реактивации инфекции выявляются специфические IgG высокой авидности.
Показания к назначению теста. В комплексе серологических тестов для диагностики токсоплазмоза и цитомегаловирусной инфекции - при выявлении положительных результатов определения IgG и IgM-антител (в целях исключения или подтверждения вероятности недавнего первичного инфицирования).
Подготовка к исследованию: не требуется.
Метод исследования. В основе этих тестов лежит метод дифференциации высоко- и низкоавидных антител с помощью обработки комплексов антиген-антитело раствором мочевины, вызывающим денатурацию белка. После такой обработки связь низкоавидных антител с антигеном нарушается. Авидность IgG-антител в пробе оценивается с помощью расчётного показателя индекса авидности, который представляет собой отношение результата иммуноферментного определения концентрации IgG-антител в пробе, подвергнутой обработке мочевиной, к результату измерения концентрации IgG-антител в пробе, не обработанной диссоциирующим агентом.
Единицы измерения: результаты приводятся в виде индекса авидности.
Интерпретация результатов теста. Внимание! Фирма-производитель наборов предупреждает, что любой результат теста, особенно при обследовании беременных женщин, должен быть подтверждён при повторном тестировании.
При диагностике токсоплазмоза:
- индекс авидности anti-Toxo-IgG антител меньше 0,3 означает присутствие низкоавидных anti-Toxo-IgG антител, в этом случае нельзя исключить первичное инфицирование Toxoplasma gondii в течение последних 4 месяцев;
- индекс авидности anti-Toxo-IgG антител больше или равный 0,35 означает присутствие высокоавидных anti-Toxo-IgG антител — результат позволяет исключить первичное инфицирование Toxoplasma gondii в последние 4 месяца;
- значения индекса авидности anti-Toxo-IgG антител от 0,3 до 0,35 соответствуют пограничной авидности anti-Toxo-IgG антител в пробе.
- индекс авидности anti-CMV-IgG антител меньше 0,3 означает присутствие низкоавидных anti-CMV-IgG антител, в этом случае нельзя исключить первичное инфицирование Сytomegalovirus в течение последних 3 месяцев.
- индекс авидности anti-CMV-IgG антител больше или равный 0,3 означает присутствие высокоавидных anti-CMV-IgG антител — результат позволяет исключить первичное инфицирование Сytomegalovirus в течение последних 3 месяцев.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Антитела класса G вырабатываются на антиген токсоплазмы при острой, подострой, хронической и латентной формах токсоплазмоза по истечении 3 - 4 недель с момента инфицирования. Антитела класса G обычно сохраняются пожизненно. Они выполняют защитную функцию и предотвращают в подавляющем большинстве случаев повторное инфицирование.
Особенности инфекции. Возбудитель - Toxoplasma gondii - относится к простейшим. Жизненный цикл возбудителя проходит внутри клеток организма-хозяина. Окончательный хозяин паразита - заражённые кошки и прочие представители семейства кошачьих выделяют с испражнениями особую форму токсоплазм - ооцисты. Ооцисты устойчивы во внешней среде. Попавшие в организм промежуточного хозяина (грызуны, птицы, скот, человек) ооцисты продолжают жизненный цикл, в мышечной и других тканях организма, где образуются псевдо- и истинные цисты. Инфицирование возможно:
при употреблении в пищу не обработанных термически мясопродуктов, дегустации сырого фарша (псевдо- или истинные цисты);
при употреблении плохо промытых овощей и несоблюдении санитарно-гигиенических норм при контактах с домашними животными (ооцисты);
от матери к плоду, в случае инфицирования женщины во время данной беременности (тахизоиты, паразитирующие в макрофагах крови). При последующих беременностях плод не инфицируется.
Передача возбудителя от человека к человеку исключена! Поскольку токсопалзма ни в одной из форм не выделяется из организма человека. При инфицировании беременной в первом триместре, возможно самопроизвольное прерывание беременности; вероятность инфицирования плода составляет не более 15%, но тяжесть неврологических дефектов и риск возникновения хориоретинитов у плода выше, если инфекция возникла у женщины в первом триместре беременности. У инфицированных новорожденных врождённый токсоплазмоз часто проявляется в виде генерализованного поражения. В случае заражения в третьем триместре беременности, вероятность инфицирования плода повышается до 65%, в этом случае врождённый токсоплазмоз проявляется поздно. У лиц с нормальным иммунитетом токсоплазмоз обычно протекает без клинических проявлений (в латентной форме). При подавлении иммунитета заболевание может проявиться в острой (наиболее тяжёлой), подострой или хронической (наиболее лёгкой) формах. Для токсоплазмоза характерны: лимфаденопатия (особенно шейных лимфоузлов), лихорадка, миалгия, головная боль, реже - гепатомегалия и спленомегалия. Возможно поражение практически любой системы органов. В периферической крови выявляется анемия, лейкопения, относительный лимфоцитоз, увеличение количества эозинофилов. Острое течение токсоплазмоза у лиц со сниженным иммунитетом токсоплазмоз угрожает развитием энцефалита, менингоэнцефалита, базального арахноидита. Ведущую роль в распознавании токсоплазмоза играет лабораторная диагностика. При обследовании беременных женщин первичная инфекция определяется по увеличению титров специфических антител в 3 и более раз. Обнаружение в крови беременной специфичных IgM и нарастание титров IgG подтверждает первичное заражение токсоплазмозом. Такие беременные, независимо от наличия или отсутствия клинических проявлений, подлежат срочному лечению с целью профилактики заражения плода. Определение IgM играет решающую роль при постановке диагноза токсоплазмоза у новорожденных, поскольку специфические IgG, в отличие от IgM, могут передаваться плоду от матери. Высокая чувствительность анализа позволяет диагностировать ранние стадии заболевания, что особенно важно для пациентов с иммунодефицитами и для младенцев, у которых уровень антител в крови, как правило, очень низкий.
Важно! Токсоплазмоз входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях - Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребёнка. В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2 - 3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
Специальная подготовка не требуется. Рекомендуется взятие крови не ранее чем через 4 часа после последнего приема пищи. С общими рекомендациями для подготовки к исследованиям можно ознакомиться здесь >>.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
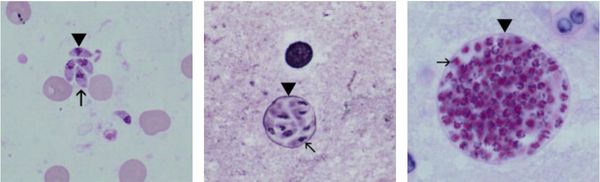
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
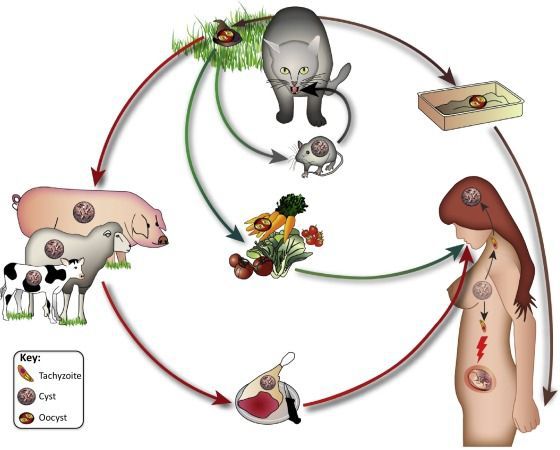
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
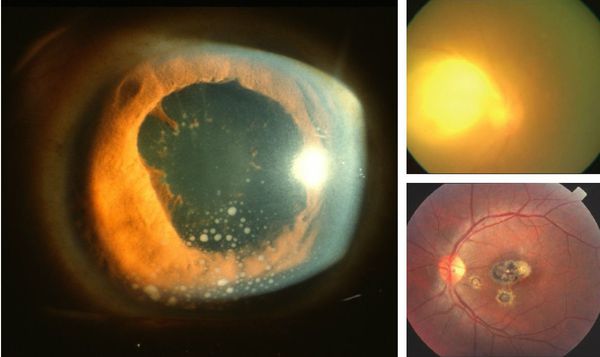
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
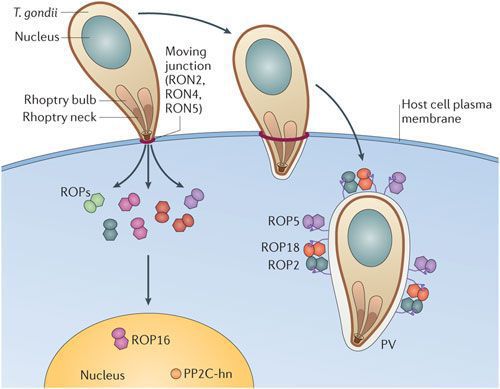
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Антитела класса G вырабатываются на антиген токсоплазмы при острой, подострой, хронической и латентной формах токсоплазмоза по истечении 3 - 4 недель с момента инфицирования. Антитела класса G обычно сохраняются пожизненно. Они выполняют защитную функцию и предотвращают в подавляющем большинстве случаев повторное инфицирование.
Особенности инфекции. Возбудитель - Toxoplasma gondii - относится к простейшим. Жизненный цикл возбудителя проходит внутри клеток организма-хозяина. Окончательный хозяин паразита - заражённые кошки и прочие представители семейства кошачьих выделяют с испражнениями особую форму токсоплазм - ооцисты. Ооцисты устойчивы во внешней среде. Попавшие в организм промежуточного хозяина (грызуны, птицы, скот, человек) ооцисты продолжают жизненный цикл, в мышечной и других тканях организма, где образуются псевдо- и истинные цисты. Инфицирование возможно:
при употреблении в пищу не обработанных термически мясопродуктов, дегустации сырого фарша (псевдо- или истинные цисты);
при употреблении плохо промытых овощей и несоблюдении санитарно-гигиенических норм при контактах с домашними животными (ооцисты);
от матери к плоду, в случае инфицирования женщины во время данной беременности (тахизоиты, паразитирующие в макрофагах крови). При последующих беременностях плод не инфицируется.
Передача возбудителя от человека к человеку исключена! Поскольку токсопалзма ни в одной из форм не выделяется из организма человека. При инфицировании беременной в первом триместре, возможно самопроизвольное прерывание беременности; вероятность инфицирования плода составляет не более 15%, но тяжесть неврологических дефектов и риск возникновения хориоретинитов у плода выше, если инфекция возникла у женщины в первом триместре беременности. У инфицированных новорожденных врождённый токсоплазмоз часто проявляется в виде генерализованного поражения. В случае заражения в третьем триместре беременности, вероятность инфицирования плода повышается до 65%, в этом случае врождённый токсоплазмоз проявляется поздно. У лиц с нормальным иммунитетом токсоплазмоз обычно протекает без клинических проявлений (в латентной форме). При подавлении иммунитета заболевание может проявиться в острой (наиболее тяжёлой), подострой или хронической (наиболее лёгкой) формах. Для токсоплазмоза характерны: лимфаденопатия (особенно шейных лимфоузлов), лихорадка, миалгия, головная боль, реже - гепатомегалия и спленомегалия. Возможно поражение практически любой системы органов. В периферической крови выявляется анемия, лейкопения, относительный лимфоцитоз, увеличение количества эозинофилов. Острое течение токсоплазмоза у лиц со сниженным иммунитетом токсоплазмоз угрожает развитием энцефалита, менингоэнцефалита, базального арахноидита. Ведущую роль в распознавании токсоплазмоза играет лабораторная диагностика. При обследовании беременных женщин первичная инфекция определяется по увеличению титров специфических антител в 3 и более раз. Обнаружение в крови беременной специфичных IgM и нарастание титров IgG подтверждает первичное заражение токсоплазмозом. Такие беременные, независимо от наличия или отсутствия клинических проявлений, подлежат срочному лечению с целью профилактики заражения плода. Определение IgM играет решающую роль при постановке диагноза токсоплазмоза у новорожденных, поскольку специфические IgG, в отличие от IgM, могут передаваться плоду от матери. Высокая чувствительность анализа позволяет диагностировать ранние стадии заболевания, что особенно важно для пациентов с иммунодефицитами и для младенцев, у которых уровень антител в крови, как правило, очень низкий.
Важно! Токсоплазмоз входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях - Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребёнка. В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2 - 3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
Специальная подготовка не требуется. Рекомендуется взятие крови не ранее чем через 4 часа после последнего приема пищи. С общими рекомендациями для подготовки к исследованиям можно ознакомиться здесь >>.
Читайте также:

