Антибактериальная терапия септического шока
Обновлено: 24.04.2024
На протяжении последних десятилетий лечение сепсиса представляет собой одну из наиболее остро стоящих проблем. Ежегодная заболеваемость сепсисом продолжает расти и только в США достигает свыше 700 тыс. случаев. Прежде всего
На протяжении последних десятилетий лечение сепсиса представляет собой одну из наиболее остро стоящих проблем. Ежегодная заболеваемость сепсисом продолжает расти и только в США достигает свыше 700 тыс. случаев. Прежде всего это связывают с изменением качественного состава возбудителей сепсиса, увеличением мультирезистентных госпитальных штаммов, а также с появлением контингента более тяжелых больных, сформировавшегося в результате значительного прогресса в лечении ранее некурабельных заболеваний (оптимизация хирургической и реанимационной техники, прогресс в трансплантологии, современные химиотерапевтические подходы в гематологии и онкологии, лечении ВИЧ-инфекции). Несмотря на появление большого количества высокоэффективных антибиотиков, летальность, связанная с сепсисом, за последние 50 лет снизилась лишь на 20% и на сегодня составляет около 40%, достигая 80–90% при синдроме полиорганной дисфункции и септическом шоке.
Классические представления о бактериемии и отдаленных пиемических очагах не отражают всей полноты развития генерализованного инфекционного процесса и являются лишь возможными клиническими вариантами течения сепсиса при определенной локализации первичного очага. Клинической интерпретацией современного взгляда на патогенез сепсиса явились критерии диагностики и классификация, предложенные на согласительной конференции Американского колледжа пульмонологов и Общества специалистов критической медицины — ACCP/SCCM (R. Bone et. al., 1992). Согласно ACCP/SCCM, сепсис определяется как системный ответ организма на инфекцию, характеризующийся четко установленной инфекционной причиной заболевания и двумя или более признаками синдрома системного воспалительного ответа (ССВО). ССВО — это патологическое состояние, обусловленное как инфекционными, так и неинфекционными причинами и характеризующееся наличием двух или более признаков: 1) температура > 38°С или < 36°С; 2) ЧСС >90/мин; 3) ЧД > 20/мин, РаСО2 < 32 мм рт. ст.; лейкоциты >12000 или < 4000 в мл и/или палочко-ядерные >10%. Тяжелым считается сепсис с органными нарушениями, гипоперфузией и/или гипотензией. Септический шок определяется как вызванная сепсисом артериальная гипотензия, сохраняющаяся, несмотря на адекватную инфузию растворов; может сочетаться с нарушением перфузии, которое проявляется в виде лактат-ацидоза, олигурии, острого нарушения сознания, но не ограничивается только этими признаками.
Фармакологические подходы к лечению сепсиса
Многочисленные иммунные нарушения, возникающие как результат воздействия инфекционного агента и проявляющиеся системной воспалительной реакцией, характеризуются активацией системы комплемента, повышенным синтезом цитокинов, метаболитов арахидоновой кислоты и других вазоактивных веществ. При системном воспалении запускаются многоступенчатые каскады иммунных реакций, происходит дисрегуляция свертывающей-противосвертывающей систем, возникает дисфункция сердечно-сосудистой системы, формируются различные варианты метаболических нарушений, в том числе предопределяющие развитие шока [1].
Сложность в определении фармакологических подходов при тяжелом сепсисе и септическом шоке заключается в комплексности данного синдрома, затрудняющей выбор тактики лечения. Необходимость комбинированной терапии диктуется проявлением собственно инфекционной нозологии, приведшей к развитию септического шока, а также формированием многочисленных синдромов, сопутствующих тяжелому сепсису.
Лекарственные средства (ЛС), назначаемые при сепсисе и патогенетически связанных с ним синдромах, могут быть разделены на три группы:
- препараты с высокой степенью доказательности, влияющие на прогноз заболевания;
- препараты, демонстрирующие позитивный симптоматический эффект без влияния на выживаемость;
- экспериментальные средства.
Единственной группой лекарственных средств, достоверно влияющих на прогноз заболевания, являются антибактериальные препараты. Из нефармакологических подходов к этой же категории можно причислить хирургические вмешательства, направленные на борьбу с инфекцией. С практической точки зрения, за исключением использования вышеперечисленных групп препаратов, терапия сепсиса предполагает применение средств, направленных на борьбу с отдельными симптомами и поддержание функции жизненно важных органов и систем (как, например, при септическом шоке адекватная инфузионная терапия и назначение вазопрессоров или искусственная вентиляция легких при дыхательной недостаточности). В свою очередь, к группе экспериментальных могут быть отнесены препараты, эффективность которых при сепсисе требует дальнейшего изучения, например глюкокортикостероиды, а также медикаментозные средства, проходящие клинические испытания, но уже продемонстрировавшие определенную клиническую эффективность (С1-эстеразный ингибитор, активированный протеин С, антитела к фактору некроза опухоли альфа и т. д.).
Антибактериальные средства
Эффективность антибактериальных средств, наблюдаемая при неосложненном течении бактериальной инфекции, значительно ограничена при тяжелом течении сепсиса. Поэтому актуальной является задача наиболее раннего и адекватного назначения антимикробных препаратов. Правила эмпирического выбора антибиотиков основываются на локализации первичного очага, определении тяжести состояния, сопутствующих заболеваний, выяснении аллергологического анамнеза.
Выявление первичной локализации процесса с высокой долей вероятности позволяет предположить возможного возбудителя. При этом правильный и своевременный забор биологического материала (кровь, моча, плевральная жидкость, биоптат и т. д.) должен быть непременным атрибутом диагностических мероприятий при сепсисе. Повысить эффективность лечения позволяет назначение антимикробных средств в наиболее ранние сроки с момента верификации бактериального процесса, что представляется возможным только при быстром и полноценном клиническом и лабораторно-инструментальном анализе состояния пациента. Учет фармакокинетических и фармакодинамических особенностей назначенной группы антибиотиков обеспечивает создание необходимой концентрации препарата в первичном очаге инфекции с минимальными нежелательными реакциями, в особенности у пациентов с тяжелым течением заболевания и синдромом полиорганной дисфункции (табл. 1).
Лекарственные средства,влияющие на систему свертывания крови
Разнонаправленные изменения и разнообразные варианты дисфункций в системе гемостаза при сепсисе затрудняют создание единых алгоритмизированных рекомендаций и требуют максимально полноценной клинико-лабораторной и инструментальной оценки состояния пациента. При прогрессировании патологии наряду с нарушениями в синтезе и потреблении факторов свертывания возникают тромбоцитопения и признаки диссеминированного внутрисосудистого свертывания (ДВС). Подозрение на развитие ДВС-синдрома требует неотложного начала терапевтических мероприятий (табл. 2).
Лекарственные средства, влияющие на выраженность системной воспалительной реакции
Данные, указывающие на способность глюкокортикостероидов (ГКС), с одной стороны, улучшать функцию сердечно-сосудистой системы за счет увеличения синтеза β-адренорецепторов и катехоламинов, с другой — модулировать иммунный ответ, угнетая агрегацию и адгезию лейкоцитов, а также уменьшая активацию системы комплемента, создают теоретические предпосылки к их использованию при сепсисе [3]. Кроме того, любой тяжелый стресс для организма (хирургическое вмешательство, травма, тяжелое инфекционное заболевание) активирует гипоталамо-гипофизарную систему, тем самым увеличивая синтез кортизола. Поэтому в случае даже относительной надпочечниковой недостаточности ГКС рассматриваются как возможный вариант заместительной терапии. Основываясь на результатах клинических исследований, применение ГКС можно рекомендовать при септическом шоке только пациентам с признаками надпочечниковой недостаточности по результатам кортикотропинового теста (концентрация кортизола крови > 9 мг/дл после введения кортикотропина). Положительный эффект от назначения ГКС описан при применении 50 мг гидрокортизона каждые 6 ч в комбинации с флудрокортизоном в дозе 50 мг/сут на протяжении 7 дней [4].
Одним из наиболее перспективных на сегодняшний день направлений в лечении тяжелого сепсиса и септического шока является воздействие на систему комплемента, так как ее чрезмерная активация приводит к тяжелому системному воспалению, повышению проницаемости капилляров и деструкции тканей [5]. Классический способ активации осуществляется через С1 фактор системы комплемента. С1-эстеразный ингибитор является единственным из известных ингибиторов С1s и С1r — компонентов классического способа активации комплемента и инактиватором факторов свертывания XII, XIa и калликреина. Несмотря на то что С1-эстеразный ингибитор является белком острой фазы, у пациентов с тяжелым сепсисом или септическим шоком наблюдается абсолютная и функциональная недостаточность С1-эстеразного ингибитора при сепсисе, связанная с его повышенным расщеплением и потреблением как в системном кровотоке, так и в очаге воспаления [6]. Назначение высоких доз экзогенного С1-эстеразного ингибитора предполагает торможение как локального, так и системного воспаления, а также стабилизацию гемодинамики в связи уменьшением проницаемости капилляров [7]. Результаты нескольких слепых плацебо-контролируемых клинических испытаний подтвердили безопасность раннего назначения высоких доз С1-эстеразного ингибитора (до 12 000 ЕД в течение 2 сут), а также выявили положительное влияние препарата на скорость восстановления почечной функции у пациентов с сепсисом или септическим шоком, уменьшение полиорганных проявлений, выражавшихся в снижении индексов тяжести ряда шкал (LOD, SOFA). Кроме того, в ходе обсервационных исследований отмечалась позитивная тенденция, выразившаяся в уменьшении смертности пациентов, получавших С1-эстеразный ингибитор. Таким образом, раннее назначение С1-ингибитора позволяет избежать нежелательных последствий системного воспаления [8] и улучшить прогноз у пациентов с сепсисом или септическим шоком, у которых традиционная терапия оказалась неэффективна [9, 10, 11].
Коррекция гемодинамических расстройств при сепсисе и септическом шоке
Своевременная коррекция артериальной гипотензии позволяет восстановить тканевую перфузию, поддержать гомеостаз и улучшить прогноз при шоке любого происхождения. Терапия, проводимая с использованием принципов стратегии, получившей название EGRT (early-goal related therapy), продемонстрировала, что эффективная коррекция перфузионных нарушений при тяжелом сепсисе возможна только при раннем применении инвазивного гемодинамического мониторинга (измерение центрального венозного давления, давления заклинивания легочной артерии, сатурации центральной венозной крови). Среди ключевых мишеней терапии рассматриваются сатурация центральной венозной крови и уровень гематокрита, значение которых уже на ранних стадиях тяжелого сепсиса позволяет выделить лиц с миокардиальной дисфункцией и высоким риском перфузионных нарушений. Необходимость поддерживать показатель центральной венозной сатурации на уровне более 70% требует инотропной терапии добутамином (добутрекс, добутамин cолвей, добутамин лахема 250) и больших объемов инфузии у пациентов в группе риска. Данная тактика способствует ранней отмене вазопрессоров, сокращению сроков искусственной вентиляции легких, оптимизирует пред- и постнагрузку, улучшает сердечную сократимость и достоверно снижает смертность у пациентов с тяжелым сепсисом и септическим шоком [12].
Базисом для проведения традиционной интенсивной фармакотерапии септического шока являются инфузионные растворы, препараты с инотропной и вазопрессорной активностью. По различным рекомендациям, первоначально требуемый режим дозирования кристаллоидов для пациентов с септическим шоком составляет 6–10 л за первые 24 ч, а для коллоидов колеблется от 2–4 л за первые сутки [13]. Прирост сердечного индекса (СИ) при данном темпе инфузии достигает 25–40% [14]. Если ранее осуществлявшаяся инфузия не привела к повышению сократительной функции левого желудочка и СИ по-прежнему составляет менее 2,5 л/мин/м2, целесообразно применение инотропных средств. Препаратом выбора в данной ситуации является добутамин (табл. 3) [15]. При использовании добутамина у пациентов с септическим шоком необходимо учитывать его β2-агонистические свойства, в то время как комбинация с вазопрессорами, в частности с норадреналином, позволяет избежать вазодилатации.
Комплексность патологических реакций значительно усложняет лечение сепсиса. Несомненно, активное изучение патогенеза заболевания будет способствовать формированию новой стратегии в современной фармакотерапии сепсиса.
И. Б. Лазарева, кандидат медицинских наук
А. А. Игонин, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва
Ингибиторы циклооксигеназы при сепсисе. Антибактериальная терапия при сепсисе.
Арахидоновая кислота, входящая в состав липидов, при своем распаде образует эйкосаыоиды: тромбоксан (Тх А2), простагландины (PGE2), простациклин (PGI2), токсичные кислородные радикалы (ОН-, 2-). Совокупность действия эйкосаноидов выражается в повышении проницаемости клеточных мембран, образовании микротромбов, развитии воспалительной реакции, высвобождении эндогенного вазоконстриктора эндотелина, способствующего спазму легочных сосудов. К препаратам, способным ингибировать действие циклооксигеназы, относятся нестероидные противовоспалительные средства кеторолак (90 мг в сутки), диклофенак (150 мг в сутки).
Антагонисты опиоидных рецепторов
Установление роли опиоидных пептидов в патогенезе септического шока (возбуждение ц- и 5-рецепторов) послужило основанием для применения антагонистов опиатов. Применение налоксона способствуем увеличению артериального давления и снижению уровня лактата крови. В комплексе интенсивной терапии септического шока налоксон вводится в дозе 0,4-1,2 мг.
Антибактериальная терапия
Применение рациональной антибактериальной терапии является важным, но не первоочередным направлением в интенсивной терапии септического шока, т. к. направлено только на тех возбудителей, которые поступают в кровоток и существенно не влияют на первичный септический очаг.
Трудности подбора антибиотика в первые часы развития септического шока диктует необходимость применения эмпирической антибактериальной терапии с использованием препаратов с максимально широким спектром действия. Примечательно, что в случае высокой чувствительности возбудителя к антибактериальному препарату, выживаемость больных с септическим шоком возрастает в три раза.
Препаратами выбора при септическом шоке являются карбапенемы (имипинем, меронем), что связано с их ультрашироким спектром действия, низким уровнем приобретенной резистентности и возможностью использования у больных с синдромом мультиорганной дисфункции.
Многочисленными исследованиями установлено, что клиническая эффективность имипинема и меронема в равных суточных дозах одинакова, а монотерапия этими препаратами не уступает режиму комбинированной антибактериальной терапии (цефатоспорины III поколения + аминогликозиды 3 поколения + метронидазол, фторхинолоны + метронидазол).
Применение имипинема, в отличие от меронема, ограничено (особенно у больных с патологией ЦНС) возможностью развития судорожного синдрома, поэтому при инфекционном поражении ЦНС использование имипенема противопоказано.

Меронем назначается внутривенно болюсно с интервалом 8 часов, имипенем только в виде инфузии в течение 60 минут с интервалом 6-8 часов. Суточная доза меронема составляет 3,0 г, имипенема - 4,0 г.
Сочетание цефалоспоринов III поколения (цефтриаксон, цефоперазон) с аминогликозидами 3 поколения (амикацин, нетилмицин) показано при развитии на фоне септического шока ОПН, особенно в случае перитонеальной локализации септическго очага, т. к. цефтриаксон и цефоперазон выводятся из организма преимущественно с желчью, а введение аминогликозидов однократно в максимальной суточной дозе значительно снижает put нефротоксичности.
Цефтриаксон вводится внутривенно в дозе 30 мг/кг с последующими инъекциями по 1-2 г через 12 часов, цефоперазон - по 3 г каждые 6-8 часов. Максимальная суточная доза для амикацина составляет 15 мг/кг, для нетилмицина - 6 мг/кг.
При септическом шоке, развившемся на фоне панкреонекроза, показана комбинация ампициллина, гентамицина и метронидазола.
В случае анаэробного компонента инфекции (абдоминальный, акушерский урологический септический шок) целесообразна комбинация цефалоспоринов IV поколения (цефепим) с метронидазолом или клиндамицином (1 г 2-3 раза в сутки). Указанная комбинация обладает высокой антибактериальной активностью, широким спектром действия, минимальным количеством резистентных к ней P. aeruginosae, высокой устойчивостью к бета-лактамазам и по эффективности сопоставима с монотерапией карбапенемами.
Цефепим вводится внутривенно в дозе 2 г с последующими инъекциями по 1-2 г через 12 часов, метронидазол по 100 мл каждые 8 часов, клиндамицин - по 1 г через 6 часов.
Антибактериальная терапия септического шока, вызванного пневмонией тяжелого течения, проводится в зависимости от характера пневмонии.
При внебольничной пневмонии препаратом выбора являются цефалоспорины III поколения с макролидами. Указанная комбинация практически полностью перекрывает весь спектр возбудителей внегоспитальной пневмонии тяжелого течения.
Особенностью нозокомиальной пневмонии в ОРИТ является то, что она, как правило, развивается на фоне профилактического применения антибиотиков широкого спектра действия, а также у больных, находящихся на ИВЛ.
Развитие септического шока у больных с пневмонией, не получавших ранее антибактериальной терапии или находящихся на ИВЛ менее 5 суток, требует назначения цефалоспоринов III поколения без антипсевдомонадной активности (цефотаксим, цефтриаксон) или фторхинолонов (ципрофлоксацин, офлоксацин) в сочетании с аминогликозидами, а в случае их неэффективности - карбапенемов.
При развитии септического шока у больных на фоне предшествующей терапии антибиотиками или у больных, находящихся на ИВЛ более 5 суток, показано назначение антипсевдомонадных цефалоспоринов (цефаперазон, цефпирамид, цефтазидим) с аминогликозидами 3 поколения.
Септический шок, развившийся на фоне пневмонии с нейтропенией (количество нейтрофилов менее 500 в мкл), требует включения в комплекс интенсивной терапии сочетания цефалоспоринов III IV поколении с аминогликозидами 3 поколения, а в качестве резерва возможно использование тикарциллина или штерациллина с аминогликозидами.
При развитии урологического септического шока целесообразно использовать сочетание цефтриаксона (а при высоком риске синегнойноп инфекции - цефоперазона) с амикащшом.
Антибактериальная терапия менингококкового септического шока должна начинаться параллельно с мероприятиями по стабилизации показателей гемодинамики и нормализации газообмена. Средством выбора антибактериального лечения менингококкового септического шока является бензилпенициллин, т. к. Neisseria meningidis обладает высокой чувствительностью к этому препарату. Бензилпенициллин вводится внутривенно в дозе 200-500 тыс. Ед/кг в сутки.
При использовании больших доз бензилпенициллина или других антибактериальных препаратов, обладающих бактериоцидным эффектом, явления эндогенной интоксикации нередко стремительно нарастают, что получило название синдрома Яриша-Герцгеймера (увеличение концентрации эндотоксина в крови за счет выхода липополисахаридов из разрушенной микробной стенки).
С целью избежания подобной ситуации целесообразно использовать антибактериальные препараты, обладающие не бактерицидным, а бактериостатическим эффектом. В частности, левомицитина сукцинат, который при менингококков ом септическом шоке вводится в дозе 3,0-4,5 г в сутки.
В случае посттравматического или послеоперационного менингита, осложненного септическим шоком, препаратами выбора являются цефалоспорины III поколения в комбинации с ванкомицином, а в качестве альтернативы - комбинация меронема с ванкомицином.
Следует помнить, что некоторые препараты (гипертонические раствора глюкозы, ГКС) уменьшают проникновение антибиотиков через гематоэнцефалический барьер, а другие (кофеин, эуфиллин), наоборот, увеличивают.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
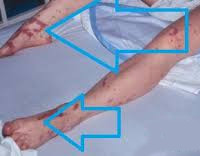
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
- Не страдавший какой-либо патологией мужчина 32 лет заболевает острым респираторным заболеванием, на этом фоне получает физическую травму. Через несколько часов у него появляется потрясающий озноб, гипертермия, затем резкое падение артериального давления, и больной госпитализируется в стационар в состоянии некупируемого шока. На аутопсии макроскопически какой-либо патологии не выявлено. При гистологическом исследовании в сосудах микроциркуляторного русла печени, селезенки, почек, легких обнаружены скопления стафилококка.
- Девушка 15 лет, после кратковременной гипертермии поступила в стационар в состоянии некупируемого шока. На аутопсии обнаружена перфорация матки после внебольничного аборта, с незначительной местной воспалительной реакцией. При гистологическом исследовании, также как и в первом примере, обнаружены скопления стафилококка в сосудах микроциркуляторного русла.
Таким образом, сепсис протекает по-разному у лиц с отягощенным и неотягощенным преморбидным фоном, поэтому патогенез и танатогенез у этих двух групп больных принципиально различается и предложенная консенсусом концепция развития сепсиса (ССВР → сепсис → тяжелый сепсис → септический шок → рефрактерный септический шок → полиорганная недостаточность) не состоятельна, поэтому мы предлагаем свою концепцию генеза сепсиса (рис.) в зависимости от преморбидного фона.
В настоящее время в лабораторном подтверждении диагноза наибольшее значение предается уровню прокальцитонина. Действительно, прокальцитониновый тест у больных сепсисом, подтвержденным выделением гемокультуры и/или ПЦР, был положительным у 86,7% больных (10 и более нг/л). У больных с тяжелым течением инфекции, при отрицательных результатах бактериологического исследования и ПЦР прокальцитониновый тест был положительным у 43,7% больных. Полученные данные позволяют рассматривать этот тест как критерий тяжести инфекционного процесса. При эффективной антибактериальной терапии уровень прокальцитонина в течение 2–3 суток резко снижается, что позволяет его использовать как надежный критерий эффективности антибактериальной терапии. Для лабораторного подтверждения диагноза сепсиса мы по-прежнему, прежде всего, придаем значение выделению гемокультуры возбудителя, что позволяет определить чувствительность возбудителя к антимикробным препаратам, а также проводить мониторирование динамики чувствительности возбудителя. Недостатками метода являются: отрицательный результат при начатой антибактериальной терапии, возможность экзогенного загрязнения, возможность транзиторной бактериемии. Для повышения эффективности бактериологического метода следует исследовать содержимое гнойных очагов (содержание пустул, пунктата гнойных очагов, спинномозговой жидкости, мочи, мокроты и т. д.). Важнейшую роль в подтверждении диагноза сепсиса имеет ПЦР, которая обладает 100% специфичностью, позволяет определить интенсивность бактериемии (микробную нагрузку), получить положительный результат в первые 1–2 суток лечения антибиотиками. Отрицательный результат ПЦР при выделении гемокультуры свидетельствует об экзогенном загрязнении. При обследовании 40 ВИЧ-инфицированных больных со стафилококковым сепсисом мы во всех случаях получили положительный результат ПЦР, причем микробная нагрузка варьировала от 8 × 10 2 до 1,38 × 10 5 .
Лечение сепсиса должно быть комплексным и включать антибактериальную, детоксикационную терапию, иммунотерапию, интенсивную терапию и реанимацию, нутритивную поддержку, по показаниям — хирургическое вмешательство, профилактику и лечение дисбиоза.
Подробные рекомендации по антибактериальной терапии даны в практических руководствах по сепсису [20, 21]. Следует остановиться только на отдельных аспектах проблемы. Во-первых, антибактериальная терапия должна проводиться поэтапно. Целью первого этапа является купирование бактериемии, что достигается постоянным поддерживанием высоких концентраций препарата в крови (минимальные промежутки между введением разовых доз препарата или непрерывное капельное введение). После купирования бактериемии стоит задача эрадикации возбудителя из септических очагов, где его биодоступность значительно ниже (воспалительный инфильтрат, биопленка на поверхности колонии возбудителя), поэтому интервалы между введением препарата и разовые дозы следует максимально увеличить [6]. При этом в крови достигаются пиковые концентрации препарата и происходит его пассаж в септический очаг. В качестве этиотропного средства не следует забывать о бактериофагах (стафилококковый, пиофаг и другие). Особенно эффективно применение индивидуальных фагов, полученных против культуры возбудителя, выделенной у больного. Важно то, что бактериофаги не обладают побочным действием и не имеют противопоказаний для применения. Иммунотерапия включает специфические (антистафилококковый иммуноглобулин) и неспецифические иммуноглобулины. При этом следует иметь в виду, что большинство препаратов иммуноглобулинов содержат IgG, которые обладают преимущественно протективным действием. Кроме того, они при избыточном введении блокируют рецепторы иммунокомпетентных клеток и подавляют продукцию собственных антител, обладающих большей овидностью к возбудителю. Эффективен только пентаглобин и его аналоги, в меньшей степени нормальный человеческий иммуноглобулин, которые содержит IgM. Важное значение имеет детоксикация, особенно экстракорпоральная. Наиболее эффективна ультрафильтрация плазмы. Хирургическая санация доступных септических очагов является важным звеном в комплексном лечении сепсиса, хотя не гарантирует полного эффекта. Методы интенсивной терапии, искусственная вентиляция легких снижают летальность при наиболее тяжелой молниеносной форме сепсиса. Интенсивность катаболических процессов, невозможность или малая эффективность, из-за ферментативной недостаточности энтерального питания, требуют полноценного парентерального питания с использованием расчетных доз белковых, аминокислотных, липидных, углеводных растворов, витаминов. Массивная антибактериальная терапия вместе с нарушениями питания приводит к развитию тяжелого дисбиоза кишечника и требует применения с первых дней лечения пробиотиков, не подверженных действию антибактериальных препаратов.
Рациональная комплексная терапия сепсиса приводит к резкому снижению летальности, хотя она остается достаточно высокой (10–20% и выше) [24–26].
Приведенные сведения свидетельствуют о необходимости дальнейшего изучения всех аспектов проблемы сепсиса, особенно патогенеза, диагностики и лечения.
Литература
Ю. Я. Венгеров*, доктор медицинских наук, профессор
М. В. Нагибина* , 1 , кандидат медицинских наук
А. П. Угринова*
А. П. Сафонова**
С. В. Матосова**
Т. С. Свистунова***, кандидат медицинских наук
О. Ю. Шипулина**
Т. М. Коваленко***
Т. Н. Молотилова***
Д. В. Чернышов***
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
** ФБУН ЦНИИЭ Роспотребнадзора, Москва
*** ГБУЗ ИКБ № 2 ДЗМ, Москва
Читайте также:

