Антибиотики для профилактики инфекционных осложнений
Обновлено: 19.04.2024
Кафедра реконструктивной хирургической стоматологии и имплантологии факультета последипломного образования Московского государственного медико-стоматологического университета
Кафедра реконструктивной хирургической стоматологии и имплантологии факультета последипломного образования Московского государственного медико-стоматологического университета
Кафедра реконструктивной хирургической стоматологии и имплантологии факультета последипломного образования ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова" Минздрава РФ
Антибиотикопрофилактика при хирургических стоматологических вмешательствах
Журнал: Российская стоматология. 2012;5(4): 25‑28
Ломакин М.В., Солощанский И.И., Дружинин А.Е. Антибиотикопрофилактика при хирургических стоматологических вмешательствах. Российская стоматология. 2012;5(4):25‑28.
Lomakin MV, Soloshchanskiĭ II, Druzhinin AE. Antibiotic prophylaxis during surgical stomatological interventions. Russian Stomatology. 2012;5(4):25‑28. (In Russ.).
Кафедра реконструктивной хирургической стоматологии и имплантологии факультета последипломного образования Московского государственного медико-стоматологического университета
В настоящей статье дается определение и цель антибиотикопрофилактики в хирургии, представлены современные сведения о профилактике развития послеоперационных инфекционно-воспалительных осложнений. Рассматриваются три схемы профилактического использования ингибиторзащищенного аминопенициллина при удалении ретенированных дистопированных третьих нижних моляров, дентальной имплантации, синус-лифтинге с антропластикой в различных по объему операциях и клиническим условиям ситуациях. Обсуждается возможность снижения риска возникновения послеоперационных инфекционно-воспалительных осложнений в хирургической стоматологии.
Кафедра реконструктивной хирургической стоматологии и имплантологии факультета последипломного образования Московского государственного медико-стоматологического университета
Кафедра реконструктивной хирургической стоматологии и имплантологии факультета последипломного образования Московского государственного медико-стоматологического университета
Кафедра реконструктивной хирургической стоматологии и имплантологии факультета последипломного образования ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова" Минздрава РФ
Кратко формулируя современные представления о профилактическом использовании антибиотиков, необходимо исходить из трех общих случаев проведения антибиотикопрофилактики: 1) для предотвращения заражения экзогенными патогенами; 2) для предотвращения распространения резидентной микрофлоры из одних участков организма в другие, в норме стерильные; 3) для предупреждения развития заболеваний при латентных инфекциях. Антибиотикопрофилактика в хирургии обычно оправдана только тогда, когда послеоперационная инфекция в ране высоковероятна или может иметь тяжелые последствия. В первую очередь такие состояния могут возникать при рассечении слизистой оболочки, в частности в полости рта, ограничивающей многочисленные популяции резидентных бактерий, из-за которых происходит контаминация раны [1, 4, 5, 10].
В настоящей статье представлены современные сведения об антибиотикопрофилактике развития послеоперационной инфекции, рассматриваются эффективные схемы профилактического использования ингибиторзащищенного аминопенициллина на примере комбинации амоксициллина с клавулановой кислотой при удалении ретенированных дистопированных третьих нижних моляров, дентальной имплантации, синус-лифтинге с антропластикой для снижения риска возникновения послеоперационных инфекционных осложнений.
Определение и цель антибиотикопрофилактики
Антибиотикопрофилактика в хирургии - это превентивное использование антибиотиков для обеспечения антимикробной защиты операционной раны при ее возможной контаминации микроорганизмами-резидентами, которые, попадая в нетипичные условия существования, могут проявлять свойства патогенов и быть причиной инфекционного процесса в области операции. Микробная контаминация операционной раны практически неизбежна даже при идеальном соблюдении правил асептики и антисептики. Имеющиеся обобщенные данные свидетельствуют, что к концу операции в 80-90% случаев раны обсеменены различной бактериальной микрофлорой. С точки зрения фармакологии, а именно фармакокинетики, цель хирургической антибиотикопрофилактики заключается в достижении эффективных концентраций антибиотиков в тканях еще до момента их микробной контаминации, поддержании терапевтического уровня активности препарата в течение всей операции и последующих 3-4 ч. Данный отрезок времени является решающим для запуска механизмов воспалительно-инфекционного процесса в ране. Антибиотикопрофилактика, начатая по истечении этого периода, является запоздалой, а ее продолжение после окончания операции в большинстве случаев считается излишним, поскольку профилактическая роль антибиотика заключается в уменьшении пороговой концентрации микроорганизмов (ниже 105-6 микробных тел на 1 г ткани) и препятствии адгезии возбудителей [2, 6, 7, 9].
Характеристика препарата для антибиотикопрофилактики на примере комбинации амоксициллина с клавулановой кислотой
Выбор препарата для антибиотикопрофилактики обусловлен его обязательным бактерицидным действием в отношении наиболее значимых микроорганизмов, хорошей тканевой проницаемостью, переносимостью, оптимальным соотношением эффективность-безопасность-стоимость. В этой связи наиболее удачной группой наряду с цефалоспаринами I-II поколения являются ингибиторзащищенные пенициллины.
Препараты этой группы представляют собой комбинацию полусинтетического пенициллина амоксициллина и клавулановой кислоты в качестве конкурентного необратимого ингибитора бета-лактамаз, что предотвращает ферментативную деградацию амоксициллина и обеспечивает гарантированную возможность проявления его бактерицидного действия за счет угнетения синтеза бактериальной стенки. Наибольшая антимикробная активность проявляется в отношении грамположительных и грамотрицательных кокков, гемофильных палочек, моракселл, представителей анаэробов - актиномицетов, бактероидов, превотелл, пептострептококков. Вышеназванные микроорганизмы являются одними из основных представителей резидентной микрофлоры полости рта, верхних дыхательных путей, включая верхнечелюстные пазухи. Способность резидентных микроорганизмов вызывать патологических процесс связана с возможностью их выхода за пределы своей экологической ниши и последующей реализацией свойств патогенности за счет процессов адгезии, инвазии, а также посредством токсинов.
Таким образом, препараты из группы ингибиторзащищенных пенициллинов как средство антибиотикопрофилактики при хирургических стоматологических вмешательствах будут являться препаратами выбора, т. е. первого ряда; их основной компонент амоксициллин, определяющий дозу препарата, внесен в модельный список антибиотиков для хирургической профилактики [8].
Послеоперационная инфекция (инфекция в области хирургического вмешательства)
Послеоперационная инфекция, иначе инфекция в области хирургического вмешательства, является частным случаем раневой инфекции, т.е. тем инфекционным процессом, который развивается вследствие внешнего микробного загрязнения при наличии повреждения покровных тканей и более или менее выраженной первичной травматической деструкции тканей, составляющих глубокие слои раны, как открытого повреждения. Оперативное вмешательство является инвазивным действием, осуществляемым с лечебной целью, но неизбежно сопряженным с более или менее выраженной травмой. В этом случае механическому разрушению довольно часто подвергаются естественные барьеры, которые разделяют ареалы внутренних биоценозов. Разрушение барьеров ведет к микробной инвазии в живые ткани, способные стать объектом патогенного воздействия микрофлоры. Этим определяется необходимость проведения превентивных мероприятий, снижающих риск послеоперационных инфекционных осложнений. Среди таких мероприятий могут быть выделены следующие: максимальное снижение травматичности (агрессивности) вмешательств и рациональное использование антибактериальных средств в периоперационном периоде, т.е. до, при необходимости, во время и после операции.
По распространенности послеоперационные инфекционные процессы разделяют на две группы: инфекции хирургической раны и инфекции органа (полости). В свою очередь инфекции хирургической раны могут быть разделены на поверхностные и глубокие [10]. Применительно к практике хирургической стоматологии в первом случае вовлечены только мягкие ткани, во втором – мягкие ткани, костная ткань и верхнечелюстная пазуха.
Основные факторы риска развития послеоперационной инфекции
Развитие инфекции в послеоперационной ране осуществляется в определенных условиях, которые индивидуальны для каждого пациента и заключаются в снижении общих и местных механизмов защиты. Возникновению инфекционных осложнений в послеоперационном периоде способствуют факторы риска, связанные с: 1) состоянием пациента, 2) особенностью микроорганизмов, 3) условиями проведения хирургического вмешательства:
1. Возраст старше 60 лет, сопутствующая патология в стадии компенсации, суб- или декомпенсации, хронические инфекции другой локализации, иммунный статус, анемия, курение (гипоскемия).
2. Вид микробной контаминации (экзогенная, эндогенная), патогенность микроорганизмов: Гр+ за счет относительно специфического действия своих экзотоксинов, Гр– за счет менее специфического действия эндотоксинов; а также вирулентность, резистентность и синергизм (аэробы + анаэробы) микроорганизмов.
3. Возможность соблюдения принципов асептики и антисептики, проведение антибиотикопрофилактики, длительность операции, степень повреждения и травматизации тканей, операционный доступ, характер и объем вмешательства (одна, две анатомические области или более), применение имплантатов, качество шовного материала, стерильность оборудования, квалификация хирурга [1].
Классификация хирургических вмешательств по степени риска развития послеоперационной инфекции
В настоящее время выделяют четыре типа хирургических вмешательств, различающихся по степени риска (D. Classen, 1992, цит. по [10]).
Схемы антибиотикопрофилактики с использованием комбинации амоксициллин/клавулановая кислота
Анализ общих и местных факторов риска развития послеоперационной инфекции при удалении ретинированных дистопированных третьих нижних моляров, дентальной имплантации, синус-лифтинге с антропластикой на основе представлений о различных типах операции позволяет определить наиболее рациональный подход к уменьшению количества возможных осложнений посредством антибиотикопрофилактики с использованием комбинации амоксициллин/клавулановая кислота.
Схема 1. Предоперационная антибиотикопрофилактика
Однократное применение антибиотика.
Введение препарата за 30-40 мин до операции: per os - 625-1000 мг или внутривенно медленно 600-1200 мг.
- удаление ретенированного дистопированного нижнего третьего моляра у пациентов без выраженной сопутствующей патологии;
- дентальная имплантация с использованием небольшого количества (1-3) имплантатов в стандартных условиях (достаточный объем костной ткани, отсутствие выраженной сопутствующей патологии).
Схема 2. Периоперационная антибиотикопрофилактика
Применение антибиотика до операции, интраоперационно и после операции.
Введение первой дозы препарата за 30-40 мин до операции: per os - 625 мг или внутривенно медленно 600 мг, при длительности операции более 3 ч интраоперационное введение второй дозы: per os - 625 мг, если операция закончена или же явится промежуточной, если операция продолжается. Введение третьей дозы должно проводиться через 8 ч после завершения операции: per os - 625 мг.
- удаление ретенированного дистопированного третьего нижнего моляра у пациентов при наличии сопутствующей патологии;
- удаление двух ретенированных дистопированных третьих нижних моляров у пациентов без выраженной сопутствующей патологии;
- дентальная имплантация с использованием небольшого количества имплантатов (1-3) при компрометированном местном и/или общем статусе;
- дентальная имплантация с использованием среднего количества имплантатов (4-8) в стандартных условиях;
- односторонний синус-лифтинг с антропластикой у пациентов без выраженной сопутствующей патологии.
Схема 3. Антибиотикопрофилактика + антибиотикотерапия (псевдоантибиотикопрофилактика)
Применение антибиотика по одной из двух вышеназванных схем профилактики с последующим назначением терапевтического курса длительностью до 7-14 дней: per os - 625 мг 3 раза в день или 1000 мг 2 раза в день.
- удаление двух ретенированных дистопированных третьих нижних моляров у пациентов при наличии местного хронического воспалительного процесса и/или сопутствующей патологии;
- дентальная имплантация с использованием среднего количества (4-8) имплантатов при компрометированном местном и/или общем статусе;
- дентальная имплантация с использованием большого количества (9-10 и более) имплантатов в стандартных условиях;
- односторонний синус-лифтинг с антропластикой аутокостным материалом у пациентов без выраженной сопутствующей патологии;
- односторонний синус-лифтинг с антропластикой при компрометированном местном и/или общем статусе;
- двусторонний синуслифтинг с антропластикой у пациентов без выраженной сопутствующей патологии.
Заключение
Проведение антибиотикопрофилактики является одним из наиболее эффективных мероприятий по предупреждению развития инфекции в области операционной раны. Экспериментальные и клинические данные, полученные в результате многоцентровых рандомизированных исследований, убедительно доказывают, что рациональное профилактическое применение антибиотиков в хирургической практике, в том числе при хирургических стоматологических вмешательствах, с помощью комбинации амоксициллин/клавулановая кислота по описанным схемам, позволяет констатировать снижение количества послеоперационных инфекционных осложнений с 10-20% до 1,5-5%.
В этой статье мы затронем одну из самых интересных тем антимикробной терапии, а именно периоперационную антибиотикопрофилактику. О нее за крайние годы сломано огромное количество копий и они, как ни странно, до сих пор продолжают ломаться.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
В этой статье мы затронем одну из самых интересных тем антимикробной терапии, а именно периоперационную антибиотикопрофилактику. О нее за крайние годы сломано огромное количество копий и они, как ни странно, до сих пор продолжают ломаться.
- особенностями преподавания принципов антибактериальной терапии в ВУЗах
- и достаточно легкого отношения к самим антимикробным препаратам бесконечно меняющиеся концепции антибактериальной терапии так же накладывают свой серьезный отпечаток.
Вы, наверное, помните, не так уж давно это было, как нас учили, что за неделю до операции пациент должен получить курс антибиотиков в качестве «подготовки к оперативном вмешательству. Потом передумали и стали проводить подобный курс уже после операции, причем абсолютно всем пациентам и вне зависимости от того, есть там инфекция или ее нет. Для профилактики. Чтобы было и не думалось. И этот подход так укоренился в сознании, что за 10 лет его никак не удается переломить.
Итак, чего бояться хирурги и почему они назначают антибактериальные препараты? А бояться они нагноения раны или говоря академическим языком – инфекции в области хирургического вмешательства (ИОХВ)
ИОХВ – это инфекция разреза, органа или полости, возникающая в течение 30 дней (без имплантата) или 1 года (с имплантатом) послеоперационного периода.
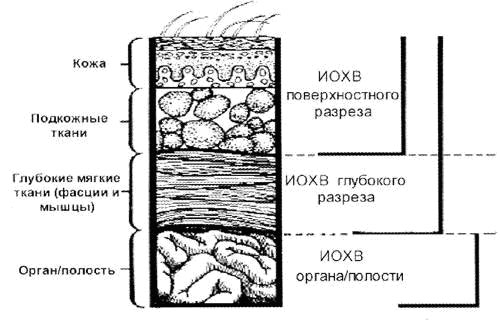
- Поверхностную ИОХВ разреза (кожа, подкожная клетчатка)
- Глубокую – ИОХВ разреза (фасция, мышцы)
- ИОХВ органа или полости
- Симптомов воспаления
- Гнойного отделяемого и лабораторное подтверждение наличия воспаления
- Достоверное микробиологическое подтверждение (окраска мазока по Граму, посев)
- необходимости вмешательство хирурга.
- Гнойное отделяемое из глубины разреза
- УЗИ и RG признаки поражения в сочетании с визуальной симптоматикой
- Спонтанное расхождение краев раны
- Присоединение глубокого поражения к поверхностному
- Необходимость хирургического вмешательства.
- Гнойного отделяемого по дренажам
- Достоверное микробиологическое подтверждение (окраска мазка по Граму, посев)
- Наличие абсцесса
Группу риска по развитию ИОХВ составляют:
- пациенты с пожилого возраста и новорожденные
- пациенты с недостатком массы тела
- больные СД
- ожирение
- сопутствующая инфекция другой локализации
- колонизация носоглотки S.aureus
- снижение местного и общего иммунитета, в т.ч. и в результате лечения.
- Особенности предоперационной подготовки – не надо брить операционное поле, это приводит к микротравматизации и увеличению риска ИОХВ
- Техника выполнения операции – при выполнении операции интернами, ординаторами и молодыми врачами, а так же в ситуациях, когда техника оперативного вмешательства еще не отточена, риски инфекции возрастают очень значительным образом.
- Несоблюдение правил асептики и антисептики
- Большая длительность операции.
- Большая кровопотеря в следствие оперативного вмешательства
- Отсутствие периоперационной антибиотикопрофилактики
- Дренирование раны
- Инфекции хирургического персонала (в том числе колонизация S.aureus)
- Степень микробной обсемененности раны
- Резистентность бактерий к антимикробной терапии.
- чистые,
- условно-чистые,
- контаминированные,
- грязные.
Чистая рана – характеризуется отсутствием признаков воспаления и вовлечения ЖКТ, МВП, дыхательных путей, а так же отсутствием технических нарушений при выполнении оперативного вмешательства.
Условно-чистая рана характеризуется вовлечением ЖКТ, мочеполовых и дыхательных путей; низкой вероятностью контаминации или незначительными техническими нарушениями при выполнении оперативного вмешательства
Контаминированная рана – имеет признаки острого негнойного воспаления; кроме того могут иметь место серьезные технические нарушения в ходе вмешательства (раны пациентов, оперированных начинающими врачами изначально должны считаться контаминированными из-за того, что техникой они еще не владеют в должном объеме)
Сюда же относится большой выброс содержимого полых органов, а также проникающие ранения со сроком менее 4 часов.
Грязные раны – характеризуются наличием гноя, предоперационной перфорацией органов и проникающими ранениями старше 4-х часов.
Итак, мы подошли к главному вопросу – когда же мы должны применить периоперационную антибиотикопрофилактику.
Периоперационную антибиотикопрофилактику мы применяем в первых трех видах ран, а в случае грязной мы с самого начала идем на антибиотикотерапию.
Почему именно тогда? В случае грязной раны возбудители могут быть какие угодно, а вот в случае первых трех, что доказано результатами многочисленных крупномасштабных исследований, ИОХВ вызовут в основном:
- Стафилококки
- Энтеробактер
- Коагулазонегативные стафилококки
- Энтерококки
- Стрептококки
- Кишечная палочка
А что же такое периоперационная антибиотикопрофилактика (ПАП) и какие цели мы перед ней ставим? Это предоперационное в/в введение антибиотика для уменьшения риска развития раневой инфекции, благодаря созданию в ране концентрации, достаточной для снижения уровня микробной контаминации тканей по ходу операционного разреза.
Давайте обратимся к очень известной картинке, которую всегда демонстрируют, когда речь идет о профилактике инфекций в хирургии:
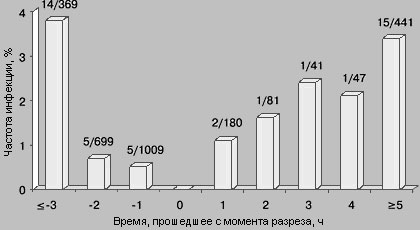
Обратите внимание, что с момента разреза контаминация тканей начинает расти в геометрической прогрессии. И введение антибиотика после операции выглядит как пальба из пушки по воробьям. При этом введение антибиотика не должно быть заблаговременным, ибо через 2-3 часа он уже будет выведен из организма, а значит и не подавит размножение микробов в ране. Таким образом, оптимальным интервалом введения, является введение антимикробного препарата за 30-40 минут до операционного разреза.
- В каких случаях следует проводить антибиотикопрофилактику?
- Какие препараты следует использовать?
- Когда необходимо начинать введение антибиотиков?
- Сколько препаратов необходимо назначить?
- Какова должна быть продолжительность антибиотикопрофилактики?
По первому пункту и третьему пунктам мы уже разобрались – профилактируем мы чистые, условно-чистые и контаминированные раны. Грязные мы начинаем сразу же лечить. А препарат вводим за 30-40 минут до разреза.
- Избирательность применения антимикробных препаратов. Т.е. препараты, применяющиеся с целью ПАП не должны больше использоваться ни в одной схеме антимикробной терапии в стационаре. Это делается для того, чтобы на максимально долгое время отсрочить развитие антибиотикорезистентности у микроорганизмов, вызывающих ИОХВ.
- Препарат должен вводится непосредственно перед операцией, за 30-40 минут до первого разреза.
- Пациентам с высокой массой тела необходимо пересчитывать дозу в сторону ее увеличения
- При длительных операциях препарат должен вводиться дважды, исходя из наиболее часто использующихся препаратов, повторная доза должна быть введена через 3-4 часа от начала оперативного вмешательства, так как это напрямую связано с фармакокинетикой антибиотика, конкретно с его периодом полувыведения (Т1/2)
- Применение ПАП более чем через 24 ч не приводит к увеличению ее эффективности. Исключением в данной ситуации являются оперативные вмешательства, проводимые молодыми врачами, осваивающими технику оперативных вмешательств. В этой ситуации антибиотикопрофилактика продляется до 72 часов.
- пациентов с трахеостомой или интубированных (для профилактики инфекций дыхательных путей);
- пациентов с постоянным мочевым катетером;
- пациентов с центральными венозными катетерами или дренажами плевральной полости;
- большинства пациентов с открытыми ранами, в том числе и ожоговыми.
Связано это с тем, что раны подвергаются постоянной контаминации и добиться там эрадикации не представляется возможным. За такими за пациентами необходим тщательный уход и контроль состояния, для того чтобы немедленно начать антибактериальную при первых же признаках инфекции
- По спектру активности – он должен включать всех наиболее часто встречающихся возбудителей
- Доза препарата должна быть обычной терапевтической (исключение – лица с ожирением)
- Время введения препарата 30-40 мин до разреза, строго!
- Кратность введения определяется Т1/2 и длительностью операции. Для основных препаратов для ПАП справедливо правило о повторном введении антибиотика через 3-4 часа от начала операции.
- легко доступен,
- дешев,
- не использоваться в схемах антибиотикотерапии в стационаре.
Почему только там? Цефазолин относится к препаратам с грам(+) активностью, он отлично воюет с грамположительными кокками, но совершенно непригоден в случае грамминус возбудителей.
Кроме того, применяя этот препарат следует помнить об общем класс-эффекте всех цефалоспоринов – лекарственные гипертермии. Примерно каждый сотый пациент выдает на цефазолин гипертермию, которая от истинной отличается тем, что проходит на фоне относительной брадикардии. Таким образом, если после АБП цефазолином у вашего пациента поднялась температура тела, а операция была чистой и в своей технике вы уверены, прежде чем паниковать и бросаться лечить его мощными антибиотиками – осмотрите рану, возьмите клинические анализы и посчитайте пульс!
Прекраснейший антибактериальный препарат, перекрывающий всех возбудителей ИОХВ и как следствие могущий использоваться при всех 3-х видах оперативных вмешательств в дозе 1,2 г в/в за 30-40 мин до разреза…
Во-вторых, его крайне сложно вывести из оборота в стационаре, так как он входит в схемы лечения многих инфекций, а что актуально конкретно для вас, так то, что он является препаратом первой линии в лечении сепсиса, тяжелых пневмоний и нейтропенических лихорадок, так же он является препаратом выбора в практике оториноларингологов. И если пациенты с подобными состояниями проходят лечение в ваших стационарах, использование амкоксициллин/клавуланата с целью ПАП принесет больше проблем, чем пользы, так как вызовет селекцию резистентных к нему штаммов. Если же подобные состояния у вас не встречаются – смело можете выводить данный препарат из общебольничной практики и использовать его в качестве периоперационной профилактики ИОХВ.
3) Ампициллин/сульбактам – перекрывает все тех же возбудителей, что и амоксициллин/клавуланат, но более дешев, легче выводится из общего оборота стационара.
Вводится по 3 г в/в за 30-40 мин до разреза. Повторная доза, если она потребуется, вводится через 3-4 часа от начала оперативного вмешательства
Отдельно следует упомянуть, что если пациент имеет в анамнезе данные об аллергических реакциях на препараты пенициллинового ряда, препаратом выбора в данной ситуации становится Клиндамицин в дозе 0,6 г.
Более подробно о методах и схемах периоперационной антибиотикопрофилактики вы можете познакомиться в следующих руководствах:
5) Антибактериальная профилактика инфекций в области хирургического вмешательства в колоректальной хирургии.
А.Н.СТРИЖАКОВ, А.И.ДАВЫДОВ, П.В. БУДАНОВ
МОСКОВСКАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ ИМЕНИ И.М. СЕЧЕНОВА
КАФЕДРА АКУШЕРСТВА И ГИНЕКОЛОГИИ №2 ЛЕЧЕБНОГО ФАКУЛЬТЕТА
(ЗАВ. КАФЕДРОЙ, АКАДЕМИК РАМН, ПРОФЕССОР А.Н. СТРИЖАКОВ)
Наиболее актуальными проблемами современной медицины является профилактика и лечение заболеваний на доклинической стадии. Широкий спектр гинекологической патологии требует оказания неотложной помощи. Это диктует необходимость проведения экстренных внутриматочных операций, что далеко не всегда позволяет провести полноценную профилактику осложнений.
В то же время, имеется высокая частота комбинации инфекционной патологии с другими заболеваниями органов малого таза. Возбудителями инфекционно-воспалительных заболеваний мочеполовых органов является большая группа бактерий и вирусов. Особого внимания заслуживают инфекции, относящиеся к группе, передающихся половым путем (ИППП). Для них характерна смешанная этиология, малосимптомные субклинические формы течения и активация в ответ на неспецифические факторы агрессии, в том числе – операционный стресс.
Все перечисленное требует проведения не только профилактики, но и зачастую превентивного лечения воспалительных заболеваний после экстренных лечебно-диагностических внутриматочных операций.
За последние несколько десятков лет в хирургии и гинекологии разработаны подходы к рациональной профилактике послеоперационных осложнений. Во многих исследованиях для стандартизации подходов к антибиотикопрофилактике выделяют степени риска развития инфекционных осложнений после оперативных вмешательств (Табл. 1).
Степени риска послеоперационных инфекционных осложнений. Таблица 1.
Кроме того, выделяют многочисленные факторы риска, влияющие на возникновение инфекционно-воспалительных заболеваний после оперативных вмешательств в акушерстве и гинекологии.
Назначение антибиотиков с целью профилактики инфекционных осложнений подразумевает обеспечение эффективных концентраций препарата в тканях до момента их контаминации во время и после операции. При этом на фоне длительного применения антимикробных средств вероятность инфекционно-воспалительных заболеваний в послеоперационном периоде не только не уменьшается, но и несколько возрастает.
Доказано, что развитие инфекционного процесса предупреждается введением антибиотика не позже 3 часов после создания раневой поверхности (входные ворота для бактериальных возбудителей). С другой стороны, назначение антибиотиков более чем за сутки до операции повышает риск развития резистентности микроорганизмов к препарату.
Поэтому оптимальным режимом антибиотикопрофлактики является первое введение антибиотика периоперационно (или интраоперационно – при кесаревом сечении) и последующие – в течение 12-24 часов.
В современных условиях для антибиотикопрофилактики не используются препараты: ь с бактериостатическим действием – тетрациклины, сульфаниламиды, хлорамфеникол; ь с очень широким спектром действия – цефалоспорины III-IV генерации, карбапенемы, уреидопенициллины; эти препараты должны использоваться в качестве резерва антибиотикотерапии; ь с коротким периодом полувыведения – полусинтетические пенициллины; ь с высоким уровнем резистентности микроорганизмов: пенициллины, гентамицин, котримоксазол; ь токсичные препараты.
Для проведения профилактики инфекционных осложнений после оперативных вмешательств следует использовать антибиотики, активные в отношении основных возбудителей, хорошо проникающие в ткани, с длительным периодом полувыведения, малотоксичные, с низкой аллергогенностью, не приводящие к быстрому развитию антибиотикорезистентности.
Как правило, для антибиотикопрофилактики используются цефазолин (цефалоспорин I поколения), при высоком риске инфекционных осложнений – цефамандол и цефуроксим (II поколение). При акушерских и гинекологических операциях создается высокий риск контаминации раны анаэробами. В связи с этим, предпочтение следует отдавать комбинации метронидазола и цефалоспоринов или аминопенициллинам с ингибиторами бета-лактамаз.
Для обеспечения быстрой и эффективной концентрации антибиотика в тканях необходимо выбирать парентеральный (внутривенный) путь введения препарата. С другой стороны принципы превентивной терапии отличаются от принципов классической антибиотикопрофилактики. Особенно это актуально в отношении инфекций, передающихся половым путем. Обоснованное превентивное назначение антибактериальных препаратов приводит к снижению частоты инфекционных осложнений. Однако в литературе практически отсутствуют исследования, посвященные проведению сравнения превентивного лечения и профилактики инфекционных заболеваний в случае экстренных вмешательств.
Критериями отбора пациенток для проведения превентивной терапии являются: § указание на специфические генитальные инфекции в анамнезе, § наличие любых клинических и лабораторных признаков воспалительного процесса на момент принятия решения об операции, § вторичное бесплодие, § привычное невынашивание, § синдром хронической тазовой боли, § перенесенные ранее операции на придатках матки, § инфекции мочевыводящих путей, § иммунодефицитные состояния.
Важным аспектом профилактической противомикробной терапии является выбор антибактериального препарата. Он должен обладать высокой биодоступностью, широким спектром действия, простотой использования, возможностью пролонгированного введения, быстро всасываться при пероральном приеме, обладать низким сродством к белкам плазмы крови, создавать бактерицидные концентрации в тканях, воздействовать на специфических возбудителей генитальных инфекций. Более того, для достижения удовлетворительных показателей комплаентности необходимы пролонгированные формы антибиотиков, позволяющие уменьшить кратность назначения препарата.
Цель настоящего исследования – сравнить эффективность проведения антибиотикопрофилактики и превентивного лечения генитальных инфекций у больных, перенесших экстренные внутриматочные операции.
Пациенты и методы
Для антибиотикопрофилактики использовали 1-2 кратное введение комбинации ампициллина и гентамицина в средней суточной дозе за 1-2 часа до операции. Кратность введения зависела от степени риска развития послеоперационных воспалительных осложнений.
Для превентивной терапии назначали пролонгированную форму ципрофлоксацина (Цифран OD) по 1000 мг 1 раз в сутки. Выбор препарата объясняется тем, что однократный прием Цифрана ОД накануне операции позволяет поддерживать его активные концентрации в плазме крови в течение суток. Начинали лечение за 2-4 часа до операции. С целью профилактики генитального кандидоза применяли однократный пероральный прием 150мг флюконазола (Дифлазон).
Всего нами обследовано 89 больных, средний возраст которых составил 36,8±6,2 лет с колебаниями от 19 до 55 лет. Всем пациенткам, вошедшим в исследование, по различным показаниям в экстренном порядке проводились следующие операции: раздельное лечебно-диагностическое выскабливание слизистой канала шейки и полости матки (41), гистероскопия (34), трансцервикальная резектоскопия (8), удаление тканей плодного яйца (9), инструментальное удаление внутриматочного контрацептива (22).
Больные были разделены на две группы. В первую группу вошли женщины, имевшие показания для проведения превентивной терапии (62). Вторая группа отобрана путем слепой выборки пациенток групп высокого риска по развитию послеоперационных воспалительных осложнений (27). После выписки из стационара за пациентами осуществляли динамическое наблюдение в течение 3-4 месяцев. В этот период проводили клиническое и лабораторное обследование, включавшее диагностику инфекций, передающихся половым путем, ультразвуковое исследование и оценку состояния мочевыделительной системы. За время пребывания в стационаре и в течение ближайших двух недель после выписки ни у одной женщины, получавшей Цифран OD (1000мг) не было отмечено воспалительных заболеваний органов малого таза и мочевыводящих путей.
За время последующего наблюдения было отмечено, что среди женщин, которым проводилась профилактическая схема введения антибиотиков, частота инфекций, передающихся половым путем и воспалительных заболеваний мочевыводящих путей был выше, чем в группе пациенток, получавших превентивную терапию в пролонгированной форме ципрофлоксацина (Цифран OD). Так, в ближайшие 1-2 месяца после стационарного лечения у 2 больных этой группы был диагностирован хламидиоз (7,4%), у 1 – торпидная гонорея, у 5 (18,5%) микоплазменная и уреаплазменная инфекция, у 1 – трихомониаз в сочетании с папилломавирусной инфекцией. То есть, общая частота ИППП у женщин группы высокого риска инфекционных осложнений в послеоперационном периоде составила 33,3%, что более чем в четыре раза выше, по сравнению с общей популяцией. При этом частота генитальных инфекций у больных, получавших антибиотикопрофилактику, по данным анамнеза составляла 18,5% (Рис. 1).
Рис. 1. Частота инфекций, передаваемых половым путем, выявленная у обследованных больных спустя 2 мес после выписки из стационара
Генитальные инфекции в анамнезе встречались у 24 (33,3%) женщин, принимавших Цифран OD. Среди 62 больных, получавших превентивную терапию Цифраном OD в виде однократной дозы 1000мг, за 4 месяца последующего обследования было выявлено 6 (9,7%) наблюдений идентификации Ureaplasma urealyticum. Других инфекций, относящихся к группе ИППП, обнаружено не было.
Антибактериальные средства (АБС) потому и названы антибактериальными, что они действуют именно на бактерии!
АБС не оказывают совершенно никакого влияния на вирусы, поэтому, с точки зрения современной науки, они не имеют никакого отношения к лечению вирусных инфекций. Никаких вирусных инфекций! Ни у кого! Никогда!
Тем не менее общеизвестно, что при вирусных инфекциях возможны осложнения, вызванные бактериями,— нагноение пузырьков на коже при ветряной оспе, пневмония при ОРВИ и т. д.
Отсюда резонная, на первый взгляд, мысль: зачем ждать развития воспаления легких — давайте сразу назначим что-нибудь антибактериальное, сразу не позволим бактериям размножаться — и не будет никаких воспалений!
И что, действительно не возникнут проблемы? Не опустится? Не станет плохо? Если бы всё было так просто. На самом деле ни логики, ни здравомыслия в подобных рассуждениях нет нисколечко. Но всё это требует аргументации. Поэтому приступим к разъяснениям.
В условиях полного здоровья дыхательные пути — особенно верхние дыхательные пути — далеко не стерильны. Их заселяет множество самых разнообразных микроорганизмов, которые мирно сосуществуют как с организмом человека, так и друг с другом.
Это мирное сосуществование обеспечивается двумя основными факторами:
системой иммунитета, прежде всего местного иммунитета (местный иммунитет — это способность организма не пускать микробы внутрь и обезвреживать их непосредственно в месте контакта с кожей или слизистыми оболочками);
конкуренцией между микроорганизмами. Каждый микроб имеет своих соперников (антагонистов) и находится с ними в состоянии вооруженного нейтралитета.
ОРВИ приводит к тому, что сдерживающее влияние системы иммунитета ослабевает. Рост бактерий активизируется. Что произойдет, если в это время появится АБС, которое уничтожит некоторых членов микробного сообщества? Понятно что: уцелевшие бактерии, лишившись своих естественных конкурентов, начнут активно размножаться. Как следствие — вероятность бактериальных осложнений не только не уменьшится, но и возрастет!
Более того, это уже будет не просто бактериальное осложнение, а осложнение, вызванное бактериями, устойчивыми к ранее назначенному АБС. Лечить такое осложнение будет многократно сложнее, ведь понадобится препарат более активный и с более широким спектром действия, нежели назначенный профилактически.
И еще несколько фактов, в качестве информации к размышлению.
Дыхательные пути заселены. Заселены хорошими микробами, которые организму привычны, которые не выделяют токсинов, живут себе и живут, дружат с системой местного иммунитета и тренируют ее. А самое главное — не пускают чужаков на пригодные для жизни места. Эти хорошие микробы являются, по сути, биологическим механизмом местного иммунитета.
Что произойдет в ситуации, когда АБС, назначенное якобы для профилактики внутренней угрозы, для защиты от своих, мирных и привычных, бактерий, фактически отключит один из важнейших механизмов местного иммунитета и оставит организм беззащитным перед угрозой внешней? Разумеется, возрастет риск вторжения, и этот риск будет тем выше, чем больше вокруг вероятных источников заражения, например других людей. Неудивительно, что профилактическое антибактериальное лечение, нежелательное в домашней обстановке, становится особо опасным в условиях стационара, где и народу больше, и вероятность встречи с госпитальной флорой выше.
применение антибактериальных препаратов при вирусных инфекциях якобы с целью профилактики, чтобы упредить развитие осложнений, недопустимо. Профилактика никогда не удается, наоборот — становится только хуже.
Во-первых, потому, что всегда найдется микроб, который уцелеет.
Во-вторых, потому, что, уничтожая одни бактерии, мы создаем условия для размножения других, увеличивая, а не уменьшая при этом вероятность все тех же осложнений.
В-третьих, потому, что, уничтожая естественную микрофлору, мы таким образом увеличиваем вероятность заселения дыхательных путей микробами однозначно патогенными, вредными, нежелательными.
Сформулированные положения легко объясняют результаты сотен научных исследований, которые убедительно доказывают, что профилактическая антибиотикотерапия на фоне вирусных инфекций не только не приводит к уменьшению числа бактериальных осложнений, но, напротив, в несколько раз увеличивает их вероятность!
Главный итог, собственно, и заключается в том, что совершенно неправильно относиться к профилактическому применению антибактериальных средств при вирусных инфекциях как к явлению лишь бесполезному. Это совершенно очевидное ЗЛО. Зло биологическое, зло социальное, зло экономическое.
Профилактическое применение АБС при вирусных инфекциях — это:
увеличение частоты и тяжести бактериальных осложнений;
бесполезные материальные затраты как на само лечение, так и на ликвидацию его нежелательных последствий;
поглощение ненужных и далеко не безопасных лекарств, сопровождаемое необоснованным и неоправданным риском побочных реакций и осложнений;
постоянная селекция микроорганизмов, приводящая к стремительному росту числа бактерий, устойчивых ко многим АБС.
Очень важно не путать профилактическое применение АБС при вирусных инфекциях и профилактическое их применение вообще.
С вирусными инфекциями все понятно: профилактика бактериальных осложнений антибактериальными средствами опасна и бесперспективна. Всегда! Никакие ссылки на тяжесть вирусной инфекции, на возраст, на факт госпитализации эту позицию изменить не в состоянии.
Но профилактическое применение АБС — зло не всегда. После многих операций, особенно на органах брюшной полости, профилактика АБС жизненно необходима. Во время эпидемии чумы массовый прием тетрациклина способен защитить от заражения, при угрозе применения спор сибирской язвы как бактериологического оружия антибактериальный препарат ципрофлоксацин может спасти миллионы человеческих жизней.
Главное: показания к профилактическому применению АБС возникают тогда, когда имеет место реальный (!) контакт с опасными бактериями.
Факт заболевания одного из членов семьи коклюшем — реальный повод незамедлительно назначить антибактериальное средство всем контактным детям. Чем ребенок младше, т. е. чем опаснее для него коклюш, тем больше необходима подобная профилактика. Похожая ситуация и показания к профилактической антибактериальной терапии возникают при контакте с больными менингитом, сифилисом, гонореей и некоторыми другими заразными бактериальными инфекциями.
Читайте также:

