Антибиотики при профилактике раневой инфекции
Обновлено: 19.04.2024
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Возбудители
- Коагулазонегативные стафилококки (особенно в кардиохирургической практике, а также и при установке имплантов и протезов)
- Staphylococcus aureus
- Streptococcus spp
- Enterobacteriaceae (ЖКТ)
- Анаробы (ЖКТ)
- Предоперационная профилактика проводится антимикробными препаратами, пациентам без признаков инфекционного воспаления, для уменьшения риска постоперационной раневой инфекции.
- Антибиотик может также вводится до проведения процедур, сопровождающихся высоким риском контаминации (например, в абдоминальной хирургии) или когда последствия инфекции могут привести к очень серьезным последствиям (например, в кардиохирургии)
- Антибактериальный препарат должен перекрывать всю преобладающую микрофлору (см. возбудителей). Стрептококки и стафилококки являются возбудителями в абсолютном большинстве случаев развития инфекции в области хирургического вмешательства (ИОХВ). Анаэробы и энтеробактерии – в абдоминальной хирургии.
- Эффективность антибактериальных препаратов в большинстве случаев зависит от уровня их пенетрации в ткани и времени введения до начала оперативного вмешательства. При длительном оперативном вмешательстве, введение антибактериального препарата необходимо повторить.
- Большинство руководств указывают на то, что в стационарах с высоким риском MRSAпредпочтение должно отдаваться ванкомицину перед цефазолином.
Лечение
Общие положение
Общая хирургия:
- Цефотетан снова доступен в США, но альтернативно могут быть использованы цефокситин 1 г в/в или цефазолин2 г + метронидазол 500 мг в/в, или ампициллин/сульбактам 3 г в/в.
- Аппендэктомия: цефотетан 2 г в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Паховая грыжа: не ущемленная - операция является чистой, антибиотикопрофилактика не рекомендуется. Не ущемленная, с установкой сетки – цефазолин 2 г в/в. Ущемленная, экстренное вмешательство: цефотетан 2 г в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Чрескожная эндоскопическая гастростомия: цефазолин 2 г в/в или цефотетан 2 г в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Проникающая абдоминальная травма: цефотетан 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Мастэктомия: антибиотикопрофилактика не рекомендуется. Мастэктомия с лимфодиссекцией: цефазолин 2 г в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Малая хирургия тонкого или толстого кишечника: цефотетан 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
Гинекологические операции
- Кесарево сечение: цефазолин 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Гистерэктомия (абдоминальная или вагинальная) неосложненная: цефазолин 2 г; осложненная цефотетан 2 г в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Выпадение мочевого пузыря или прямой кишки: цефазолин 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Аборт: не осложненный, не нуждается в антибиотикопрофилактике. Осложненный: цефазолин 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
Ортопедия
- Эндопротезирование суставов: цефазолин 2 г в/в. При аллергии на пенициллин: ванкомицин в/в.
- Открытая репозиция: цефазолин 2 гр в/в переоперационно, продолжить 24 часа (открытый перелом может лечиться как инфицированный -цефазолин 2 гр в/в каждые 8 часов х 10 дней). При аллергии на пенициллин: ванкомицин в/в.
- Ампутация нижней конечности: цефотетан 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Ляминэктомия: цефазолин 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в
- Спондилодез: цефазолин 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в или ванкомицин в/в
- Артроскопическая хирургия: нет данных за антибиотикопрофилактику.
Кардиоваскулярная хирургия
- Неосложненная срединная стернотомия/ неосложненный сердечный транслантат: цефазолин 2 гр в/в. При аллергии на пенициллины: ванкомицин в/в +/- гентамицин в/в
- Сердечный трансплантат с предшествующим LVAD, колонизацией MRSA: цефазолин 2 г в/в + ванкомицин в/в. При аддергии на пенициллин: ванкомицин в/в +/- гентамицин в/в
- Установка пейсмейкеров/автоматических кардиовертеров: цефазолин 2 гр в/в. При наличии MRSA инфекции или колонизации необходимо использовать ванкомицин + цефазолин 2,0 в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в или ванкомицин в/в
- Установка LVAD/BIVAD: ванкомицинв/в + ципрофлоксацин 400 мг в/в + флуконазол 400 мг в/в в течение 8 часов.
- Можно продлить антибиотикопрофилактику до 24 часов только при срединной стернотомии.
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов. Ведущим ограничением в выборе антибактериальных препаратов в настоящее время является широкое распространение полирезистентных микроорганизмов. Это значительно сужает выбор как системных, так и местных препаратов эмпирической антибактериальной терапии ран. В настоящее время в целях профилактики прогрессирования раневой инфекции находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов.
К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран, можно отнести сульфаниламид (Ранавексим), сульфатидин серебра, неомицин с бацитрацином. Местная терапия инфицированных ран должна базироваться на этиологических и анамнестических характеристиках раны, фазе раневого процесса и объеме поражения. Местное применение антибактериальных препаратов (например, сульфаниламида) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги).
Ключевые слова: раны, антибактериальная терапия, полирезистентность, местное применение антибиотиков, сульфаниламид.
Для цитирования: Левчук И.П., Костюченко М.В. Антибактериальные препараты для местной терапии ранений различной этиологии //РМЖ. Медицинское обозрение. 2018. № 00. С. 1-6.
Antibacterial drugs for topical therapy of the wounds of various etiologies
Levchuk I.P., Kostyuchenko M.V.
Pirogov Russian National Research Medical University, Moscow
Abstract
The article deals with modern problems of antibiotic therapy of the wounds of various etiologies, possibilities and limitations of the use of topical antibiotics. Currently, the main limitation in the choice of antibacterial drugs is the widespread use of multiresistant microorganisms. This fact significantly reduces the choice of both systemic and topical drugs for empirical antibiotic therapy of wounds. At present, topical antibiotics are often used to prevent the progression of wound infection, which often allows to avoid systemic side effects. Topical antibacterial preparations most actively used for outpatient management of wounds can be attributed to a sulfanilamide (Ranavexim), sulfatides silver, neomycin with bacitracin. Topical therapy of wounds should be based on etiological and anamnestic characteristics of the wound, phase of the wound process and the extent of the lesion. Topical use of antibacterial drugs (e. g. sulfanilamide) is possible with small lesions without an active infectious process in the wound (such as abrasions, scratches, small cuts and burns).
Key words: wounds, antibacterial therapy, multidrug resistance, topical application of antibiotics, sulfonamide.
For citation: Levchuk I.P., Kostyuchenko M.V. Antibacterial drugs for topical therapy of the wounds of various etiologies // RMJ. Medical Review. 2018. № 00. P. 1-6.
Все раны, полученные в нестерильных условиях, являются инфицированными, рост бактериальной флоры в ране провоцирует развитие воспалительного процесса, сопровождающегося повышением местной температуры, гиперемией, болью и нарушением функции части тела, на которой находится рана. Частота развития инфекционных осложнений остается весьма значительной и достигает в целом 45%. Наиболее подвержены развитию инфекционных осложнений раны, загрязненные землей, с нарушением кровоснабжения в области непосредственно самого повреждения или всей части тела, огнестрельные и минно-взрывные раны, укусы животных и человека. В зависимости от вида повреждения и условий окружающей среды в раны могут попадать различные микроорганизмы: резидентные - постоянно живущие и размножающиеся на коже (преимущественно коагулазонегативные кокки, например Staphylococcus epidermidis, S. aureus, и дифтeроиды, например Corinebacterium spp., реже - грамотрицательные бактерии), и транзиторные - в норме отсутствующие и попадающие на кожу после контакта с контаминированными объектами окружающей среды и больными людьми. В зависимости от области тела (голова, конечности, перианальная область и т. д.) спектр резидентной микрофлоры может быть различным. Транзиторная флора также неодинакова по составу, который зависит от характера раны, этиологии, окружающей среды и может быть представлен различными инфекционно-опасными микроорганизмами (Escherichia coli, Klebsiella spp., Pseudomonas spp., Salmonella spp. и другими грамотрицательными бактериями, S. aureus, вирусами и грибами, Candida albicans, ротавирусами и др.). При повреждении кожи транзиторные микроорганизмы способны длительно колонизировать и инфицировать кожу, формируя при этом новую, гораздо более опасную резидентную (но не нормальную) флору. В большинстве случаев инфицирование обусловливается микробными ассоциациями. Так, укусы собак сопровождаются инфекционным осложнением примерно в 20% случаев, кошек - до 30-50%, человека - 70-80% 1.
Из-за изменения гистохимических параметров тканей в результате повреждения и разрушения защитной барьерной функции кожи даже непатогенные микроорганизмы могут стать причиной выраженных воспалительных, гнойных процессов. Для выбора оптимальной антибактериальной терапии необходимо учитывать возможный микробный спектр раны (табл. 1).
Таблица 1. Этиология и микробный спектр ран
| Этиология ран | Спектр возбудителей раневых инфекционных осложнений |
| Раны в результате несчастных случаев | Чаще встречаются Enterobacteriaceae spp. и S. aureus, в т. ч. возможны и внебольничные MRSA-штаммы, Staphylococcus spp. [4]. При ранах в области верхних конечностей, особенно кистей рук, преобладают кокковые формы: 90% стафилококк (57% в чистой культуре и 33% - в ассоциации со спороносными палочками); реже обнаруживаются дифтероиды, аэробные спороносные палочки и различные сапрофиты воздушного происхождения; при травме нижних конечностей встречаются кишечная палочка и протей -13,5%, реже - анаэробы [5]. В перианальной области в ране содержатся разнообразные комбинации грамположительных кокков (стафилококки, стрептококки и энтерококки) и энтеробактерий (кишечная палочка, клебсиелла, энтеробактер и др.) в возможной ассоциации с анаэробами (пептострептококки, бактероиды, фузобактерии, клостридии и др.) [6]. При ранении в морской воде - Vibrio spp, Mycobacterium marinun, в пресной воде - Pseudomonas aeruginosa, Aeromonas spp. и Mycobacterium spp. (чаще - M. marinum, Mycobacterium avium), Vibrio spp, Enterobacteriaceae spp. [7, 8]. Повреждения, сопровождающиеся нарушением кровоснабжения и резким снижением оксигенации тканей, наиболее благоприятны для развития C. perfringens, C. novyi, C. septicum, C. hystoliticum, C. bifermentans [6]. |
| Ожоговые раны | Чаще всего рану колонизируют стафилококк, вегетирующий в виде сапрофитной флоры на неповрежденной коже, и стрептококк. На госпитальных этапах - нозокомиальные инфекции (больничная полирезистентная флора), частота MRSA-штаммов -37-50% [9]. Монокультуры микроорганизмов встречаются в 57% случаев, микробные ассоциации - в 43%, они включают: S. aureus и Proteus vulgaris; S. aureus и S. epidermidis; S. aureus и P. aeruginosa; P. vulgaris, E. coli, S. aureus; P. aeruginosa, K. pneumonia, S. aureus (Моррисон В.В., 2015). |
| Укушенные раны | При укусах животных первое место по числу занимают микробные аэробно-анаэробные ассоциации - 50-65%, Pasteurella spр. - 2075% (Pasteurella multocida - 60% и P. canis - 18%), а также Peptostreptococcus spp, S. aureus - 20-40% и Streptococcus mitis, Moraxella spp, Corynebacterium spp. и Neisseria spp. 9. При укусах кошки: P. multocida, S. aureus, MRSA, Cl. tetani; при укусах свиньи: полимикробная флора (грамположительные кокки, грамотрицательные палочки, Pasteurella spp. + анаэробы, Cl. tetani); при укусах крысы: S. moniliformis, Cl. tetani; при укусах змеи: Pseudomonas spp, Enterobacteriaceae spp., Clostridium spp. [1, 4]. При укусах человека спектр возбудителей представлен преимущественно Streptococcus spp. (17-90%), S. aureus (13-50%), Eikenella corrodens (10-29%), Haemophilus influenza (17-26%), Bacteroides spp, Fusobacterium spp. (12-33%), Peptostreptococcus spp. (22%), преобладает смешанная флора [4, 9-10, 12]. Возможны внебольничные MRSA-штаммы, особенно при укусах животных [13]. |
| Раны после разделки мяса или рыбы | Erysipelothrixrhusiopathiae [7]. |
| Раны, полученные в результате боевых действий и других ЧС | Часто грамотрицательные аэробные возбудители: Enterobacteriaceae spp, Pseudomonas spp, а также Staphylococcus spp. При повреждениях полых органов, например при проникающих абдоминальных ранениях: контаминация раны грамотрицательными возбудителями из семейства Enterobacteriaceae и анаэробами [4]. При глубоких ранах, загрязненных землей, с нарушением кровоснабжения и резким снижением оксигенации тканей: C. perfringens, C. novyi, C. septicum, C. hystoliticum, C. bifermentans [6]. |
| Послеоперационные раны | S. aureus - 20% (в т. ч. MRSA-штаммы), коагулазонегативные стафилококки - 14%, энтерококки - 12%, E. coli - 8%, P. aeruginosa - 8%, Enterobacter spp. - 7%, P. mirabilis - 3%, K. pneumoniae - 3%, C. albicans - 3-9,5%, другие грамположительные аэробы - 2%, Bacteroides fragilis - 2% [1, 4]. |
Антибактериальная терапия
В настоящее время внебольничные штаммы остаются чувствительными к большому числу антибиотиков, в т. ч. ß-лактамам. До конца 1990-х годов метициллин-резистентные микроорганизмы (MRSA) были исключительно внутрибольничной проблемой с преимущественным распространением в Европе. Однако в настоящее время имеются сведения и о внебольничных резервуарах полирезистентного стафилококка зоонозного происхождения, который составляет в общей массе до 50% и более на юге Европы и 10-25% в Центральной Европе и Великобритании [14]. В России в амбулаторных условиях частота встречаемости MRSA не превышает 3,8%, однако в условиях стационара частота встречаемости этих микроорганизмов, а также устойчивых к цефалоспоринам грамотрицательных E. coli и Klebsiella spp. достигает 60,4-84,9%. При выявлении высокого риска инфицированности MRSA-штаммами необходимо включить анти-MRSA-препарат в схему лечения 6.
В целях профилактики прогрессирования раневой инфекции в настоящее время находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов. Системной антибактериальной терапии не требуется при очагах менее 5 см после адекватной хирургической обработки [6].
Таблица 2. Характеристика антибактериальных препаратов для наружного применения
Примечание: ПАБК - парааминобензойная кислота
В случае обширных раневых дефектов, клинических проявлений инфекции, включая системные признаки воспаления (повышение температуры тела >38° С или снижение 12*10 9 /л или лейкопения 90 уд./мин; одышка >24 дыханий/мин), иммунодефицитного состояния необходимо системное применение антибиотиков [7]. Местные лекарственные формы с антибактериальным компонентом при этом также находят место в протоколах лечения.
Активно применяющиеся в настоящее время антибактериальные препараты, при кажущемся на первый взгляд многообразии, с учетом современной концепции лечения инфицированных ран и требований, предъявляемых к подобным препаратам, имеют существенные ограничения. Спектр действия большей части широко известных препаратов значительно сузился для стационарного применения в связи с полирезистентностью микроорганизмов (табл. 2) и ограничением из-за побочных эффектов при больших раневых поверхностях (табл. 3).
Таблица 3. Показания, побочные эффекты и ограничения для антибактериальных препаратов для наружного применения
Многие местно применяемые антибактериальные препараты имеют достаточно жесткие ограничения для стационарного применения в связи с резистентностью микрофлоры, а также по площади раневой поверхности из-за активного всасывания и токсичности при попадании в системный кровоток [20]. К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран с целью профилактики развития раневой инфекции, можно отнести сульфаниламид, сульфатидин серебра, неомицин с бацитрацином, при риске негоспитальных устойчивых штаммов - мупироцин и фузидовую кислоту. Сульфаниламид не потерял актуальности и характеризуется противомикробным действием по отношению к негоспитальным штаммам грамположительных и грамотрицательных кокков, E. coli, Shigella spp., Vibrio cholerae, Haemophilus influenzae, Clostridium spp., Bacillus anthracis, Corynebacterium diphtheriae, Yersinia pestis, а также Chlamydia spp., Actinomyces spp., Toxoplasma gondii и некоторым другим бактериям при ранах и ожогах, полученных в результате несчастных случаев и в чрезвычайных ситуациях [15-16, 21].
Применяя местные антибактериальные препараты, которые непосредственно контактируют с раной, необходимо учитывать их форму выпуска и состав вспомогательных веществ, соотнося их с фазами раневого процесса.
В первой фазе раневого процесса рекомендуются для местного применения препараты на водорастворимой основе с сульфаниламидом [6]. Сульфаниламид в виде порошка для местного применения (Ранавексим в банке с дозатором) поглощает раневой экссудат, не травмирует ткани раневой поверхности, препятствует развитию микрофлоры в ране и вторичному инфицированию [21, 22]. При использовании лекарственной формы в упаковке с дозатором легко контролируются дозировка лекарственного вещества и равномерность нанесения порошка без контакта с раневой поверхностью, что уменьшает риск побочных эффектов.
При глубоких ранениях в полость раны вносят 5-15 г порошка для наружного применения (Ранавексим), при этом максимальная суточная доза для взрослых составляет 15 г, для детей старше 3-х лет - 300 мг, при местном применении в виде порошка (непосредственном нанесении на раневую поверхность) препарат не обладает раздражающим ткани действием [15, 21, 23].
Во второй фазе раневого процесса следует отдавать преимущество формам, не наносящим ущерба грануляциям.
Учитывая мультирезистентность микроорганизмов, в настоящее время эмпирические схемы антибактериальной терапии претерпевают значительные изменения. Давно известные и широко используемые антибиотики остаются, как правило, препаратами выбора лишь для ведения небольших ран в амбулаторных условиях у пациентов с низким риском инфицирования MRSA и другими устойчивыми штаммами. Раны, требующие хирургического лечения в условиях стационара, автоматически переводят пациентов в группу риска, и выбор препарата меняется. При этом антибактериальный спектр применяемого препарата должен включать возможных возбудителей с учетом этиологических и анамнестических характеристик раны.
Заключение
Таким образом, при назначении антибактериальной терапии ран необходимо учитывать этиологию и обстоятельства, при которых было получено повреждение, возможный спектр возбудителей, лечение амбулаторное или стационарное, риск инфицирования резистентной микрофлорой, особенности хирургического лечения раны и фазу раневого процесса. При этом, несмотря на широкое использование местных форм антибактериальных препаратов, в настоящее время отсутствуют четкие стандартизированные подходы относительно фаз раневого процесса. Только местное применение антибактериальных препаратов (например, сульфаниламида в форме порошка для наружного применения - Ранавексима) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги). При глубоких и обширных раневых дефектах после хирургической обработки применяется системная антибактериальная терапия, дополняемая при необходимости местными лекарственными формами.

Под термином "антибактериальная химиотерапия" понимают использование химических соединений, назначаемых при инфекционных заболеваниях и вызывающих гибель их возбудителей без повреждения тканей хозяина.
К сожалению, многие из препаратов, разработанных в 40-60 годах, в настоящее время во многом утратили свою клиническую значимость, что обусловлено эволюцией микроорганизмов, возникновением их устойчивости к действию антибиотиков.
Этот биологический феномен - антибиотикорезистентность - определяет как тактику терапии и направления деятельности фармацевтической промышленности, вынужденной производить все новые антибактериальные препараты, так и направления научных исследований по поиску новых групп препаратов, более эффективных для лечения раневой инфекции.
Раневая инфекция в общей структуре хирургической заболеваемости занимает одно из ведущих мест.
Гнойно-воспалительные процессы наблюдаются у 35% – 45% хирургических больных. Инфекция является причиной не только различных хирургических заболеваний, но и многочисленных послеоперационных осложнений: от нагноения послеоперационной раны до развития хирургического сепсиса, который часто приводит к смерти больного.
Причины возрастания частоты и течения гнойной инфекции в хирургии многообразны и включают в себя следующие факторы: увеличение объема оперативных вмешательств, особенно у больных группы риска, широкое использование методов инструментального обследования и лечения, сопровождающееся инфицированием больного (внутрисосудистые и мочевые катетеры, интубационные трубки, эндоскопические манипуляции и др.), распространение антибиотикоустойчивых штаммов микроорганизмов. Указанные факторы, а также нерациональное использование антибиотиков привели к увеличению частоты внутрибольничных инфекций, вызываемых множественно устойчивыми условно-патогенными возбудителями.
Более половины всех используемых в настоящее время в мире антибиотиков составляют беталактамы (пенициллины, цефалоспорины, цефамицины, карбапенемы, монобактамы).
Данные бактериологических исследований, проведенных в различных клиниках, свидетельствуют о приобретении патогенными микроорганизмами устойчивости к длительно применяемым в практике антибактериальным препаратам (пенициллин, стрептомицин, ампициллин, амоксициллин, цефазолин и др.).
Наиболее значимым механизмом формирования резистентности к беталактамным антибиотикам является продукция бактериями беталактамаз – с ним связано приблизительно 80% случаев устойчивости как грамположительных, так и грамотрицательных микроорганизмов, что является одной из основных причин снижающейся эффективности многих традиционных для каждого стационара антибактериальных препаратов.
Одним из путей преодоления антибиотикорезистентности является использование ингибиторов беталактамаз в сочетании с пенициллинами или цефалоспоринами в составе комбинированных препаратов. На основе ингибитора беталактамаз клавулановой кислоты создан комбинированный препарат амоксициллин/клавуланат калия, на основе ингибитора беталактамаз сульбактама созданы комбинированные препараты тикарциллин/клавулановая кислота, ампициллин/сульбактам, цефоперазон/сульбактам, на основе ингибитора беталактамаз тазобактама – пиперациллин/тазобактам.
Изучение возбудителей тяжелых хирургических гнойных осложнений и их чувствительности к антибактериальным препаратам позволяет считать наиболее эффективными лекарственными средствами:
- аминогликозиды 3 поколения (нетилмицин, амикацин, сизомицин),
- цефалоспорины III-IY поколения,
- фторхинолоны,
- линкозамины,
- имипенем, меропенем,
- антибиотики в комбинации с ингибиторами беталактамаз (ампициллин и цефоперазон с сульбактамом, амоксициллин с клавулановой кислотой, пиперациллин с тазобактамом).
При выявлении метициллинрезистентных микроорганизмов – ванкомицин, тейкапланин. Достаточно высокую клиническую значимость сохраняют давно известные антимикробные препараты – диоксидин и фурагин-растворимый.
Выбор антибактериального препарата должен быть обоснован не только данными бактериологического исследования, но и тяжестью проявления клиники интоксикации, степенью выраженности полиорганной недостаточности, обширностью гнойного процесса.
При ограниченном гнойном процессе, отсутствии клинико-лабораторных признаков интоксикации предпочтение должно отдаваться пероральным формам препаратов.
При установлении осложненного течения раневой инфекции с вовлечением внутренних органов антибактериальная терапия должна базироваться только на инъекционных формах. в этих случаях все антибиотики должны вводиться только через катетеры, установленные в центральные вены или в артерии, при наличии гнойного процесса на нижних конечностях.
Современная антибактериальная терапия раневой инфекции базируется на обязательности адекватного хирургического лечения гнойного очага, дополненного новыми антибактериальными препаратами, назначаемыми рациональным путем и в адекватных дозах, ориентируясь на тяжесть раневого процесса при регулярном контроле состава микрофлоры в ранах и контроля переносимости проводимой терапии.
В экстренных случаях, при отсутствии возможности выполнения бактериологических исследований, иногда допускается использование антибактериальных препаратов, перечисленных в программах эмпирической и этиотропной антибактериальной терапии больных с раневой инфекцией (рис. 30).
ИСТОРИЯ РАЗВИТИЯ АНТИБАКТЕРИАЛЬНОЙ ХИМИОТЕРАПИИ
В развитии химиотерапии можно проследить три периода: до работ П. Эрлиха (до 1891 г.), период исследований П. Эрлиха и после 1935 г., когда были открыты сульфаниламиды и антибиотики.
Непреходящее и сегодня значение сохраняют тезисы Эрлиха, сформулированные на основе опыта и логики поисковой работы: "Химиотерапия ставит себе задачу найти такие вещества, которые при большом влиянии на паразитов принесли бы возможно менее вреда организму".
Важнейшие для медицинской практики антибиотики ХХ века были открыты или случайно (пенициллин), или путем так называемого направленного скрининга.
Продукты жизнедеятельности грибов и микроорганизмов (Penicillium, Streptomyces, Bacillus, а также высших грибов), обладающие способностью убивать возбудителей болезни, обозначают в узком смысле как антибиотики.
"Глядя на зараженные раны, на людей, которые мучились и умирали, я сгорал от желания найти какое-нибудь средство, которое способно убить микробы" (Флеминг А., 1881-1995 гг.).
Сегодня каждый прохожий молча, почтительно склонит голову, прочитав на могильном памятнике "Сэр Александр Флеминг - изобретатель пенициллина".
Народ нашей страны всегда будет благодарен З.В. Ермольевой - создателю отечественного пенициллина, спасшего тысячи жизней раненых в годы Великой отечественной войны.
В 1943 г. Фармакологический комитет по докладу З.В. Ермольевой принимает решение о медицинском применении отечественного пенициллина. С этой даты началась эра антибиотиков в нашей стране. З.В. Ермольева, Н.И. Гращенков, И.Г. Руфанов проводят в течение двух месяцев детальное изучение эффективности пенициллина при лечении более чем 1200 раненых (эвакогоспиталь № 5004).
1943 г. - лечение и схемы применения первого отечественного пенициллина на 25 "безнадежных" и впоследствии выздоровевших септических больных проводила врач-хирург Анна Марковна Маршак.
"Боевое крещение" отечественный пенициллин получил на 1-ом Прибалтийском фронте под руководством главного хирурга Армии Н.Н. Бурденко.
Ученик З.В.Ермольевой - С.М.Навашин, академик РАМН, профессор, лауреат Государственной премии, директор Государственного центра по антибиотикам, продолжил основные направления ее фундаментальные исследования в комплексной науке об антибиотиках с начала 50-х годов.
Под руководством С.М.Навашина за 50-летний период в ГНЦА были разработаны антибактериальные препараты практически всех групп:
- природные, пролонгированные и полусинтетические пенициллины,
- природные и полусинтетические аминогликозиды,
- полусинтетические цефалоспорины,
- тетрациклины,
- макролиды,
- резервные противотуберкулезные антибиотики,
- рифампицин и его производные,
- линкомицин,
- фузидин,
- противоопухолевые антибиотики,
- полимиксины,
- липосомальные формы антибиотиков.
Разработана отечественная технология важнейших фторхинолонов 1 поколения.
Уже в 70-е годы отечественная промышленность антибиотиков занимала второе место в мире, как по объему, так и по номенклатуре выпускаемых препаратов. В таблице на рис.1 приведена классификация антибактериальных средств.
"Золотая эра" антибиотикотерапии ознаменовалась выдающимися достижениями во всех областях медицины – снижением распространения инфекций, тяжести их течения и снижением показателя смертности при инфекционных заболеваниях. Ушли в прошлое представления о неизлечимости многих инфекционных заболеваний (сепсис, туберкулез, эндокардит, многих особо опасных инфекций и др.). Об эффективности антибиотикотерапии можно судить, например, по показателям смертности при пневмонии: до 40-х годов – 30-40%, после внедрения пенициллина - 5% (С.М. Навашин, 1997 г.).
ПРОТИВОГРИБКОВЫЕ ПРЕПАРАТЫ
Больные с раневой инфекцией, получающие длительную антибактериальную терапию сразу несколькими препаратами, являются группой высокого риска поражения микотическими инфекциями. Летальность при инвазивных микозах, вызванных, например, грибами рода Candida, достигает 85%. Кандидоз, являясь эндогенной инфекцией, может проявляться клиникой поражения грибами мозга, печени, селезенки, почек, сердца, легких, суставов. Для лечения в арсенале врача имеется только пять эффективных противогрибковых препаратов: амфотерицин В, флуконазол, итраконазол, флюцитозин и липосомальный амфотерицин В.
Наибольшее распространение в клиниках получили первые два – амфотерицин В и флуконазол. Вместе с тем, несмотря на высокую клиническую эффективность к амфотерицину В, при лечении кандидемии этот препарат используется значительно реже из-за его токсического воздействия на почки. Липосомальный амфотерицин В менее токсичен, более удобен в использовании, так как его можно вводить через периферические вены. Флуконазол считается препаратом выбора при кандидемии, раневой инфекции, перитоните, инфекции мочевыводящих путей
ЭУБИОТИКИ ДЛЯ ПРОФИЛАКТИКИ ДИСБАКТЕРИОЗА У БОЛЬНЫХ С РАНЕВОЙ ИНФЕКЦИЕЙ
Длительная антибактериальная терапия, лучевая терапия, гормоно- и химиотерапия неизбежно приводят к значительным качественным и количественным изменениям в составе нормальной микрофлоры человека. Для профилактики эндогенной инфекции у тяжелых больных применяется селективная деконтаминация пищеварительного тракта. Используется пероральное или интрагастральное введение антибиотиков, не всасывающихся в кишечнике. При раневой инфекции, если позволяет клиническая ситуация, предпочтение отдается химиотерапевтическим препаратам для местного применения. В профилактике и лечении дисбактериозов при раневой инфекции в настоящее время упор делается на применение бактериальных биологических препаратов из нормальной микрофлоры, т.е. применение эубиотиков, изготовляемых на основе бифидумбактерий, лактобацилл, кишечной палочки, споровых форм бактерий. Последними исследованиями установлена высокая эффективность биопрепарата "Бифилиз" (сочетание лизоцима и бифидумбактерина).
Для сохранения нормальной экологии кишечника необходимо включение в комплексное лечение пробиотиков.
- монокомпонентных (бифидумбактерин, лактобактерин, колибактерин, споробактерин, бактиспорин, бактисубтил и др.);
- поликомпонентных (бифилонг, ацилакт, ацинол, линекс, биоспорин);
- комбинированных (бифидумбактерин форте, бифилиз).
ПУТИ ВВЕДЕНИЯ АНТИБИОТИКА
Эффективность действия антибиотика зависит от создания высокой его концентрации в очаге поражения, что достигается назначением соответствующей дозы препарата и введением его оптимальным путем.
При местном характере гнойной инфекции с целью купирования острого гнойного процесса достаточно использование одного антибактериального препарата с обязательным местным лечением гнойной раны под повязками с мазями на полиэтиленгликолевой основе, обладающими широким спектром антимикробной активности, или современными йодофорами, диоксидином, усиливающими антимикробное действие препаратов, назначенных для общей антибактериальной терапии.
При обширных гнойных очагах, сепсисе необходимо повышать дозы антибиотиков до максимальных, с учетом видового состава микрофлоры, выделенной из разных биологических сред. Целесообразно использовать комбинации 2-3 препаратов. Препараты необходимо вводить через катетеры, установленные в центральные вены, что позволяет при лечении генерализованных форм создать и длительно поддерживать на нужном уровне концентрацию антибиотика не только в очаге поражения, но и во всем организме больного.
При локализации гнойного очага на нижних конечностях эффективно внутриартериальное введение препаратов в нижнюю надчревную артерию методом круглосуточной инфузии с помощью перфузоров.
Длительная внутриартериальная инфузия позволяет создавать и поддерживать достаточно высокую концентрацию препаратов в тканях поврежденной конечности, оставляя при этом концентрацию антибиотиков в общем кровотоке на более низком уровне. Это способствует повышению эффективности антибактериальной терапии и уменьшает возможность общего токсического воздействия антибиотиков.
КОНТРОЛЬ ЛЕКАРСТВЕННОЙ ПЕРЕНОСИМОСТИ ПРИ ДЛИТЕЛЬНОЙ ОБШЕЙ И МЕСТНОЙ АНТИМИКРОБНОЙ ТЕРАПИИ РАНЕВОЙ ИНФЕКЦИИ
Чрезмерное, часто неконтролируемое увлечение каким-нибудь одним препаратом, несоблюдение правила чередования лекарственных средств с учетом стадии течения раневого процесса или назначение одномоментно нескольких лекарственных форм, содержащих одинаковый антимикробный компонент, могут привести к сенсибилизации организма с последующим развитием местной или общей аллергической реакции, иногда с проявлениями токсического поражения внутренних органов. Для своевременной диагностики развивающейся реакции целесообразно внедрение в практику медикаментозного теста "In vitro" индекс лекарственной чувствительности (ИЛЧ) по Демьяненко С.М. (1989 г.).
При хорошей переносимости различных препаратов ИЛЧ составляет 0,96 - 1,0, а в группе с развивающейся аллергической реакцией на какой-нибудь препарат, входящий в комплексное лечение, этот показатель находится на уровне 0,76 - 0,83.
Регулярная постановка данного теста в группе больных с длительной терапией или при многокомпонентной терапии позволяет своевременно диагностировать процесс формирования замедленной аллергической реакции, уточнить истинный причинный препарат (анестетики, растворители препаратов, витамины, белковые препараты, сосудистые препараты и др.) и в ряде случаев избежать ошибочной отмены антибактериального препарата.
ПРОДОЛЖИТЕЛЬНОСТЬ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
При местном гнойном процессе достаточно введение антибиотика в течение 3-5 суток. Более длительная терапия проводится в группах больных с острыми гнойными заболеваниями мягких тканей, с генерализацией инфекционного процесса. Критерием необходимости продолжения терапии или отмены препаратов должны служить данные бактериологического контроля, а также динамика клинических показателей.
Основными критериями отмены терапии являются исчезновение патогенной микрофлоры из гнойного очага или снижение количества микробов в 1 г ткани раны, отчетливая положительная динамика клинико-лабораторных показателей раневого процесса, нормализация температуры, улучшение общего состояния больного и т.д.
Ранняя отмена антибактериальной терапии до достижения стойкого клинического эффекта может привести к рецидиву или затяжному течению заболевания и значительно осложнить дальнейшее лечение.
СТУПЕНЧАТАЯ АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ РАНЕВОЙ ИНФЕКЦИИ
В настоящее время антибиотики выпускаются в лекарственных формах, предназначенных как для парентерального введения, так и для приема внутрь (например, офлоксацин, ципрофлоксацин, пефлоксацин и др.)
Наличие двух лекарственных форм одного и того же препарата позволяет последовательно использовать их (сначала парентерально, а затем внутрь). Ориентируясь на динамику клинических признаков раневого процесса, можно сократить сроки введения препарата парентерально и перейти на прием внутрь, что значительно сокращает общие затраты на лечение (расходные материалы, трудозатраты медперсонала), улучшает комфортность лечения, сокращает сроки пребывания больного в стационаре.
В этой статье мы затронем одну из самых интересных тем антимикробной терапии, а именно периоперационную антибиотикопрофилактику. О нее за крайние годы сломано огромное количество копий и они, как ни странно, до сих пор продолжают ломаться.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
В этой статье мы затронем одну из самых интересных тем антимикробной терапии, а именно периоперационную антибиотикопрофилактику. О нее за крайние годы сломано огромное количество копий и они, как ни странно, до сих пор продолжают ломаться.
- особенностями преподавания принципов антибактериальной терапии в ВУЗах
- и достаточно легкого отношения к самим антимикробным препаратам бесконечно меняющиеся концепции антибактериальной терапии так же накладывают свой серьезный отпечаток.
Вы, наверное, помните, не так уж давно это было, как нас учили, что за неделю до операции пациент должен получить курс антибиотиков в качестве «подготовки к оперативном вмешательству. Потом передумали и стали проводить подобный курс уже после операции, причем абсолютно всем пациентам и вне зависимости от того, есть там инфекция или ее нет. Для профилактики. Чтобы было и не думалось. И этот подход так укоренился в сознании, что за 10 лет его никак не удается переломить.
Итак, чего бояться хирурги и почему они назначают антибактериальные препараты? А бояться они нагноения раны или говоря академическим языком – инфекции в области хирургического вмешательства (ИОХВ)
ИОХВ – это инфекция разреза, органа или полости, возникающая в течение 30 дней (без имплантата) или 1 года (с имплантатом) послеоперационного периода.
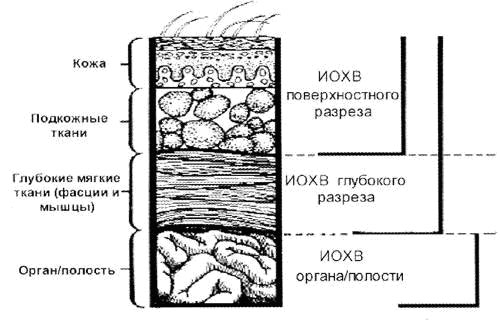
- Поверхностную ИОХВ разреза (кожа, подкожная клетчатка)
- Глубокую – ИОХВ разреза (фасция, мышцы)
- ИОХВ органа или полости
- Симптомов воспаления
- Гнойного отделяемого и лабораторное подтверждение наличия воспаления
- Достоверное микробиологическое подтверждение (окраска мазока по Граму, посев)
- необходимости вмешательство хирурга.
- Гнойное отделяемое из глубины разреза
- УЗИ и RG признаки поражения в сочетании с визуальной симптоматикой
- Спонтанное расхождение краев раны
- Присоединение глубокого поражения к поверхностному
- Необходимость хирургического вмешательства.
- Гнойного отделяемого по дренажам
- Достоверное микробиологическое подтверждение (окраска мазка по Граму, посев)
- Наличие абсцесса
Группу риска по развитию ИОХВ составляют:
- пациенты с пожилого возраста и новорожденные
- пациенты с недостатком массы тела
- больные СД
- ожирение
- сопутствующая инфекция другой локализации
- колонизация носоглотки S.aureus
- снижение местного и общего иммунитета, в т.ч. и в результате лечения.
- Особенности предоперационной подготовки – не надо брить операционное поле, это приводит к микротравматизации и увеличению риска ИОХВ
- Техника выполнения операции – при выполнении операции интернами, ординаторами и молодыми врачами, а так же в ситуациях, когда техника оперативного вмешательства еще не отточена, риски инфекции возрастают очень значительным образом.
- Несоблюдение правил асептики и антисептики
- Большая длительность операции.
- Большая кровопотеря в следствие оперативного вмешательства
- Отсутствие периоперационной антибиотикопрофилактики
- Дренирование раны
- Инфекции хирургического персонала (в том числе колонизация S.aureus)
- Степень микробной обсемененности раны
- Резистентность бактерий к антимикробной терапии.
- чистые,
- условно-чистые,
- контаминированные,
- грязные.
Чистая рана – характеризуется отсутствием признаков воспаления и вовлечения ЖКТ, МВП, дыхательных путей, а так же отсутствием технических нарушений при выполнении оперативного вмешательства.
Условно-чистая рана характеризуется вовлечением ЖКТ, мочеполовых и дыхательных путей; низкой вероятностью контаминации или незначительными техническими нарушениями при выполнении оперативного вмешательства
Контаминированная рана – имеет признаки острого негнойного воспаления; кроме того могут иметь место серьезные технические нарушения в ходе вмешательства (раны пациентов, оперированных начинающими врачами изначально должны считаться контаминированными из-за того, что техникой они еще не владеют в должном объеме)
Сюда же относится большой выброс содержимого полых органов, а также проникающие ранения со сроком менее 4 часов.
Грязные раны – характеризуются наличием гноя, предоперационной перфорацией органов и проникающими ранениями старше 4-х часов.
Итак, мы подошли к главному вопросу – когда же мы должны применить периоперационную антибиотикопрофилактику.
Периоперационную антибиотикопрофилактику мы применяем в первых трех видах ран, а в случае грязной мы с самого начала идем на антибиотикотерапию.
Почему именно тогда? В случае грязной раны возбудители могут быть какие угодно, а вот в случае первых трех, что доказано результатами многочисленных крупномасштабных исследований, ИОХВ вызовут в основном:
- Стафилококки
- Энтеробактер
- Коагулазонегативные стафилококки
- Энтерококки
- Стрептококки
- Кишечная палочка
А что же такое периоперационная антибиотикопрофилактика (ПАП) и какие цели мы перед ней ставим? Это предоперационное в/в введение антибиотика для уменьшения риска развития раневой инфекции, благодаря созданию в ране концентрации, достаточной для снижения уровня микробной контаминации тканей по ходу операционного разреза.
Давайте обратимся к очень известной картинке, которую всегда демонстрируют, когда речь идет о профилактике инфекций в хирургии:
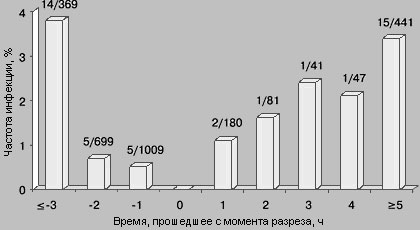
Обратите внимание, что с момента разреза контаминация тканей начинает расти в геометрической прогрессии. И введение антибиотика после операции выглядит как пальба из пушки по воробьям. При этом введение антибиотика не должно быть заблаговременным, ибо через 2-3 часа он уже будет выведен из организма, а значит и не подавит размножение микробов в ране. Таким образом, оптимальным интервалом введения, является введение антимикробного препарата за 30-40 минут до операционного разреза.
- В каких случаях следует проводить антибиотикопрофилактику?
- Какие препараты следует использовать?
- Когда необходимо начинать введение антибиотиков?
- Сколько препаратов необходимо назначить?
- Какова должна быть продолжительность антибиотикопрофилактики?
По первому пункту и третьему пунктам мы уже разобрались – профилактируем мы чистые, условно-чистые и контаминированные раны. Грязные мы начинаем сразу же лечить. А препарат вводим за 30-40 минут до разреза.
- Избирательность применения антимикробных препаратов. Т.е. препараты, применяющиеся с целью ПАП не должны больше использоваться ни в одной схеме антимикробной терапии в стационаре. Это делается для того, чтобы на максимально долгое время отсрочить развитие антибиотикорезистентности у микроорганизмов, вызывающих ИОХВ.
- Препарат должен вводится непосредственно перед операцией, за 30-40 минут до первого разреза.
- Пациентам с высокой массой тела необходимо пересчитывать дозу в сторону ее увеличения
- При длительных операциях препарат должен вводиться дважды, исходя из наиболее часто использующихся препаратов, повторная доза должна быть введена через 3-4 часа от начала оперативного вмешательства, так как это напрямую связано с фармакокинетикой антибиотика, конкретно с его периодом полувыведения (Т1/2)
- Применение ПАП более чем через 24 ч не приводит к увеличению ее эффективности. Исключением в данной ситуации являются оперативные вмешательства, проводимые молодыми врачами, осваивающими технику оперативных вмешательств. В этой ситуации антибиотикопрофилактика продляется до 72 часов.
- пациентов с трахеостомой или интубированных (для профилактики инфекций дыхательных путей);
- пациентов с постоянным мочевым катетером;
- пациентов с центральными венозными катетерами или дренажами плевральной полости;
- большинства пациентов с открытыми ранами, в том числе и ожоговыми.
Связано это с тем, что раны подвергаются постоянной контаминации и добиться там эрадикации не представляется возможным. За такими за пациентами необходим тщательный уход и контроль состояния, для того чтобы немедленно начать антибактериальную при первых же признаках инфекции
- По спектру активности – он должен включать всех наиболее часто встречающихся возбудителей
- Доза препарата должна быть обычной терапевтической (исключение – лица с ожирением)
- Время введения препарата 30-40 мин до разреза, строго!
- Кратность введения определяется Т1/2 и длительностью операции. Для основных препаратов для ПАП справедливо правило о повторном введении антибиотика через 3-4 часа от начала операции.
- легко доступен,
- дешев,
- не использоваться в схемах антибиотикотерапии в стационаре.
Почему только там? Цефазолин относится к препаратам с грам(+) активностью, он отлично воюет с грамположительными кокками, но совершенно непригоден в случае грамминус возбудителей.
Кроме того, применяя этот препарат следует помнить об общем класс-эффекте всех цефалоспоринов – лекарственные гипертермии. Примерно каждый сотый пациент выдает на цефазолин гипертермию, которая от истинной отличается тем, что проходит на фоне относительной брадикардии. Таким образом, если после АБП цефазолином у вашего пациента поднялась температура тела, а операция была чистой и в своей технике вы уверены, прежде чем паниковать и бросаться лечить его мощными антибиотиками – осмотрите рану, возьмите клинические анализы и посчитайте пульс!
Прекраснейший антибактериальный препарат, перекрывающий всех возбудителей ИОХВ и как следствие могущий использоваться при всех 3-х видах оперативных вмешательств в дозе 1,2 г в/в за 30-40 мин до разреза…
Во-вторых, его крайне сложно вывести из оборота в стационаре, так как он входит в схемы лечения многих инфекций, а что актуально конкретно для вас, так то, что он является препаратом первой линии в лечении сепсиса, тяжелых пневмоний и нейтропенических лихорадок, так же он является препаратом выбора в практике оториноларингологов. И если пациенты с подобными состояниями проходят лечение в ваших стационарах, использование амкоксициллин/клавуланата с целью ПАП принесет больше проблем, чем пользы, так как вызовет селекцию резистентных к нему штаммов. Если же подобные состояния у вас не встречаются – смело можете выводить данный препарат из общебольничной практики и использовать его в качестве периоперационной профилактики ИОХВ.
3) Ампициллин/сульбактам – перекрывает все тех же возбудителей, что и амоксициллин/клавуланат, но более дешев, легче выводится из общего оборота стационара.
Вводится по 3 г в/в за 30-40 мин до разреза. Повторная доза, если она потребуется, вводится через 3-4 часа от начала оперативного вмешательства
Отдельно следует упомянуть, что если пациент имеет в анамнезе данные об аллергических реакциях на препараты пенициллинового ряда, препаратом выбора в данной ситуации становится Клиндамицин в дозе 0,6 г.
Более подробно о методах и схемах периоперационной антибиотикопрофилактики вы можете познакомиться в следующих руководствах:
5) Антибактериальная профилактика инфекций в области хирургического вмешательства в колоректальной хирургии.
Читайте также:

