Антифосфолипидный синдром и вич
Обновлено: 07.05.2024
Антифосфолипидный синдром – это патологическое состояние, относящееся к группе тромбофилий, для которых характерно повышенное тромбообразование. Это одна из самых актуальных проблем междисциплинарного характера. Истинная частота патологии неизвестна. Согласно данным разных авторов, ею страдает от 0 до 14% населения в мире, в зависимости от региона. Средний показатель составляет 2–4%.
Стаж работы более 40 лет.
Статья проверена заместителем генерального директора, врачом акушер-гинекологом Дмитриевым Дмитрием Викторовичем.
- Причины антифосфолипидного синдрома
- Признаки и симптомы антифосфолипидного синдрома
- Диагностика антифосфолипидного синдрома
- Лечение антифосфолипидного синдрома
- Профилактика антифосфолипидного синдрома
- Нет времени читать?
Данная статья не может быть использована для постановки диагноза, назначения лечения и не заменяет прием врача.
Антифосфолипидный синдром (АФС) является аутоиммунным процессом не воспалительного генеза.
При этом процессе иммунные клетки вырабатывают антитела, направленные на уничтожение фосфолипидов – структурные образования сосудистых и нервных клеток, а также мембран тромбоцитов. Особую опасность представляют осложнения антифосфолипидного синдрома у беременных — мертворождение, преждевременные роды, выкидыши, тяжелая форма преэклампсии. Чтобы это предотвратить, еще на этапе подготовки к беременности должна быть проведена необходимая диагностика, исключена приобретенная или наследственная тромбофилия посредством анализа крови.
Различают такие виды данной патологии:
- катастрофический АФС – тромбообразование в разных органах за короткий срок (до семи часов);
- первичный – без проявлений красной волчанки или сопутствующих инфекционных болезней;
- вторичный – на фоне системной волчанки;
- синдром без специфических антител;
- АФС, проявляющийся симптомами, характерными для других форм тромбофилий.
Виды АФС, обусловленные наличием или отсутствием антифосфолипидных антител:
- серопозитивная форма – в крови помимо специфических антител выявлен волчаночный антикоагулянт;
- серонегативная форма – отсутствие волчаночного антикоагулянта, отсутствие антител к кардиолипину.
Диагностика антифосфолипидного синдрома и его формы возможна только в условиях современной лаборатории, оснащенной высокочувствительным техническим оборудованием и высококачественными реагентами.
Причины антифосфолипидного синдрома
Причины антифосфолипидного синдрома первичной формы, как и любых других аутоиммунных заболеваний, не установлены. Современным ученым удалось выделить группу факторов, при воздействии которых вероятность развития болезни повышается. К основным из них относятся:
- генетический фактор — наличие заболевания у родственников сопряжено с повышенным риском патологии у женщины;
- бактериальные инфекции, вызванные стрептококками, стафилококками, туберкулезной бациллой;
- вирусные инфекции: ВИЧ, цитомегаловирус, гепатит, вирус Эпштейн-Барр, инфекционный мононуклеоз и другие;
- аутоиммунные состояния: волчанка, узелковый периартериит, тромбоцитопеническая пурпура, склеродермия и другие;
- ревматоидный артрит;
- злокачественные новообразования;
- продолжительный прием определенных медикаментов: психотропная группа, оральные противозачаточные средства, интерфероны.
Здесь нужно понимать, что наличие одного или даже нескольких из вышеперечисленных факторов не является диагностическим критерием, но пациентам из группы риска следует более внимательно относиться к своему здоровью.
Признаки и симптомы антифосфолипидного синдрома
Клинические признаки всех форм АФС обусловлены тромбозом. Симптомы антифосфолипидного синдрома зависят от локализации процесса, размера и вида сосуда, скорости развития тромбоза. При поражении мелких сосудов симптомы антифосфолипидного синдрома развиваются медленно, постепенно прогрессируют, напоминают поражение органа хроническим воспалительным процессом. При поражении крупных сосудов функция соответствующего органа нарушается резко, что приводит к катастрофическим изменениям.
Проявления при поражении определенных органов и систем:
- нижние конечности: отеки, болезненность, гиперемия, изъязвления, гангрена;
- нервная система: энцефалопатия, мигрень, тугоухость, нейропатия, парестезия, амнезия и микроинсульт;
- сердце: кардиомиопатия, гипертония и инфаркт;
- почки: признаки почечной недостаточности;
- печень: симптомы портальной гипертензии;
- кожа: синюшная сеточка, сыпь и гангрена пальцев;
- беременность: отслойка плаценты и самопроизвольный аборт.
Редко поражаются сосуды легких, желудка или кишечника.
При поражении нижних конечностей пациенты жалуются на интенсивную боль в ногах, которая усиливается после физической нагрузки и уменьшается после отдыха. Некоторые больные отмечают усиление болевых ощущений при опущении конечностей ниже уровня головы. Кожа ног бледная, иногда — синюшная, на ощупь — холодная, при хроническом, медленно развивающемся процессе заметны трофические изменения.
При поражении центральной нервной системы больные жалуются на приступы головных болей. Боль чаще всего боль локализуется в правой или левой половине головы, интенсивная, усиливается от малейшего шума или даже света. Иногда приступам предшествуют слуховые или зрительные галлюцинации, вспышки света перед глазами.
О развитии энцефалопатии говорят забывчивость, невозможность сориентироваться на месте и во времени, головокружение, снижение когнитивных возможностей. Интеллектуальные задачи, с которыми пациент раньше справлялся без проблем, становятся непосильными. В конечностях или на определенных участках тела снижается чувствительность, появляется ощущение покалывания, ухудшается переносимость низких температур. При поражении сердечно-сосудистой системы отмечаются повышенное артериальное давление, периодические боли в сердце. Несмотря на адекватную терапию, у больного происходят сердечно-сосудистые катастрофы — инсульты и инфаркты.
Почечная недостаточность развивается постепенно. На начальных этапах пациенты чувствуют себя удовлетворительно. При значительном нарушении функции появляются тошнота, рвота, общая слабость, головокружение, уменьшается количество мочи. В крови значительно повышается уровень креатинина и мочевины — основных показателей азотистого обмена, которые в норме выводятся почками. О поражении печени свидетельствуют скопление жидкости в животе, чувство тяжести и боль в правом подреберье, горечь во рту. Возможно развитие желтухи.
Беременные женщины — особенная категория больных АФС. Выносить и родить здорового ребенка без адекватной сопроводительной терапии таким пациенткам практически невозможно. В большинстве случаев у женщин диагностируется замершая беременность на ранних сроках и самопроизвольные выкидыши. Даже если беременность не прервалась на раннем сроке, очень высока вероятность преждевременных родов, внутриутробной гибели плода и преждевременной отслойки плаценты.
Диагностика антифосфолипидного синдрома
Диагностика антифосфолипидного синдрома включает оценку клинических проявлений, данные лабораторных и визуальных исследований.
Верность диагноза зависит от наличия саппоровских критериев, включающих:
- эпизоды тромбоза, даже единственный эпизод;
- патология беременности;
- смерть нормально развивающегося плода до десятинедельного срока;
- преждевременная родовая деятельность;
- два и более выкидыша;
- наличие антикардиолипиновых антител;
- выявление волчаночного антикоагулянта.
Лабораторная диагностика антифосфолипидного синдрома считается достоверной при соблюдении таких условий:
- умеренно повышенный или высокий уровень антител к кардиолипину определяется дважды. Минимальный интервал между обследованиями — 12 недель;
- тест на волчаночный антикоагулянт в плазме крови проводится дважды, с интервалом в 6 недель.
Лечение антифосфолипидного синдрома
Лечение антифосфолипидного синдрома нацелено на снижение рисков тромбообразования, заключается в пожизненном приеме антикоагулянтов. Поскольку причины синдрома неизвестны, то и единых протоколов лечения данного заболевания на сегодняшний день нет.
Основная цель терапии — нормализация работы свертывающей системы крови, предотвращение осложнений антифосфолипидного синдрома, предупреждение повторных эпизодов заболевания. С этой задачей успешно справляется варфарин — непрямой антикоагулянт. Эффективную дозу подбирают индивидуально, ориентируясь на лабораторные показатели свертывания крови. Беременным варфарин противопоказан, так как препарат приводит к формированию врожденных пороков у плода. Женщинам, вынашивающим ребенка, рекомендуют прием низких доз аспирина в комбинации с низкомолекулярными гепаринами. Данные препараты обладают высокой эффективностью, при минимальной вероятности развития осложнений. Данная терапия продолжается в послеродовом периоде. Доза препаратов, длительность лечения определяется индивидуально, в зависимости от наличия и исхода предыдущих беременностей, эпизодов беременности в анамнезе.
Глюкокортикоиды и цитостатические средства назначаются только при наличии системных воспалительных заболеваний соединительной ткани. То есть, препараты этих групп нужны для лечения основного заболевания. По показаниям подбирают симптоматическую терапию — обезболивающие, противовоспалительные, средства, улучшающие реологические свойства крови и состояние стенок кровеносных сосудов.
Профилактика антифосфолипидного синдрома
Профилактика антифосфолипидного синдрома остается очень сложной проблемой. Это объясняется особенностями механизма развития и разнообразностью клинических проявлений.
Первичная профилактика антифосфолипидного синдрома заключается в устранении тех факторов риска, на которые можно повлиять:
- уровень артериального давления;
- показатели жирового обмена;
- курение;
- активность системных воспалительных заболеваний соединительной ткани, в частности, системной красной волчанки;
- инфекционные процессы с латентным характером течения;
- психоэмоциональные стрессы.
Особое внимание следует уделить режиму дня, питанию. Пациентам из группы риска категорически противопоказаны как физические, так и умственные переутомления. Больных обучают планировать труд и отдых, эффективно восстанавливать силы. Из рациона следует исключить алкогольные напитки, ограничить острые, пряные блюда, жирную, жареную пищу. Пациентам следует употреблять как можно больше овощей, фруктов, нежирные сорта мяса и рыбы.
Медикаментозная профилактика тромбозов заключается в пожизненном приеме препаратов, препятствующих образованию тромбов.
У вас есть вопросы? Проконсультируйтесь с нашими опытными врачами и эмбриологами.

15 мая 2019 г. European League Against Rheumatism опубликовала рекомендации по лечению антифосфолипидного синдрома у взрослых .
1. У бессимптомных носителей антифосфолипидных антител ( не подходящих никаким сосудистым или акушерским классификационным критериям антифосфолипидного синдрома) с профилем антифосфолипидных антител высокого риска, с или без традиционных факторов риска, рекомендуется профилактическое лечение с применением аспирина в низкой дозе (75 - 100 мг в день).
2. У пациентов с системной красной волчанкой и без наличия в анамнезе тромбозов или осложнений беременности:
А. с профилем антифосфолипидных антител высокого риска рекомендуется профилактическое лечение с применением аспирина в низкой дозе.
В. с профилем антифосфолипидных антител низкого риска можно рассмотреть профилактическое лечение с применением аспирина в низкой дозе.
3. У небеременных женщин с наличием в анамнезе только акушерского антифосфолипидного синдрома (с или без системной красной волчанки) , после надлежащей оценки риск/польза рекомендуется профилактическое лечение с применением аспирина в низкой дозе.
4. У пациентов с точным антифосфолипидным синдромом и впервые возникшим венозным тромбозом:
А. рекомендуется лечение с применением антагонистов витамина К с целевым МНО 2 - 3.
В. нельзя применять ривароксабан у пациентов с тремя положительными подтипами антифосфолипидных антител ввиду высокого риска рецидивных событий. Можно рассмотреть применение НОАК у пациентов, которые не могут достигнуть целевых значений МНО несмотря на хорошую приверженность к приему антагониста витамина К, либо у пациентов с противопоказаниями к применению антагонистов витамина К (например аллергия или непереносимость).
С. у пациентов с непровоцированным впервые возникшим венозным тромбозом, антикоагуляция должна продолжаться длительное время.
5. У пациентов с точным антифосфолипидным синдромом и рецидивным венозным тромбозом несмотря на лечение с применением антагониста витамина К с целевым МНО 2 -3:
А. необходимо рассмотреть расследование приверженности и обучение приверженности к применению антагониста витамина К, совместно с частым тестированием МНО.
В. если целевые значения МНО 2 -3 достигнуты, то можно рассмотреть добавление аспирина в низкой дозе, повышение МНО до 3 - 4 или замену на низкомолекулярный гепарин.
6. У пациентов с точным антифосфолипидным синдромом и впервые возникшим артериальным тромбозом:
А. Рекомендуется применение антагониста витамина К, чем изолированное применение аспирина в низкой дозе.
В. Рекомендуется применение антагониста витамина К с целевым МНО 2 -3 или МНО 3 - 4, с учетом индивидуального риска кровотечений и рецидивных тромбозов. Можно также рассмотреть применение антагониста витамина К с целевым МНО 2 -3 плюс аспирин в низкой дозе.
С. нельзя применять ривароксабан у пациентов с тремя положительными подтипами антифосфолипидных антител и с артериальными событиями. На основании имеющихся сейчас доказательств, не рекомендуется применение НОАК у пациентов с точным антифосфолипидным синдромом и с артериальными событиями ввиду высокого риска рецидивных тромбозов.
7. У пациентов с рецидивным артериальным тромбозом несмотря на должное лечение с применением антагониста витамина К, после оценки на другие потенциальные причины можно рассмотреть повышение МНО до 3 - 4, добавление аспирина в низкой дозе, или замену на низкомолекулярный гепарин.
Акушерский антифосфолипидный синдром.
8. У женщин с профилем антифосфолипидных антител высокого риска, но без наличия в анамнезе тромбозов или осложнений беременности (с или без системной красной волчанки) необходимо рассмотреть лечение с применением аспирина в низкой дозе (75 - 100 мг в день) во время беременности.
9. У женщин с наличием в анамнезе только акушерского антифосфолипидного синдрома (без предшествующих тромботических событий), с или без системной красной волчанки:
А. с наличием в анамнезе ≥ 3 рецидивных спонтанных абортов в сроке < 10 недель гестации и у женщин с наличием в анамнезе потерей плода (≥ 10 недель гестации), рекомендуется во время беременности применение комбинированного лечения с аспирином в низкой дозе плюс гепарин в профилактической дозе.
В. с наличием в анамнезе родов в сроке < 34 недель гестации из-за эклампсии или тяжелой преэклампсии, либо по причинам плацентарной недостаточности, рекомендуется (с учетом индивидуального профиля риска) лечение с применением аспирина в низкой дозе, либо аспирина в низкой дозе с гепарином в профилактической дозе.
С. при клиническом некритериальном акушерском антифосфолипидном синдроме таком как с наличием 2х рецидивных спонтанных абортов < 10 недель гестации, либо роды в сроке ≥ 34 из за эклампсии или тяжелой преэклампсии, можно рассмотреть (с учетом индивидуального профиля риска) лечение с применением изолированно аспирина в низкой дозе или в комбинации с гепарином.
Д. При акушерском антифосфолипидном синдроме, пролеченном с применением профлактической дозы гепарина во время беременности, необходимо рассмотреть продолжение гепарина в профилактической дозе в течение 6 недель после родов для снижения риска тромбоза у матери.
10. У женщин с критериальным акушерским антифосфолипидным синдромом с рецидивными осложнениями беременности несмотря на комбинированное лечение аспирином в низкой дозе и гепарином в профилактической дозе, можно рассмотреть повышение дозы гепарина до терапевтической дозы, либо добавление гидроксихлорохина или преднизолона в низкой дозе в первом триместре. В очень отобранных случаях можно рассмотреть применение в/в иммуноглобулина.
11. У женщин с наличием в анамнезе тромботического антифосфолипидного синдрома, рекомендуется применение комбинации лечения аспирина в низкой дозе и гепарина в терапевтической дозе во время беременности.
Катастрофический антифосфолипидный синдром.
12.
А. Рекомендуется неотложное лечение инфекций путем раннего применения антиинфекционных препаратов у всех пациентов с положительными антифосфолипидными антителами и минимизация перерывов в антикоагуляции или низких уровней МНО у пациентов с тромботическим антифосфолипидным синдромом с целью профилактики развития катастрофического антифосфолипидного синдрома.
В. Для лечения первой линии пациентов с катастрофическим антифосфолипидным синдромом рекомендуется комбинированное лечение с глюкокортикоидами, гепарином и плазмаферезом или в/в иммуноглобулином, чем какой либо изолированный препарат или другая комбинация лечения. Дополнительно, необходимо проводить соответствующее лечение любых провоцирующих факторов (например инфекции, гангрены или рака).
У пациентов с рефрактерным катастрофическим антифосфолипидным синдромом можно рассмотреть истощение В-леток (например ритуксимаб) или подавление комплемента (например экулизумаб).
Было несколько выкидышей? Во время прошлой беременности диагностировали тяжелую форму преэклампсии? В прошлом развивался артериальный или венозный тромбоз? Чтобы повысить шансы на успешное вынашивание беременности, необходимо исключить АФС.
Что такое АФС?
АФС – аутоиммунное состояние, когда антитела к фосфолипидным комплексам, присутствующим в самых разных органах человека, начинают атаковать ткани собственного организма, поскольку воспринимают их как чужеродные и, как следствие, пытаются противостоять мнимой угрозе.
Несмотря на то что теоретически пострадать может любая система, чаще всего АФС становится причиной тромбозов (как артериальных, так и венозных), в результате чего развиваются такие опасные патологии, как тромбоэмболия, инсульт и инфаркт. Кроме того, синдром провоцирует серьезные осложнения во время беременности.
Сразу следует отметить, что сама по себе продукция антител к фосфолипидам не может стать причиной тромбоза. Необходимо некое событие, которое станет фактором, запускающим активацию иммунных сил организма. Что это может быть? Например, беременность, травма и стрессовое состояние.
Виды АФС
Антифосфолипидный синдром подразделяется на первичный и вторичный. Клинические проявления у обеих форм одинаковые – это тромбозы различной локализации, невынашивание беременности, акушерские осложнения (задержка роста плода, преэклампсия, отслойка плаценты). Разница лишь в наличии или отсутствии фонового заболевания, которое могло стать причиной появления АФС.
Возникает у пациентов без сопутствующей аутоиммунной патологии, онкологических, инфекционных процессов. Другими словами, нет никакой явной причины для выработки антифосфолипидных антител.
- Вторичный антифосфолипидный синдром на фоне аутоиммунных патологических состояний: ревматоидный артрит, системная красная волчанка, системная склеродермия, неспецифический язвенный колит, аутоиммунный тиреоидит и т.п.
- Антифосфолипидный синдром, протекающий на фоне злокачественной патологии (карциномы, тимомы, опухоли лимфатической системы).
- АФС, возникший на фоне инфекционно-воспалительных процессов, а также инфекционно-иммунологической патологии (ВИЧ, гломерулонефрит, бронхиальная астма и другие).
- АФС, возникший на фоне системных патологий, таких как хроническая почечная или печеночная недостаточность.
Критерии антифосфолипидного синдрома
1. Клинические критерии:
- Тромбоз любой локализации. Это может быть венозный тромбоз (поражающий вены нижних или верхних конечностей, тромбоз венозных синусов головного мозга); артериальный тромбоз (в сосудах конечностей, артериях сердца – инфаркт миокарда, артериях мозга – ишемический инсульт, сосудах брюшной полости – мезентериальный тромбоз, тромбоз почечных артерий и т.д.), тромбоз сосудов сетчатки, а также тромботические поражения микрососудистого русла – например, подкожные диффузные тромбозы, которые проявляются сетчатым рисунком на коже (сетчатое ливедо).
- 3 или более последовательные потери морфологически нормального плода на сроке беременности до 10 недель. Если у погибшего плода выявлена хромосомная патология, такой случай потери беременности не учитывается в качестве критерия АФС.
- Хотя бы одна потеря морфологически нормального плода на сроке беременности более 10 недель (антенатальная гибель, поздний выкидыш).
- Преждевременные роды на сроке до 34 недель беременности, произошедшие по причине отслойки плаценты, тяжелой преэклампсии, плацентарной недостаточности.
2. Лабораторные критерии:
- положительный анализ крови на волчаночный антикоагулянт,
- антитела к кардиолипину IgG и(ли) IgM, определенные методом ИФА, в титре 40 ЕД/мл и выше (при норме лаборатории не более 20 ЕД/л),
- антитела к бета-2-гликопротеину IgG и(ли) IgM, определенные методом ИФА, в титре 40 ЕД/мл (при норме лаборатории не более 20 ЕД/мл)
Важно: лабораторный критерий считается соблюденным, если выявлены позитивные антитела как минимум дважды с интервалом не менее 12 недель между анализами, но не более 5 лет.
Кроме того, диагноз АФС не считается подтвержденным, если между клиническими проявлениями (тромбоз или потеря беременности) и положительным лабораторным тестом прошло более 5 лет.
Вероятный антифосфолипидный синдром
Симптомы антифосфолипидного симптома
Обеспокоенность врача могут вызвать такие эпизоды в прошлом пациентки, как:
- замершие беременности на сроке от 10 недель (даже один такой случай является поводом для обследования на наличие АФС);
- преждевременные роды на сроке до 34 недель, в случае если во время беременности были выявлены) тяжелые формы преэклампсии или фетоплацентарная недостаточность;
- выкидыши (3 и более) на ранних сроках (до 10 недель), если причины этого обнаружить не удалось;
- гипоксия (состояние, обусловленное недостаточным поступлением кислорода) и задержка развития плода;
- преждевременная отслойка нормально расположенной плаценты.
Также в группе риска находятся женщины, у которых в прошлом развивались венозные или артериальные тромбозы во время беременности, на фоне приема оральных контрацептивов или после рождения ребенка.
Диагностика антифосфолипидного синдрома
На консультации гемостазиолога специалист назначает пациентке анализ крови на АФС, позволяющий обнаружить специфические антитела и определить их титр (количество). Дополнительно врач ориентируется на такие проявления синдрома, как выкидыши и преждевременные роды, тромбозы, а также другие критерии.
АФС во время беременности
Чтобы предотвратить развитие опасных осложнений, врач назначает лечение с самого начала беременности.
Если имеются соответствующие показания, специалист может назначить антикоагулянты (препараты, которые уменьшают вязкость крови) и антиагреганты (вещества, которые препятствуют склеиванию эритроцитов и тромбоцитов).
Дополнительно рекомендуется прием витаминов группы B (в том числе фолиевой кислоты) и магния.
Если беременная женщина страдает АФС, у нее развивается прогестероновая недостаточность, поэтому с самого начала беременности врач назначает препараты прогестерона.
Ведение беременности должно осуществляться под контролем опытного врача-гемостазиолога. Необходимо тщательное наблюдение за состоянием будущей мамы и малыша, а также коррекция дозировки препаратов на основании результатов исследований. При отсутствии адекватного лечения вероятность успешного исхода беременности очень мала. Если терапию начали проводить своевременно, шансы заметно возрастают.
Лечение и профилактика АФС
Рассуждая о возможности профилактики антифосфолипидного синдрома, мы вынуждены признать, что предотвратить (в буквальном смысле) его появление невозможно. Нарушения в иммунной системе могут возникать как спонтанно, непредсказуемо, так и после воздействия провоцирующих факторов (хроническое заболевание, инфекция, прием гормональных препаратов). Поэтому работа с пациентами, имеющими антифосфолипидный синдром, сводится к лечению и профилактике тромбозов, а также предупреждению осложнений беременности.
Важно: следует понимать, что никакие современные методы лечения не преследуют цель полностью устранить антифосфолипидные антитела из крови. Процесс их выработки стихийный. Количество антител в крови может спонтанно меняться с течением времени: повышаться или понижаться, вплоть до полного исчезновения, либо появляться вновь после долго отсутствия. Динамика уровня антител мало зависит от применяемых методов лечения.
Цель назначения лекарственных препаратов – предупредить осложнения, вызываемые присутствием патогенных антител в крови. Другими словами, зная о наличии антифосфолипидных антител, мы предпринимаем меры для того, чтобы из воздействие на организм не привело к макро- и микротромбозам.
1. Антикоагулянтная и антиагрегантная терапия.
Пациенты, у которых не было тромботических осложнений в прошлом и нет беременности в настоящее время, никакие разжижающие препараты принимать не должны.
Антикоагулянты и дезагреганты (препараты, снижающие активность свертывающей системы крови) назначаются в следующих ситуациях:
- лечение свершившегося тромбоза (обычно не менее чем в течение 6 месяцев после эпизода венозного тромбоза, а после инсульта или инфаркта дезагреганты назначаются пожизненно);
- период вынашивания беременности. Сроки начала приема препаратов могут различаться: часть пациенток начинает лечение только с положительного теста на беременность, другие – заранее, с цикла, в котором планируется зачатие;
- период проведения программы ЭКО. Препараты, используемые для стимуляции овуляции, имеют свойство повышать свертываемость крови, поэтому пациентки с тромбофилией принимают антитромботические препараты уже на этапе стимуляции, а не только в период переноса эмбриона;
- также кратковременно можно рекомендовать прием разжижающих препаратов пациентам с АФС при проведении оперативных вмешательств, лечении травм (иммобилизации), длительных авиаперелетах.
2. Противомалярийные средства
В ряде случаев пациенткам с невынашиванием беременности или акушерскими осложнениями в анамнезе дополнительно назначаются препараты, относящиеся к группе противомалярийных. Они имеют свойство снижать агрессивность антифосфолипидных антител даже при очень высоком их титре в крови. Такие препараты не используются рутинно, но могут быть полезны в случаях, когда назначение только лишь антикоагулянтов и антиагрегантов оказалось неэффективным.
3. Иные методы лечения
В индивидуальном порядке, в комплексе с вышеописанными методами лечения антифосфолипидного синдрома, врач может назначать такие процедуры, как проведение гирудотерапии (например, перед вступлением в протокол ЭКО или при планировании естественной беременности), плазмаферез, курсы введения человеческого иммуноглобулина. Данные методы лечения не доказали свою эффективность в клинических исследованиях, однако могут быть использованы в некоторых ситуациях по усмотрению лечащего врача.
Антифосфолипидный синдром (АФС) — системное аутоиммунное заболевание с артериальным или венозным тромбозом различной локализации, с невынашиванием беременности (спонтанные аборты, выкидыши, внутриутробная гибель плода) и с&n

Антифосфолипидный синдром (АФС) — системное аутоиммунное заболевание с артериальным или венозным тромбозом различной локализации, с невынашиванием беременности (спонтанные аборты, выкидыши, внутриутробная гибель плода) и с высоким титром патогенетически значимых антител к фосфолипидам (ФЛ), таких как антитела к кардиолипину (КЛ), антитела к волчаночному антикоагулянту (ВА) и антитела к кофакторным белкам (протромбин, протеин С, протеин S, аннексин V, простациклин и бета2-гликопротеин-I (бета2-ГП-I) [13].
Изучение АФС началось в 1907 г. с разработки Васcерманом лабораторного метода диагностики сифилиса. Впервые АФС описал в 1986 г. английский ревматолог Hughes G. R. V. С этого времени начинается интенсивное изучение патофизиологических и клинических особенностей АФС. Критерии диагностики АФС, которые были сформулированы в октябре 1998 г. на VIII международном симпозиуме, делятся на клинические и лабораторные (табл.).
Клинические критерии АФС:
Один или более клинических эпизодов артериального, венозного тромбоза или тромбоза сосудов малого диаметра, в любых тканях или органах. Тромбоз должен быть подтвержден картиной ультразвукового доплеровского сканирования или данными гистологического исследования, за исключением поверхностных венозных тромбозов. При гистологическом исследовании тромбоз должен быть представлен значительными изменениями сосудистой стенки невоспалительного характера.
а) Один или более необъяснимых случаев смерти морфологически нормального плода на 10-й или позже неделе нормальной беременности, причем нормальная морфология плода должна быть документирована данными ультразвукового сканирования или непосредственным исследованием плода или
b) Один или более случаев преждевременных родов морфологически нормального плода к 34-й или ранее неделе беременности вследствие тяжелой преэклампсии или эклампсии, или тяжелой плацентарной недостаточности или
с) Три или более необъяснимых последовательных аборта до 10-недельного срока беременности. При этом без патологических или анатомических аномалий и/или гормональных нарушений у матери, причем хромосомные причины должны быть исключены у отца и матери.
Лабораторные критерии АФС:
Умеренный или высокий уровень антител к КЛ класса IgG и/или IgМ в крови в двух или более исследованиях, полученных с интервалом не менее 6 недель, измеренных путем стандартного и иммуноферментного метода (ИФА) для бета2-ГП-I-зависимых антител к КЛ.
Позитивный тест на наличие волчаночного антикоагулянта в плазме в двух или более исследованиях, полученных с интервалом не менее 6 недель [10].
Достоверный АФС диагностируется при наличии, по крайней мере, одного клинического и одного лабораторного критерия [5]. К сожалению, данные критерии разработаны для диагностики АФС у взрослых и не учитывают особенностей детского возраста.
Выявление АФС в педиатрии имеет важное прогностическое значение, поскольку предполагает высокий риск тромбозов, а также определяет течение и исход основного заболевания. Впервые ассоциации между наличием циркулирующего антикоагулянта и сосудистым тромбозам у детей были отмечены в 1972 г. у детей с системной красной волчанкой (СКВ) [10].
Диагноз АФС для ребенка является достоверным при наличии клинического критерия и хотя бы одного лабораторного критерия.
Нужно отметить, что при подозрении АФС у детей важным критерием для постановки диагноза является семейный анамнез, наличие у родственников:
В исследуемых группах больных с АФС выявлены АФС-ассоциированные признаки заболевания: тромбоцитопения, мигрень или мигренеподобные головные боли, кровотечения из носа, сетчатое ливедо, эпилепсия, нарушения клапанного аппарата сердца, асептический некроз костей, хорея (гиперкинезы) и артериальная гипертензия. Данные проявления не являются клиническими критериями, но их наличие в совокупности с антителами к ФЛ представляет собой важный диагностический фактор для детей с АФС [14].
Выделяют несколько клинических вариантов АФС как у детей, так и у взрослых:
Вторичный АФС (ВАФС) развивается у больных с ревматическими и аутоиммунными заболевания, со злокачественными новообразованиями, при применении ряда лекарственных препаратов (гормональных, контрацептивных, психотропных веществ, Новокаинамида, высоких доз интерферона альфа), инфекционных заболеваниях (герпесвирусная инфекция, микоплазмоз).
Катастрофический АФС — мультисистемные, преимущественно органные тромбозы на уровне микроциркуляторного русла с высоким титром антител к ФЛ, диссеминированная внутрисосудистая активация с тромбозом в сосудах с небольшим диаметром, полиорганное поражение организма. Диагностирующим критерием для катастрофического АФС у детей является вовлечение в тромботический процесс не менее трех систем организма человека с гистологическим подтверждением микроваскулярной окклюзии и наличие антифосфолипидных антител (АФА).
Неонатальный АФС. Это редкая патология имеет место у новорожденных детей при передаче тромботических факторов трансплацентарным путем от матерей с высокими АФА. Часто беременность на фоне высоких титров АФА разрешается мертворождением плода на раннем этапе гестации.
Наиболее распространенными формами АФС у детей являются ПАФС и ВАФС.
J.-C. Pitte и соавт. (1993) разработали ряд критериев, исключающих ПАФС:
Антитела к ФЛ представлены различными классами (IgG, IgM, IgA) и имеют фосфолипидную специфичность. ФЛ — гетерогенная группа молекул с различным химическим строением и электрическим зарядом. К отрицательно заряженным ФЛ относятся: фосфатидилглицерин — КЛ, фосфатидилинозитол, а к нейтральным — фосфатидилхолин и фосфатидилэтаноламин. В клеточной мембране ФЛ образуют двойной слой с выраженной асимметрией. Отрицательно заряженные ФЛ создают поверхность, на которой происходит сборка ферментных комплексов двух основных звеньев коагуляционного каскада. В одном из них (теназный комплекс) фактор Х активируется комплексом факторов IXа и VIIa, а в другом — протромбиназная реакция — происходит конверсия протромбина в тромбин ферментным комплексом, состоящим из фактора Xa и Va (протромбиназный комплекс). Взаимодействие факторов IXa, Xa и протромбина с липидной поверхностью происходит посредством образования кальцийзависимого мостика между остатками гамма-карбоксиглютаминовой кислоты этих белков и отрицательно заряженными полярными группами ФЛ. Связывание с липидной поверхностью приводит к увеличению локальной концентрации и эффективного расположения коагуляционных факторов, что способствует максимальной скорости протекания реакции. Любые вещества, мешающие сборке этих комплексов на фосфолипидной поверхности, в том числе антитела к ФЛ, способны повышать уровень образования тромбина и нарушать свертывание крови. К ФЛ относится и ВА, который in vitro пролонгирует различные фосфолипидзависимые коагуляционные тесты [1, 10, 11].
Со времен Hughes G. R. V. существуют различные теории, объясняющие клеточные и молекулярные механизмы, с помощью которых антифосфолипидные антитела к ФЛ инициируют тромбозы. Одна из теорий предполагает активацию эндотелиальных клеток при присоединении антитела к ФЛ, что проявляется экспрессией молекул адгезии, увеличением секреции цитокинов и метаболизма простациклина.
Вторая теория базируется на оксидантзависимом повреждении сосудистого эндотелия. Окисленные липопротеиды низкой плотности (ЛПНП) захватываются макрофагами, что приводит к их активации, продукции цитокинов и последующему повреждению эндотелиальных клеток. Это подтверждает тот факт, что антитела к КЛ перекрестно реагируют с окисленными ЛПНП. Более того, антитела к ФЛ связываются с окисленным кардиолипином и, вероятно, распознают окисленные ФС, фосфолипидсвязывающие белки или и то и другое.
Третья теория предполагает, что антитела к ФЛ взаимодействуют с фосфолипидсвязывающими протеинами и/или модулируют их функции регулирования коагуляции. Этой теорией объясняются молекулярные механизмы влияния антител к ФЛ к кофакторным белкам: протромбина, протеина С, протеина S, аннексина V, простациклина и бета2-ГП-I [4].
Клинические признаки АФС разнообразны и зависят от локализации невоспалительной тромботической васкулопатии сосудистого русла.
При венозных тромбозах отмечается поражение глубоких вен нижних конечностей. У некоторых детей может развиться и тромбоз легочной артерии, правда, очень редко. Характерен тромбоз венозных сосудов почек, печени, глаз и мезентеральных сосудов.
Артериальный тромбоз у детей отмечается в церебральных артериях. Клиническая манифестация данной патологии — транзиторная ишемическая атака головного мозга или значительно реже встречающийся инсульт [2]. Тромботическая васкулопатия характерна для артерий почек, печени и мезентеральных сосудов. Локализация артериально-венозных тромбозов определяет разнообразие клинических проявлений АФС.
Высокий титр антифосфолипидных антител обусловливает широкий спектр патологии центральной и периферической нервной системы: транзиторная ишемическая атака головного мозга, окулярная нейропатия, внезапная тугоухость, парциальные судороги, эписиндром, хорея, транзиторная общая амнезия и психоз.
Ravelli A., Martini A. (2007) в своих исследованиях уловили значимое родство антител к КЛ класса IgM c цереброваскулярными проявлениями у детей с СКВ. Подобное исследование врачей из Торонто показало, что патогенетическим фактором у детей с СКВ являются антитела к бета2-ГП-I [8]. Наличие высоких титров антител к ФЛ характерно для детей с мультифокальным судорожным синдромом [7].
Педиатрический регистр больных с АФС (Ped-APS регистр) заявил о наличии ассоциации между гематологическими проявлениями и ВАФС у детей. Из них более частыми являются: тромбоцитопения, аутоиммунная гемолитическая болезнь и кровотечения. Клинические проявления поражения сердечно-сосудистой системы вариабельны и характеризуются поражением клапанов сердца, миокарда, артериальной гипертензией и внутрисердечными тромбами.
Кожные проявления АФС разнообразны и проявляются в первую очередь сетчатым ливедо — это сосудистая сеточка в виде синеватых пятен на голенях, ступнях, бедрах, кистях, особенно хорошо выявляемая при охлаждении. Возможна поверхностная сыпь в виде точечных геморрагий, напоминающих васкулит, или кровоизлияние в подногтевое ложе, подошвенная и ладонная эритема и кожные узелки. Наиболее тяжелые кожные проявления АФС — это некроз кожи дистальных отделов нижних конечностей и хронические язвы голеней.
По данным Европейской группы по изучению АФС у детей (Euro-Phosphpolipid Project Group) из 1000 детей с симптомами АФС у 53,1% был диагностирован первичный АФС. Наиболее характерными проявлениями АФС у детей являются венозные тромбозы, тромбоцитопения, livedo reticularis. Неврологическая симптоматика отмечается примерно у 20% больных [12].
По нашим данным ПАФС развивался чаще у мальчиков с отягощенной наследственностью (спонтанные аборты в анамнезе их матерей, инсульт, гипертоническая болезнь, варикозная болезнь, инфаркт миокарда). В клинических проявлениях преобладали симптомы поражения ЦНС на фоне более низких уровней антикардиолипиновых антител (АКА) и АФА класса IgG. ВАФС характеризовался клиническими признаками поражения почек, легких, кожи и наличием антител к ДНК (Рис.).
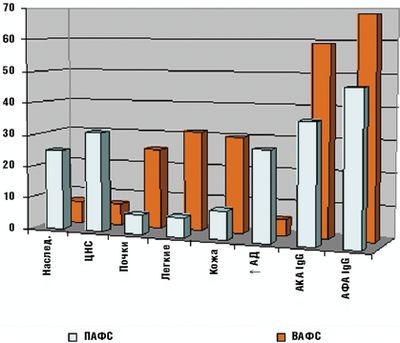
Необходимо отметить, что нередко выявляемое на фоне широкого спектра бактериальных и вирусных инфекций повышение уровня АФА (как правило, транзиторное) редко сопровождается развитием тромботических осложнений. Это связывают с различиями в иммунологических свойствах АФА при АФС и инфекционных заболеваниях: у больных с АФС формируются бета2-ГП-I-зависимые антикардиолипиновые антитела. Ряд вирусных инфекций (вирус Эпштейн–Барр, вирус герпеса и т. д.) способствуют повышению титра антител к ФЛ, поэтому для достоверности диагноза АФС у детей требуется наблюдение и контроль клинико-иммунологических показателей тромбоза в динамике [9, 13].
Ведение больных АФС представляет серьезную проблему. В основе АФС лежат различные патогенетические механизмы, приводящим к тромбозам. Гетерогенность клинических проявлений АФС, отсутствие общепризнанных клинических и лабораторных показателей, позволяющих прогнозировать рецидивирование тромботических проявлений, существенно усложняет выбор медикаментозной терапии больных с АФС. Например, развитие повторных тромбозов не всегда коррелирует с изменением титров антител к ФЛ и активностью основного заболевания при вторичном АФС.
Изучение механизмов развития, клинических особенностей и подходов к лечению АФС продолжает оставаться одной из наиболее актуальных мультидисциплинарных проблем современной медицины, для решения которой необходимо объединение усилий специалистов различных областей медицины — педиатров, ревматологов, кардиологов, невропатологов, акушеров-гинекологов, иммунологов.
Баркаган З. С., Момот А. П. Диагностика и контролируемая терапия нарушений гемостаза. Изд. 2-е, дополненное. М.: Ньюдиамед, 2001.
Калинина Н. М., Дрыгина Л. Б., Соколян Н. А. Аутоиммунная патология эндотелия // Медицинская иммунология. 2004. Т. 6. № 1, 1–15.
Решетняк Т. М. Антифосфолипидный синдром. Низкомолекулярные гепарины в терапии антифосфолипидного синдрома и новые перспективы. CONSILIUM-MEDICUM: Том 08 / N 2/2006.
Asherson R. A. Harris E. N. Anticardiolipin antibodies-clinical association // Postgrad. Med. J. 1986. Vol. 62. P. 1081–1087.
Avcin T., Cimaz R., Silverman E. D., Cervera R. Gattorno M., Garay S., Berkun Y., Sztajnbok F. R., Silva C. A., Campos L. M., Saad-Magalhaes C., Rigante D., Ravelli A., Martini A., Rozman B., Meroni P. L. Pediatric antiphospholipid syndrome: clinical and immunologic features of 121 patients in an international registry//Pediatrics Nov. 2008; 122 (5): 1100–1107.
Heshmat N. M., El-Kerdany T. H. Serum levels of vascular endothelial growth factor in children and adolescents with systemic lupus erythematosus // Pediatr Allergy Immunol. Jun 2007; 18 (4): 346–353.
Piette J.-C., Cervera R., Font J. et al. Antiphospholipid syndrome: clinical and immunologic manifistations and patterns of disease expression in a cohort of 1000 patients // Arthritis Rheum.
2002. 46: 1019–1027.
Ravelli A., Martini A. Antiphospholipid syndrome in pediatrics //Rheum Dis Clin North Am. Aug 2007; 3 (3): 499–523.
Wilson W. A., Gharavi A. E., Koike T. International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome // Arthritis Rheum. 1999. 42: 1309–1311.
Xiao H. J., Yang J. Y., Gao T. J., Huang J. P., Yao Y., Zhang Y. Clinical significance of antiphospholipid antibody in pediatric patients and review of literature // Zhonghua Er Ke Za Zhi. Aug 2004; 42 (8): 571–573.s
Г. А. Новик, доктор медицинских наук, профессор Н. М. Калинина, доктор медицинских наук, профессор Л. Н. Аббакумова, кандидат медицинских наук, доцент К. Г. Кикнадзе СпбГПМА, Санкт-Петербург
Изучение антифосфолипидного синдрома (АФС) началось в 1907 г. с разработки Васcерманом лабораторного метода диагностики сифилиса. Впервые АФС описал в 1986 году английский ревматолог Hughes G. С этого времени начинается интенсивное изучение патофизиологич
Изучение антифосфолипидного синдрома (АФС) началось в 1907 г. с разработки Васcерманом лабораторного метода диагностики сифилиса. Впервые АФС описал в 1986 году английский ревматолог Hughes G. С этого времени начинается интенсивное изучение патофизиологических и клинических особенностей АФС. Критерии диагностики АФС, которые были сформулированы в октябре 1998 г. на VIII Международном симпозиуме [1], делятся на клинические и лабораторные. Нужно отметить, что эти критерии разработаны для диагностики АФС у взрослых и не учитывают особенностей детского возраста.
АФС — системное аутоиммунное заболевание: с артериальным или венозным тромбозом различной локализации, с невынашиванием беременности (спонтанные аборты, выкидыши, внутриутробная гибель плода) и с высоким титром патогенетически значимых антител к фосфолипидам (ФЛ) — таких как антитела к фосфолипидам (антитела к ФЛ), антитела к кардиолипинам (антитела к КЛ), антитела к волчаночному антикоагулянту (ВА) и антитела к кофакторным белкам (протромбин, протеин С, протеин S, аннексин V, простациклин) и бета2-гликопротеин I (бета2-ГП-I).
Диагноз АФС для ребенка является достоверным при наличии клинического критерия и хотя бы одного лабораторного критерия.
Выделяют несколько клинических вариантов АФС у детей. Первичный антифосфолипидный синдром (ПАФС) — развивается у лиц без аутоиммунных заболеваний. Вторичный антифосфолипидный синдром (ВАФС) развивается у больных с ревматическими и аутоиммунными заболевания, со злокачественными новообразованиями, при применении ряда лекарственных препаратов (гормональных, контрацептивных, психотропных веществ, новокаинамида, высоких доз интерферона альфа), инфекционными заболеваниями (герпетическая инфекция, микоплазмоз). Катастрофический АФС — мультисистемные, преимущественно органные тромбозы на уровне микроциркуляторного русла с высоким титром антител к ФЛ, диссеминированная внутрисосудистая активация с тромбозом в сосудах с небольшим диаметром, полиорганные поражения.
Наиболее распространенными формами АФС у детей являются ПАФС и ВАФС. Диагноз ПАФС правомочен при наблюдении не менее 5 лет с момента выявления первых признаков заболевания, т. к. возможна не только трансформация ПАФС во вторичный, но и начало аутоиммунного заболевания с тромбозами и тромбоцитопенией.
J. C. Pittte и соавторы (1993) разработали ряд критериев, исключающих ПАФС. Это эритема лица (бабочка), дискоидная эритема, изъязвление слизистой рта или глотки, артриты, плевриты (без тромбоэмболии легочной артерии или левожелудочковой недостаточности), перикардит (исключается инфаркт миокарда или уремия), персистирующая протеинурия более чем 0,5 г/сут (наличие иммунокомплексного гломерулонефрита), лимфопения менее 1000 клеток в 1 мкл, антитела к нативной ДНК, антитела к экстрагированным ядерным антигенам, антинуклеарные антитела в высоком титре, прием препаратов, индуцирующих выработку антител к ФЛ.
Клинические признаки АФС разнообразны и зависят от локализации невоспалительной тромботической васкулопатии сосудистого русла.
При венозных тромбозах отмечается поражение глубоких вен нижних конечностей. У некоторых детей может развиться и тромбоз легочной артерии, правда, очень редко. Характерен тромбоз венозных сосудов почек, печени, глаз и мезентеральных сосудов.
Артериальный тромбоз у детей отмечается в церебральных артериях. Клиническая манифестация данной патологии — транзиторная ишемическая атака головного мозга или значительно реже — инсульт. Тромботическая васкулопатия характерна для артерий почек, печени и мезентеральных сосудов.
Локализация артериально-венозных тромбозов определяет разнообразие клинических проявлений АФС.
Высокий титр антифосфолипидных антител обусловливает широкий спектр патологии центральной и периферической нервной системы: транзиторная ишемическая атака головного мозга, окулярная нейропатия, внезапная тугоухость, парциальные судороги, эписиндром, хорея, транзиторная общая амнезия и психоз.
Клинические проявления поражения сердечно-сосудистой системы вариабельны и характеризуются поражением клапанов сердца, миокарда, артериальной гипертензией и внутрисердечными тромбами.
Кожные проявления АФС разнообразны и проявляются в первую очередь сетчатым ливедо — это сосудистая сеточка в виде синеватых пятен на голенях, ступнях, бедрах, кистях, особенно хорошо выявляемая при охлаждении. Возможна поверхностная сыпь в виде точечных геморрагий, напоминающих васкулит, или кровоизлияние в подногтевое ложе, подошвенная и ладонная эритема и кожные узелки. Наиболее тяжелые кожные проявления АФС — это некроз кожи дистальных отделов нижних конечностей и хронические язвы голеней.
Целью настоящего исследования является анализ клинических, лабораторных и иммунологических показателей у детей с АФС.
Методы исследования
Методы иммунологического анализа включали определение гетерогенной группы АФА. Использовались Антифосфолипид скрин (Orgentec, Германия), работающий по принципу непрямого твердофазного ИФА-ELISA. Он разработан для количественного определения аутоантител класса IgG и IgM к фосфолипидам. Ячейки планшета покрыты высокоочищенными человеческими фосфолипидами (кардиолипином, фосфатидил-серином, фосфатидил-инозитолом, фосфатидиловой кислотой). У всех детей определяли анти бета2-ГП-I антитела и проводили исследование системы гемостаза. Комплекс современных стандартизованных тестов, оценивающих состояние всех звеньев системы гемостаза, включал: сосудисто-тромбоцитарный гемостаз, агрегационную функцию тромбоцитов с определением спонтанной агрегации, АДФ — агрегацию с максимальной и субпороговой концентрацией индуцера. О наличии волчаночного антикоагулянта в плазме крови судили по удлинению времени свертывания крови in vitro при проведении фосфолипид-зависимых коагуляционных тестов. Согласно рекомендациям I Международного рабочего совещания, определения ВА осуществляли в три этапа.
Общая характеристика пациентов
Исследуемую группу составил 91 пациент с различными клиническими проявлениями АФС, проходивший стационарное лечение в кардиоревматологическом отделении ДГБ № 2 г. Санкт-Петербурга и педиатрическом отделении № 3 СПбГПМА.
Возраст детей составил от 2 до 18 лет (средний возраст 13,12 года), из них 59 девочек (64,80%) и 32 мальчика (35,20%). Дети в возрасте до 6 лет составили 5,56%, от 6 до 12 — 16,67%, дети старше 12 лет — 77,78%.
Клиническая картина АФС в связи с поражением различных органов и систем разнообразна (рис. 1).
Одним из ведущих клинических признаков АФС у детей является ливедо (сетчатость кожных покровов), которое встречалось одинаково часто как при ВАФС, так и при ПАФС. Нужно отметить, что усиление венозной сети на коже было более характерным для ВАФС (p < 0,05).
Результаты нашего исследования показали, что у детей с ВАФС, имеющих высокие титры аФЛ и анти бета2-ГП-I антитела, достоверно чаще отмечалось поражение легких, сердца, почек, что необходимо учитывать при ведение этих детей с тем, чтобы своевременно выявить пациентов с группой риска венозно-артериального тромбоза (рис. 2).
Характеристика и частота тромботических осложнений у детей с АФС
Наиболее часто отмечался тромбоз мелких сосудов кожи: ладонный и подошвенный тромбоваскулит с очагами поверхностного некроза, трофические язвы и livedo reticularis. У 5 детей (12,5%) была диагностирована почечная тромботическая микроангиопатия с гематурией и протеинурией различной степени выраженности, почечной недостаточностью острого периода и злокачественной артериальной гипертензией. Поражение ЦНС было выявлено у 5 детей, у одного ребенка течение основного заболевания осложнилось инсультом, а у остальных были стойкие проявления ишемической энцефалопатии, в виде нарушения когнитивных функций (памяти, внимания, мышления) и неустойчивого настроения. У двоих детей отмечался судорожный синдром (рис. 3).
Для наглядного представления пациентов с АФС приводим выписки из историй болезни из группы наблюдения.
Мальчик К., 16 лет, дебют заболевания отмечался 4 года назад осенью, когда появились зуд и отечность V пальцев обеих стоп. Через 2 года дефигурация нескольких пальцев кистей рук с зудом кожных покровов, сопровождавшимся нейтрофилезом и ускорением СОЭ до 35 мм/час. На холоде отмечалась отечность мягких тканей в области кистей рук с изменением цвета кожи в виде побледнения, сменяющегося цианозом с реактивной гиперемией и ощущением покалывания в пальцах. В дальнейшем состояние трактовалось как синдром Рейно и на фоне сосудистых препаратов отмечалась положительная динамика. В течение последнего года у мальчика отмечено варикозное расширения вен нижних конечностей, появление на внутренней поверхности правого бедра двух плотных узелков, сопровождающееся болевым синдромом и синюшным цветом кожи над ними. Ребенок также страдает частыми головными болями и кровотечением из носа. Из анамнеза наследственности известно, что у матери ребенка варикозное расширение вен нижних конечностей, частые мигреноподобные головные боли, кровотечение из носа, два выкидыша на 10-й и 12-й неделе беременности неясного генеза, кроме этого — ее сестра скончалась от СКВ.
Девочка М. в возрасте 12 лет госпитализирована экстренно на четвертые сутки болезни с жалобами на боли в животе, повышение температуры. Диагностирован острый аппендицит. Выполнена лапароскопическая аппендектомия. Диагностирован гангренозно-перфоративный аппендицит, оментит, разлитой перитонит. При сборе дополнительного анамнеза стало известно, что в течение последних двух лет до развития заболевания у девочки отмечался субфебрилитет, а весной прошлого года два эпизода немотивированных синкопальных состояний. Наследственность: дядя по линии отца страдает системной красной волчанкой.
На основании отягощенной наследственности, анамнестических данных, клинико-лабораторных, иммунологических, инструментальных показателей, а также дебюта и течения заболевании у девочки диагноз трактовался как системная красная волчанка с полиорганным поражением, АФС, нефрит с нефротическим синдромом, цереброваскулит, миоперикардит, плеврит, пневмонит, поражение сосудов желудочно-кишечного тракта. Ребенок за время госпитализации получал гормональные, цитостатические препараты, антиагреганты, антикоагулянты, несколько курсов антибактериальных препаратов и симптоматические препараты. Был проведен ряд оперативных вмешательств. В итоге девочка в удовлетворительном состоянии (на фоне отрегулированной базисной терапии) находится под наблюдением кардиоревматолога в условиях амбулаторного и периодически стационарного лечения (в целях отслеживании клинико-лабораторных показателей и коррекции терапии).
При обследовании показателей внутрисосудистой активации тромбоцитов выявлено увеличение суммы активных форм тромбоцитов. Диагноз на основании клинико-лабораторных, инструментальных и иммунологических данных трактовался как первичный антифосфолипидный синдром. Получала антиагрегантные, антикоагулянтные и сосудистые препараты. Через два года была госпитализирована с жалобами на боли в животе. В связи с подозрением на кишечное кровотечение (при поступлении отмечался стул с большим количеством крови и слизи) была проведена диагностическая лапароскопия и лапаротомия. В результате обследования был выявлен терминальный илеит. На фоне терапии состояние девочки стабилизировалось. Находится под наблюдением ревматолога, получает терапию, которая корригируется на основании иммунологических и клинико-лабораторных показателей.
Ведение больных АФС представляет серьезную проблему. В основе АФС лежат различные патогенетические механизмы, приводящие к тромбозам. Гетерогенность клинических проявлений АФС, отсутствие общепризнанных клинических и лабораторных показателей, позволяющих прогнозировать рецидивирование тромбозов, существенно усложняет выбор медикаментозной терапии больных с АФС. Например, развитие повторных тромбозов не всегда коррелирует с изменением титров антител к ФЛ и активностью основного заболевания при вторичном АФС.
Лечение больных АФС основывается на назначении непрямых антикоагулянтов и антиагрегантов (низкие дозы аспирина), которые широко используются для профилактики тромбозов, не связанных с АФС. У больных с ВАФС, кроме того, проводится лечение основного заболевания.
Таким образом, изучение АФС остается одной из наиболее актуальных мультидисциплинарных проблем медицины. Для определения адекватной терапии этого заболевания необходимо объединение усилий специалистов различных областей медицины — педиатров, ревматологов, кардиологов, невропатологов, акушеров-гинекологов, иммунологов.
Литература
Wilson W. A., Gharavi A. E, Koike T. et al. International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome // Arthr. Rheum. 1999,42, 1309–1311.
Olive D., Andreґ E., Brocard O. et al. Lupus eґ rytheґ mateux disseґ mineґ reveґ leґ par des thrombophleґ bites des membres inferieurs // Arch Fr Pediatr. 1979; 36 (9): 95.
Font J. Lopez-Soto A., Cervera R. et al. The primary antiphospholipid syndrome antiphospholipid antibody patern and clinical features of series of 23 patients autoimmunity. 1991,9, 69–75.
Shi W., Chong B. H., Chesterman C. N. b2-glycoprotein I is a requirement for anticardiolipin antibodybinding to activated platelets: differences with lupus anticoagulants // Blood. 1993,81: 1255–1262.
Arvieux J., Roussel B., Pouzol P., Colomb M. G. Platelet activating properties of murine monoclonalantibodies to beta2-glycoprotein I // Thromb Haemost. 1993, 70: 336–341.
Arvieux J., Jacob M. C., Roussel B., Bensa J. C., Colomb M. G. Neutrophil activation by anti-b2-glycoproteinI monoclonal antibodies via Fcг receptor II // J Leukoc Biol. 1995;57: 387–394.
Font J., Espinosa G., Tassies D. et al. Etteftc of beta2-glycoprotein I and monoclonal anticardiolipin antibodies in platelet interaction with subendothelium under flow conditions //Arthritis Rheum. 2002, 46: 3283–3289.
Lutters B. C., Derksen R. H., Tekelenburg W. L., Lenting W. L., Arout H., de Groot P. G. Dimers of beta2-glycoprotein I increase platelet deposition to collagen via interaction with phospholipids and the apolipoprotein E receptor 2’ // J Biol Chem. 2003, 278: 33831–33838.
Barreirinho S., Ferro A., Santos M. et al. Inherited and acquired risk factors and their combined effects in pediatric stroke // Pediatr. Neurol. 2003, 28, 134–138.
Cardo E., Monros E., Cobome C. et al. Children with stroke: polymorphism of the MTHFR gene, mild hyperhomocysteinemia, and vitamin status // J. Child. Neurol. 2000,15, 295–298.
Kynch J., Han C., Nee L. et al. Prothrombotic factorsin children with stroke or porencephalya // Pediatrics. 2005, 447–453.
Torres J. D., Cardona H., Alvares L. Inherited thrombophilia is associated with deep vein thrombosis in a Colombian population // Am. J. Haematol. 2006, 81 (12), 933–937.
Asherson R. A., Harris E. N. Anticardiolipin antibodies-clinical association // Postgrad. Med. J. 1986. Vol. 62. P. 1081–1087.
Г. А. Новик, доктор медицинских наук, профессор
Н. М. Калинина, доктор медицинских наук, профессор
Л. Н. Аббакумова, кандидат медицинских наук, доцент
К. Г. Кикнадзе
СпбГПМА, Санкт-Петербург
Читайте также:

