Антиген ротавирусов группы а
Обновлено: 18.04.2024
В настоящее время острые кишечные инфекции (ОКИ), являясь одной из важных медицинских и социальных проблем, вносят значительный вклад в формирование экономического ущерба для общества [1, 2]. В последние годы в этиологической структуре ОКИ возросла роль вирусных гастроэнтеритов. Молекулярно-генетическое разнообразие вирусов, формирование нестойкого, типоспецифического иммунитета, частое бессимптомное течение инфекции у взрослого населения способствуют сохранению ведущего положения вирусных диарей в общей структуре ОКИ детского возраста [3, 4], при этом главная роль принадлежит ротавирусам [5].
Высокая частота повторного заражения ротавирусной инфекцией (РВИ) детей первого года жизни и раннего возраста (30–70%), подчас длительное вирусоносительство после клинического выздоровления, влияние на формирование хронической патологии желудочно-кишечного тракта (ЖКТ) у детей [6–8] определяют необходимость дальнейшего изучения тактики ведения пациентов с моно- и микст-вариантами РВИ.
Цель исследования — изучить катамнез детей, перенесших моно- и микст-варианты РВИ.
Материал и методы
Данное исследование проводилось в отделении кишечных инфекций детского инфекционного стационара МУЗ ОГКБ № 1 им. А. Н. Кабанова г. Омска. Критериями включения больных в исследование являлось наличие клиники кишечной инфекции вирусной этиологии; возраст от одного месяца до трех лет; обращение за медицинской помощью в первый-второй день заболевания; отсутствие у больных хронической патологии и врожденных пороков развития со стороны органов ЖКТ.
В соответствии с критериями клинико-катамнестическое наблюдение проведено за 58 детьми (30 девочек и 28 мальчиков), из которых 39 детей перенесли острый моновариант РВИ, 19 детей — микст-вариант РВИ. Средний возраст детей с моновариантом РВИ составлял 20,8 ± 10,1 мес, с микст-вариантом РВИ 9,8 ± 17,6 мес.
Результаты и обсуждение
Генетическая идентификация изолятов ротавируса, выделенных из фекальных проб от 53 детей, показала, что генотип G4 преобладал и составил 56,6% (p = 0,000), вторым по встречаемости был генотип G2 — 16,9%. Генотипы G1 и G3 встречались реже — 5,7% и 11,3% соответственно. Среди P-генотипов преимущественно встречался генотип P [8] — 69,8% (p = 0,000), следующим генотипом был P [4] — 16,9%, в двух пробах (3,9%) не был определен P-генотип, в пяти пробах (9,4%) не определялись оба генотипа — нетипируемый генотип. При микст-варианте РВИ условно-патогенная флора была представлена Klebsiella pneumonia, Pseudomonas aeruginosa, Citrobacter amalanaticus, Enterobacter cloacae, Proteus vulgaris, P. mirabilis. У всех наблюдаемых детей с моно- и микст-вариантом РВИ острый период заболевания характеризовался клинической картиной средней степени тяжести. При этом тяжесть течения заболевания оценивалась по балльной шкале T. Vesikari и T. Ruusaka (1990) (табл. 1) [9].
Оценка степени тяжести в соответствии со шкалой Т. Vesikari для моноварианта РВИ составила в среднем 8,9 балла, для микст-варианта — 9,3 балла.
Всем пациентам с моно- и микст-вариантом РВИ при поступлении в стационар проводилась в соответствии с рекомендациями ВОЗ общепринятая базисная терапия (диета, оральная регидратация, ферментативные препараты, симптоматические средства). Детям, находящимся на естественном вскармливании, сохранялось питание грудным молоком, при искусственном вскармливании на острый период болезни назначались безлактозные (NAN Безлактозный, Нутрилон Безлактозный) и низколактозные смеси (Нутрилон Низколактозный, Нутрилак Низколактозный). У детей старшего возраста из питания исключались молочные, богатые углеводами продукты и продукты, усиливающие перистальтику кишечника (свежие овощи и фрукты, в том числе соки).
Регидратационную терапию при моно- и микст-варианте РВИ проводили по общепринятым правилам. Оральная регидратация при эксикозе 1–2 степени проводилась с использованием глюкозосолевых растворов Оралит, Регидрон, Гастролит. Инфузионная терапия назначалась при эксикозе 2–3 степени и неукротимой рвоте. Объем вводимых растворов зависел от степени обезвоживания и массы тела ребенка.
При моноварианте РВИ назначались индукторы интерферонов (Кипферон суппозитории per rectum детям до 12 лет — в средней разовой дозе 50000 МЕ/кг массы тела, но не более 1 млн МЕ/сут (2 суппозитория)). При микст-варианте РВИ дополнительно антибактериальные препараты: нифуроксазид (Энтерофурил суспензия 5 мл/200 мг, детям в возрасте от одного до шести месяцев — 100 мг (1/2 мерной ложки) 2–3 раза в день, от 7 месяцев до двух лет — 100 мг (1/2 мерной ложки) 4 раза в день. Эрцефурил суспензия 5 мл/220 мг; детям от одного до 30 месяцев — 220–660 мг (1–3 мерных ложки) за 2–3 приема, старше 30 месяцев — 220 мг (1 мерная ложка) 3 раза в день. Курс лечения — не более 7 дней), а также парентеральные антибиотики: цефалоспорины 1–2 поколения (цефазолин 20–50 мг/кг, в/м 3 раза в день, курс лечения 5–7 дней).
Детям, находящимся на грудном вскармливании или получавшим низколактозные смеси, с первых дней заболевания назначались ферментативные препараты (Лактаза — при грудном вскармливании, перед началом кормления грудью в 30 мл предварительно сцеженного грудного молока добавляют 1/6 капсулы). При выраженных копрологических признаках нарушения пищеварения, с 3–4 дня заболевания назначались препараты на основе панкреатина (Панкреатин детям до одного года — 0,10–0,15 г, до двух лет — 0,20 г, на прием 3–4 раза в день до еды).
Дети основной группы (30 человек) дополнительно к базисной терапии получали энтеросорбент смектит диоктаэдрический (Неосмектин — детям до одного года — 1 пакетик в сутки (3 г), 1–2 лет — 2 пакетика в сутки (6 г), старше двух лет — 2–3 пакетика в сутки (6–9 г)) до нормализации частоты и характера стула. Курс лечения составил 3–5 дней. Контрольную группу (18 человек) составили дети, сопоставимые по возрасту и степени тяжести заболевания, но получавшие только базисную терапию.
При сравнительном анализе купирования основных симптомов заболевания, в группе детей, получавших в лечении смектит диоктаэдрический, симптомы интоксикации у 22 детей (73%) купировались на 2-й день, а на 3-й день — у 28 пациентов (93%), в то время как в группе сравнения лишь у 6 детей (χ 2 = 6,54, p = 0,016). У детей, получавших энтеросорбент, быстрее прекращалась рвота и купировались явления метеоризма, происходила нормализация стула. На 3-й день лечения рвота прекратилась у 83,3% пациентов основной группы, в то время как в группе сравнения рвота в эти сроки купировалась только у 70% (p < 0,05). В контрольной группе пациентов, не получавших смектит диоктаэдрический в комплексной терапии, средняя частота стула в первые сутки лечения сохранялась той же, а улучшения характера стула не регистрировалось. На 4–5 день лечения смектитом диоктаэдрическим у всех больных наступало клиническое выздоровление с нормализацией стула, при этом в группе сравнения в эти сроки клиническое выздоровление имело место лишь в 80% случаев.
Катамнестическое наблюдение и изучение основных жалоб детей, перенесших острый моно- и микст-вариант РВИ, было проведено в течение трех месяцев от начала заболевания. Контрольное исследование антигена ротавируса в копрофильтрате детей проводилось на 14-й день, если результат ИФА был положительным, то антиген ротавируса у данной группы детей определяли через 1, 2 и 3 месяца после перенесенной РВИ до получения отрицательного результата.
По данным эпидемиологического анамнеза в 21,4% случаев заболевшие дети находились в контакте с детьми или взрослыми, имеющими клинические проявления ОКИ. У детей, выделяющих Ag ротавируса более 30 суток от начала заболевания, было проведено амбулаторное обследование родственного окружения, и в 10,2% случаев реакция на Ag ротавируса методом ИФА в копрофильтрате была положительной.
У детей, перенесших острый моновариант РВИ, достоверное уменьшение большинства жалоб было отмечено к 2-му месяцу катамнестического наблюдения. Восстановление аппетита у 92,3% детей отмечалось на 2-м месяце наблюдения (p = 0,02), периодические абдоминальные боли и их эквиваленты, а также нарушение работы кишечника в виде неустойчивого стула регистрировались и на 2-м, и на 3-м месяце диспансерного наблюдения, но достоверное уменьшение данных симптомов отмечалось на 2-м месяце наблюдения (p = 0,007).
Катамнез детей, перенесших микст-вариант РВИ, показал, что купирование основных жалоб отмечалось к 2–3 месяцу наблюдения, к 2-му месяцу наблюдения реже регистрировались: метеоризм (p = 0,000), боли в животе непостоянного характера (p = 0,001), при этом неустойчивый стул у 1/3 наблюдаемых детей сохранялся и на 3-м месяце наблюдения (p = 0,008).
При исследовании контрольного анализа копрофильтрата на Ag ротавируса методом ИФА на 14-й день, а также на 1-м и 2-м месяце наблюдения после перенесенного моно- или микст-варианта РВИ достоверных различий выявлено не было (p > 0,05).
Сравнительная характеристика жалоб детей, находившихся под наблюдением в течение трех месяцев после перенесенного острого моно- и микст-варианта РВИ, позволила выявить, что купирование основных жалоб в период реконвалесценции у детей с моновариантом РВИ отмечалось уже на 1-м месяце наблюдения (восстановление аппетита (p = 0,01), купирование абдоминальной боли (p = 0,03), нормализация функции кишечника (p = 0,02)), на 2-м месяце наблюдения полностью восстановилась функция кишечника (p = 0,004) по сравнению с детьми, перенесшими микст-вариант РВИ, у которых неустойчивый характер стула отмечался на 3-м месяце наблюдения (табл. 2).
Таким образом, дети после перенесенного острого моноварианта РВИ нуждаются в диспансерном наблюдении в течение не менее двух месяцев, а дети с перенесенным острым микст-вариантом РВИ в течение трех месяцев, так как в этот период сохраняются как общие жалобы, так и жалобы со стороны ЖКТ не только у детей, которые продолжают выделять Ag ротавируса, но и у детей без выделения Ag ротавируса. Дети, выделяющие Ag ротавируса более 14 дней, независимо от перенесенного микст- или моноварианта РВИ, нуждаются в обязательном контрольном обследовании в течение 30 дней после выписки, при одновременном обследовании родителей и/или ближайшего окружения на ротавирусную инфекцию с целью оценки возможного риска реинфецирования.
Литература
- Rheingans R. D. et al. Economic costs of rotavirus gastroenteritis and cost-effectiveness of vaccination in developing countries // J. Infec. Dis. 2009. Vol. 200, № 1. P. 16–27.
- Chai P. F., Lee W. S. Out-of-pocket costs associated with rotavirus gastroenteritis requiring hospitalization in Malaysia // Vaccine. 2009. Vol. 27, № 5. P. 112–115.
- Tran A. et al. Prevalence of Rotavirus, Adenovirus, Norovirus and Astrovirus Infections and Co-infections Among Hospitalized Children in Northern France // J. Clin. Microbiol. 2010. Vol. 26, № 1. P. 26–30.
- Ushijima H. Diagnosis and molecular epidemiology of viral gastroenteritis in the past, present and future // Uirusu. 2009. Vol. 59, № 1. P. 75–90.
- Anderson E. J. Prevention and treatment of viral diarrhea in pediatrics/E. J. Anderson // Expert. Rev. Anti. Infect. Ther. 2010. Vol. 8, № 2. P. 205–217.
- Учайкин В. Ф. и др. Роль ротавирусов в хронической гастроэнтерологической патологии у детей // Детские инфекции. 2003. № 1. С. 10–12.
- Turck D. Prevention and treatment of acute diarrhea in infants // Arch. Pediatr. 2007. Vol. 14, № 11. P. 1375–1378.
- Newton H. Viral diarrhea can be infectious for a long time // Child. Health. Alert. 2007. Vol. 25, № 2. P. 4–5.
- Ruuska T. et al. Rotavirus disease in Finnish children: use of numerical scores for clinical severity of diarrhoeal episodes // Scand. J. Infect. Dis. 1990. Vol. 22, № 3. P. 259–267.
Ю. Б. Белан, доктор медицинских наук, профессор
Н. А. Полянская
Это наиболее чувствительный и специфичный метод диагностики ротавирусной инфекции, в основе которого лежит взаимодействие антиротавирусных антител с ротавирусным антигеном в кале.
Синонимы русские
Синонимы английские
Метод исследования
Одностадийный иммунохроматографический метод.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Подготовки не требуется.
Общая информация об исследовании
Ротавирусная инфекция – острое вирусное заболевание с фекально-оральным путем передачи, возбудителями которого являются РНКсодержащие ротавирусы (Rotavirus). Это самая частая причина тяжелой диареи у детей младшего возраста, а также у пожилых людей. Источник инфекции – больной человек. Инфицирование чаще всего происходит в холодное время года, инкубационный период длится от 15 часов до нескольких суток. Начало заболевания острое, с симптомами гастроэнтерита: тошнотой, рвотой, диареей, иногда лихорадкой. При отсутствии лечения может возникнуть обезвоживание и нарушение электролитного и кислотно-щелочного баланса.
Иногда ротавирусная инфекция протекает бессимптомно. Иммунитет после перенесенной инфекции нестойкий, поэтому возможно повторное развитие заболевания.
Наиболее чувствительным и специфичным методом диагностики ротавирусной инфекции является выявление антигена вируса в кале.
Для чего используется исследование?
- Для выявления больных с ротавирусной инфекцией.
- Для выявления вирусоносителей.
Когда назначается исследование?
- При подозрении на ротавирусную инфекцию (на 1-4-й день предполагаемого заболевания).
- При подозрении на носительство ротавируса.
- При дифференциальной диагностике заболеваний, протекающих со сходными симптомами: холеры, эшерихиоза, сальмонеллеза, пищевых отравлений, дизентерии, других вирусных диарей и пр.
Что означают результаты?
Референсные значения: отрицательно.
Исследование наиболее целесообразно проводить в первые 4 суток заболевания, поскольку пик выделения вируса с калом приходится именно на этот период.
Ротавирусы. Виды ротавирусов. Строение ротавирусов.
11 геномных сегментов ротавирусов кодируют 13 белков, 2 из которых образуются в результате посттрансляционного расщепления.
Данные по характеристике белковой композиции ротавирусов основном получены на модели ротавирусов животных, в частности обезьян, крупного рогатого скота и свиней, которые адаптированы к культуре клеток и накапливаются в высоких титрах.
В вирионах ротавирусов обнаружено шесть полипептидов (VP1, VP2, VP3, VP4, VP6 и VP7) с молекулярной массой от 37 до 125 кД, один из которых (VP7) гликозилирован.
Два белка VP4 (90 кД) и VP7 (36-38 кД) являются компонентами наружного капсида и не обнаруживаются в однокапсидных частицах. Другие белки образуют внутренний капсид или ассоциированы с сердцевиной вируса. Мажорным белком вириона является полипептид внутреннего капсида VP6 (42 кД). Три белка VP1, VP2 и VP3 входят в состав сердцевины.
Полипептиды наружного капсида ротавирусов представляют особый интерес, поскольку играют основную роль в возникновении инфекционного процесса и развитии иммунитета. Они ответственны за осуществление ранних этапов взаимодействия вирионов с чувствительными клетками - адсорбцию и проникновение, с ними связывают вирулентность ротавирусов. Эти же белки (VP7 и VP4) вызывают образование специфических вируснейтрализующих антител. Они ответственны за иммуногенность ротавирусов. Вирусоподобные частицы ротавирусов, содержащие основные иммуногенные белки, могут служить своеобразными компонентными вакцинами.
Белок VP7 является основным протективным антигеном ротавирусов, ответственным за образование ВН-антител. С помощью моноклональных антител (МАТ) в его составе обнаружен большой домен нейтрализации, включающий несколько перекрывающихся эпитопов. Гликозилирование VP7 - необходимое условие для взаимодействия с клетками-мишенями и проявления инфекционности.
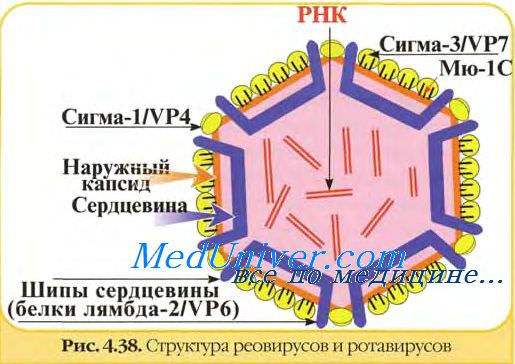
Другим важным белком наружного капсида является VP4. Он ответственен за адаптацию ротавирусов к росту in vitro, контролирует их вирулентность на уровне организма, к тому же является вирусным гемагглютинином и, по-видимому, осуществляет некоторые функции, что и гемагглютинин вируса гриппа, то есть является вирусным белком, обеспечивающим проникновение вируса в клетку. Гемагглютинирующий и нейтрализующий домены находятся в N-концевой половине VP4 ротавируса.
В отличие от гемагглютинина орто- и парамиксовирусов, гемагглютинин ротавирусов не является гликопротеином, хотя в первичной структуре этого белка обнаружены потенциальные сайты гликозирования. В результате протеолиза от полипептида VP4 отщепляется фрагмент — VP8, в котором обнаружено пять нейтрализующих эпитопов.
Нейтрализующие моноклональные антитела к VP7 и VP4 сообщали протективный иммунитет против гомологичного и некоторых гетерологичных серотипов ротавируса. Способность VP4 и VP7 к независимой и гетеротипической индукции синтеза протективных антител может иметь важное значение при конструировании современных ротавирусных вакцин.
Сравнительное изучение антигенных свойств ротавирусов различными методами показало наличие у них общих групповых антигенов. Групповое сходство определяется антигенной общностью внутреннего капсида, а антигенная специфичность связана с белками наружного капсида. Ротавирусы разделяют на группы, субгруппы и серотипы. Белки наружного капсида содержат типоспецифические антигенные детерминанты, а внутреннего — группоспецифические и субгруппоспецифические антигенные детерминанты. Групповая принадлежность определяется антигенной общностью белка VP6, субгрупповая — его антигенными различиями. Гликопротеин VP7 (главный белок нейтрализации) является типоспецифическим антигеном ротавирусов и определяет их серотиповую принадлежность. Серотиповая специфичность отличается высокой консервативностью. Критерием антигенного различия вирусов принята 20-кратная или большая разность титров вируса в РН с гомологичными и гетерологичными антителами.
Исходя из наличия общего группоспецифического антигена (VP6), все ротавирусы, независимо от вида естественного хозяина, разделены на шесть антигенных групп: А, В, С, D, Е и F. Наиболее многочисленна группа А, представители которой играют существенную роль в патологии человека и животных.
Большинство ротавирусов человека и животных относят к группе А, включающей так называемые типичные ротавирусы. Ротавирусы других групп называют атипичными, или параротавирусами. Они изучены недостаточно, поскольку, за небольшим исключением, их пока не удалось размножить in vitro. Каждая группа ротавирусов на основании типоспецифических антигенов делится на серотипы. Так, ротавирусы группы А разделены на 11 серотипов, получивших название G-серотипы.
В другие антигенные группы также входят ротавирусы, поражающие различных хозяев. Вирусы, имеющие одного хозяина, могут настолько сильно различаться между собой в антигенном отношении, что представляют различные антигенные группы. Штаммы ротавирусов, относящиеся к одному серотипу, но выделенные от различных видов животных, часто имеют более тесную антигенную связь, чем штаммы различных серотипов, выделенные от одного вида животных.
В группу В входят ротавирусы человека, крупного и мелкого рогатого скота, в группу С — человека и свиней, группы Е и F — свиней, группу D — птиц. В настоящее время различают не менее четырех серотипов ротавируса человека. Известно о существовании не менее трех серотипов ротавирусов группы А свиней. Кроме того, известны ротавирусы свиней, относящиеся к серогруппам В, С, Е. Серогрупповая серотиповая вариантность имеет место у ротавирусов крупного рогатого скота и других животных. В перекрестной реакции нейтрализации тесное антигенное родство выявлено между ротавирусами обезьян и свиней, а также между ними и ротавирусами крупного рогатого скота. Гомология первичной структуры VP7 различных серотипов достигает 71—85%. Различная степень антигенного родства по VP4 обнаружена между ротавирусами, выделенными от свиней, человека, обезьян и собак. Штамм (АН-1), выделенный от человека, характеризовался высокой гомологией с ротавирусом, выделенным от кошек (FRV-1). От крупного рогатого скота с диареей выделен ротавирус, геномная РНК которого была аналогична ротавирусу птиц. Ротавирусы человека и свиней имели высокую степень гомологии нуклеотидных последовательностей и, возможно, могли иметь общего предка.
Ротавирусы обезьян, свиней и кроликов легко инфицировали телят в экспериментальных условиях. Ротавирус человека вызывал летальную инфекцию у новорожденных поросят при оральном заражении. Существуют ротавирусы, обладающие двойной субгрупповой специфичностью. Такая уникальная способность обнаружена, например, у ротавируса лошадей (штамм FI-14), который взаимодействовал с антителами первой и второй субгрупп. Известен штамм ротавируса свиней с двойной серотипоспецифичностью (G3 и G5). Природа антигенного полиморфизма у ротавирусов пока не выяснена. Приведенные выше данные свидетельствуют о возможности пересечения ротавирусами видовых барьеров и их миграции между различными классами и видами млекопитающих в естественных условиях.
В последнее время у кур, свиней и человека были обнаружены атипичные ротавирусы, не имеющие группоспецифического антигена, несмотря на типичную для ротавирусов морфологию. Они были названы параротавирусами. Атипичные штаммы были обнаружены в 5% случаев при ротавирусных инфекциях у свиней и в 1% — ротавирусных диареях у крупного рогатого скота. При изучении с помощью ЭФ в ПААГ выявлены различия в профиле геномов этих штаммов и типичных ротавирусов. Параротавирусы свиней, в отличие от ротавирусов, вызывают образование синцития из энтероцитов в тонком кишечнике. Хемопротеин в тонком отделе кишечника удаляет наружный капсид ортореовирусов и ротавирусов и повышает их эффективность.
Колтивирусы и аквареовирусы по структуре и свойствам практически не отличаются от свойств, присущих семейству.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо). Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гаст
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо).
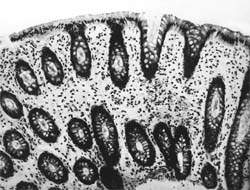 |
| Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимально выраженный катаральный колит. х 100. |
Ротавирусы представляют собой род семейства Reoviridae, который объединяет большое количество сходных по морфологии и антигенной структуре вирусов, вызывающих гастроэнтерит у человека, млекопитающих и птиц. Систематическое изучение ротавирусов человека началось с 1973 года, когда они были обнаружены при электронной микроскопии ультратонких срезов биоптатов слизистой оболочки двенадцатиперстной кишки, полученных от больных острым гастроэнтеритом детей Австралии (Р. Бишоп и соавторы). В том же году Т. Флеветт обнаружил сходный вирус в копрофильтратах больных гастроэнтеритом методом электронной микроскопии при негативном контрастировании препаратов.
Вирусные частицы имеют диаметр от 65 до 75 нм. При проникновении контрастирующего вещества в вирион выявляется электронно-плотный центр диаметром 38 — 40 нм, который представляет собой так называемую сердцевину, окруженную электронно-прозрачным слоем. Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободом, поэтому их стали называть ротавирусами (лат. rota — колесо).
Ротавирусы имеют две белковые оболочки — наружный и внутренний капсиды. Сердцевина содержит внутренние белки и генетический материал, представленный двунитчатой фрагментированной РНК. Геном ротавирусов человека и животных состоит из 11 фрагментов, которые могут быть разделены при электрофорезе в полиакриламидном геле (ПААГ) или агарозе. В составе ротавирусов обнаружено четыре антигена; основной из них — это групповой антиген, обусловленный белком внутреннего капсида. С учетом группоспецифических антигенов все ротавирусы делятся на пять групп: A, B, C, D, E. Ротавирусы одной группы имеют общий групповой антиген, который выявляется иммунологическими реакциями: иммуноферментный анализ, иммунофлюоресценция, иммунная электронная микроскопия и др. Большинство ротавирусов человека и животных относятся к группе A.
| Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями |
Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями. Вирусы в фекалиях заболевших появляются одновременно с развитием клинических симптомов, наибольшая концентрация их в кале (до 109 — 1011 вирусных частиц в 1 г) регистрируется в первые 3 — 5 дней болезни. В эти дни больные представляют наибольшую эпидемиологическую опасность для лиц, контактирующих с ними. Наиболее частым источником заболевания для детей первого года жизни являются инфицированные ротавирусом матери; для взрослых и детей более старшего возраста — дети, в основном из детских коллективов. Возможность заражения человека от животных не доказана.
Патогенез ротавирусной инфекции характеризуется проникновением вируса в эпителиоциты слизистой оболочки желудочно-кишечного тракта, преимущественно тонкой кишки, что приводит к их повреждению и отторжению от ворсинок. Вследствие этого на ворсинках тонкой кишки появляются функционально и структурно незрелые энтроциты с низкой способностью синтезировать пищеварительные ферменты. При ротавирусном гастроэнтерите это проявляется снижением уровня дисахаридаз, развивается вторичная дисахаридазная недостаточность, при которой в просвете тонкой кишки накапливаются нерасщепленные дисахариды, что создает повышенное осмотическое давление и приводит к выводу в просвет кишечника воды и электролитов из тканей организма. Это является основной причиной диареи и дегидратации и определяет основные клинические проявления болезни.
Ротавирусный гастроэнтерит как инфекционное заболевание имеет циклическое течение. Инкубационный период продолжается чаще всего от 12 — 24 часов до двух суток. Клиническая картина ротавирусного гастроэнтерита характеризуется в основном острым началом, однако в ряде случаев может иметь место продромальный период длительности от 12 до 48 — 72 часов. В этот период больные отмечают недомогание, общую слабость, повышенную утомляемость, снижение аппетита, головную боль, познабливание, урчание и неприятные ощущения в животе, умеренно выраженные катаральные явления: заложенность носа, першение в горле, легкий кашель.
В клинической картине ротавирусного гастроэнтерита в период развернутых клинических проявлений ведущими являются синдромы гастроэнтерита и интоксикации. Выраженность диареи и обусловленной ею той или иной степени дегидратации организма, а также токсикоза, продолжительность этих симптомов в значительной мере определяет тяжесть течения заболевания.
Синдром гастроэнтерита характеризуется развитием диареи, снижением аппетита, появлением урчания и болей в животе, тошноты и рвоты. Наиболее типичен для ротавирусного гастроэнтерита обильный водянистый пенистый стул желтого или желто-зеленого цвета. У больных с легким течением заболевания стул может быть кашицеобразным. Как правило, патологические примеси в стуле отсутствуют. Боль локализуется преимущественно в верхней половине живота или является диффузной, она может быть разной интенсивности. Почти всегда она сопровождается громким урчанием в животе.
Синдром интоксикации появляется в самом начале заболевания. Слабость, зачастую резкая, является наиболее частым проявлением этого синдрома; реже отмечается головная боль. При более тяжелом течении имеют место головокружение, обморочное состояние, коллапс. Обращает на себя внимание следующая особенность ротавирусного гастроэнтерита: два ведущих в клинической картине болезни синдрома развиваются в процессе заболевания не всегда однонаправленно; у некоторых больных на фоне сравнительно слабо выраженных диспепсических явлений могут наблюдаться резко выраженные симптомы общей интоксикации, особенно слабость.
Повышение температуры тела не всегда может отмечаться при ротавирусном гастроэнтерите, особенно у взрослых. У некоторых больных может быть озноб без повышения температуры. В то же время нередко в разгар заболевания выраженность лихорадочной реакции варьируется от субфебрильных цифр и выше и может достигать 38 — 39°С как у детей, так и у взрослых.
Важным в диагностическом плане для ротавирусного гастроэнтерита считается сочетание двух ведущих клинических синдромов с симптомами поражения верхних дыхательных путей. Катаральный синдром встречается приблизительно у 50% больных и проявляется в виде гиперемии и зернистости слизистых оболочек мягкого неба, небных дужек, язычка, задней стенки глотки, а также насморка, заложенности носа, кашля, болей в горле. В ряде случаев катаральные симптомы наблюдаются уже в продромальном периоде, до проявления симптомов гастроэнтерита.
В разгар болезни отмечается изменение функционального состояния сердечно-сосудистой системы, чаще у пациентов с более тяжелым течением и при наличии сопутствующих заболеваний органов кровообращения. У большинства пациентов отмечается тенденция к артериальной гипертензии, тахикардия, определяется глухость сердечных тонов при аускультации. У больных с тяжелым течением заболевания, как правило, возникают обмороки и коллапсы из-за выраженных расстройств гемоциркуляции, в генезе которых наряду с токсическими воздействиями существенное значение имеет гиповолемия. Потери жидкости и электролитов вследствие рвоты и диареи могут быть значительными и приводят к развитию дегидратации. Клинические проявления дегидратации зависят от ее степени. При легком и среднетяжелом течении ротавирусного гастроэнтерита отмечается жажда, сухость во рту, слабость, бледность (дегидратация I — II степени), при тяжелом течении наряду с этими симптомами наблюдаются также осиплость голоса, судороги мышц конечностей, акроцианоз, снижение тургора кожи, уменьшение диуреза (дегидратация III степени).
В связи с развитием при ротавирусном гастроэнтерите возможных осложнений, главным образом циркуляторных расстройств, острой сердечно-сосудистой недостаточности, нарушений гомеостаза, выделяют группы больных повышенного риска, в которые включают новорожденных, детей младшего возраста, лиц пожилого возраста, а также больных с тяжелыми сопутствующими заболеваниями. Описанные в литературе и наблюдавшиеся нами случаи ротавирусного заболевания с летальным исходом относятся именно к этим группам.
Выделяются две основные клинические формы ротавирусного заболевания — гастроэнтерическая и энтерическая. Симптомы только острого гастрита (гастритический вариант) встречаются в 3 — 10% случаев. Функциональные и морфологические нарушения со стороны желудочно-кишечного тракта, возникающие при ротавирусном гастроэнтерите в случае наличия у пациентов фоновой гастроэнтерологической патологии, нередко способствуют развитию таких осложнений основного заболевания, как обострение сопутствующих болезней: хронического гастрита, энтероколита, панкреатита, часто в сочетании с выраженными явлениями дисбактериоза кишечника, требующими коррекции при лечении.
Методы диагностики ротавирусной инфекции
При ротавирусном гастроэнтерите гемограмма изменяется следующим образом: в остром периоде заболевания с высокой частотой выявляются лейкоцитоз с нейтрофилезом и повышенная СОЭ. В периоде реконвалесценции картина крови обычно нормализуется полностью. Изменения урограммы у большинства больных имеют кратковременный характер и проявляются чаще всего небольшой протеин-, лейкоцит- и эритроцитурией; в редких случаях в моче появляются гиалиновые цилиндры в незначительном количестве. При тяжелом течении заболевания нарушения функции почек могут быть более выраженными, с повышением уровня мочевины крови, олигоурией или анурией, снижением клубочковой фильтрации. На фоне проводимой терапии указанные изменения быстро исчезают и при повторных обследованиях не отмечаются.
В качестве примера, иллюстрирующего особенности клинического течения ротавирусного гастроэнтерита, приводим выписку из истории болезни.
Лечение: обильное питье солевых растворов, парентеральная регидратационная и дезинтоксикационная терапия — трисоль 1000 мл внутривенное капельное введение, внутрь ферментные препараты: абомин, панкреатин, тансол, карболен. Течение заболевания без осложнений. На третий день болезни — субфебрильная температура, оставалась слабость; боли в животе прекратились. Стул кашицеобразный до пятого дня от начала заболевания. Полное выздоровление наступило на седьмой день болезни.
Дифференциальный диагноз у больных ротавирусным гастроэнтеритом проводят с другими острыми кишечными инфекциями как вирусной так и бактериальной этиологии, прежде всего в тех случаях, когда в клинической картине на первый план выступает синдром гастроэнтерита: с вирусными диареями различной этиологии (аденовирусы, коронавирусы, астровирусы, калицивирусы, вирус Норфолк, энтеровирусы Коксаки и ЕСНО); с гастроинтестинальной формой сальмонеллеза, с гастроэнтеритическим и гастроэнтероколитическим вариантами острой дизентерии, с пищевыми токсикоинфекциями, вызванными условно-патогенными бактериями; с холерой.
Обнаружение специфических антител и нарастание их титра в сыворотке крови больных и переболевших ротавирусным гастроэнтеритом при помощи серологических реакций с целью текущей диагностики на практике в настоящее время широкого распространения не получило и используется в основном для ретроспективного анализа различных эпидемиологических ситуаций.
Методы обнаружения вирусспецифической РНК, которые можно назвать высокочувствительными и специфичными, имеют, однако, ряд недостатков, ограничивающих их практическое применение (необходимость наличия специальной аппаратуры, реактивов, квалифицированного персонала и др.) Наиболее простой метод в этой группе — электрофорез ротавирусной РНК в полиакриламидном геле. Этот метод, позволяющий идентифицировать штаммы вирусов, вызвавшие заболевание, и дать характеристику штаммов, циркулирующих на данной территории, в основном применяется при эпидемиологических исследованиях.
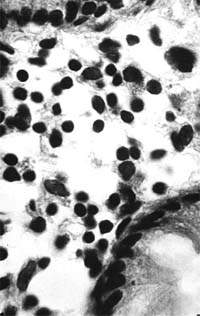 |
| Рисунок 2. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимальное содержание плазматических клеток в собственной пластинке, увеличение в ней числа макрофагов. х 400 |
В клинической практике врач нередко сталкивается с обстоятельствами (сомнительные результаты вирусологических и серологических исследований, случаи микст-инфекций), когда возникает необходимость в применении дополнительных методов для верификации диагноза. С этой целью может быть использован доступный для практического здравоохранения интрументальный метод исследования — ректороманоскопия с аспирационной биопсией слизистой оболочки толстой кишки. При гистологическом, морфометрическом и гистохимическом исследованиях биоптатов при ротавирусном гастроэнтерите выявляются характерные изменения в виде поверхностного минимально выраженного катарального колита с незначительной дистрофией эпителия (рис. 1), снижения числа серотонинсодержащих желудочно-кишечных эндокриноцитов (ЕС-клетки) в эпителиальном пласте кишечных желез, умеренной инфильтрацией собственной пластинки плазматическими клетками и увеличением в ней числа макрофагов (рис. 2). Эти особенности имеют дифференциально-диагностическое значение, поскольку отличаются указанным показателем от других острых кишечных инфекций, что может быть использовано в диагностически сложных случаях.
Здравоохранение в настоящее время не располагает препаратами, обладающими специфическим антиротавирусным действием, поэтому терапия ротавирусного гастроэнтерита является патогенетической. Основные ее цели — борьба с дегидратацией, токсикозом и связанными с ними наиболее часто встречающимися при ротавирусном гастроэнтерите нарушениями функции жизненно важных органов — сердечно-сосудистой системы и органов мочевыделения, степень выраженности которых во многом определяет тяжесть течения заболевания и его прогноз.
Для правильного выбора характера и объема проводимой регидратационной терапии в первую очередь необходимо установить степень дегидратации у того или иного пациента. При эксикозе I — II степени следует ограничиваться пероральной регидратационной терапией (препараты регидрон, глюксолан и др.). При дегидратации III степени целесообразно прибегать к комбинированной парентеральной и пероральной регидратации. Для парентеральной регидратации применяют растворы трисоль, квартасоль, ацесоль и др. С целью дезинтоксикации и улучшения гемодинамики при среднетяжелом и тяжелом течении заболевания показаны коллоидные растворы (гемодез, полиглюкин и др.).
| Для ротавирусной инфекции характерно сочетание гастроэнтерита, интоксикации и симптомов поражения верхних дыхательных путей |
Современными представлениями о патогенезе диарейного синдрома при ротавирусном гастроэнтерите обусловлено и назначение соответствующих средств, способствующих нормализации состояния пищеварительного тракта, а также диеты. Учитывая нарушения активности ряда пищеварительных ферментов, в частности лактазы, рекомендуется исключить в острый период заболевания из пищевого рациона больных молоко и молочные продукты. Кроме того, по этой же причине целесообразно ограничивать и пищу, богатую углеводами. В связи с вышеизложенным, в острый период необходимы энзимные препараты (панзинорм-форте, фестал и др). Кроме того, в остром периоде заболевания могут быть использованы адсорбирующие и вяжущие средства, способствующие ускоренному формированию стула (смекта, карболен и др.) также возможно применение хилака-форте. Высокой частотой дисбактериозов кишечника различной степени выраженности у больных ротавирусным гастроэнтеритом обусловлена необходимость применения в комплексной терапии бактерийных биологических препаратов. Лучшая терапевтическая эффективность при ротавирусном гастроэнтерите отмечена при применении лактосодержащих бактерийных биологических препаратов (ацилакт, лактобактерин и др.), что, по-видимому, связано с заместительным действием бактериальной лактазы, содержащейся в лактобактериях. В последние годы в комплексной терапии ротавирусного гастроэнтерита начал применяться комплексный иммуноглобулиновый препарат (КИП), который разработан и выпускается в МНИИЭМ им. Г. Н. Габричевского. Это первый отечественный иммуноглобулиновый препарат для энтерального применения. КИП характеризуется повышенной концентрацией антител к микроорганизмам, возбудителям острых кишечных инфекций, в том числе ротавирусам, сальмонеллам, шигеллам, эшерихиям и др. Применение КИП в комплексной терапии больных ротавирусным гастроэнтеритом оказывает отчетливый положительный терапевтический эффект, существенно сокращая продолжительность интоксикации и диареи, что открывает новые возможности в лечении этого заболевания.
Литература
1. Букринская А. Г., Грачева Н. М., Васильева В. И. Ротавирусная инфекция. М., 1989.
2. Дроздов С. Г., Покровский В. И., Шекоян Л. А., Машилов В. П. и др. Ротавирусный гастроэнтерит. М., 1982.
3. Новикова А. В. и др. Архив патологии, 1989, №6.
4. Щербаков И. Т. и др. Архив патологии, 2995, №3.
5. Юшук Н. Д., Царегородцев А. Д.. Лекции по инфекционным болезням. М., 1996.
Читайте также:

