Антимикробной активностью в отношении стрептококков
Обновлено: 15.04.2024
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор раздела: Трубачева Елена Сергеевна, врач – клинический фармаколог, более 15 лет занимающаяся практическими вопросами лечения и профилактики внутрибольничных инфекций и эпидемиологического надзора. Автор множества печатных работ на указанную тематику.
"Идея "Азбуки антибиотиков" вынашивалась в течение трех лет как способ донести сложные вещи максимально понятным языком для тех, кто только начинает постигать этот действительно сложный раздел практической медицины, и дать импульс к дальнейшему изучению, не продираясь через дебри терминологии и смежных дисциплин, теряя интерес по дороге."
Тема эта очень узконаправленная, и вопрос в том, насколько она может быть интересна широкому кругу читателей. Однако ради одних только отдаленных последствий заболеваний, вызванных S. agalactiae, ее стоит рассмотреть.
Стрептококки – это большая разнородная группа микроорганизмов, включающая следующие группы.
S.pyogenes является грамположительным кокком, собранным в цепочки. В норме колонизирует глотку у 3% взрослых и 15-20% детей школьного возраста.
Пневмококк, он же Streptococcus pneumoniae, является одним из основных возбудителей заболеваний верхних и нижних дыхательных путей. Однако проблема в том, что те же заболевания точно так же и с той же симптоматикой вызывает и множество вирусов, а потому микробиологическая диагностика буквально жизненно необходима, причем не когда-то там, а прямо здесь и сейчас.
В этой статье мы поговорим о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Информация о препаратах, отпускаемых по рецепту, размещенная на сайте, предназначена только для специалистов. Информация, содержащаяся на сайте, не должна использоваться пациентами для принятия самостоятельного решения о применении представленных лекарственных препаратов и не может служить заменой очной консультации врача.
Свидетельство о регистрации средства массовой информации Эл № ФС77-79153 выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) 15 сентября 2020 года.

Тонзиллофарингит является частым заболеванием в детском возрасте. Среди бактериальных возбудителей основную роль играет beta-гемолитический стрептококк группы А (БГСА). Установлено, что эффективность коротких курсов ряда антибиотиков сопоставима с 10-днев
Жалоба на боль в горле является одним из наиболее частых поводов для обращения за медицинской помощью к педиатру. Основной причиной боли в горле является воспаление небных миндалин и слизистой оболочки глотки — тонзиллофарингит. Данный термин широко используется в научной литературе, несмотря на то, что согласно Международной классификации болезней тонзиллит и фарингит являются отдельными нозологиями.
Ключевой проблемой антибактериальной терапии при тонзиллофарингитах у детей является определение показаний к ее назначению. Установлено, что чаще всего острый тонзиллофарингит является проявлением острой вирусной инфекции (ОРВИ) и, соответственно, не требует назначения антибактериальной терапии. Среди бактериальных возбудителей тонзиллофарингита у детей безусловным лидером является β-гемолитический стрептококк группы А (БГСА, Streptococcus pyogenes), на долю которого приходится 15–36% случаев острого тонзиллофарингита [1–3]. В 2012–2013 гг. мы обследовали 119 детей с острым тонзиллофарингитом с помощью экспресс-теста на БГСА с высокой диагностической точностью (Стрептатест), положительный результат получен у 19% больных.
Необходимость обязательного назначения антибактериальной терапии при стрептококковом тонзиллофарингите не вызывает сомнений. В систематическом обзоре Кокрановского сотрудничества (2013 г.), в который вошли десятки исследований (начиная с 1951 г.), было показано, что назначение антибиотиков при боли в горле существенно снижает вероятность осложнений — как поздних негнойных (острая ревматическая лихорадка), так и ранних гнойных (средний отит, синусит, паратонзиллярный абсцесс) [4].
Решение обозначенной проблемы кроется в своевременной верификации стрептококкового тонзиллофарингита. В многочисленных исследованиях показано, что внедрение методов экпресс-диагностики, обладающих высокой чувствительностью и специфичностью, позволяет непосредственно при осмотре всего за несколько минут пациента выявить заболевание, вызванное БГСА, дает возможность, с одной стороны, своевременно назначить антибактериальную терапию при стрептококковом тонзиллофарингите, а с другой стороны — значительно снизить частоту необоснованного назначения антибиотиков [5–6].
В то же время существует еще целый ряд актуальных проблем антибактериальной терапии при тонзиллофарингитах у детей, которые требуют обсуждения. Это проблемы, связанные с выбором антибактериального препарата, и режима его применения.
Бактерии рода Streptococcus, в том числе БГСА, не способны продуцировать β-лактамазы. Кроме того, данный возбудитель не обладает и другими механизмами резистентности к β-лактамным антибиотикам. До настоящего времени в мире не выделено ни одно штамма БГСА, резистентного к пенициллинам, цефалоспоринам и карбапенемам. Также возбудитель в 100% случаев сохраняет чувствительность к гликопептидам и оксазолидинонам. В то же время наблюдается резистентность БГСА к макролидам, линкозамидам, фениколам, тетрациклинам, фторхинолонам, сульфаниламидам [7].
В ходе многоцентровых российских исследований, проводившихся в 2001–2005 гг., была оценена резистентность более 1000 штаммов БГСА (табл. 1): выявлен очень высокий уровень резистентности БГСА к тетрациклинам, высокий к хлорамфениколу, небольшой уровень резистентности к 14- и 15-членным макролидам (менее 10%), минимальная резистентность к 16-членным макролидам и линкозамидам (менее 2%) и отсутствие резистентности к фторхинолонам [8].
Учитывая высокую стабильную активность пенициллина в отношении БГСА, этот антибиотик (феноксиметилпенициллин перорально, а также бензатинпенициллин внутримышечно) в течение многих лет рассматривается как препарат выбора для лечения стрептококкового тонзиллофарингита и в отечественных, и в зарубежных руководствах [9–12]. В ряде руководств в качестве препарата выбора также рассматривается амоксициллин [10–11].
Однако в 80-х годах XX века была выявлена серьезная проблема — нарастающая частота клинической и микробиологической неэффективности пенициллина при стрептококковом тонзиллофарингите, по данным отдельных исследований эрадикации БГСА не удавалось достичь у каждого четвертого пациента [13]. Вместе с тем было установлено, что другие антибиотики превосходят пенициллин по эффективности, в частности, если частота формирования носительства БГСА у детей после стрептококкового тонзиллофарингита при лечении пенициллином составила 11,3%, то при использовании макролидов и цефалоспоринов она была существенно меньше — 7,1% и 4,3% соответственно [14].
Изучение несоответствия эффективности пенициллина in vitro и in vivo при стрептококковом тонзиллофарингите позволило определить ключевую причину данного феномена — наличие в миндалинах у пациентов ко-патогенных бактерий (Bacteroides spp., Staphylococcus aureus и др.), которые продуцируют β-лактамазы и, соответственно, разрушают природные пенициллины и аминопенициллины [15–16]. Поэтому у пациентов, недавно получавших β-лактамные антибиотики, а также в случае рецидивирования тонзиллофарингита, в современных руководствах рекомендуется назначение препаратов, которые устойчивы к действию β-лактамаз, — ингибиторозащищенных аминопенициллинов и цефалоспоринов, а в отдельных случаях — линкозамидов [9–12].
Дополнительным фактором, ограничивающим применение пенициллина при тонзиллофарингите, является возможная аллергическая реакция на данный препарат, которая по данным различных исследований составляет от 1% до 20% случаев [17]. В случае аллергии на пенициллин рекомендуется применение макролидов или линкозамидов [9–11].
Суммированные рекомендации по антибактериальной терапии при стрептококковом тонзиллофарингите в современных руководствах можно представить в виде алгоритма (табл. 2).
Данный алгоритм основывается на двух основных факторах, определяющих выбор антибиотика. Однако в научной литературе представлены данные еще о ряде факторов, влияющих на эффективность антибактериальной терапии стрептококкового тонзиллофарингита. В частности, показано, что эффективность антибактериальной терапии зависит от частоты носительства штаммов бактерий, продуцирующих β-лактамазы, в целом в популяции, а не только у больных тонзиллофарингитом. В исследовании, проводившемся в течение года, была проанализирована по месяцам эффективность амоксициллина при стрептококковом тонзиллофарингите у детей и частота выявления в ротоглотке у здоровых детей штаммов бактерий, продуцирующих β-лактамазы. Частота неудач при использовании амоксициллина в течение года колебалась от 8% до 32%, и при этом прослеживалась очевидная корреляция с частотой носительства штаммов бактерий, продуцирующих β-лактамазы (рис. 1) [18].
В качестве одной из возможных причин неэффективности пенициллина при стрептококковом тонзиллофарингите рассматривается подавление пенициллинами α-гемолитических стрептококков, которые являются представителями нормальной микрофлоры ротоглотки и препятствуют колонизации БГСА [19].
Учитывая названные дополнительные факторы, влияющие на выбор антибактериального препарата, большой интерес представляет применение цефалоспоринов в лечении стрептококкового тонзиллофарингита у детей. Препараты данной группы устойчивы к действию многих β-лактамаз [20], они оказывают меньшее по сравнению с пенициллинами влияние на α-гемолитические стрептококки, что способствует более эффективной эрадикации БГСА [22, 23].
Данные 35 доказательных клинических исследований (более 7000 пациентов), оценивавших эффективности различных цефалоспоринов при стрептококковом тонзиллофарингите у детей, были обобщены в метаанализе. В анализировавшихся исследованиях сравнивался 10-дневный курс перорального цефалоспорина 1–3 поколения и перорального пенициллина. Данные метаанализа показали, что цефалоспорины значительно превосходят пенициллин по клинической и микробиологической эффективности (p < 0,00001) (рис. 2) [24].
Одним из препаратов, показавших существенно большую эффективность, чем пенициллин, является пероральный цефалоспорин III поколения цефиксим. В многоцентровом рандомизированном контролируемом исследовании было проведено сравнение эффективности и безопасности 10-дневных курсов цефиксима и пенициллина у 154 детей от 2 до 12 лет со стрептококковым тонзиллофарингитом. Клинический эффект был достигнут у всех пациентов. Микробиологическая эффективность составила 83% для группы детей, получавших цефиксим, и 77% — для группы детей, получавших пенициллин. Нежелательные явления в обеих группах были единичными [25]. В аналогичном рандомизированном исследовании, включавшем 110 детей со стрептококковым тонзиллофарингитом, микробиологическая эффективность цефиксима была существенно выше, чем у пенициллина, — 94% против 77% (p < 0,05) [26].
При стрептококковом тонзиллофарингите важно не только обеспечить выздоровление пациента от инфекционного заболевания, но и предотвратить развитие поздних осложнений и распространение инфекции. Поэтому целью антибактериальной терапии является эрадикация возбудителя. Проведенные исследования показали, что высокий уровень эрадикации достигается при использовании 10-дневного курса лечения пенициллином. Такая же длительность курса лечения рекомендуется и при использовании большинства других антибиотиков [10, 27]. Установлено, что в случае нарушения назначенной врачом длительности курса лечения пенициллином эффективность терапии при стрептококковом тонзиллофарингите снижается в среднем на 20% [28]. Еще более 50 лет назад были проведены исследования, которые показали, что назначенный 10-дневный курс лечения не выполняют подавляющее большинство больных. В одном исследовании было показано, что только 46% детей с тонзиллофарингитом продолжают получать пенициллиин на 3-й день терапии, 31% — на 6-й день и 8% — на 9-й день [29]. В аналогичном исследовании показатели были лучше: 81% пациентов принимали пенициллин на 5-й день лечения и 56% — на 9-й день. Авторы изучили факторы, которые влияют на выполнение рекомендаций врача. Было показано, что длительность курса терапии не зависела от возраста и пола ребенка, оцененной врачом тяжести заболевания и длительности сохранения симптомов. Одновременно было установлено, что на длительность лечения влияли оценка матерью тяжести состояния ребенка, назначение терапии врачом, длительно наблюдающим ребенка, или другим врачом, а также отношение матери к врачу [30].
Учитывая низкую комплаентность при 10-дневном курсе антибактериальной терапии тонзиллофарингита, а также неодинаковую эффективность различных антибиотиков, большой интерес представляют клинические исследования эффективности сокращенных курсов лечения стрептококкового тонзиллофарингита. В ряде исследований было показано, что 6-дневный курс амоксициллина, 4–5-дневный курс цефалоспоринов и 5-дневный курс азитромицина сопоставимы по эффективности с 10-дневным курсом пенициллина. При этом отмечен ряд преимуществ коротких курсов: более высокая комплаентность, меньшая частота нежелательных эффектов, лучшее отношение родителей пациента к лечению, снижение стоимости лечения [31]. В 2009 г. был опубликован систематический обзор Кокрановского сотрудничества, в котором проведено сравнение эффективности при остром стрептококковом тонзиллофарингите у детей коротких курсов антибактериальной терапии по сравнению с 10-дневным курсом пенициллина. В обзоре проанализированы 20 исследований, включавших более 13 000 пациентов. Короткие курсы более эффективных антибиотиков характеризовались более быстрым прекращением лихорадки и боли в горле. По частоте рецидивов тонзиллофарингита 10-дневный курс пенициллина и короткий курс других исследованных антибактериальных препаратов не имели достоверных отличий [32].
Одним из препаратов, эффективность короткого курса которого доказана при стрептококковом фарингите, также является цефиксим. В рандомизированном исследовании, включавшем 160 детей со стрептококковой ангиной, сравнивалась эффективность 5-дневного курса цефиксима и 10-дневного курса пенициллина. Клиническая эффективность была достигнута у 96% пациентов, которые лечились цефиксимом, и у 97,4% пациентов, получавших пенициллин, эрадикация БГСА достигнута соответственно у 82,8% и 88,2% детей. В течение 4 недель после окончания лечения рецидивы заболевания отмечены у 6 пациентов, получавших цефиксим, и у 8 пациентов, получавших пенициллин. В целом достоверных отличий результатов лечения в исследуемых группах не выявлено, что позволило авторам сделать вывод о сопоставимой эффективности короткого курса цефиксима и стандартного курса пенициллина [33]. Важной фармакокинетической особенностью цефиксима является относительно длительный период полувыведения, который позволяет принимать препарат 1 раз в сутки [34], что способствует повышению приверженности к лечению.
В нашей клинике был обобщен опыт применения цефиксима (Супракс®) с оценкой клинической эффективности и безопасности в качестве препарата эмпирической терапии при инфекции дыхательных путей у детей в возрасте от 1 до 12 лет, в том числе у пациентов с острым тонзиллитом и обострением хронического тонзиллита. У всех детей с тонзиллитом была отмечена быстрая положительная динамика. В целом в исследовании была отмечена хорошая переносимость цефиксима — у 8,3% больных отмечены нежелательные явления в виде легкой диареи, которая не требовала отмены препарата [34].
Цефалоспорин III поколения для перорального применения цефиксим обладает высокой активностью в отношении многих клинически значимых грамположительных и грамотрицательных бактерий. Хорошая биодоступность препарата после приема внутрь (около 50%) позволяет создать высокую сывороточную концентрацию и эффективные концентрации в тканях. Проведенные исследования свидетельствуют о высокой эффективности цефиксима при тонзиллофарингите, препарат входит в Стандарт Министерства здравоохранения Российской Федерации по оказанию первичной медико-санитарной помощи при остром тонзиллите у детей и взрослых в амбулаторных условиях [35]. На российском фармацевтическом рынке представлен оригинальный препарат цефиксима — Супракс®, который выпускается в виде гранул для приготовления суспензии, диспергируемых таблеток и капсул, что дает возможность использовать его у детей начиная с раннего возраста.
Литература
И. А. Дронов 1 , кандидат медицинских наук
Н. А. Геппе, доктор медицинских наук, профессор
У. С. Малявина, кандидат медицинских наук
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова, Москва
Abstract. Tonsillitis-pharyngitis is frequent childish disease. Among pathogenic bacteria the main role plays A group β-hemolytic streptococcus (GAS). Effectiveness of short courses of treatment with antibiotics may be compared with 10-days course of treatment with penicillin. Clinical trial showed that oral intake of III generation cephalosporin — cefixime is highly efficient with children with streptococcus tonsillitis-pharyngitis including treatment by short courses.
В этой статье мы поговорим о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Почему за исключением S. pyogenes? Да потому что данного возбудителя мы рассмотрели в отдельной статье. Кроме того, мы уже говорим практически на одном языке, а потому можем себе позволить поговорить о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Микробиологические аспекты
Для начала разберемся с классификациями, чтобы понимать принципы разнесения стрептококков по группам. Так сложилось, что для классификации стрептококков используются их фенотипические характеристики, а именно характеристики по гемолитическим свойствам:
- β-гемолитические стрептококки вызывают полный гемолиз эритроцитов питательной среды с формированием прозрачной зоны вокруг колоний на кровяном агаре
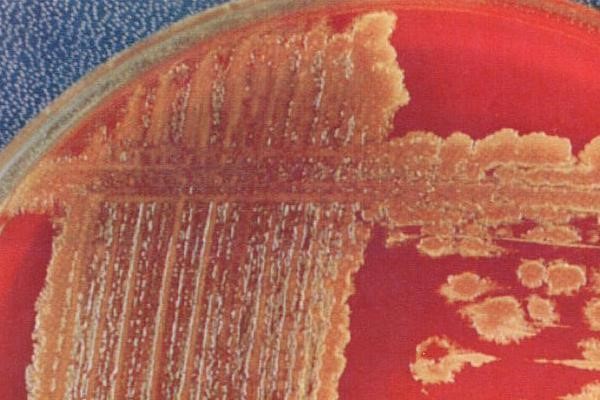
- α-гемолитические (зеленящие) образуют зеленоватый ореол вокруг колоний в результате неполного разложения гемоглобина
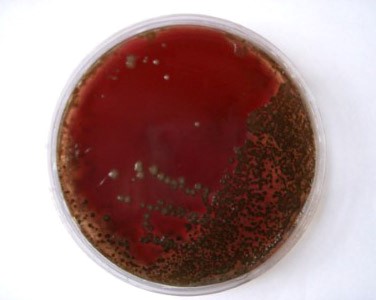
- γ-гемолитические по-другому именуются негемолитическими, то есть ничего никуда из крови не разлагают.
Собственно, почему кровь? Дело в том, что стрептококки крайне требовательны к питательным средам и к условиям, в которых их растят. И чтобы они выросли, в питательные среды (в основном, жидкие) необходимо или добавлять мясной экстракт, или использовать коммерческие питательные среды с добавлением крови барана, или 5%-й кровяной агар – и все это с большим количеством дополнительных компонентов. Для определения характера гемолиза традиционно используется среда с 5%-й дефибринированной кровью барана.
Подобное разделение по группам и типам гемолиза является решающим для деления стрептококков, имеющих медицинское значение, позволяя разделить патогенные и условно-патогенные микроорганизмы. Про патогенные мы уже поговорили ранее, теперь будем вести разговор о более обширной группе условно-патогенных представителей и начнем со стрептококков групп A, C, D и F, оставив для отдельного разговора группу В и единственного ее представителя – S. agalactiae.
Основными характеристиками представителей этих групп является то, что все они:
- Обладают β-гемолитической активностью
- Относятся к нормальной микрофлоре человека и животных
- Могут вызывать оппортунистические инфекции в различных локализациях
- Fc-антиген, способный взаимодействовать с Fc-фрагментом IgG, тем самым угнетая систему комплемента и подавляя активность фагоцитов. Кроме того, он же активирует выработку аутоиммунных антител, которые в дальнейшем участвуют в развитии иммунного воспаления;
- Р-антиген, обладающий иммуносупрессивной активностью и являющийся общим для всех стрептококков. Он подавляет выработку антител и усиливает реакции гиперчувствительности замедленного типа.
Кроме того, стрептококки имеют такой фактор патогенности, как М-протеин, который нарушает фагоцитарную активность путем маскировки рецепторов для комплемента, что очень затрудняет борьбу с этими возбудителями.
Клинические аспекты
1. Streptococcus dysgalactiae – объединяет двух представителей Streptococcus dysgalactiae subsp. dysgalactiae и Streptococcus dysgalactiae subsp. equisimilis. Первый живет на животных (и вызывает маститы у коров, на человеке в качестве возбудителя пока не ловили), второй на человеке – в верхних дыхательных путях и влагалище – и может быть причиной менингита, септических артритов и инфекций кожи (при условии наличия соответствующей симптоматики и в отсутствии других вероятных возбудителей).
2. Стрептококки группы Anginosus (S. anginosus, S. constellatus, S. intermedius) относятся к представителям нормальной флоры человека. Обрести зубы и стать возбудителями инфекции их могут заставить травмы, оперативные вмешательства, сахарный диабет, онкологические заболевания и иммунодефициты различной этиологии. Сами по себе на человека не бросаются и обнаружение оных вне клинической картины истребления не требует.
- S.anginosus – в норме обитает в полости рта, верхних дыхательных путях и влагалище. При патологии может быть высеян из урогенитальной и желудочно-кишечной локализаций.
- S. constellatus – в норме живет в верхних дыхательных путях и ЖКТ. При патологических процессах могут быть обнаружены где угодно.
- S. intermedius – в норме обитает в полости рта и верхних дыхательных путях. При патологических процессах в основном высевается из мозга, из крови при эндокардитах и из печеночных абсцессов (проще говоря оттуда, где в норме все должно быть стерильно).
3. S. equi клинического значения не имеет, так как является зоонозом и вызывает ветеринарные проблемы у коров, лошадей, морских свинок, овец и коз. Иногда – при употреблении зараженных молочных продуктов – может быть обнаружен у людей, больных нефритом.
4. S. canis, как понятно из названия, выделяют от собак. У людей могут вызывать инфекции мягких тканей, пневмонии, сепсис, остеомиелит.
5. S. iniae – обнаруживается у дельфинов и рыб. А также у людей, занятых на обработке замороженной рыбы. Крайне редко вызывает заболевание (описаны всего несколько случаев), хорошо лечится бета-лактамами и макролидами.
6. И несколько чисто зоонозных представителей, не имеющих медицинского значения, но иногда сеющихся с людей, которые за этими животными ухаживают или лечат:
- S. porcinus – вызывает абсцессы глотки свиней, пневмонию и аборты;
- S. didelphis – вызывает инфекции кожи, печени, легких и селезенки у опоссумов;
- S. phocae – выделяется у морских котиков при пневмонии у оных.
Как мы увидели, в большинстве своем перечисленные возбудители относятся к нормальной микрофлоре верхних дыхательных путей, кожи, ЖКТ и урогенитального тракта, а чтобы они вызвали заболевание, во внутреннюю среду организма должно проникнуть очень большое количество оных, при этом иммунная система должна быть подавлена тем или иным образом. Чаще всего такую роль играют медицинские вмешательства (инъекции, операции, катетеризация сосудов, гемодиализ и т. п.) на фоне тяжелых основных или сопутствующих заболеваний. Тогда стрептококки способны вызвать инфекции кожи и мягких тканей, верхних дыхательных путей, эндокардиты и сепсис, инфекции урогенитального тракта, при этом строгой локализации процесса соответствующим возбудителем уже не будет, а будет инфекция, связанная с медицинским вмешательством.
Что делать?
Как можно раньше провести бактериологическую диагностику и главным в ней будет правильная техника взятия биологического материала, чтобы точно исключить его контаминацию ни в чем не повинными мирными соседями, просмотрев истинного возбудителя. Техника взятия материала и правила транспортировки в лабораторию подробно расписаны здесь.
Чем лечить?
Этот вопрос мы можем задать только тогда, когда точно понимаем, что именно вышеуказанные зверушки являются возбудителями и никто за ними не прячется. Хорошая новость в том, что стрептококки до сих пор сохранили высокую чувствительность к бета-лактамам вообще и к пенициллинам в частности, то есть лечить их дешево. Плохая новость в том, что фактически утеряна чувствительность к макролидам, и поэтому они не могут быть препаратами выбора – это обязательно надо учитывать при назначении стартовой терапии.
Кроме того, стрептококки продолжают демонстрировать высокую чувствительность к ванкомицину, но в виду неоднозначности самого препарата в плане безопасности его применения, им тоже не следует злоупотреблять и включать его в схему лечения только в случае наличия аллергии к пенициллиновому ряду.
Итак, мы закончили краткое рассмотрение представителей стрептококков групп A, C, D, F и G, и нам осталось рассмотреть только одного представителя из группы В, а именно S.agalactiae, чем мы и займемся в следующей статье.
S.pyogenes является грамположительным кокком, собранным в цепочки. В норме колонизирует глотку у 3% взрослых и 15-20% детей школьного возраста.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Микробиологические аспекты
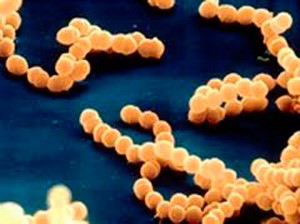
S.pyogenes является грамположительным кокком, собранным в цепочки. В норме колонизирует глотку у 3% взрослых и 15-20% детей школьного возраста. Так что без клинической картины острого фарингита не надо хвататься за антибиотики, как собственно и что-то сеять вне обострений.
100% штаммов чувствительны к пенициллинам, при этом Резистентность к макролидам в Европе – от 2 до 32%, в США – 7%. У нас в связи с великой любовью к этой группе, особенно среди педиатров, скорее всего, как в Европе. То есть о макролидах в этой ситуации надо забыть, к тому же тем же азитромицином не получится создать необходимую экспозицию в связи с ограничениями по срокам применения.
Клинические аспекты
При всем вышеперечисленном БГСА – зверь страшный, и основная проблема в том, что страх к нему мы почти потеряли. Лирическое отступление on. Именно этот зверь был постоянной причиной хирургических инфекций и родильной горячки (послеродового сепсиса) в доантибиотиковую эру. А женщины, как вы помните, умирали от нее, как мухи, пока Земмельвейс не заставил врачей мыть руки (за что закончил в психушке), но они их хотя бы на руках таскать перестали. Но даже сейчас, не дай бог, хирургу со стрептококковой ангиной подойти к операционному столу, и к концу первых суток стрептококк организует очень больную и страшно воняющую проблему в конкретной послеоперационной ране. Лирическое отступление off.
Потому напомним, что S.pyogenes может вызывать следующие заболевания:
- Фарингиты
- Поражения кожи и мягких тканей – целлюлиты, эризипелоид, лимфангит, рожа
- Некротические миозиты и фасцииты
- Послеродовый сепсис
- Пневмонии
- Сепсис
- Бактериальные эндокардиты (раньше редко, все же ангины и скарлатины старая школа требовала лечить строго 14 дней и ампициллином в задницу: сейчас стали встречаться почаще – привет коротким курсам антибиотиков при лечении ангин)
- Действие токсинов запускают синдром токсического шока и скарлатину
- Аутоиммунное воздействие приводит к ревматическим лихорадкам, с последующими возможным формированием пороков сердца и острому гломерулонефриту
- Послеоперационные раневые инфекции первых суток
Практические вопросы диагностики:
Микробиологическая диагностика S.pyogenes не представляет никакого труда, здесь в прямом смысле достаточно покрасить мазок по Граму. Все упирается в организационные аспекты – пока мазок доберется до лаборатории, пока покрасят. Пока ответят, пациент успеет много раз осложнится, если это стрептококк, или выздороветь, если это был фарингит и вызвавший его вирус (все-таки до 60% фарингитов вызваны вирусами, а не бактериальной флорой). Не хотелось бы останавливаться подробно на каждом перечисленном заболевании, но не упомянуть о диагностике острого фарингита, которая чаще всего и запускает множество вторичных осложнений, мы не можем. Для облегчения диагностики острого существуют несколько диагностических шкал. Автору более всего симпатична шкала Мак-Айзека в виду максимальной простоты ее использования.
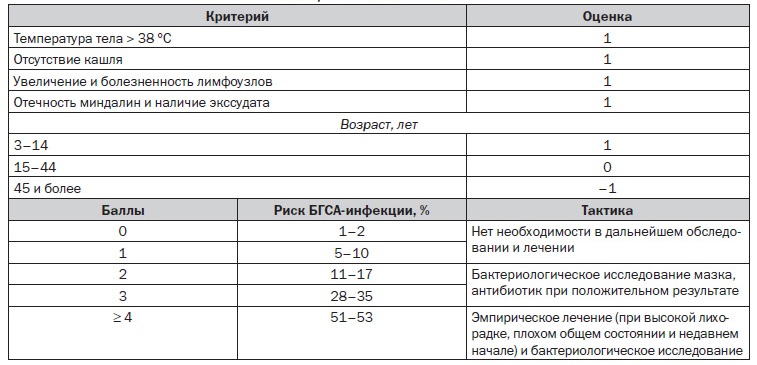
Но самым быстрым тестом для точной диагностики на месте является стрептатест, который в течение пяти минут дает ответ о вероятности наличия БГСА у больного с острым фарингитом.
Аспекты медикаментозного лечения
- Итак, мы определили, что имеем дело с БГСА, и тогда препаратами выбора в амбулаторной практике будут являться аминопенициллины, так как их много, они доступны, и главное, к ним 100% чувствительность у возбудителя.
Если ангина произошла впервые в жизни – лечим 10 дней. Если имеем дело с постоянными рецидивами – 14 дней, так как зверь может уйти во внутриклеточное состояние, оттуда руля процессом, и, чтобы до него добраться, доза должна быть выше средней, а курс лечения соответствующим.
Когда БГСА может уйти внутрь клетки? На тех самых пресловутых 5-7 днях, когда налеты с миндалин только сошли, температура только-только нормализовалась, а антибиотик взяли и отменили. И хорошо, если после подобного произойдет только рецидивирование фарингита, а не начнутся такие осложнения, как ревматизм, гломерулонефриты и далее по списку.
- Если пациент оказался в стационаре и ему обеспечен венозный доступ, то могут использоваться и пенициллины, и ампициллин в разных его вариациях. Главное – правильная доза, правильная кратность и ПРАВИЛЬНАЯ ДЛИТЕЛЬНОСТЬ КУРСА. Идеальный вариант из серии "дешево и сердито". Но обязательно должна быть доказанная микробиология.
При непереносимости пенициллинов помним о клиндамицине как об их адекватной замене.
- Пиогенный стрептококк, как мы выше упомянули, является причиной ранней послеоперационной раневой инфекции. Напомним, что стандартная послеоперационная раневая инфекция развивается к седьмым суткам. А если это произошло в первые сутки, да к тому же страшно завоняло (пиогенный стрептококк недаром называют мясоедным), немедленно делаем мазок, бежим с ним в лабораторию (можно даже своими ногами – это же ваш пациент осложнился, там так же бегом делают мазок по Граму, обнаруживают цепочки, и после этого начинаем лить аминопенициллин в вену, если не использовали его для периоперационной антибиотикопрофилактики (если использовали, то просто продолжаете дальше). Если совсем все бедно, можно пенициллин – 12 млн в сутки. Но если вы провели правильную периоперационную антибиотикопрофилактику, учли все риски и не забыли про свой личный стрептококк в горле, то риск ранней раневой минимален, а если профилактика продленная на 72 часа, то она и раскрутиться не успеет.
- При инфекциях кожи и мягких тканей, а также стрептококковом сепсисе препаратами выбора будут клиндамицин (который блокирует выработку токсических продуктов) в сочетании с пенициллином (24 млн ЕД в сутки) – это наиболее предпочтительная и малозатратная комбинация
Альтернативой в режиме монотерапии могут служить:
-
600 мг в/в каждые 6 часов 2,0 каждые шесть часов 2-3 г в/в каждые 6 часов или цефтриаксон по 2 г в сутки внутривенно в расчете 15 мг/кг в/в каждые 12 часов
Почему максимально важно соблюдать как дозировку, так и кратность введения читаем тут – /vracham/antibiotikoterapiya/polozheniya (часть 1 и часть 2).
В заключение хочется снова воскликнуть – пожалуйста, помните о пиогенном стрептококке и о правильной длительности его лечения.
Читайте также:

