Артралгии при кишечных инфекциях
Обновлено: 19.04.2024
ООО "Он Клиник", Москва
Артриты, ассоциированные с воспалительными заболеваниями кишечника
Журнал: Доказательная гастроэнтерология. 2014;3(2): 32‑35
Кузин А.В., Румянцев В.Г. Артриты, ассоциированные с воспалительными заболеваниями кишечника. Доказательная гастроэнтерология. 2014;3(2):32‑35.
Kuzin AV, Rumiantsev VG. Arthritis associated with the inflammatory intestinal diseases. Russian Journal of Evidence-Based Gastroenterology. 2014;3(2):32‑35. (In Russ.).
В статье приводится обзор литературы, посвященной поражению опорно-двигательного аппарата при воспалительных заболеваниях кишечника. Периферический артрит, воспалительные изменения в позвоночнике (изолированный сакроилеит или анкилозирующий спондилит) и энтезиты относят к наиболее частым ревматологическим проявлениям этих заболеваний.
ООО "Он Клиник", Москва
Воспалительные заболевания кишечника (ВЗК) нередко сопровождаются разнообразными системными внекишечными проявлениями в различных органах и системах. Ревматологические проявления, в первую очередь поражения опорно-двигательного аппарата (ОДА), занимают среди них важное место. Это обусловлено их широкой распространенностью (до 50%), разнообразием и вариабельностью течения (от бессимптомного до тяжелого инвалидизирующего), а также возможностью появления задолго до первых симптомов ВЗК [1—4].
Происхождение внекишечных проявлений ВЗК остается неясным. Предполагают участие внутрикишечных бактерий, повышенной проницаемости стенки кишечника при неспецифическом язвенном колите (НЯК) и болезни Крона (БК), а также генетических особенностей организма [5, 6]. В результате повреждения кишечной стенки в кровоток попадают компоненты оболочки клеток бактерий, способных приводить к развитию артритов посредством индукции иммунологических механизмов. Связываясь с молекулами главного комплекса гистосовместимости (HLA В27) и активируя в дальнейшем Т-лимфоциты, пептиды вызывают воспаление суставов. При этом в процессе рециркуляции между кишкой и синовиальной оболочкой происходит адгезия активированных Т-клеток слизистой оболочки кишки к эндотелию венул синовии, что приводит к синовиту [7, 8].
Впервые интернисты обратили внимание на проблему сочетания артритов и ВЗК в начале XX века, когда была выдвинута идея внекишечных проявлений НЯК и Б.К. Спустя несколько десятилетий V. Wright и J. Moll [9] сформулировали концепцию серонегативных спондилоартритов, в группу которых, кроме анкилозирующего спондилита (АС), псориатического и реактивных артритов были включены также артриты при ВЗК.
С этого времени вырос интерес к проблеме внекишечных проявлений ВЗК, включающих и ревматологические синдромы, так как долгое время артрит крупных суставов, сакроилеит, АС трактовались при ВЗК как проявления сопутствующих заболеваний, не связанных с кишечной патологией. Многие научные работы, проведенные впоследствии, опровергли данное представление, так как в них было доказано, что течение некоторых вариантов поражения ОДА тесно связано с обострениями и ремиссиями ВЗК [10, 11].
В настоящее время наличие внекишечных проявлений рассматривают как один из признаков активности НЯК и Б.К. Ревматологические проявления, в первую очередь симптомы поражения ОДА, при НЯК и БК практически одинаковы [12, 13]. Частота их развития достаточно высока — от 21,4 до 62%, причем большинство исследователей указывают на интервал 30—40% [14—16].
При изучении взаимосвязи патологии ОДА с тяжестью и характером течения кишечного воспаления были получены данные о развитии ревматологических проявлений при более тяжелом течении ВЗК и большей площади поражения желудочно-кишечного тракта, хотя не исключены варианты легкого течения ВЗК с ограниченным поражением кишечника [17, 18]. Например, Е.А. Дорофеев и соавт. [19] при обследовании 319 пациентов НЯК обнаружили, что артриты достоверно чаще развивались при более распространенном поражении кишечника (левостороннем колите и панколите), чем при дистальном колите. Кроме того, в литературе имеются сведения, указывающие на рост числа ревматологических проявлений с увеличением длительности ВЗК [20—22]. При сопоставлении хронологии возникновения ВЗК и артритов у большинства пациентов (до 50%) вначале отмечают дебют НЯК или БК, а позднее присоединяется поражение ОДА [23, 24]. Одновременное появление клинической симптоматики ВЗК и артрита или спондилита выявляют у 30—40% больных [22].
Существует несколько вариантов развития суставного синдрома при НЯК и Б.К. Принципиально важным моментом является разделение патологии ОДА на поражение периферических суставов или аксиального скелета. Наиболее часто клиницист имеет дело с развитием периферического артрита (ПА). Распространенность П.А. среди больных ВЗК наиболее часто составляет 10—22% [25—27]. В большинстве случаев артрит бывает асимметричным и нередко носит мигрирующий характер [28, 29]. Симптоматика обычно купируется в сроки 4—6 нед [10, 30], при этом рецидивы ПА, связанные с обострением ВЗК, отмечают у 10—20% пациентов, а у 20—40% наблюдают хотя бы единичные повторные эпизоды суставного синдрома [15, 30]. У больных БК отмечено более частое развитие ПА с вовлечением в воспалительный процесс толстой кишки [31, 32]. Этот факт хорошо иллюстрирует известное исследование A. Greenstein и соавт. [29] с участием 700 больных БК: ревматологические проявления встречались достоверно чаще в случае вовлечения в воспалительный процесс толстой кишки (при колите и илеоколите), чем при поражении только тонкого кишечника. Попытку классифицировать пациентов с ПА предприняли T. Orchard и соавт. [14], основываясь на анализе данных 1459 пациентов с ВЗК и достоверным П.А. Авторы выделили два типа периферического артрита: при 1-м типе развивается артрит преимущественно коленных и голеностопных суставов, связанный с обострением основного заболевания, при 2-м типе имеет место поражение мелких суставов кистей (пястно-фаланговых, проксимальных межфаланговых суставов), что может затруднять проведение дифференциальной диагностики с ревматоидным артритом. Отличительной чертой ПА 2-го типа является отсутствие хронологической связи между обострениями ВЗК и развитием артрита: кишечный и суставной синдромы существуют практически независимо друг от друга. Оба типа ПА отличаются и количеством вовлекаемых суставов: при 1-м наблюдается олигоартрит, тогда как для 2-го характерен полиартикулярный характер суставного синдрома. При рентгенологическом исследовании пораженных суставов больных ПА в большинстве случаев не удается выявить каких-либо изменений, а в лабораторных показателях ревматоидный фактор отрицательный [33]. Лишь у небольшого числа пациентов с хроническим воспалительным процессом в суставах с течением времени выявляют околосуставной остеопороз, единичные кистовидные просветления костной ткани вблизи пораженных суставов, но даже при торпидном хроническом синовите не удается обнаружить эрозии суставных поверхностей [34].
Как указывалось выше, воспалительные изменения в позвоночнике (аксиальная спондилоартропатия) при ВЗК могут быть представлены в двух вариантах [11]. В первом случае речь идет о сакроилеите изолированном (СИ), нередко бессимптомном, с поражением только крестцово-подвздошных суставов без вовлечения вышестоящих отделов позвоночника [35]. Другим вариантом является АС, при котором кроме сакроилеита имеется поражение других отделов позвоночника с развитием типичной симптоматики [5]. В этом случае пациенты соответствуют Нью-Йоркским модифицированным критериям АС. У ряда больных поражение позвоночника может сопровождаться развитием воспалительной боли в позвоночнике [36, 37]. В отличие от ПА, течение форм аксиальной спондилоартропатии практически не зависит от активности ВЗК [38].
При ВЗК возможно развитие как СИ, так и сакроилеита при А.С. Кроме того, сакроилеит может сочетаться с воспалительной болью в нижней части спины, ПА [39].
Частота обнаружения СИ при ВЗК зависит от методов обследования крестцово-подвздошных суставов. Традиционно для диагностики СИ используют рентгенографию таза. Из данных литературы известно, что СИ, выявляемый при рентгенографии, встречается у 15—27% больных ВЗК [40—42]. Однако основной недостаток рентгенографии — невозможность раннего выявления воспалительных изменений в КПС, а это важно для своевременного установления диагноза и проведения адекватной терапии. Компьютерная томография превосходит рентгенографию при диагностике СИ [43], но для раннего выявления СИ в настоящее время большие надежды возлагают на магнитно-резонансную томографию [44]. Клиническая симптоматика у большинства пациентов стертая, поэтому выявление сакроилеита нередко становится находкой при обследовании [45, 46]. Интересные данные, касающиеся бессимптомного сакроилеита, получены в работе W. Scott и соавт. [47], когда в группе из 64 больных ВЗК при проведении компьютерной томографии СИ был выявлен у 29% больных, при этом клинические симптомы СИ присутствовали лишь в 3% случаев. Генетическая предрасположенность к СИ менее понятна, чем при АС.
СИ чаще всего протекает с минимальной клинической симптоматикой, нередко имеет бессимптомное течение; процесс чаще двусторонний, хотя возможно развитие одностороннего поражения. Клиническое значение СИ недостаточно изучено, видимо, необходимо проведение крупных долгосрочных исследований для выявления пациентов, прогрессирующих в АС [48]. Распространенность А.С. у больных ВЗК составляет 2—12% [18, 39]. Клинические проявления АС при ВЗК практически неотличимы от идиопатического АС (болезнь Бехтерева) [10, 11]. Ведущими симптомами являются боли воспалительного характера в позвоночнике, в том числе в нижней части спины, утренняя скованность, боли в ягодицах [49]. При длительном течении АС происходит ограничение или потеря движений в различных отделах позвоночника с формированием в ряде случаев вынужденных положений туловища [20, 50]. Симптоматика А.С. может значительно опережать появление первых признаков ВЗК [51]. В отличие от идиопатического АС, частота выявления комплекса гистосовместимости HLA B27 при ВЗК и АС ниже и составляет 40—60%. Рентгенологические изменения в позвоночном столбе неотличимы от идиопатического А.С. Возможно развитие типичных для АС рентгенологических симптомов, таких как спондилит (передний и задний), спондилодисцит, синдесмофиты. В отличие от ПА, течение АС обособленное и практически не зависит от активности ВЗК [52—54]. В подтверждение данного факта можно привести данные литературы об отсутствии влияния хирургического лечения ВЗК (иссечение участка пораженного кишечника) на течение АС [11].
В последние годы в литературе появились описания поражения мягких околосуставных тканей при ВЗК — энтезитов (воспаление мест прикрепления сухожилий, связок, апоневрозов к кости), тендинитов, дактилитов, бурситов [55]. Эпидемиологические исследования, посвященные периартикулярной патологии при ВЗК, проводились редко, однако по имеющимся данным ее распространенность составляет 1,5—5,4% [50, 56]. Боль и в некоторых случаях локальная припухлость являются типичными клиническими проявлениями поражения мягких околосуставных тканей при ВЗК, которые могут быть как связанными с активностью основного заболевания, так и присутствовать самостоятельно. Локализация энтезопатий разнообразна, хотя наиболее часто поражаются ахиллово сухожилие и подпяточная область [38].
Кроме описанных выше вариантов поражения возможно развитие редких состояний, также относящихся к поражению ОДА при ВЗК, но не имеющих отношения к спондилоартриту: например, гипертрофической остеоартропатии, периоститов и асептических некрозов костей, крайне редко — гранулем костей и суставов [10, 11].
В ряде случаев наряду с поражением ОДА развиваются другие ревматологические проявления ВЗК. К наиболее значимым относят поражение кожи (узловатая эритема, гангренозная пиодермия) и глаз (конъюнктивит, увеит). Узловатая эритема встречается у 10% больных, часто ассоциирована с активностью ВЗК и ПА [14].
Увеит в большинстве случаев связан с поражением позвоночника и практически не коррелирует с активностью ВЗК [51].
Лечение патологии ОДА представляет собой сложную задачу из-за ограниченности применения нестероидных противовоспалительных средств (НПВС). Хорошо известна эффективность сульфасалазина (в дозе 2 г в сутки) у пациентов с ПА. В то же время применение его при изолированном поражении аксиального скелета оказалось неэффективным. Курация именно этой категория пациентов представляет наибольшую сложность. Невозможность длительного назначения НПВС в терапевтических дозах и неэффективность сульфасалазина диктует целесообразность раннего применения биологических агентов, относящихся к группе антител к фактору некроза опухоли-α [57]. При наличии синовитов или энтезитов торпидного течения возможно внутрисуставное или периартикулярное введение глюкокортикоидов. Кроме того, в комплексном лечении суставного синдрома при ВЗК применяют физиотерапевтическое лечение, лечебную физкультуру. Определение тактики лечения ревматологических проявлений ВЗК необходимо проводить совместно гастроэнтерологам и ревматологам.
В статье рассматриваются особенности течения суставных проявлений при хронических воспалительных заболеваниях кишечника, а также приводится клинический пример течения болезни Крона с дебютом с внекишечных проявлений в виде суставного синдрома.
Изучение хронических воспалительных заболеваний кишечника (ХВЗК) является актуальной проблемой не только детской гастроэнтерологии, но и детской ревматологии вследствие частого дебюта этих патологических состояний именно с суставных проявлений и дальнейшего течения клинически взаимосвязанных кишечного и суставного синдромов.
Распространенность ХВЗК среди детского населения составляет 2,2–6,8 на 100 тыс. детей [1, 2]. С наибольшей частотой в детском возрасте диагностируются такие заболевания этой группы, как болезнь Крона и язвенный колит. Отмечено, что язвенный колит чаще встречается у мальчиков, а болезнь Крона — у мальчиков и девочек с примерно с одинаковой частотой [2].
Болезнь Крона (регионарный энтерит, гранулематозный илеит) — воспалительное заболевание с вовлечением в процесс всех слоев кишечной стенки; характеризуется прерывистым (сегментарным) характером поражения различных разделов желудочно-кишечного тракта. Для него характерна диарея с примесью слизи и крови, боли в животе (часто в правой подвздошной области), потеря массы тела, лихорадка.
Язвенный колит (неспецифический язвенный колит, идиопатический колит) — язвенно-деструктивное поражение слизистой оболочки толстой кишки, которое локализуется преимущественно в ее дистальных отделах. В клинической картине характерны: кровотечения из прямой кишки, учащенное опорожнение кишечника, тенезмы; боли в животе менее интенсивны, чем при болезни Крона, локализуются чаще всего в левой подвздошной области. Примерно у 30% пациентов юношеского возраста язвенный колит начинается внезапно с появления болей в животе и диареи с примесью крови.
По данных разных авторов, внекишечные проявления ХВЗК отмечаются в 5–25% случаев. Наибольшая их доля приходится на тотальные формы неспецифического язвенного колита (87,5%) и болезни Крона с вовлечением в процесс толстой (29%) или толстой и тонкой кишки (58,1%) [3]. Системные проявления ХВЗК по патогенетическому принципу разделяют на три группы. К первой группе относят проявления, возникающие вследствие системной гиперсенсибилизации, — поражения суставов, глаз, кожи, слизистой оболочки рта; ко второй — обусловленные бактериемией и антигенемией в портальной системе — поражения печени и билиарного тракта. Выделяют также явления, развивающиеся вторично при длительно существующих нарушениях в толстой кишке, — анемии, электролитные расстройства.
Патогенез суставных проявлений остается неясным. Обсуждается значение повышенной проницаемости стенки кишечника, отмечающейся у больных язвенным колитом и болезнью Крона, в результате чего в кровь в большом количестве попадают компоненты оболочки стенок бактерий. Эти компоненты выступают в качестве пептидных антигенов, способных приводить к развитию артритов. Связываясь с молекулами комплексов гистосовместимости и активируя в дальнейшем Т-лимфоциты, пептиды приводят к возникновению воспаления суставов [3].
С точки зрения ревматолога суставные проявления ХВЗК относят к т. н. серонегативным спондилоартропатиям. Это большая гетерогенная группа клинически пересекающихся, хронических воспалительных ревматических заболеваний [4]. Помимо артритов, связанных с воспалительными заболеваниями кишечника, в эту группу включают такие ревматические заболевания детского возраста, как ювенильный спондилоартрит, ювенильный реактивный артрит, ювенильный псориатический артрит, а также недифференцированные спондилоартропатии (дактилит, увеит, сакроилеит в отсутствии полного набора критериев). Несмотря на гетерогенность заболеваний данной группы, клинически серонегативные спондилоартропатии имеют общие признаки и характеризуются:
- патологическими изменениями в крестцово-подвздошном отделе и/или других суставах позвоночника;
- синдромом периферической воспалительной артропатии, проявляющейся асимметричным артритом преимущественно нижних конечностей;
- энтезопатическим синдромом;
- ассоциацией с антигеном гистосовместимости HLA-B27;
- тенденцией к накоплению этих заболеваний в семьях;
- частым наличием внесуставных симптомов (поражение глаз, клапанов аорты, кожи) [5, 6]. В МКБ-10 поражения суставов при рассматриваемых нами заболеваниях кодируются следующим образом: М07.4 Артропатия при болезни Крона (К50); М07.5 Артропатия при язвенном колите (К51).
Поражения суставов при ХВЗК встречаются в 20–40% случаев и протекают в виде артритов (периферической артропатии), сакроилеита и/или анкилозирующего спондилита [3].
Артриты
Артриты относятся к наиболее частым суставным проявлениям хронических воспалительных заболеваний кишечника. Нередко они сочетаются с поражением кожи в виде узловатой эритемы. Частота возникновения артритов, распространенность поражения толстой кишки коррелируют с воспалительной активностью основного заболевания. В некоторых случаях артриты могут предшествовать кишечным проявлениям за много месяцев и даже лет, а также сохраняться в фазу ремиссии [7].
Клиническая картина артритов при болезни Крона и язвенном колите идентична. Характерно ассиметричное, мигрирующее поражение суставов чаще нижних конечностей. Преимущественно страдают коленные и голеностопные суставы, далее следуют локтевые, тазобедренные, межфаланговые и плюснефаланговые суставы. Число пораженных суставов обычно не превышает пяти. Суставной синдром течет с чередованием периодов обострений, длительность которых не превышает 3–4 месяцев, и ремиссий. Могут выявляться энтезопатии, талалгии. Артриты, как правило, начинаются остро. Однако нередко больные предъявляют жалобы только на артралгии, и при объективном обследовании изменения не обнаруживаются. Со временем обострения артритов становятся реже. У большинства больных артриты не приводят к деформации или деструкции суставов.
Выделяют два типа поражения периферических суставов. Для первого характерно поражение небольшого количества крупных суставов, ассиметричность суставного синдрома, острое течение. Часто при этом типе суставной синдром предшествует клинической картине основного заболевания, ассоциируется с его обострениями и сочетается с другими внекишечными проявлениями ХВЗК. Второй тип протекает по типу симметричного полиартрита, его обострения не совпадают по времени с обострениями основного процесса в кишечнике и другими системными проявлениями заболевания [7, 8].
Проведение колэктомии у больных язвенным колитом способствует прекращению рецидивирующих артритов [3].
Сакроилеит
По данным рентгенологического исследования, сакроилеит обнаруживается примерно у 50% больных ХВЗК. При этом у 90% он имеет бессимптомное течение. Он не ассоциируется с повышенной частотой выявления у больных HLA-B27. Также наличие сакроилеита не коррелирует с активностью воспалительного заболевания кишечника. Существуя на протяжении нескольких лет, может быть предшественником язвенного колита или болезни Крона. Сакроилеит может быть единственной локализацией изменений со стороны суставов, но часто сочетается с первым типом течения артритов. Необходимо помнить, что сакроилеит может быть ранним симптомом анкилозирующего спондилита. Терапия кишечного синдрома не приводит к изменению клинической картины сакроилеита [7].
Анкилозирующий спондилит
Анкилозирующий спондилит (АС) при ХВЗК клинически, как и сакроилеит, не отличается от идиопатического анкилозирующего спондилита. Чаще встречается у лиц мужского пола. По наблюдениям, у лиц женского пола поражение шейного отдела позвоночника манифестирует в более молодом возрасте и протекает тяжелее. Симптомы АС обычно предшествуют манифестации болезни Крона или язвенного колита и не коррелируют с активностью воспаления в кишечнике. Отмечаются боли в позвоночнике, чувство утренней скованности, нарастает ограничение подвижности в шейном, грудном, поясничном отделах позвоночника. Активная терапия основного заболевания не приводит к изменению клинической картины спондилита [3, 7, 9, 10].
Клиническое наблюдение
Иллюстрацией к вышеизложенному материалу может служить клиническое наблюдение за течением болезни Крона с внекишечными суставными проявлениями у пациента подросткового возраста.
Клинический диагноз: болезнь Крона (поражение тонкого, толстого кишечника, желудка, пищевода), фаза ремиссии, внекишечные проявления (лихорадка в анамнезе, лимфаденопатия, гепатомегалия, железодефицитная анемия). Осложнения: стеноз устья баугиниевой заслонки, сужение входа в слепую кишку.
Ювенильный спондилоартрит, активность I степени, рентгенологическая стадия I–II, НФ-1.
Из анамнеза жизни следует отметить, что мальчик от 2-й беременности, протекавшей физиологически, от первых срочных родов, осложнившихся слабостью родовой деятельности (акушерское пособие — наложение проходных щипцов). Находился на раннем искусственном вскармливании. На первом году жизни наблюдался неврологом. В дальнейшем редкие ОРВИ. Привит по календарю. Детскими инфекциями не болел. Наследственность отягощена по заболеваниям сердечно-сосудистой системы.
Анамнез заболевания: в сентябре 2008 г. после травмы левого голеностопного суставе у ребенка отмечался отек и болезненность в левом голеностопном сустава. Получал местно мази с нестероидными противовоспалительными препаратами (НПВП). Также применялось физиотерапевтическое лечение, что вызвало ухудшение состояния: появилась субфебрильная лихорадка, усилились артралгии в левом голеностопном суставе, также появилась болезненность в височно-нижнечелюстных суставах с ограничением подвижности в них. За три месяца мальчик похудел на 12 кг. Обследован по месту жительства: в анализе крови скорость оседания эритроцитов (СОЭ) 47–55 мм/ч, лейкоцитоз, в биохимическом анализе повышение аспартатаминотрансферазы (АСТ) до 2 норм, С-реативный белок (СРБ)++. Выявлена кишечная инфекция: титр к S. flexneri 1:400. Проводимая терапия (НПВП, антибиотики — цефазолин, цефтриаксон, амикацин) эффекта не дала. На фоне приема антибиотиков появился неустойчивый, разжиженный стул, боли в околопупочной области. В НИИ фтизиатрии исключен туберкулез. При компьютерной томографии левого голеностопного сустава выявлено: сужение суставной щели, краевая узура в медиальной лодыжке, выпот в полость сустава. Исключена ортопедическая патология. С января 2009 г. наблюдается в Университетской детской клинической больнице (УДКБ) Первого МГМУ им. И. М. Сеченова. При поступлении состояние средней степени тяжести. Бледен, выражены симптомы интоксикации. Дистрофия. Суставной синдром в виде выпота, ограничения подвижности, повышения местной температуры и болезненности в левом голеностопном суставе, ахиллобурсит слева, умеренная атрофия мышц левой голени, походка нарушена. Ригидность грудного отдела позвоночника (+ 1 см), ограничение подвижности в височно-нижнечелюстных суставах. Отмечаются боли в животе, разжиженный стул. Высокая гуморальная активность: СОЭ до 50 мм/ч, лейкоцитоз до 22 000 в 1 мкл с палочкоядерным сдвигом до 24%, анемия — гемоглобин (Hb) 109 г/л, однократно повышения уровней АСТ и аланинаминотрансферазы (АЛТ) до 1,5–2 норм. Обследован на артритогенные инфекции: результат отрицателен. При иммуногенетическом обследование выявлены HLA 1-го класс: А2, В 64 (14), В38 (16). Ребенку выставлен предварительный диагноз: ювенильный спондилоартрит. Использовали пульс-терапию глюкокортикоидами, введение внутривенного иммуноглобулина, НПВП, проведена внутрисуставная пункция левого голеностопного сустава с введением Депо-медрола. В качестве базисного препарата ребенку назначен сульфасалазин 1500 мг/сутки. На фоне проводимой терапии отмечалась положительная динамика, несколько снизилась лабораторная активность, купированы боли в животе, нормализовался стул, возрос объем движений в левом голеностопном суставе, однако сохранялась отечность и утренняя скованность в нем. В марте 2009 г. вновь обострение суставного синдрома, лихорадка до 37,8 °C, боли в животе, неустойчивый стул, появилась отечность правого голеностопного сустава. Ребенок вновь госпитализирован в УДКБ в мае-июне 2009 г.: СОЭ 29 мм/ч, гипохромная анемия, тромбоцитоз, СРБ ++, IgG 2150 мг/дл, в копрограмме эритроциты до 40 в поле зрения однократно. Выполнена ректороманоскопия: сигмоидит, проктит, эндоскопические признаки колита. На эзофагогастродуоденоскопии: эрозивный гастрит, дуоденит, еюнит. Рекомендовано проведение колоноскопии, от проведения которой родители ребенка отказались. Мальчику была повышена доза сульфасалазина до 1750 мг/сутки. Но состояние пациента оставалось нестабильным: сохранялись неустойчивый стул, отечность, болезненность и нарушение функции левого голеностопного сустава. В октябре 2009 г. вновь госпитализирован в УДКБ: СОЭ 34 мм/ч, наросла гипохромная анемия Hb 90 г/л, тромбоцитоз, лейкоцитоз до 16 тыс. в 1 мкл, СРБ ++. Ребенку проведена колоноскопия: болезнь Крона, глубокие язвы в ободочной кишке, язвенный терминальный илеит, проктит, колит, сигмоидит. По данным магнитно-резонасной томографии илеосакральных сочленений — левосторонний сакроилеит. Мальчику проводилась коррекция терапии: сульфасалазин отменен, назначен Салофальк 2000 мг/сутки, продолжал получать НПВП. На фоне терапии состояние с положительным эффектом — купирован кишечный синдром, нормализовался стул. Однако в декабре 2009 г. после ОРВИ вновь обострение основного заболевания: повышение температуры до фебрильных цифр, СОЭ 50 мм/ч, отек голеностопных суставов, скованность в них. С конца декабря 2009 г. отмечаются схваткообразные боли в животе, разжиженный стул. В январе 2010 г. в связи с высокой лабораторной и клинической активностью основного заболевания, неэффективностью традиционной терапии (монотерапии Салофальком), прогрессирующей инвалидизацией пациента начата терапия инфликсимабом. 3.02.2010 г. проведено первое введение, на фоне которого отмечена выраженная положительная динамика, купирован кишечный синдром, возрос объем движений в голеностопных суставах, уменьшилась экссудация в них, снизилась активность лабораторных показателей. 17.02.2010 и 17.03.2010 проведены второе и третье внутривенное введение Ремикейда по 100 мг на 1 введение. На фоне лечения отчетливая положительная динамика, полностью купирован кишечный синдром, прибавил в весе 7 кг, однако сохранялось снижение Hb до 87 г/л. При госпитализации в мае-июле 2010 г. СОЭ 23 мм/ч, Hb 91 г/л. При повторной колоноскопии выявлено сужение поперечной ободочной кишки, не проходимое для эндоскопа. Проведена ирригоскопия: слепая, восходящая, 1/2 поперечной кишок деформированы, с выраженным спазмом, с постстенотическим расширением поперечной и нисходящей ободочной кишки. Продолжилась терапия инфликсимабом, с учетом увеличения веса пациента доза повышена. Всего мальчик получил 24 введений инфликсимаба. Состояние его полностью стабилизировалось. Он поправился на 22 кг, вырос на 25 см. Полностью купированы кишечный и суставные синдромы. Полностью нормализовались лабораторные показатели СОЭ 5–14 мм/час. Hb 151 г/л. Мальчик ведет активный образ жизни.
Литература
- Яблокова Е. А. Клинические особенности и нарушение минерализации костной ткани у детей с воспалительными заболеваниями кишечника. Дисс. канд. мед. наук. М., 2006. 185 с.
- Tourtelier Y., Dabadie A., Tron I., Alexandre J. L., Robaskiewicz M., Cruchant E., Seyrig J. A., Heresbach D., Bretagne J. F. Incidence of inflammatory bowel disease in children in Britani (1994 –1997). Breton association of study and research on digestive system diseases (Abermad) // Arch Pediatr. 2000 Apr; 7 (4): 377–384.
- Гвидо Адлер. Болезнь Крона и язвенный колит. М.: ГЭОТАР-МЕД, 2001.
- Шостак Н. А., Правдюк Н. Г., Абельдяев Д. В. Серонегативные спондилоартропатии — совершенствование подходов к ранней диагностике и лечению // РМЖ. 2013, № 6, 1002–1008.
- Справочник по ревматологии / Хаким А., Клуни Г., Хак И.; пер. с англ. Н. И. Татаркиной. М.: ГЭОТАР-Медиа, 2010. 560 с.
- Dougados M., Hermann K. G., Landewe R. et al. Assess spondyloarthritis to international Society (ASAS) handbook: a guide The Assessment of spondyloArthritis // Ann Rheum Dis. 2009. Vol. 68. Р. 1–44.
- Ревматология. Национальное руководство под ред. Е. Л. Насонова, В. А. Насоновой. М.: ГЭОТАР-Медиа, 2008. 720 с.
- D’Incà R., Podswiadek M., Ferronato A., Punzi L., Salvagnini M., Sturniolo G. C. Articular manifestation in inflammatory bowel disease patients. A prospective study // Dig Liver Dis. 2009, Mar 9.
- Rodriguez V. E., Costas P. J., Vazquez M., Alvarez G., Perez-Kraft G., Climent C., Nazario C. M. Prevalence of spondyloarthropathy in Puerto Rican patients with inflammatory bowel disease/Ethn Dis. 2008, Spring; 18 (2 Suppl 2): S2–225–9.
- Руководство по детской ревматологии / под ред. Н. А. Геппе, Н. С. Подчерняевой, Г. А. Лыскиной. М.: ГЕОТАР-Медиа, 2012. 720 с.
А. В. Мелешкина 1 , кандидат медицинских наук
С. Н. Чебышева, кандидат медицинских наук
Е. С. Жолобова, доктор медицинских наук, профессор
М. Н. Николаева
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Abstract. The article covers specifics of development of articular manifestations under chronic inflammatory bowel diseases and provides clinical example of crohn’s disease development starting with un-bowel manifestations in forn of articular syndrome.
Рассмотрены трудности диагностики иерсиниоза, клинические проявления иерсиниозной инфекции у детей. Даны подходы к лечению, включая рекомендации по функциональному питанию, использованию метаболической и энерготропной терапии с обязательным продолжением б
Difficulties of yersiniosis diagnostic, clinical manifestations of yersiniosis infection with children are analyzed. Approaches to treatment are covered, including recommendations to functional nutrition, using of metabolic and energotropic therapy with compulsory bio-correction support.
.jpg)
Иерсиниоз (псевдотуберкулез и кишечный иерсиниоз) широко распространен во многих регионах России. Клинические проявления заболевания, вызванного иерсиниями, разнообразны и зависят от массивности инфицирования пациента, возраста ребенка, состояния его реактивности, а также от отягощенности фоновыми заболеваниями детей к моменту инфицирования иерсиниями [10]. Вариабельность клинических проявлений иерсиниоза и недостаточные возможности лабораторной диагностики создают дополнительные трудности для распознавания заболевания [11].
Полиморфизм клинических черт иерсиниозной инфекции с вирусными и протозойными возбудителями приводит к большому числу диагностических ошибок, несвоевременному и неэффективному лечению, возникновению хронических гастроэнтерологических заболеваний [6]. Значительные затруднения в диагностике иерсиниоза возникают у врача в связи с наслоением инфекции на предшествующую гастроэнтерологическую патологию (хронический гастродуоденит, синдром мальабсорбции и др.). Создается возможность принять ухудшение в состоянии пациента как очередное обострение хронического заболевания органов пищеварения. Это нередко уводит клинициста в сторону от правильного диагноза, что предрасполагает к формированию негладкого течения иерсиниоза с последующим развитием рецидивирующих форм болезни и длительной персистенцией иерсиний [9].
Нередко причинами рецидивов иерсиниозной инфекции у детей являются легкие или абортивные формы, перенесенные детьми в острый период инфекции, и, как следствие, воздержание от назначения этиотропной терапии или использование антибиотиков, к которым первично нечувствительны микробы. Достоверно чаще возникают рецидивы иерсиниозной инфекции у детей дошкольного возраста, у пациентов с неблагополучием преморбидного состояния: протозойная инвазия, дисбактериоз кишечника, вторичный иммунодефицит и др. [2, 1]. Смена клинической доминанты, наблюдающаяся при рецидивирующем течении иерсиниоза, появление внекишечных признаков данной инфекции (узловатой эритемы, лимфаденита, реактивного артрита, увеита и др.) отвлекают мысль педиатра от правильного диагноза. Все это в совокупности и определяет позднюю диагностику и неадекватность лечения иерсиниоза у детей [5].
Материал и методы обследования. В комплекс обследования включались оценка клинико-анамнестических данных, анализы клинического минимума, УЗИ органов брюшной полости, фиброгастродуоденоскопия с проведением хелпил-теста и дыхательные пробы (хелик-тест), реакция непрямой гемагглютинации (РНГА) с кишечными и иерсиниозными диагностикумами, полимеразная цепная реакция (ПЦР) кала на ДНК иерсиний. По показаниям проводилось исследование крови, иммуноферментный анализ (ИФА), на антитела к вирусам герпеса (HV 1-го, 2-го типов, вирус Эпштейна–Барр (ВЭБ), цитомегаловирус (ЦМВ)) и ПЦР на маркеры ДНК к вирусам семейства герпеса в двух биосубстратах (секрет из носоглотки и кровь). Исследование крови на инвазию лямблий проводилось методом формалин-эфирного обогащения. У больных с длительной персистенцией возбудителей оценивались показатели микробиоценоза кишечника.
Под наблюдением в условиях дневного стационара находилось 83 пациента в возрасте от 3 до 11 лет с рецидивирующим течением иерсиниозной инфекции. У 46 детей (из 83) возникновению иерсиниоза предшествовал хронический гастродуоденит (ХГД), у 17 — хронический гастрит (ХГ), у 15 — пищевая аллергия и у 14 — протозойная инвазия.
Результаты. При клинико-эндоскопическом обследовании у 34 (из 46) детей с ХГД был поверхностный тип изменений СОЖ (74%) и у 12 — нодулярный или эрозивный тип (26%). У детей с ХГ у 14 (из 17) были поверхностные изменения слизистой (82,4%) и у 3 детей — эрозивный тип (17,6%).
Диспептические расстройства у больных при рецидиве иерсиниозной инфекции характеризовались упорной тошнотой, появлением повторных приступов рвоты, снижением аппетита, неустойчивым характером стула с примесью в нем слизи. В копрограмме определялись признаки илеоцекального синдрома, слизь, лейкоциты от 5 до 15 в поле зрения.
На основании анамнестических сведений, где в недалеком прошлом были указания на острое начало заболевания с повышением температуры, выраженного энтерального синдрома и характерной кишечной симптоматики, свойственной рецидиву болезни, — упорные абдоминальные боли, боль при пальпации илеоцекальной зоны, положительные симптомы Падалки, Образцова, увеличение мезентериальных узлов, устанавливался диагноз терминального илеита и мезаденита иерсиниозной этиологии. Однако, несмотря на выраженность вышеперечисленных симптомов, диагноз илеита и мезаденита у больных до поступления в стационар не был установлен ни у одного больного. Не было придано диагностического значения и внекишечным проявлениям болезни. У 32 детей в анамнезе отмечалось пластинчатое шелушение кожи на кистях и стопах, у 17 детей были проявления узловатой эритемы, у 20 детей были лимфоаденопатии, из них у 7 пациентов было оперативное пособие по поводу лимфаденита, упорные артралгии и артриты были у 23 детей, увеиты — у 5 больных.
Проведенная диагностика инфекции Helicobacter pylory (НP) у больных с заболеваниями желудка показала НP(+)-ассоциации у 35 из 46 больных ХГД и у 12 из 17 пациентов ХГ, что составило 76% и 70% соответственно. НP-негативных пациентов с ХГД было 11 и с ХГ — 5 больных. Лямблиозная инвазия при рецидивирующих формах иерсиниоза была обнаружена у 30 детей (из 83), что составило 36,1%.
У детей с заболеваниями желудка (ХГД и ХГ) при рецидиве иерсиниозной инфекции чаще всего обнаруживались ассоциации иерсиний с хеликобактерами и лямблиями — у 28 детей из 63 (44,4%).
В связи с указанием в анамнезе наблюдаемых детей на часто переносимые респираторные заболевания, сопровождающиеся высокой лихорадкой, ангинами, лимфоаденопатиями или повторными герпетическими высыпаниями на слизистых оболочках, им назначалось вирусологическое тестирование с целью выявления возможного персистирования у них вирусных инфекций [3, 8]. Известно, что вирусы обладают иммунодепрессивным действием, могут вызывать иммунопатологические реакции, тем самым способствуя у ослабленных детей персистенции в их организме бактериальных возбудителей.
У детей с заболеваниями желудка при рецидиве иерсиниозной инфекции методом ИФА сыворотки крови и ПЦР-тестами с двумя биосубстратами (секрет из носоглотки и кровь) обнаруживались микст-формы персистенции иерсиний с вирусами семейства герпеса в различных сочетаниях у 24 детей из 63, что составило 38,1%. Ассоциации иерсиний с ВЭБ-инфекцией наблюдались у 12 детей, иерсиний с ВЭБ и HV 1-го, 2-го типов — у 9 детей и иерсинии с ВЭБ, HV 1-го типа и ЦМВ — у 3 детей. Значительно реже обнаруживались ассоциации иерсиний с моновирусами: иерсинии с HV 1-го типа были у 3 детей (4,7%).
Таким образом, выявление ассоциативных форм возбудителей при рецидивирующем течении иерсиниоза вносит смысл в понимание измененной иммунологической реактивности детей и диктует необходимость патогенетического лечения пациентов с учетом приоритета патогенетических нарушений в организме.
При двойном и тройном инфицировании пациентов (иерсинии, герпесвирусы, НP-инвазия) антибактериальная и антивирусная терапия должна предшествовать назначению эрадикационных схем [8]. Выбор антибиотиков должен быть дифференцированным, с высокой чувствительностью к ним иерсиний (Гентамицин, Амикацин, Аугментин, Левомицетин), длительность курса не менее 2 недель. В связи с длительным пребыванием бактерий в макрофагах и незавершенностью в них фагоцитоза корригирующая пробиотическая поддержка и нормализация дисметаболических нарушений должна быть пролонгированной с учетом длительности жизненного цикла макрофагов.
В восстановительный период болезни при диспансерном наблюдении за больными необходимо уделять максимальное внимание режиму жизни детей, функциональному питанию, использованию метаболической и энерготропной терапии (Эссенциале форте H, Элькар, Кудесан, Магне В6, Лецитин) с обязательным продолжением биокоррекционной поддержки (Примадофилус Джуниор, Примадофилус Детский и др.). Показано также применение натуропатических препаратов.
Приведем клинические иллюстрации.
Анамнез болезни. Заболел в летние месяцы на выезде на отдых в Крым, появилась лихорадка до 40 °С, держалась 5 дней одновременно с дисфункцией кишечника, стул был жидкий, 4–5 раз в день. Был на госпитализации в г. Симферополь, получил в больнице капельное введение глюкозосолевых растворов и Амоксиклав в течение 5 дней. Состояние улучшилось, выписан на 6?й день болезни. Прием препаратов был прекращен. После возвращения домой стали возникать боли в животе, стул был неустойчивый. В сентябре в школе по контакту с гепатитом было выявлено увеличение АСТ и АЛТ до 300 ед. Маркеры гепатита оказались отрицательными. Повышенные уровни трансаминаз и увеличение печени в размерах по данным УЗИ объясняли стеатогепатитом, так как у пациента была избыточная масса тела (ИМТ — 25). Назначались гепатопротекторные препараты, но положительного эффекта не было.
Анамнез жизни. От первой беременности, первых родов. Беременность и роды протекали нормально. Родился доношенным, масса тела 3750 г/52 см. Выписан из роддома на 5-й день жизни. Грудное вскармливание с рождения до 10 месяцев жизни. Прикормы вводились по возрасту, адаптация к ним была хорошая. Весовые прибавки были избыточные, в 1 год — масса 11 800 г, длина 77 см. В дошкольном возрасте респираторными заболеваниями болел редко, перенес ветряную оспу в 4 года и в 5 лет — острый бронхит. Избыточная масса тела с рождения, индекс массы тела (ИМТ) в 10 лет — 25.
В анализе крови — лейкопения, нейтропения, лимфомоноцитоз, СОЭ — 18 мм/час. Анализ мочи без патологии. В копрограмме — полуоформленный стул, синдром нарушенного желчеотделения, энтеральный синдром. В биохимическом анализе крови — диспротеинемия, синдром цитолиза и холестаза.
Таким образом, анамнестически и клинико-лабораторно у пациента выявлен терминальный илеит и мезаденит, иерсиниозной этиологии. Реактивный гепатит. Хронический гастродуоденит, ассоциированный с НP-инфекцией и ВЭБ, эрозивный тип. Сопутствующие заболевания: дискинезия желчевыводящих путей (на почве деформации желчного пузыря). Избыточная масса тела. Дисбактериоз кишечника.
Больному назначено лечебное питание (стол 1), комплекс витаминов (Алфавит), Галстена, Эссенциале форте H и Хилак форте. Антибактериальная терапия терминального илеита, мезаденита проводилась гентамицином в течение 7 дней и Аугментином 8 дней. Антивирусное лечение проводилось препаратом Реаферон-ЕС-Липинт в течение 4 недель. В программу эрадикационной терапии включались омепразол, Флемоксин Солютаб и Макмирор в сочетании с Циклофероном внутрь по прерывистой схеме. Через 1 месяц от начала антибактериальной и гепатопротекторной терапии уровень АЛТ и АСТ нормализовался. ПЦР кала на маркеры ДНК иерсиний была негативной. Контрольная ФГДС, выполненная через 1,5 месяца после эрадикационной схемы лечения, выявила поверхностные изменения СОЖ в антруме, эрозии не обнаруживались, хелпил-тест отрицательный. Вирусологическое тестирование через 3 месяца от начала антивирусной терапии не выявило маркеров ДНК ВЭБ в секрете из носоглотки, в ИФА крови — обнаружены IgGNA.
Последующее наблюдение за пациентом в течение полугода — стойкая ремиссия.
Анамнез жизни. Пренатальный анамнез благополучный, вес при рождении — 3560 г, рост 52 см. Грудное вскармливание до одного года, прикормы введены с 6 месяцев. Физическое развитие по возрасту, с 3 лет посещает детский сад. Простудные заболевания редкие.
Данные обследования: анализ крови от 07.06.11 — гемоглобин 123 г/л, эритроциты — 4,3 × 10 12 /л, лейкоциты — 8,0 × 10 9 /л, палочкоядерные — 2%, сегментоядерные — 34%, лимфоциты — 61%, моноциты — 3%, СОЭ — 16 мм/час. Анализ мочи без особенностей. Копрограмма — признаки нарушения полостного пищеварения, слизь (+), лейкоциты — 5–6 в поле зрения, единичные лямблии, яйца глистов не обнаружены. УЗИ брюшной полости: печень — обычной эхогенности, увеличение размеров правой доли печени, перегиб в области шейки желчного пузыря, поджелудочная железа и селезенка — без особенностей. Биохимия крови: общий белок — 69,8 г/л, альбумины — 59,7%, альбумины/глобулины — 1,4, альфа1-глобулины — 4%, альфа2-глобулины — 14,2%, бета-глобулины — 12,8%, гамма-глобулины — 13,8%, глюкоза — 4,1 ммоль/л, сывороточное железо — 14,2 мкмоль/л, билирубин — 10 мкмоль/л.
Лечение проводилось диетой (стол 4), левомицетин внутримышечно, Эссенциале форте H, сорбент — Энтеросгель, пробиотик — Бифидум БАГ 791.
Литература
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
Северо-Западный Государственный медицинский университет им. И. И. Мечникова, Санкт-Петербург
Человек постоянно контактирует с окружающей средой, а значит и с населяющими ее микроорганизмами, многие из которых являются патогенными, способными вызвать воспалительный процесс. Инфекционный артрит развивается при попадании инфекции в сустав. Предупредить тяжелые осложнения этого заболевания может только своевременное обращение за медицинской помощью.
Общие сведения о заболевании
Инфекционный артрит – это воспаление сустава, вызванное местной или общей инфекцией. Симптомы болезни и ее течение во многом зависят от вызвавшей инфекционный процесс инфекции.
Коды инфекционных артритов по МКБ-10:
- стафилококковый - M00.0;
- пневмококковый - M00.1;
- стрептококковые - M00.2;
- вызванные другими уточненными бактериальными возбудителями - M00.8;
- пиогенный неуточненный - M00.9;
- туберкулезный – М01.1;
- гонококковый - M01.3;
- вирусный – М01.5.
Заболевание очень распространено и может стать причиной стойкого нарушения суставной функции. Четверть пациентов, обращающихся по поводу заболеваний суставов, страдают инфекционными артритами.
Причины инфекционного артрита
Причиной заболевания является инфекция – гнойная инфекция из расположенных рядом очагов (флегмон, абсцессов) или занесенная с током крови при холециститах тонзиллитах, а также общие инфекционные заболевания. При попадании инфекционных возбудителей в сустав иммунная система начинает с ними бороться, вызывая воспалительный процесс, течение которого напрямую связано с особенностями инфекционного возбудителя.
Воспаление может быть:
- неспецифическим – то есть, иметь общие симптомы, характерные для воспалительных процессов; вызываются такие процессы гноеродной патогенной и условно-патогенной микрофлорой – стафилококками, стрептококками, синегнойной и кишечной палочками и др.; вызываемые ими воспалительные процессы носят обычно острый гнойный характер и протекают остро, особенно, у детей;
- специфическим – при таком воспалении развиваются, как общие симптомы, характерные для всех артритов, так и симптомы, свойственные данной инфекции; к таким инфекциям относят туберкулезный, бруцеллезный, гонорейный, вирусный, грибковый, паразитарный воспалительные процессы.
Инфекционные артриты имеют два механизма развития:
- бактериально-метастатический – воспаление начинается из-за присутствия в суставе инфекции;
- токсико-аллергический – воспаление развивается за счет общей интоксикации и неадекватного иммунного ответа на внедрение в организм инфекции;
- смешанный – действуют оба механизма.
Факторы, предрасполагающие к развитию инфекционного артрита: вредные привычки, поднятие тяжестей, наличие лишней массы тела, сахарного диабета. Гнойные поражения суставов особенно часто развиваются у женщин, страдающих ревматоидным артритом.
Симптомы инфекционного атрита
Инфекционный артрит обычно начинается и протекает остро, иногда подостро. Но при некоторых специфических инфекциях он имеет незаметное начало и длительное течение.
Начало болезни и первые симптомы
При остром начале основными симптомами инфекционного артрита являются: выраженная лихорадка, озноб, летучие мышечно-суставные боли в сочетании с резкой болезненностью в пораженном суставе, отеком и гиперемией кожи над ним. Практически всегда остро протекает инфекционный артрит у детей.
Подострое течение имеет не такое заметное начало, температура тела нормальная или субфебрильная. Отек, гиперемия и боль в суставах умеренные.
Самым опасным является скрытое, незаметное течение, характерное для туберкулезного артрита. Характерны неопределенные боли в суставах, похрустывание, снижение двигательной активности. Болезнь протекает на фоне туберкулеза, небольшое повышение температуры также может не привлечь внимания, поэтому туберкулезный артрит редко выявляется на ранних стадиях.
Боли и и отеки характерны для начальной стадии инфекционного токсико-аллергического артрита у детей и взрослых
Явные симптомы
Острый гнойный артрит развиваются очень быстро, состояние ухудшается с каждым днем, беспокоит лихорадка, отечность, гиперемия и боль нарастают. Не исключено, что больному потребуется хирургическая помощь.
При более медленном течении симптомы инфекционного артрита развиваются постепенно, появляется общее недомогание, слабость, суставные боли становятся постоянными, усиливаясь при движении. Постепенно нарушается функция конечностей: появляются трудности в их сгибании или разгибании.
Когда необходимо обращаться за медицинской помощью
К врачу нужно обращаться при появлении следующих симптомов:
- постоянных или регулярно повторяющихся болях в суставах;
- появлении лихорадки, недомогания в сочетании с болями в суставах;
- отека, гиперемии кожи над суставом в сочетании с лихорадкой у пациентов, уже страдающих хроническим артритом – возможно, к имеющемуся хроническому воспалению присоединилась инфекция;
- появление суставных болей при туберкулезе легких, гонорее, бруцеллезе и др. инфекционных заболеваниях.
Опасности
Заболевание часто протекает тяжело, с осложнениями.
Стадии заболевания
Течение болезни связано с ее клинической формой, поэтому стадии развития патологического процесса могут иметь значительные различия. Рассмотрим стадии развития острого гнойного артрита, разработанные НИИ им. Вишневского:
- Начальная – гнойный процесс без деструкции внутрисуставных тканей:
- А. - без поражения околосуставных тканей;
- В. – с развитием гнойных процессов в прилегающих тканях.
- Развернутая – гнойный артрит с деструкцией внутрисуставных тканей:
- А. - без поражения околосуставных тканей;
- В. – с гнойным поражением окружающих мягких тканей.
- Запущенная – с поражением костной и хрящевой ткани:
- А. - без поражения окружающих тканей;
- В. – с гнойным поражением данных тканей;
- С. – с выходом гноя на поверхность тела (свищами).
- Завершающая:
- при отсутствии адекватного лечения – деструкция, неподвижность сустава, инвалидизация;
- при правильном лечении – полное или частичное восстановление функции конечности.
Возможные осложнения
Инфекционный артрит может давать ранние и поздние осложнения. К ранним осложнениям относятся в основном осложнения гнойного артрита:
- нагноение околосуставных тканей;
- генерализация инфекции, сепсис.
Отдаленные последствия – это утрата функции конечности разной степени: от легкой до полной неподвижности.
Классификация
Происхождение и симптомы инфекционного артрита разных клинических форм имеют, как сходство, так и отличие. Рассмотрим наиболее распространенные формы.
Острый гнойный
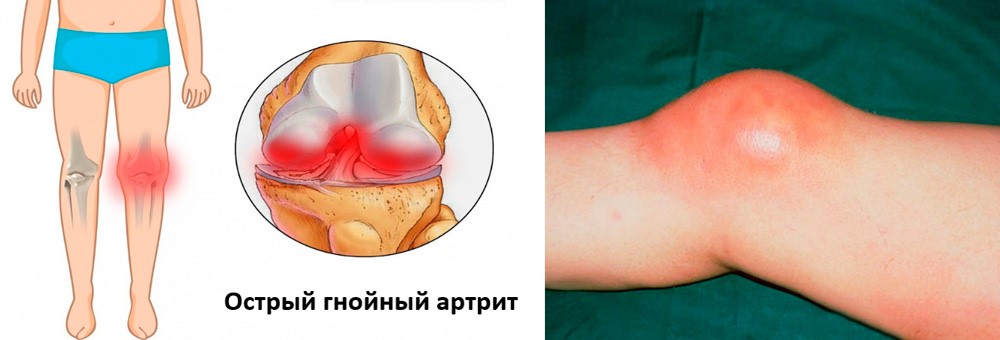
Острый гнойный артрит коленного сустава
Данная форма заболевания развивается при попадании в сустав гноеродной инфекции (синегнойной палочки, стафилококков, стрептококков и др.). Заражение может быть первичным при ранениях и вторичным – при переходе инфекции из окружающих тканей или отдаленных очагов инфекции. К группе риска относятся лица, страдающие ревматоидным артритом, особенно, женщины.
Начинается заболевание остро и протекает тяжело. Появляется лихорадка, головная боль, озноб. Пораженный сустав отекает, кожа над ним краснеет. Боль настолько сильная, что больной не может пошевелить конечностью и старается придать ей положение, вызывающее наименьшую болезненность.
Без оказания своевременной помощи суставные поверхности быстро разрушаются с ограничением подвижности конечности. При назначении адекватного лечения наступает полное выздоровление.
Септический
Развивается на фоне уже существующего сепсиса – генерализованного инфекционного процесса. Инфекция попадает в суставную полость гематогенным путем - с током крови. Заболевание может протекать в виде:
- бактериально-метастатической формы с симптомами острого гнойного артрита – состояние пациента может быть крайне тяжелым; прогноз заболевания зависит от своевременного лечения;
- токсико-аллергической формы – течение не всегда имеет острый характер, часто протекает подостро с множественным поражением суставов мигрирующего (чередующегося) характера; процесс носит негнойный характер и заканчивается выздоровлением на фоне излечения сепсиса.
Туберкулезный
Артрит в данном случае также протекает в виде бактериально-метастатической и токсико-аллергической форм. В первом случае поражаются в основном позвоночник и крупные суставы конечностей, а заболевание носит название костно-суставного туберкулеза. Протекает изначально хронически с нарастающими болями при движении, общим недомоганием. Основные изменения видны на рентгене в виде поражения суставной костной ткани от появления пятна с утратой костью кальция до разрушения кости. При отсутствии лечения приводит к инвалидности.
Токсико-аллергическая форма впервые описанная Понсе в начале 20-го века, протекает очень похоже на ревматоидный артрит с хроническим началом и поражением мелких суставов кисти и стоп. Возможна также их деструкция и инвалидизация. Поражение крупных суставов иногда протекает без последствий и проходит на фоне противотуберкулезной терапии.
Хондропротекторы что это как выбрать, насколько они эффективны
Боль в суставах в состоянии покоя
Гонорейный
Поражение суставов гонококковой инфекцией может иметь бактериально-метастатическую и токсико-аллергическую формы. В обоих случаях поражаются крупные суставы, чаще всего один коленный (голеностопный, лучезапястный). Протекает болезнь остро, с высокой температурой, интоксикацией и сильнейшими суставными болями. Колено отекает, краснеет, до него невозможно дотронуться из-за болей.
При проведении своевременного лечения болезнь имеет благоприятный исход. Если же не лечить, быстро наступает полная неподвижность конечности.
Боррелиозный
Боррелиоз или болезнь Лайма – это инфекция, вызываемая спиралевидными бактериями – спирохетами боррелиями. Передается она клещами и протекает в виде последовательной смены стадий:
- Через 1-2 недели после укуса клеща появляются повышение температуры тела, интоксикация, скованность мышц и появление на теле в месте укуса клеща покраснения - эритемы, окруженной концентрическими кольцами, распространяющейся на большие участки тела. При своевременном назначении антибактериальной терапии заболевание может закончиться на этой стадии.
- Развивается через 1 – 3 месяца после начала заболевания и проявляется в виде поражений нервной системы (менингитов, невритов с острыми болями) и сердца (сердечных блокад, миокардитов и др.).
- Поражение суставов начинается через полгода (иногда через 2 года) после начала заболевания у генетически предрасположенных людей и протекает в виде сильных суставных болей, доброкачественного рецидивирующего воспалительного процесса, протекающего по типу инфекционно-аллергического артрита с асимметричным поражением 1 – 2 суставов (чаще всего коленного) и заканчивающегося через несколько лет выздоровлением у большинства больных. Но у некоторых пациентов заболевание может переходить в хроническую форму с постепенным нарушением функции конечностей.
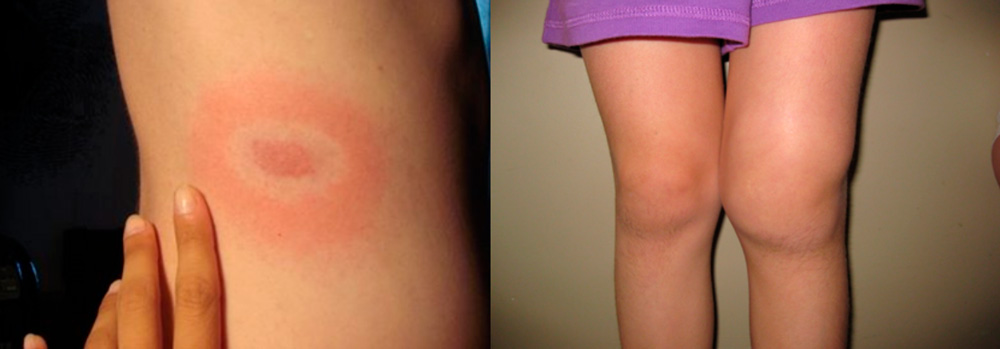
Начальная стадия боррелиоза – мигрирующая эритема и 3 стадия - хронический артрит колена
Вирусный
Развивается на фоне различных вирусных заболеваний:
- Парвовирусная инфекция, вызванная парвовирусом B19 – заболевание протекает с интоксикацией, лихорадкой, кожными проявлениями в виде красных пятен, возвышающихся над кожей папул и точечных подкожных кровоизлияний. Одновременно происходит симметричное поражение суставов. Могут вовлекаться мелкие суставчики кисти, лучезапястные, локтевые, коленные, голеностопные суставы. Симптомы похожи на ревматоидные поражения, но протекают от 3 месяцев до года и имеют благоприятный исход.
- Краснуха – артрит развивается чаще у взрослых женщин на фоне уже имеющихся симптомов краснухи или перед их появлением. У детей такие поражения встречаются редко. Околосуставные ткани отекают, краснеют, появляются сильные боли, нарушающие суставную функцию. Поражение асимметричное с вовлечением мелких суставов кисти, лучезапястных, коленных, локтевых суставов. Артрит продолжается две-три недели, после чего наступает полное выздоровление.
- Вирусные гепатиты В и С – артриты развиваются достаточно часто, но имеют доброкачественное течение и заканчиваются полным выздоровлением. Поражаются мелкие суставы кисти, локтевые, голеностопные и реже другие суставы. Воспаление в суставах обычно начинается до появления желтухи и заканчивается в период ее разгара.
Грибковый
Чаще всего грибковые поражения суставов развиваются при актиномикозе, но встречаются и при другой грибковой инфекции. Патогенные грибки попадают в суставную полость из расположенного рядом костного очага поражения или из отдаленных очагов (кариозные зубы) с током крови. Течение хроническое, с рецидивами и возможным присоединением бактериальной инфекции. Очень часто возникают свищи – ходы, по которым гной из сустава выделяется на поверхность кожи. При отсутствии адекватного лечения приводит к постепенной утрате суставной функции.
Паразитарный
Причиной артрита обычно является эхинококкоз, поражающий костную ткань позвонков, костей таза и длинных костей конечностей. В суставах обычно развивается токсико-аллергический воспалительный процесс. Часто вовлекаются суставы позвоночника, тазобедренные, коленные и локтевые суставы. Течение доброкачественное, но сопровождается сильными суставными болями. Выздоровление наступает при назначении полноценного лечения эхинококкоза.
Инфекционно-аллергический артрит
Инфекционно-аллергический артрит возникает, когда есть аллергия, на фоне которой развивается при неблагоприятных условиях воспалительный процесс в суставах. Заболевание протекает в бурной форме, сопровождается высокой температурой и сильными болевыми признаками. В области поражения наблюдается покраснение, отечность, припухлость. На разных участках кожи – кольцеобразная аллергическая сыпь. Лечением инфекционно-аллергического артрита занимаются ревматолог и аллерголог.
Локализация инфекционного артрита
При инфекционном поражении суставов локализация патологического процесса зависит от особенностей инфекции и ее клинической формы. При острых гнойных артритах – это в основном крупные суставы – коленный, голеностопный, локтевой. Мелкие суставы кисти и стопы поражаются при токсико-аллергической форме туберкулезного и некоторых вирусных артритах.
Асимметричное поражение одного-двух крупных суставов характерно для боррелиоза, чаще всего при этой инфекции в процесс вовлекаются коленные суставы.
Читайте также:

