Атипичная инфекция у детей что это такое
Обновлено: 22.04.2024
Эпштейна-Барр вирусная инфекция (ЭБВИ) относится к наиболее распространенным инфекционным заболеваниям человека. Антитела (Ат) к вирусу Эпштейна-Барр (ВЭБ) обнаруживают у 60% детей первых двух лет жизни и у 80–100% взрослых [3, 13]. Заболеваемость острой формой ЭБВИ (ОЭБВИ) в различных регионах мира колеблется от 40 до 80 случаев на 100 тыс. населения [2]. Хроническая форма ЭБВИ (ХЭБВИ) развивается у 15–25% лиц после ОЭБВИ [1, 5, 15]. Установлена роль ВЭБ в развитии злокачественных новообразований, аутоиммунных заболеваний и синдрома хронической усталости [3, 5, 14, 15]. Все это свидетельствует об актуальности проблемы ЭБВИ.
ВЭБ, открытый в 1964 г. M. Epstein и Y. Barr, относится к γ-герпес-вирусам [3]. ВЭБ имеет в своем составе 3 антигена: капсидный (VCA), ранний (EA) и ядерный (EBNA). Своеобразие патологического процесса при ЭБВИ определяется способностью ВЭБ к трансформации В-лимфоцитов, пожизненной персистенции в организме человека, индукции вторичного иммунодефицитного состояния (ИДС), аутоиммунных реакций, злокачественных опухолей [1, 3, 5, 12].
Источник заражения ВЭБ — больные манифестными и бессимптомными формами. 70–90% лиц, перенесших ОЭБВИ, выделяют вирус в последующие 1–18 мес. Пути передачи ВЭБ: воздушно-капельный, контактно-бытовой, парентеральный, половой, вертикальный. ОЭБВИ характеризуется эпидемическими подъемами 1 раз в 6–7 лет, чаще регистрируется в возрасте от 1 до 5 лет, в организованных коллективах [4, 7, 9].
Иммунный статус 109 больных ОЭБВИ в возрасте от 5 до 14 лет в нашей работе выявил признаки активации Т-клеточного звена иммунной системы — повышение количества Т-лимфоцитов (CD3), цитотоксических Т-лимфоцитов (CD8), клеток с маркерами поздней активации (HLA-DR); поликлональную активацию В-лимфоцитов — увеличение количества CD20-клеток, иммуноглобулинов (Ig) IgA, IgM, IgG, циркулирующих иммунных комплексов (ЦИК). Обнаружены признаки угнетения иммунной системы: нормальное содержание Т-хелперов (CD4), снижение иммунорегуляторного индекса CD4/CD8, количества естественных киллерных клеток NK (CD16), повышение готовности иммунокомпетентных клеток к апоптозу (CD95). Наблюдалась активация кислородзависимого метаболизма нейтрофилов и редукция его адаптационных возможностей.
У трети обследованных детей (33,9%) ОЭБВИ протекала в форме микст-инфекции с цитомегаловирусами (ЦМВ), вирусами простого герпеса 1 и 2 типов (ВПГ-1, ВПГ-2). При бактериологическом исследовании мазков из ротоглотки у 41,3% пациентов выделены Streptococcus (S.) viridans, у 11,9% — Candida albicans, у 8,2% — Staphilococcus (Staph.) epidermidis, у 6,4% — S. pyogenes, у 2,7% — Klebsiella (Kl.) pneumoniae, у 41,3% — ассоциация бактерий. У 43,1% пациентов — серологические маркеры активной формы хламидийной инфекции, у 30,3% — микоплазмоза.
Возможны следующие исходы ОЭБВИ: латентная инфекция, ХЭБВИ, ИДС, онкологические, аутоиммунные заболевания, синдром хронической усталости [5, 8, 10, 11]. Переход в ХЭБВИ связан с комплексом неблагоприятных факторов в анте-, интра- и постнатальном периодах, нарушением нейроиммунноэндокринной регуляции, генетической предрасположенностью.
Проведенное нами обследование 60 детей в возрасте от 5 до 14 лет с ХЭБВИ показало, что в этой группе у 86,7% матерей имел место отягощенный акушерский анамнез; у 83,3% детей обнаружены перинатальная и постнатальная патология ЦНС, ЛОР-органов и др.
Нарушения иммунного статуса приводили к активации условно-патогенной микрофлоры, вирусных и грибковых инфекций. В микробном спектре слизистой ротоглотки пациентов с ХЭБВИ выделены S. Viridans (30%), Candida albicans (28,3%), Staph. Epidermidis (25%), S. Pyogenes (20%), Kl. Pneumoniae (8,4%), ассоциация бактерий (41,7%); у 28,3% — серологические маркеры активной формы хламидиоза, у 26,7% — микоплазмоза. У 90% пациентов заболевание протекало в форме микст-инфекции с участием герпес-вирусов: ВЭБ + ЦМВ, ВЭБ + ВПГ-1, ВПГ-2.
Классификация. Общепринятая классификация заболевания отсутствует; рекомендуем использовать разработанную нами рабочую классификацию ЭБВИ.
- По периоду возникновения: врожденная, приобретенная.
- По форме: типичная (инфекционный мононуклеоз), атипичная: стертая, бессимптомная, висцеральная.
- По тяжести: легкая, среднетяжелая, тяжелая.
- По течению: острая, затяжная, хроническая.
- По фазе: активная, неактивная.
- Осложнения: гепатит, разрыв селезенки, менингоэнцефалит, полирадикулонейропатия, миокардит, синусит, отит, гемолитическая анемия, тромбоцитопения, нейтропения, панкреатит и др.
- Микст-инфекция.
Примеры оформления диагноза:
- Осн.: Приобретенная ЭБВИ, типичная тяжелая форма (инфекционный мононуклеоз), острое течение, активная фаза. Осл.: Острый гепатит.
- Осн.: Приобретенная ЭБВИ, висцеральная форма (менингоэнцефалит, гепатит, нефрит), тяжелое хроническое течение, активная фаза. Осл.: острая печеночно-почечная недостаточность. Сопp.: Респираторный хламидиоз (ринофарингит, бронхит, пневмония).
Клиническая картина острой ЭБВИ впервые была описана Н. Ф. Филатовым (1885) и Е. Пфейфером (1889). Инкубационный период длится от 4-х дней до 7 нед. Полный симптомокомплекс формируется к 4–10-му дням болезни [4, 7].
Нами обследованы 109 детей с ОЭБВИ. У большинства пациентов заболевание начинается остро, с повышения температуры тела и появления симптомов интоксикации; реже отмечается постепенное начало: несколько дней наблюдается недомогание, слабость, вялость, снижение аппетита. Температура тела субфебрильная или нормальная. Ко 2–4-му дням болезни температура достигает 39–40 °С; лихорадка и симптомы интоксикации могут сохраняться в течение 2–3 и более недель.
Тонзиллит — наиболее частый и ранний симптом ОЭБВИ, сопровождается увеличением миндалин до II-III степени. Лакунарный рисунок подчеркнут за счет инфильтрации ткани миндалин или сглажен из-за лимфостаза. На миндалинах — налеты желтовато-белого или грязно-серого цвета в виде островков, полосок. Они исходят из лакун, имеют шероховатую поверхность (напоминают кружево), легко снимаются без кровоточивости, растираются, не тонут в воде. Характерно несоответствие размера налета и степени увеличения регионарных ЛУ. При фибринозно-некротическом характере налетов в случае их распространения за пределы миндалин необходим дифференциальный диагноз с дифтерией. Налеты на миндалинах исчезают, как правило, через 5–10 дней.
Гепатомегалия может быть обнаружена с первых дней болезни, однако чаще выявляется на второй неделе. Нормализация размеров печени происходит в течение полугода. У 15–20% больных в качестве осложнения развивается гепатит.
Спленомегалия относится к поздним симптомам, встречается у большинства больных. Нормализация размеров селезенки происходит в течение 1–3 нед.
Экзантема при ОЭБВИ появляется на 3–14-й дни болезни, имеет полиморфный характер — пятнистая, папулезная, пятнисто-папулезная, розеолезная, мелкоточечная, геморрагическая. Определенной локализации нет. Сыпь наблюдается в течение 4–10 дней, иногда оставляет пигментацию. У детей, получавших ампициллин или амоксициллин, сыпь появляется чаще (90–100%).
Гематологические изменения включают лейкоцитоз (10–30 х 10 9 /л), нейтропению с палочкоядерным сдвигом влево, увеличение количества лимфоцитов, моноцитов, атипичных мононуклеаров до 50–80%, повышение СОЭ до 20–30 мм/час. Характерный гематологический признак — атипичные мононуклеары в количестве 10–50%: они появляются к концу первой недели заболевания, сохраняются в течение 1–3 нед.
Хроническая ЭБВИ является исходом ОЭБВИ или развивается как первично-хроническая форма [2, 5, 8, 10, 11, 15]. Нами обследовано 60 детей с ХЭБВИ, клиника которой включала хронический мононуклеозоподобный синдром и полиорганную патологию. У всех пациентов обнаружены лимфопролиферативный синдром (генерализованная лимфаденопатия, гипертрофия небных и глоточной миндалин, увеличение печени и селезенки) и признаки хронической интоксикации (длительный субфебрилитет, слабость, снижение аппетита и др.). Вследствие развития ИДС наблюдались острые инфекции респираторного тракта и ЛОР-органов с обострениями до 6–11 раз в год: ринофарингиты (28,3%), фаринготонзиллиты (91,7%), аденоидиты (56,7%), отиты (11,7%), синуситы (20%), ларинготрахеиты (18,3%), бронхиты (38,3%), пневмонии (25%). Обращала внимание высокая частота полиорганной патологии, обусловленная длительной репликацией ВЭБ, вторичным ИДС, аутоиммунными реакциями (патология ЦНС; хронический гастрит, дискинезия желчевыводящих путей; кардиальный синдром, артралгии).
В последние годы описана врожденная ЭБВИ. Установлено, что риск ее при первичной ЭБВИ во время беременности составляет 67%, при реактивации — 22%. Клиника врожденной ЭБВИ сходна с ЦМВИ.
Установлена роль ВЭБ в развитии онкологических заболеваний и паранеопластических процессов — лимфомы Беркетта, назофарингеальной карциномы, лимфогранулематоза, опухолей желудка, кишечника, слюнных желез, матки, лейкоплакии языка и слизистой ротовой полости, а также ряда аутоиммунных заболеваний — системной красной волчанки, ревматоидного артрита, синдрома Шегрена, лимфоидного интерстициального пневмонита, хронического гепатита, увеита и др. [3, 5, 14, 15]. ВЭБ, наряду с вирусами герпеса человека 6 и 7 типов, является этиологическим фактором синдрома хронической усталости и наиболее частой причиной (15%) развития длительной лихорадки неясного генеза.
Диагностика ЭБВИ основана на учете групп риска, ведущих клинических синдромов и данных лабораторного исследования [8–11]. К группам риска у матери относят отягощенный анамнез, маркеры герпес-вирусных инфекций и др., у ребенка — перинатальное поражение ЦНС, аллергический фенотип, ИДС, маркеры герпес-вирусных инфекций и др. Ведущими клиническими синдромами ЭБВИ являются мононуклеозоподобный, общеинфекционный синдромы, экзантема, синдром полиорганной патологии.
В обязательный стандарт диагностики ЭБВИ входят клинический анализ крови, общий анализ мочи, биохимическое исследование крови, бактериологическое исследование слизи ротоглотки и носа, серологические маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм, УЗИ органов брюшной полости, консультация ЛОР-врача, по показаниям — рентгенография придаточных пазух носа, органов грудной клетки, ЭКГ. Дополнительный стандарт диагностики (в специализированном лечебно-профилактическом учреждении): маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм методом полимеразной цепной реакции (ПЦР), иммунограмма второго уровня, консультация иммунолога, по показаниям — коагулограмма, морфологическая картина стернальной пункции, консультация гематолога, онколога.
Методом иммуноферментного анализа (ИФА) определяют Ат к антигенам ВЭБ, что позволяет осуществить лабораторную диагностику ЭБВИ и определить период инфекционного процесса.
Ат класса IgM к VCA появляются одновременно с клиникой ОЭБВИ, сохраняются в течение 2–3 мес, повторно синтезируются при реактивации ВЭБ. Длительная персистенция высоких титров этих Ат характерна для ХЭБВИ, ВЭБ-индуцированных опухолей, аутоиммунных заболеваний, ИДС.
Ат класса IgG к EA достигают высокого титра на 3–4-й нед ОЭБВИ, исчезают через 2–6 мес. Они появляются при реактивации, отсутствуют при атипичной форме ЭБВИ. Высокие титры Ат данного класса выявляют при ХЭБВИ, ВЭБ-индуцированных онкологических и аутоиммунных заболеваниях, ИДС.
Ат класса IgG к EBNA появляются через 1–6 мес после первичной инфекции. Затем их титр уменьшается и сохраняется в течение всей жизни. При реактивации ЭБВИ происходит повторное увеличение их титра.
Большое значение имеет исследование авидности Ат класса IgG (прочности связывания антигена с Ат). При первичной инфекции сначала синтезируются Ат с низкой авидностью (индекс авидности (ИА) менее 30%). Для поздней стадии первичной инфекции характерны Ат со средней авидностью (ИА — 30–49%). Высокоавидные Ат (ИА — более 50%) образуются через 1–7 мес после инфицирования ВЭБ.
Серологическими маркерами активной фазы ЭБВИ являются Ат IgM к VCA и Ат IgG к EA, низкая и средняя авидность Ат IgG к маркерам неактивной фазы, Ат IgG к EBNA.
Материалом для ПЦР служат кровь, ликвор, слюна, мазки со слизистой ротоглотки, биоптаты органов и др. Чувствительность ПЦР при ЭБВИ (70–75%) ниже, чем при других герпесвирусных инфекциях (95–100%). Это связано с появлением ВЭБ в биологических жидкостях лишь при иммуноопосредованном лизисе инфицированных В-лимфоцитов.
На основании опыта лечения 169 детей с ЭБВИ нами разработан стандарт лечения этого заболевания.
Базисная терапия: охранительный режим; лечебное питание; противовирусные препараты: вироцидные препараты — инозин пранобекс (Изопринозин), аномальные нуклеозиды (Валтрекс, Ацикловир), Арбидол; препараты ИФН — рекомбинантный ИФН α-2β (Виферон), Кипферон, Реаферон-ЕС-Липинт, интерфероны для в/м введения (Реаферон-EC, Реальдирон, Интрон А, Роферон А и др.); индукторы ИФН — Амиксин, сверхмалые дозы антител к γ-ИФН (Анаферон), Циклоферон, Неовир. По показаниям: локальные антибактериальные препараты (Биопарокс, Лизобакт, Стопангин и др.); системные антибактериальные препараты (цефалоспорины, макролиды, карбапенемы); иммуноглобулины для внутривенного введения (Иммуновенин, Габриглобин, Интраглобин, Пентаглобин и др.); витаминно-минеральные комплексы — Мульти-табс, Вибовит, Санасол, Киндер Биовиталь гель и др.
Интенсификация базисной терапии по показаниям:
Симптоматическая терапия.
При лихорадке — жаропонижающие препараты (парацетамол, ибупрофен и др.); при затруднении носового дыхания — назальные препараты (Изофра, Полидекса, Називин, Виброцил, Адрианол и др.); при сухом кашле — противокашлевые препараты (Глаувент, Либексин), при влажном кашле — отхаркивающие и муколитические препараты (АмброГЕКСАЛ, бромгексин, ацетилцистеин и др.).
Эффективность этиотропной терапии ОЭБВИ оценена в двух группах больных. Пациенты 1-й группы (52 человека) получали инозин пранобекс (Изопринозин) в сочетании с рекомбинантным ИФН α-2β (Вифероном), больные 2-й группы (57 детей) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Клинико-серологические показатели до начала лечения и через 3 мес терапии представлены в табл. 1. У пациентов обеих групп в динамике отмечалось достоверное уменьшение таких симптомов, как генерализованная лимфаденопатия, тонзиллит, аденоидит, гепатомегалия и спленомегалия. Вместе с тем на фоне комбинированной терапии, положительная динамика клинических показателей была более значительной; острые респираторные инфекции (ОРИ) лишь у 19,2% больных 1-й группы и у 40,3% больных 2-й группы (p < 0,05). На фоне комбинированной терапии наблюдалось более быстрое исчезновение серологических маркеров репликации.
Эффективность этиотропной терапии исследована у 60 больных ХЭБВИ. Пациенты 1-й группы (30 детей) получали инозина пранобекс (Изопринозин) и рекомбинантный ИФН α-2β (Виферон), 2-я группа (30 человек) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Независимо от схемы лечения через 3 мес после начала терапии отмечалось достоверное уменьшение частоты генерализованной лимфаденопатии, гипертрофии небных и глоточной миндалин, спленомегалии, интоксикационного, инфекционного и вегето-висцерального синдромов (табл. 2). Комбинация инозина пранобекса (Изопринозина) с рекомбинантным ИФН α-2β (Вифероном) способствовало более существенной динамике клинических показателей. Количество эпизодов ОРИ снизилось с 6–11 (7,9 ± 1,1) до 4–6 (5,2 ± 1,2) в год на фоне монотерапии рекомбинантным ИФН α-2β (Вифероном), и до 2–4 (2,5 ± 1,4) в год на фоне комбинированной терапии (p < 0,05). В обеих группах уменьшалась частота репликации ВЭБ, однако при сочетанном применении противовирусных препаратов этот эффект был более выраженным.
Побочных эффектов при использовании инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона) не было.
Результаты проведенного исследования свидетельствуют о потенцировании эффектов при комбинации инозина пранобекса (Изопринозина) с рекомбинантным ИФН a-2b (Вифероном) у больных ЭБВИ.
Потенцирование противовирусных, иммуномодулирующих и цитопротекторных эффектов этих препаратов приводит к более существенной, чем при монотерапии, положительной динамике проявлений клинических симптомов ЭБВИ, к исчезновению серологических маркеров активности инфекционного процесса. Следует отметить высокую эффективность и безопасность комбинированной терапии с использованием инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона).
Реабилитация. Ребенок наблюдается участковым врачом и инфекционистом, снимается с учета через 6–12 мес после исчезновения клинико-лабораторных показателей активности инфекционного процесса. Кратность осмотров — 1 раз в месяц. По показаниям рекомендуют консультацию ЛОР-врача, иммунолога, гематолога, онколога и др. Лабораторные и инструментальные исследования пациентов включают: клинический анализ крови 1 раз в месяц в течение 3 мес, затем 1 раз в 3 месяца, по показаниям — чаще; серологические маркеры ВЭБ методом ИФА один раз в три месяца, по показаниям — чаще; ПЦР крови, мазков из ротоглотки 1 раз в 3 месяца, по показаниям — чаще; иммунограмма — 1 раз в 3–6 мес; биохимическое и инструментальное исследования — по показаниям.
Реабилитационная терапия включает: охранительный режим, лечебное питание, противовирусные препараты по пролонгированным схемам. Под контролем иммунограммы осуществляют иммунокоррекцию. По показаниям назначают локальные антибактериальные препараты, курсы витаминно-минеральных комплексов, про- и пребиотиков, препаратов метаболической реабилитации, энтеросорбентов, антигистаминные препараты, гепато-, нейро- и ангиопротекторы, кардиотропные препараты, ферменты, гомеопатические средства, немедикаментозные методы лечения.
Таким образом, ЭБВИ характеризуется широким распространением, длительным течением с периодической реактивацией инфекционного процесса у части пациентов, возможностью развития осложнений и неблагоприятных исходов (онкозаболеваний, аутоиммунной патологии). Важную роль при ЭБВИ играет формирование вторичного ИДС. Ведущими клиническими синдромами ЭБВИ являются острый и хронический мононуклеозоподобный синдромы, интоксикационный, инфекционный, церебральный, гастроинтестинальный, кардиальный и артралгический синдромы. Диагностика ЭБВИ основана на анализе групп риска, выделении ведущих клинических синдромов и лабораторном исследовании. Лечение ЭБВИ является комплексным и включает этиотропные средства (виростатические препараты, интерферон и его индукторы), препараты патогенетической, иммуномодулирующей, симптоматической терапии. Сочетанное пролонгированное использование инозина пранобекс (Изопринозина) и рекомбинантного ИФН α-2β (Виферона), потенцирующих свои иммунокорригирующие и цитопротекторные эффекты, существенно повышает эффективность лечения. Больные ЭБВИ нуждаются в длительной реабилитации с обязательным контролем клинико-лабораторных показателей активности инфекционного процесса.
По вопросам литературы обращайтесь в редакцию.
Э. Н. Симованьян, доктор медицинских наук, профессор
В. Б. Денисенко, кандидат медицинских наук
Л. Ф. Бовтало, кандидат медицинских наук
А. В. Григорян
Ростовский ГМУ, Ростов-на-Дону
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
Владимир Кириллович Таточенко, доктор медицинских наук, профессор:
- Простой вопрос: что такое рациональное использование антибиотика (АБ). Это использование антибиотика только тогда, когда есть бактериальная инфекция. Выбор только такого АБ, к которому чувствителен предполагаемый возбудитель. Применение дозировок АБ, которые способны обеспечить концентрации, подавляющие возбудителя в очаге воспаления. Отказ от профилактического применения АБ, за очень небольшим исключением. Есть несколько позиций, при которых это рекомендуется.
АБ применяют чаще всего, когда у ребенка есть лихорадка. Надо всегда помнить, что лихорадка – защитная, мобилизующая иммунитет реакция. Особо переживать по поводу лихорадки не нужно. Это не гипертермия, не перегрев. Ничего плохого обычно не бывает.
Сейчас сложилась такая ситуация, что мы не имеем дифтерии, кори. Сейчас появилось десятка два случаев. Раньше миллион случаев было в год. Коклюш, туберкулез, паротит, полиомиелит – все это более-менее в прошлом, а лихорадящие дети остались.
У педиатра есть две сложные проблемы:
2. Обеспечить лихорадящих детей с вирусными инфекциями, для которых нет этиотропных средств, обоснованной патогенетической и симптоматической терапией, избегая полипрагмазии.
Несмотря на то, что есть приказ министра о том, что больше пяти средств одновременно нельзя применять, регулярно дети с насморком получают бесконечное количество снадобий. Большая часть из них, кроме рекламы, никаких серьезных поддерживающих материалов не имеет.
Выловить бактериальных и оставить в покое детей с насморком, с кашлем, с бронхитом, который сам проходит – очень сложная задача.
Создавшаяся ситуация очень неблагоприятная. Я сошлюсь на только опубликованные данные. Во Владивостоке 86% детей с ОРЗ и бронхитом получают макролиды. В нашей клинике вы увидите, что получают 1-3%.
Выбор АБ происходит эмпирическим путем с учетом вероятной этиологии, чувствительности предполагаемого возбудителя. Хотя хорошо известно, что если бронхит и вызывает бактерии, то крайне-крайне редко. Бронхит – вирусное заболевание.
В Америке оценка качества лечебной работы включает процент больных с бронхитом, леченных АБ. Чем выше этот процент, тем хуже качество.
Наши данные о том, как часто мы используем АБ. При ОРВИ, при крупе, при бронхитах используются очень редко. Неоправданно. Иногда бывает отит у ребенка (с крупом обычно). Обычно несколько процентов получают. Либо родители отказываются отменить АБ.
Это нам дает резкое сокращение длительности пребывания в стационаре. Красным показаны данные, которые мы взяли из городской больницы. Зеленым наши данные. Обычно это 2-3, максимум 4 дня у детей с бронхиолитом. Мы дожидаемся, когда они перестанут свистеть. АБ мы им не даем.
Это преамбула к моей лекции.
Если взять острые лихорадочные заболевания. Мы взяли 1800 детей, госпитализированных в последние годы. Их можно разделить на две неравные части. Это дети с лихорадкой и выраженными катаральными явлениями и дети с лихорадкой без катаральных явлений. Это хорошее деление, потому что катаральные явления видно издали.
Распределение с катаральными явлениями. 35% – поражения только верхних дыхательных путей. 30% – поражение нижних дыхательных путей. Желтым показаны формы, при которых не надо давать АБ.
Если взять без катаральных явлений, дети с поносом и рвотой…
У нас сейчас огромное количество ротавирусной и других вирусных диарей. Боковирус третьего типа тоже вызывает диареи, третьи после рота- и норовируса. Без видимого очага инфекций, относительно редкий контингент – здесь тоже есть вирусные инфекции, которые не дают в первые дни признаков катаральных явлений. Имеется бактериальная инфекция – бактериемия – инфекция мочевых путей, которая представляет большую сложность.
Если взять формы и посмотреть соотношение, то получается, что дети с лихорадкой и катаром – 67% случаев не нуждаются в АБ. Это по больнице. Если взять в поликлинике, которых не госпитализируют, соотношение будет еще более контрастное.
Если взять детей с лихорадкой и без катаральных явлений, то имеем обратное соотношение. 60% детей требуют антибактериальной терапии. Лихорадка без катара случается, но это только 40%.
Когда педиатр сталкивается с ребенком, он меньше всего интересуется уровнем. Меня интересуют другие признаки бактериального заболевания. Такие как нарушение общего состояния, токсичность ребенка, аппетит, пьет он или не пьет. Эти симптомы. Смотрит в глаза или не смотрит. Ребенок с тяжелым бактериальным заболеванием не смотрит в глаза врачу. Это хороший признак.
Да хоть 40,5. Ничего страшного. Дайте ему жаропонижающее. От этого большого вреда не будет. Только иммунитет укрепит.
Что у нас делается по бактериальным заболеваниям. На одной руке хватает пальцев, чтобы перечислить бактериальных возбудителей. Это пневмококки, H. influenza, стрептококк гемолитический (БГСА), Mycoplasma и Moraxella. Стафилококка золотистого больше при кожной инфекции. Chlamydophila бывает у пневмонии. Еще речь о E. сoli при почечных инфекциях.
Мы имеем дело с четырьмя основными возбудителями, которые вызывают практически весь спектр респираторных бактериальных заболеваний.
Если говорить об оральных антибиотиках первого выбора (у детей надо шире применять оральные препараты)…
Сегодня опубликована статья о том, что все почечные инфекции, включая пиелонефриты, прекрасно лечатся оральными препаратами и дают такой же процент рубцов на паренхиме, как и действие только внутривенных препаратов. Колоть лишний раз ребенка не нужно.
Маленьким детям (которым месяц, два, три) дать препарат внутрь бывает сложнее, чем ввести ему в вену. Сейчас ставим, он лежит спокойно.
При каких формах их применять. Отит, синусит, тонзиллит, типичная пневмония, инфекции мочевых путей.
Макролиды – незаменимые препараты при атипичных инфекциях (микоплазмозе и хламидиозе). Или как заменитель лактамов, если у ребенка имеется какая-то аллергия к ним.
Лечение острого отита или синусита. Здесь основная флора – это пневмококк или гемофильная палочка у леченных ранее детей, недавно получавших АБ. У них может быть моракселла. Гемолитический стрептококк.
Американцы, у которых чаще устойчивость к лактамам пневмококка, рекомендуют сейчас 100 мг и для лечения пневмонии. Хотя для пневмонии достаточно 50 мг, в легких он хорошо концентрируется, накапливается.
Лихорадка или боль в ухе. Привожу два примера. Ребенок первого года, болен два дня. Температура 38,5. Иногда вскрикивает. Мутная барабанная перепонка, виден экссудат, 15 тысяч лейкоцитов. Ясно, что здесь гнойный отит.
Повышение дозы до 100 мг. Парацентез пришлось сделать – привело к быстрому снижению температуры. Выбор, может быть, не столько выбор, сколько выбор дозировки препарата. Никакой сложности здесь нет.
85% детей после первой дозы поправляются. У них прекращается стеноз. Некоторые требуют две дозы. Очень редко три дозы.
С такой же клинической картиной, но без катаральных явлений, с ознобом, признаками токсичности, без изменения голоса (голос просто сдавленный, но не хриплый) – это эпиглоттит (воспаление надгортанника). У нас еще не проводится массовая вакцинация против гемофилиса В.
Здесь лечение должно быть обязательно внутривенным. Очень ранняя инкубация. Очень легко западает надгортанник. Инкубация на сутки, больше не нужно.
Пневмония. Иногда приходится слышать, что сейчас какие-то другие возбудители, и все они устойчивы. Ничего подобного. Пневмококк как был основным возбудителем, так и остался. Конечно, у детей первых месяцев жизни, чаще всего это аспирация пищи, муковисцидоз – такие причины пневмонии.
Примерно 10% заражаются от старших сипсов – это пневмококк или гемофилис. Иногда бывает хламидия трахоматис. От шести месяцев до пяти лет практически 85 – 90% – это пневмококк и гемофилис. Атипичная – микоплазма и хламидии – бывают в этом возрасте редко.
После пяти лет получается 50/50. Примерно половина – это типичная пневмококковая пневмония. Вторая половина – микоплазмы. Значительно реже хламидии.
Чем отличается атипичная пневмония от типичной. Симптомы. Микоплазменная пневмония протекает с обилием хрипов. При типичной пневмонии хрипов или нет или их очень мало. Это самая распространенная ошибка. Нет хрипов – нет пневмонии. Наоборот, когда я не слышу хрипы, мне кажется, что нужно посмотреть за этим ребенком.
Если я слышу много хрипов – это бронхит или атипичная пневмония. Микоплазменная пневмония протекает с красными коньюктивами.
Разница небольшая – 5%. Но если вы будете лечить 100 детей и в пяти случаях не попадете – это будет достаточно неприятно. В педиатрии допустимо одновременное назначение бета-лактама и макролида. Хотя у взрослых считается стандартной практикой начинать лечить (особенно пожилых) при не очень тяжелых пневмониях сразу давать оральный лактам и макролид. Мы рекомендуем, если доктор не уверен.
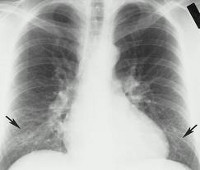
Разрешите проиллюстрировать примером то, что я сказал. Хламидийная пневмония. В чем ее отличие. При ней бывает очень высокий лейкоцитоз. У данного ребенка лейкоцитоз был 37 тысяч. Умеренная эозинофилия. Это очень необычная ситуация. Множественные мелкие очаги. Очень похоже на милиарный туберкулез. Милиарный туберкулез большинство терапевтов не видело. Сравнение некорректное.
Дозировка прописана, которая везде рекомендуется (45мг/кг). Какой-то иезуит сделал такую дозировку. Если ребенок весит 17 кг, перемножьте, сколько мы должны дать ему. Мне кажется, что здесь расщеплять волосы и быть точными не нужно. 50 мг.
Американцы честно помножили на два и дают 90 мг. 17 на 90 тоже не очень просто помножить. 50, 100 легко помножить. Конечно, доза привязывается к размеру таблетки, к размеру ложки. Но не нужна эта излишняя точность.
Та же история. Здесь нам удалось поймать иммуноглобулин М. Обычно иммуноглобулин М появляется к концу второй недели. Когда вы берете свежего ребенка и делаете ему иммуноглобулин М, он оказывается отрицательный. Вы считаете, что здесь нет микоплазмоза.
Еще один ребенок. На шестой день болезни IgM отрицательный. Хотя здесь не было совершенно никаких сомнений, что это пневмония микоплазма.
Теперь я хочу показать один случай. Если вы полезете в литературу, никто не описывает, как выглядит хламидийная пневмония. Мы тоже не очень верим в легковерность, что это хламидийная пневмония. Пришлось на компьютерной томограмме показывать. Очаги на рентгенограмме были не очень яркие, какие-то совершенно необычные и справа и слева.
Такое необычное начало с обструкцией описано как хламидийная пневмония. Нам удалось один раз такое поймать и доказать. Будем считать, что здесь ничего не напутали. Правда, у ребенка IgM 1133 ЕД/мл. Обструкция могла быть совершенно спокойно астматического порядка.
На томографии плеврит слева, не очень заметны изменения были на рентгенограмме. Несмотря на такое лечение, на 22-й день болезни были еще очень большие изменения. СОЭ очень высокое. С такими больными трудно.
Деструкция. Мы не боимся деструкции. При пневмококковой пневмонии это достаточно частое явления. Маленький ребенок с пневмонией верхушки нижней доли слева. Он поступил 29 сентября. 3 октября у него появились просветления.
Мы к этому тоже относимся очень спокойно. Недавно вышли американские рекомендации. Там немножко они все еще волнуются. На этом фоне развился участок буллезного деструктивного процесса. Все рассосалось без хирургии.
Маленький ребенок, казалось бы, с небольшой пневмонией. После начала лечения дает длительную лихорадку. Метапневмонический плеврит одновременно возникает на месте очага. Слева возникает полностью с уровнем жидкости. Но мы не рассматриваем как настоящие абсцессы. Продолжаем лечение.
На фоне температуры довольно быстро перешли на оральный препарат. АБ здесь для успокоения родителей. Скорее всего, для лечения.
Недавно у нас такой же случай. Пневмония с деструкцией. Падение температуры и образование метапневмонического, видимо, междолевого плеврита. Мы его не пунктировали. Мы знаем, что это все рассосется.
Очень характерно ускорение СОЭ на фоне метапневмонического плеврита. При поступлении СОЭ было 12, стало 61 при падении числа лейкоцитов. Опорожнилась полость, раздулась немножко. Ребенок выписался.
Атипичная пневмония – это инфекционно-воспалительные поражения легких, вызываемые нехарактерными (атипичными) возбудителями – хламидиями, микоплазмами, легионеллами, вирусами. Атипичные пневмонии протекают с явлениями общего недомогания, высокой лихорадкой, ознобами, потливостью, мышечной и головной болью, кашлем, одышкой. В тяжелых случаях может развиться легочно-сердечная недостаточность и наступить гибель пациента. Диагностика атипичной пневмонии требует учета данных эпиданамнеза, идентификации возбудителя (методами ИФА, РИФ, ПЦР, культурального посева и др.), проведения рентгенографии легких. С учетом этиологии лечение атипичной пневмонии проводится противомикробными (макролидами, фторхинолонами, тертрациклинами) и противовирусными химиопрепаратами. Основная трудность терапии заключается в том, что против некоторых вирусных возбудителей атипичной пневмонии до настоящего времени не найдено действенных препаратов.
МКБ-10
Общие сведения

Причины
На сегодняшний день к так называемым атипичным микроорганизмам - возбудителям атипичной пневмонии относится многочисленная группа инфекционных агентов. Атипичные пневмонии могут вызываться микоплазменной (Mycoplasma pneumoniae) и хламидийной (Chlamydophila pneumoniae) инфекцией, легионеллой (Legionella spp.), коксиеллой (Coxiella burnetti), вирусами (респираторными вирусами парагриппа 1, 2 и 3; гриппа А и В; вирусом EpsteinBarr, респираторным синцитиальным вирусом), возбудителями лептоспироза (Leptospira spp.), туляремии (Francisella tularensis), хантавирусами, коронавирусом ТОРС (SARS-CoV) и др. Несмотря на значительные различия эпидемиологической и микробиологической характеристики возбудителей, а также патоморфологической картины инфекционного процесса, данные микроорганизмы объединены устойчивостью к антибиотикам пенициллинового ряда и другим β-лактамам, а также общими подходами к лабораторной верификации.
Заражение атипичной пневмонией происходит обычно при тесном контакте в коллективах; путь передачи - воздушно-капельный. Восприимчивость к SARS высокая вне зависимости от возраста: среди болеющих атипичной пневмонией преобладают люди моложе 40 лет, обладающие крепким здоровьем. Инкубационный период при атипичной пневмонии длится от 3-х до 10 дней. В зависимости от возбудителя выделяют следующие основные формы атипичной пневмонии: микоплазменную пневмонию, лихорадку Q, легионеллезную пневмонию, хламидийную пневмонию, тяжелый острый респираторный синдром и др.
Атипичная микоплазменная пневмония
Симптомы
Атипичная микоплазменная пневмония составляет около 10-20% случаев от всех воспалений легких у детей и подростков и 2-3% случаев – у взрослых. В детских коллективах возможны очаговые эпидемические вспышки микоплазменной пневмонии. Клинически респираторный микоплазмоз может протекать в виде назофарингита, трахеита, бронхита, атипичной пневмонии.
Течение микоплазменной пневмонии, как правило, легкое или среднетяжелое. После инкубационного периода (3-11 дней) наступает непродолжительный продромальный период (1-2 суток), в течение которого беспокоит сухость слизистых верхних дыхательных путей, першение в горле, сухой кашель, головная боль и незначительное недомогание. Клиника собственно атипичной микоплазменной пневмонии характеризуется субфебрильной температурой, не поднимающейся выше 38°С; приступообразным непродуктивным кашлем, который беспокоит около 2-3 недель. В 20-30% случаев микоплазменное воспаление легких является двусторонним.
В тяжелых случаях атипичная микоплазменная пневмония протекает с высокой лихорадкой, выраженной интоксикацией, артралгией, миалгией, носовыми кровотечениями, полиморфной сыпью на коже, шейным лимфаденитом, альбуминурией и микрогематурией, гепатоспленомегалией, дистрофическими изменениями миокарда. Однако обычно, по сравнению с бактериальным воспалением, микоплазменная пневмония имеет более вялое и стертое течение. Осложнениями микоплазменной пневмонии могут являться деформирующий бронхит, бронхиолит, бронхоэктазы, пневмосклероз.
Диагностика
Лечение
Своевременная и адекватная этиотропная терапия способствует быстрому регрессу клинических проявлений атипичной микоплазменной пневмонии. Между тем, рентгенологические изменения могут сохраняться длительно, до 4-6 недель. В терапии атипичной пневмонии, вызываемой микоплазмой, используются макролиды (азитромицин, эритромицин), линкозамины (клиндамицин) основным курсом не менее 7 дней и дополнительным - 2 дня после стихания симптомов. Одновременно проводится симптоматическая (жаропонижающая, муколитическая, бронхолитическая) терапия, при бронхиолите назначаются глюкокортикостероиды.
Атипичная хламидийная пневмония
Симптомы
Микроорганизмы из рода Chlamydophila (С.trachomatis, С.pneumoniae) обладают тропностью к эпителиальным клеткам мочеполовой системы, конъюнктивы, бронхов, легких, вызывая у человека урогенитальный хламидиоз, хламидийный конъюнктивит, острый бронхит, пневмохламидиоз. На долю хламидийных пневмоний приходится не менее 10% случаев всех воспалений легких. Заболеваемости атипичной хламидийной пневмонией наиболее часто подвержены дети и подростки, а также люди пожилого и старческого возраста. Chlamydophila pneumoniae иногда длительно существует в организме, не вызывая инфекционных проявлений.
Диагностика
Физикальные изменения при атипичной хламидийной пневмонии сохраняются 7-10 дней, а рентгенологические – до 12-30 суток. Стетоакустическое обследование выявляет в легких сухие и влажные хрипы. Рентгенологические изменения характеризуются мелкоочаговой и/или интерстициальной инфильтрацией чаще с двух сторон. Присутствие в организме хламидии определяется с помощью культурального, микроскопического, ИФА, ПЦР исследования биологических сред. Наибольшее диагностическое значение при атипичной хламидийной пневмонии имеет определение IgA, IgG, IgM к антигенам белков внешней мембраны.
Лечение
Препаратами этиотропного действия при атипичной хламидийной пневмонии служат тетрациклины и макролиды. Курс терапии должен продолжаться не менее 10-14 дней, поскольку короткие циклы могут способствовать хронизации и рецидивированию пневмохламидиоза. В некоторых случаях прибегают к назначению фторхинолонов (спарфлоксацина, офлоксацина и др.), доксициклина.
Атипичная легионеллезная пневмония
Симптомы
Атипичная легионеллезная пневмония встречается преимущественно среди лиц среднего и пожилого возраста. К ее возникновению предрасполагает курение, иммуносупрессия, хроническая почечная недостаточность. Инфекция чаще развивается в летние месяцы и регистрируется в виде спорадических случаев или массовых вспышек. Данная форма атипичной пневмонии протекает по типу долевой пневмонии, с вовлечением в патологический процесс терминальных бронхиол и альвеол, массивной экссудацией и выраженным отеком интерстициальной ткани в зоне поражения.
Атипичная легионеллезная пневмония имеет тяжелое клиническое течение. Симптоматика характеризуется подъемом температуры в течение 24-48 ч до 40°С и выше, сильнейшими ознобами и головной болью. Одновременно присоединяется кашель: вначале сухой, затем – с отделением слизистой или слизисто-гнойной мокроты. В 20% случаев отмечается кровохарканье. Общая картина отягощается одышкой, мышечными и плевральными болями, тошнотой, рвотой, диареей, тахикардией, абдоминальными болями. Наиболее грозными осложнениями атипичной легионеллезной пневмонии служат дыхательная недостаточность и вторичная почечная недостаточность, приводящие к гибели больных.
Диагностика
При диагностике атипичной легионеллезной пневмонии учитываются эпидемиологические данные, тяжелое клиническое течение пневмонии, результаты инструментальных и лабораторных исследований. При аускультации в легких выслушиваются влажные хрипы. С помощью рентгенографии (КТ, МРТ легких) определяются округлые инфильтраты, занимающие не менее одной доли легкого и имеющие тенденцию к слиянию. У трети пациентов выявляется плеврит с небольшим количеством плеврального выпота.
Как правило, посев крови и мокроты на наличие легионелл дает отрицательный результат. Диагноз атипичной легионеллезной пневмонии удается подтвердить путем посева на специальные среды трахеального аспирата, лаважной жидкости, плеврального выпота. С целью получения необходимого биологического материала проводится трахеальная аспирация, бронхоскопия с забором мокроты, бронхоальвеолярный лаваж, плевральная пункция. Также используется РИФ, ИФА диагностика.
Лечение
Прогрессирующее ухудшение состояния при атипичной пневмонии, вызываемой легионеллой, часто диктует необходимость перевода пациента на ИВЛ. Клиническое улучшение, как правило, появляется на 4-5 сутки после начала интенсивного применения антибиотиков (эритромицина, рифампицина, доксициклина, ципрофлоксацина). Лихорадка при атипичной легионеллезной пневмонии в среднем продолжается около 2-х недель; разрешение инфильтратов в легочной ткани занимает до 1 мес. В некоторых случаях после атипичной пневмонии остаются участки ограниченного пневмосклероза в легких. Реконвалесценция протекает медленно, длительно сохраняется слабость и утомляемость.
Атипичная пневмония (тяжелый острый респираторный синдром)
Симптомы
Атипичная пневмония – малоизвестная форма острой респираторной инфекции, поражающей нижние дыхательные пути. Известно, что возбудителями атипичной пневмонии является ТОРС (SARS)-коронавирус, входящий в семейство Сoronaviridae. В настоящее время продолжается эпидемиологическое, лабораторное и клиническое изучение ТОРС-коронавируса. Большинство заболевших атипичной пневмонией в 2002-2003 г.г. составили лица 25-70 лет; отмечены единичные случаи заболеваемости детей до 15 лет. Основной механизм передачи коронавируса - воздушно-капельный, однако выявление возбудителя в моче и фекалиях не исключает возможности фекально-орального заражения.
Инкубационный период при атипичной пневмонии составляет 2-7, в отдельных случаях - 10 дней. Вначале симптомы атипичной пневмонии малоспецифичные: заболевание манифестирует с высокой лихорадки (выше 38°С), которая сопровождается ознобами, потливостью, головными болями, миалгией. В ряде случаев на высоте лихорадочного состояния отмечается рвота и диарея.
На 3-7 сутки атипичной пневмонии развивается сухой кашель, одышка, прогрессирующая гипоксемия. Нарастающая гипоксия сопровождается цианозом носогубного треугольника, тахикардией, глухостью сердечных тонов, гипотонией. В последующие 6-7 суток у части пациентов наблюдается улучшение самочувствие и стихание симптоматики; в других случаях - развивается респираторный дистресс-синдром, требующий перехода к ИВЛ. В последней группе пациентов отмечается высокая летальность от токсико-инфекционного шока, острой дыхательной и сердечной недостаточности, сопутствующих осложнений.
Диагностика
Отсутствие достоверных диагностических тест-систем тяжелого острого респираторного синдрома и сложность дифференциальной диагностики заболевания в начальном периоде, диктует необходимость предполагать атипичную пневмонию у пациентов, посещавших в течение 10 дней эпидемически неблагополучные районы, а также лиц, страдающих лихорадочным состоянием с симптомами респираторного поражения.
Аускультативно при атипичной пневмонии определяется ослабление дыхания, крепитация, влажные мелкопузырчатые хрипы. При перкуссии выявляется притупление легочного звука. Рентгенологически в разгар атипичной пневмонии обнаруживаются двусторонние внутритканевые инфильтраты на периферии легочных полей. В лабораторных тестах крови выявляется лимфопения, тромбоцитопения, повышение уровня печеночных ферментов, изменение газового состава крови (снижение насыщения крови О2). Для идентификации возбудителя атипичной пневмонии используются ИФА, РИФ, молекулярные тесты.
Лечение
Поскольку атипичная пневмония является новым и малоизученным заболеванием, эффективной этиологической терапии пока не разработано. Согласно рекомендациям ВОЗ, при атипичной пневмонии необходимо включение в схему лечения нескольких противомикробных препаратов (фторхинолонов, ß-лактамов, цефалоспоринов, тетрациклинов). Данные меры позволяют предупредить наслоение бактериальной инфекции.
Прогноз и профилактикаи
Прогноз атипичной пневмонии зависит от формы заболевания: при микоплазменной и хламидийной пневмонии он, как правило, благоприятный для жизни; при легионеллезной и особенно ТОРС-инфекции – очень серьезный. С целью профилактики заражения и распространения атипичной пневмонии ВОЗ рекомендует воздерживаться от посещения эпидемически неблагоприятных регионов; установить строгий эпидконтроль лиц, прибывающих из данных районов; проводить дезинфекцию транспортных средств; использовать индивидуальные маски однократного применения при необходимости контакта с пациентами, подозрительными в отношении инфекции. В настоящее время работа по созданию эффективной вакцины и специфических тестов ранней диагностики атипичных пневмоний продолжается.
2. Современные подходы к диагностике атипичных пневмоний/ Тартаковский И.С.// Клиническая микробиология и антимикробная химиотерапия – 2000 - Том 2, № 1.
3. Атипичная пневмония - значимая проблема детского возраста/ Горбич О. А.// Медицинский журнал. - 2016. - № 3.
Какие назначения необходимы при подозрении на инфекцию нижних дыхательных путей? Какие патогенные факторы играют существенную роль? Как вести больных? Респираторные заболевания являются частой причиной обращения к врачу в Великобритании,
Какие назначения необходимы при подозрении на инфекцию нижних дыхательных путей?
Какие патогенные факторы играют существенную роль?
Как вести больных?
 |
Респираторные заболевания являются частой причиной обращения к врачу в Великобритании, причем в большинстве случаев они относятся к инфекционным [1]. Трем четвертям пациентов, обращающихся с признаками острого заболевания нижних дыхательных путей, врач общей практики назначает антибиотики, хотя лишь в немногих случаях удается выделить возбудителя и антибиотики или вообще не влияют, или мало влияют на естественный ход заболевания [2,3].
Назначая антибиотики, врач руководствуется ожиданиями пациента и старается действовать согласно определенной терапевтической стратегии, хотя зачастую, выписывая рецепт, чувствует, что при этом состоянии антибиотики будут неэффективны [4,5].
Причины, по которым пациент первый раз приходит на прием к своему врачу и затем повторно обращается за консультацией, довольно сложны и часто никак не соотносятся с течением болезни. Как правило, они обусловлены обеспокоенностью своим здоровьем или давлением со стороны друзей, семьи и сотрудников.
При необходимости назначить антибиотик для лечения инфекции нижних дыхательных путей обычно выбирают амоксициллин. Пациенты, повторно обращающиеся к врачу, скорее всего, получат другой антибиотик, например эритромицин или новейшее средство из группы макролидов, хинолонов или пероральный цефалоспорин [3,6].
Проведенные нами недавно исследования показали, что повторное обращение пациентов с инфекциями нижних дыхательных путей, уже получивших назначения на первичном приеме, никак не связано с антибиотикотерапией. Только у 4% таких больных сохранялась бактериальная инфекция и ни у одного из них не было устойчивости к амоксициллину [7]. Повторно приходить на прием побуждают пациентов немедицинские факторы, такие как привычка обращаться к врачу.
Таблица 1. Почему пациенты повторно обращаются к врачу при острой инфекции нижних дыхательных путей
- Пациент неверно представляет себе естественное течение болезни
- Пациент продолжает беспокоиться по поводу симптомов болезни
- Пациенту нравится ходить на прием к врачу
- По настоянию членов семьи, друзей, сотрудников
- У пациента появились соображения, касающиеся важности симптомов
- Инфекция хронизируется или к ней присоединяется другая инфекция
- Проявляется серьезное основное заболевание
При повторном обращении по поводу респираторного заболевания врач общей практики прежде всего должен попытаться установить причину такого обращения (табл. 1). Вполне возможно, что оно вызвано необоснованными ожиданиями пациента, и наилучшим средством здесь было бы объяснение нормальных сроков выздоровления от простуды. Или же есть какое-то основное заболевание, не распознанное на первичной консультации, например астма, недолеченное хроническое обструктивное легочное заболевание, рак или бронхоэктазы.
В том случае если врач считает, что причина в продолжающейся инфекции, необходимо определить возможного возбудителя и выбрать соответствующий антибиотик (табл. 2). Ниже мы обсудим некоторые сложные случаи, которые необходимо иметь в виду [8,9]. Однако нужно помнить, что наиболее распространенными возбудителями остаются Streptоcoccus pneumoniae и респираторные вирусы, а сложные случаи составляют скорее исключение, чем правило в ежедневной общей практике.
Пенициллин-резистентный Streptococcus pneumoniae. Хотя число случаев развития лекарственной устойчивости неуклонно возрастает и представляет серьезную проблему для целого ряда европейских стран, в Англии антибиотикорезистентность пока не считается причиной неудачного лечения инфекций дыхательных путей. Нужно убеждать врачей общей практики проводить пневмококковую вакцинацию населения, входящего в группу риска, а антибиотики назначать строго по показаниям и в адекватной дозе.
Амоксициллин-резистентный Haemophilus influenzae. Haemophilus influenza (Hi) является частой бактериальной причиной обострения хронических обструктивых заболеваний легких (ХОЗЛ), а также вызывает персистирующий бронхит у здоровых взрослых людей. Некоторые антибиотики, такие как эритромицин и цефалоспорины первого поколения, недостаточно эффективны в отношении Hi. Наличие b-лактамазы объясняет отсутствие реакции на амоксициллин. Такие штаммы называются амоксициллин-резистентными Hi (АRHi).
Таблица 2. Возможная причина отсутствия цикла терапии острой инфекции нижних отделов дыхательных путей, назначенной на первом приеме*
Заболеваемость, обусловленная АRHi, растет и составляет сегодня в Великобритании 10-25% общего числа респираторных заболеваний в зависимости от региона. В других странах, таких как Испания, Португалия и некоторые районы Франции, уровень лекарственной устойчивости гораздо выше — это нужно иметь в виду в тех случаях, когда пациент мог заразиться зарубежом.
Об этом возбудителе следует помнить, если у пациента с ХОЗЛ после лечения часто повторяющимися курсами амоксициллина сохраняются симптомы заболевания и гнойная мокрота. В данном случае целесообразным будет недельный курс хинолона или коамоксиклава. От назначения ципрофлоксацина следует воздержаться, если пациент принимает теофиллин.
Moraxella catarrhalis. Некоторым название этого микроорганизма может показаться незнакомым, поскольку раньше его относили к роду Neisseria вида Branhamella.
Это грамотрицательный диплококк, входящий в нормальную микрофлору молодых и пожилых людей. Вслед за Haemophilus influenza и Streptococcus pneumoniae он является третьей по распространенности причиной обострения ХОЗЛ и часто поражает пациентов с тяжелыми хроническими легочными заболеваниями или раком легких.
Обнаружение этого микроорганизма служит показателем тяжести процесса. Сообщалось о недавнем наблюдении 42 случаев пневмонии, вызванной M. catarrhalis, когда около половины пациентов погибло от основного заболевания в течение трех месяцев после обнаружения инфекции.
Важно и то обстоятельство, что практически все штаммы сегодня являются b-лактамазопродуцирующими и соответственно амоксициллинорезистентными. Имеется предположение, что b-лактамаза, продуцируемая M. Catarrhalis, обеспечивает устойчивость к амоксициллину в норме чувствительных респираторных возбудителей, таких как S. pneumoniae и H. influenzae. Проводимая терапия не отличается от той, которая применяется в случаях АРHi (см. выше).
Pseudomonas aeruginosa. Об этом возбудителе нужно помнить в связи с возможностью развития бронхоэктазов и кистозной болезни. Стоит один раз заразиться Pseudomonas aeruginosa, и рецидивы могут следовать один за одним. В настоящее время единственным эффективным пероральным средством является ципрофлоксацин, но к нему быстро развивается устойчивость, и пациентов приходится госпитализировать для проведения внутривенной антибиотикотерапии и физиотерапии.
Другие бактериальные возбудители. Изредка выделяют грамотрицательную кишечную палочку, или Staphylococcus aureus. Эти возбудители чаще связаны с больничными пневмониями, но иногда обнаруживаются у пациентов, недавно выписавшихся из больницы.
Под атипичными обычно подразумеваются инфекции, вызываемые Mycoplasma pneumoniae, Chlamydia psittaci, Chlamydia pneumoniae, Coxiella burnetti и Legionella pneumophila. Лихорадка Q, возбудителем которой служит Coxiella burnetti, встречается редко (как правило, в сельской местности), поэтому не будет упоминаться в дальнейшем. Все атипичные инфекции трудно поддаются распознаванию на ранних стадиях; серологические исследования, проведенные как в острый период, так и в период реконвалесценции, редко дают положительный ответ и не представляют клинической ценности.
Ни один из возбудителей атипичных инфекций не поддается воздействию b-лактамных антибиотиков, что объясняет отсутствие эффекта от назначения амоксициллина.
Mycoplasma pneumoniae. Эпидемия, вызванная этим возбудителем, случается каждые три-четыре года, и в такой период может составлять значительную часть всех респираторных заболеваний.
Обычно она охватывает школьников, студентов и людей среднего возраста; маленькие дети и старики страдают редко.
В отличие от бактериальных инфекций, заболевание начинается постепенно, через 10-14 дней после заражения, проявляясь сухим кашлем или выделением скудной чистой мокроты. Общее недомогание и повышение температуры тела обычно умеренные, при исследовании грудной клетки обнаруживаются незначительные изменения. Иногда такие проявления, как сыпь, буллезный мирингит, а также выявление холодовых агглютининов помогают поставить диагноз.
Микоплазменную инфекцию следует заподозрить, если взрослый человек, до этого не жаловавшийся на здоровье, при отсутствии серьезных патологических симптомов и признаков интоксикации не поддается лечению амоксициллином. В этом случае имеет смысл попробовать назначить антибиотик из группы макролидов; альтернативный подход — тетрациклины. Кашель, как правило, медленно поддается лечению.
Хламидии. Большинствo врачей общей практики время от времени сталкиваются со случаями пситаккоза, вызванного длительным контактом с какой-нибудь любимой домашней птичкой. В последние годы установлено, что наиболее распространенным возбудителем инфекций дыхательных путей является Chlamydia pneumoniae, передающаяся от человека к человеку [10]. Эта инфекция проявляется такими же стертыми симптомами, как и микоплазменная, среди которых выделяются кашель и фарингит. Но, в противоположность микоплазменной инфекции, данное заболевание поражает и пожилых людей, часто вследствие реинфекции.
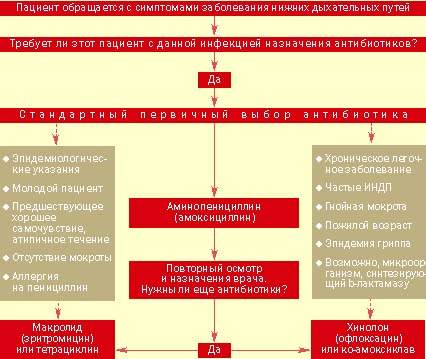 |
| Рисунок 2. Тактика ведения больного с выраженными клиническими показаниями для назначения антибиотиков при остром заболевании нижних дыхательных путей |
В некоторых исследованиях обнаружена связь между Chlamydia pneumoniaе и болезнями коронарных артерий и бронхиальной астмой, возможно обусловленная наличием хламидиального антигена, прикрепляющегося к эндотелию и эпителию. Рекомендуемое лечение — антибиотик из группы макролидов или тетрациклинов.
Legionella pneumophila. Болезнь легионеров все еще находится в центре внимания. Легионелла — редкий возбудитель пневмонии, развивающейся в местах большого скопления людей. Похоже, что легионелла не вызывает такие менее тяжелые заболевания дыхательной системы, как бронхит или инфекции верхних дыхательных путей. Состояние пациентов с болезнью легионеров достаточно тяжелое; обычно им требуется лечение в условиях стационара.
Известна связь этого заболевания с зараженными легионеллами источниками воды, поэтому упоминание пациента о заграничной поездке, пребывании в отеле или больнице, ванне джакузи помогает врачу общей практики правильно поставить диагноз. Нередко встречаются такие осложнения, как дыхательная недостаточность и энцефалит, поэтому все больные, даже в сомнительных случаях, должны быть направлены на госпитальное обследование.
- Практические советы по ведению больных с инфекциями дыхательных путей
Назначение антибиотиков. Подход к ведению больных с острыми инфекциями нижних дыхательных путей представлен на рис. 2. Ключевым моментом является принятие решения о назначении или неназначении антибиотиков. Большинство врачей общей практики считают необходимым применение антибиотиков при серьезных системных нарушениях, постоянном выделении гнойной мокроты, появлении местных признаков поражения легких и отягощенности предшествующими заболеваниями. Если уже решено использовать этот вид лечения, выбор нужного препарата не представляет особого труда.
 |
| Рисунок 3. Пациентам, входящим в группу риска, необходимо провести пневмококковую вакцинацию |
В большинстве случаев назначается амоксициллин. Согласно последним рекомендациям, доза амоксициллина принята равной 500 мг (а не 250 мг, как было раньше), чтобы снизить частоту развития резистентности пневмококков. Однако эта проблема лучше разрешается путем уменьшения общего количества назначений антибиотиков при инфекциях нижних дыхательных путей.
Врач общей практики не должен рекомендовать больному прием антибиотиков просто потому, что это самый легкий способ, или в случае, когда нет четких клинических показаний для их назначения. Проблемы резистентности возбудителей инфекций дыхательных путей решаются при назначении антибиотиков, обусловленном строгими показаниями. Снабжение пациентов простыми информационными листками значительно снижает необходимость повторных консультаций.
Литература
1. Office of Population Censuses and Surveys. Morbidity statistics from general practice: foutrh national study 1992. London: HMSO, 1995 (Series MB5;3).
2. Orr P. H., Scherer K., Macdonald A., Moffatt M. E. Randomosed placebo controlled trials of antibiotics for acute bronchitis: a critical review of the literature. J Fam Pract 1993; 36:507–512.
3. Macfarlane J. T., Holmes W. F., Macfarlane R. M., Lewis S. Contemporary use of antibiotics in 1089 adults presenting with acute lower respiratory tract illness in general practice in the UK: implications for developing managment guidelines. Respiratory Medicine, 1997; 91:427–434.
4. Holmes W. F., Macfarlane J. T., Macfarlane R. M., Lewis S. The influence of antibiotics and other factors on reconsultation for acute lower respiratory tract illness in primary care. Br J Gen Pract (in press).
5. Macfarlane J. T., Holmes W. F., Macfarlane R. M. Acutr lower respiratory tract illness in general practice; a study of the view on 787 patients and their influence on antibiotic prescribing. BMJ, 1997; 315:1211–1214.
6. Macfarlane J. T, Colville A., Guion A., Macfarlane R. M., Rose D. H. Prospective study of aetiology and outcome of adult lower respiratory tract infection in the community. Lancet, 1993; 341:511–514.
7. Macfarlane J., Prewett J., Rose D., Gard P., Guion A., Cunnigham R., Myint S. A prospective, case control study of the aetiology of community acquired lower respiratory tract infections in adult who felt to improve with initial antibiotics. BMJ, 1997; 315:1206–1210.
8. Venkatesan P., Innes J. A. Antibiotic resistance in common acute respiratory pathogenes. Thorax, 1995; 50:481–483.
9. Anon. Lower respiratory tract infections. MeReC Bulletin 1994; 5:5–8.
10. Torres A., ElEbiary M. Relevance of Chlamydia pneumoniae in community acquired respiratory infections. Eur Respir J, 1993; 6:7–8.
11. Macfarlane J. T., Holmes W. F., Macfarlane R. Reducing reconsultations for acute lower respiratory tract illness with an information leaflet. Br J Gen Pract, 1997; 47:710–722.
Читайте также:

