Аутоиммунные заболевания щитовидной железы при вич
Обновлено: 22.04.2024
— Аида Низамовна, что такое аутоиммунный тиреоидит?
— Это специфическое воспаление щитовидной железы. При этом заболевании в организме обнаруживаются антитела к железе. Приведу некоторые сведения о ней.
Сама по себе щитовидная железа невелика, но при этом представляет собой самую крупную эндокринную железу нашего организма. Она состоит из двух долей и перешейка и по форме напоминает бабочку. Правда, иногда встречается дополнительная, пирамидальная, доля. Размер каждой из долей примерно с ногтевую фалангу большого пальца человека. В среднем объём щитовидной железы у женщин не превышает 18 миллилитров, у мужчин — не более 25. Важно отметить, что нижней границы её размера на сегодняшний день не существует: она может быть совсем небольшой, но при этом исправно выполнять свои функции — в достаточном количестве вырабатывать гормоны.
Аутоиммунный тиреоидит был впервые описан японским врачом Хашимото в 1912 году, поэтому у болезни есть ещё и другое название — тиреоидит Хашимото.
При аутоиммунном тиреоидите в организме обнаруживаются антитела к щитовидной железе.
— Как часто встречается аутоиммунный тиреоидит у россиян и в мире?
— Распространённость носительства антител к щитовидной железе достигает до 26 % у женщин и 9 % у мужчин. Что, однако, не означает, что все эти люди больны аутоиммунным тиреоидитом. В Великобритании было проведено исследование, в котором приняли участие около трёх тысяч человек, и вот что выяснилось. Например, у женщин риск развития заболевания составил всего 2 %. То есть из 100 носительниц повышенного содержания антител к щитовидной железе нарушение её функции развивалось только у двух.
— Каковы причины аутоиммунного тиреоидита? Почему он возникает?
Подробнее о гипотиреозе можно прочитать в нашей статье
— Каковы симптомы аутоиммунного тиреоидита?
— Их выраженность может варьировать от полного отсутствия жалоб до тяжёлых последствий, опасных для жизни пациента. При снижении функции щитовидной железы страдают практически все органы. Наиболее типичными проявлениями болезни можно считать наличие таких симптомов:
- общая слабость;
- утомляемость;
- прибавка веса;
- ощущение холода без видимых причин;
- снижение аппетита;
- отёчность;
- появление хриплости голоса;
- сухость кожи;
- повышенная ломкость и выпадение волос;
- ломкость ногтей.
Со стороны нервной системы это такие жалобы, как сонливость, ухудшение памяти, концентрации внимания, невозможность сосредоточиться, в отдельных случаях депрессия.
Что касается сердечно-сосудистой системы: может быть замедленный пульс, повышение диастолического (нижнего) артериального давления.
Желудочно-кишечный тракт: имеется склонность к хроническим запорам.
Половая система: у женщин отмечается нарушение менструального цикла, бесплодие, в отдельных случаях возможно прерывание беременности; у мужчин — нарушение эрекции.
Уровень холестерина в крови может быть повышенным.
Читайте материалы по теме:
— Как проводится диагностика этого заболевания? Есть ли какие-то анализы, которые помогут выявить аутоиммунный тиреоидит?
Анализ выглядит достаточно привычно для всех — это сдача крови из вены натощак.
— В настоящее время этот диагноз при нормальном значении гормонов не правомочен.
— А если при этом был также сделан анализ и на антитела к щитовидной железе, и они были выявлены?
— Далеко не всегда обнаружение этих антител свидетельствует о наличии аутоиммунного тиреоидита. Само по себе их носительство не является заболеванием. Практически у 20 % здоровых людей в крови могут обнаруживаться антитела к щитовидной железе. К примеру, в зарубежной научной литературе аутоиммунный тиреоидит как самостоятельная клиническая проблема практически не рассматривается. Лечить это нужно только в случае развития гипотиреоза, то есть снижения функции щитовидной железы.
— Как проводится лечение аутоиммунного тиреоидита?
— Лечение заключается в возмещении недостатка тиреоидных гормонов в организме. Это называется заместительной терапией. Человеку надо дать то, чего ему не хватает — в данном случае недостающий тироксин (основная форма тиреоидных гормонов щитовидной железы). Пациент ежедневно должен принимать современные препараты на основе тироксина. По своей структуре они совершенно не отличаются от нашего собственного гормона, который при нормальных условиях производит щитовидная железа. Правильно подобранная дозировка этих препаратов предотвращает все возможные неблагоприятные последствия дефицита гормонов. Госпитализация при этом не требуется. Но заместительная терапия в случаях заболевания проводится пожизненно, поскольку сама по себе нормальная работа щитовидной железы восстановиться не может.
— Насколько эффективно применение БАДов при аутоиммунном тиреоидите?
— При лечении не только этого, но и других заболеваний места БАДам нет. Любой добросовестный современный врач должен придерживаться принципов доказательной медицины. Иными словами, подход к профилактике, диагностике и лечению заболеваний щитовидной железы применяется, исходя из имеющихся доказательств эффективности и безопасности препаратов. БАДы же для лечения применяться не могут. Это положение регламентировано во всех странах.
БАДы для лечения аутоиммунного тиреоидита применяться не могут
— Если этот недуг обнаружен у женщины репродуктивного возраста, которая планирует беременность, возникает вопрос: а можно ли забеременеть при аутоиммунном тиреоидите?
— Напомню: носительство антител — это не заболевание и, соответственно, не выступает в роли препятствия для наступления беременности. Однако если у женщины, которая хочет родить ребёнка, выявлено нарушение функции щитовидной железы, то оно может помешать наступлению беременности и вынашиванию плода. Если женщина страдает гипотиреозом, то ребёнок при рождении может иметь различные отклонения и дефекты (это и нарушение умственного развития, и проблемы роста). В том числе у ребёнка может быть и врождённый гипотиреоз. Поэтому крайне важно выявление и лечение болезни заранее.
Записаться на приём к врачу-эндокринологу можно здесь
ВНИМАНИЕ: услуга доступна не во всех городах
Беседовал Игорь Чичинов
Редакция рекомендует
Для справки
Гюльмагомедова Аида Низамовна
Член Российской Ассоциации эндокринологов, член Ассоциации эндокринологов Ростовской области.
Общий стаж работы более 10 лет.
Автор около 20 печатных работ в научных журналах.
Принимает по адресу: г. Ростов-на-Дону, ул. Красноармейская, 262.
Другие статьи по теме
Говоря о диабете, обычно подразумевают сахарный. Однако есть и несахарный диабет, а. Сахарный? Не только! Что такое несахарный диабет?
Значительное место в практической деятельности врачей- эндокринологов занимают диагностика и лечение заболеваний щитовидной железы. Среди них одним из наиболее частых является аутоиммунный тиреоидит (АИТ). Распространенность АИТ среди населения разных стран колеблется от 0,1— 1,2% у детей до 6—11% у женщин старше 60 лет (Matsuura и соавт., 1990). По данным A. Weetman (1992), частота АИТ в популяции (клинически явные формы) составляет 1%. В то же время субклинический тиреоидит и циркулирующие антитиреоидные антитела могут быть обнаружены у 10—15% практически здоровых лиц, находящихся в эутиреоидном состоянии. Соотношение болеющих мужчин и женщин составляет 1:4— 1:8 (Р. Langer, 1996).
Ключевые слова
Для цитирования:
For citation:
Значительное место в практической деятельности врачей- эндокринологов занимают диагностика и лечение заболеваний щитовидной железы. Среди них одним из наиболее частых является аутоиммунный тиреоидит (АИТ). Распространенность АИТ среди населения разных стран колеблется от 0,1— 1,2% у детей до 6—11% у женщин старше 60 лет (Matsuura и соавт., 1990). По данным A. Weetman (1992), частота АИТ в популяции (клинически явные формы) составляет 1%. В то же время субклинический тиреоидит и циркулирующие антитиреоидные антитела могут быть обнаружены у 10—15% практически здоровых лиц, находящихся в эутиреоидном состоянии. Соотношение болеющих мужчин и женщин составляет 1:4— 1:8 (Р. Langer, 1996).
Классификация. АИТ является одним из наиболее типичных аутоиммунных заболеваний. Впервые он был описан Ха- шимото в 1912 г. Большинство авторов выделяют 2 основные формы АИТ (гипертрофическую — зоб Хашимото и атрофическую — первичную микседему), являющиеся причиной развития спонтанного гипотиреоза. Отдельной формой тиреоидита, также предположительно имеющей аутоиммунную основу, является послеродовой тиреоидит (ПТ). Ниже представлена классификация хронических тиреоидитов.
гипертрофическая форма (зоб Хашимото);
атрофическая форма. Фиброзно-инвазивный тиреоидит (Риделя).
Послеродовой ("молчащий") тиреоидит
Этиология и патогенез. Как и многие аутоиммунные нарушения, АИТ — это взаимодействие генетической предрасположенности и действия факторов окружающей среды, которые в дальнейшем модифицируются под влиянием таких эндогенных факторов, как возраст и уровень секреции половых гормонов (A. Weetman, 1992). Повышенная частота возникновения АИТ у женщин указывает на возможную связь между генами Х-хромосомы и развитием аутоиммунного процесса. Один из вероятных механизмов реализации наследственной предрасположенности может быть связан с влиянием эстрогенов на функцию Т-лимфоцитов. АИТ чаще возникает в возрасте 25—35 лет, однако случаи заболевания могут встречаться в любом возрасте. Наибольшее количество случаев АИТ у женщин отмечается после 60 лет.
АИТ имеет тенденцию проявляться в виде семейных форм болезни. Наблюдение за разнояйцевыми близнецами свидетельствует об одновременном возникновении у них АИТ в 3—9% случаев, а у однояйцевых близнецов — в 30—60% случаев (R. Volpe, 1985).Последний факт является убедительным доказательством наличия инетического фона для развития АИТ. Кроме того, наблюдается сочетание АИТ в пределах одной семьи с другими аутоиммунными заболеваниями — пернициозной анемией, аутоиммунным первичным гипокортицизмом, хроническим активным гепатитом, инсулинзависимым диабетом, аллергическим альвеолитом, витилиго, гнездной плешивостью. синдромом Шегрена, ревматоидным артритом и др. (Herrman и соавт., 1990; В. Ghovolensson и соавт., 1994; Р. Langer, 1996). Описаны случаи, когда один из монозиготных близнецов имел диффузный токсический зоб (ДТЗ), другой — тиреоидит Хашимото. В семьях пациентов с ДТЗ всречается много родственников с тиреоидитом Хашимото (R. Volpe, 1988).
При типировании остальных аллелей II класса, особенно DQA1, DQB1 и DPB1. выявлен вариант сильнейшего родственного риска развития АИТ — HLA DQW7. Этот признак оказался более надежным, чем HLA DR3 или HLA DR5. Среди японской популяции отмечено наличие локусов DRW6 и DRW12. Wan и соавт. (1995) обнаружили ассоциацию тиреоидита Хашимото с HLA А2 и DRB4*0101. Названные антигены обнаружены у 97% пациентов с АИТ (японцев) по сравнению с 79% в контроле. Напротив, Tamagi и соавт. (1994) сообщили, что среди японцев, больных АИТ, реже по сравнению с контрольной группой обнаруживались антигены HLA DQAl*0102 (9,5% против 24,9%) и DQB 1*0602 (2,9% против 12,6%). Представленные данные могут свидетельствовать о наличии естественных механизмов защиты против аутоиммунных заболеваний.
- R. Volpe в 1997 г. предложена гипотеза развития аутоиммунных заболеваний щитовидной железы, разработанная на основе клонально-селекционной теории Барнета (1959). Она состоит в следующем: заболевание обусловлено частичным дефектом иммунологического надзора, что связано со специфическим дефицитом Т-лимфоцитов-супрессоров. Этот дефект допускает выживание "запрещенного" клона органоспецифических Т-лимфоцитов, появляющихся в результате случайной мутации. "Запрещенный" клон Т-лимфоцитов взаимодействует с комплементарными органными антигенами, оказывая повреждающее действие на клетки-мишени и запуская тем самым локализованный иммунный процесс по типу гиперчувствительности замедленного типа. Антигенная стимуляция Т-лимфоцитов со стороны клеток-мишеней обусловливвает реакцию бласттрансформации с последующим делением клеток. При этом выделяются медиаторы, которые также оказывают цитотоксическое действие. Т-лимфоциты-хелперы воздействуют соответствующим образом на В-лимфоциты, которые превращаются в плазматические клетки и образуют антитела к тиреоглобулину и микросомальным белковым структурам фолликулярного эпителия. Циркулирующие антитела, кооперируясь на поверхности клеток фолликулярного эпителия с Т-лимфоцитами-киллерами, оказывают цитотоксическое действие на гормонально-активные клетки щитовидной железы, вызывая их деструкцию, постепенное уменьшение их массы и снижение функции щитовидной железы. В ответ на повреждающее действие аутоагрессии наблюдается гиперплазия щитовидной железы, поддерживающая состояние эутиреоза, а иногда сопровождающаяся признаками гиперфункции. Длительный процесс аутоагрессии приводит к постепенному снижению функциональной активности щитовидной железы — прогрессирующему гипотиреозу. По принципу обратной связи нарастает продукция тиреотропного гормона (ТТГ) гипофизом. В конечном итоге это ведет к образованию зоба. Изложенный выше механизм относится к гипертрофической форме тиреоидита Хашимото.
Атрофическую форму АИТ связывают с эффектом блокирующих антител к рецептору ТТГ (Chiovato и соавт., 1990). Циркулирующие в крови аутоантитела к тиреоглобулину и микросомальной фракции не способны оказывать повреждающее действие, пока они нс скооперируются с Т-лимфоцитами- киллерами, которые выделяют цитотоксические факторы, вызывающие разрушение клеток. Этот процесс носит название "антителозависимая клеточноопосредованная цитотоксичность". Сенсибилизированные к специфическим антигенам Т- лимфоциты высвобождают лимфокины, которые участвуют в эффекте цитотоксичности и могут непосредственно повреждать клетки-мишени. К лимфокинам относятся лимфотоксин, фактор хемотаксиса, МИФ-фактор, фактор некроза опухолей и др. Таким образом, в патогенезе АИТ участвуют клеточный и гуморальный компоненты иммунного ответа.
Mackenzie и соавт. в конце 80-х — начале 90-х годов изучали клоны внутритиреоидных Т-клеток у больных с аутоиммунными заболеваниями щитовидной железы. При АИТ 59% клонов фенотипически относились к группе супрессоров — цитотоксических клеток, 55% оказывали цитотоксическое действие на аллогенные эритробласты. 55% клонов также реагировали с аутологичными моноядерными клетками периферической крови.
Вместе с тиреоидными антигенами 11% клонов Т-клеток от больных с АИТ реагировали с тиреоглобулином человека, но ни один не взаимодействовал с микросомальным антигеном. 2 клона оказывали цитотоксическое действие на аутологичные, но не аллогенные клетки щитовидной железы. Таким образом, при АИТ большинство Т-клеток щитовидной железы аутореактивно.
Помимо полового и возрастного фактора, существенную роль играют факторы внешней среды, которые могут "запустить" аутоиммунный процесс у генетически предрасположенных лиц. Показано, что распространенность АИТ одинакова в различных географических регионах, однако в тех странах, где отсутствует дефицит йода, относительная частота АИТ может быть выше (Г. Ф. Александрова, 1996).
В литературе продолжает широко дискутироваться вопрос о связи между уровнем потребления йода и частотой АИТ. Так, по мнению J. Rendl и соавт. (1993), прием высоких фармакологических доз йода у генетически предрасположенных животных значительно увеличивает частоту развития АИТ. Однако точные механизмы йодиндуцированной стимуляции тиреоидного аутоиммунитета до сих пор неизвестны. Экспериментальные и клинические исследования показывают, что длительный прием избыточного количества йода может привести к увеличению частоты АИТ и у лиц, имеющих к нему генетическую предрасположенность. Речь идет об очень высоких дозах йода (десятки и сотни миллиграммов), которые содержатся в таких препаратах, как амиодарон (кордарон), рентгеноконтрастных средствах, некоторых антисептиках. Вместе с тем нет оснований считать, что восполнение нормальной потребности в йоде (назначение йода в суточной дозе 100—200 мкг) может увеличивать частоту аутоиммунной патологии щитовидной железы у здоровых лиц (Г. А. Герасимов, Н. А. Петунина, 1993).
Имеются предварительные данные о том, что радиационное воздействие увеличивает как бессимптомное носительство антител к ткани щитовидной железы (микросомальному антигену), так и число пациентов с клинически явными формами болезни (Д. Е. Шилин, Э. П. Касаткина, 1997).
Во многих работах указано на возможную роль бактерий и вирусов как факторов, индуцирующих аутоиммунные заболевания щитовидной железы. Так, J. Tomer и Т. Davies (1993) показали, что классические аутоиммунные заболевания щитовидной железы (болезнь Грейвса—Базедова и АИТ) развиваются при наличии различных патогенных бактерий (Yersinia enterocolitica, ретровирусы).
По мнению Wilson и соавт. (1990), на развитие аутоиммунных заболеваний щитовидной железы оказывает влияние литий. Ими обследована группа из 40 пациентов, которым была назначена медикаментозная терапия по поводу психического заболевания. В ходе терапии использовались препараты, содержащие литий. Авторы обнаружили повышенное образование антител к ткани щитовидной железы на фоне происходивших одновременно типичных изменений в ткани, характерных для аутоиммунного поражения органа.
В ряде работ показано, что лечение интерфероном может вызвать экспрессию молекул HLA-П-гаплотипа на эпителии щитовидной железы in vitro и in vivo, запуская аутоиммунные реакции. Так, у больных раком щитовидной железы, которые получали лечение а-интерфероном, нередко параллельно развивались аутоиммунные заболевания щитовидной железы (W. Scherbaum, 1993). Всем вышеперечисленным факторам отводится провоцирующая роль на фоне генетической предрасположенности к заболеванию.
Морфология. Типичным морфологическим признаком АИТ является локальная или распространенная инфильтрация щитовидной железы лимфоцитами. Такие очаги поражения состоят из лимфоцитов, плазматических клеток и макрофагов. Лимфоциты не только контактируют с фолликулами, но и пенетрируют в цитоплазму ацинарных клеток, что не наблюдается в нормальной щитовидной железе. Характерным является также наличие больших оксифильных клеток (Ашкенази и Гюртля). С помощью электронной микроскопии на основной мембране фолликулов выявляются плотные образования, которые представляют собой отложения иммунных комплексов. Встречаются и фибробласты, особенно при атрофической форме заболевания.
- Mizurami и соавт. (1992) считают возможным разделять всех больных АИТ по результатам гистологического исследования ткани щитовидной железы на 4 группы: с оксифильным, смешанным, фокальным и гиперпластическим тиреоидитом. При этом авторы выявили связь между результатами гистологического исследования и функциональным состоянием щитовидной железы. Показано, что частота гипотиреоза связана с наличием в тиреоидной ткани оксифильных клеток, а частота гипертиреоза — с наличием гиперплазии эпителия. Больные с фокальным тиреоидитом обычно находятся в состоянии эутиреоза, в то время как у больных хроническим тиреоидитом смешанного типа могут выявляться все формы функционального состояния щитовидной железы (табл. 1).
М. Э Бронштейн (1991) на основе морфологического исследования ткани железы выявила 3 основных гистологических варианта АИТ: 1) классический вариант (собственно зоб Хашимото) в 2 формах — диффузный и диффузно-узловой; 2) хронический лимфоматозный тиреоидит как самостоятельная форма и 3) хронический лимфоматозный струмит. В последнем случае характер и степень выраженности лимфоидной инфильтрации сходны с таковыми при хроническом лимфома- тозном тиреоидите, но сохраняется тиреоидная ткань с выраженными зобными изменениями.
Диагностика аутоиммунного тиреоидита
Диагностика АИТ основывается на следующих основных клинических, лабораторных и инструментальных методах обследования: наличии характерных клинических и пальпаторных признаков, показателях функционального состояния щитовидной железы, результатах ультразвукового исследования (УЗИ) щитовидной железы, наличии антител к компонентам ткани щитовидной железы, данных пункционной биопсии щитовидной железы.
Следует отметить, что АИТ — это клинический диагноз, устанавливаемый на основе клинических признаков и результатов инструментального и лабораторного исследования. Ни один из методов, даже самый информативный, сам по себе не позволяет диагностировать АИТ. В целом же чем больше у пациента имеется клинических, инструментальных и лабораторных признаков заболевания, тем больше вероятность наличия АИТ.
Клиника. Наиболее типичным для АИТ является присутствие симптоматики гипотиреоза, реже — гипертиреоза. Вместе с тем эти клинические признаки очень неспецифичны, так как у значительной части пациентов с АИТ имеется эутиреоз. При гипертрофической форме АИТ может определяться (пальпаторно и/или визуально) увеличение щитовидной железы, которая имеет плотную, часто неоднородную структуру. Таким пациентам нередко ставят диагноз "узловой зоб”. При наличии достаточных оснований у пациентов с подозрением на АИТ следует провести дополнительное обследование.
Функциональное состояние щитовидной железы. В процессе морфологической эволюции аутоиммунного процесса при АИТ функция щитовидной железы претерпевает стадийные изменения с практически обязательным исходом в гипотиреоз. Гипотиреоз различной степени выраженности диагностирован у 36,5% больных с АИТ; у 40,5% больных с помощью гормональных исследований и пробы с тиролиберином отмечен субклинический гипотиреоз, у 18,9% — состояние эутиреоза и лишь у 4,1% — гиперфункция щитовидной железы (Н. А. Сакаева, 1989). Таким образом, среди пациентов с АИТ преобладают больные с субклиническими и манифестными формами гипотиреоза.
У некоторой части больных АИТ в дебюте заболевания возможно наличие гипертиреоза, который связывают с процессом деструкции ткани щитовидной железы вследствие аутоагрессии и поступлением в кровь большого количества ранее синтезированных гормонов. Другой причиной транзитор- ного гипертиреоза (называемого также хашитоксикозом) может быть наличие антител, стимулирующих продукцию тиреоидных гормонов. Однако роль этих антител не очень велика: Гистологическая классификация хронических тиреоидитов (по Mizurami и соавт., 1992) Гистологическая группа
Классификация по Woolner Хронический оксифильно-клеточный тиреоидит
Хронический смешанный тиреоидит
Диффузная клеточная инфильтрация: от умеренной до выраженной
Оксифильные изменения эпителиальных клеток: почти всегда
Фиброз: от умеренного до выраженного
Диффузная клеточная инфильтрация: умеренная
Диффузный тиреоидит, оксифильный эпителий
Диффузный тиреоидит, лимфоидный тип
Диффузный тиреоидит, приводящий к эпителиальной деструкции
Диффузный тиреоидит, различные эпителиальные изменения Хронический фокальный, легкий тиреоидит
Хронический гиперпластический тиреоидит
Фолликулярные эпителиальные изменения: различные (оксифильные, гиперпластические и нормальные)
Статья посвящена клиническому случаю развития болезни Грейвса у пациентки с ВИЧ-инфекцией, получающей антиретровирусную терапию. За последние десятилетия число ВИЧ-инфицированных пациентов во всем мире существенно возросло. Применяемая на сегодняшний день высокоактивная антиретровирусная терапия позволяет существенно улучшить прогноз для этих пациентов. Однако ее применение сопряжено с рядом осложнений, в частности, развитием синдрома восстановления иммунитета, на фоне чего возможно развитие таких аутоиммунных заболеваний, как болезнь Грейвса, полимиозит и синдром Гийена–Барре. Поэтому хотелось бы обратить внимание врачей на возможность развития такого осложнения у больных, получающих антиретровирусную терапию. Своевременная диагностика и лечение нарушений функции щитовидной железы позволят избежать осложнений, сопряженных с избытком или дефицитом тиреоидных гормонов.
Ключевые слова
Для цитирования:
For citation:
АКТУАЛЬНОСТЬ
В последние десятилетия для лечения пациентов с ВИЧ-инфекцией в клиническую практику стали активно внедрять различные комбинации антиретровирусных препаратов. Проводимая на сегодняшний день высокоактивная антиретровирусная терапия (ВААРТ) позволила, с одной стороны, в определенной мере контролировать течение ВИЧ-инфекций, что привело к уменьшению показателей заболеваемости и смертности у ВИЧ-инфицированных пациентов. С другой стороны, был отмечен ряд нежелательных явлений, ассоциированных с данной терапией. Одним из них является синдром восстановления иммунитета. В литературе можно встретить и другие названия данного синдрома: синдром иммунной перестройки, синдром реконструкции иммунной системы, воспалительный синдром иммунной перестройки и другие. К наиболее частым неинфекционным проявлениям данного синдрома относятся болезнь Грейвса, саркоидоз, системная красная волчанка, полимиозит и другие заболевания. В данной статье мы хотим представить клиническое наблюдение пациентки с ВИЧ-инфекцией и болезнью Грейвса, развившейся на фоне проводимой антиретровирусной терапии.
ОПИСАНИЕ СЛУЧАЯ
Из анамнеза. В 2004 г. у пациентки выявлена ВИЧ-инфекция. С 2016 г. получает антиретровирусную терапию по схеме: лопинавир/ритонавир 200 мг + 50 мг 3 таблетки в стуки, ламивудин 150 мг 1 таблетка в сутки. Иммунный статус от 02.2019: CD4 683 (35%), CD8 706 (36%), CD4/CD8 0,97, ПЦР РНК ВИЧ от 02.2019 – не обнаружена.
Таблица 1. Динамика уровня гормонов и антител к рецептору ТТГ
Дата исследования
ТТГ
(0,4–4,0 мЕд/л)
свободный Т4
свободный Т3
АТ-рТТГ
(0–1 МЕ/л)
Результаты физикального, лабораторного и инструментального исследования
Данные физикального осмотра. Вес — 48 кг, рост — 161 см, ИМТ = 18,52 кг/м 2 . Кожные покровы физиологической окраски, умеренной влажности, чистые. Подкожножировая клетчатка развита умеренно, распределена равномерно. Отеков нет. В легких дыхание везикулярное, хрипов нет. Частота дыхания (ЧД) — 17 в минуту. Тоны сердца приглушены, ритмичные, шумов нет. АД 100/75 мм рт. ст. Пульс — 82 в минуту, ритмичный. Живот округлой формы, мягкий, при пальпации безболезненный во всех отделах. Печень по передней подмышечной линии по краю реберной дуги. Симптом поколачивания отрицательный с обеих сторон. ЩЖ равномерно увеличена (II ст.), безболезненна при пальпации, мягко-эластической консистенции, узловые образования не пальпируются. Обращает на себя внимание экзофтальм OU. Активность орбитопатии по шкале CAS — 1 балл OU. Симптом Грефе — положительный; симптомы Дальримпля, Кохера, Штельвага, Розенбаха — отрицательные.
Показатели общего и биохимического анализов крови — в пределах референсного диапазона. Результаты исследования ТТГ и тиреоидных гормонов представлены в таблице 1.
УЗИ ЩЖ (06.05.19): ЩЖ расположена типично. Размеры: перешеек — 5,0 мм, правая доля — длина 87 мм, толщина 37 мм, ширина 43 мм, левая доля — длина 90 мм, толщина 34 мм, ширина 39 мм. Объем ЩЖ: 123 см 3 . Контуры ровные, капсула не утолщена, уплотнена; эхогенность диффузно умеренно пониженная. Эхоструктура ткани однородная. В режиме цветового допплеровского картирования (ЦДК) сосудистый рисунок значительно диффузно усилен. Линейная скорость кровотока по задней щитовидной артерии 150 см/с. Региональные лимфоузлы: патологического увеличения не выявлено.
ИСХОД И РЕЗУЛЬТАТЫ ПОСЛЕДУЮЩЕГО НАБЛЮДЕНИЯ
Принимая во внимание клиническую картину заболевания (в том числе наличие у пациентки эндокринной орбитопатии), результаты лабораторных исследований (повышенный уровень антител к рецептору ТТГ), диффузное увеличение ЩЖ, повышение васкуляризации железы по данным ультразвукового исследования, болезнь Грейвса сомнений не вызывает. На фоне проводимой тиреостатической терапии у пациентки развился ятрогенный гипотиреоз. Проведена коррекция терапии. Пациентка проинформирована обо всех возможных вариантах лечения болезни Грейвса (медикаментозное, радикальное). Принимая во внимание высокий уровень антител к рецептору ТТГ, большой объем ЩЖ, а также желание самой пациентки вариантом выбора является хирургическое лечение (тиреоидэктомия). В дальнейшем пациентке была выполнена тиреоидэктомия, назначена заместительная терапия левотироксином в дозе 100 мкг. Послеоперационный период протекал без особенностей, состояние пациентки оставалось стабильно удовлетворительным. По результатам гистологического исследования: морфологическая картина диффузного токсического зоба. В анализе крови от июня 2019 г. (через 2 месяца после оперативного лечения) уровень ТТГ 1,5 мкМЕ/мл (0,4–4,0).
ОБСУЖДЕНИЕ
ВИЧ-инфекция — прогрессирующее антропонозное заболевание с преимущественно контактным механизмом заражения, характеризующееся специфическим поражением иммунной системы с развитием иммунодефицита, который проявляется развитием оппортунистических инфекций, злокачественных новообразований, возникновением аутоиммунных реакций. Внедрение в клиническую практику ВААРТ способствовало переходу ВИЧ-инфекции из категории смертельных болезней в хроническое заболевание с большой ожидаемой продолжительностью жизни.
Применение активной антиретровирусной терапии обеспечивает клинически значимое повышение количества клеток CD4 + Т-клеток, что сопровождается уменьшением риска прогрессирования заболевания, а также снижением риска оппортунистических инфекций. Вместе с тем длительная ВААРТ приводит к развитию ряда аутоиммунных заболеваний, обусловленных синдромом восстановления иммунитета [1]. Патогенез развития данного синдрома связан с качественным и количественным изменением CD4 + лимфоцитов. В ранний период применения ВААРТ происходит увеличение количества данных клеток за счет перераспределения их в организме пациента. Они поступают в кровоток из периферических лимфоузлов, где в основном сосредоточены активированные лимфоциты. Это создает предпосылки для запуска вторичного иммунного ответа на уже имеющиеся у больного неинфекционные и инфекционные антигены. Значительное увеличение абсолютного количества CD4 + Т-лимфоцитов приводит к усилению антигенспецифического иммунного ответа и продукции медиаторов воспаления, что может привести к образованию аутоантител и инфильтрации тканей активированными лимфоцитами. Аутоиммунные тиреопатии у пациентов с ВИЧ, получающих ВААРТ, встречаются в 1,5–2 раза чаще, чем в общей популяции: примерно у 3,0% у женщин и 0,2% мужчин [2]. Наиболее часто развивается болезнь Грейвса (88% случаев), гораздо реже тиреоидит Хашимото (6%) и гипотиреоз без повышения антител к ткани ЩЖ (6%). Аутоиммунное поражение ЩЖ может развиться спустя несколько месяцев, иногда несколько лет после начала антиретровирусной терапии [3, 4]. Так, по данным Rasul S. и соавт., у 4 пациентов болезнь Грейвса манифестировала через 19–53 месяца от начала антиретровирусной терапии [4]. В работе Hsu E. и соавт. показано, что у пяти пациентов болезнь Грейвса манифестировала через 23–96 месяцев [5]. Учитывая высокую распространенность нарушений функции ЩЖ, сопутствующих иммуновосстановительной терапии, Европейская тиреоидная ассоциация (ЕТА) предлагает следующий подход к ведению таких пациентов [6].
Перед началом терапии всем пациентам рекомендуется определять уровень ТТГ, при выявлении отклонений — уровни свободных тироксина (Т4) и трийодтиронина (Т3). Рутинное определение антител к тиреопероксидазе (АТ-ТПО), антител к рецептору ТТГ (АТрТТГ), а также визуализация ЩЖ не рекомендуются. Наличие у пациента нарушения функции ЩЖ в анамнезе либо на момент планируемой ВААРТ не является противопоказанием к проведению ВААРТ, однако требует предварительного лечения и последующего наблюдения у эндокринолога. Внимательно необходимо отнестись к пациентам с ремиссией болезни Грейвса после консервативного лечения, в случае радикального лечения ожидаемый риск рецидива низкий. Противопоказаниями к ВААРТ являются активная стадия эндокринной офтальмопатии и наличие заболевания сердца, при котором тиреотоксикоз может представлять угрозу для здоровья. ЕТА рекомендует лечение этих состояний до проведения ВААРТ [6].
После проведения ВААРТ, в отличие от других вариантов иммуновосстановительной терапии, не рекомендуется рутинное динамическое определение ТТГ. Оценка уровня ТТГ показана только при развитии клинических проявлений патологии ЩЖ: потливость, неожиданные колебания веса, нервозность, учащенное сердцебиение и нарастающая утомляемость; следует предупредить пациента о необходимости обратиться за медицинской помощью при появлении этих симптомов. Данная рекомендация ЕТА согласуется с рекомендациями по ведению пациентов с ВИЧ Американского общества инфекционных заболеваний, может быть объяснена меньшей распространенностью патологии ЩЖ при применении ВААРТ в сравнении с другой иммуновосстановительной терапией. В поперечном исследовании Silva G.A. и соавт. у 117 пациентов с ВИЧ-инфекцией распространенность нарушений функции ЩЖ составила 34%, большинство имели субклинический или манифестный гипотиреоз, однако в 13% случаев выявлялся низкий свободный Т4 при нормальном или сниженном ТТГ, у 1% выявили изолированное повышение свободного Т4, что может свидетельствовать о патологии гипофиза либо синдроме эутиреоидной патологии [6, 7].
Рутинная визуализация ЩЖ данной группе пациентов также не показана. В отношении длительности наблюдения четких рекомендаций не сформулировано, описано развитие болезни Грейвса у пациентов с ВИЧ в течение 8–33 месяцев (в среднем 17 месяцев) после начала ВААРТ.
У нашей пациентки на фоне проводимой 3-компонентной ВААРТ получен адекватный иммунный ответ, и через 24 месяца от начала лечения появились клинические проявления тиреотоксикоза, у нее была диагностирована болезнь Грейвса. В большинстве случаев симптомы тиреотоксикоза появляются в течение первых 12 месяцев лечения. Как правило, у пациентов нет других аутоиммунных заболеваний, часто не отягощен семейный анамнез по аутоиммунной патологии [5]. На сегодняшний день не выделено четких факторов риска развития болезни Грейвса у пациентов с ВИЧ-инфекцией на ВААРТ. В литературе обсуждается вопрос о возможной ассоциации болезни Грейвса с полиморфизмом генов MHC [8, 9]. Очевидно, чаще болезнь Грейвса будет развиваться у пациентов, получающих также противовирусную терапию препаратами интерферона по поводу гепатита С.
ЗАКЛЮЧЕНИЕ
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Рукопись подготовлена на личные средства авторов.
Согласие пациента. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации в обезличенной форме.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы внесли значимый вклад и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
Список литературы
1. Roszkiewicz J, Smolewska E. Kaleidoscope of autoimmune diseases in HIV infection. Rheumatol Int. 2016;36(11):1481−1491. doi: 10.1007/s00296-016-3555-7.
2. Chen F, Day SL, Metcalfe RA, et al. Characteristics of autoimmune thyroid disease occurring as a late complication of immune reconstitution in patients with advanced human immunodeficiency virus (HIV) disease. Medicine (Baltimore). 2005;84(2):98−106. doi: 10.1097/01.md.0000159082.45703.90.
3. Jubault V, Penfornis A, Schillo F, et al. Sequential occurrence of thyroid autoantibodies and Graves’ disease after immune restoration in severely immunocompromised human immunodeficiency virus-1-infected patients. J Clin Endocrinol Metab. 2000;85(11):4254−4257. doi: 10.1210/jcem.85.11.6988.
4. Rasul S, Delapenha R, Farhat F, et al. Graves’ disease as a manifestation of immune reconstitution in HIV-Infected individuals after initiation of highly active antiretroviral therapy. AIDS Res Treat. 2011;2011:743597. doi: 10.1155/2011/743597.
5. Hsu E, Phadke VK, Nguyen ML. Short communication: hyperthyroidism in human immunodeficiency virus patients on combined antiretroviral therapy: case series and literature review. AIDS Res Hum Retroviruses. 2016;32(6):564−566. doi: 10.1089/AID.2015.0374.
7. Silva GA, Andrade MC, Sugui Dde A, et al. Association between antiretrovirals and thyroid diseases: a cross-sectional study. Arch Endocrinol Metab. 2015;59(2):116−122. doi: 10.1590/2359-3997000000023.
8. Weetman AP. Thyroid abnormalities. Endocrinol Metab Clin North Am. 2014;43(3):781−790. doi: 10.1016/j.ecl.2014.05.006.
9. French MA, Lewin SR, Dykstra C, et al. Graves’ disease during immune reconstitution after highly active antiretroviral therapy for HIV infection: evidence of thymic dysfunction. AIDS Res Hum Retroviruses. 2004;20(2):157−162. doi: 10.1089/088922204773004879.
Снижение веса, учащённый пульс, беспокойство, раздражительность – эти, а также ряд других проявлений могут свидетельствовать о такой патологии, как гипертиреоз.
– Существуют два понятия: гипертиреоз и тиреотоксикоз. Иногда их объединяют, в частности, в иностранных источниках. Но разница есть. Чем же отличается тиреотоксикоз от гипертиреоза? Гипертиреоз – это усиление функции щитовидной железы, а тиреотоксикоз – синдром избытка тиреоидных гормонов в организме, то есть более широкое понятие. И первый является одной из причин второго.
А знаете ли вы, что происходит с организмом при гипотиреозе? Подробнее об этой патологии читайте в нашей статье
– Каковы причины развития гипертиреоза?
– Болезней, протекающих с гипертиреозом, а тем более с тиреотоксикозом, много. Например: болезнь Грейвса, узловой токсический зоб, гестационный тиреотоксикоз, деструктивные тиреоидиты, патология гипофиза и гипоталамуса, опухоли яичников, экзогенный тиреотоксикоз.
Самым частым заболеванием со стойким гипертиреозом является болезнь Грейвса (или, иначе, диффузный токсический зоб). В результате дефекта иммунной системы вырабатываются антитела, которые начинают активировать щитовидную железу, и развивается тиреотоксикоз.
Толчком для начала болезни чаще всего становится стресс – драматические события, связанные, например, со смертью близкого человека, с потерей работы, разводом, переездом в другую климатическую зону. Также могут оказать влияние перенесённые инфекции, травмы, операции, беременность, избыточная инсоляция.
Часто тиреотоксикоз возникает у тех, чьи родители имели патологию щитовидной железы. Предрасполагающими факторами являются дефицит йода, селена, цинка, загрязнение окружающей среды, курение, аутоиммунные заболевания.
– Как проявляется гипертиреоз?
– Как можно выявить гипертиреоз? Какова диагностика этой патологии?
– Наличие гипертиреоза, тиреотоксикоза определяется с помощью анализа крови на ТТГ (тиреотропный гормон, вырабатывается в гипофизе), Т4 свободный, Т3 свободный (эти два гормона синтезируются щитовидной железой).
Остальные исследования назначаются для установления причины появления тиреотоксикоза, степени выраженности осложнений.
– Как проводится лечение гипертиреоза?
– В зависимости от того, какое заболевание, протекающее с гипертиреозом (или тиреотоксикозом) диагностировано у больного, назначается соответствующая терапия. Тактика лечения может быть совершенно разная.
Для примера остановлюсь на болезни Грейвса. Начинают с назначения тиреостатиков, которые приостанавливают функцию щитовидной железы, блокируя в ней образование тиреоидных гормонов. Лечение длительное, до 1,5 лет. В 20% случаев наступает ремиссия. Если же нет, то следующим этапом является либо хирургическое вмешательство (удаляется практически вся щитовидная железа, чтобы не было рецидива болезни), либо радиойодтерапия, т.е. лучевая деструкция щитовидной железы с помощью радиоактивного йода (без хирургического вмешательства). Уровень тиреоидных гормонов снижается ниже нормы, поэтому в дальнейшем подбирается заместительная терапия тироксином (синтетическим аналогом тиреоидного гормона T4).
– Константин Анатольевич, что делать, если гипертиреоз выявлен у беременной женщины?
– Как при длительно существующем тиреотоксикозе, так и при гипертиреозе беременность и роды могут осложниться. Есть риск замирания беременности, появления мертворождённого малыша, преждевременных родов, отслоения плаценты, послеродового кровотечения. Не исключены врождённые пороки у ребёнка. Поэтому тиреотоксикоз желательно ликвидировать ещё до зачатия. Если же болезнь возникла, когда женщина уже в положении, надо как можно раньше обратиться к эндокринологу и начать лечение. Прерывание беременности в этом случае не потребуется.
Почему важно готовиться к беременности и как это делать? Подробнее читайте в нашей статье
– Существуют ли меры профилактики развития гипертиреоза?
– Рекомендуется здоровый образ жизни, рациональное питание с достаточным потреблением йода, цинка, селена, белков. Необходимо отказаться от употребления хлорированной воды, курения, чрезмерного загара. Избегать, по возможности, сильных стрессов, переутомлений, переохлаждений.
Записаться на приём к врачу-эндокринологу можно здесь
ВНИМАНИЕ : услуга доступна не во всех городах
Беседовал Игорь Чичинов
Редакция рекомендует:
Для справки :
Силиваненко Константин Анатольевич
В 1984 году окончил лечебный факультет Запорожского медицинского института.
В 1997-2000 годах - клиническая ординатура, специализация по эндокринологии в Военно-медицинской академии г. Санкт-Петербурга. Врач высшей категории.
Другие статьи по теме
Говоря о диабете, обычно подразумевают сахарный. Однако есть и несахарный диабет, а. Сахарный? Не только! Что такое несахарный диабет?
Что такое гипотиреоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., эндокринолога со стажем в 28 лет.
Над статьей доктора Курашова О. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Гипотиреоз — это заболевание эндокринной системы, возникающее из-за длительно низкого уровня тиреоидных гормонов, вырабатываемых щитовидной железой, и проблем с их воздействием на организм преимущественно на тканевом уровне.
Ежегодно на каждую тысячу человек приходится 0,6-3,5% заболевших гипотиреозом. [3] [6] [8] Данное нарушение может возникнуть в любом возрасте, но обычно оно возникает у пожилых людей старше 60 лет. [14] Среди новорождённых гипотиреоз встречается в одном случае из 4-5 тысяч.
К факторам риска относятся:
-
; ;
- подострый и послеродовой тиреоидит;
- аутоиммунные заболевания (B1-дефицитная анемия, болезнь Аддисона, сахарный диабет I типа);
- рак тканей головы и шеи (леченый);
- курение;
- болезни щитовидной железы у родственников;
- применение радиоактивного йода при лечении рака щитовидной железы ;
- приём некоторых препаратов (амиодарон, α-интерферон, карбонат лития, йод-, бромсодержащие и другие лекартсва). [15]
В 80% случаев гипотиреоз связан с поражением защитных сил организма, т. е. аутоиммунным тиреоидитом. Он является ведущей причиной первичного гипотиреоза у взрослых людей. [3]
Риск возникновения аутоиммунного тиреоидита зависит от возраста и пола пациента: у женщин в возрасте 40-50 лет он возникает в 10-15 раз чаще, чем у мужчин. [6] [9]
При аутоиммунном тиреоидите даже на фоне длительной ремиссии функциональное состояние щитовидной железы в разное время может значительно различаться. Так, с возрастом деструктивные изменения в щитовидной железе постепенно нарастают. Этот фактор, а также наличие тиреоидных аутоантител могут спровоцировать переход субклинического (скрытого) гипотиреоза, протекающего на фоне аутоиммунного тиреоидита, в явный. Частота таких случаев составляет около 5 % в год.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гипотиреоза
Симптомы гипотиреоза крайне обманчивы, разнообразны и не всегда заметны. Их проявление зависит от степени выраженности заболевания.
К основным клиническим проявлениям относятся: [9] [11] [14]
- Обменно-гипотермический синдром. Характерно постоянное чувства холода, снижение температуры тела, увеличение веса.
- Нарушение нервной системы и органов чувств. Человек становится заторможенным, вялым, появляется сонливость, ухудшается память, нарушается носовое дыхание и слух, голос становится низким и грубым, а речь замедленной. На лице и конечностях может возникнуть плотный отёк. Кожа утолщается, становится сухой и холодной, приобретает бледный окрас с желтоватым оттенком, волосы становятся тусклыми и ломкими, подверженными выпадению.
- Нарушение сердечно-сосудистой системы. Наблюдается пониженное или нормальное артериальное давление. У части пациентов возникает мягкая диастолическая гипертензия.
- Изменения со стороны ЖКТ. Замедляется перистальтика кишечника, возникают запоры, изменения желчного пузыря и его протоков, снижается аппетит, вплоть до развития анорексии.
- Анемический синдром. Из-за недостатка гормонов щитовидной железы возникает депрессия костно-мозгового кроветворения, нередко развивается В12-дефицитная и постгеморрагическая анемия, время кровотечения увеличивается.
- Дисфункция почек. Почечный кровоток и скорость клубочковой фильтрации снижаются, как и эффективность почечного плазмотока, уровень глюкозы и натрия в крови становится ниже нормы.
- Сбои репродуктивной системы. У женщин происходит нарушение овуляции, менструальные циклы становятся короткими и редкими, возникает бесплодие. В большинстве случаев развивается вторичная гиперпролактинемия, которая сопровождается самопроизвольным вытеканием молока из молочной железы и отсутствием месячных. На фоне декомпенсированного гипотиреоза беременность наступает крайне редко. Снижение либидо наблюдается у лиц обоего пола. У мужчин может развиваться эректильная дисфункция, нарушение сперматогенеза.
- Нарушение опорно-двигательной системы. Как правило, замедляется костное ремоделирование, снижается интенсивность резорбции (рассасывания) кости и костеобразования. Часто возникает снижение плотности костной ткани и рабдомиопатия, причём как с гипертрофией (увеличением) мышц, так и с их атрофией.
Патогенез гипотиреоза
Тиреоидные гормоны, которые вырабатывает щитовидная железа, называются "трийодтиронин" (Т3) и "тироксин" (Т4). Они влияют практически на все процессы, протекающие в организме. Стимулирующее влияние на них оказывает тиреотропный гормон гипофиза (ТТГ).
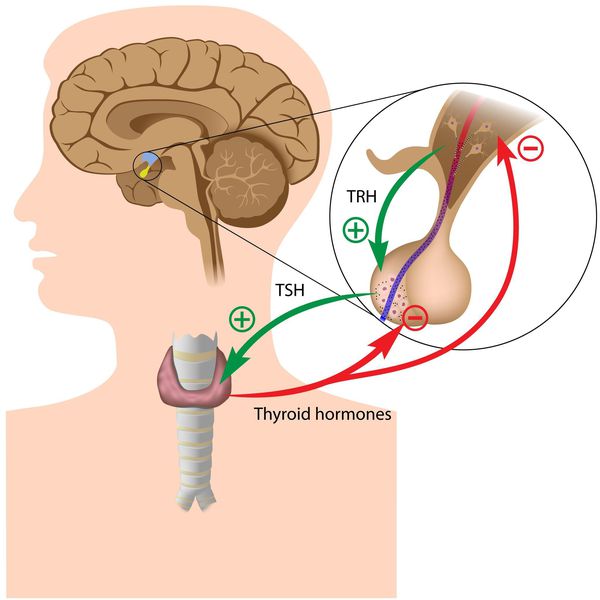
Синтез тиреоидных гормонов начинается после того, как щитовидная железа захватывает йод. Он является регулятором гормоногенеза и размножения тиреоцитов — клеток эпителия щитовидной железы. Попав в тиреоциты, йодид окисляется до активной формы при помощи тиреопероксидазы — микросомального антигена, к которому образуются антитела, в частности при аутоиммунном тиреоидите. [4] [6] [7] Уровень поступления йода изменяет чувствительность тиреоцитов к воздействию ТТГ, которая усиливается при дефиците йода. [3] [6]
Исходя из этого механизма возникновения гормонов щитовидной железы, патогенетически гипотиреоз делится на три типа:
- первичный (тиреогенный);
- вторичный (гипофизарный);
- третичный (гипоталамический);
- периферический (тканевой).
Первичный гипотиреоз возникает в 80-95% случаев и чаще всего обусловлен нарушениями общей структуры щитовидной железы, которые являются врождёнными или приобретёнными, а также сбоем секреторной функции её клеток.
Вторичный и третичный гипотиреоз возникают в 3-4% случаев. Они связаны с заболеваниями таких участков головного мозга, как аденогипофиз или гипоталамус в результате которых наблюдается стойкая нехватка гормонов щитовидной железы и нарушение секреции ТТГ гипофиза. [4] [6]
Периферический гипотиреоз развивается крайне редко — в 0-1% случаев. Основным фактором его возникновения является резистентность (сопротивляемость) тканей-мишеней (например, мозга, гипофиза, сердца, костей, печени) гормонам Т4 и Т3. [5] [6] [7]
В патогенезе аутоиммунных заболеваний щитовидной железы взаимодействуют генетические и средовые факторы. Однако точная роль тех и других не определена. Ведущее значение в гибели тиреоцитов при этих заболеваниях придают клеточным механизмам, т.е. цитотоксическим эффектам аутореактивных Т- лимфоцитов. [3] [5] Отсутствие при аутоиммунных поражениях щитовидной железы классических признаков гнойного воспаления (боли, отёка и других), обычно сопровождающих массивный некроз ткани, указывает в таких случаях на иной механизм гибели тиреоцитов. В последние годы установлено, что Т-лимфоциты способны вызывать гибель клеток-мишеней не только путём некроза, но в основном путём индукции их разрушения. [3] [5] [7] [9]
Классификация и стадии развития гипотиреоза
В Международной классификации болезней десятого пересмотра выделены две формы гипотиреоза:
- Субклинический (скрытый) гипотиреоз, развившийся в результате йодной недостаточности.
- Иные формы гипотиреоза:
- врожденный гипотиреоз с диффузным зобом;
- врождённый гипотиреоз без зоба;
- гипотиреоз, возникший по причине приёма лекарств и других экзогенных веществ;
- постинфекционный гипотиреоз;
- атрофия щитовидной железы (приобретённая);
- другие уточнённые гипотиреозы;
- неуточнённый гипотиреоз.
Первичный гипотиреоз подразделят на три большие группы:
- Врождённый гипотиреоз.
- Гипотиреоз, связанный с уменьшением количества функционирующей ткани щитовидной железы:
- возникающий после операции
- развивающийся после облучения
- вызванный аутоиммунным нарушением щитовидной железы
- связанный с вирусным заболеванием щитовидной железы
- возникающий на фоне новообразований щитовидной железы.
- Гипотиреоз, связанный с нарушением выработки тиреоидных гормонов:
- эндемический зоб — возникает в районах с йододефицитом;
- спорадический зоб с гипотиреозом — развивается в случае дефектов биосинтеза гормонов;
- медикаментозный гипотиреоз — появляется в результате приёма тиреостатиков и других препаратов;
- зоб и гипотиреоз, развившиеся в связи с употреблением продуктов, содержащих вредные вещества. [3][5][7][9]
В последнее время разработана классификация первичного гипотиреоза, которая основывается на выраженности симптомов и результатах гормональных исследований (определяющий показатель — уровень ТТГ). В неё включают:
- Субклинический (скрытый) гипотиреоз — симптомы размыты или отсутствуют, уровень ТТГ повышен, содержание Т4 в норме.
- Манифестный — возникает типичная клиническая картина гипотиреоза, уровень ТТГ повышен, концентрация Т4 снижена:
- компенсированный.
- декомпенсированный.
- Осложнённый — развивается кретинизм, сердечная недостаточность, выпот в серозные полости, вторичная аденома гипофиза. [2]
Осложнения гипотиреоза
Гипотиреоидная кома ("спячка") — это угрожающее жизни состояние, которое чаще развивается у пожилых людей, которые долгое время не лечили тяжёлый гипотиреоз, который был у них довольно долгое время. [3] [5] [7] [9]
К основным провоцирующим факторам такого осложнения относят:
- охолаждение;
- сердечно-сосудистые заболевания;
- острые инфекции;
- травмы;
- кровопотерю;
- хирургические вмешательства;
- приём алкоголя или лекарств, угнетающих функцию центральной нервной системы;
- стрессовые ситуации. [6][7][8]
При гипотиреоидной коме температура тела, как правило, снижается до 24-32,2°С, возникают судороги и угнетение дыхания. Лечение такого состояния нужно начинать незамедлительно. [14] Но даже при своевременном обнаружении осложнения и незамедлительном лечении смерть может наступить в 25-60% случаев. [15]
Но появление осложнений может вызвать не только отсутствие лечения, но и неграмотная медикаментозная терапия. Например, передозировка лекарствами может привести к избыточному синтезу гормонов щитовидной железы и патологиям со стороны сердечно-сосудистой системы. В связи с этим крайне важно соблюдать все рекомендации врача по лечению заболевания и ни в коем случае не лечиться самостоятельно.
Диагностика гипотиреоза
Диагностика гипотиреоза включает в себя подробный опрос пациента, осмотр и лабораторные исследования.
Так как симптомы гипотиреоза неспецифичны, он может скрываться под масками других заболеваний. Поэтому по проявлениям его иногда можно спутать с железодефицитной анемией, депрессией, аменореей, невритом и другими нарушениями. [15] [16] В связи с этим важную роль в определении гипотиреоза играют лабораторные исследования. Они показаны всем пациентам с нарушениями щитовидной железы и предполагают оценку уровня ТТГ и свободного Т4. [2] [12] Определение уровня Т3 в крови, как правило, не является информативным, так как при первичном гипотиреозе этот показатель находится в норме. [14]
На явное наличие гипотиреоза будет указывать высокий уровень ТТГ и низкий уровень свободного Т4 в крови. При субклиническом гипотиреозе уровень ТТГ также будет повышен, а уровень свободного Т4 будет находиться в пределах нормы.
После того как наличие гипотиреоза подтверждено, при помощи показателя ТТГ также определяется характер заболевания и наличие возможных осложнений. Уровень ТТГ также позволяет в значительном большинстве случаев оценить адекватность проводимой терапии: об этом будет свидетельствовать стойкий уровень ТТГ в крови в пределах нормы. [6] [7] [8]
В достаточно редких случаях проводят пробу с тиреолиберином для оценки аутоиммунных заболеваний щитовидной железы. [6] [9] [15]
Дополнительные методы диагностики, такие как УЗИ щитовидной железы, сцинтиграфия или пункционная биопсия, используются для уточнения характера и степени выраженности заболевания. [6] [11] [12] [16]
Так как с возрастом учащаются случаи узлового зоба, выраженный шейный кифоз может смещать трахею кзади и вниз, что затрудняет пальпаторную оценку состояния щитовидной железы, в результате чего своевременная диагностика заболевания не проводится. [4] [5] [6] [7] [8]
В связи с тем, что гипотиреоз не всегда проявляет себя, среди населения принято проводить массовую диагностику данного заболевания — скрининг. Так, определение уровня ТТГ позволяет обнаружить первичный гипотиреоз у людей без каких-либо других его проявлений, а также у новорождённых (исследование проводится на 4-5 сутки жизни). При планировании беременности и на ранних её сроках также важно пройти исследование на гипотиреоз. [3] [5] [7] [9]
Лечение гипотиреоза
Цель лечения гипотиреоза — это поддержание уровня ТТГ в пределах 0,5-1,5 мМЕ/л.
Единственным методом лечения является пожизненная заместительная терапия. Начинать её стоит при уровне ТТГ более 10 мЕД/л, высоких титрах антител к ТПО и других показателях. Для этого предпочтительны препараты левотироксина натрия. Его применение противопоказано лишь в случае нелеченого тиреотоксикоза и недостаточности коры надпочечников, остром инфаркте миокарда, аллергии и индивидуальной непереносимости препарата. [16]
Обычно лечение проводится в условиях стационара. Показаниями к госпитализации пациентов с гипотиреозом служат:
- тяжёлая степень заболевания;
- наличие выраженной сердечной патологии;
- гипотиреоидная кома.
Заместительная терапия первичного (манифестного) гипотиреоза показана пожизненно с назначением тироксина в средней дозе 1,6-1,8 мкг/кг. Пациентам с кардиальной патологией доза рассчитывается, исходят из расчёта 0,9 мкг/кг. Стоит отметить, что в связи с уменьшением метаболизма тиреоидных гормонов потребность в них с возрастом снижается. [5] [7] [9]
Дозы тироксина зависят от причин и патогенеза заболевания. Потребность в препарате у людей со спонтанным гипотиреозом выше, чем у пациентов с гипотиреозом, возникшим после хирургического лечения и применения радиоактивного йода.
Уровень ТТГ при диагностике гипотиреоза напрямую связан с оптимальной заместительной дозой тироксина: у большинства женщин она составляет 75-100 мкг, а у мужчин — до 150 мкг в день приёма.
Первый контроль уровня ТТГ после начатого лечения проводят через 2-3 месяца, затем один раз в шесть месяцев (при обязательном условии соблюдения пациентом схемы лечения). [6] [9] [13]
При субклиническом гипотиреозе существует риск развития манифестной формы заболевания со всеми характерными проявлениями. Так, явный гипотиреоз возникает у 20-50% пациентов в течение 4-8 лет, а присутствие антитиреоидных антител увеличивает риск до 80%. [8] [9] [10] Потому людям со скрытым гипотиреозом следует длительно наблюдаться у специалистов.
Проблемы при лечении гипотиреоза
Лечение тироксином безопасно, просто и сравнительно дешево. Но, несмотря на многолетний опыт его использования, при нём всё же могут возникать многие проблемы. Основная из них связана с несоблюдением пациента схемы лечения. Так, одновременное повышение уровней Т4 и ТТГ, по всей вероятности, будет указывать на то, что за несколько дней до визита к врачу пациент не выполнял его назначений.
Снижение эффективности установленной дозы тироксина часто связано с меньшим содержанием гормона в таблетках (например, в непатентованных препаратах) или взаимодействием лекарств при одновременном приёме других препаратов. [9] [13]
Недостаточность дозы также может быть связана с уменьшением всасывания тироксина, нарушением энтеропечёночного кровотока, ускорением кругооборота или выделением гормона с мочой, медленным снижением тиреоидной функции после лечения гипертиреоза.
Существуют и другие особенности и проблемы при лечении гипотиреоза. [6]
Лучшим критерием подбора дозы тироксина при аутоиммунном тиреоидите является исследование ТТГ и свободного Т4. При этом лечение нацелено на компенсацию гипотиреоза благодаря той же заместительной терапии и редукция зоба при помощи супрессивной терапии. [6] [9] Критериями эффективности лечения при этом будут служить:
- уменьшение зоба в объёме;
- снижение плотности щитовидной железы;
- уменьшение титра антител до нормы;
- поддержание уровня ТТГ в пределах нормы.
Назначение препаратов тиреогормонов при аутоиммунном тиреоидите без нарушения функции щитовидной железы нецелесообразно, а операция может привести к состоянию, способному значительно ухудшить качество жизни пациента с возможностью развития тяжёлого гипотиреоза и инвалидизации. [9] [13]
Прогноз. Профилактика
Прогноз заболевания при своевременной диагностике и лечении благоприятный. [10] Осложнить его, особенно в отношении трудоспособности и состояния здоровья в целом, могут фибрилляция предсердий и выраженная сердечная недостаточность, развивающиеся на фоне тиреотоксикоза. [5]
Специфической профилактики заболевания не существует. Снизить риск развития гипотиреоза можно только при помощи сбалансированного правильного питания , употребления достаточного количества йода с пищей (включения в рацион морепродуктов) и контроля гормонального баланса. Крайне важно проходить профилактические осмотры и являться на контрольные приёмы к лечащему врачу. [5] [11] [12]
В качестве неспецифической профилактики патологий щитовидной железы стоит проходить санаторно-курортное лечение по показаниям врача.
Доказано, что медикаментозная терапия при гипотиреозе становится более эффективной в сочетании с радоновыми процедурами, а азотные ванны, не содержащие радон, оказывают профилактическое воздействие. [1] [5] Благодаря этому удаётся добиться стойкости ремиссии заболевания.

Рекомендуется проведение до трёх курсов таких процедур с интервалом от 8 до 12 месяцев. Подбор схем лечения в санатории (в т.ч. медикаментозных), рациональное использование природных и климатических факторов определяют ближайший и отдалённый результат оздоровления.
Читайте также:

