Аутоиммунный панкреатит и вич
Обновлено: 17.04.2024
Первый Московский государственный медицинский университет им. И.М. Сеченова
Аутоиммунный панкреатит: новые представления о патогенезе, диагностике и лечении
Журнал: Доказательная гастроэнтерология. 2013;(1): 22‑27
Охлобыстин А.В. Аутоиммунный панкреатит: новые представления о патогенезе, диагностике и лечении. Доказательная гастроэнтерология. 2013;(1):22‑27.
Okhlobystin AV. Autoimmune pancreatitis: new concepts of pathogenesis, diagnostics, and treatment. Russian Journal of Evidence-Based Gastroenterology. 2013;(1):22‑27. (In Russ.).
Первый Московский государственный медицинский университет им. И.М. Сеченова
Изложены основные представления об аутоиммунном панкреатите как о заболевании, имеющем сложный патогенез, включающий не только собственно аутоиммунные, но и инфекционные, наследственные факторы. Показана сложность диагностики в связи с отсутствием типичных клинических, лабораторных и инструментальных признаков. Представлены основные морфологические признаки двух типов заболевания, критерии диагностики клиники Мейо (HiSORT), которые позволяют в большинстве случаев правильно дифференцировать аутоиммунный панкреатит и рак поджелудочной железы. Определены основные подходы к лечению - небходимость стероидной терапии в начальную фазу заболевания и ферментной заместительной терапии в поздние сроки.
Первый Московский государственный медицинский университет им. И.М. Сеченова
Согласно современному определению, аутоиммунный панкреатит (АИП) - это системное воспалительное заболевание с выраженным фиброзом, которое поражает не только поджелудочную железу (ПЖ), но и ряд других органов, включая желчные протоки, слюнные железы, забрюшинную клетчатку, лимфатические узлы. В вовлеченных органах наблюдается лимфоплазмоцитарная инфильтрация (клетки дают положительную окраску на IgG 4 ). Заболевание успешно поддается терапии стероидными препаратами [1].
Тем не менее АИП - это редкое заболевание. При оценке с использованием диагностических критериев Японского панкреатологического общества его распространенность в Японии на 2002 г. составляла всего 0,82 случая на 100 тыс. населения [5]. Больные АИП составляют 5-6% от общего числа всех случаев хронического панкреатита. В США выявлено 43 случая (2,4%) АИП на 1808 резекций ПЖ. Мужчины болеют примерно в 2-3 раза чаще женщин, 85% больных АИП старше 50 лет.
Обнаружена связь заболеваемости АИП с наследственными факторами: сцепленность с серотипами HLA DRB1*0405 и DQB1*0401, по данным исследований, проведенных в Японии, и HLA DQβ1-57 - в Корее [6].
Продолжаются исследования возможной роли аутоиммунных факторов в патогенезе данного заболевания. Так, показано, что сывороточные IgG 4 больных АИП связываются с нормальным эпителием протоков ПЖ, желчных протоков, протоков слюнных желез.
К потенциальным аутоантигенам относят карбоангидразу, лактоферрин, панкреатический секреторный ингибитор трипсина и трипсиногены, однако они неспецифичны и не могут быть использованы для диагностики [7]. Выявляют антинуклеарный фактор, антилактоферрин, антитела к карбоангидразе-2, ревматоидный фактор, антитела к гладкой мускулатуре. Карбоангидразы распределены преимущественно в желудочно-кишечном тракте, а также в дистальных канальцах почек, бронхиальном дереве. Таким образом, наличие аутоантител к этому ферменту может объяснять механизм сочетанного иммунного поражения органов пищеварения, почек и легких, клетки которых несут на своей поверхности антигены-мишени [8, 9]. Аналогично этому, лактоферрин определяется во многих человеческих тканях, включая бронхиальные, слюнные, желудочные железы, панкреатические ацинусы. Лактоферрин также может выступать в роли антигена-мишени, вызывая клеточно-опосредованный иммунный ответ при этом заболевании. К настоящему времени выделен только один белок сыворотки массой 13,1 кД, который может быть специфическим аутоантигеном [10].
Интересна взаимосвязь аутоиммунных и инфекционного факторов - выявлена молекулярная мимикрия: обнаружены антитела к плазминогенсвязывающему белку и UBR2 пилорического хеликобактера [11].
Морфологически заболевание проявляется склеротическими изменениями ПЖ без псевдокист или кальцификации/конкрементов, т.е. без признаков предшествующего острого и/или алкогольного панкреатита. Характерна лимфоплазмоцитарная инфильтрация стенок протоков T- и B-лимфоцитами, иногда также эозинофилами и нейтрофилами. Наблюдаются сужение и разрушение стенок протоков. Воспалительная инфильтрация распространяется на дольки ПЖ, нередко наблюдается флебит. При АИП выделяют диффузные, сегментарные и очаговые формы поражения ПЖ. В типичных случаях воспаление охватывает более 1 / 3 органа. Как и при других формах хронического панкреатита (ХП), возможно возникновение кальцификации ПЖ. В 2009 г. были описаны две формы АИП: лимфоплазмоцитарный склерозирующий панкреатит и идиопатический перипротоковый панкреатит [12]. Для обеих форм основным морфологическим признаком является преимущественное поражение протоков ПЖ. Однако при АИП 1-го типа выявляют выраженную лимфоплазмоцитарную инфильтрацию с большим количеством клеток, дающих положительную окраску на IgG 4 , облитерирующий флебит, вихревидные фиброзы. При АИП 2-го типа в инфильтрате преобладают нейтрофилы, которые образуют скопления наподобие микроабсцессов, менее выражен флебит и фиброзирование. Обычно отмечаются потеря дольчатой структуры, минимальная реакция перипанкреатического жира, редко выявляется увеличение регионарных лимфатических узлов.

У многих пациентов возникает существенное увеличение головки ПЖ, что приводит к сдавлению общего желчного протока, очень часто боли в животе отсутствуют или гастроэнтерологическая симптоматика носит стертый характер. Острый панкреатит и панкреатит тяжелого течения возникают редко (рис 1). Рисунок 1. Клинические проявления АИП.
К настоящему времени в мире существует большое количество национальных критериев диагностики АИП: Американские (критерии клиники Мэйо), Японские, Корейские, объединенные азиатские, Немецкие (критерии Маннгейм) [13]. Наиболее тщательно разработаны критерии HiSORT (клиника Мэйо) [14]. Система HiSORT включает в себя следующие группы признаков:
Диагностические критерии дают следующие уровни вероятности диагностики АИП:
- уровень A: типичные гистологические признаки. Наличие одного или более из следующих признаков:
- участок ткани с характерными особенностями лимфоплазмоцитарного склерозирующего панкреатита;
- не менее 10 IgG 4 + -клеток в поле зрения на фоне лимфоплазмоцитарной инфильтрации;
- уровень B: типичные лабораторно-инструментальные данные. Наличие всех признаков:
- диффузная неравномерность просвета Вирсунгова протока при эндоскопической ретроградной панкреатикографии;
- повышение уровня IgG 4 сыворотки;
- уровень C: положительный ответ на стероидные гормоны. Наличие всех признаков:
- исключение всех других причин поражения ПЖ;
- повышение уровня IgG 4 сыворотки или поражение других органов, подтвержденное обнаружением большого количества IgG 4 + -клеток;
- исчезновение/значительное улучшение панкреатических или внепанкреатических изменений на фоне терапии стероидами.

Важно, чтобы диагностика ex juvantibus с помощью пробной терапии стероидами применялась только при уверенности в отсутствии опухоли. Тонкоигольной биопсии недостаточно для определения типа АИП (чувствительность составляет 33%), как и для дифференциальной диагностики АИП и аденокарциномы ПЖ. Золотым стандартом является получение морфологического материала при толстоигольной биопсии, краевой биопсии или после резекции ПЖ (табл 2).
Лечение
Назначение стероидов с лечебной целью обеспечивает купирование клинических проявлений панкреатита или внепанкреатических поражений, восстановление размеров и структуры ПЖ (при отсутствии выраженного фиброза). Минимальная эффективная доза преднизолона при АИП - 30-40 мг/сут. Клинический эффект наступает обычно через 2-3 нед лечения; нормализация лабораторно-инструментальных данных - через несколько недель или месяцев.
При сочетании АИП с ретроперитонеальным фиброзом доза может быть увеличена в 2 раза. Длительность курса стероидной терапии зависит от клинического ответа, побочных эффектов, наличия сопутствующих аутоиммунных заболеваний, а также необходимости их лечения. Стероидная терапия обычно эффективна и при поражении желчных протоков, слюнных желез. Только в редких случаях состояние больных спонтанно улучшается без применения лекарственных препаратов.
С того момента, когда глюкокортикостероиды (ГКС) начали успешно применять для лечения АИП, немногое известно о состоянии пациентов после достижения клинической ремиссии. T. Nishino и соавт. [15] провели исследование отдаленных результатов стероидной терапии. Авторы более 1 года наблюдали за 12 пациентами. Исходно увеличение размеров ПЖ и неравномерное сужение Вирсунгова протока имели все больные, стриктуры холедоха - 10 человек. Все больные получали преднизолон в начальной дозе 30-40 мг/сут с последующим снижением. Нормализация размеров ПЖ и разрешение стеноза Вирсунгова протока отмечены у всех больных. Стриктуры желчных протоков уменьшились в разной степени во всех случаях, однако у 4 (40%) пациентов стриктуры терминальной части холедоха сохранялись длительно. Рецидивов АИП в дальнейшем не отмечено. Атрофия ПЖ развилась у 4 (33%) из 12 пациентов. Ухудшения экзокринной функции ПЖ на фоне терапии ГКС, эпизодов лекарственного панкреатита не отмечено. Эти результаты предполагают, что большинству больных АИП стероиды обеспечивают благоприятный и долгосрочный эффект. При длительной терапии преднизолоном необходим контроль течения заболевания, включающий оценку симптомов, диагностику нарушений экзо- и эндокринной функции ПЖ, контроль уровня IgG 4 и размеров ПЖ, а также состояния протоков по данным КТ/МРТ. Для пациентов с бессимптомными и неосложненными формами АИП рекомендации по ведению не разработаны.
Предпринимаются попытки для поддержания ремиссии использовать азатиоприн [16], микофенолат мофетила [17] и метотрексат [18]. Однако эффективность этих препаратов (в отличие от преднизолона) в клинических исследованиях не доказана.
У больных с рефрактерным течением заболевания применяют ритуксимаб [19], который снижает число B-лимфоцитов, что обеспечивает быстрый клинический ответ и снижение уровня IgG 4 .
При морфологически верифицированном диагнозе АИП можно рекомендовать расширение терапии с включением в схему (дополнительно к преднизолону) ферментных препаратов, ингибиторов протонной помпы. С симптоматической целью по показаниям можно использовать спазмолитики и нестероидные противовоспалительные препараты. По данным K. Tsubakio и соавт. [20], получен клинический эффект препаратов урсодезоксихолевой кислоты при АИП, протекающем с синдромом холестаза на фоне стеноза терминального отдела холедоха. Препарат в дозе 12-15 мг/кг может эффективно использоваться при АИП, особенно если в патологический процесс вовлечена билиарная система.
При значительном увеличении ПЖ и нарушении оттока панкреатического секрета показано назначение панкреатических ферментов, антисекреторных препаратов и спазмолитиков по схеме, применяемой для лечения болевой формы ХП. Рекомендуется принимать препараты в виде минимикросфер по 25-40 тыс. ед. при основных приемах пищи (в начале приема пищи) и 10-25 тыс. ед. при приеме небольшого количества пищи. Поскольку острые формы с деструкцией ПЖ встречаются редко, голод, блокада желудочной секреции, антибактериальные препараты обычно не требуются. Если у пациента возникают симптомы обструктивной желтухи, показано чрескожное чреспеченочное или же эндоскопическое ретроградное дренирование, особенно при присоединении бактериальной инфекции. Если малоинвазивные подходы к разрешению желтухи безуспешны, больному может быть проведена холецисто- или гепатикоэнтеростомия [21].
Несмотря на то что АИП не имеет многих характерных клинических проявлений, присущих панкреатиту другой этиологии, при этом варианте заболевания также наблюдается исход в экзокринную панкреатическую недостаточность. Это объясняют разрушением функционально-активной паренхимы ПЖ: обнаружены антитела к трипсиногенам 1 и 2, ряду других ацинарных антигенов: амилазе α-2A, лактоферрину, панкреатическому секреторному ингибитору трипсина, лептину. У больных выявлено уменьшение количества трипсинсодержащих ацинарных клеток. Вклад в развитие проблемы также может вносить выраженное фиброзирование ПЖ. По существующим данным, у 34% больных АИП через 3 года возникает экзокринная недостаточность ПЖ. Адекватная заместительная терапия должна обеспечивать полное купирование симптомов и нормализацию трофологического статуса. Для этого показано назначение минимикросферических ферментов в дозе 40 тыс. ед. с каждым приемом пищи (5-6 раз в сутки). В дальнейшем дозу ферментов корректируют, добиваясь нормализации индекса массы тела и других трофологических показателей (например, уровня ретинолсвязывающего белка).
Прогноз при АИП зависит от тяжести осложнений, сопутствующих аутоиммунных заболеваний и сахарного диабета.
Таким образом, согласно современной классификации ХП, АИП выделен в самостоятельную нозологическую форму, его патогенез обусловлен преимущественно аутоиммунными нарушениями наряду с генетическими и инфекционными факторами. Для этой формы ХП характерно повышение уровня сывороточного 0xE3;-глобулина или IgG, наличие аутоантител, диффузное увеличение ПЖ и диффузное неравномерное сужение главного панкреатического протока. Терапия с применением ГКС эффективно уменьшает воспаление в ПЖ, однако долгосрочные эффекты стероидов в отношении АИП изучены мало.
В статье собраны и проанализированы имеющиеся сведения о патогенезе, особенностях диагностики и течения острого панкреатита у ВИЧ-инфицированных пациентов на основе зарубежных наиболее цитируемых научных работ за последние годы.
Пациенты с ВИЧ/СПИДом могут быть подвержены широкому спектру факторов развития ОП, таких как условно-патогенные инфекции, новообразования и метаболические изменения вследствие применения антиретровирусных препаратов. С введением комбинированных антиретровирусных препаратов проявились новые метаболические нарушения, такие как стеатоз печени и лактоацидоз, так же оказывающие токсическое влияние на поджелудочную железу.
Анализ произведен по признакам отличия от популяции без ВИЧ-инфекции, наличия ВААРТ, лабораторным и морфологическим особенностям, коморбидности по вирусным гепатитам, степени иммуносупрессии и гендерному признаку. Проведено сравнение течения панкреатита у пациентов с ВИЧ и в общей популяции.
В результате сформированы наиболее актуальные для изучения вопросы по данной тематике.
Ключевые слова: ВИЧ, панкреатит.
ACUTE PANCREATITIS IN HIV-INFECTED PATIENTS: THE CURRENT DEVELOPMENTS
Petri S.I. 1, *, Darvin V.V. 2
1 ORCID: 0000-0002-8509-6691;
2 ORCID: 0000-0002-1121-9636;
1, 2 Surgut State University, Department of Surgical Diseases, Surgut, Russia
Abstract
The current article collects and analyzes the available data about the pathogenesis, features of the diagnosis and course of acute pancreatitis in HIV-infected patients on the basis of the most cited foreign research works in recent years.
Patients with HIV / AIDS may be exposed to a wide range of acute pancreatitis development factors, such as opportunistic infections, neoplasms, and metabolic changes due to the use of antiretroviral drugs. With the introduction of combined antiretroviral drugs, new metabolic disorders, such as hepatic steatosis and lactic acidosis, also have a toxic effect on the pancreas.
The analysis was performed based on the signs of differences from the population without HIV infection, the presence of HAART, laboratory and morphological characteristics, comorbidity for viral hepatitis, the degree of immunosuppression, as well as gender differences. The course of pancreatitis in patients with HIV and in the general population was also compared.
As a result, the study forms the most relevant research issues on this topic.
Keywords: HIV, pancreatitis.
Введение
Инфекция вируса иммунодефицита человека (ВИЧ) и синдром приобретенного иммунодефицита (СПИД) являются проблемами общественного здравоохранения во всем мире. Внедрение комбинированного антиретровирусного лечения, известного под аббревиатурой ВААРТ – высокоактивная антиретровирусная терапия, для лечения ВИЧ/СПИДа, позволило добиться ремиссии вируса ВИЧ-1 в течение длительных периодов времени, улучшая качество жизни этих людей и способствуя снижение числа осложнений и смертей, связанных с вирусом ВИЧ.
По данным UNAIDS [31] в 2019 году в мире количество людей, инфицированных ВИЧ-инфекцией, составило 38 (31,6–44,5) миллионов человек, 26 (25,1–26,2) миллионов человек проходили лечение антиретровирусными схемами терапии. Количество новых случаев инфицирования ВИЧ достигло 1,7 (1,2-2,2) миллионов человек за 2019 год. В 2019 году количество пациентов, умерших от сопутствующих СПИДу заболеваний составило 690 000 (500 000–970 000) человек. Для наглядности приведем показатели 2004 года, составлявшие 1,7 (1,2–2,4) миллионов человек и 1,1 (830 000– 1,6) миллионов человек в 2010 году.
В настоящее время Россия – единственная страна в мире, использующая принцип широкого охвата населения обследованием на ВИЧ и индивидуальный (полицевой) учет всех пациентов [1].
Несмотря на все плюсы антиретровирусной терапии, длительное лечение АРВТ-препаратами вызывает выраженные токсические эффекты. Частота острого панкреатита (ОП) может достигать в отдельных регионах 40% от числа ВИЧ-положительных пациентов, что значительно выше, чем среди населения в целом, заболеваемость которого составляет 2% [24].
Поражение поджелудочной железы у пациентов в стадии СПИД было обычным явлением в посмертных исследованиях в период до ВААРТ, так как вирус иммунодефицита человека напрямую разрушительно воздействует на поджелудочную железу. Chehter et al.[8] обнаружили атрофию ацинарных клеток в 60% образцов из 109 посмертных поджелудочных желез, в дополнение к уменьшению гранул зимогена (52%) и изменений ядра (64%).
Кроме того, Cappell и Marks [3] показали, что лишь 25% ВИЧ-серопозитивных пациентов, подвергшихся УЗИ брюшной полости, и лишь 33% из тех, кто был подвергнут КТ-сканированию, имели патологию поджелудочной железы, включая очаговые или диффузные увеличения, расширение Вирсунгова протока, формирование псевдокист и абсцессов.
В эпоху до ВААРТ пентамидин и диданозин четко коррелировали с увеличением частоты ОП, что объяснялось длительным лечением высокими дозами антиретровирусных препаратов и тяжелой иммуносупрессией [21].
Пациенты с ВИЧ/СПИДом подвержены широкому спектру факторов развития ОП, таких как условно патогенные инфекции, злокачественные и доброкачественные новообразования, а также дисметаболические явления вследствие применения антиретровирусных препаратов. С введением комбинированных схем лечения стали проявляться новые метаболические нарушения, такие как стеатоз печени и лактоацидоз, также оказывающие токсическое влияние на поджелудочную железу [25], [26].
Цель настоящей работы – обобщить имеющиеся сведения о патогенезе, особенностях диагностики и течения острого панкреатита у ВИЧ-инфицированных пациентов.
Основная часть
Сравнение течения панкреатита у пациентов с ВИЧ и в общей популяции
В популяции ВИЧ-инфицированных пациентов заболеваемость острым панкреатитом достигает 40% по сравнению с 2% в общей популяции [21].
Медицинским институтом в Нью-Джерси проведено ретроспективное исследование, в котором осуществлено прямое сравнение 44 пациентов с острым панкреатитом и ВИЧ и 44 контрольных пациентов с острым панкреатитом без ВИЧ. В результате выявлено, что панкреатит у пациентов сравниваемых групп проявляется аналогично, кроме некоторых значимых отличий, например таких, как высокая частота панкреатита, связанного с приемом лекарств (чаще всего препаратов ВААРТ), низкая частота панкреатита, связанного с холелитиазом, дополнительные симптомы, обусловленные степенью иммуносупрессии (тяжелые анемии, гипоальбуминемии и лейкопении и повышение частоты лихорадки, диареи, и гепатомегалии) и увеличенная длительность стационарного лечения. В этом же исследовании показано, что шкала APACHE II может быть использована у больных с ВИЧ для прогнозирования длительности госпитализации или летального исхода в стационаре. Шкала APACHE II сравнивалась со шкалами Рэнсона и модифицированной Глазго, последние показали себя плохими предикторами тяжести заболевания у пациентов с ВИЧ, что связано в первую очередь с отсутствием у этих шкал маркеров иммуносупрессии [3]. В исследовании Bhurwal A. et al. [20] с ВИЧ-инфекцией был связан с 1% всех острых панкреатитов. Несмотря на то, что ВИЧ-статус связан с более высокой частотой полиорганной недостаточности и длительным стационарным лечением, смертность в стационаре значительно не повышается при контроле факторов при многомерном анализе. В исследовании Anderson F., Thomson S. R. Показано, что, несмотря на тот факт, что панкреонекроз был более распространенным при ВИЧ-ассоциированном панкреатите, смертность была одинаковой [19].
Зависимость от АРВТ
В течение последнего десятилетия в нескольких исследованиях ставился вопрос о том, является ли ВААРТ причиной возникновения панкреатита. До начала ВААРТ в нескольких докладах под подозрение попадали такие нуклеозидные ингибиторы обратной транскриптазы (НИОТ), как диданозин и ставудин [5], [6], [7]. Связь между НИОТ и острым панкреатитом была впервые отмечена вскоре после их введения для лечения ВИЧ в середине 90-х годов. Наиболее выраженным патологическим воздействием на поджелудочную железу при этом обладал ставудин [21]. Из различных комбинаций НИОТ, изученных Reisler et al [5], частота панкреатита для ингибиторов обратной транскриптазы с одним, двумя и тремя нуклеозидами была одинаковой, показатели же частоты развития панкреатита в группах с диданозином зависели от дозы. Частота панкреатита в группах диданозин/гидроксимочевина существенно не отличалась от показателей для одного диданозина. Общие показатели острого панкреатита для исследований диданозин/ставудин были высокими. Самые высокие показатели наблюдались при комбинации индинавир/диданозин/ставудин с включением или исключением гидроксимочевины. Тем не менее, несмотря на большое количество наблюдений (8451 человек), исследователи наблюдали значительную вариабельность показателей заболеваемости острым панкреатитом среди различных групп исследования.
Острый панкреатит может быть вызван прямым воздействием вируса на ткани поджелудочной железы, либо, чаще всего, схемами антиретровирусных препаратов (ВААРТ), такими как нуклеозидный ингибитор обратной транскриптазы или ингибиторы протеаз, которые вызывают гипертриглицеридемию, которая впоследствии вызывает острый панкреатит [22].
Терапия ВААРТ на основе ингибиторов протеазы (ИП) была впервые введена в 1996 году, после чего обнаружено значительное увеличение гипертриглицеридемического панкреатита после введения и широкого применения ИП. Manfredi и соавт. [29] доказали повышенный риск развития панкреатита при воздействии ВААРТ на основе ИП, однако, это исследование включало в анализ эпизоды как клинического, так и субклинического (т.е. только лабораторного – по меньшей мере, трехкратного увеличения уровней сывороточной амилазы и/или липазы).
При этом в исследовании Raza S. et al. [4] только треть пациентов с диагнозом ОП проходили терапию ВААРТ, что позволило предположить, что другие факторы риска по крайней мере в равной степени способствуют развитию острого панкреатита у пациентов с низким уровнем CD4. ИП могут вызывать метаболические нарушения, включая развитие резистентности к инсулину, гипергликемию, гиперхолестеринемию и гипертриглицеридемию. Однако уровни триглицеридов могут быть и нормальными. Согласно нескольким исследованиям, никакого значительного увеличения частоты острого панкреатита не происходит после введения ИП для лечения [23].
Anderson F., Thomson S. R. [19] в своем исследовании связали антиретровирусную терапию с острым панкреатитом у 35,8% из 106 пациентов, имевших панкреатит в сочетании с ВИЧ.
В серии исследований Cappell and Marks, [3] среди 18 пациентов с ОП, пентамидин был признан причинным фактором в 12 случаях, за ним следовали диданозин (в 4 случаях) и сульфаметоксазолтриметоприм (в 2 случаях). Riedel D. J. et al. [27] в своем исследовании при проведении многомерного анализа связали острый панкреатит c применением аэрозольного пентамидина и ставудина, при этом не найлено никаких доказательств того, что более новые антиретровирусные препараты, включая ИП (например, атазанавир и лопинивир / ритонавир), НИОТ (например, тенофовир и абакавир) или ННИОТ (например, эфавиренц), были связаны с повышенным риском развития панкреатита.
Лабораторные показатели при панкреатите у ВИЧ-инфицированных пациентов
Во многих исследованиях отсутствует комплексный подход к определению понятия острого панкреатита. Используется либо клиническая диагностика панкреатита (высокая специфичность), с недооценкой уровня заболеваемости, либо определение панкреатита с лабораторной точки зрения (высокая чувствительность), которая, напротив, завышает уровень заболеваемости [5], особенно в исследованиях, использующих в качестве однозначного признака острого панкреатита уровни амилазы. Высокие уровни сывороточной амилазы могут отражать высокие уровни изоамилазы S-типа, секретируемой главным образом слюнными железами, что обычно наблюдается при гиперплазии слюнной и околоушной желез [11].
Кроме того, гиперамилаземия может быть связана с почечной недостаточностью, патологией печени, мальабсорбцией в желудочно-кишечном тракте, заболеваниями женской половой сферы, неспецифицеским ацидозом, онкологической патологией и ВИЧ-инфекцией [11], [12], [13]. В свою очередь, гиперлипаземия может быть связана с почечной недостаточностью, болезни печени [12], [13], [14], онкопатологией [15] и ВИЧ [13].
Хотя уровень сывороточной липазы обладает большей чувствительностью и специфичностью в отношении острого панкреатита, чем анализ сывороточной амилазы, могут возникать несоответствия, обусловленные высоким биологическим разбросом в результатах конкретного пациента и методов калибровки аппаратуры [16]. В исследовании Riedel D. J. et al. [27] среди 85 больных острым панкреатитом средний уровень амилазы составлял 445 ед / л (диапазон 73–4924 ед / л), а средний уровень липазы составлял 393 ед / л (диапазон 39–7770 ед / л). Calleja и Barkin [17] предложили для улучшения специфичности анализа липазы увеличение верхней границы нормы в 3 раза. Это предложение поддержано наблюдениями Byrne et al. [18], выявившими, что слабое повышение уровня ферментов поджелудочной железы (менее чем в 3 раза по сравнению с верней границей нормы) не сопровождалось значительными изменениями в поджелудочной железе.
Морфологические особенности
Chehter и др. [8] посмертно изучили поджелудочную железу у 109 пациентов со СПИДом и 38 контрольных пациентов и обнаружили в группе ВИЧ-инфицированных пациентов ацинарную атрофию в 60% случаев, небольшое количество гранул зимогена в ацинарной цитоплазме (52%), аномалии в ацинарном ядре (65%), стеатоз поджелудочной железы (66%) и очаговый некроз (17%).
Ferreira F. M. et al. [30] в своем исследовании двух групп пациентов (С АРВТ и без АРВТ) показали значимые различия между группами, островки Лангерганса были склонны к гипертрофии в группе высокоактивной антиретровирусной терапии и не имели изменений в контрольной группе.
Коморбидность с вирусными гепатитами
Одним из важных наблюдений в исследовании Raza S. et al. [4] была высокая распространенность инфекций вируса гепатита С и вируса гепатита В у ВИЧ-инфицированных пациентов. Ранее Reisler и соавторы [5] так же сообщали об аналогичных результатах в своем исследовании. Повышенная распространенность вирусов гепатита В и С подняла несколько вопросов о тяжести острого панкреатита у этих пациентов. Также возможно, что вирус ВИЧ сам по себе или сопутствующая инфекция вирусным гепатитом B и гепатитом C могли утяжелять течение панкреатита.
Иммунный статус
Гендерный фактор
В исследованиях Reisler R. B. et al. и Mocroft A. et al. [5], [6] сообщалось, что женский пол является потенциальным фактором риска острого панкреатита, как и в исследовании Dragovic G. et al. [28], которые обнаружили связь между женским полом и острым панкреатитом. В двухфакторном анализе факторы риска острого панкреатита Riedel D. J. et al. [27] включали женский пол. Тогда исследователи выдвинули гипотезу, что меньшая масса тела может увеличить токсичность НИОТ.
В ретроспективном анализе Moore et al. [10] также предполагают, что к значительным факторам риска панкреатита относится женский пол, но в то же время некоторые другие исследования, такие как Cappell и Marks [3], обнаружили повышенный риск развития панкреатита у мужчин. В исследовании Bhurwal A. et al. [20] ВИЧ-ассоциированный панкреатит так же наблюдался чаще у мужчин.
Raza S. et al. [4] и Manfredi R. et al. [29] не обнаружили никакой гендерной связи с процентным соотношением мужчин и женщин.
Заключение
Приведенный анализ свидетельствует о довольно низкой активности научного сообщества в отношении изучения хирургической патологии при ВИЧ-инфекции в целом и острого панкреатита в частности. Достоверно можно судить об отсутствии зависимости гендерной принадлежности пациента и тяжести течения панкреатита. Так же не вызывает сомнений наличие четкой связи между тяжестью течения острого панкреатита и степенью иммунносупрессии, что подтверждено как минимум пятью авторами в своих исследованиях. В отношении антиретровирусных препаратов наибольшую панкреатогенную активность представляет ставудин и комбинации с ним, тогда как более новые антиретровирусные препараты не ассоциируются в настоящее время с токсическим воздействием на поджелудочную железу. Справедливости ради надо отметить, что исследований подобного рода в настоящее время недостаточно, чтобы сделать однозначные выводы.
Острый панкреатит и панкреонекроз при сравнении групп ВИЧ-инфицированных пациентов и без ВИЧ-инфекции показывал большую частоту возникновения и повышенную тяжесть течения заболевания в первой группе, однако, на итоговую летальность в обеих популяциях это не влияло. Тяжелое течение и высокая заболеваемость в этом случае, вероятно, связаны с наличием сопутствующих инфекционных заболевания, таких, например, как вирусные гепатиты, наличие которых утяжеляло течение панкреатита.
Корреляция тяжести панкреатита у ВИЧ-инфицированных пациентов и уровней панкреатоэнзимемии так же весьма вариабельна и подлежит более углубленному изучению.
В настоящее время представляются наиболее актуальными следующие вопросы изучения панкреатита у ВИЧ-инфицированных пациентов:
- Частота возникновения панкреатита у ВИЧ-инфицированных пациентов на фоне приема препаратов ВААРТ с учетом режима дозирования и комбинаций препаратов.
- Изучение функционального состояния поджелудочной железы у ВИЧ-инфицированных пациентов без ВААРТ и на фоне терапии, изучение корреляции триглицеридемии, липаз- и амилаземии с вероятностью развития острого панкреатита.
- Зависимость тяжести течения панкреатита от имеющейся у пациента сопутствующей инфекционной и неинфекционной патологии.
- Разработка высокочувствительных алгоритмов ранней диагностики панкреатита у ВИЧ-инфицированных пациентов с учетом коморбидности, иммунного статуса и функционального состояния поджелудочной железы.
Список литературы / References
Список литературы на английском языке / References in English
Медикаментозный панкреатит – воспаление поджелудочной железы, вызванное применением определенных лекарственных средств. Его причиной может быть использование фармакопрепаратов различных групп: стероидов, антибиотиков, ингибиторов протонной помпы, гипотензивных, статинов и других. Основные симптомы – боль и диспепсические явления. В диагностике важна детальная оценка данных анамнеза, лабораторных и инструментальных методов исследования: УЗИ поджелудочной железы, КТ, МРТ органов брюшной полости. Лечение заключается в отмене препарата, ставшего причиной заболевания, обезболивании, дезинтоксикации, подавлении панкреатической ферментативной активности.
Общие сведения
Медикаментозный панкреатит – относительно редкая нозологическая форма, ее частота составляет около 3% всех случаев острых панкреатитов. Несколько чаще данное заболевание встречается у представителей групп риска: пациентов детского возраста и ВИЧ-инфицированных. Несмотря на то, что первый случай медикаментозного панкреатита был описан еще в 1950-х годах, проблема не утрачивает актуальность. С каждым годом расширяется список фармакологических препаратов, которые могут спровоцировать поражение поджелудочной железы. При этом довольно затруднительно оценить способность лекарственного средства вызвать медикаментозный панкреатит: у одних препаратов имеется достаточная доказательная база, у других – лишь единичные сведения, базирующиеся на мнении клинициста об отсутствии другой этиологии заболевания.
С накоплением доказательной базы была разработана классификация лекарственных препаратов по их способности вызывать поражение поджелудочной железы. Данная классификация учитывает 4 критерия: панкреатит развился в период лечения данным лекарственным средством; нет доказательств влияния других вероятных этиологических факторов; симптомы заболевания исчезли после отмены препарата; при повторном его назначении патология рецидивировала.
Причины
К лекарственным средствам, достоверно ассоциированным с развитием медикаментозного панкреатита, относятся следующие: антимикробные препараты (цефтриаксон, ампициллин, тетрациклин, рифампицин, эритромицин, изониазид, нитрофурантоин, метронидазол); противовирусные препараты, которые применяются для лечения ВИЧ (нелфинавир, диданозин); диуретики (хлортиазид, гидрохлортиазид, фуросемид); препараты, используемые в лечении заболеваний ЖКТ (ранитидин, циметидин, омепразол, октреотид), сердечно-сосудистой системы (каптоприл, эналаприл, амиодарон, лозартан); иммуносупрессанты/цитостатики (цитозин, арабинозид, ифосфамид, дексаметазон, паклитаксел, такролимус); другие часто назначаемые препараты (преднизолон, дексаметазон, кодеин, симвастатин, правастатин, парацитомол, эстрогены, эрготамин, даназол, индометацин).
Патогенез медикаментозного панкреатита окончательно не изучен. Крайне редко заболевание развивается при явной передозировке препарата. Существуют теории иммуносупрессивного, осмотического, цитотоксического и метаболического воздействия лекарственных средств, тромбоза панкреатических кровеносных сосудов при применении определенных препаратов. В большинстве случаев медикаментозный панкреатит возникает вследствие идиосинкразии, которая подразумевает развитие побочных эффектов при использовании препарата в стандартных дозировках. Данный тип побочных реакций не зависит от дозировки и непредсказуем.
Симптомы повреждения поджелудочной железы могут развиваться отсрочено, даже уже после отмены препарата, что связывают с накоплением токсических метаболитов. Некоторые лекарственные средства вызывают медикаментозный панкреатит даже спустя месяцы после отмены (например, пентамидин, азатиоприн), другие – даже после однократного приема.
Симптомы медикаментозного панкреатита
Медикаментозный панкреатит практически всегда острый, его течение может варьировать от легкого до крайне тяжелого. В большинстве случаев заболевание протекает как острый отечный панкреатит, в редких случаях развивается некротическая геморрагическая форма, при которой возможен летальный исход.
Клиническая картина медикаментозного панкреатита напоминает таковую при типичном остром воспалении поджелудочной железы. Наиболее характерный симптом – боль в эпигастрии, подреберьях. Болевой синдром может иметь разную интенсивность – от умеренных ноющих ощущений до нестерпимой опоясывающей боли, при которой пациент занимает вынужденное положение (это характерно для некротической формы медикаментозного панкреатита). Также типичны диспепсические явления: тошнота, рвота, диарея. Возможно головокружение, выраженная общая слабость.
Диагностика
Диагностика медикаментозного панкреатита вызывает большие трудности. Это связано с тем, что очень многие лекарственные препараты могут вызывать повреждение поджелудочной железы, время между приемом препарата и развитием клинической картины существенно варьирует, а характерные именно для данного заболевания признаки, выявляемые при лабораторных и инструментальных методиках, отсутствуют. В диагностике очень важна консультация гастроэнтеролога, тщательный опрос пациента, настороженность врача в отношении данной патологии и выявление в анамнезе сведений о применении лекарственных средств, которые потенциально могут вызвать данную патологию.
К возможным биохимическим маркерам медикаментозного панкреатита относят уровень С-реактивного белка. При данной патологии СРБ повышается в значительно меньшей степени, чем при остром воспалении поджелудочной железы другой этиологии, поэтому у всех пациентов с панкреатитом неясного генеза с незначительно повышенным уровнем СРБ можно предположить медикаментозную этиологию заболевания. С целью исключения аутоиммунной причины определяют уровень IgG4, который должен быть в норме. В общем анализе крови при медикаментозном панкреатите выявляется лейкоцитоз, повышение СОЭ, в биохимических анализах крови – повышение амилазы крови, Г-ГТП, ЛДГ, возможно повышение глюкозы крови.
Инструментальные методы исследования, которые проводятся при подозрении на медикаментозный панкреатит, выявляют воспаление поджелудочной железы, однако типичных именно для лекарственной этиологии признаков нет. УЗИ поджелудочной железы позволяет определить увеличение органа, изменение эхогенности паренхимы. Для детальной оценки состояния поджелудочной железы и соседних органов проводится КТ, МРТ, МСКТ органов брюшной полости.
Лечение медикаментозного панкреатита
Лечение пациентов с медикаментозным панкреатитом в зависимости от тяжести течения заболевания может проводиться в отделении гастроэнтерологии или интенсивной терапии. Обязательно назначается диета (в первые сутки полный голод с постепенным переходом на стол №5). Главное в лечении данного заболевания – отмена лекарственного средства, вызвавшего повреждение поджелудочной железы.
Консервативная терапия заключается в применении обезболивающих препаратов, дезинтоксикации. С целью предупреждения инфекционных осложнений назначаются антибиотики. Также вводятся спазмолитические препараты, глюкозо-новокаиновая смесь, применяются антигистаминные препараты. Внутривенно капельно вводят инфузионные растворы с ингибиторами протеаз (апротинин).
При геморрагической форме медикаментозного панкреатита с целью обезболивания вводят промедол. В случае массивной панкреатогенной токсемии применяют методы экстракорпоральной гемокоррекции. При неэффективности консервативной терапии при некротическо-геморрагическом медикаментозном панкреатите проводят хирургическое лечение, которое заключается во вскрытии панкреатической капсулы, дренировании железы, удалении участков некротизированной паренхимы (некрэктомии). В редких случаях производят резекцию части поджелудочной железы или ее полное удаление.
Прогноз и профилактика
Прогноз при медикаментозном панкреатите зависит от степени тяжести заболевания. В большинстве случаев патология протекает в доброкачественной форме и хорошо поддается терапии после отмены препарата. Однако при некротическо-геморрагической форме летальность высокая – около 70%. Очень важен контроль проводимой фармакотерапии в случае применения препаратов, потенциально опасных в плане повреждения поджелудочной железы.
Специфической профилактики данного заболевания нет. Категорически запрещается самостоятельное применение лекарственных препаратов, особенно из тех групп, которые могут стать причиной медикаментозного панкреатита.
Аутоиммунный панкреатит — это редкая системная болезнь поджелудочной железы и других органов, вызванная повреждением соединительной ткани иммуноглобулинами G4. Проявляется абдоминальной болью, желтушным синдромом, диспепсией, изменениями стула и признаками недостаточности питания. Диагностируется с помощью УЗИ, МРТ панкреатической железы, копрограммы, определения уровня иммуноглобулинов и гистологического анализа. Для терапии используются кортикостероиды и моноклональные антитела. При неэффективности консервативного лечения выполняется дренирование, стентирование, стомирование панкреатических и желчевыводящих протоков.
МКБ-10
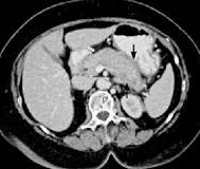
Общие сведения
Хотя аутоиммунный панкреатит считается редким заболеванием, его доля в структуре хронических воспалений поджелудочной железы достигает 4-6%. Распространенность болезни не превышает 0,0008%. Впервые патология описана французским клиницистом Г. Сарлесом в 1961 году. В качестве отдельной нозологической единицы заболевание признано в 2001 году после разработки этиологической классификации панкреатита TIGAR-O. Аутоиммунное поражение панкреатической железы у мужчин выявляется в 2-5 раз чаще, чем у женщин. До 85% пациентов заболевает после 50 лет. Болезнь зачастую сочетается с ревматоидным артритом, забрюшинным фиброзом, склерозирующим холангитом и другими аутоиммунными процессами.

Причины
Этиология аутоиммунного панкреатита не установлена. Обычно заболевание диагностируется методом исключения при выявлении иммуноглобулинов типа G4 и отсутствии других возможных причин поражения поджелудочной железы. Специалисты в сфере клинической гастроэнтерологии допускают ведущую роль наследственной отягощенности, в ходе медико-генетических исследований установлена ассоциация аутоиммунного процесса с серотипами HLA DRβ1-0405, DQβ1-0401, DQβ1-57. Из крови пациентов выделен сывороточный протеин массой 13,1 кДа, который считают специфическим антигеном.
В качестве вероятных аутоантигенов рассматриваются карбоангидраза, присутствующая в тканях пищеварительных органов, бронхиальном дереве и дистальных почечных канальцах, лактоферрин, выявляемый в панкреатических ацинусах, железах бронхов и желудка, компоненты клеточных ядер и гладкомышечных волокнах, панкреатический ингибитор трипсиногена и трипсина. Не исключена перекрестная сенсибилизация с инфекционными агентами – обнаружена молекулярная мимикрия между антителами к протеинам возбудителя хеликобактериоза и плазминоген-связывающему белку.
Патогенез
Пусковым механизмом изменений в панкреатической железе и других чувствительных органах становится связь сывороточных Ig G4 с аутоантигенами ацинарных клеток, нормальных эпителиоцитов панкреатических, желчных, слюнных протоков и др. Антигенное повреждение сопровождается нарушением апоптоза клеточных элементов иммунной системы. Ключевым звеном патогенеза аутоиммунного панкреатита считается накопление в соединительной ткани персистирующих активированных Т- и В-лимфоцитов, нейтрофилов и эозинофилов, провоцирующее фиброзно-склеротические процессы.
При цитологическом исследовании в панкреатической строме выявляются признаки фиброза и склероза при отсутствии псевдокист и конкрементов. Из-за лимфоплазмоцитарной, нейтрофильной и эозинофильной инфильтрации стенки протоков уплотнены, сужены, при длительном течении аутоиммунного процесса фрагментированы. Распространение воспалительной инфильтрации на дольки поджелудочной железы приводит к потере дольчатой структуры органа и часто сочетается с флебитом. Как и при других вариантах хронического панкреатита, возможна кальцификация паренхимы и стромы.
Классификация
При систематизации форм аутоиммунного панкреатита учитывают распространенность фиброзно-склеротического процесса, наличие сопутствующих поражений других органов, морфологические особенности воспаления. При очаговом варианте заболевания повреждены отдельные участки панкреатической паренхимы, преимущественно головка органа. Обычно поражено не менее 1/3 железы (сегментарная форма панкреатита). Для диффузной формы патологии характерно вовлечение всего органа.
При отсутствии других аутоиммунных болезней панкреатит называют изолированным. В случае системного поражения нескольких органов говорят о синдромальном аутоиммунном панкреатическом воспалении. С учетом гистологической картины различают два основных варианта заболевания, каждый из которых отличается характерными клиническими особенностями:
- Лимфоплазмоцитарно-склерозирующая форма панкреатита. Преобладает инфильтрация иммуноглобулин-продуцирующими клетками, выраженный фиброз стромы органа и облитерирующий флебит. Сочетается с IgG4-ассоциированной аутоиммунной патологией. Характерно часто рецидивирующее течение с прогрессированием склеротических изменений.
- Протоково-концентрический идиопатический панкреатит. Морфологически проявляется нейтрофильной инфильтрацией с клеточными скоплениями, напоминающими микроабсцессы. Флебит и фиброз выражены меньше. Уровень сывороточных IgG4 обычно в норме. В 30% случаев ассоциирован с язвенным колитом. Протекает без рецидивов. Встречается в 3,5-4 раза реже.
Симптомы аутоиммунного панкреатита
Клиническая картина заболевания отличается от типичного воспаления поджелудочной железы. При аутоиммунном варианте поражения органа боли менее интенсивные, тупые, не связаны с погрешностями в рационе питания. Болевой синдром развивается только у половины пациентов. Другой важный симптом аутоиммунного панкреатита — механическая желтуха, которая возникает в среднем у 60-80% больных и проявляется желтушным окрашиванием кожи и склер, кожным зудом, обесцвечиванием кала.
Аутоиммунная панкреатическая патология часто сопровождается диспепсическими расстройствами: тошнотой, изменением характера стула (обильный зловонный кал сероватого цвета), вздутием живота. При прогрессировании заболевания возникает нарушение всасывания и дефицит питательных веществ, который проявляется снижением массы тела пациентов, безбелковыми отеками лица и нижних конечностей. На поздних стадиях панкреатита развивается постоянная жажда, полиурия (симптомы нарушения обмена глюкозы).
Осложнения
У большинства больных аутоиммунный панкреатит протекает с вовлечением в патологический процесс других органов и тканей. Чаще всего заболевание распространяется на билиарную систему с развитием склерозирующего холангита и бескаменного холецистита. На связь этих нозологических форм с панкреатитом указывает типичная лимфогистиоцитарная инфильтрация стенок желчевыводящих путей и хороший ответ на гормональную терапию. Иногда поражается печень с формированием псевдоопухоли или цирроза.
Частым осложнением панкреатического аутоиммунного воспаления является сахарный диабет, который возникает вследствие постепенного некроза клеток островков Лангерганса, сопровождающегося резким снижением выработки инсулина. Более редкие последствия заболевания — иммунокомплексное поражение почечной паренхимы по типу тубулоинтерстициального нефрита, интерстициальная пневмония. Циркуляция антител IgG в крови приводит к склерозу тканей слюнных желез.
Диагностика
Постановка правильного диагноза представляет затруднения, что объясняется редкой встречаемостью патологии и разнообразием ее клинических проявлений. В большинстве случаев диагностический поиск при аутоиммунном панкреатите направлен на исключение других форм панкреатического воспаления. Наиболее информативными являются такие методы исследования, как:
Показатели общего анализа крови при панкреатите аутоиммунного типа обычно без изменений. В биохимическом анализе крови выявляют неспецифические признаки поражения билиарного тракта и печени: повышение уровня печеночных ферментов, липазы и амилазы, увеличение концентрации билирубина за счет конъюгированной фракции. При подозрении на аутоиммунное поражение легких проводят рентгенографию, при нарушении функции почек — анализ мочи по Зимницкому.
Прежде всего, заболевание необходимо дифференцировать с раком поджелудочной железы, особенно у пациентов старше 60 лет. В пользу аутоиммунного воспаления свидетельствует повышение специфических антител в крови, типичные УЗИ-признаки, воспалительная инфильтрация панкреатической ткани по результатам гистологии. Дифференциальную диагностику также осуществляют с первичным склерозирующим холангитом, раком желчных путей. Для обследования пациента с аутоиммунным вариантом панкреатита привлекаются врач-гастроэнтеролог, онколог, иммунолог.
Лечение аутоиммунного панкреатита
Поскольку у части больных возможно спонтанное излечение с полным восстановлением экзокринной и эндокринной панкреатических функций, медикаментозную терапию проводят только при наличии соответствующих показаний. При бессимптомном течении назначение лекарственных средств оправдано в случае выявления персистирующего образования панкреатической железы, стойком изменении печеночных показателей в сочетании с признаками склерозирующего холангита. Рекомендованные схемы лечения аутоиммунного варианта панкреатита обычно включают:
- Глюкокортикостероиды. Стероидные гормоны являются препаратами первой линии и зачастую в течение 2-3 недель оказывают долгосрочный терапевтический эффект. При отсутствии явного фиброза размеры и структура поджелудочной железы могут полностью восстановиться. Назначение стероидов результативно не только при признаках панкреатита, но и при аутоиммунном поражении других органов.
- Моноклональные антитела. Показаны при резистентном течении заболевания или наличии противопоказаний к стероидной терапии. Синтетические иммуноглобулины Ig G1-k применяются для связывания В-лимфоцитарного CD-антигена. Быстрое уменьшение количества В-лимфоцитов сопровождается падением уровня Ig G4 и индукцией ремиссии аутоиммунного панкреатического воспаления.
В симптоматической терапии с учетом клинических проявлений используют панкреатические ферменты, сахароснижающие средства и блокаторы протонной помпы. Для купирования болевого синдрома рекомендованы нестероидные противовоспалительные средства, миотропные спазмолитики. Пациентам со стойкой компрессией выполняется стентирование главного панкреатического протока, чрескожное транспеченочное дренирование желчных протоков, назобилиарное дренирование при РПХГ. При безуспешности малоинвазивных техник проводится панкреатоеюностомия, холецистоэнтеростомия.
Прогноз и профилактика
Исход болезни зависит от степени поражения тканей, тяжести осложнений. Хотя стероидная терапия позволяет достичь ремиссии более чем у 90% больных, прогноз аутоиммунного панкреатита относительно неблагоприятный, у части пациентов происходит необратимое снижение эндокринной и экзокринной функций органа. Из-за недостаточно изученного этиопатогенетического механизма меры специфической профилактики не разработаны. Для предупреждения осложнений важно своевременно выявлять и лечить аутоиммунные заболевания пищеварительного тракта.
1. Аутоиммунный панкреатит: новые представления о патогенезе, диагностике и лечении/ Охлобыстин А.В. // Доказательная гастроэнтерология – 2013 - №1.
2. Аутоиммунный панкреатит: современные представления / Кучерявый Ю.А., Оганесян Т.С., Калюзин А.Н., Свиридова А.В.// Экспериментальная и клиническая гастроэнтерология – 2010 - №8.
4. Аутоиммунный панкреатит/ Гаврилина Н.С., Седова Г.А., Косюра С.Д.// Архивъ внутренней медицины – 2014 - №3.
Читайте также:

