Аутоиммунный тиреоидит и системная красная волчанка
Обновлено: 24.04.2024

Обзор
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
Автор
Редакторы


Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
Лекарства, применяемые при ревматических болезнях
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.

Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).

Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы ФНО
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.

Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.

Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
Блокаторы интерлейкиновых рецепторов
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].

Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.

Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Анти-B-клеточная терапия
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].

Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Анти-Т-клеточная терапия
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).

Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.

Обзор
Автор
Редакторы

Эта Статья заслужила приз зрительских симпатий.
Однако есть заболевания, возможно, не столь смертельные, но куда сильнее бьющие по нам экономически. Это аутоиммунные заболевания, такие, как рассеянный склероз, системная красная волчанка или диабет 1-го типа. Если рак и инсульты чаще всего встречаются у пожилых людей, то аутоиммунные состояния обычно манифестируют (проявляются в виде симптомов) у молодых людей трудоспособного возраста и либо ложатся тяжким бременем на бюджет страны или больного (россияне, больные диабетом, если не получают инсулин от государства, тратят на поддержание собственной жизни от 1 до 5–6 тысяч рублей в месяц), либо, как в случае рассеянного склероза, просто ставят крест на карьере и жизни пациента.
Особенность аутоиммунных заболеваний состоит в том, что практически ни для одного из них мы за долгие годы исследований и экспериментов не научились достигать стойкой ремиссии. Текущие решения сводятся либо к поддерживающей терапии (как в случае с инсулинозависимым диабетом), либо к попыткам отсрочить терминальную стадию заболевания, на что нацелены препараты от рассеянного склероза. До недавнего времени ситуация выглядела довольно плачевно. Дополнительно усугубляет ее тот факт, что количество людей с аутоиммунными заболеваниями растет каждый год, и мы находимся на пороге настоящей эпидемии.
Однако там, где фармацевтическая отрасль терпит одну неудачу за другой, внезапно сама природа показала, куда смотреть исследователям и откуда брать по-настоящему работающее лекарство.
История вопроса
Чтобы понять, откуда возникла проблема с аутоиммунными заболеваниями, придется заглянуть далеко в прошлое.
Дело в изменившемся в ходе FET образе жизни человека. До этого мы жили небольшими группами, состоявшими не более чем из 50 особей, занимавшими довольно обширные пространства. К тому же мы постоянно меняли место жительства, нигде не оставались надолго. Культура гигиены была довольно низкой — зачем следить за чистотой убежища, если ты уже съел всех мамонтов вокруг и завтра надо искать новое место?
В ходе FET люди начали надолго оставаться на одном месте, формировать более крупные группы для защиты от набегов соплеменников. Скученность и загрязнение места обитания создали оптимальные условия для развития у нас инфекций. Начались эпидемии, которые были тем свирепее, чем больше был город и чем плотнее жили в нем люди.

Довольно долгое время, около 5000 лет, понадобилось человечеству, чтобы научиться справляться с инфекциями. Где-то раньше, где-то позже люди осознали важность гигиены для жизни и здоровья. Были эмпирически найдены лекарства от многих болезней. Можно сказать, весь прогресс медицины и человечества в целом происходил под постоянно довлеющим страхом новых эпидемий.

Рисунок 2. Обложка Le petit journal от 1 сентября 1912 года, посвященного эпидемии холеры в Индии и на Ближнем Востоке в начале 20-го века.
В настоящее время мы настолько чисты, насколько не были никогда в истории. Особенно хорошо это видно в развитых странах. Мы привыкли к тому, что во все дома подведена вода и всегда есть возможность принять ванную или душ. Мы пользуемся мылом, влажными салфетками, асептическими гелями. Мы даже моем наши дороги шампунем!
Казалось бы, ну чистые и чистые, что тут такого? При чем тут аутоиммунные заболевания? Оказывается, связь самая прямая.
Гигиеническая гипотеза
Этот переход стал возможен благодаря появлению антибиотиков и других высокоэффективных противопаразитических лекарств. В развитых странах он завершился к концу 20-го века. Если в середине века в Европе каждый третий житель был поражен гельминтами [1], то в настоящий момент обнаружение носителя этих паразитов скорее редкость. Россия в этом отношении практически не отстает от развитого мира благодаря нашим сильным гигиеническим традициям. Дополнительный вклад вносит городской образ жизни, централизованное снабжение очищенной водой, контроль качества пищи и так далее.

Рисунок 3. Обратное отношение между частотой инфекционных заболеваний и частотой иммунных расстройств с 1950 по 2000 годы. а — Изменение относительного количества заболевших различными инфекционными заболеваниями. б — Относительный рост заболеваемости аутоиммунными заболеваниями за тот же период.
Впоследствии многие исследователи показали то же самое на примере других аллергий и аутоиммунных реакций. К примеру, если детям из неблагополучных по гигиене регионов вроде Чили или Тайланда провести европейскую программу дегельминтизации, у них букетом высыпают аллергии [4].
Наверное, самым интересным примером тут является история с рассеянным склерозом [5–8]. Ученые решили посмотреть, что происходит, когда больной этим страшным заболеванием заражается гельминтами, и начали искать инфицированных червями пациентов с РС. Результаты были ошеломляющи. У пациентов, которые заражались определенными гельминтами (например, власоглавом Trichuris trichiura) течение заболевания практически останавливалось [6]. Во время инфекции у них на 95% снижалось количество новых бляшек в мозге (рис. 4). Результат, недостижимый ни одним современным методом терапии! Если же по каким-то причинам гельминтов требовалось удалить (например, развивалось острое воспалительное поражение кишечника), болезнь возобновлялась с той стадии, на которой остановилась при инфекции.

Рисунок 4. График появления новых бляшек в мозге (когортное исследование 2011 года). Круги — неинфицированные гельминтами пациенты, квадраты — инфицированные, треугольники — инфицированные, но вылеченные от гельминта (момент излечения показан черной стрелкой).
Иммунный ответ
Иммунная система призвана защищать организм от внутренних и внешних врагов. Внешними врагами являются вирусы, бактерии, простейшие и черви, которые постоянно попадают в наш организм и уничтожаются на дальних рубежах. Внутренними врагами являются раковые клетки, а также клетки, зараженные вирусами или внутриклеточными бактериями.
Когда паразит попадает в организм, первым делом его встречает врожденный иммунитет, клетки которого (макрофаги) есть во всех тканях. Антигеном в данном случае служат нехарактерные для нашего организма молекулы — клеточная стенка бактерий, двухцепочечная РНК некоторых вирусов, свободно плавающая в межклеточном пространстве наша ДНК и так далее. При обнаружении пришельцев, клетки врожденного иммунитета пытаются их уничтожить, параллельно выделяя провоспалительные молекулы (рис. 5). Воспаленная ткань блокирует выход паразита из места проникновения в остальной организм и привлекает новые клетки иммунитета к месту повреждения.

Рисунок 5. Фагоцит пожирает бактерии.
Если врожденному иммунитету не удается уничтожить захватчиков, в дело вступает адаптивный иммунитет. Происходит это отнюдь не сразу: активации адаптивного ответа предшествуют 3–4 дня подготовки в лимфоузлах (при этом лимфоузлы увеличиваются в размерах, что является признаком инфекционного заболевания). Начинается все с того, что некоторые из клеток врожденного иммунитета прибывают в лимфоузел, неся на себе антигены из места поражения. Антигенами в данном случае выступают короткие (от 8 до 20 аминокислот) пептиды из белков инфекционного агента и окружающих тканей. По сути, макрофаг (или специализированный активатор адаптивного иммунитета — дендритная клетка) просто захватывает из места воспаления образцы растворенных белков, ошмётков паразита и погибших клеток и приносит в лимфоузел.
В лимфоузле его встречают наивные (неактивированные) клетки адаптивного иммунитета — Т-лимфоциты. Каждый лимфоцит, выйдя из места своего формирования, несет на себе уникальный рецептор, который формируется путем направленного внесения мутаций в геном. Заранее неизвестно, может ли этот рецептор распознать какой-либо антиген, но его вариантов так много (по некоторым оценкам, у нас может быть до 10 48 разных типов этого рецептора, но большая часть их будет нефункциональна), что в течение нескольких часов в лимфоузле обнаруживается как минимум несколько клеток, способных распознать антигены паразита. Затем эти клетки делятся, активируются и отправляются в поврежденную ткань, где отыскивают свои антигены и уничтожают как самих захватчиков, так и зараженные клетки, если мы говорим о вирусе или внутриклеточной бактерии (рис. 6).

Рисунок 6. Т-лимфоциты (красные) убивают раковую клетку (синяя) своего же организма. После получения сигнала раковая клетка начинает распадаться на небольшие пузырьки, которые затем съедят клетки врожденного иммунитета.
Иммунологическая толерантность
Иммунная система — единственная из систем организма, в чью задачу входит уничтожение других живых существ — отдельных клеток или многоклеточных организмов. Причем наши собственные клетки тоже часто должны уничтожаться, если они заражены вирусом, бактерией или превратились в раковые. При этом необходимо избегать иммунного ответа на нормальные клетки. Если такой ответ развивается — возникает аутоиммунное заболевание.
Периферическая толерантность возникает, когда Т-лимфоцит распознает антиген в лимфоузлах, но никакого воспаления в месте, откуда этот антиген попал в лимфоузел, нет. Напротив, высока концентрация противовоспалительных молекул. Такой лимфоцит опять-таки или уничтожается, или превращается в регуляторный.
Паразиты и симбионты
Миллиарды лет эволюции крупные многоклеточные организмы были домом и едой для более мелких одноклеточных и многоклеточных. Человек тут не исключение — ведь мы являемся как хорошим источником пищи, так и отличным защитником для всего, что сумеет поселиться внутри нас или на нас.
Эволюция поделила этих сожителей на 2 большие группы — паразиты и симбионты. Паразиты делают ставку на быстрое размножение. У них есть возможность подавления врожденного иммунитета, а пока адаптивный активируется, они уже успевают размножиться за счет наших ресурсов и передать инфекцию дальше. Так действует, например, вирус гриппа или бактериальная пневмония.
Симбионты же научились подавлять как врожденный, так и адаптивный иммунитеты. Для этого им пришлось умерить свои аппетиты — если клетки организма постоянно повреждаются, то никакие уловки не смогут предотвратить активацию иммунитета. Потому они поселились на поверхностях нашего тела, прежде всего на поверхности ЖКТ, где они получают лишь часть нашей пищи, но не покушаются на сам организм.
Помимо этого, они научились подавлять воспаление, выделяя вещества, которые похожи на наши противовоспалительные молекулы. Макрофаги врожденного иммунитета, столкнувшись с такими бактериями, могут почувствовать антигены клеточной стенки, но не активируются, так как подавлены противовоспалительным фоном вокруг.
Третьим механизмом защиты стала антигенная мимикрия. Для адаптивного иммунитета основным антигеном являются пептиды из белков. И многие наши симбионты в ходе эволюции поменяли свой белковый состав так, чтобы в нем был максимум пептидов, похожих на наши. Таким образом они встают под защиту регуляторных лимфоцитов. Этот механизм характерен для всех видов наших сожителей — бактерий, червей (рис. 7), вирусов и так далее.

Рисунок 7. Власоглав — один из гельминтов, активно изучаемых в рамках гигиенической гипотезы.
В течение миллионов лет каждая особь нашего вида, рождаясь, сразу же вступала в контакт с симбионтами, населявшими кожу, слизистые и кишечники своих собратьев. Со временем организм научился извлекать выгоду из такого постоянного неустранимого сосуществования. В частности, способность бактерий и червей создавать сильный противовоспалительный фон в месте своего обитания стала за это время ключевым фактором создания периферической толерантности. Она распространилась как на антигены самих сожителей, так и на сопутствующие им — антигены пищи (в кишечнике), пыли и пыльцы (в легких) и собственного организма (те самые антигены, которые сожители развили в ходе антигенной мимикрии).
И снова гигиеническая гипотеза
Особенно сильно на риск развития таких заболеваний влияет первый год жизни. Если в этот период ребенок оказывается в деревне, проводит некоторое время в больших группах сверстников (в больнице или в детском саду) и вообще чаще встречается с инфекциями — риск развития аутоиммунных заболеваний серьезно снижается [11], [12].
Разумеется, не только микробиом (совокупность всех симбиотических микроорганизмов конкретного человека) [13] и гельминты влияют на риск развития аутоиммунных и аллергических реакций. Есть и генетическая предрасположенность, и условия, в которых человек впервые встречается с тем или иным внешним антигеном. Есть некоторые микроорганизмы, которые не защищают, а, напротив, провоцируют аутоиммунные заболевания. Например, стрептококк способен вызывать ревматизм, а некоторые стафилококки производят суперантиген, который неспецифически запускает все клоны Т-лимфоцитов с любым рецептором — это тоже может привести к аутоиммунным заболеваниям.
| Заболевание | Количество исследований | Общее количество пациентов | Результаты |
|---|---|---|---|
| Болезнь Крона | 6 | 543 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Неспецифический язвенный колит | 3 | 192 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Рассеянный склероз | 6 | 156 | Показана безопасность, статистически значимые улучшения у части пациентов. |
| Непереносимость глютена (целиакия) | 2 | 35 | Исследования только начались |
| Расстройства аутического спектра | 3 | 90 | Пилотное исследование показало эффективность, подтверждающие только начаты |
| Псориаз | 3 | 55 | Исследования только начались |
| Аллергия на арахис | 1 | 18 | Исследования только начались |
| Бронхиальная астма | 1 | 32 | Зафиксированы статистически недостоверные улучшения |
| Аллергический риноконъюнктивит | 2 | 130 | Эффективность не показана |
| Ревматоидный артрит | 1 | 50 | Исследование только началось |
Что же делать нам, простым смертным, пока ученые по кусочкам разбирают эту тайну и ищут решение? Начать стóит со снижения маниакального стремления к чистоте во всем. Я не предлагаю не мыть руки перед едой. Но довольно часто в последнее время мы перегибаем палку. Антибиотики при каждом чихе, асептические спиртосодержащие гели каждые 10 минут, антибактериальное мыло вместо обычного в ванной. Все эти меры способны спасти вас от эпидемии. Но каждодневное их применение, особенно детьми, способно нанести куда больший урон, чем грипп или пищевое отравление.
Что такое аутоиммунный тиреоидит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Сивова А. А., эндокринолога со стажем в 13 лет.
Над статьей доктора Сивова А. А. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Хронический аутоиммунный (лимфоматозный) тиреоидит (ХАИТ) — хроническое заболевание щитовидной железы аутоиммунного происхождения, было описано Х. Хасимото в 1912 г. Заболевание чаще наблюдается у женщин и наиболее часто диагностируется среди известных патологий щитовидной железы. Аутоиммунный тиреоидит выявляется у одной из 10-30 взрослых женщин. [1]
Рассматриваемое заболевание аутоиммунной природы, и для него обязательно присутствие антител. Впервые опубликовали данные об обнаружении антител к ткани щитовидной железы в сыворотке у пациентов с аутоиммунным тиреоидитом в 1956 году. Впоследствии выяснилось, что аутоиммунный тиреоидит подразумевает наличие антител к тиреоглобулину, второму коллоидному антигену и тиреопероксидазе (микросомальному антигену).
Провоцирующие факторы
Сегодня принято считать, что апоптоз, то есть программируемая гибель фолликулярных клеток щитовидной железы — одна из главных причин аутоиммунного тиреоидита и других патологий щитовидной железы. [2] Предполагается, что запуску апоптоза способствуют вирусы и генетические нарушения.
Чем опасен тиреоидит во время беременности
Аутоиммунный тиреоидит у женщины никак не отражается на возможности забеременеть и родить здорового ребёнка при условии, что у пациентки нормальный уровень гормонов — тиреотропный гормон (ТТГ) до 2,5 мЕд/л, в том числе в первом триместре беременности.
При гормональном нарушении возможны следующие осложнения:
-
;
- выкидыш;
- преждевременные роды;
- проблемы со сном;
- поздний токсикоз; ;
- кровотечения после родов;
- гипоксия плода;
- неонатальный тиреотоксикоз.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
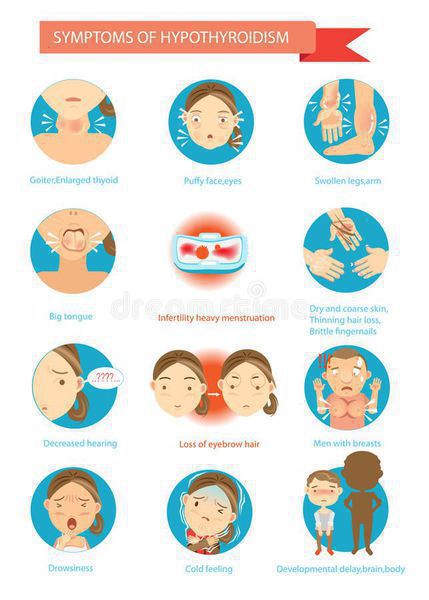
Симптомы аутоиммунного тиреоидита
Изначально, на протяжении некоторого времени, больные не высказывают никаких жалоб. Постепенно с течением времени регистрируют медленное развитие клинической картины снижения функции щитовидной железы, вместе с тем в части ситуаций будет отмечаться прогрессирующее уменьшение размеров железы или же наоборот ее увеличение. [3]
Клинические проявления при хроническом аутоиммунном тиреоидите начинают появляться с нарушением функции щитовидной железы, но в части ситуаций симптомов может и не быть. Все симптомы аутоиммунного тиреоидита щитовидной железы неспецифические, т. е. могут быть при многообразных заболеваниях. Но несмотря на это, все же обозначим клинические проявления, имея которые следует обратиться к эндокринологу для обследования.

Патогенез аутоиммунного тиреоидита
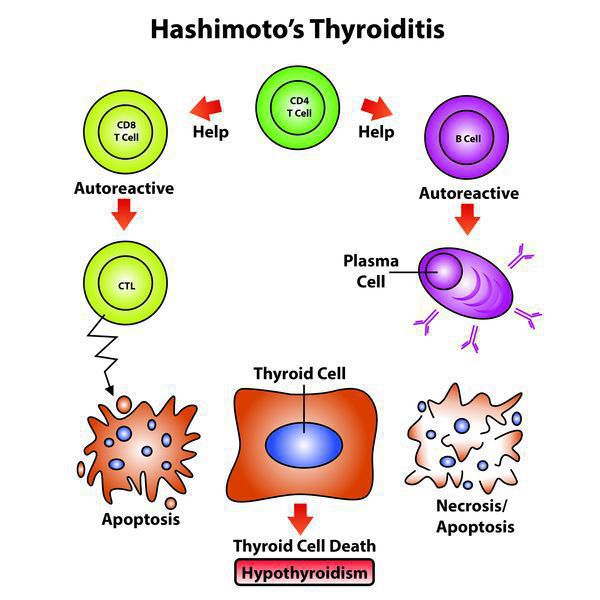
Эндогенный (внутренний) критерий наследования аутоиммунных заболеваний взаимосвязан с клонами Т-лимфоцитов.
- Чтобы произошло развитие хронического заболевания с учетом имеющейся наследственной предрасположенности, нужно влияние экзогенных факторов (вирусных и любых других инфекций, фармпрепаратов), которые способствуют активации Т-лимфоцитов, те впоследствии активируют В-лимфоциты, запуская цепную реакцию.
- Далее Т-клетки, кооперируясь с антитиреоидными антителами, воздействуют на эпителиальные клетки фолликулов, содействуя их деструкции, вследствие чего снижается численность правильно функционирующих структурных единиц щитовидной железы. [1][4]
Количество антитиреоидных антител при этом заболевании непосредственно отражает выраженность аутоиммунного процесса и иногда имеет склонность уменьшаться по мере увеличения продолжительности заболевания. Только присутствия антитиреоидных антител недостаточно, чтобы травмировать структурные элементы щитовидной железы.
Для реализации токсических свойств имеющимся антителам необходимо вступить во взаимодействие с Т-лимфоцитами, которые чувствительны к антигенам щитовидной железы при ХАИТ, чего не бывает при наличии обычного зоба или если патология щитовидной железы не выявлена.
В норме все клетки имеют иммунологическую нечувствительность к другим клеткам собственного организма, которая приобретается во время внутриутробного развития (еще до рождения), во время взаимодействия зрелых лимфоцитов со своими антигенами. Любые нарушения в данном взаимодействии и синтез особых клонов Т-лимфоцитов, которые вступают во взаимодействие со своими же антигенами, и могут стать той причиной, которая приводит к нарушению иммунологической нечувствительности и впоследствии привести к формированию любых аутоиммунных патологий, включая и ХАИТ.
Классификация и стадии развития аутоиммунного тиреоидита
Формы ХАИТ с учетом объема железы и данных клиники:
- Гипертрофическая (тиреоидит Хасимото). Наиболее распространена. Щитовидная железа отличается плотностью, увеличена до II или III степени. Функция железы чаще не изменена, однако в большинстве ситуаций регистрируют тиреотоксикоз или гипотиреоз. Встречается у 15-20% больных.
- Атрофическая. Щитовидная железа в норме или незначительно увеличена, а на момент осмотра может быть даже уменьшена. Функционально — гипотиреоз. Встречается у 80-85% пациентов.
Еще одна классификация аутоиммунного тиреоидита щитовидной железы: [2]
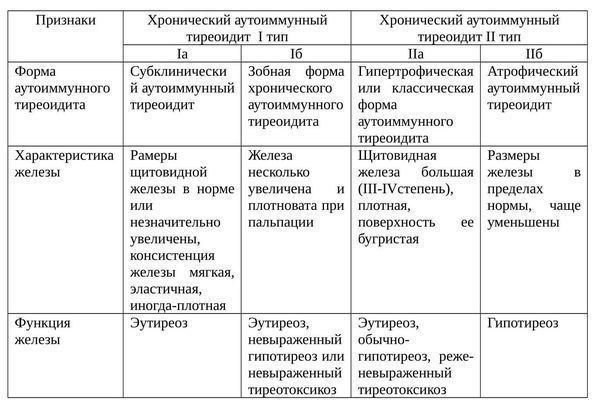
Фазы ХАИТ с учетом клинической картины заболевания:
- Эутиреоидная. Бессимптомное продолжительное (иногда пожизненное) течение, без изменений в функции щитовидной железы.
- Субклиническая. Если заболевание прогрессирует, то поскольку происходит деструкция клеток щитовидной железы и уменьшается уровень тиреоидных гормонов, повышается синтез тиреотропного гормона (ТТГ), который в свою очередь чрезмерно стимулирует щитовидную железу, благодаря чему организм поддерживает на нормальном уровне секрецию Т4.
- Фаза тиреотоксикоза. Поскольку заболевание продолжает развиваться, в кровь высвобождаются имеющиеся тиреоидные гормоны и формируется тиреотоксикоз. Не считая этого, в кровь попадают разрушенные части внутренних структур фолликулярных клеток, в результате образуются антитела к клеткам щитовидной железы. Когда при прогрессирующей деструкции щитовидной железы концентрация гормонопродуцирующих клеток снижается ниже допустимого предела, концентрация в крови Т4 стремительно уменьшается, развивается стадия явного гипотиреоза.
- Фаза гипотиреоза. Продолжается приблизительно в течение года, чаще всего после этого происходит восстановление функции щитовидной железы. Иногда гипотиреоидная фаза продолжается всю жизнь.
ХАИТ преимущественно протекает только с одной фазой заболевания. [5]
Осложнения аутоиммунного тиреоидита
ХАИТ — условно безопасное заболевание, не приводящее к осложнениям только при условии сохранения необходимой концентрации гормонов в крови, т. е. эутиреоидного состояния. И, соответственно, тогда никаких осложнений не развивается. Но при наступлении гипотиреоза могут наблюдаться осложнения. При отсутствии лечения гипотиреоза могут возникать осложнения: нарушение репродуктивной функции, выраженное снижение памяти, вплоть до слабоумия, анемия, но самое грозное и тяжелое осложнение гипотиреоза — гипотиреоидная или мексидематозная кома — возникает при резкой недостаточности гормонов щитовидной железы. [5] [6]
Диагностика аутоиммунного тиреоидита
Диагностика ХАИТ состоит из нескольких пунктов. Для определения данного заболевания у больного необходим минимум один большой критерий, если таких критериев не обнаружено, то диагноз лишь вероятен. [1]
Большие диагностические критерии:
- первичный гипотиреоз (причем возможен как манифестный, так и устойчивый субклинический);
- присутствие антител к ткани щитовидной железы;
- ультразвуковые критерии аутоиммунной патологии.
Пальпация щитовидной железы
Какие анализы нужны, чтобы определить АИТ
Для установления аутоиммунного тиреоидита необходимо сдать кровь на тиреотропный гормон ( ТТГ), тироксин свободный (Т4 свободный) и антитела к тиреопероксидазе (ТПО). Если антитела к ТПО повышены, но ТТГ в пределах нормы, то диагноз АИТ носит вероятный характер.
Нужно заметить, что при обнаружении у больного гипотиреоза манифестного или стабильного субклинического, диагностирование аутоиммунного тиреоидита важно для установления причины уменьшения функции железы, но несмотря на это постановка диагноза никак не меняет терапевтических методов. Лечение заключается в употреблении заместительной гормональной терапии препаратами тиреоидных гормонов.
Использование пункционной биопсии щитовидной железы не показано для установления хронического аутоиммунного тиреоидита. Ее необходимо проводить, только если имеются узлы щитовидной железы, более 1 см в диаметре.
Важно отметить, что нет надобности контролировать в течение болезни количество имеющихся антител к щитовидной железе, потому что данная процедура не имеет диагностической роли для анализа прогрессирования аутоиммунного тиреоидита. [7]
Лечение аутоиммунного тиреоидита
Терапия аутоиммунного тиреоидита щитовидной железы неспецифическая. При формировании фазы тиреотоксикоза достаточно применения симптоматической терапии. При формировании гипотиреоза главным вариантом медикаментозной терапии является назначение тиреоидных гормонов. Сейчас в аптечной сети РФ возможно приобрести только таблетки Левотироксина натрия (L-тироксин и Эутирокс). Применение таблетированных препаратов тиреоидных гормонов нивелирует клинику гипотиреоза и при гипертрофической форме аутоиммунного тиреоидита вызывает уменьшение объема щитовидной железы до допустимых значений.
В случае обнаружения у пациента манифестного гипотиреоза (повышение уровня тиреотропного гормона и снижение концентрации Т4 свободного) необходимо использование в лечении левотироксина натрия в средней дозе 1,6 – 1,8 мкг/кг массы тела пациента. Показателем правильности назначенного лечения будет являться уверенное удержание в пределах референсных значений тиреотропного гормона в крови больного.
Когда у больного диагностирован субклинический гипотиреоз (увеличена концентрация ТТГ в совокупности с неизмененной концентрацией Т4 свободного), необходимо:
- Спустя 3–6 месяцев вторично провести гормональное обследование для доказательства наличия изменения функции щитовидной железы;
- Когда в течение беременности у пациентки обнаружено увеличение уровня тиреотропного гормона, даже при сохраненной концентрации Т4 свободного, назначить левотироксин натрия в полной расчетной заместительной дозе сразу же;
- Лечение левотироксином натрия нужно при постоянном субклиническом гипотиреозе (увеличение концентрации тиреотропного гормона в крови свыше 10 мЕд/л, и еще в ситуациях не менее двукратного определения концентрации тиреотропного гормона между 5 – 10 мЕд/л), но если этим больным более 55 лет и у них имеются сердечно-сосудистые патологии, лечение левотироксином натрия назначается только при отличной переносимости лекарства и при отсутствии сведений о декомпенсации данных болезней на фоне приема тироксина;
- Показатель достаточности лечения субклинического гипотиреоза представляет собой стабильное удержание уровня ТТГ в пределах референсных значений в крови.
Если у женщин перед планированием беременности, выявлены антитела к ткани щитовидной железы и/или ультразвуковые признаки аутоиммунного тиреоидита, нужно определить гормональную функцию щитовидной железы (концентрацию тиреотропного гормона и концентрацию Т4 свободного) и обязательно определять уровень гормонов в каждом триместре беременности. [8]
Если поставлен диагноз аутоиммунный тиреоидит, но не выявляются изменения в работе щитовидной железы, применение препаратов левотироксина натрия не показано. [9] Оно возможно иногда в исключительных ситуациях внушительного увеличения объема щитовидной железы, спровоцированного аутоиммунным тиреоидитом, при этом решение принимается по каждому пациенту индивидуально. [10]
Физиологическое количество калия йодита (приблизительно 200 мкг/сутки) не могут спровоцировать формирование гипотиреоза и не осуществляют негативного воздействия на функцию щитовидной железы при ранее развившемся гипотиреозе, вызванном аутоиммунным тиреоидитом.
Питание при аутоиммунном тиреоидите
Продуктов, которые влияют на течение аутоиммунного тиреоидита, не существует. Глютен или лактоза не имеют отношения к гипотиреозу на фоне АИТ. Поэтому рекомендации по питанию для людей с аутоиммунным тиреоидитом такие же, как и для всех остальных: разнообразное сбалансированное питание с достаточным употреблением воды.
Существуют ли народные способы лечения
Аутоиммунный тиреоидит лечат только медицинскими препаратами, которые назначает эндокринолог. Отсутствие адекватной терапии может грозить опасными осложнениями: нарушением репродуктивной функции, выраженным снижением памяти (вплоть до слабоумия), анемией и комой, которая возникает при резкой недостаточности гормонов щитовидной железы.
Прогноз. Профилактика
Хронический аутоиммунный тиреоидит прогрессирует обычно крайне медленно, с развитием гипотиреоидного состояния спустя несколько лет. В отдельных ситуациях состояние и трудоспособность сохраняются в течение 15-18 лет, даже с учетом непродолжительных обострений. В фазе обострения тиреоидита регистрируются симптомы невыраженного либо гипотиреоза, либо тиреотоксикоза.
Сегодня методов профилактики хронического аутоиммунного тиреоидита не найдено.
На сервисе СпросиВрача доступна консультация эндокринолога онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!

Здравствуйте! С щитовидной железной у Вас все в порядке, никакого гормонального лечения Вам не нужно. У Вас аутоиммунный тиреоидит, эутиреоз. Функция железы сохранена, но при АИТ может снижаться. Поэтому 2 раза в год необходим контроль уровня ТТГ. АТ к ТПО будут повышены всегда, их сдавать больше не нужно. Обратитесь к трихологу по поводу выпадения волос, возможно проблемы в коже головы либо в самих волосах. Какой уровень витамина Д и ферритина сейчас?


об этом очень хорошо написано тут

Витамин Д болжен быть не ниже 50. Принимайте витамин Д в капсулах или каплях в дозе 2 000 МЕ. Так же сдайте ферритин. При уровня ферритина менее 70 необходим будет приём препаратов железа

Здравствуйте. Повышение антител к щитовидной железе может быть и при обычном носительстве, и при тиреоидите. Пока нарушения функции железы нет, симптомов быть не может (выпадение волос). Нужен лишь контроль ТТГ, св.Т4 через 6 мес. По поводу выпадения волос, самая частая причина - снижение ферритина крови (депо железа). Особенно у женщин, т.к. женщины менструируют и теряют железо ежемесячно. Сдайте кровь на ферритин и если он менее 50, то нужно лечение препаратами железа. Если он в норме, обратитесь к трихологу для фитотрихограммы.

Здравствуйте! Выявление антинуклеарных антител является признаком системных заболеваний соединительной ткани. Грнаулярный тип свечения АНФ может выявляться при аутоиммунных патологиях, инфекциях и онкологии , или даже у здоровых лиц, но он должен быть в низком титре. Менее 2:640. С 2:640идет выявление только при обострениях СКВ. Поэтому есть некоторая вероятность того, что это не СКВ, но пока я склоняюсь к такому диагнозу. Рекомендую повторить исследования через 22мес. Сейчас принимать витамин Д в дозе 5.000если анализ на витамин будет ниже 30нг/мл,.прием ежедневно кроме дней когда загораете или находитесь на воздухе до 12.00. Восстанавливает волосы очень хорошо но только долго пить не менее 2мес, с периодичеким контролем, чтоб было в крови 40-60 нг/мл. Также необходимо делать маски с соком лука, кашицей чеснока и желтком и медом, все в равных количествахh столовой ложке. Курс 3часа3-7раз.
На сервисе СпросиВрача доступна консультация ревматолога онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!

Здравствуйте, некоторые проявления действительно похожие на дебют волчанки. Ядерный тип свечения м.б. при ряде аутоимунных заболеваний. У Вас В моче были эритроциты? Есть ли очаговое выпадение волос? Кожный синдром? Реагируете на солнце? Все таки, были артриты с деформацией суставов или только артралгии? Что в биохимии (интересует ггтп,кфк,щф,алт,аст, общий белок, креатинин, мочевина) и какая цифра лекцоцитов?
Кристина, Кристина, эритроцитов в моче не было, волосы сильно выпадали осенью и зимой, прям очень выпали, но не очагово. На солнце не было никогда реакции, равномерно ложится загар,никогда не сгораю. Эту весну периодически горело лицо,но я принимала различные лекарства от неврологов, думала,от них, или из-за тахикардии.
Деформация визуально есть, особенно в области больших пальцев рук, шишки.
Я не поняла сокращение, поэтому просто перепишу из анализа (все норма): общий белок 74, билирубин об. 13,4, билирубин по. 4,9, АЛС 20, АСТ 17, гамма-глутамилтрансфераза 12, щелочная фотосфаза 43, мочевина 3,8, креатинин 63, мочевая кислота 173, глюкоза 4,36, холестерин 4,16. Лейкоциты от 19.05 - 3,24 (норма 4-8,8) и от 03.06 - 3,5 (норма 4,5-11)

Лейкопения пусть и небольшая сохраняется., Гематологический синдром уже есть.пришлите фото суставов и высыпаний,если имеются. Температура была?
На нефрит сейчас не тянет-белок у вас 0.1 (а цилиндры были в моче?)
Я бы дополнительно отправила Вас на с3 компонент комплемента, антитела к кардиолипину, гликопротеину, реакцию Вассермана, дополнительно провела экг и эхог.
Кристина, температуру иногда намеряли 37,1-37,4 мне, просто начали при карантине у всех при входе в поликлиники измерять, раза 4 была такая. Сама не ощущала и дома специально не измеряла. Цилиндров в моче не было. Раньше сдавала мочу, терапевт говорила,что все нормально, сама не смотрела результаты. ЭКГ делала в марте, синусовый ритм, и эхокардиографию делала зимой, кардиолог сказала,что там было в норме.
Как здесь прикрепить фото, не могу разобраться.



Здравствуйте!Диагноз СКВ настолько трудно и редко ставят, приеюмерно 1раз в год, что если вам его озвучили, вряд ли можно оспорить и снять. Я так понимаю, лечение не требуется азначили? Базовая терапия, Преднизолон, метатрекчат или ещё что нибудь. Что подавляет аутоиммунное воспаление. Поэтому процесс продолжается.насчет ошибки, в Москве в институте ревматологии можно уточнить
Ирина, назначили Иммард 200 2 раза в сутки. В связи с коронавирусом очень сложно хоть куда-то пробиться.

Здравствуйте! От СКВ тут пока только лейкопения и белок в моче, этого маловато. Какие были лейкоциты? Повторный анализ мочи делали?
Нет ли на коже изменений, особенно на лице? Не выпадают ли волосы гораздо сильнее, чем обычно? Не белеют ли или не синеют пальцы рук на холоде? Нет ли аллергии на солнце? Сейчас припухание и постоянные боли в каких то суставах есть? Как вы питаетесь, ест ли аппетит? Принимаете ли витамин Д?
Марина, Лейкоциты от 19.05 - 3,24 (норма 4-8,8) и от 03.06 - 3,5 (норма 4,5-11). Повторно мочу пока не делала.
На лице мне кажется, что немного огрубела кожа на подбородке и в районе лба, но не помню, было ли такое раньше.
Аллергии на солнце никогда не было. Волосы сильно выпали зимой, ломкие. Витамин Д не принимаю. Пальцы рук на холод не реагируют. Припухлости нет, есть шишки на больших пальцах кистей и на мизинце с прошлого года. На данный момент не растут и чувства жжения уже нет. Аппетита нет, заставляю себя есть, так как страшно на весы вставать уже.

Витамин Д принимаем 2000МЕ в день, это 4 капли аквадетрима или детримакса. Сходить к психотерапевту, тревожно и очень много.
Пока волчанки я тут не вижу. Иммуноблот через месяц в проверенной лаборатории.
К анализам которые я выше написала, можно ещё антитела к лейкоцитам сдать.
Читайте также:

