Автор вирусо генетической теории происхождения злокачественных опухолей
Обновлено: 24.04.2024
Опухоли повсюду
В XX веке опухоли или опухолеподобные процессы нашли практически у всех многоклеточных организмов, в том числе у беспозвоночных, и даже у гадрозавров, обитавших в меловом периоде. (У других семейств динозавров опухолей пока не обнаружили. Возможно, различные группы динозавров имели разную предрасположенность к новообразованиям.) Вообще, чем выше организация животных, тем чаще у них возникают опухоли. Например, у насекомых они встречаются чаще, чем у всех более низкоорганизованных беспозвоночных, у позвоночных чаще, чем у низших хордовых (оболочников и ланцетников), а у костистых рыб чаще, чем у хрящевых. Опухоли беспозвоночных и низших позвоночных отличаются от опухолей млекопитающих. Так, новообразования рыб, как правило, менее агрессивны, более дифференцированны и реже метастазируют. У рыб и тритонов описаны сезонные опухоли с полной регрессией — феномен, неизвестный у млекопитающих.
Опухоли не редкость и у растений. Их вызывают самые разные факторы внешней среды (например, облучение или ранения) или патогены (бактерии, вирусы, простейшие). Большую группу опухолей растений составляют спонтанные новообразования генетической природы.
Примером растительных опухолей могут служить так называемые корончатые галлы, возникающие под влиянием опухолеобразующих бактерий Agrobacterium tumefaciens. Исследования последних десятилетий показали, что A. tumefaciens трансформирует клетки растений фрагментом ДНК (T-DNA, transferred DNA) большой Ti-плазмиды (tumor inducing plasmid). Т-ДНК включает растительные онкогены, продукты которых, ауксины и цитокины, стимулируют деление клеток и образование опухоли. Кроме того, Т-ДНК содержит ген, кодирующий фермент синтеза опинов — производных аминокислот, которые бактерии (но не растение) используют в качестве источника углерода, азота и энергии. Сильно пораженные растения становятся чахлыми, мелкими и непродуктивными. Таким образом, корончатые галлы представляют собой настоящую инфекционную опухолевую патологию у растений и по своей природе близки к истинным опухолям животных.
Систематизировав и обобщив множество наблюдений и экспериментальных фактов, сравнительная онкология сформулировала представление о широкой распространенности опухолей у многоклеточных организмов, включая беспозвоночных и растения. Поэтому опухоли вполне могут играть какую-то роль в эволюции многоклеточных.
В этой статье мы рассмотрим свидетельства в пользу возможной положительной роли опухолей в эволюции, в том числе наши собственные экспериментальные данные, полученные в Биомедицинском центре. При этом вслед за Н. Н. Петровым мы будем рассматривать не отдельные формы злокачественных опухолей, а все виды избыточного клеточного роста у многоклеточных организмов, включая опухолеподобные процессы у беспозвоночных и растений, доброкачественные опухоли и опухоли на ранних стадиях прогрессии.
Опухоли — эволюции
Многие опухоли и полученные из них клеточные линии продуцируют белки, нехарактерные для тканей или клеточных типов, из которых произошли эти опухоли.
Другое эволюционно важное свойство опухолевых клеток — их способность к дифференцировке с одновременной потерей злокачественности.
В 70-х годах XX века ученые из разных стран установили, что диметилсульфоксид, добавленный в культуру опухолевых клеток, вызывает их дифференцировку. Аналогично действует на некоторые мышиные миелоидные клеточные линии фактор CSF, вызывающий образование колоний. В 1975 году Беатриса Минц (США) и Карл Ильмензее (Швейцария) установили, что клетки тератокарциномы, введенные в мышиный эмбрион на стадии бластулы, утрачивают злокачественность и участвуют в образовании нормальных тканей. В результате получаются нормальные генетически мозаичные мыши. Таким образом, даже клетки опухолей млекопитающих способны к дифференцировке с утратой злокачественности. Что касается опухолей беспозвоночных и низших позвоночных, то они изначально более дифференцированы и менее злокачественны, чем у млекопитающих.
Способность опухолевых клеток дифференцироваться в различных направлениях вместе с утратой злокачественности и активация в опухолях генов, которые не экспрессируются в нормальных тканях, но присутствуют в геноме, в том числе эволюционно новых генов, теоретически может приводить к возникновению эволюционно новых типов клеток.
Положительная роль патологий
До настоящего времени в науке господствует представление, что патологические процессы не могут играть положительную роль в эволюции. Но это не так. Наука знает примеры патологий и патогенов, имеющих приспособительное и/ или положительное эволюционное значение. Например, эволюции могут способствовать вирусы, переносящие гены между организмами разных видов.
Другой пример адаптивной молекулярной патологии — признак серповидноклеточности эритроцитов, связанный с некоторой устойчивостью к малярийному плазмодию Plazmodium falciparum. Эта болезнь вызвана альтернативной формой гемоглобина A, HbS. Эритроциты, содержащие такой гемоглобин, имеют серповидную форму, что приводит к повышению вязкости крови, замедлению кровотока и застою крови в капиллярах. Анемия, отечность, гемолиз, воспаление — вот неполный перечень симптомов серповидноклеточной анемии. Однако в районах с высоким распространением малярии частота мутантного аллеля HbS выше, поскольку гетерозиготные носители этого аллеля менее восприимчивы к малярии. Вообще, эволюция невозможна без мутационного процесса, хотя значительная часть мутаций (если не большинство) вредна для индивидуальных организмов.
Мутационный процесс имеет две стороны. Он приводит к нарушениям в сбалансированных молекулярных механизмах и работает как генератор разнообразных болезней, но он же поставляет новый генетический материал для отбора.
Все сказанное о мутациях справедливо и для опухолей. Хотя развитие опухоли вредно для индивидуальных организмов, но оно обеспечивает избыточные массы клеток с высоким уровнем биосинтеза, из которых в ходе эволюции иногда могут возникать новые клеточные типы.
Полезные опухоли
Бактерии рода Rhizobium вызывают на корнях бобовых опухоли — азотфиксирующие клубеньки. Населяющие их бактерии фиксируют азот, используемый самим растением, поэтому опухоль фактически превратилась в новый орган с регулируемой функцией. Существенное отличие клубеньков от обсуждавшихся выше опухолей, вызываемых A. tumefaciens, заключается в том, что опухоли, вызываемые агробактериями, полезны только самим бактериям, а растению вредны.
Для фиксации азота необходим леггемоглобин, который составляет около 40% растворимых белков клубеньков и кодируется геном растения. Ученые предполагают, что ген леггемоглобина — результат дупликации и последующей дивергенции гена, кодировавшего несимбиотический гемоглобин, и для бобовых относительно нов.
Мы предполагаем, что в эволюции сначала появилась популяция рыб с локусом Tu и высокой предрасположенностью к развитию меланом. После этого мог возникнуть ген R, который блокировал развитие меланом, и это в конечном счете привело к появлению полезного для рыбы признака — маскировочных пятен (макромеланофор).
Позднее оказалось, что локус Ти включает два тесно сцепленных гена: Mdl, определяющий различные типы пигментирования, которые связаны с макромеланофорами (Mdl -macromelanophore determining locus), и онкоген Xmrk. Оба гена относительно новы и возникли незадолго до появления рода Xiphophorus (5–6 миллионов лет назад). Самки Xiphophors maculatus предпочитают самцов с увеличенной экспрессией меланина, связанной с присутствием онкогена Xmrk. Макромеланофоры у X. maculatus представляют собой меланому, стабилизировавшуюся в результате удачной комбинации онкогена, гена-супрессора и определяющего пигментацию гена Mdl. Благодаря этой комбинации половой отбор поддерживает присутствие онкогена в популяции.
Нужны новые концепции!
В тех случаях, когда экспрессия нового гена в клетках опухоли приводила к возникновению новой функции, одновременно возникали новые обратные связи, регулирующие его деятельность. Клетки опухоли дифференцировались и давали начало новому для данного вида многоклеточных организмов типу клеток, который наследовался благодаря эпигеномным механизмам, как и предсуществовавшие типы клеток. Схема этого процесса показана на рисунке.
Популяции организмов-опухоленосителей, у которых опухоли были генетически или эпигенетически детерминированы, могли представлять собой переходные формы между видами организмов, находящихся на разных ступенях прогрессивной эволюции. Примером такого рода популяций опухоленосителей служат упомянутые выше гадрозавры.
В определенные периоды филогенеза дифференцировка опухолевых клеток в популяциях опухоленосителей должна была происходить достаточно часто, чтобы давать популяции организмов с новым типом клеток. Эти организмы затем проходили отбор на конкурентоспособность и приспособленность, как мы видим у рыб рода Xiphophorus.
Новые типы клеток могли принимать участие в образовании новых тканей и органов, например клубеньков бобовых или костных разрастаний на головах гадрозавров, с помощью которых они, как принято считать, издавали различные звуки.
У млекопитающих насчитывают от 200 до 500 специализированных типов клеток. Так что если опухоли действительно играли роль в происхождении новых клеточных типов, то происходило это достаточно редко.
Итак, в соответствии с концепцией эволюционной роли опухолей они предоставляют условия для экспрессии эволюционно новых и/или спящих генов, которые не экспрессируются в нормальных клетках и потому не подвержены в них действию естественного отбора и не имеют функции. Изменение этих последовательностей ДНК в зародышевых клетках и их экспрессия в опухолях могут привести к возникновению гена с новой функцией, что в свою очередь вызовет дифференцировку опухолевых клеток в соматические клетки нового типа. Очень важно то обстоятельство, что для возникновения нового гена и новой функции недостаточно только эволюции последовательности на уровне ДНК. Необходимы также ее экспрессия и отбор на новую функцию на уровне РНК и /или белка, который должен начаться в определенной момент эволюции новой последовательности.
Предсказания и их подтверждение
Концепция эволюционной роли опухолей позволяет выдвигать экспериментально проверяемые гипотезы. Так, мы предположили, что в опухолях должно экспрессироваться много последовательностей, которые не проявляют себя ни в каких нормальных типах клеток, причем последовательности эти либо эволюционно новые, либо ранее молчащие, и что в опухолевых клетках происходит отбор на новые функции. Начиная с 1980-х годов, мы работали над экспериментальным подтверждением этих гипотез и показали, что в опухолях млекопитающих экспрессируются последовательности, не экспрессирующиеся ни в одной экспериментально доступной нормальной ткани.
Насколько эволюционно новы обнаруженные нами опухолеспецифические последовательности? Среди первых девяти изученных новыми оказались шесть: две из них возникают у человека, одна — у приматов, а три другие найдены только у млекопитающих и эволюционируют нейтрально, о чем свидетельствуют высокая скорость нуклеотидных замен и отсутствие консервативных фрагментов в их составе.
Затем мы применили противоположный подход — исследование опухолевой специфичности генов, о которых известно, что они эволюционно новые. В настоящее время, когда полностью секвенированы геномы многих видов организмов, такие гены можно обнаружить. И первый же изученный нами ген (PBOV1, prostate and breast cancer overexpressed 1), эволюционно новый для человека, оказался абсолютно опухолеспецифичным — он экспрессировался в 20 опухолях различной локализации и ни в одной из 19 нормальных тканей!
Таким образом, предположение об экспрессии эволюционно новых и/или спящих последовательностей в опухолях получило экспериментальное подтверждение.
Объяснение парадоксов
Совсем недавно ученые из разных зарубежных лабораторий получили данные о скорости эволюции некоторых опухолеспецифических генов у разных видов млекопитающих, включая приматов. Для этого последовательности опухолеспецифических генов человека сравнивали с последовательностями аналогичных генов приматов и мыши. Оказалось, что скорость эволюции таких генов выше, чем у нормальных тканеспецифических генов, что свидетельствует об отборе на новую функцию. Эти данные можно рассматривать как прямое свидетельство в пользу нашей концепции. Действительно, если эволюционно новый ген экспрессируется в опухоли или нейтральная последовательность приобретает функцию и становится эволюционно новым геном, должен иметь место отбор на усиление новой функции, который связан с более высокой скоростью замен в нуклеотидной последовательности. Именно это и было обнаружено в упоминавшихся работах. Следует подчеркнуть, что речь идет об эволюции организмов, а не об эволюции злокачественных клеток опухоли. Парадокс позитивной селекции опухолеспецифических генов в эволюции организмов нельзя объяснить иначе, как допустив позитивную роль опухолей в эволюции.
Рассмотренные выше бобово-ризобиальный симбиоз и маскировочные пятна у рыб рода Xiphophorus также связаны с экспрессией в опухолях эволюционно новых для организма генов, которая сопровождалась приобретением функции и утратой автономности опухолевыми клетками. Список подобных примеров можно продолжить.
Новые парадигмы — новые технологии
Итак, мы видим, что опухоли в ряде случаев могли играть роль в эволюции, снабжая многоклеточные организмы избыточными клеточными массами для экспрессии новых генов. Популяции организмов-опухоленосителей, возможно, служили переходными формами между разными видами, которые отличаются количеством типов клеток.
Концепция возможной эволюционной роли опухолей позволяет объяснить механизмы возникновения новых типов клеток у многоклеточных, что до последнего времени упрощенно сводили только к появлению новых генов. Она также объясняет парадокс позитивной селекции множества опухолеспецифических генов в ряду млекопитающих и приматов, необъяснимый другим путем. Она позволяет формулировать нетривиальные предсказания, планировать эксперименты по их подтверждению и получать оригинальные результаты.
Концепция эволюционной роли опухолей, как всякая новая парадигма, значительно расширяет наши представления о природе опухолей и о возможностях влияния на опухолевые процессы. Из нее следует, что в области лечения и профилактики онкологических заболеваний следует больше внимания уделять подходам, связанным с возможностью дифференцировки опухолевых клеток и их включения в функциональные сети организма; что следует искать эволюционно новые опухолеспецифические гены как возможные мишени терапевтических и/или профилактических воздействий, а также использовать их в молекулярной диагностике.
В настоящее время широкое признание приобрела вирусно-генетическая теория происхождения опухолей, которая еще в 1908— 1911 гг. получила экспериментальное подтверждение на примере лейкоза и сарком кур.
Сегодня не стоит вопрос, могут ли вирусы вызвать опухоли, особенно у экспериментальных животных, речь идет о другом — как широк круг опухолей, вызываемых ими, и каков механизм этого явления. Эти вопросы до недавнего времени оставались нерешенными, и только после разработки нашим замечательным ученым А. Зильбером вирусно генетической теории возникновения опухолей стало возможным выяснить некоторые из них.

Основные положения этой теории сводятся к следующему: онкогенный вирус (вирус, образующий раковую опухоль) осуществляет наследственное (передающееся от клетки к клетке) превращение нормальной клетки в опухолевую благодаря проникновению вирусного генома (единица наследственности, несущая определенную информацию) или его части в гене клетки животного. Эти два генома интегрируют (сливаются) между собой, придавая клетке совершенно новые свойства. Внедрившийся вирус (его геном) уже не играет роли в размножении трансформированных клеток, в образовании опухолей, и он, как правило, исчезает из крови и ткани в которой была опухоль.
Онкогенные вирусы могут жить в нас без образования опухоли
Большинство из известных онкогенных вирусов способно длительно, а иногда и пожизненно латентно (без проявления активности) существовать в организме без образования опухоли. Но затем, в силу еще не установленных причин, вирусы активируются, вызывая появление опухоли, представляющей смертельную опасность для организма животного. Причинами активизации вируса, вероятно, могут быть как внешние, так и внутренние факторы, снижающие или полностью подавляющие защитные силы организма — носителя онкогенного вируса.
Возникает законный вопрос: существуют ли специфические онкогенные вирусы или все инфекционные вирусы способны на опухолевую трансформацию? В настоящее время существуют доказательства значительного сходства функций онкогенных и инфекционных вирусов. В самом деле, такие типичные онкогенные вирусы, как вирус саркомы Рауса (вирус назван по имени ученого, открывшего его, — П. Рауса), вирус полиомы, вызывающий много разных опухолей, и другие, в определенных условиях могут оказаться причиной неопухолевых заболеваний. Иными словами, взаимодействие опухолеродных вирусов с клетками животных может проходить либо по типу латентной инфекции, либо опухолевой трансформации или заканчивается размножением инфекционного вируса с развитием характерных для вирусной инфекции изменений животной клетки. И наоборот, некоторые инфекционные вирусы (аденовирусы человека и животных, вирус герпеса и др.) могут вызывать развитие опухоли у животных. Таким образом, характер болезни (латентное сохранение генома вируса в клетке, перерождение клетки в опухолевую или развитие вирусов в клетке) обусловливается главным образом характером взаимодействия вируса с клеткой, физиологическое состояние и геном которой влияют на проявление функции наследственного аппарата вируса. Поэтому изучению молекулярных механизмов, регулирующих процессы в клетке, инфицированной онкогенными вирусами, уделяют серьезное внимание биологи, биофизики, генетики и онкологи.

Изучение этиологии онкологических заболеваний длится уже много десятилетий. В результате этих исследований были обнаружены онкогенные вирусы. Их роль в возникновении онкологических заболеваний была продемонстрирована на многих моделях: саркоме Рауса у кур, папилломе и раке кожи у кроликов, лимфоме у цыплят. Однако еще в прежние времена у всех исследователей возникал вопрос: куда исчезает вирус после злокачественного перерождения клетки?. Ни один метод не мог его обнаружить в раковой клетке.
Противоречие удалось объяснить русскому ученому Л.А. Зильберу - создателю вирусно-генетической теории происхождения злокачественных опухолей.
Для трансформации нормальной клетки в опухолевую необходимо взаимодействие генома вируса и клетки, в результате которого образуется новый комплексный геном и вирус "исчезает" из клетки, оставаясь в ее ядре в виде провируса. Было выявлено, что процесс злокачественного перерождения зависит как от вируса, так и от клетки-хозяина.
Благодаря развитию молекулярной биологии установлено, что в нормальных клетках существует семейство генов- протоонкогенов. Эти гены необходимы для регуляции и размножения клеток. Их продуктами являются различные протеокиназы и факторы транскрипции. Различные внешние факторы могут воздействовать на протоонкоген клетки и вызывать его превращение в онкоген. Под их влиянием включается генетический механизм перерождения нормальной клетки в злокачественную.
Одним из факторов генетического воздействия на геном клетки могут быть вирусы, которые могут содержать (onc+) или не содержать онкоген (onc-). Вирус onc+, интегрируясь в хромосому клетки, одновременно вносит в нее онкоген со всеми вытекающими последствиями для клетки. Онкоген вируса, соединившись с хромосомой клетки, наделяет ее способностью к безграничному размножению.
Вирус onc-, проникнув в клетку на первом этапе взаимодействия генома с геном клетки-хозяина, не вызывает ее трансформации. Однако развитие событий зависит от локализации этого контакта. Если вирус onc- интегрируется в хромосому рядом с одним из протоонкогенов, он подчиняет его работу своему промотору. Выходя из хромосомы, вирусный геном захватывает с собой протоонкоген, который становится его составной частью и превращает вирус onc- в вирус onc+. Клеточный онкоген выходит из-под контроля материнской клетки. Интегрируясь в хромосому другой клетки, вновь образованный вирус onc+ одновременно вносит в нее онкоген и активирует трансформацию клетки в злокачественную.
В дальнейшем оказалось, что онкогенез вирусов зависит от реакции клетки. Гены p53 и Rb кодируют опухоль-супрессирующие белки. Ген р53 является супрессором опухолевого роста. В результате его деятельности происходить ограничение размножения клеток. Rb- ген кодирует белок, контролирующий клеточную пролиферацию. В результате его деятельности замедляется клеточная пролиферация.
Против вирусно-генетической теории может свидетельствовать наличие онкогенных свойств не только у ДНК-содержащих, но и у РНК-содержащих вирусов, что исключает включение РНК-генома вируса в ДНК-геном клетки хозяина. Однако это противоречие было устранено после открытия РНК-зависимой ДНК-полимеразы, которая на базе вирионных РНК синтезирует ДНК-копию, способную к интеграции с ДНК-геномом клетки. Механизм онкогенеза реализуется в результате активации протоонкогена включением в геном клетки ДНК- провируса. Роль вируса в злокачественном перерождении клеток сводится к пусковому механизму онкогенеза.
В 1946 г. выдающийся советский вирусолог Лев Александрович Зильбер предложил вирусогенетическую теорию рака. Согласно этой теории, вирусы вызывают рак, но в отличие от других заболеваний вирусного происхождения рак – патологический процесс, а не инфекционный.
При онкогенезе ДНК вирусного происхождения внедряется (интегрируется) как фрагмент в ДНК клетки и становится составной частью клеточного генома. Поэтому при электронно-микроскопическом исследовании опухолей далеко не всегда в их клетках можно обнаружить вирус. Эта интеграция – начальное звено в цепи процессов превращения нормальной клетки в раковую.
Впервые возможность интеграции вирусных геномов в геном клетки была установлена на умеренных фагах. При заражении бактериальных клеток фагами может либо развиться острая инфекция, заканчивающаяся лизисом бактериальной клетки и выходом из нее новых фаговых частиц, либо произойти интеграция генома фага с геномом бактериальной клетки.
В середине 1950-х гг. американский ученый Ренато Далбекко показал, что вирус полиомы, подобно умеренным фагам, либо размножается обычным путем и вызывает острую инфекцию клеток, либо его геном интегрируется в геном клетки, после чего может вызвать ее злокачественную трансформацию.
Большую роль в развитии рака может играть действие химических и физических канцерогенов, а также старение организма. У кур, зараженных вирусом птичьей оспы, при смазывании кожи метилхолантреном развивается рак кожи. Нанесение дегтя на кожу кролика, зараженного вирусом папилломы Шоупа, сокращает латентный период и увеличивает частоту образования опухолей.
ДНК- и РНК-содержащие вирусы
Среди опухолеродных вирусов есть ДНК- и РНК-содержащие. ДНК-содержащие вирусы разделяются на следующие 5 классов.
1. Полиомавирусы – обезьяний вирус SV40, вирус полиомы мышей и вирусы человека ВК и JC.
2. Папилломавирусы – 16 вирусов папилломы человека и множество папилломовирусов животных.
3. Аденовирусы – 37 вирусов человека, множество аденовирусов животных (например, 24 вируса обезьян и 9 вирусов крупного рогатого скота).
4. Герповирусы – вирусы простого герпеса человека, цитомегаловирус человека, вирус Эпштейна–Барр и онкогенные вирусы приматов, лошадей, кур, кроликов, лягушек.
5. Вирусы, подобные вирусу гепатита В, – вирус гепатита В человека, гепатита североамериканского сурка, гепатита земляных белок и гепатита уток.
РНК-содержащие опухолеродные вирусы разделяются на 4 класса.
1. Вирусы типа С – возбудители лейкозов и сарком.
2. Вирусы типа В – вирус рака молочных желез мышей.
3. Вирусы типа А.
4. Вирусы типа D – вирус, выделенный при раке молочных желез обезьян резус, и вирус, выделенный из перевиваемых клеток человека.
Объяснение возникновения рака интеграцией вирусного и клеточного геномов, данное Л.А. Зильбером, было понятно для ДНК-содержащих вирусов. Однако его теория сталкивалась с большими трудностями в случае онкогенных вирусов, содержащих РНК, поскольку вирусная РНК не может встраиваться непосредственно в геном клетки.
Между ДНК- и РНК-содержащими опухолеродными вирусами существуют кардинальные различия. При заражении клеток ДНК-содержащими вирусами происходит либо репликация, приводящая к инфекции, либо интеграция геномов, приводящая к трансформации клетки. РНК-содержащие вирусы индуцируют только трансформацию нормальной клетки в злокачественную, т.е. при заражении клетки таким вирусом должна происходить интеграция их геномов.
Только в 1970 г. американские ученые Г.Темин и Мицутани и независимо от них Д.Балтимор разрешили эту загадку. Они доказали возможность передачи генетической информации от РНК к ДНК. Это открытие перевернуло центральную догму молекулярной биологии о том, что генетическая информация может переноситься только в направлении ДНК–РНК–белок.
Пять лет понадобилось Г.Темину для обнаружения фермента, осуществляющего перенос информации от РНК к ДНК, – РНК-зависимой ДНК-полимеразы. Этот фермент получил название обратной транскриптазы. Г.Темину удалось не только получить фрагменты ДНК, комплементарные заданной цепи РНК, но и доказать что ДНК-копии могут встраиваться в ДНК клеток и передаваться потомству.
Группа РНК-содержащих вирусов, в цикле развития которых по геномной РНК с помощью обратной транскриптазы осуществляется синтез ДНК, встраивающейся затем в геном клетки хозяина, получила название ретровирусов (Retroviridae – от REversed TRanscription). В семейство ретровирусов входят вирусы саркомы Рауса, миелоцитоматоза, саркомы мышей Харви и Молони, лейкоза птиц, ретикулоэндотелиоза птиц, лейкоза мышей, Т-клеточного лейкоза человека, иммунодефицита человека.
Вирусная ДНК, встроившаяся в геном эукариотической клетки-хозяина, может в течение многих поколений никак себя не проявлять. Однако при определенных условиях вирусные гены могут активироваться и вызывать либо репликацию вируса, либо превращение клетки в раковую.
Многочисленные работы, проведенные в 1970–1980-х гг. показали, что у многих видов животных есть гены, похожие, но не совпадающие с генами ретровирусов. Эти гены животных и человека иногда называют эндогенными ретровирусами (HERV), или провирусами.
Обычно HERV не активны и менее онкогенны для вида-хозяина, чем экзогенные. Возможно, вызывающие рак гены ряда ретровирусов когда-то, на ранних этапах биологической эволюции, закрепились в ДНК предков вида-хозяина. При репликации всей ДНК клетки онкогены передавались из поколения в поколение. По оценкам ученых HERV появились в геноме предков человека приблизительно 50 млн лет назад.
Интеграция экзогенного ретровируса в геном хозяина не сайт-специфична (случайна), поэтому закрепление его в геноме подчиняется достаточно жестким правилам. Поскольку провирус не исчезает из генома, присутствует во всех клетках своего носителя и распространяется по популяции, то его присутствие должно быть безвредным для организма и, возможно, дает какие-то преимущества своему хозяину.
Имеются данные об участии HERV в регуляции экспрессии генов, в эмбриональном развитии, в предотвращении заражения родственными экзогенными ретровирусами, в иммуносупрессии и развитии некоторых аутоиммунных заболеваний.
Необходимо упомянуть также, что существует теория происхождения ретровирусов из клеточных генов. Главную роль в этом процессе отводится обратной транскриптазе, включению созданных ею ДНК в ДНК клетки и процесс рекомбинации (Г.Темин).
Опухолеродные вирусы, как правило, видоспецифичны, т.е. поражают животных только определенного вида. Но из каждого правила есть исключения. Например, вирусом куриной саркомы можно заразить крыс, кроликов, хомячков, обезьян, ящериц и даже змей.
Группа ученых под руководством Б.А. Лапина установила, что вирус лейкоза человека может вызывать сходное заболевание у двух видов обезьян. Это привело к созданию экспериментальной модели для изучения всех стадий развития заболевания, начиная с самых первых этапов.
Исследователи показали, что при заражении клетки ретровирусом синтез его ДНК происходит в два этапа: вначале по нити вирусной РНК синтезируется комплементарная ей нить ДНК, затем на последней достраивается комплементарная ей вторая нить ДНК и одновременно происходит, деградация нити РНК вируса.
Онковирусы могут принимать участие в развитии иммунологических заболеваний. Так, при изучении красной волчанки методом молекулярной гибридизации было показано, что в ДНК клеток пораженных болезнью тканей имеются последовательности, комплементарные РНК вируса кори и обратная транскриптаза. Это указывало на экспрессию онковируса в клетках больных волчанкой.
На основании полученных данных было высказано предположение, что на начальных стадиях заболевания происходит взаимодействие коревого вируса с латентным онковирусом. В результате обратная транскриптаза онковируса транскрибирует коревую РНК в ДНК, которая затем встраивается в геном клетки. Экспрессия этих дополнительных генов проявляется в синтезе специфических вирусных белков, часть из которых встраивается в мембраны клеток и изменяет их свойства. Эти клетки становятся чужеродными для организма и подвергаются атаке собственной иммунной системы.
Онковирусы могут активироваться при трансплантации (пересадке) тканей. Рассмотрим следующий пример. При скрещивании двух чистых линий мышей рождается потомство, толерантное к пересадке тканей любого из родителей: все виды тканей, включая и лимфоидную, содержащую иммуноактивные клетки, приживаются. Однако если перед пересадкой лимфоидной ткани у реципиента подавить иммунную систему, то после трансплантации у мышей резко усиливается экспрессия онковирусов. С течением времени у животных развиваются злокачественные лимфомы.
Возможно, онковирусы – нормальные компоненты организма, принимающие участие в процессах клеточного цикла, дифференциации и пролиферации. Тогда старение, действие физических и химических канцерогенов может вызвать развитие рака. Однако присутствие канцерогенов нехарактерно для естественной среды обитания, а заболевание особей, вышедших из репродуктивного периода, не может отразиться на судьбе популяции. В то же время, интегрированный в геном клетки онковирус со слабыми онкогенными свойствами может защитить клетку от родственного высокоактивного вируса.
ДНК-вирусы как причина развития рака - вирусный канцерогенез
В канцерогенезе также могут участвовать ДНК-содержащие вирусы. Наиболее крупные ДНК-содержащие вирусы принадлежат к группе герпесвирусов. Первым вирусом, выделенным из культуры опухолевых клеток, был вирус Эпштейна-Баррра (ЭБВ).
Вирус был получен из культуры опухолевых клеток больных лимфомой Беркита. В культуре in vitro ЭБВ вызывает бесконечную пролиферацию человеческих В-лимфоцитов. Вирусные гены, встраиваясь в геном этих клеток, инициируют пролиферацию путем активации клеточных генов-регуляторов роста (онкогенов).
В крови больных лимфомой Беркита обнаруживается более высокий, чем у здоровых людей, титр антител к антигенам вирусной оболочки и к мембранным антигенам. В то же время в африканских странах среди множества детей, инфицированных этим вирусом, лимфома развивается только в единичных случаях.
Механизм онкогенеза этого заболевания не может быть объяснен только вирусным заражением. К тому же, за пределами африканского континента регистрируются случаи заболевания лимфомой Беркита, абсолютно не связанные с инфицированием вирусом ЭБВ. По-видимому, ЭБВ также может принимать участие в патогенезе карциномы носоглотки, так как клетки этой опухоли экспрессируют вирусные антигены EBNA-1.
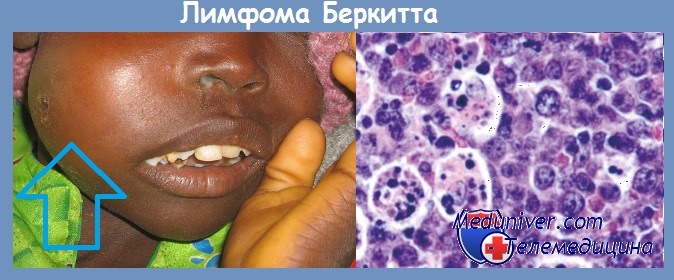
При исследованиях саркомы Капоши, развивающейся у больных СПИДом, в 1994 г. из ее клеток был выделен новый герпесвирус. Первоначально вирус получил название герпес-вируса саркомы Капоши (ГСК), впоследствии он был переименован в герпесвирус человека серотип 8 (ГВЧ 8). Вирус обнаруживается в веретеновидных клетках саркомы Капоши практически при всех случаях заболевания.
ГВЧ 8 был также найден в опухолевых клетках первичной эффузионной лимфомы и в клетках многоочаговой болезни Кастлемана. Данный вирус кодирует синтез циклина, который является промотором клеточного деления, чем и объясняется высокая пролиферативная активность инфицированных клеток.
Человеческие папилломавирусы (ПВЧ) вызывают кожные бородавки и ряд доброкачественных папиллом. Это весьма обширный класс вирусов, и некоторые его представители могут в той или иной степени участвовать в развитии злокачественных опухолей. Большинство вирусов вызывает лишь ограниченную пролиферацию клеток, но ряд серотипов может вызвать и развитие злокачественных новообразований.
Наибольшую опасность с точки зрения онкологии представляют серотипы 16, 18, 31 и 33. Более 90% опухолей карциномы шейки матки in situ обнаруживают в своих клетках генные последовательности вирусов ПВЧ. Эти вирусы также играют значительную роль в возникновении инвазивных и многоочаговых плоскоклеточных раков кожи, которые часто развиваются у больных после долгосрочных курсов иммуносупрессивной терапии.
Механизмы вирусного канцерогенеза в этом случае изучены недостаточно. В исследованиях доказано, что существует вероятность включения вирусной ДНК в клетки базального эпителия. Обычно в клеточную ДНК внедряются восемь ранних и два поздних гена. Ранние гены Е6 и Е7 вызывают пролиферацию клеток.
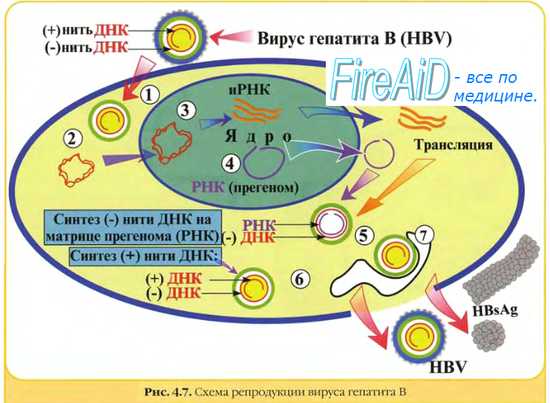
Вирус гепатита В четко связывают с развитием печеночно-клеточного рака. Риск развития этого заболевания у инфицированных вирусом в 200 раз превышает таковой у неинфицированных людей. Механизмы зарождения рака не до конца понятны: считается, что вирус вызывает бесконечную пролиферацию клеток, хотя зараженные вирусом клетки уничтожаются иммунной системой организма. Возможно, что пролиферирующие клетки становятся чувствительными к другим канцерогенам, например к афлатоксину.
Подытоживая вышесказанное, можно заключить, что основным механизмом канцерогенного воздействия является повреждение молекул ДНК и нарушения процессов ее репарации. Если не происходит исправления первичных повреждений ДНК, ошибки со временем начинают накапливаться, что ведет к дестабилизации структуры хромосом и к соматическим мутациям. Большинство таких мутаций летальны для клетки.
Однако, если часть клеток выживает, происходит постепенное накопление клеточной массы с опухолевым фенотипом, что в итоге приводит к клиническим проявлениям. Большой вклад в понимание этого процесса внесли современные исследования механизмов регулировки клеточного цикла и недавнее открытие регуляторных белков, которые запрещают клетке делиться, если ее геном сильно поврежден.
Для развития опухоли может быть недостаточно единичных мутаций в генах-регуляторах деления, но накопление массы ошибок в регуляторных генах может привести к фатальным последствиям. Особенно критичны мутации в генах, регулирующих клеточное деление, так называемых онкогенах. Очень опасны также мутационная инактивация генов, подавляющих клеточное деление — генов-подавителей опухоли, и мутации в генах, кодирующих белки, запрещающие деление при повреждении клеточного генотипа.
Накопление числа жизнеспособных мутаций по одному или нескольким из этих генов приводит к общей клеточной дезорганизации и к потере контроля над клеточным делением. В следующем разделе мы рассмотрим механизмы действия онкогенов и наиболее важные моменты контроля над клеточным циклом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

