Бактериальный сепсис новорожденного неуточненный что это
Обновлено: 19.04.2024
- поздний неонатальный сепсис, реализация которого происходит в возрасте > 72 часов после рождения.
Этиология и патогенез
Этиология
Ранний неонатальный сепсис (наиболее частые возбудители):
- стрептококки группы Б;
- гемофильная палочка и др.
Поздний неонатальный сепсис:
- энтеробактерии (клебсиелла, протей и др.);
- анаэробы - синегнойная палочка.
Частота раннего неонатального сепсиса: общая - 1,0-3,5 случая на 1000 родившихся живыми.
Частота позднего неонатального сепсиса:
- у новорожденных с гестационным возрастом (ГВ) менее 25 недель - 46 на 1000 родившихся живыми;
- у новорожденных с ГВ 25-28 недель - 29 на 1000 родившихся живыми;
- у новорожденных с ГВ 29-32 недели - 10 на 1000 родившихся живыми;
- у новорожденных с ГВ более 32 недель - 2 на 1000 родившихся живыми;
- (Stallet et al., 2002).
Факторы и группы риска
1. Факторы риска раннего неонатального сепсиса:
- положительный посев на стрептококк группы В в 36 недель беременности;
- безводный период более 18 час.;
- температура тела у матери в родах более 38°С;
- в анамнезе сепсис, вызванный стрептококком В у предыдущего ребенка.
2. Факторы риска позднего неонатального сепсиса:
- перекрестное заражение (слишком много младенцев в отделении, неправильное соотношение медсестра/пациент);
- раздельное содержание ребенка с матерью;
- нерациональная антибактериальная терапия;
- плохое мытье рук персоналом.
Диагностика
Диагностические критерии:
- анамнез (факторы риска);
- клинические проявления (клинические симптомы сепсиса неспецифичны);
Признаки, которые могут свидетельствовать о наличии инфекции:
- изменения в поведении / мышечном тонусе;
- бледность кожных покровов;
- плохо сосет, теряет в массе;
Лабораторная диагностика
Лабораторные исследования:
- общий анализ крови (OAK);
Бактериологическое исследование крови:
1. Изменения в лейкограмме, которые могут указывать на наличие инфекции: количество лейкоцитов < 5 тыс. или >30 тыс. в 1-е сутки жизни, или > 20 тыс. со 2-х суток жизни.
2. Лейкоцитарный индекс (ЛИ - сумма молодых форм нейтрофилов (миелоциты, юные, палочкоядерные) деленная на общую сумму молодых и зрелых нейтрофилов) > 0,2.
3. Абсолютное количество незрелых нейтрофилов > 1,44.
4. СОЭ > 10 (0-7 дней жизни) и > 15 (> 7 дней жизни).
5. С-реактивный белок (СРБ) > 1 мг/100 мл.
6. Рентгенография органов грудной клетки при расстройстве дыхания.
7. Люмбальная пункция (ЛП) при неврологических расстройствах.
8. У новорожденных с массой тела при рождении менее 1500 г с наличием симптомов сепсиса - люмбальная пункция рекомендуется в комплексном обследовании на сепсис.
Лечение
Тактика лечения
Тактика лечения - в зависимости от наличия клинических признаков инфекции.
Лечение бактериального сепсиса
А. Обследование и лечение новорожденного при наличии факторов риска (нет клинических признаков инфекции):
1. Назначить OAK, СРБ:
- если посев крови (+): антибиотики продолжить 7-10 дней;
Б. Обследование и лечение новорожденного при наличии клинических признаков сепсиса:
- назначить OAK, СРБ или СОЭ, взять посев крови и тест на чувствительность к антибиотикам (Rg - грудной клетки при СДР, посев ликвора при подозрении на менингит);
- начать лечение с комбинации антибиотиков ампициллин/пенициллин + гентамицин в/в.
- посев крови отрицательный;
- лейкограмма и СРБ в норме;
- повторить OAK, СРБ;
- в норме: прекратить АБТ после 5 дней;
- > 2 патологических признаков, АБ 7-10 дней;
- прекратить АБТ после 5 дней.
- посев крови положительный;
- клинические симптомы сохраняются;
- изменения в лейкограмме, СРБ.
Продолжить АБТ до 10 дней (при менингите до 14-21 дня) с учетом результатов бакпосева.
Если бакпосев крови невозможен, а клинические симптомы сохраняются или изменения в лейкограмме, СРБ сохраняются - сменить ампициллин или пенициллин на цефатаксим.
Антибактериальная терапия
При раннем неонатальном сепсисе:
- полусинтетический пенициллин и аминогликозиды;
- цефалоспорины третьего поколения дополнительно используются при подозрении или при подтвержденном диагнозе менингита.
При позднем неонатальном сепсисе: антистафилококковый пенициллин или оксациллин, цефалоспорины, аминогликозиды.
Важно учитывать местные эпидемиологические - микробиологические данные!
Перечень основных медикаментов
Дозы антибиотиков
Антибиотик
Доза в мг
Доза
в мл
8 и старше день жизни
8 и старше день жизни
Ампициллин ТОЛЬКО для менингита
100 мг/кг каждые 12 часов
100 мг/кг каждые 8 часов
1.0 мл/кг каждые 12 часов
1.0 мл/кг каждые 8 часов
Ампициллин для сепсиса
50 мг/кг каждые 12 часов
50 мг/кг каждые 8 часов
0.5 мл/кг каждые 12 часов
0.5 мл/к г каждые 8 часов
Бензатин бензилпенициллин для бессимптомного ребенка, мать которого не проходила лечение от сифилиса
75 мг/кг (100000 единиц/ кг) в единичной дозе
75 мг/кг (100000 единиц/кг) в единичной дозе
0.2 мл/кг в единичной дозе
0.2 мл/кг в единичной дозе
Бензатин бензилпенициллин для врожденного сифилиса без поражения ЦНС
75 мг/кг (100000 единиц/ кг) один раз ежедневно
75 мг/кг (100000 единиц/кг) один раз ежедневно
0.2 мл/кг один раз ежедневно
0.2 мл/кг один раз ежедневно
Бензилпенициллин для врожденного сифилиса без поражения ЦНС
30 мг/кг (50000 единиц/ кг) один раз ежедневно
30 мг/кг (50000 единиц/кг) один раз ежедневно
0.25 мл/кг один раз ежедневно
0.25 мл/кг один раз ежедневно
Бензилпенициллин для врожденного сифилиса с поражением ЦНС
30 мг/кг (50000 единиц/ кг) каждые 12 часов
30 мг/кг (50000 единиц/кг) каждые 12 часов
0.25 мл/кг каждые 12 часов
0.25 мл/кг каждые 12 часов
Бензилпенициллин для столбняка
60 мг/кг (100000 единиц/ кг) каждые 12 часов
60 мг/кг (100000 единиц/кг) каждые 12 часов
0.5 мл/кг каждые 12 часов
0.5 мл/кг каждые 12 часов
Цефотаксим ТОЛЬКО для менингита
50 мг/кг каждые 8 часов
50 мг/к г каждые 6 часов
0.5 мл/кг каждые 8 часов
0.5 мл/кг каждые 6 часов
Цефотаксим для сепсиса
50 мг/кг каждые 12 часов
50 мг/кг каждые 8 часов
0.5 мл/кг каждые 12 часов
0.5 мл/кг каждые 8 часов
50 мг/ кг однократно
50 мг/кг однократно
0.5 мл/кг однократно
0.5 мл/кг однократно
Клокеациллин (оральное введение)
50 мг/кг каждые 8 часов
50 мг/кг каждые 8 часов
2 мл/кг каждые 8 часов
2 мл/кг каждые 8 часов
50 мг/кг каждые 8 часов
50 мг/кг каждые 8 часов
2 мл/кг каждые 8 часов
2 мл/кг каждые 8 часов
50 мг/кг каждые 8 часов
50 мг/кг каждые 8 часов
0,5 мл/кг каждые 8 часов
0,5 мл/кг каждые 8 часов
50 мг/кг каждые 8 часов
50 мг/кг каждые 8 часов
0,5 мл/кг каждые 8 часов
0,5 мл/кг каждые 8 часов
12,5 мг/кг каждые 6 часов
12,5 мг/кг каждые 6 часов
0,5 мл/кг каждые 6 часов
0,5 мл/кг каждые 6 часов
4 мг/кг один раз ежедневно
7,5 мг/кг один раз в день ИЛИ 3,5 мг/ кг каждые 12 часов
0,4 мл/кг один раз в день
0,75 мг/кг один раз в день ИЛИ 0,35 мг/кг каждые 12 часов
5мг/кг один раз ежедневно
7,5 мг/кг один раз в день ИЛИ 3,5 мг/ кг каждые 12 часов
0,5 мл/кг один раз в день
0,75 мг/кг один раз в день ИЛИ 0,35 мг/кг каждые 12 часов
Прокаин бензилпенициллин для врожденного сифилиса без поражения ЦНС
100 мг/кг (100000 единиц/ кг) один раз в день
100 мг/ кг (100000 единиц/кг) один раз в день
0.5 мл/кг один раз в день
0.5 мл/кг один раз в день
Прокаин бензилпенициллин для бессимптомного ребенка, мать которого не получала лечения от сифилиса
100 мг/кг (100000 единиц/ кг) однократно
100 мг/ кг (100000 единиц/кг) однократно
0.5 мл/кг однократно
0.5 мл/кг однократно
Разведение антибиотиков
Антибиотик
Разведение
Добавьте 5 мл стерильной воды в бутылочку с 500 мг сухого вещества = 100 мг/мл
Добавьте 5 мл стерильной воды в бутылочку с 1.8 г (2.4 миллионов единиц) сухого вещества = 360 мг/мл (480 000 единиц/мл)
Добавьте 5 мл стерильной воды в бутылочку с 600 мг (1 миллион единиц) сухого вещества = 120 мг/мл (200000 единиц/мл)
Добавьте 5 мл стерильной воды в бутылочку с 500 мг сухого вещества = 100 мг/мл
Добавьте 5 мл стерильной воды в бутылочку с
250 мг сухого вещества = 50 мг/мл
Клоксациллин для инъекций
Добавьте 5 мл стерильной воды в бутылочку с 500 мг сухого вещества = 100 мг/мл
Клоксациллин для орального применения
Добавьте 5 мл кипяченной воды в бутылочку с 125 мг сухого вещества = 25 мг/мл
Эритромицин для орального применения
Добавьте 5 мл кипяченной воды в бутылочку с 125 мг сухого вещества = 25 мг/мл
Используйте 10 мг/мл, 2 мл ампулу = 10 мг/мл
Добавьте 5 мл стерильной воды в бутылочку с 1 г (1 миллион единиц) сухого вещества = 200
мг/мл (200 000 единиц/мл)
Общие принципы организации помощи новорожденному с сепсисом:
1. Обеспечить тепловую защиту.
2. Назначить на 12 часов инфузию 10% раствора глюкозы в соответствии с возрастной потребностью.
3. Проводить мониторинг жизненно важных функций (ЧД, ЧСС, температура тела младенца; диурез; по возможности - SpO2, АД).
4. Оценивать состояние новорожденного каждые 6 часов, наблюдая за динамикой.
5. Решить вопрос о переводе ребенка в стационар третьего уровня или в отделение патологии новорожденных детской больницы (при необходимости).
6. После 12 часов лечения антибиотиками или как только состояние ребенка начнет улучшаться - попробовать приложить его к груди матери или использовать альтернативный метод кормления сцеженным материнским молоком.
7. Определять уровень гемоглобина не реже двух раз в неделю.
8. После прекращения антибактериальой терапии наблюдать за ребенком в течение как минимум 24 часа. Если в течение этого времени состояние ребенка удовлетворительное и у него нет других проблем - выписать домой.
Если же симптомы инфекции появляются вновь:
- провести дополнительное обследование;
- назначить антибиотики, эффективные в отношении возбудителей позднего сепсиса;
- учесть результаты бактериологического исследования крови и в случае несоответствия внести изменения в проводимую терапию.
Профилактика
Профилактика. См. акушерский протокол.
Профилактическое применение внутривенных иммуноглобулинов. Профилактическое внутривенное применение иммуноглобулинов не значительно снижает риск развития сепсиса (на 3-4%) у недоношенных детей, но не связан со снижением других заболеваний: ЯНЭК, ВЖК, продолжительности пребывания в стационаре или смертности. В настоящее время в мире применение иммуноглобулинов для профилактики сепсиса ограничено и предназначено для лечения тяжелых инфекций.
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Сепсис новорожденных – генерализованная гнойно-септическая инфекция, характеризующаяся наличием первичного очага и циркуляцией инфекции в крови. Сепсис новорожденных проявляется признаками инфекционного токсикоза (температурной реакцией, вялостью, диспепсией, землистой окраской кожных покровов) и образованием гнойных метастатических очагов в различных органах (мозговых оболочках, легких, костях, печени и пр.). Диагноз сепсиса у новорожденных устанавливается на основании клинических критериев и выделения возбудителя при бактериологическом посеве крови. Лечение сепсиса новорожденных включает системную антибиотикотерапию, санацию первичного и метастатических гнойных очагов, посиндромную терапию.
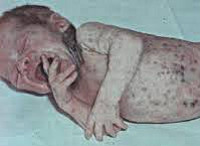
Общие сведения
Сепсис новорожденных – общий инфекционный процесс, обусловленный попаданием условно-патогенной и гноеродной микрофлоры из локальных очагов в кровяное русло и сопровождающийся тяжелыми системными проявлениями. По данным зарубежной педиатрии, частота сепсиса новорожденных составляет 0,1-0,8%; среди недоношенных и детей с перинатальной патологией, находящихся в ОРИТ, - 14%. Неонатальная смертность, обусловленная сепсисом новорожденных, высока и стабильна – около 30-40%. Развитию сепсиса способствуют недостаточная сформированность барьерных механизмов и иммунитета у новорожденных, пограничные состояния периода новорожденности, патологическое протекание перинатального периода, сложность ранней диагностики септических состояний.

Причины
В настоящее время доминирующее место (около 50%) среди возбудителей сепсиса новорожденных принадлежит грамположительной флоре (главным образом, стафилококкам, гемолитическому стрептококку группы А). Чуть реже (до 40% случаев) выявляется грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, клебсиелла и др.); в 10% этиологическими агентами выступает смешанная флора (часто ассоциация стафилококка с грибами Candida).
Со стороны матери факторами, способствующими бактериальной контаминации новорожденного, выступают бактериальный вагиноз, кольпиты, эндометрит. Большое значение имеет степень и характер иммуносупрессии у новорожденного, которые могут быть связаны с неполноценным питанием или приемом лекарств беременной, наследственным иммунодефицитом или ВИЧ-инфекцией. В отдельных случаях причиной вспышек сепсиса новорожденных становится несоблюдение санитарного режима в родильных или детских отделениях.
Классификация
По времени развития выделяют внутриутробный и постнатальный (ранний неонатальный и поздний неонатальный) сепсис новорожденных. Внутриутробный сепсис предполагает антенатальное или интранатальное инфицирование плода; при этом первичный гнойно-септический очаг располагается вне организма ребенка (чаще всего в его роли выступает плацентит, хорионит, хориоамнионит и т. д.). В случае постнатального сепсиса первичный гнойно-воспалительный очаг всегда располагается в организме самого новорожденного.
Ранний неонатальный сепсис новорожденных развивается в первые 4-ро суток жизни ребенка. Клинические течение заболевания обычно молниеносное, с быстрым развитием полиорганнной недостаточности, летальным исходом в 5-20% случаев. Поздний неонатальный сепсис новорожденных манифестирует на 5-й день и позднее. Характеризуется медленно прогрессирующим течением, возникновением вторичных септических очагов, 5-10%-ной летальностью.
Течение сепсиса новорожденных может быть молниеносным (3-7 дней), острым (до 4-8 недель), подострым (до 1,5-3 месяцев), затяжным (более 3 месяцев). С учетом локализации первичного септического очага и входных ворот различают: пупочный, кожный, легочный, ринофарингеальный, отогенный, риноконъюнктивальный, кишечный, урогенный, катетеризационный и др. виды сепсиса новорожденных. Сепсис новорожденных может протекать в форме септицемии или септикопиемии.
Симптомы сепсиса новорожденных
Септицемия или сепсис новорожденных без метастазов обычно развивается на фоне предшествующего мокнущего пупка, конъюнктивита, гнойничковой сыпи, опрелостей, стоматита. Предвестниками сепсиса новорожденных могут выступать вялость или беспокойство, снижение аппетита, обильные частые срыгивания, плохая прибавка в весе. В период разгара развивается температурная реакция (гипер- или гипотермия), отечный синдром или эксикоз, гипотрофия. Характерным признаком сепсиса новорожденных является грязновато-серый (землистый) оттенок кожных покровов, желтушность, мраморность кожи, сыпь.
Вследствие токсического поражения различных органов возникают гепатоспленомегалия, пневмопатия (тахипноэ, цианоз), кардиопатия (тахикардия или брадикардия, артериальная гипотензия), диспепсия, мочевой синдром (олигурия, анурия, ОПН), геморрагический синдром, надпочечниковая недостаточность. Чаще всего септицемия осложняется присоединением пневмонии, которая выступает как самостоятельное интеркуррентное заболевание.
Септикопиемия или сепсис новорожденных с гнойными метастазами характеризуется возникновением на фоне интоксикации вторичных очагов отсева в мозговых оболочках, легких, костях, печени, других органах. Чаще всего септикопиемия протекает с развитием гнойного менингита, абсцедирующей пневмонии, остеомиелита; реже – с формированием абсцесса печени, гнойного артрита, панофтальмита, медиастинита, флегмоны желудка или кишечника. В восстановительном периоде происходит санация пиемических очагов, стихание токсикоза, постепенное восстановление нарушенных функций.
Молниеносная форма сепсиса новорожденных протекает с развитием септического шока: стремительным ухудшением состояния ребенка, снижением температуры тела, брадикардией, кровоточивостью, отеком легких, острой почечной недостаточностью. Летальный исход при молниеносном течении сепсиса новорожденных наступает в течение 3-5 суток.
Диагностика сепсиса новорожденных
Диагноз сепсиса новорожденного может быть заподозрен неонатологом или педиатром на основании лихорадки свыше 3 дней или прогрессирующей гипотермии; гиперлейкоцитоза, сменяющегося лейкопенией; повышением содержания в крови маркеров инфекционного процесса (СРБ, интерлейкина-8, прокальцитонина).
Факт бактериемии при сепсисе новорожденных подтверждается путем посева крови на стерильность. Важное значение имеет выявление первичного гнойного очага и метастатических очагов, микробиологического исследование отделяемого из них (бактериологическое исследование мазка с конъюнктивы, мочи на микрофлору, соскоба/отделяемого с кожи на микрофлору, мазка из глотки, кала на дисбактериоз и т. п.).
Дифференциальная диагностика сепсиса новорожденных осуществляется с локализованными гнойно-воспалительными заболеваниями (пневмонией, медиастинитом, перитонитом, менингитом, энтероколитом), генерализованными вирусными инфекциями (цитомегалией, герпесом, энтеровирусной инфекцией) и микозами (кандидозом, аспергиллезом) и др. Для этого используются дополнительные лабораторные методы – ПЦР, ИФА, микроскопия.
Лечение сепсиса новорожденных
Терапия при сепсисе новорожденных проводится одновременно в нескольких направлениях и включает санацию септического и пиемических очагов, подавление циркуляции возбудителя в крови, коррекцию нарушенных функций.
Основу этиологического лечения сепсиса новорожденных составляет антибиотикотерапия: эмпирическая комбинированная до уточнения характера микрофлоры) и целенаправленная после получения антибиотикограммы. Противомикробные препараты вводятся внутривенно, в максимальных возрастных дозировках в течение 10-15 суток с последующей сменой. Чаще всего в клинической практике для лечения сепсиса новорожденных в различных сочетаниях используются цефалоспорины, аминогликозиды, аминопенициллины, карбапенемы и др.
С целью местного лечения гнойных очагов производится вскрытие фурункулов и абсцессов, перевязки с антибактериальными и ферментными препаратами; назначается УВЧ, СВЧ, электрофорез.
Патогенетическая терапия сепсиса новорожденных включает иммунокоррекцию (плазмаферез, гемосорбцию, введение иммуноглобулинов), проведение дезинтоксикационной терапии (внутривенной инфузии глюкозо-солевых растворов и свежезамороженной плазмы), адекватную кислородотерапию и т. д. При сепсисе новорожденных обязательно проводится мониторинг состояния жизненно-важных функций: АД, ЧСС, ЭКГ, КОС и газового состава крови, биохимических показателей (сахара крови, креатинина, электролитов), гематокрита.
В остром периоде сепсиса целесообразно пребывание новорожденных в кувезе, кормление материнским молоком, тщательный уход. В восстановительном периоде к лечению подключается гимнастика, массаж, лечебные ванны.
Прогноз и профилактика сепсиса новорожденных
Прогноз сепсиса новорожденных серьезный: летальность составляет от 30-40% до 60% среди глубоко недоношенных детей. У выздоровевших детей в отделенном периоде могут отмечаться частые ОРВИ, пиелонефрит, анемия, перинатальная энцефалопатия.
Профилактика сепсиса новорожденных включает выявление и санацию инфекций мочеполовой сферы у беременной, соблюдение противоэпидемических мероприятий медперсоналом родильных домов и отделений новорожденных, тщательный гигиенических уход за новорожденным, естественное вскармливание. Вопрос о сроках вакцинации новорожденных с сепсисом против туберкулеза и против гепатита В , проводимой в первые дни жизни, решается в индивидуальном порядке.
Неонатальный сепсис – системное инфекционное заболевание у ребенка первых 28 дней жизни, проявляющееся характерными клиническими симптомами и подтвержденное одной или несколькими положительными культурами крови (ЕРБ ВОЗ, 2002 г.).
Р 36.3 Сепсис новорожденного, обусловленный другими и неуточненными стафилококками
Р 36.4 Сепсис новорожденного, обусловленный кишечной палочкой (Escherichia coli)
Классификация
Этиология и патогенез
Факторы и группы риска
Диагностика
Физикальное обследование:
- нестабильность температуры;
- изменения в поведении / мышечном тонусе;
- бледность кожных покровов;
- плохо сосет, теряет в массе;
- рвота / диарея;
- тахикардия.
- лейкоцитарный индекс (ЛИ - сумма молодых форм нейтрофильных лейкоцитов, деленная на общую сумму молодых и зрелых нейтрофильных лейкоцитов) > 0,2-0,3;
Инструментальные исследования
Рентгенография органов грудной клетки и люмбальная пункция (ЛП) при наличии показаний (цитоз > 20/3, белок > 1 г/л):
1. Показания к ЛП: симптомы сепсиса + любой из симптомов менингита (выбухание родничка, любые неврологические симптомы и рвота) + лейкоцитов < 5 тыс. или >30 тыс. в 1-е сутки жизни или > 20 тыс. со 2-х суток жизни, или ЛИ > 0,4, или СРБ > 10 мг/100 мл, или ≥ 2 лабораторных показателя с явным отклонением от нормы.
2. У новорожденных с массой тела при рождении менее 1500 г с наличием симптомов сепсиса – люмбальная пункция рекомендуется в комплексном обследовании на сепсис.
Лечение
Цели лечения: улучшить диагностику и исходы, а также проведение своевременной адекватной терапии сепсиса.
3. Настоящая беременность с положительным результатом на СГБ (за исключением планового кесарева сечения при отсутствии родовой деятельности).
Алгоритм оказания помощи младенцам, рожденным матерями с вышеперечисленными факторами:
АБП* ≥ 4 час после введения АБ роженице.
** Факторы риска: СГВ+, хориоамнионит, длительность безводного периода > 18 час., температура у матери в родах ≥ 38ºС, гестационный возраст < 37 недель.
– цефалоспорины третьей генерации дополнительно используются при подозрении или при подтвержденном диагнозе менингита.
Общие принципы организации помощи новорожденному с сепсисом:
3. Проводить мониторинг жизненно важных функций (ЧД и тяжесть ДР, ЧСС, температура тела младенца; диурез; по возможности – SpO2, АД).
9. При наличии признаков улучшения в течение 3-х дней – продолжить антибактериальную терапию до конца 10 дня.
10. При отсутствии признаков улучшения или при ухудшении состояния новорожденного после 3-го дня лечения:
- при их отсутствии – назначить цефотаксим вместо ампициллина и продолжить лечение (цефотаксим + аминогликозид), в течение 7 дней после появления симптомов улучшения;
- решить вопрос о переводе ребенка в стационар третьего уровня или в отделение патологии новорожденных детской больницы.
11. После 12 часов лечения антибиотиками или как только состояние ребенка начнет улучшаться – попробовать приложить его к груди матери или использовать альтернативный метод кормления сцеженным материнским молоком.
13. После прекращения антибактериальной терапии наблюдать за ребенком в течение как минимум 24 часов. Если в течение этого времени состояние ребенка удовлетворительное и у него нет других проблем – выписать домой.
- учесть результаты бактериологического исследования крови и, в случае несоответствия, внести изменения в проводимую терапию.
Дальнейшее ведение: нет.
Индикаторы эффективности лечения: улучшение качества жизни.
Неонатальный сепсис – системное инфекционное заболевание у ребенка первых 28 дней жизни, проявляющееся характерными клиническими симптомами и/или подтвержденной положительной культурой крови [9].
Пользователи протокола: неонатологи, педиатры, врачи общей практики, врачи скорой и неотложной медицинской помощи.
Класс I - польза и эффективность диагностического метода или лечебного воздействия доказана и/или общепризнаны
Класс III - имеющиеся данные или общее мнение свидетельствуют о том, что лечение неполезно/неэффективно и, в некоторых случаях может быть вредным
В - результаты одного рандомизированного клинического исследования или крупных нерандомизированных исследований
С – общее мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
Классификация
Ранний неонатальный сепсис – реализация процесса происходит в возрасте 0 - 72 часа после рождения; [1.2]
Поздний сепсис новорожденных – инфекция новорожденного в возрасте> 72 часов после рождения, обусловленная горизонтальным переносом микроорганизмов из окружающей среды или реже через плаценту, во время родов [3,4].
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: не проводится.
• определение газов крови и электролитов.
Диагностические мероприятия, проводимые на этапе скорой помощи: не проводятся.
• плохое мытье рук медицинского персонала.
• изменения со стороны ЦНС – раздражительность, летаргия, гипотония, гипорефлексии, вялость, тремор, набухание большого родничка, судороги
• изменения со стороны ЖКТ - плохо сосет, теряет в массе тела, срыгивания, рвота, метеоризм, гепатоспленомегалия, диарея;
Лабораторные исследования:
• Общий анализ крови: анемия, лейкоцитоз или лейкопения, тромбоцитопения. ЛИ -> 0,2- 0,3, нейтропения, ускоренное СОЭ;
• Биохимический анализ крови: увеличение СРБ, гипогликемия, повышение АЛТ и АСТ, билирубина за счет прямой фракции, повышение мочевины, креатинина, азотемия;
• Бактериологическое исследование крови: рост бактерий для раннего – СГБ; грамм отрицательные бактерии, энтерококки и др., и для позднего: стафилококк золотистый, грамм отрицательные бактерии (клебсиелла, псевдомонас, ацинетобактер), грибы.
• рентгенография сустава при остеомиелите/остеоартрите: утолщение надкостницы, признаки разрушения кости, отек мягких тканей, накопление жидкости;
Читайте также:

