Бактерии рода хеликобактер микробиология
Обновлено: 18.04.2024
К роду Helicobacter в настоящее время относится до 10 видов микроорганизмов (Helicobacter pylori, Helicobacter heilmannii, Helicobacter mustelae, Helicobacter felis и т.д). Основным возбудителем заболеваний у человека является H. pylori. Определенное значение в патологии имеет H. heilmannii. Считается, что Helicobacter pylori играет существенную роль в патогенезе острого и хронического гастритов, язвенной болезни желудка и 12-перстной кишки. Кроме того, инфекция Helicobacter pylori является предрасполагающим фактором в развитии рака желудка и лимфоцитарной опухоли желудочно-кишечного тракта (мальтомы).
Это грамотрицательные, короткие, извитые S-образные бактерии средних размеров, подвижные, имеют 4-5 жгутиков, лофотрихи (рис. 17). Содержание Г+Ц составляет 35-37%.
Культуральные свойства
Хорошо растут в микроаэрофильных условиях, в аэробных и анаэробных условиях не растут. Температурный оптимум 37°С, не растут при температуре 25-28 и 42°С, хорошо растут на кровяном агаре, на средах, содержащих 10% сыворотки. Не растут на средах, содержащих глицерин, желчные соли и NaCl.
Биохимические свойства
Оксидазо- и каталазоположительны, проявляют выраженную уреазную активность, обладают фосфатазой, образуют H2S, не свертывают молоко.
Антигенная структура
Имеется О-АГ – ЛПС, Н-АГ, а также поверхностные мембранные белковые АГ (OMP-белки), по которым определяют типоспецифичность возбудителя с помощью моноклональных АТ.
Факторы патогенности
В патогенезе существенное значение имеют адгезины возбудителя, вакуолизирующий цитотоксин (VacA), поражающий эпителий желудка, белок CagA – продукт генов островков патогенности, ферменты супероксиддисмутаза и каталаза.
Резистентность
Характеристика заболевания
Источник инфекции – больные люди.
При пероральном попадании возбудителя большое число бактерий скапливается в антральной части желудка, так как там мало клеток, секретирующих соляную кислоту, что помогает выживанию бактерий на поверхности эпителия. Проникая через слой слизи, хеликобактеры прикрепляются к эпителиальным клеткам (в области межклеточных ходов адгезины микроба связываются с мембранными гликолипидами, компонентами слизи), проникают в железы слизистой оболочки, разрушают слизистый слой и обусловливают контакт желудочного сока со стенкой органа. ЛПС стимулирует выделение ИЛ-8, миграцию нейтрофилов и способствует развитию острого воспаления. Локализация в области межклеточных ходов обусловлена хемотаксисом к местам выхода мочевины и гемина. Под действием фермента уреазы мочевина превращается в аммиак, который повреждает слизистую оболочку желудка и двенадцатиперстной кишки. Кроме того, аммиак нейтрализует соляную кислоту желудка, способствуя выживанию хеликобактерий.
Клиническая картина
Клинические проявления не отличаются от симптомов гастродуоденитов. Инкубационный период – 7 суток. В острой фазе заболевания отмечается изменение рН желудочного сока, тошнота, рвота, в дальнейшем появляются симптомы язвенного гастродуоденита.
Лабораторная диагностика
Материал для исследования: биоптаты слизистой оболочки желудка и двенадцатиперстной кишки.
Бактериоскопический метод. Выявляют бактерии в препаратах, окрашенных гематоксилин-эозином или акридиновым оранжевым. В фазовоконтрастном микроскопе определяют характерную подвижность.
Бактериологический метод. Производят посев материала на кровяной агар с амфотерицином, культивируют в термостате 5-7 суток при 37° в микрофильных, аэробных и анаэробных условиях. Вид микроба определяют по характерной морфологии и виде колоний, способности к росту только в микроаэрофильных условиях, по наличию оксидазной и уреазной активности.
Для лечения используются схемы, включающие ингибиторы желудочной секреции (блокатор протонного насоса омепразол), антибиотики (кларитромицин, азитромицин, доксициклин, метронидазол), коллоидный субцитрат висмута (Де-нол).
Инфекции вызванные Helicobacter pylori: диагностика, лечение
Helicobacter pylori — грамотрицательная неспорообразующая микроаэрофильная спиральная бацилла, подвижность которой обеспечивают пять — шесть униполярных (однополярных) жгутиков. Обладает каталазной, оксидазной, а также высокой уреазной активностью.
От ВИЧ-инфицированных пациентов с проктоколитом и бактериемией выделяют Helicobacter cinaedi и Н. fennelliae.
Патогенез инфекции Helicobacter pylori. Helicobacter pylori образует фермент уреазу, способствующий повышению уровня рН среды в месте обитания возбудителя и предохранению последнего от воздействия соляной кислоты желудочного сока. Патогенный островок CagA содержит гены, которые кодируют IV тип секреторной системы, осуществляющей внедрение белка CagA в цитоплазму клеток хозяина. В результате происходит нарушение различных функций клетки, выделение ИЛ-8 и возникновение воспалительного процесса. При тяжёлом течении заболевания отмечают повреждение клеток белком VacA.
Клинические признаки инфекции Helicobacter pylori. Заболевание часто протекает бессимптомно. Хроническая форма обычно приобретает признаки вялотекущего гастрита. Существует взаимосвязь между инфекцией Helicobacter pylori и развитием язвы желудка и двенадцатиперстной кишки, а также повышенным риском возникновения рака желудка.
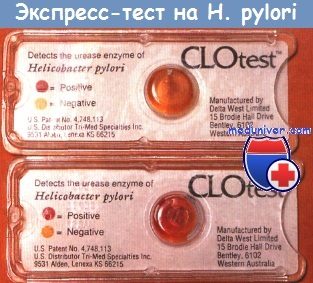
Диагностика инфекции Helicobacter pylori. Диагноз основан на результатах биопсии желудка и двенадцатиперстной кишки, определении антител в сыворотке или кале с помощью ИФА. Материал для биопсии получают при эндоскопическом исследовании. Выполняют гистологическое, бактериологическое исследование биоптата и молекулярно-генетические методы. Для подтверждения диагноза проводят тест уреазной активности.
Для этого пациент принимает внутрь определённое количество мочевой кислоты с меченым атомом углерода 13С, который затем определяют в выдыхаемом воздухе.
Лечение инфекции Helicobacter pylori. Наиболее эффективным методом лечения считают комплексное применение антибиотиков и ингибиторов протонного насоса (амоксициллин + метронидазол + омепразол). При назначении других подобных препаратов также наблюдают терапевтический эффект, но их идеальная комбинация пока не создана. Случаи повторного заражения Н. pylori у взрослых встречают не часто.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Более 10 видов хеликобактерий являются патогенными для человека (H. pylori, H. heilmannii, H. cinaedi, H. fennelliae, H. bilis, H. pullorum, H. hepaticus и др.).
 |
| Язва желудка человека |
Вторым по важности для человека видом хеликобактера является Helicobacter heilmannii. Он встречается у 0,25-1,7 % населения Земли (в Китае — до 6 %) и обычно вызывает антральный гастрит.
Заражение человека иными видами, обитающими у животных и птиц происходит или фекально-оральным путём, или при употреблении инфицированных продуктов животноводства и птицеводства в пищу, или в процессе общения с инфицированными животными и птицами.
Хеликобактер — возбудитель других заболеваний человека
Helicobacter cinaedi и Helicobacter fennelliae отнесены к возбудителям инфекций, передающихся половым путём, в частности при гомосексуальных сношениях у мужчин они могут быть причиной заражения проктитом или колитом. Эти виды также могут вызывать бактериемии у пациентов с иммунодефицитами.
Имеются данные, что Helicobacter bilis может ассоциироваться с раком желчного пузыря и раком желчных протоков человека.
Хеликобактер — нормальная микрофлора и возбудитель заболеваний органов пищеварения животных
 |
| От мышей выделено большое число видов геликобактерий: H. bilis, H. ganmani, H. hepaticus, H. muridarum, H. mastomyrinus, H. rappini, H. rodentium, H. typhlonius |
От мышей выделены следующие виды хеликобактерий: H. bilis, H. ganmani, H. hepaticus, H. muridarum, H. mastomyrinus, H. rappini, H. rodentium, H. typhlonius. От крыс — H. bilis, H. muridarium, H. rodentium, H. trogontum, H. typhlonius.
Однако, например, достоверных данных о выделении каких-либо видов хеликобактерий от лошадей нет.
Некоторые виды хеликобактера являются патогенами для животных: Helicobacter bilis вызывает колит у собак, кошек и мышей, H. bizzozeronii, Н. felis, Н. heilmannii, Н. salomonis — гастрит у кошек и собак, Н. pylory — гастрит у кошек, H. mustelae — язвенную болезнь желудка, хронический гастрит и аденокарциному и MALT-лимфому у хорьков и норок, Н. suis — язвенную болезнь желудка и гастрит у свиней. С клиническими заболеваниями мышей и крыс ассоциированы H. bilis и H. hepaticus.
Таблица 1. Различные виды хеликобактера и животных, у которых они выявлены (а также у человека), локализация различных видов хеликобактера**
| Вид (таксон) | Хозяева | Первичная локализация | Вторичная локализация |
| H. acinonychis | гепарды, тигры | желудок | - |
| H. aurati | хомяки | желудок, кишечник | - |
| H. bilis | мыши, собаки, крысы, кошки, песчанки, человек | кишечник | печень (мыши), желчный пузырь (человек) |
| H. bizzozeronii | человек, кошки, собаки, гепарды, приматы, дикие крысы | желудок | - |
| H. bovis | крупный рогатый скот | сычуг | - |
| H. canadensis | человек, дикие гуси | кишечник | - |
| H. canis | человек, кошки, собаки | кишечник | печень (собаки) |
| H. cetorum | дельфины, киты | желудок | - |
| H. cholecystus | хомяки | желчный пузырь | - |
| H. cinaedi | человек, хомяки, макаки, собаки | кишечник | кровь, мозг, суставы (человек), печень (макаки) |
| H. felis | кошки, собаки, человек | желудок | - |
| H. fennelliae | человек | кишечник | - |
| H. ganmani | мыши | кишечник | - |
| H. hepaticus | мыши, песчанки | кишечник | - |
| H. marmotae | североамериканские лесные сурки, кошки | кишечник | печень (североамериканские лесные сурки) |
| H.mesocricetorum | хомяки | кишечник | - |
| H. muricola | корейские дикие мыши | кишечник | - |
| H. muridarum | мыши, крысы | кишечник | желудок (мыши) |
| H. mustelae | хорьки, норки | желудок | - |
| H. pametensis | дикие птицы, свиньи | кишечник | - |
| H. pullorum | человек, куры | кишечник | печень (куры) |
| H. pylori | человек, приматы, кошки | желудок | - |
| H. rappini | человек, кошки, собаки, мыши, овцы, свиньи | кишечник | планцета, плод, печень (овцы), кровь (человек) |
| H. rodentium | мыши, крысы | кишечник | - |
| H. salomonis | собаки | желудок | - |
| H. suis | свиньи | желудок | - |
| H. suncus | гигантские белозубки | желудок | - |
| H. trogontum | крысы | кишечник | - |
| H. typhlonius | мыши, крысы | кишечник | - |
| H. winghamensis | человек | кишечник | - |
Род хеликобактер в систематике бактерий
К роду Helicobacter отнесены следующие виды бактерий: H. acinonychis, H. ailurogastricus, H. anseris, H. apodemus, H. apri, H. aurati, H. baculiformis, H. bilis, H. bizzozeronii, H. brantae, H. callitrichis, H. canadensis, H. canicola, H. canis, H. cetorum, H. cholecystus, H. cinaedi, H. cynogastricus, H. equorum, H. felis, H. fennelliae, H. ganmani, H. heilmannii, H. hepaticus, H. himalayensis, H. jaachi, H. japonicus, H. macacae, H. magdeburgensis, H. marmotae, H. mastomyrinus, H. mesocricetorum, H. muricola, H. muridarum, H. mustelae, H. pametensis, H. peregrinus, H. pullorum, H. pylori, H. rappini, H. rodentium, H. saguini, H. salomonis, H. suis, H. suncus, H. trogontum, H. tursiopsae, H. typhlonius, H. valdiviensis, H. vulpecula, H. winghamensis, Candidatus Helicobacter bovis, Candidatus Helicobacter cebus.
Род Helicobacter входит в семейство Helicobacteraceae, порядок Campylobacterales, класс Epsilonproteobacteria, подтип delta/epsilon subdivisions, тип Proteobacteria, царство Бактерии.
- к роду кампилобактер относились виды:
- Helicobacter cinaedi (старое наименование Campylobacter cinaedi)
- Helicobacter fennelliae (старое наименование Campylobacter fennelliae)
- Helicobacter mustelae (старое наименование Campylobacter pylori subsp. mustelae)
- Helicobacter pylori (старые наименования: Campylobacter pyloridis, Campylobacter pylori subsp. pylori)
- Helicobacter heilmannii (старое наименование Gastrospirillum hominis)
- Helicobacter suis (старое наименование Gastrospirillum suis)
![Биохимический профиль, характеристика роста, морфология флагелл различных видов геликобактерий (M.T. Whary, J.G. Fox)]()
Таблица 2. Биохимический профиль, характеристика роста, морфология флагелл различных видов хеликобактерий**
Источники:
* Фотографии: Stoffel M.H. et al. Distinction of Gastric Helicobacter spp. in Humans and Domestic Pets by Scanning Electron Microscopy / January 2001. DOI: 10.1046/j.1523-5378.2000.00036.x. Blackwell Science, 1083-4389/00/232–239. Inc. Volume 5 • Number 4 • 2000.
** Таблицы 1 и 2: M.T. Whary, J.G. Fox. Natural and Experimental Helicobacter Infections. Comparative Medicine. Overview / Vol 54, No 2, April 2004, 128.![хеликобактер пилори]()
Хеликобактер пилори (лат. Helicobacter pylori) — спиралевидная грамотрицательная микроаэрофильная бактерия, инфицирующая слизистую оболочку желудка и двенадцатиперстной кишки. Иногда называют геликобактер пилори (см. Циммерман Я.С.).
Заблуждения, связанные с Helicobacter pylori
Helicobacter pylori однозначно требует эрадикации, если у больного имеется язва желудка или двенадцатиперстной кишки, МАLТома или если у него была резекция желудка по поводу рака. Многие авторитетные гастроэнтерологи (не все) в этот список включают также атрофический гастрит.
Эрадикация Helicobacter pylori может быть рекомендована для снижения риска развития рака желудка. Известно, что как минимум 90% случаев рака желука связаны с H. pylori-инфекцией (Старостин Б.Д.).
![Helicobacter pylori]()
![Helicobacter pylori]()
Helicobacter pylori от экспериментально моноинфицированных мышей (A), слизистой оболочки желудка человека (B) и культивированные на пластине агара (C). Как выделенных от экспериментально инфицированных мышей, так и при биопсии человека поверхность Helicobacter pylori является грубой, а жгутики имеют тенденцию склеиваться. За исключением коккоидной формы, морфология сравнительно хорошо сохраняется в культуре на агаре (С). Масштабные метки = 1 мкм. Источник: Stoffel M.H. et al. Distinction of Gastric Helicobacter spp. in Humans and Domestic Pets by Scanning Electron Microscopy / January 2001. DOI: 10.1046/j.1523-5378.2000.00036.x. Blackwell Science, 1083-4389/00/232–239. Inc. Volume 5 • Number 4 • 2000. Факторы вирулентности Helicobacter pylori
- Жгутики позволяют Helicobacter pylori передвигаться в желудочном соке и слое слизи.
- Helicobacter pylori способен прикрепляться к плазмолемме эпителиальных клеток желудка и разрушать компоненты цитоскелета этих клеток.
- Helicobacter pylori вырабатывает уреазу и каталазу. Уреаза расщепляет мочевину, содержащуюся в желудочном соке, что повышает рН непосредственного окружения микроба и защищает его от бактерицидного действия кислой среды желудка.
- Helicobacter pylori способен подавлять некоторые иммунные реакции, в частности фагоцитоз.
- Helicobacter pylori вырабатывает адгезины, способствующие адгезии бактерий к эпителиальным клеткам и затрудняющие их фагоцитоз полиморфно-ядерными лейкоцитами.
Язва двенадцатиперстной кишки, ассоциированная с Helicobacter pylori
Основным местом обитания Helicobacter pylori является слизистая оболочка антрального отдела желудка, пораженная воспалительно-атрофическим процессом — гастритом, ассоциированным с Helicobacter pylori. Для развития язвы двенадцатиперстной кишки, ассоциированной с Helicobacter pylori, необходимо наличие в слизистой оболочке двенадцатиперстной кишки участков желудочной метаплазии, которая в свою очередь связана с увеличение кислотности двенадцатиперстной кишки. Таким образом, язва двенадцатиперстной кишки, ассоциированная с Helicobacter pylori и дуоденит всегда развиваются на фоне кислотно-пептической агрессии в двенадцатиперсную кишку, т.е. одновременно являются и кислотно-зависимой патологией. При этом важнейшим фактором гиперсекреции соляной кислоты в желудке является прямое влияние Helicobacter pylori на секреторный процесс путем избыточного ощелачивания антрального отдела желудка продуктами гидролиза мочевины уреазой, вырабатываемой Helicobacter pylori. Следствием избыточного ощелачивания является гипергастринемия, приводящая в свою очередь к гиперпродукции соляной кислоты. Нарушения в регуляции кислотообразования при ассоциированном с Helicobacter pylori гастрите также обусловлены самим процессом специфического воспаления и его медиаторами (цитокинами и эпидермальными факторами роста), синтезируемыми в слизистой оболочке антрального отдела желудка в ответ на инфицирование Helicobacter pylori, особенно выраженное у цитотоксичных штаммов. Данные штаммы могут не только вызывать выраженное воспаление в желудке, но и способствовать развитию деструктивных процессов – язвообразованию, в том числе в двенадцатиперстной кишки в участках желудочной метаплазии. Этому способствуют агрессивные факторы дуоденальной среды, снижение защитных свойств слизистого барьера, нарушение микроциркуляции (в том числе из-за Helicobacter pylori), наследственная предрасположенность. Все эти процессы приводят к появлению язвы (Маев И.В, Самсонов А.А.).
Схемы эрадикации Helicobacter pylori
![Динамика резистентности к метронидазолу, кларитромицину и амоксициллину штаммов Н. pylori, выделенных от взрослых (а) и от детей (б)]()
Всемирной организаций здравоохранения к активным препаратам в отношении Helicobacter pylori отнесены метронидазол, тинидазол, коллоидный субцитрат висмута, кларитромицин, амоксициллин и тетрациклин (Подгорбунских Е.И., Маев И.В., Исаков В.А.).
Эрадикация Helicobacter pylori не всегда достигает цели. Очень широкое и неправильное применение распространенных антибактериальных средств привело к повышению устойчивости к ним Helicobacter pylori. На рисунке справа (взято из статьи Белоусовой Ю.Б., Карпова О.И., Белоусова Д.Ю. и Бекетова А.С.) показана динамика резистентности к метронидазолу, кларитромицину и амоксициллину штаммов Helicobacter pylori, выделенных от взрослых (сверху) и от детей (снизу). Признано, что в разных странах мира (разных регионах) целесообразно применение разных схем. Ниже даны рекомендации по эрадикации Helicobacter pylori, изложенные в Стандартах диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний принятых Научным обществом гастроэнтерологов России в 2010 г. Выбор схемы эрадикации зависит от наличия индивидуальной непереносимости пациентами конкретных лекарств, а также чувствительности штаммов Helicobacter pylori к этим лекарствам. Применение кларитромицина в эрадикационных схемах возможно лишь в регионах, где резистентность к нему менее 15–20 %. В регионах с резистентностью выше 20 % его использование целесообразно только после определения чувствительности Helicobacter pylori к кларитромицину бактериологическим методом или методом полимеразной цепной реакции.Антациды могут применяться в комплексной терапии в качестве симптоматического средства и в монотерапии — до проведения рН-метрии и диагностики Helicobacter pylori.
Первая линии антигеликобактерной терапии
Вариант 1. Один из ингибиторов протонной помпы (ИПП) в стандартной дозировке (омепразол 20 мг, лансопразол 30 мг, пантопразол 40 мг, эзомепразол 20 мг, рабепразол 20 мг) 2 раза в день и амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) в сочетании с кларитромицином (500 мг 2 раза в день), или джозамицином (1000 мг 2 раза в день), или нифурателем (400 мг 2 раза в день) в течение 10–14 дней.
![Вариант 3 примеяется при наличии подтверждения рН-метрией]()
Вариант 2. Лекарства, используемые при варианте 1 (один из ИПП в стандартной дозировке, амоксициллин в сочетании с кларитромицином, или джозамицином, или нифурателем) с добавлением четвертого компонента — висмута трикалия дицитрата 120 мг 4 раза в день или 240 мг 2 раза в день в течение 10–14 дней.
Вариант 3 (при наличии атрофии слизистой оболочки желудка с ахлоргидрией, подтвержденной при рН-метрии). Амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) в сочетании с в сочетании с кларитромицином (500 мг 2 раза в день) или джозамицином (1000 мг 2 раза в день), или нифурателем (400 мг 2 раза в день), и висмута трикалия дицитрат (120 мг 4 раза в день или 240 мг 2 раза в день) в течение 10-14 дней.Примечание. При сохранении язвенного дефекта по результатам контрольной эндоскопии на 10–14-й день от начала лечения рекомендовано продолжить терапию висмута трикалия дицитратом (120 мг 4 раза в день или 240 мг 2 раза в день) и/или ИПП в половинной дозе в течение 2–3 недель. Пролонгированная терапия висмута трикалия дицитратом показана также в целях улучшения качества послеязвенного рубца и скорейшей редукции воспалительного инфильтрата
Вариант 4 (рекомендуется только пожилым больным в ситуациях, при которых полноценная антигеликобактерная терапия невозможна):
а) ИПП в стандартной дозировке в сочетании с амоксициллином (500 мг 4 раза в день или 1000 мг 2 раза в день) и висмута трикалия дицитратом (120 мг 4 раза в день или 240 мг 2 раза в день) в течение 14 дней
б) висмута трикалия дицитрат по 120 мг 4 раза в день в течение 28 дней. При наличии болей — короткий курс ИПП.
Вариант 5 (при наличии поливалентной аллергии к антибиотикам или отказе больного от антибактериальной терапии). Один из ИПП в стандартной дозировке в сочетании с 30 %-ным водным раствором прополиса (100 мл 2 раза в день натощак) в течение 14 дней.
Вторая линия антигеликобактерной терапии
Выполняется при отсутствии эрадикации Helicobacter pylori после терапии первой линии.
Вариант 1. Один из ИПП в стандартной дозировке, висмута трикалия дицитрат по 120 мг 4 раза в день, метронидазол по 500 мг 3 раза в день, тетрациклин 500 мг 4 раза в день в течение 10–14 дней.
Вариант 2. Один из ИПП в стандартной дозировке, амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) в сочетании с нитрофурановым препаратом: нифурателем (400 мг 2 раза в день) или фуразолидоном (100 мг 4 раза в день) и висмута трикалия дицитрат (120 мг 4 раза в день или 240 мг 2 раза в день) в течение 10–14 дней.
Вариант 3. Один из ИПП в стандартной дозировке, амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день), рифаксимин (400 мг 2 раза в день), висмута трикалия дицитрат (120 мг 4 раза в день) в течение 14 дней.
Третья линия антигеликобактерной терапии
При отсутствии эрадикации Helicobacter pylori после лечения второй линии рекомендуется подбор терапии только после определения чувствительности Helicobacter pylori к антибиотикам.
Гибридная схема
По мнению некоторых исследователей, сегодня перспективной является гибридная терапия. Она включает 7-дневный курс ИПП (стандартная доза) и амоксициллина (1 г 2 раза в день) с последующим 7-дневным курсом четырехкомпонентной схемы с применением ИПП (стандартная доза), амоксициллина (1 г 2 раза в день), кларитромицина (500 мг 2 раза в день) и метронидазола (500 мг 2 раза в день) (Парцваниа-Виноградова Е.В.).
В 1987 г. была основана Европейская группа по изучению инфекции H. pylori — European helicobacter pylori study group (EHSG), целью которой явилось содействие междисциплинарным исследованиям патогенеза H. pylori-ассоциированных заболеваний. По месту проведения первой согласительной конференции все соглашения называются Маастрихтскими. Четвертая согласительная конференция прошла во Флоренции в ноябре 2010 года. Выработка Guidelines (рекомендаций) по результатам этой конференции продолжалась два года. Схемы эрадикационной терапии в соответствии с консенсусом Маастрихт IV представлены на рисунке ниже (Маев И.В. и др.):
![Схемы эрадикационной терапии H. pylori, рекомендуемые консенсусом Маастрихт IV (Маев И.В. и др.)]()
В России отсутствуют полномасштабные исследования, устанавливающие уровень распространённости резистентнных к кларитромицину штаммов H. pylori. Однако имеется несколько локальных исследований, в каждом из которых установлен в терминологии Маастрихта IV низкий уровень резистентности и, исходя из этого, в российских условиях, скорее всего, более целесообразно применять левую часть схемы, обозначенную зелёным.
Статьи, методические рекомендации
Видео
![]()
Кадр из видео: Шурпо Е.М. Хронический гастрит
(лекция для студентов медицинского университета)![]()
![]()
![]()
![]()
![]()
![]()
Кадр из видео: Эмбутниекс Ю.В. Аутоиммунный гастрит:
принципы диагностики и лечения
![]()
![]()
![]()
![]()
![]()
Проведение эрадикации Helicobacter pylori у беременных и кормящих матерей
Эрадикация Helicobacter рylori согласно Маастрихтским консенсусам II-2000 и III-2005 у беременных не проводится. Решение вопроса о проведении эрадикации Helicobacter рylori ставится после родоразрешения и окончания периода кормления грудью (Ребров Б.А., Комарова Е.Б.).
Распространённость Helicobacter pylori в разных странах и в России
По данным Всемирной гастроэнтерологической организации (Helicobacter pylori в развивающихся странах, 2010, WGO) более половины населения Земли является носителями Helicobacter pylori), при этом частота инфицированности значительно варьируется между различными странами, а также внутри этих стран. В целом, инфицированность возрастает с возрастом. В развивающихся странах инфицированность Helicobacter pylori значительно более выражена у лиц молодого возраста, чем в развитых странах.
ВГО приводит следующие цифры:
Россия относится к странам с очень высокой распространенностью хеликобактерной инфекции. В некоторых регионах, например, в Восточной Сибири, эта цифра превышает 90% и в монголоидной, и в европеоидной популяции. В Москве инфицированность Helicobacter pylori ниже. По данным ЦНИИ Гастроэнтерологии около 60% жителей ВАО Москвы – носители хеликобактера. Хотя в отдельных группах населения хеликобактер более распространен. В частности, среди работников промышленных предприятий Москвы инфицированы Helicobacter pylori 88 % (Бордин Д.С.).
Helicobacter pylori в систематике бактерий
Helicobacter pylori относится к роду Helicobacter, который входит в семейство Helicobacteraceae, порядок Campylobacterales, класс Epsilonproteobacteria, подтип delta/epsilon subdivisions, тип Proteobacteria, царство Бактерии. Ранее Helicobacter pylori назывался Campylobacter pyloridis и включался в состав рода кампилобактер (Campylobacter).
Helicobacter pylori у животных
Helicobacter pylori в МКБ-10
Науке известно множество примеров, когда какая-либо бактерия на протяжении тысячелетий обитает в организме определенного вида позвоночных.
Род Helicobacter включает спиралевидных, очень подвижных, уреазоположительных грамотрицательных бактерий, колонизирующих желудок многих млекопитающих. Каждое млекопитающее имеет один или больше доминантных видов Helicobacter, которые, в свою очередь, являются высокоспецифичными для вида хозяина или даже могут колонизировать исключительно один вид. Это согласуется с гипотезой о том, что когда около 150 млн лет назад из рептилий произошли первые млекопитающие, они содержали в себе древние хеликобактерии, которые эволюционировали вместе со своими хозяевами. Согласно этой гипотезе хеликобактерии являются потомками древних бактерий, колонизировавших желудок млекопитающих. H. pylori – штамм хеликобактерий, адаптировавшихся к человеку, который ни в природных, ни в лабораторных условиях не может существовать в организме других животных, включая приматов.
Мы не можем точно знать, как долго H. pylori присутствовала в желудке человека. Предположительно, предшественники этого микроорганизма возникли в то время, когда от приматов произошли предки современного человека – то есть около 4 млн лет назад. В пользу этого предположения служат результаты филогеографических исследований; все они единогласно указывают на то, что наши предки уже имели желудочную H. pylori, когда группа людей, в конечном итоге населившая большую часть мира, покинула Африку (более 58 тыс. лет назад). Во всяком случае, точно известно, что H. pylori колонизировала желудок человека уже во времена палеолита.
В этой статье мы предлагаем читателям ознакомиться с доказательствами наличия связи между этим древним членом микробиоты человека (и в особенности его отсутствием) и недавно начавшейся и продолжающейся эпидемией астмы и других аллергических заболеваний. Мы также обсудим предположение о том, что исчезновение H. pylori стимулирует распространенность аллергических заболеваний, а колонизация желудка H. pylori – защищает человека от них.
Приобретение и персистенция H. pylori
Человек приобретает H. pylori в раннем детстве, обычно после первого года жизни. Путь передачи – фекально-оральный, орально-оральный и рвотно-оральный. После попадания в желудок, в отсутствие приема антибиотиков, H. pylori персистирует на протяжении десятилетий, а в большинстве случаев – в течение всей жизни хозяина. Штаммы H. pylori обладают значительной вариабельностью, при этом на взаимодействие макроорганизма и бактерий влияют различные участки генов H. pylori. Например, штаммы с интактным участком cag вставляют белок CagA в эпителиальные клетки желудка хозяина.
На протяжении большей части своей истории человек жил в небольших родственных группах, при этом микробиота свободно смешивалась между отдельными членами группы. В условиях отсутствия какой-либо гигиены, которые также преобладали в истории существования человека, передача желудочно-кишечных микробов осуществлялась очень легко. Сегодня в развивающихся странах, где санитария не достигла уровня стран Запада, H. pylori является убиквитарной: распространенность у взрослого населения составляет около 80%, при использовании нескольких методов диагностики – до 100%. В популяциях с высокой распространенностью H. pylori часто наблюдается колонизация желудка несколькими штаммами этого микроорганизма.
H. pylori исчезает
Несмотря на неопровержимые доказательства древности и убиквитарности колонизации H. pylori у людей, сегодня можно говорить о том, что распространенность H. pylori быстро снижается. Это следствие так называемого эффекта поколения, начавшегося в начале ХХ века во многих развитых странах и усилившегося после Второй мировой войны. Этот эффект настолько выраженный, что сегодня в США и других индустриализованных странах положительны по H. pylori менее 10% детей в возрасте до 10 лет по сравнению с историческим уровнем 70-90%. В результате такого изменения, наблюдаемого в разных странах в различной степени, стало возможным определить факторы риска приобретения H. pylori. К ним относятся большая семья (количественно); родители (особенно мать) – носители H. pylori; брат или сестра, положительные по H. pylori; тесные условия проживания в детстве.
Таким образом, после того как исчезновение H. pylori началось, его следствия будут ощущать на себе все последующие поколения людей, особенно если вода будет становится чище, семья – меньше, а питание – лучше.
К еще одному явлению, несомненно, вносящему вклад в исчезновение H. pylori, можно отнести широкое использование антибиотиков, особенно в раннем детском возрасте. Чтобы надежно искоренить H. pylori – а именно это означает английское слово eradicate, – сегодня необходима комбинация двух-четырех антибактериальных препаратов, однако в ранних исследованиях с применением монотерапии, в том числе b-лактамными антибиотиками и макролидами, частота успешной эрадикации составляла 10-50%. С учетом того, что такой эффект происходит каждый раз, когда ребенок получает лечение антибиотиками по поводу инфекции верхних дыхательных путей, инфекции кожи или среднего отита, снижение в развитых странах распространенности H. pylori у детей объяснить не трудно.
Следствия наличия и отсутствия H. pylori
Наличие клеток воспаления привело к использованию терминов, подразумевающих патологический процесс. Однако, по мнению авторов данной статьи – биологов по образованию, скопление иммунных и воспалительных клеток в ткани следует расценивать как физиологический ответ на индигенную микробиоту (ФОИМ). Таким же образом собственные пластинки рта, влагалища и толстой кишки млекопитающих населены фагоцитирующими и иммунологическими клетками, реагирующими на местную микрофлору. Безмикробные животные, напротив, вообще не имеют фагоцитирующих и иммунных клеток в собственных пластинках слизистых; восстановление нормальной микрофлоры у таких животных возвращает и эти клетки, что в комплексе расценивается как нормальная гистопатологическая картина.
Влияние H. pylori на физиологию человека
Желудок – орган, выполняющий множество функций; H. pylori и физиологический ответ на H. pylori влияют, по меньшей мере, на три из них.
Во-первых, желудок секретирует кислоту. Этот процесс находится под сложным регулирующим контролем, который осуществляется при помощи автономной иннервации, нейроэндокринных пептидов, гастрина и соматостатина. Доказано, что H. pylori-статус влияет на этот гомеостаз.
Во-вторых, желудок обладает адаптивной иммунологической активностью, которая выражается в функциях Т- и В-клеток. H. pylori-положительные и H. pylori-отрицательные желудки иммуннологически разные, и в отношении не только связанных с H. pylori, но и системных эффектов. В частности, персистенция H. pylori сопровождается намного большей концентрацией регуляторных Т-клеток.
В-третьих, желудок продуцирует лептин и является основным местом образования грелина. Эти нейроэндокринные пептиды играют важную роль в энергетическом гомеостазе млекопитающих, и появляется все больше данных в пользу того, что H. pylori-статус влияет на их регуляцию.
Таким образом, становится очевидно, что в развитых странах вырастают поколения детей, не имеющих H. pylori, которая регулирует эти и другие физиологические функции. Естественно предположить, что изменение секреции кислоты, иммунологической активации и нейроэндокринной регуляции будет иметь различные последствия.
Связь с астмой и аллергическими состояниями
В последние годы в развитых странах отмечается стабильный рост заболеваемости бронхиальной астмой (БА), аллергическим ринитом и атопическим дерматитом. Разительное увеличение распространенности атопических состояний во всех возрастных категориях должно быть связано с факторами окружающей среды, в том числе такими, как курение, загрязнение воздуха, аллергены, экзогенные инфекции, ожирение.
Однако, кроме экзогенных причин, существуют и эндогенные, связанные с изменением нашей индигенной микробиоты. И в этом контексте логично вспомнить про H. pylori, так как ее исчезновение хорошо доказано документально и происходит в мировом масштабе. Более того, исчезновение H. pylori предшествовало росту заболеваемости бронхиальной астмой. Однако связаны ли эти события?
Чтобы подтвердить или опровергнуть результаты указанных популяционных исследований, мы ретроспективно проанализировали два других проведенных нами исследования.
Масштабное исследование National Health and Nutrition Survey (NHANES) III проводилось между 1988 и 1994 годами. В середине 1990-х были выполнены серологические исследования материала, полученного от более 10 тыс. участников исследования, причем лаборанты и статисты не знали, была ли у пациента астма или атопия. В 2006 г. было доступно 7663 записей, содержащих информацию об астме и H. pylori-статусе. Отмечена обратная связь между наличием бронхиальной астмы и cagA+ штамма H. pylori (снижение риска БА на 21%) с наиболее выраженной корреляцией у участников в возрасте ниже среднего в популяции исследования (43 года; снижение риска БА на 37%) и ее отсутствием у пожилых пациентов. Подобным же образом наиболее мощная обратная связь отмечена у пациентов, у которых БА началась в возрасте до 15 лет (снижение риска на 37%); при более позднем начале БА связь отсутствовала.
Подводя итоги анализа исследования NHANES III, можно увидеть обратную связь между H. pylori, особенно cagA+ штаммами, и бронхиальной астмой и связанными с ней аллергическими расстройствами, особенно у молодых пациентов с ранним началом заболевания.
Основываясь на полученных результатах, мы провели независимую оценку этой связи, используя данные следующего исследования NHANES (1999-2000). В этом исследовании принимали участие 7412 пациентов, для которых был известен аллергологический анамнез и H. pylori-статус (тестирование по cagА не проводили). Средний возраст пациентов был 25 лет. С учетом полученных раннее результатов относительно раннего начала БА особое внимание мы уделили пациентам в возрасте 20 лет и младше. В результате была обнаружена значительная обратная связь между H. pylori-положительным статусом и ранним началом астмы и аллергического ринита у детей и подростков в возрасте до 20 лет, а также наличием астмы на момент исследования у детей в возрасте от 3 до 13 лет. Также H. pylori обратно коррелировала с наличием свистящего дыхания, аллергического ринита, дерматита и сыпи.
Таким образом, эти два независимые масштабные популяционные исследования показали высоко последовательные результаты, дополняющие полученные ранее данные относительно протективной роли H. pylori.
Биологические предпосылки протективной роли H. pylori в отношении бронхиальной астмы
H. pylori-статус может быть причинно связан с БА и другими аллергическими состояниями таким образом, что лица, колонизированные H. pylori, имеют определенную защиту от БА. В пользу этого предположения можно привести ряд известных фактов.
На протяжении многих лет наблюдается одна и та же тенденция: H. pylori исчезает, заболеваемость БА растет; противоположный эффект H. pylori маловероятен.
Важным является тот момент, что снижение распространенности H. pylori, которое началось в начале ХХ века, предшествовало увеличению заболеваемости БА. Ни одно из эпидемиологических исследований, позволяющих оценить данную связь, не было проспективным. Несмотря на это, вероятность того что БА и другие аллергические состояния могут сами приводить к исчезновению H. pylori, очень мала. После колонизации в раннем детском возрасте, в отсутствие лечения антибиотиками, H. pylori персистирует в течение десятилетий, а то и всей жизни человека.
H. pylori в большей мере связана с манифестацией атопии в детском возрасте, когда происходит формирование иммунитета
Мощная обратная связь с H. pylori имеет место для астмы и других состояний аллергического (атопического) спектра. Обратная связь с H. pylori сильнее выражена для бронхиальной астмы с началом в детском возрасте, этиология которой отличается от таковой при БА с манифестацией во взрослом возрасте. Детская астма часто проходит в подростковом возрасте, хотя часть пациентов, вошедших в ремиссию, в дальнейшем могут иметь рецидивы. Эффект H. pylori может быть меньше выражен в отношении БА с поздним началом, так как факторы риска в этом случае более неоднородны, чем при детской астме; заболевание имеет более сложный патогенез, который может отягощаться воздействием факторов внешней среды (курение, профессиональные вредности). Наконец, у взрослых чаще имеет место ошибочная диагностика БА-статуса и H. pylori-статуса. Так как эта диагностика проводится независимо друг от друга, она не является дифференциальной, что при статистической оценке сводит вероятность смещения к нулю.
Обратная связь между H. pylori и БА согласуется с результатами, полученными в двух масштабных исследованиях NHANES; каких-либо других гипотез, которые бы объясняли наблюдаемую корреляцию, нет
Одно из возможных объяснений состоит в том, что H. pylori-статус, хотя и связанный с БА, на самом деле является лишь маркером какого-то другого явления. Например, антибиотикотерапия в раннем детском возрасте приводит к эрадикации не только H. pylori, но и других микроорганизмов, которые являются истинными факторами защиты. В настоящее время каких-либо данных в пользу этого предположения не получено.
В ряде исследований, в которых изучали несколько инфекций, был установлен их аддитивный эффект в этиологии БА. Кроме того, обратная связь между H. pylori и БА не зависит от социально-экономического положения, возраста, пола, этнического происхождения, курения и вирусного гепатита А.
Существуют механизмы, которые объясняют протективный эффект H. pylori
В настоящее время накоплено достаточно данных о защитной роли H. pylori (особенно cagA+ штаммов) в отношении астмы и других атопических состояний (см. ниже).
Механизмы, благодаря которым колонизация H. pylori желудка может влиять на риск бронхиальной астмы
На сегодня уже доказано, что физиология желудка у H. pylori-положительных и отрицательных лиц значительно различается. При этом значение имеют несколько взаимосвязанных механизмов.
Во-первых, H. pylori, фактически защищая от ГЭРБ, может защищать и от бронхиальной астмы, так как у части пациентов БА развивается вследствие ГЭРБ. Однако этого механизма недостаточно, чтобы объяснить протективную роль H. pylori в отношении аллергического ринита и атопического дерматита.
В-вторых, сочетание БА, атопии, аллергического ринита и сенситизации кожи предполагает иммунологическую медиацию. H. pylori-положительные лица имеют популяцию иммуноцитов, включая регуляторные Т-клетки, которая в большой мере или вообще отсутствует у H. pylori-отрицательных лиц. Эти клетки могут проявлять системную иммуномодулирующую активность. Недавние исследования выявили взаимосвязь между колонизацией H. pylori и инфекцией Mycobacterium tuberculosis – колонизация сопровождалась длительным поддержанием туберкулезной инфекции в латентном состоянии, что является еще одним подтверждением системной иммуномодулирующей роли H. pylori.
Третий механизм может быть связан с эффектами H. pylori-индуцированного воспаления на уровень гастральных гормонов. Лептин и грелин не только регулируют энергетический гомеостаз, но и проявляют иммуномодулирующую активность. Появляется все больше данных в пользу того, что колонизация желудка H. pylori влияет на продукцию обоих гормонов.
Наконец, определенную роль может играть воздействие H. pylori на автономную нервную систему, при этом индивидуальные различия могут обусловливать и различный риск БА.
Возможно, впервые за всю историю человечества растет поколение детей, не имеющих в своих желудках H. pylori – бактерии, которая способствует развитию иммунной системы, гормональной регуляции энергетического гомеостаза и регуляции кислотности желудка. Утрата этого древнего, доминантного и неизменного члена нормальной микробиоты человека, несомненно, будет иметь последствия.
К настоящему времени уже накоплено достаточно данных относительно положительных и отрицательных эффектов этого явления на состояние желудочно-кишечного тракта. Основное же внимание ученых направлено на внекишечные проявления исчезновения H. pylori, включая нарушения энергетического гомеостаза (ожирение) и бронхиальную астму. Обратная связь между H. pylori и детской астмой, аллергическим ринитом и атопией становится все более очевидной. И хотя это может быть лишь вторичным патологическим явлением как часть более глобального изменения микроэкологии человека, существуют четкие доказательства биологической роли исчезновения H. pylori в увеличении аллергической заболеваемости детей. Если H. pylori и, особенно, cagA-статус являются единственными маркерами риска БА, это можно использовать в клинических и эпидемиологических исследованиях.
На сегодня понятно, что взаимодействие H. pylori с человеком сложное, в некоторой степени индивидуальное и до конца не изученное. Врач должен знать, что колонизация H. pylori снижает риск заболеваний пищевода (в том числе злокачественных), бронхиальной астмы и атопии, а также, возможно, ожирения и сахарного диабета, и учитывать это при назначении лечения. Вполне вероятно, что уже в ближайшие годы после проведения соответствующего фенотипирования и генотипирования ребенку можно будет выписать рецепт на получение в аптеке препарата, содержащего один или несколько штаммов H. pylori, колонизация которыми позволит улучшить его здоровье в течение всей последующей жизни.
Список литературы находится в редакции.
Статья напечатана в сокращении.Gut 2008;57:561-567
Перевел с англ. Алексей ГладкийHelicobacter pylori – друг или враг?
M.J. Blaser, Yu Chen, J. Reibman, Нью-Йорк, США.Читайте также:




















