Бактериофаг стафилококковый и ирс-19
Обновлено: 19.04.2024
В последние годы для понимания патогенеза рецидивирующих инфекций носоглотки и респираторного тракта большое внимание уделяется изучению системы местного иммунитета слизистых, особенно синтеза и секреции IgA; проводятся исследования механизма действия бак
В последние годы для понимания патогенеза рецидивирующих инфекций носоглотки и респираторного тракта большое внимание уделяется изучению системы местного иммунитета слизистых, особенно синтеза и секреции IgA; проводятся исследования механизма действия бактериальных лизатов на модельных системах у больных при данной патологии. Одним из таких препаратов является ИРС-19, выпускаемый в виде назального спрея и содержащий лизаты 19 возбудителей, наиболее часто высеваемых при рецидивирующих инфекциях носоглотки и респираторного тракта. Задачей настоящего исследования явилось изучение механизма действия ИРС-19 в группе длительно и часто болеющих детей.
В исследование были включены 15 детей в возрасте от 6 до 10 лет (8 мальчиков и 7 девочек). В анамнезе частые ОРВИ (более 6 раз в год), аденоиды (5 детей), риносинусопатия (5 детей), хронический фарингит (4 детей), хронический отит (2 ребенка).
Клинико-иммунологическое обследование проводилось до назначения ИРС-19 (Solvay Pharma, Германия), после окончания курса лечения ИРС-19 и через три месяца. ИРС-19 назначали по стандартной схеме — одна ингаляция в каждую ноздрю два раза в день вне периода обострения. 8 детей получали ИРС-19 в течение 14 дней; 7 детей со снижением CD4+-клеток — в течение одного месяца. Клетки CD3+, CD4+, CD8+, CD19+ определяли с помощью моноклональных антител (фирма Becton-Dikinsen), сывороточные IgM, IgG, IgA методом радиальной иммунодиффузии, IgA в слюне — методом ИФА, показатели хемилюминесценции — по стандартным методикам, специфические IgM, IgG к общим антигенам Staphylococcus, Neisseria, Klebsiella species, Streptococcus (гиалуронидаза) — методом иммуноферментного анализа.
Статистическая обработка результатов проводилась с использованием компьютерных программ общепринятыми методами.
По данным таблицы можно отметить увеличение относительного и абсолютного количества CD4+-клеток у больных с изначальным снижением этого показателя (разница статистически достоверна). Динамика клеток CD3+, CD8+, ИРИ не была значимой.
Значимой динамики количества лейкоцитов, лимфоцитов, эозинофилов, палочкоядерных и нейтрофильных лейкоцитов на фоне приема ИРС-19 не отмечено, прослеживалась лишь тенденция к нормализации количества лейкоцитов при исходном повышении.
Динамика CD19+-клеток не была значимой, до начала курса лечения ИРС-19 их количество составляло 12±0,7%, после окончания курса — 12±0,9%.
Клинический эффект применения ИРС-19 описан и в других исследованиях. По данным М. Р. Богомильского с соавт., у 89% пациентов с острыми заболеваниями верхних дыхательных путей назначение ИРС-19 в комплексе с базисной терапией приводило к выздоровлению. А. В. Караулов с соавт. отмечают снижение числа эпизодов респираторных инфекций у детей в 2,4 раза и сокращение длительности обострений у взрослых. Со стороны иммунологических показателей авторы отмечают повышение числа CD4+-клеток, фагоцитарной активности нейтрофильных лейкоцитов, уровня секреторного IgA.
Необходимо отметить, что ИРС-19 является в основном препаратом местного действия, не определяется его влияния в общей группе больных на показатели крови (клетки CD3+, CD8+, CD19+; ИРИ), повышение уровня сывороточных иммуноглобулинов, изменение уровня специфических IgG, IgM-AT к Staphylococcus sp., Streptococcus (гиалуронидаза), Klebsiella sp., Neisseria sp. Мы наблюдали повышение относительного и абсолютного количества CD4+-клеток, уровня сывороточного, IgG и IgA у детей с исходным снижением CD4+-клеток. Четкая динамика, повышение уровня IgA в слюне наблюдались у всех больных. В последние годы отмечается резистентность высеваемой из зева флоры к антибактериальной терапии.
Снижение CD4+-клеток, по нашим данным, наблюдается у 20-30% длительно и часто болеющих детей, может быть связано с запаздыванием развития иммунной системы и не является противопоказанием для назначения препарата у данной категории больных. У таких детей целесообразно применение препарата в течение месяца.
На сервисе СпросиВрача доступна консультация педиатра по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!

Стафилококк антибиотиками лечится, ими только усугубить ситуацию. Если хотите с ним разобраться Хотя он у вас в очень мпленьком титре, нужно пропить фаг по чувствительности. Антистафилококковый бактериофаг любого производителя по 10 мл 3 раза в день бак-сет одна капсулы 1 раз в день и Хилак форте 30 капель 3 раза в день. К FAQ 10 дней Хилак и бак-сет 21. По описанию кашель действительно похож на эти тикоидное расстройство. После курса бактериофага и пробиотиков пропить бактоблис одну таблетку на ночь месяц

Добрый день! Кровь не бактериальная: лейкоциты в норме, соэ тоже не высокое доя бактериальной инфекции. Вы были на консультации у ЛОР врача?

Здравствуйте, нос дышит сейчас?
Прикрепите фото глотки по возможности.
Температура в норме?
Что принимали последний раз?
Екатерина, нос дышит, сопли густые и прозрачные. Фото глотки не получается. Но там все норм. В бакпосеве носа ничего не выделено. Только в зеве рост флоры. Когда-то было в носу, тогда был аденоидит, но мы вылечили. Сейчас рост в зеве- 2 месяца кхыкает. При аденоидах не кхыкал- храпел. Темп 36,6. Реньше это когда? От начала этого заболевания не пили ничего. В нос при заложенности- виброцил. Все. Еще раньше при прошлом заболевании? По разному.

Здравствуйте, Марина. Флора в рото-носоглотке меняется в течение дня ежедневно- это вариант нормы вследствие взаимодействия с внешними факторами, но есть и постоянные источники в организме. Очный осмотр стоматолога и при необходимости лечение и санкции ротовой полости. Промывания носа регулярно после сна и прогулок. По вашему описанию похоже больше,что кашель имеет невротический характер - поэтому консультация невролога желательно. По поводу приёма антибиотика - не надо,но можно стафилококковый бактериофаг курсом 10 дней/бактоблис/имудон/лизобакт/ИРС-19 - все эти препараты оказывают лечебное и профилактическое действие. По поводу усиления кашля на данное время - необходим очный осмотр лор- возможно, есть постназальный затек, что и вызывает такой кашель

Здравствуйте, кровь вирусного характера, антибактериальная терапия не требуется
Вам нужно дообследование
Сдайте риноциограмму, кал и соскоб на я/г, IgE, катионный эозинофильный белок
Осмотр лор врача
Стафилококк в данном титре лечить не нужно
Татьяна, я тоже обратила внимание на увеличенные эозонофилы. У меня в крови они тоже почему-то увеличены. Обычно такого не бывает. Мы алергиями не страдаем. Хочу просто проглистовать семью. Анализ не хочу сдавать, тк говорят сложно их найти. Мы каждый год для профилактики глистуемся, видимо наступил такой момент. А вот на счет крови не согласна. Прикреплю фото как я определяю. И всегда подтверждается. Так уже вылечила два аденоидита вызванных пиогенным стрептокок, и моракселлу. А врачи говорили -вирусы. Кровь показывала бактерию и юыло подтверждение бакпосевом. Когда была кровь вирускся и посевы были чистые

Здравствуйте.Результат анализа крови говорит о вирусной инфекции в организме.
По поводу посева ,бактерии выселялись в предельно допустимых значениях поэтому антибактериальное лечение ребенку не показано .
Необходимо промывать нос солевым раствором ( Аквамарис или аналоги) по 2впр 3р/д(14 дней).В нос масляный Хлорофиллипт по 2к 2р/д(10 дней) - это противостафилококковый препарат.
Горло выполаскивайте раствором хлорофиллипта спиртового ( 5 мл на 200 мл воды) 3р/д(7 дней) ,если ребенок ещё не полощит,тогда подойдёт спрей Хлорофиллипт по 2впр 3р/д(7 дней).
Также эффективно будет пойти тубус - кварц зев/нос (7 дней).

Антибиотик не нужен, т.к. кровь небактериальная. Титр низкий, посев лечить не нужно, лечим ребенка. А ребенок здоров
Зоя, Вы знаете, на поотяжении 2-х последних месяцев, мне уже надоело выслушивать от окружаюших, что наденьте маску ребенку, он кашляет. Здоровый ребенок кашлять не будет! Когда он здоров и анализы совсем другие! Сейчас он болен, и я больна. Кашляю очень сильно. И анализы тому показатель! Поэтому лечение нужно, только вопрос какое? Если вирус- то просто обильное питье. Но если бактерия? Вот тут то у меня и вопрос


Напоминаем, что консультации специалистов сайта даются исключительно в справочных целях и не являются постановкой диагноза или основанием
для назначения лечения. Необходима очная консультация специалиста, в том числе для выявления возможных противопоказаний.
Для цитирования: Гунчиков М.В., Винников А.К. Эффективность ИРС-19 в лечении воспалительных заболеваний верхних дыхательных путей. РМЖ. 2000;17:712.
Российская медицинская академия последипломного образования, Москва
В настоящее время одной из самых актуальных проблем в оториноларингологии является повышение эффективности лечения больных с воспалительными заболеваниями дыхательных путей. В связи с серьезными экологическими проблемами количество таких больных неуклонно нарастает. В этом аспекте главные достижения современной медицины принадлежат иммунологии.
Барьерная функция слизистых оболочек дыхательных путей (в первую очередь носа, околоносовых пазух и глотки) связана с иммунологическими механизмами. Факторы местного иммунитета слизистых оболочек верхних дыхательных путей составляют как бы несколько эшелонов иммунных реакций, начиная с поверхности слизистой оболочки и продолжаясь к ее более глубоким слоям. Таким образом, выделяют два барьера - специфический (иммунный) и неспецифический, которые тесно взаимосвязаны между собой.
Первым эшелоном выступают неспецифические факторы. Сюда относят : мукоцилиарную транспортную систему, колонизационный иммунитет (наличие колоний условно-патогенных микробов, присущих конкретному индивидууму, предполагающие конкуренцию с патогенными микроорганизмами за соответствующие рецепторы на эпителиальных клетках), различные антимикробные факторы, вырабатываемые клетками слизистой оболочки (лизоцим, интерферон, лактоферрин, секреторные антитела и др.), фагоцитарная система (мононуклеарные фагоциты и полиморфноядерные лейкоциты). Недостаточное присутствие и активность неспецифических факторов на поверхности слизистых оболочек создают условия для инвазии патогена в слизистую оболочку и возникновению воспаления с сопутствующей ему индукцией неспецифических и специфических реакций иммунной защиты.
Значительную роль в неспецифической защите играет функционирование лимфоидной ткани, ассоциированной со слизистой оболочкой. Такие ассоциации лимфоидной ткани встречаются как в форме очаговых скоплений лимфоидной ткани, образующей особые органы периферического иммунитета (лимфоглоточное кольцо Вальдейера), так и в форме диффузно рассеянных лимфоцитов и плазматических клеток, населяющих слизистые оболочки.
В контексте течения воспалительной реакции антибактериальные и противовоспалительные препараты являются препаратами выбора. Однако на протяжении последних лет во всем мире отмечается значительный рост устойчивости возбудителей внебольничных и нозокомиальных инфекций к антибактериальным препаратам. По мнению ведущих мировых экспертов, почти в 50% случаев антибактериальная терапия назначается необоснованно. В результате, наряду с подавлением микробов-возбудителей, отмечаются негативные побочные эффекты в виде дисбактериоза и сенсибилизации. Кроме того, действие большинства антибиотиков на иммунную систему может обуславливать снижение интенсивности специфического иммунного ответа и фагоцитоза. В ряде случаев их действие может вызвать парадоксальный эффект - воспаление принимает затяжное течение, рецидивирует или становится хроническим.
В современной оториноларингологии большое внимание уделяется применению иммунотропных лекарственных средств, с помощью препаратов, содержащих бактериальные антигены. К числу таких заболеваний относят респираторные инфекции и их осложнения. При этом проводят как иммунопрофилактику, так и иммунотерапию.
Одним из препаратов такого действия является ИРС-19. Это иммуномодулирующий респираторный спрей - лизат инактивированных бактерий, содержащий 19 штаммов наиболее часто встречающихся возбудителей заболеваний дыхательных путей. Препарат обладает способностью иммунизировать слизистую оболочку и вызывать появление плазмоцитов, секретирующих специфические антитела к определенным бактериальным антигенам.
Очень перспективным видится путь местного - интраназального применения. Это позволяет избегать всасывания препарата и системного метаболизма. Кроме того, системный путь введения ограничивает проникновение препарата в воспаленные ткани очага инфекции, что особенно важно с учетом нарушения общей циркуляции именно в этих зонах.
Показанием к применению ИРС-19 являются лечение и профилактика острых, рецидивирующих и хронических инфекций дыхательных путей. Назначение этого препарата не отменяет антибактериальную терапию.
Нами были изучены клинические результаты использования поливалентной вакцины ИРС-19, применяемой в виде назального аэрозоля. Под наблюдением находились 60 больных (19 мужчин и 41 женщина) в возрасте от 19 до 53 лет. У 12 пациентов был выявлен острый пансину сит, у 7 - двухсторонний острый гайморит, у 11 - односторонний гайморит, у 19 - острый ринофарингит. В 16 случаях процесс определен, как гнойный. Помимо общепринятой противовоспалительной терапии у некоторых больных, а также местных процедур и физиотерапевтического лечения, использовалась вакцина - ИРС-19 от 2 до 4 раз в день на протяжении 5-10 дней. Клиническая динамика прослеживалась ежедневно до полного стихания воспалительных явлений и выписки больных из стационара.
Субъективное улучшение в виде уменьшения заложенности носа и снижения интенсивности головной боли в первые сутки комплексного лечения отметили 4 пациента, на второй день - 17, на третий - 9. У 5 человек субъективные ощущения не изменились. При риноскопии было выявлено уменьшение гиперемии и отечности слизистой оболочки носа и количества отделяемого.
Выявленная динамика воспалительного процесса у большинства больных (29 человек) была положительной и позволила на 4-5 день от начала лечения отменить антибактериальную терапию и пункции верхнечелюстных пазух.
Наблюдение за группой больных ринофарингитами (19 человек) также показало положительную динамику у 15 пациентов. Антибиотикотерапия этим больным не проводилась. При орофарингоскопии отмечалось снижение гиперемии и отечности слизистой оболочки полости носа и глотки (задней стенки и миндалин). 13 человек отметили снижение явлений дисфагии к 4 дню заболевания. У 10 больных отмечено уменьшение частоты и интенсивности кашля.
Для сравнения полученных результатов мы наблюдали контрольную группу из 20 больных с аналогичной патологией, лечившихся одновременно с основной группой, но без использования ИРС-19. Отмечено, что длительность лечения в контрольной группе составила 7-8 дней, а количество лечебных пункций при гнойном гайморите достигало 5-6.
Необходимо отметить, что у большинства больных переносимость препарата была хорошая. Три пациента предъявляли жалобы сухость в горле, однако прямой взаимосвязи с лечением препаратом ИРС-19 выявить не удалось. Эти побочные явления не явились причиной отмены препарата до реконвалесценции.
Таким образом, проведенное нами исследование подтвердило предположение о выраженном местном воздействии поливалентной вакцины ИРС-19, которое проявилось в сокращении сроков и повышении эффективности лечения больных с острой воспалительной патологией верхних дыхательных путей.
Для цитирования: Караулов А.В., Сокуренко С.И., Климов Э.В. Применение иммуномодулятора ИРС 19 при рецидивирующих респираторных заболеваниях. РМЖ. 2000;13:552.
ММА имени И.М. Сеченова
Одним из главных достижений современной медицины является успешное развитие иммунологии. Раскрытие роли иммунной системы в физиологических и патофизиологических процессах в организме человека привело к созданию методов профилактики, лечения и реабилитации, основанных на направленной регуляции иммунных реакций. Применение иммунотропных лекарственных средств становится определяющим фактором в лечении многих соматических и инфекционных заболеваний.
К числу заболеваний, исход и течение которых определяется направленной иммунотерапией, относятся респираторные инфекции. Отсутствие массовой адекватной иммунопрофилактики приводит к постояному росту этих заболеваний, которые только по официальной статистике составляют треть из числа регистрируемых при обращении больных к врачу общей практики . В то же время, даже новые антибактериальные и противовоспалительные средства не только не решают проблему, но и создают основу для хронизации и постоянного рецидивирования. Причины такого состояния вполне очевидны для большинства клинических иммунологов. Как известно, местная иммунная система слизистых оболочек, ответственная за защиту от инфекций на поверхности, подвергается различным нарушениям.
Наряду с первичным нарушением иммунной системы вторичные нарушения являются наиболее частой причиной хронических рецидивирующих инфекций дыхательных путей. Риск инфекции особенно повышается в силу того, что факторы, ответственные за нарушение мукоцилиарной системы, одновременно ухудшают и иммунную защиту. Это касается как ингаляционных, так и инфекционных патогенных факторов, к которым относятся микоплазмы или вирусы. При дисбалансе в системе иммунитета макроорганизма под действием бактерий может произойти угнетение иммунной системы, обусловленное как продуктами секреции бактерий, так и эндотоксинами, освобождаемыми в процессе бактериолизиса. При этом иммуностимуляции, усиливающейся с ростом числа бактерий, противостоит ими обусловленная иммуносупрессия. В механизме иммуносупрессии лежит сниженная спосособность лимфоцитов периферической крови человека к репарации ДНК и накопление повреждений ДНК, что приводит к генетической нестабильности. Этот длительный, усиливающийся под влиянием антибактериальной терапии процесс может быть ослаблен при использовании иммуномодуляторов. При отсутствии иммунологической поддержки возникает опасность развития рецидива и перехода заболевания из острой формы в хроническую. С учетом этого обстоятельства представляется целесообразным проведение иммунопрофилактики и иммунотерапии с помощью препаратов, содержащих бактериальные антигены. Такая терапия должна проводиться в каждом случае заболевания респираторной инфекцией. Если же врач принимает решение о проведении антибиотикотерапии, то иммунотерапия абсолютно необходима во избежание иммунологической недостаточности ятрогенной природы. Иммунокоррекция становится логичной терапевтической стратегией, призванной служить повышению эффективности общепринятого патогенетического лечения и генетической стабильности клеток иммунной системы.
Специфические методы направлены на регуляцию иммунного ответа в отношении определенного антигена и группы антигенов, а также на нейтрализацию отдельных экзогенных и эндогенных веществ, участвующих в патогенезе заболеваний. Эти методы включают в первую очередь вакцинацию и введение специфических иммуноглобулинов и сывороток. Активацией специфического иммунного ответа в значительной степени обусловлены терапевтический и профилактический эффекты ИРС 19 - вакцины в форме аэрозоля для интраназального применения, включающей антигены 19 штаммов микроорганизмов, которые являются наиболее частыми возбудителями инфекций дыхательных путей. По нашим наблюдениям, этот препарат оказался эффективным дополнением к лечению рецидивирующих респираторных заболеваний.
Материалы и методы
Под нашим наблюдением находились 21 ребенок в возрасте 3–14 лет и 19 взрослых с респираторными редицивирующими заболеваниями (РРЗ) с клиническими проявлениями верхнечелюстного синусита и бронхита. 12 больным детям ИРС 19 назначали с профилактической целью по 1 ингаляции эндоназально 2 раза в сутки в течение 14 дней, взрослым - в острый период заболевании по 1 ингаляции в каждый носовой ход до 5 раз в сутки, лечение прекращали при стихании симптомов инфекции. 9 детям с рецидивирующим ринофарингитом, протекающим с перманентной заложенностыо носа и сопровождающимся наличием аденоидов I-II степени, назначали препарат по 1 ингаляции в каждый носовой ход 2 раза в сутки в течение 2 месяцев с 30-дневным интервалом. Клинико-иммунологический мониторинг больных последней группы проводили каждые 3 месяца в течение 12 месяцев от начала лечения. Эффективность терапии анализировали по частоте и длительности инфекционных эпизодов, объему дополнительно применяемых противомикробных средств. Оценка иммунной системы включала определение СDЗ+, СD4+, СD8+, 3F3+ лимфоцитов, сывороточных иммуноглобулинов А, М, G, секреторного иммуноглобулина А, фагоцитарной активности нейтрофилов.
Результаты и обсуждение
Под влиянием монотерапии в течение 2 месяцев был получен продолжительный лечебный эффект, сопровождающийся выраженной иммунологической динамикой. Количество Т-хелперов заметно превышало исходные показатели, хотя к концу наблюдения несколько понизилось. Фагоцитарная активность нейтрофилов достоверно превышала исходные значения в течение первых 6 месяцев мониторинга.
Лечение взрослых пациентов также дало положительные результаты: продолжительность респираторных инфекций была меньше, чем в группе сравнения на 3,6 ± 0,2 дня (р<0,01); исследуемая группа выгодно отличалась и по выраженности клинической симптоматики и длительности применения противовоспалительной терапии.
Характер иммунологических изменений при лечении ИРС 19 был идентичным у детей и взрослых и заключался в увеличении относительного и абсолютного содержания СD4+ Т-хелперов, уровня секреторного IgA и повышении фагоцитарной активности нейтрофилов. Динамики других иммунологических параметров не выявлено. Отмечена корреляция положительных клинических и иммунологических результатов (г=0,65). Переносимость препарата расценена как хорошая, побочных и нежелательных эффектов у пациентов не зафиксировано; установлено, что ИРС 19 прекрасно сочетается с традиционным лечением РРЗ.
Клинический успех проведенной терапии назальным аэрозолем ИРС 19 демонстрирует важность направленного воздействия на иммунитет при РРЗ и позволяет рекомендовать данный препарат для комплексного лечения и профилактики респираторных инфекций. Препарат обладает отличной местной и общей переносимостью. Его можно назначать детям (независимо от возраста), лицам с нарушениями иммунной системы различного генеза и аллергией. Учитывая полную безвредность и простоту применения препарата, его можно использовать в качестве базового средства иммунопрофилактики и иммунореабилитации респираторных заболеваний.
Так мир познакомился с микроорганизмами, питающимися бактериями, которые много тысяч лет делали свое дело слаженно, не давая бактериям уничтожить все живое на земле. В 1921 г. Д. Мэйсон и Р. Брайон впервые описали успешное лечение стафилококковой инфекции кожи с помощью стафилококкового бактериофага. Во время Второй мировой войны бактериофаги использовались при гнойно-септических инфекциях, дизентерии, тифе и др.
Бактериофаги еще в прошлом столетии доказали свою эффективность и безопасность. Почему же бактериофаги до сих пор не стали основными средствами борьбы с инфекцией? Это объясняется несколькими причинами. Главная — открытие новой группы препаратов – антибиотиков, надолго оттеснившее интерес к бактериофагам. Плюс:
- недостаточная информированность врачей и пациентов,
- отсутствие фагов ко многим патогенным бактериям,
- неэффективность лечения в связи с неправильным подбором бактериофагов для лечения конкретного больного,
- недостаточно изученное иммунологическое взаимодействие бактериофагов и организма человека,
- отсутствие нормативно-правовых аспектов применения бактериофагов в лечении инфекций человека.
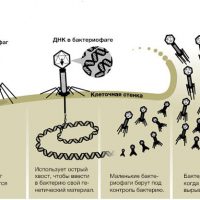
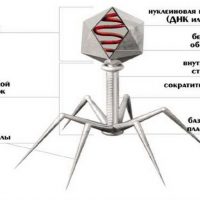
Что такое бактериофаги![Механизм]()
В 1939 году А. Флемингом был открыт антибиотик, и началась эра антибиотиков в лечении бактериальных инфекций. Появилось большое количество антибиотиков 1, 2, 3, 4 поколений, причем антибиотики последнего поколения, которыми пользуются и сейчас, появились еще в 70-е годы прошлого столетия. На Западе и Америке отказались от бактериофагов и активно начали применять антибиотики.
Но А. Флеминг предупреждал о некоторых обязательных моментах применения антибиотиков:
- строгих показаниях к назначению,
- соблюдении продолжительности и запрете прерывания курса лечения,
- адекватных дозах препарата,
- способах введения,
- назначения их обязательно врачом,
- отпуске антибиотиков исключительно по рецепту.
Несоблюдение хотя бы части этих требований могло привести и, как оказалось, приводит к кризису антибиотиковой эры. Бактерии перестают реагировать на препараты. Пока ещё действуют антибиотики последнего поколения, решая труднейшие клинические проблемы, но рассчитывать на появление новых антибиотиков не приходится.
Россия на сегодняшний день оказалась самой развитой страной в области микробиологии изучения бактериофагов. Бактериофаги – это естественные антагонисты бактерий.
Каков механизм действия бактериофагов
Сегодня многие заболевания вызываются стафилококками, стрептококками, клебсиеллами и другими бактериями, и успешно могут лечиться бактериофагами. Это естественная альтернатива антибиотикам, возврат к природе.
Какие преимущества имеют бактериофаги в лечении бактериальных инфекций
Бактериофаги много тысяч лет делали свое дело, не давая бактериям уничтожить все живое на земле.
Бактериофаги могут применяться и у беременных, и у детей, во всех возрастных группах людей. Противопоказаний к их применению нет.
Фаги совместимы с различными лекарствами, в том числе с антибиотиками, причем они уменьшают непереносимость (резистентность) бактерий к антибиотикам.
Курс лечения бактериофагами более короткий (7-14 дней). Фаги практически не дают побочных явлений. Они определяются бактериальной зараженностью и распадом бактерий с выделением эндотоксина, но они значительно меньше, чем при приеме антибиотиков, эти явления легко снимаются приёмом энтеросорбентов. Бактериофаги можно применять при аллергических реакциях на антибиотики.
Бактериофаги, благодаря своей специфичности воздействия на бактерии, не убивают хорошие бактерии и не изменяют нормальную микрофлору кишечника. Они, в отличие от антибиотиков, не нарушают микробиом человека.
Какие виды бактериофагов известны
Известно, что бактериофаги действуют на один штамм бактерий, поэтому производятся препараты бактериофагов, действующих против разных штаммов одного возбудителя:
- стафилококковый бактериофаг,
- сальмонеллезный бактериофаг,
- стрептококковый бактериофаг,
- клебсиеллёзный бактериофаг (Клебсиелла пневмония),
- бактериофаг псевдомонас (против синегнойной палочки).
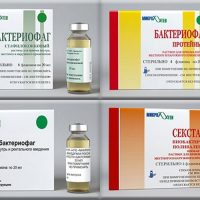
Производятся препараты против двух и более возбудителей, поливалентные бактериофаги:
- бактериофаг дизентерийный, действующий на разные штаммы дизентерийной палочки,
- клебсиеллезный бактериофаг против трёх видов клебсиелл,
- бактериофаг бактериальный поливалентный очищенный (действует на стрептококк, стафилококк, протей, клебсиеллу пневмонию, кишечную палочку, синегнойную палочку),
- пиобактериальный комплексный бактериофаг (против стафилококка, стрептококка, двух видов протея, двух видов клебсиеллы, энтерококков, энтеропатогенной кишечной палочки, синегнойной палочки),
- бактериофаг интестин-бактериальный против дизентерийной палочки, сальмонеллы, кишечной палочки, протея, энтерококков, стафилококков, синегнойной палочки,
- пиобактериофаг поливалентный или секстафаг (против стафилококка, стрептококка, протея, синегнойной палочки, клебсиеллы пневмонии, энтеропатогенной кишечной палочки).
Особенность бактериофагов – узкая специфичность, в следствие чего они могут применяться против определенных штаммов бактерий, поэтому необходимо иметь большую коллекцию бактериофагов, из которой можно выбрать подходящий препарат или фаговый коктейль для конкретного пациента. Коллекция бактериофагов составляет более 200 препаратов.
Производителем бактериофагов в России является научно-производственное объединение Микроген — мировой лидер изучения бактериофагов.
При каких заболеваниях применяются бактериофаги
Бактериофаги применяются при:
- трофических язвах,
- раневых инфекциях,
- инфекциях органов дыхания,
- мочеполовой системы,
- желудочно-кишечных тракта,
- болезнях лор-органов и др. заболеваниях.
Инфекции желудочно-кишечного тракта, вызванные сальмонеллой, золотистым стафилококком, протеем, и др. и сопровождающиеся диареей (поносами), успешно лечатся бактериофагами.
Применяться бактериофаги при острых кишечных инфекциях могут:
- в виде монотерапии при легких формах,
- в сочетании с антибиотиками при
- средне-тяжелых формах болезни,
- бактерионосительстве – выделении энтеропатогенных бактерий,
- комплексной терапии условно-патогенной флоры и нарушении микробиома (микрофлоры) кишечника.
Используются бактериофаги в дерматологии, в детской практике, хирургии. С профилактической целью — в детских садах и школах для предотвращения эпидемий, например, дизентерии. Бактериофаги уже более 100 лет на службе человека. Может быть, как раз сейчас начинается эпоха бактериофагов. В новосибирском научном центре разрабатываются технологии персонализированного лечения. Медицинские центры Франции, Бельгии, Швейцарии проводят клинические исследования коктейлей бактериофагов.
![]()
Важным условием успешного лечения бактериофагами является знание микрофлоры тех органов, где предполагается бактериальная инфекция. Ниже приведены необходимые исследования микрофлоры для различных очагов заражения:
Участок заражения Обследование желудочно-кишечный тракт анализ на микробиом толстой кишки (на дисбактериоз) носоглотка мазок на микрофлору урологические заболевания посев мочи,
посев секрета простатыгинекологические заболевания мазки раневые поверхности и язвы,
в том числе при диабетической стопепосев В настоящее время при выявлении бактериального возбудителя болезни есть возможность определить его чувствительность к бактериофагу. Перед началом лечения необходимо пройти это обследование.
Как принимаются бактериофаги
Бактериофаги хранятся в холодильнике при температуре 2-8 градусов.
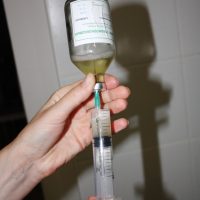
Бактериофаги — это крупные частицы. Они трудно проникают в ткани органов, поэтому лучше вводить их при лечении прямо к месту локализации инфекции. Это могут быть ингаляции при легочной патологии, промывания при лор-заболеваниях, аппликации при трофических язвах, ожогах, ранах. При инфекциях мочевыводящих путей для достижения успеха препараты бактериофагов вводятся в полость мочевого пузыря (хронический цистит).
Для внутреннего употребления есть бактериофаги во флаконах по 20 мл, 4 флакона в упаковке. Перед употреблением флакон следует подержать в руке, согреть, перелить в чистую посуду и принять внутрь. Принимать 2 раза в день натощак и после ужина, курс лечения 6 дней.
![Забор бактериофага из 100-мл флакона]()
Есть упаковки по 50 мл и 100 мл. Поскольку следует максимально сохранять стерильность препарата (при помутнении запрещён его приём), необходимый для однократного приёма объём следует набирать в шприц.
В настоящее время проводят лечение бактериофагами диабетической стопы. Из больных тканей берут мазок для выявления конкретных патогенных бактерий. Затем из коллекции бактериофагов подбирают те, которые способны ликвидировать именно эти бактерии. Бактериофаг наносят на стерильную салфетку, прикладывают к ране. Лечение около недели.
Бактериофаги применяются в медицине местно или внутрь. Еще в 30-ые годы прошлого столетия бактериофаги доказали свою безопасность и высокую эффективность в клинических условиях. Но покупать бактериофаги и лечиться самостоятельно не стоит.
Заключение
Не всегда бактериофаги могут заменить антибиотики. Так, если имеет место острая ситуация, когда заподозрена бактериальная инфекция, но нет времени определить бактериальный фон болезни, чтобы подобрать препарат бактериофаг, то применяется лечение антибиотиками. При хронических инфекционных болезнях, когда установлена нечувствительность бактерий к антибиотикам и бактериальный фон заболевания, предпочтение следует отдать бактериофагам.
Хотя бактериофаги, возможно, не смогут полностью заменить антибиотики, но вместе они могут бороться со многими серьезными болезнями в клинической практике.
Читайте также: