Бактероиды фрагилис лечение травами
Обновлено: 24.04.2024
Для цитирования: Шульпекова Ю.О. Избыточный бактериальный рост в кишечнике: патогенетические особенности и лечебные подходы. РМЖ. 2003;5:281.
ММА имени И.М. Сеченова
Основная часть микроорганизмов поступает в просвет желудочно–кишечного тракта из ротоглотки и с пищей.
В составе нормальной микрофлоры желудочно–кишечного тракта выделено более 400 видов непатогенных аэробных и факультативно анаэробных бактерий.
Состав микрофлоры неодинаков на всем протяжении желудочно–кишечного тракта. В верхнем и среднем отделах тонкой кишки популяция микроорганизмов сравнительно небольшая (в начале тощей кишки их содержание не более 100 микроорганизмов на 1 мл содержимого) и включает преимущественно грамположительные факультативные аэробы, небольшое количество анаэробов, дрожжей и грибов.
По мере приближения к илеоцекальному клапану состав микролоры начинает все более походить на популяцию толстой кишки. В дистальном отделе подвздошной кишки содержание микробов составляет 10 5 –10 8 /г кишечного содержимого.
Наибольшее содержание микроорганизмов наблюдается в толстой кишке. Здесь их концентрация достигает 10 10 –10 11 и более на 1 г содержимого.
Микробная популяция играет важнейшую роль во внутрипросветном пищеварении, в частности, участвует в переваривании пищевых волокон (целлюлозы), ферментативном расщеплении белков, высокомолекулярных углеводов, жиров и в процессе метаболизма вырабатывает ряд полезных для организма веществ.
Главный представитель анаэробной кишечной микрофлоры – бифидобактерии – синтезируют аминокислоты, белки, витамины В1, В2, В6, В12, викасол, никотиновую и фолиевую кислоты. Выдвинуто предположение, что некоторые вещества, вырабатываемые бифидобактериями, обладают антиоксидантными свойствами и способствуют снижению риска заболеваемости раком толстой кишки.
Среди аэробных микроорганизмов важнейшая роль в метаболических процессах принадлежит кишечной палочке, обладающей большим спектром функциональных свойств. E.coli вырабатывает несколько витаминов (тиамин, рибофлавин, пиридоксин, витамины В12, К, никотиновую, фолиевую, пантотеновую кислоты), участвует в обмене холестерина, билирубина, холина, желчных и жирных кислот, и, опосредованно влияет на всасывание железа и кальция.
Образующиеся под влиянием микрофоры продукты метаболизма белка (индол, фенол, скатол) оказывают регулирующее воздействие на перистальтическую активность кишечника.
В последнее время интенсивно изучается роль кишечной микрофлоры в формировании иммунологической реактивности и иммунологической толерантности организма.
Представители нормальной кишечной микрофлоры вырабатывают вещества с антибактериальной активностью (такие как бактериокины и короткоцепочечные жирные кислоты, лактоферрин, лизоцим), которые предотвращают внедрение патогенных микроорганизмов и подавляют избыточное размножение условно–патогенной флоры. Кишечные палочки, энтерококки, бифидобактерии и лактобациллы обладают наиболее выраженными антагонистическими свойствами в отношении патогенных штаммов.
Продуктами метаболизма молочнокислых бактерий (бифидобактерий, лактобацилл) и бактероидов являются молочная, уксусная, янтарная, муравьиная кислоты. Это обеспечивает поддержание показателя рН внутрикишечного содержимого на уровне 4,0–3,8, благодаря чему тормозится рост и размножение патогенных и гнилостных микроорганизмов в ЖКТ.
Микрофлора желудочно–кишечного тракта активно участвует в химических превращениях многих веществ эндогенного и экзогенного происхождения, в частности, лекарств. В процессе кишечно–печеночной циркуляции вещества, поступающие из просвета кишечника в печень, подвергаются конъюгации с глюкуронатом, сульфатом и другими молекулярными остатками, и многие из них затем вновь выделяются с желчью. В просвете кишечника под действием ферментов кишечной микрофлоры они подвергаются деконъюгации и другим изменениям, после чего вновь всасываются и возвращаются в печень по воротной вене.
Количественный и качественный состав кишечной микрофлоры может изменяться под воздействием различных факторов эндогенного или экзогенного происхождения. Однако это изменение следует рассматривать как вторичное по отношению к первопричинному фактору.
Избыточный бактериальный рост в кишечнике (в англоязычной литературе – bacterial overgrowth) – обусловлен нарушением качественного и количественного состава микробного биоценоза кишечника, размножением условно–патогенных бактерий в количестве, не свойственном здоровому человеку. Нельзя забывать, что избыточный бактериальный рост в кишечнике и связанные с ним клинические проявления представляет собой не самостоятельную нозологическую форму, а синдром.
Фоном для развития синдрома избыточного бактериального роста служат различные состояния, сопровождающиеся нарушением переваривания пищи, пассажа внутрипросветного содержимого; изменением иммунологической реактивности организма, ятрогенные воздействия на микрофлору кишечника.
При различных состояниях, сопровождающихся нарушением переваривания и всасывания пищи (врожденный дефицит ферментов, панкреатит, глютеновая энтеропатия, энтериты), невсосавшиеся питательные вещества служат питательной средой для избыточного размножения бактерий.
При анацидных состояниях и иммунодефицитах утрачивается регулирующее влияние со стороны организма на поддержание состава кишечной микрофлоры.
Применение антибиотиков, кортикостероидов, цитостатиков, особенно у ослабленных и пожилых пациентов, сопровождаются вмешательством во взаимоотношения микрофлоры и макроорганизма.
Пожалуй, в качестве единственной самостоятельной нозологической формы избыточного бактериального роста в кишечнике выступает псевдомембранозный колит, который обусловлен избыточным размножением Clostridium difficile – облигатно–анаэробной грамположительной спорообразующей бактерии, обладающей природной устойчивостью к большинству широко применяемых антибиотиков. Популяция C.difficile в составе нормальной микрофлоры кишечника составляет примерно 0,01–0,001%; она существенно возрастает (до 15–40%) при приеме антибиотиков, угнетающих рост штаммов кишечной флоры, которые в норме подавляют жизнедеятельность C.difficile (в первую очередь, клиндамицина, ампициллина, цефалоспоринов).
Избыточное размножение бактерий в тонкой кишке является дополнительным фактором, поддерживающим воспаление слизистой оболочки, снижающим продукцию ферментов (в наибольшей степени – лактазы) и усугубляющим нарушение переваривания и всасывания. Эти изменения обусловливают развитие таких симптомов, как коликообразные боли в околопупочной области, метеоризм, диарея, похудание.
При преимущественном вовлечении в процесс толстой кишки пациенты предъявляют жалобы на неоформленный стул, метеоризм, ноющие боли в животе.
Диагностика синдрома избыточного бактериального роста подразумевает анализ картины основного заболевания, с выявлением возможной причины нарушения микробного биоценоза кишечника. Проводится дополнительное обследование, которое может включать эндоскопическое, рентгенологическое исследование кишечника для выявления нарушений анатомического строения, оценки перистальтики желудочно–кишечного тракта; биопсию тонкой кишки – для установления диагноза энтерита, энтеропатии, диагностики ферментопатий (к сожалению, возможности проведения этого исследования в нашей стране ограничены) и др. Мало доступными на сегодняшний день, но точными методами диагностики избыточного бактериального роста являются аспирация содержимого тонкой кишки с немедленным посевом аспирата на питательную среду, а также неинвазивный дыхательный водородный тест с лактулозой. Посев кала, ранее использовавшийся в нашей стране как метод оценки микробного биоценоза кишечника, признан неинформативным, поскольку даже при максимальном приближении к правилам проведения микробиологических исследований может дать представление лишь о микробном составе дистального отдела толстой кишки.
Перед тем как непосредственно приступить к лечению синдрома избыточного бактериального роста, необходимо определить причину развития нарушений микробного биоценоза и, по возможности, устранить влияние данного фактора. Например, назначить пациенту противовоспалительную, заместительную ферментную терапию, использовать возможности по нормализации перистальтической активности кишечника.
Изменение характера питания позволяет воздействовать на микрофлору физиологическим путем. Однако диетические предписания необходимо давать с учетом основного заболевания. В любом случае, при избыточном бактериальном росте в кишечнике показано ограничение потребления легкоусвояемых углеводов и исключение потребления молока (особенно пресного). При отсутствии противопоказаний целесообразно потребление овощей, фруктов и ягод, обладающих бактерицидным действием (редька, редис, лук, чеснок, хрен, морковь, малина, клубника, земляника, черника, абрикосы, яблоки, черноплодная рябина, сок граната, гвоздика, корица, лавровый лист).
Однако при тяжелых формах избыточного бактериального роста в кишечнике показана антибактериальная терапия (назначение метронидазола по 400 мг 3 раза в день в течение недели; при неэффективности метронидазола к лечению целесообразно добавить тетрациклин по 250 мг 4 раза в день в течение 2 недель). Антибиотики резерва – ципрофлоксацин (по 500 мг 2 раза в день) и ванкомицин (по 125 мг 4 раза в день). Лечение псевдомембранозного колита проводится по определенным схемам и не рассматривается в данной статье вследствие обособленности этого заболевания.
В ряде случаев для подавления условно-патогенных микроорганизмов используются бактериофаги (стафилококковый и коли–протейный) по 50 мл 2 раза в день за час до еды в течение 3–4 дней, проводится 2–3 курса с 3–дневным перерывом.
Не менее важным и, зачастую, основным направлением лечения является воссоздание условий, благоприятных для восстановления нормальной микрофлоры. Лекарственные препараты, обладающие подобными свойствами, носят название пробиотиков.
Некоторое время назад в качестве пробиотиков особенно широко использовались биологические препараты для перорального приема, содержащие в своем составе бифидобактерии, лактобациллы, кишечные палочки с полезными сойствами. Необходимо учитывать, что микробы, вводимые в составе лекарственных препаратов, сами по себе надолго не приживаются в кишечнике и элиминируются спустя 2–3 недели. Основой лечебного действия подобных препаратов является их способность временно поддерживать ферментативную активность и защитные свойства (колициногенность) собственной микрофлоры кишечника. Ниже охарактеризованы некоторые из наиболее известных препаратов.
Благоприятные условия для размножения бифидобактерий создает дисахарид лактулоза, обладающий также слабительными и аммонийсвязывающими свойствами. Он служит питательной средой для размножения молочнокислых бактерий и источником выработки ими молочной кислоты, снижающей рН кишечного содержимого. К существенным недостаткам лактулозы относятся нередко развивающиеся вздутие живота и диарея с потерей электролитов (поэтому назначение лактулозы предпочтительно пациентам, страдающим запором). Лактулоза противопоказана при галактоземии. Доза сиропа лактулозы для взрослых варьирует от 15 до 45 мл в сутки (в 2–3 приема).
Начальная доза для взрослых составляет по 40–60 капель 3 раза в день; для детей – по 20–40 капель 3 раза в день; для детей грудного возраста – по 15–30 капель 3 раза в день. По мере клинического улучшения доза может быть уменьшена наполовину.
1. Вудли М., Уэлан А., ред. Терапевтический справочник Вашингтонского университета. Пер. с англ. – М.: Практика, 1995г.
2. Гребенев А.Л., Мягкова Л.П. Болезни кишечника. – М.: Медицина, 1994 г.
3. Денисов И.Н., Кулаков В.И., Хаитов Р.М., гл. ред. Клинические рекомендации для практикующих врачей, основанные на доказательной медицине. – М.: ГЭОТАР–МЕД, 2001г.
5. Котельников Г.П., Яковлев О.Г., ред. Практическая гериатрия: Руководство для врачей. – Самара: Самарский Дом печати, 1995г.
6. Fauci A.S., Braunwald E., Isselbacher K.J. et al., ed. Harrison’s Principles of Internal Medicine. 14th edition – Copyright (c) 1998 by The McGraw–Hill Companies, Inc., USA.
7. Herfindal Е.Т., Gourley D.R., ed. Textbook for therapeutics: drug and disease managment – 6th ed. – Copyright (c) 1996 Williams & Wilkins, Baltimore, USA.
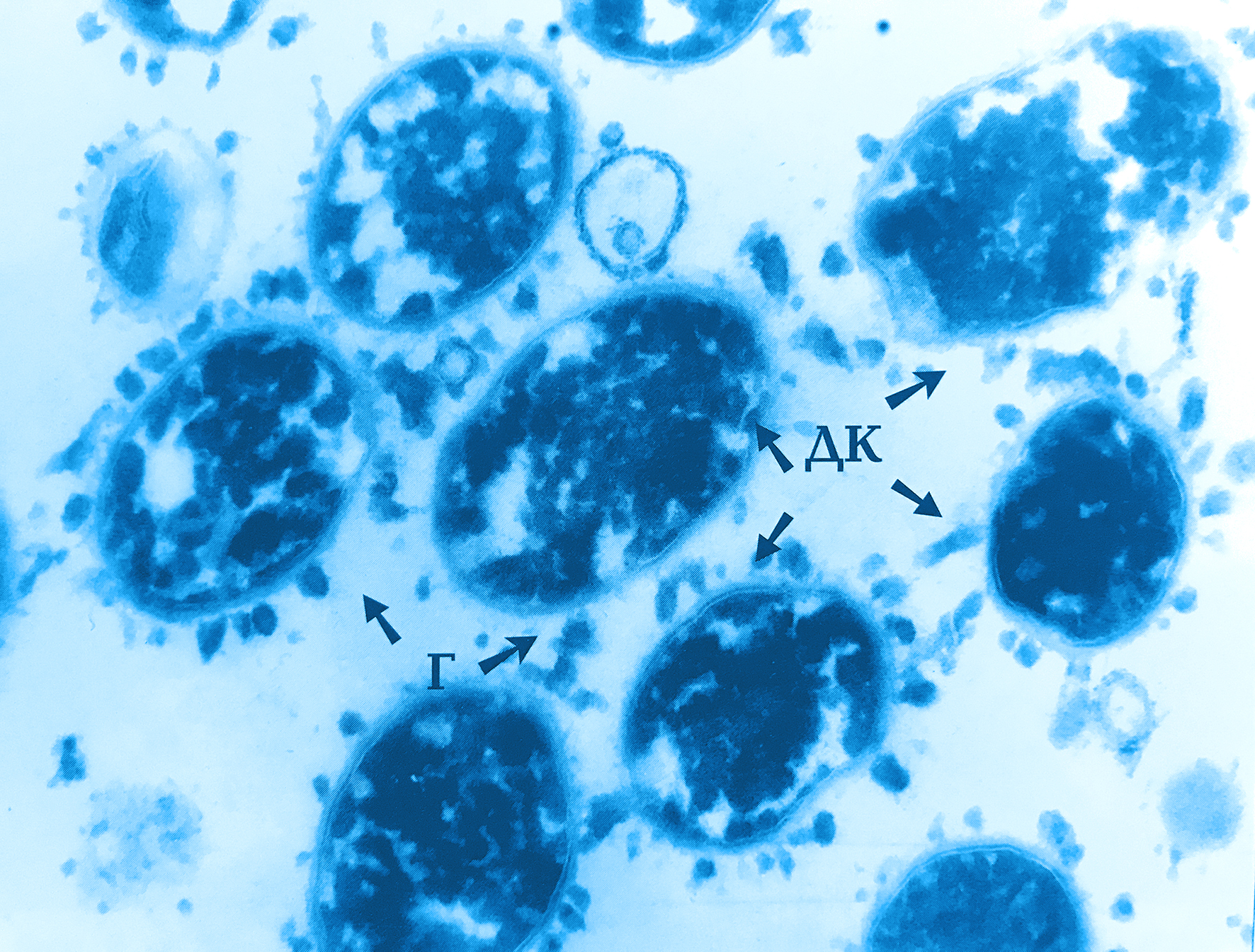
Бактероиды (Bacteroides) были впервые обнаружены в 1898 году учеными Вейоном и Зюбером (A. Veillon, H. Zuber). Микроорганизмы выделены у больного с абдоминальным абсцессом и получили название Bacillus fragilis. Спустя 14 лет Дистазо (A. Distaso) обнаружил их у здоровых людей, а через семь лет Кастеллани (A. Castellani) и Чалмерс (A. J. Chalmers) дали этим палочкам название Бактероиды.
Внешний вид под микроскопом
Бактероиды при микроскопии могут иметь разную форму. Преимущественно это небольшие палочки, не окрашивающиеся по Граму. У отдельных видов эти палочки не обособляются при размножении, в результате чего получаются скопления бактерий, напоминающие ветви. Иногда у бактероидов имеются в одном из концов утолщенные вакуоли, за счет чего клетка приобретает форму кеглей или булавы. Поэтому их легко спутать с коринебактериями или спорообразующими бактериями. Бактероиды имеют жгутики и способны к образованию капсулы, позволяющей переждать неблагоприятные для жизни условия.
Где обитает
В норме представители Bacteroides у человека колонизируют толстую кишку и являются типичными представителями нормофлоры, наряду с лакто- и бифидобактериями. В фекалиях здорового человека около 40-50% всех микробных клеток составляют бактероиды.
Классификация
Царство
Bacteria
Тип
Bacteroidetes
Класс
Bacteroidia
Порядок
Bacteroidales
Семейство
Bacteroidaceae
Род
Bacteroides
Prevotella
Свойства
Бактероиды способны утилизировать сахарозу, мальтозу, глюкозу, рамнозу. Продуцируют янтарную, изовалериановую, уксусную и масляную кислоту. Вырабатывают вещества, способные инактивировать антибиотики пенициллового и цефалоспоринового ряда. Для роста необходим углекислый газ в концентрации 5-10% и температурный диапазон от +25 до +45°С. Оптимальная температура +37°С.
Функции
Биологическая роль бактероидов в толстом кишечнике изучена недостаточно. Однако доказана их антагонистическая активность по отношению к сальмонеллам, шигеллам и некоторым патологическим эшерихиям. Можно предположить, что, колонизируя толстый кишечник, представители Bacteroides защищают своего хозяина от инфекционных энтероколитов, вызванных патогенными микроорганизмами.
Вызываемые заболевания
В условиях нарушения иммунитета бактероиды проявляют свою патогенную активность. Они не вырабатывают эндотоксичные вещества, но, поскольку имеют полисахаридную капсулу, могут спровоцировать выработку антител в организме хозяина. В ассоциации с другими патогенными и условно-патогенными бактериями, Bacteroides способны вызывать перитонит, кольпит, пневмонию, пародонтоз, абсцессы, аппендицит, эндокардиты, заболевания слизистых оболочек и кожи.
Профилактика и лечение
Для подавления роста и размножения бактероидов используются антибиотики, в частности, ципрофлоксацин, офлоксацин, метронидазол, клиндамицин, левомицитин. Общеукрепляющие процедуры и элементарная гигиена, защита от стрессов и нормализация пищевого поведения (отказ от голодания и переедания), а также сбалансированный рацион питания способствуют защите от чрезмерного размножения бактероидов.

Систематика грамвариабельной бактерии гемеллы
Раньше гемелла входила в род стрептококков, но после тщательного изучения, ее вывели в Bacillales Family XI. Incertae Sedis.
Бактерии анаэробны, способны давать отрицательную реакцию на разные виды окрашиваний. Гемеллы обладают способностью ферментировать, производить кислоты.
К роду гемелла относят следующие микроорганизмы:
- Asaccharolytica;
- Bergeri;
- Haemolysans;
- Cuniculi;
- Haemolysans;
- Morbillorum;
- Parahaemolysans;
- Palaticanis;
- Sanguinis;
Гемелла встречается в ротовой полости, в верхних отделах пищеварительной системы у людей и у животных. Разновидность haemolysans способна вызывать легочные патологии у людей, страдающих пороками сердца, после стоматологических вмешательств. Для подавления колоний бактерий, применяют гентамицин и пенициллиновый ряд антибактериальных препаратов. При обнаружении гемеллы во влагалище, велика вероятность заражения ВИЧ-инфекции.
В некоторых случаях гемелла обнаруживается в желудке, но только при условии отсутствия большого количества хеликобактери пиллори.
Строение и размножение бактерии гемелла
Бактерии Gemella попадают во внешнюю среду с дыханием человека, животного. Этот вид имеет продолговатый сферический вид. Чаще всего они располагаются в парах. Соприкасающиеся стороны имеют уплощение. Как правило, в паре одна гамелла крупнее другой.
Стенка бактерии дает грамположительный окрас, а по Граму — вариабельна. Бактерии можно культивировать на кровяном агаре, МПА, где образуется росинчатые маленькие колонии. На молочном и капустном субстрате растут медленно. Бактерии способны вызывать гемолиз.
Некоторые представители рода колонизируют на растениях. Они могут сбраживать молоко, из-за чего применяются в пищевой промышленности совместно с другими видами микроорганизмов (например, для получения сыров, квашенной капусты). Микробактерии размером до 1.2 мкм окружены капсулой. При средней температуре 25 градусов хорошо размножаются.
При выявлении гемеллы в организме человека, применяют антибактериальные препараты пенициллинового ряда.

В 1885 году английский ветеринар Дениел Салмон обнаружил сальмонеллу, а в 1887 году Киёси Сига (первоначально его фамилия в транскрипции читали как Шига) обнаружил возбудителя дизентерии — шигеллу, одновременно с русским исследователем Алексеем Григорьевым.
Внешний вид под микроскопом
Энтеробактерии — не окрашивающиеся по методу Грама палочковидные бактерии, не образующие спор и скоплений в виде цепочек. Многие роды имеют жгутики для передвижения. Форма и размеры клеток варьируют: они могут быть прямыми и изогнутыми, длиной от 1 до 5 мкм.
Где обитает
В человеческом организме энтеробактерии, в частности, Эшерихия коли (кишечная палочка) населяют кишечник человека, животных и птиц. Для патогенных микроорганизмов этого класса местом обитания могут стать легкие и дыхательные пути, суставы, носовые и лобные пазухи, мочевой пузырь, почки и даже лимфоузлы.
Классификация
Царство
Bacteria
Тип
Proteobacteria
Класс
Gammaproteobacteria
Порядок
Enterobacteriales
Семейство
Enterobacteriaceae
Свойства
Энтеробактерии — грамотрицательные палочки, относящиеся к факультативным анаэробам. Для биохимического определения часто используется способность к усваиванию сахаров — глюкозы и лактозы.
В процессе расщепления глюкозы они могут образовывать углекислый газ, что также является одним из признаков, помогающих в определении не только рода, но и группы. Например, патогенные эшерихии в большинстве случаев не выделяют СО2, так же, как и шигеллы. Бактерии рода Протей и Сальмонелла продуцируют сероводород. Некоторые энтеробактерии продуцируют индол.
Оптимальная температура для развития энтеробактерий — 32-37°С. В то же время иерсинии, например, могут размножаться и при +5°С.
Функции
Эшерихия коли, то есть кишечная палочка, имеет множество серогрупп, часть из которых патогенна, другая является нормальным представителем флоры кишечника, преимущественно толстой кишки. Здесь они являются одним из компонентов иммунной системы, поскольку образуют налет на слизистой, препятствующий колонизации этой части пищеварительного тракта патогенными бактериями. Кроме того, кишечная палочка продуцирует витамины группы К.
Заболевания
Самые распространенные болезни — энтерит, колит, дизентерия, острое пищевое отравление Реже — воспаления различных органов, гнойные инфекции кожи и слизистых. Иерсиния пестис вызывает бубонную и легочную чуму.
Лечение
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Бактериальный вагиноз: причины появления, симптомы, диагностика и способы лечения.
Определение
Бактериальный вагиноз — это инфекционное полимикробное заболевание, связанное с изменением микрофлоры влагалища, при котором происходит значимое уменьшение количества или полное исчезновение палочек Додерлейна (лактобактерий) и их замещение факультативными анаэробными микроорганизмами и/или возбудителем гарднереллеза. Увеличение уровня лейкоцитов в вагинальном отделяемом и признаки воспаления стенок влагалища могут отсутствовать.
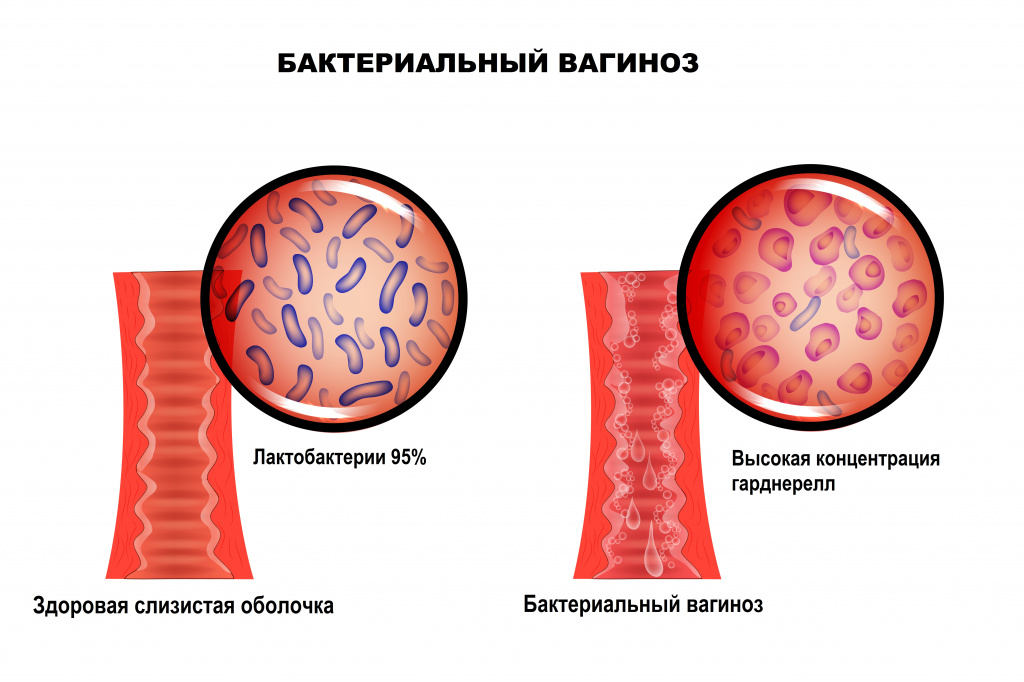
Отличительной особенностью заболевания является отсутствие какого-либо одного конкретного возбудителя. Микрофлора, приходящая на смену лактобактериям, может быть различной и чаще всего представлена условно-патогенными бактериями. Кислотность среды влагалища смещается в сторону ощелачивания. При нарушении экосистемы влагалища формируется хорошо структурированная полимикробная пленка (биопленка - форма микробных сообществ), покрывающая вагинальный эпителий и состоящая из анаэробных бактерий, что приводит к рецидивирующему течению бактериального вагиноза. В биопленках бактерии защищены от компонентов врожденного и приобретенного иммунитета.
В норме ведущее место (95%) в вагинальном микробиоценозе занимают палочки Додерлейна, продуцирующие перекись водорода и молочную кислоту.
Они поддерживают постоянство богатой кислородом кислой рН-среды и играют роль местных факторов защиты. В случае нарушения защитных механизмов патогенные или условно-патогенные микроорганизмы транзиторной или факультативной флоры прикрепляются к клеткам влагалищного эпителия с последующим размножением и повреждением тканей.
Бактериальный вагиноз является наиболее частой причиной патологических вагинальных выделений у женщин репродуктивного возраста, однако иногда он может наблюдаться и у девочек до менархе, и у женщин в период менопаузы.
Причины появления бактериального вагиноза
Предрасполагающие факторы, ведущие к развитию бактериального вагиноза:
- использование антибактериальных препаратов;
- длительное применение внутриматочных контрацептивов;
- ношение синтетического нижнего белья, злоупотребление прокладками на каждый день и тампонами, которые препятствуют проникновению кислорода;
- длительный прием антибиотиков;
- хронические заболевания кишечника и другие состояния, вызывающие дисбактериоз;
- использование пероральных контрацептивов;
- перенесенные ранее воспалительные заболевания урогенитального тракта;
- нарушение гормонального статуса, сопровождающееся нарушением менструального цикла, преимущественно по типу олигоменореи или аменореи;
- атрофия слизистой оболочки влагалища;
- снижение иммунитета;
- воздействие малых доз ионизирующего излучения;
- стрессовые воздействия на организм.
Классификация бактериального вагиноза на основании микроскопического исследования:
- Компенсированный бактериальный вагиноз — количество лактобактерий снижено, что является фактором риска заселения влагалища патогенными микроорганизмами.
- Субкомпенсированный — низкий уровень лактобактерий и растущее число условно-патогенных микроорганизмов.
- Декомпенсированный — в мазке выявляются условно-патогенные микроорганизмы, лактобактерии отсутствуют, выражены клинические симптомы бактериального вагиноза.
У большинства женщин бактериальный вагиноз протекает бессимптомно и может быть обнаружен случайно во время рутинного осмотра и взятия мазка.
Интенсивный рост факультативной флоры, образование патологических биопленок сопровождается появлением влагалищных выделений с характерным неприятным запахом.
Хронический бактериальный вагиноз — это непрерывное течение заболевания более 2-х месяцев, несмотря на проводимое лечение. Как правило, он сочетается с нарушением гормонального фона и атрофией слизистой оболочки влагалища.
Диагностика бактериального вагиноза
При постановке диагноза у врача есть четыре критерия, которыми он пользуется. Наличие у пациентки трех из них говорит в пользу бактериального вагиноза.
Микроскопическое (бактериоскопическое) исследование мазка, окрашенного по Граму. Материалом для оценки состояния флоры влагалища служат гинекологические мазки (отделяемое наружных половых органов, уретры, влагалища, шейки матки, полости матки).
Читайте также:

