Бактисубтил для профилактики кишечной инфекции
Обновлено: 15.04.2024
Роза Исмаиловна Ягудина, д. фарм. н., проф., зав. кафедрой организации лекарственного обеспечения и фармакоэкономики и зав. лабораторией фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
Евгения Евгеньевна Аринина, к. м. н., ведущий научный сотрудник лаборатории фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
С наступившим летом тема нашей статьи приобрела особую актуальность. Кишечные инфекции — это целая группа инфекционных заболеваний, поражающих в основном желудочно-кишечный тракт. Острые кишечные инфекции по своей распространенности уступают только острым респираторным заболеваниям. Пик заболеваемости обычно приходится на лето, но и в холодное время года часто встречаются кишечные инфекции, вызываемые преимущественно вирусами. Однако наиболее частая причина возникновения этих заболеваний — попадание возбудителей инфекции с загрязненными продуктами и водой в желудочно-кишечный тракт.
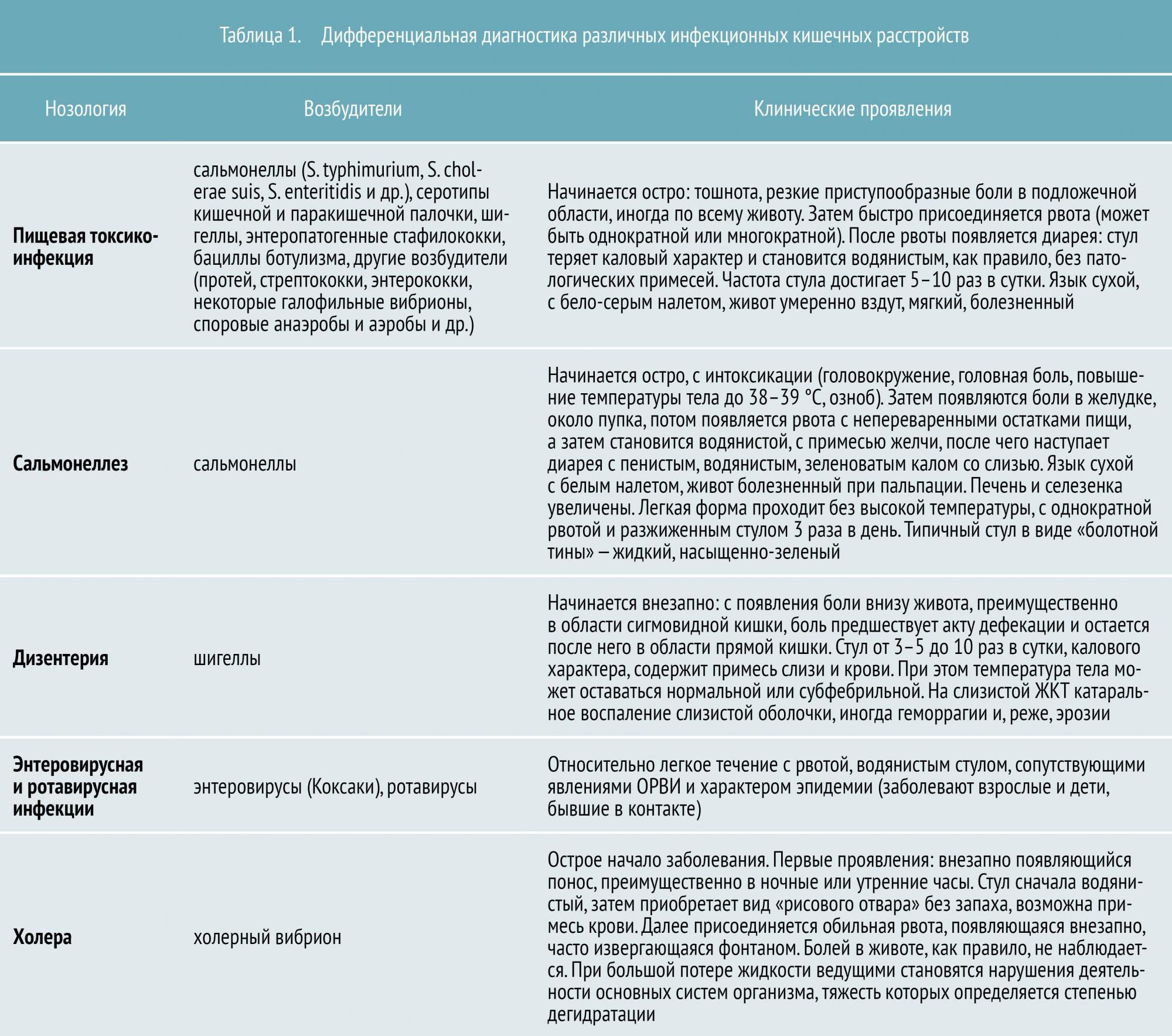
Всего в настоящее время известно около 30 инфекционных кишечных заболеваний. К наиболее распространенным относятся:
- пищевая токсикоинфекция (в основном стафилококковой этиологии)
- сальмонеллез
- дизентерия
- энтеровирусная и ротавирусная инфекция
- холера
Осложнения кишечных инфекций:
- бактериальные инфекции органов дыхания и среднего уха
- дисбактериоз кишечника
- кишечное кровотечение
- перфорация стенки кишки
- инвагинация кишечника
- бактериально-токсический шок
Возбудители кишечной инфекции
Помимо инфекционных агентов из естественной среды источником заражения может стать уже заболевший человек. Выделяя большое количество патогенных микроорганизмов (микробы выделяются с испражнениями, рвотными массами, иногда с мочой), больной заражает предметы, находящиеся вокруг, и, если не соблюдать меры предосторожности, может возникнуть цепная реакция в распространении инфекции.
Практически все возбудители кишечных инфекций чрезвычайно живучи. Они способы подолгу существовать в почве, воде и на различных предметах (ложках, тарелках, дверных ручках и мебели). Инфекционные микроорганизмы во внешней среде не только не погибают, но и сохраняют способность к размножению, а размножаются они наиболее активно в теплых и влажных условиях. Однако самая благоприятная среда для развития бактерий — это кисломолочные и мясные продукты.
Установлена связь отдельных форм острых кишечных инфекций с видами пищи. Так, дизентерия чаще возникает при употреблении молока и молочных продуктов, а кишечные инфекции, вызванные стафилококком, — при употреблении молочных продуктов и кондитерских изделий с кремом. Иерсиниозы обычно развиваются при употреблении сырых овощей, салатов и другой растительной пищи.
Возбудителями кишечных инфекций могут быть как бактерии (сальмонеллы, шигеллы, иерсинии, энтеропатогенные кишечные палочки, стафилококки), так и их токсины (пищевые токсикоинфекции). Вирусы (ротавирусы, энтеровирусы, астровирусы, парвовирусы) пока на втором месте по частоте встречаемости, однако в последнее время вирусные инфекции получают всё более широкое распространение. И на последнем месте — простейшие (лямблии, амебы, бластоцисты).
После попадания патогенов в организм человека, как правило, проходит бессимптомный инкубационный период, который продолжается от 6 до 48 часов — от попадания микроорганизмов в ротовую полость до момента поступления их в кишечник, где происходит их бурное размножение. После того как патогенные микроорганизмы размножились, начинается стадия клинических проявлений.
N. B.! При появлении симптомов, напоминающих острую кишечную инфекцию, необходимо срочно обратиться к инфекционисту для правильного подбора терапии и профилактики осложнений.
Наступает острый период — от 1 до 14 дней, в это время клинические проявления со стороны ЖКТ выражены максимально. Как правило, период заканчивается, когда нормализуется температура и прекращается ведущий симптом (понос или рвота).
Период реконвалесценции — не менее 2 недель, а в некоторых случаях при отсутствии лечения до нескольких лет. В этот период функция желудочно-кишечного тракта, как правило, восстанавливается не полностью — может быть неустойчивый стул.
В основном все кишечные инфекции протекают с достаточно похожими симптомами. Они всегда начинаются внезапно. В самом начале заболевания появляется резкая слабость, вялость, снижение аппетита, головная боль, повышение температуры — неспецифические симптомы, которые могут напоминать симптомы респираторных вирусных инфекций. Однако вскоре возникают тошнота, рвота, схваткообразные боли в животе, понос с примесью слизи, гноя или крови (например, при дизентерии), также могут беспокоить жажда и озноб. Среди клинических проявлений со стороны желудочно-кишечного тракта, как правило, сильнее всего выражены симптомы, связанные с пораженным органом:
- тошнота, рвота и боли в эпигастральной области (при гастрите);
- понос (при энтерите);
- рвота и понос (при гастроэнтерите);
- кровь в стуле и его нарушения (при колите);
- поражения всего кишечника (при энтероколите).
Одно из самых неблагоприятных последствий кишечной инфекции — это дегидратация организма из‑за рвоты и/или поноса и, как следствие, нарушение водно-электролитного обмена. Результатом резкой дегидратации может стать даже шок.
Однако иногда кишечные инфекции могут не иметь видимых симптомов, но сопровождаются выделением возбудителей. В плане распространения инфекции такое носительство наиболее опасно: ничего не подозревающий человек становится постоянным источником инфекции, заражая окружающих.
Врачу важно провести дифференциальную диагностику между кишечной инфекцией и соматическими заболеваниями со сходными симптомами: диареей, связанной с приемом лекарственных препаратов, острым аппендицитом, инфарктом миокарда, пневмонией, внематочной беременностью и т. д.
Диагностика и лечение кишечной инфекции
- Выделение из крови возбудителя и его антигенов (токсинов)
- Бактериологическое исследование: выделение и типирование возбудителя в посевах кала, других биологических секретов и экскретов организма больного
- Вирусологическое исследование: выделение вируса из кала в посевах на культуре клеток или при электронной микроскопии
- Микроскопическое исследование: обнаружение паразитов в мазках нативного кала после обработки специальными красителями
- Выявление сывороточных антител к антигенам возбудителя и роста их титра: серологическое обследование с использованием специальных диагностикумов в реакциях (РПГА, РИГА, ИФА и т. п.); прирост титра в 4 раза.
Основные принципы терапии кишечных инфекций:
- борьба с возбудителем (антибактериальная терапия);
- борьба с обезвоживанием (как правило, для устранения недостатка жидкости пациентам назначают солевые растворы);
- устранение диареи (энтеросорбенты);
- соблюдение щадящей диеты (исключение свежих овощей и фруктов, молочных продуктов, сладкого).
Во время болезни необходимо соблюдать диету, помогающую замедлить перистальтику кишечника. Рекомендуются продукты с высоким содержанием танина (черника, черемуха, крепкий чай); вещества вязкой консистенции (слизистые супы, протертые каши, кисели); сухари; индифферентные вещества — паровые блюда из нежирного мяса и рыбы. Важный этап в лечении кишечных инфекций — исключение из рациона жареных и жирных блюд, сырых овощей и фруктов.
Главное направление лечебной тактики — нейтрализация экзотоксинов в кишечнике (энтеросорбенты) и регидратация — компенсация патологических потерь жидкости и электролитов специально разработанными глюкозо-солевыми растворами. Объем вводимых растворов зависит от степени обезвоживания и массы тела больного, а скорость введения составляет 1–1,5 л/ч. Дезинтоксикационная и регидратационная терапия в 85–95 % случаев может осуществляться перорально.
Антибиотики может назначить только инфекционист с учетом проведенных лабораторных тестов и выявленного возбудителя инфекции. Однако при выраженной диарее для ускоренной санации обоснованным является назначение антибактериальных ЛС, которые не всасываются или плохо всасываются из кишечника и обладают широким спектром действия (например, энтерофурил или ко-тримоксазол). Эффективными средствами альтернативной этиотропной терапии, в качестве препаратов от острой кишечной инфекции, являются энтеросорбенты и пробиотики. Этиотропное действие пробиотиков связано с выраженной антагонистической активностью в отношении всех возбудителей острых кишечных инфекций (ОКИ) бактериальной этиологии и опосредованным иммуномодулирующим действием на местное звено иммунитета.
Обзор лекарств для лечения кишечных инфекций
Нифуроксазид (энтерофурил)
Безрецептурное противомикробное средство широкого спектра действия, производное 5‑нитрофурана. Антимикробная активность нифуроксазида вызвана наличием в его составе NO2‑группы, которая угнетает активность дегидрогеназы и нарушает синтез белков в патогенных бактериях.
Нифуроксазид не оказывает действия на сапрофитную флору, не нарушает равновесия нормальной кишечной флоры. При острой бактериальной диарее восстанавливает эубиоз кишечника. При инфицировании энтеротропными вирусами препятствует развитию бактериальной суперинфекции. Этот препарат для лечения кишечной инфекции можно назначать беременным и кормящим женщинам, детям начиная с одного месяца. Терапия нифуроксазидом не должна превышать 7 дней, при этом запрещено употреблять алкоголь.
Безрецептурный препарат в форме вагинальных и ректальных суппозиториев. Обладает иммуномодулирующим, противовирусным, антихламидийным действием. Кипферон — комплексная лекарственная форма, содержащая человеческий рекомбинантный интерферон-α2 и комплексный иммуноглобулиновый препарат (КИП). Разрешен к применению у детей на первом году жизни.
Ко-тримоксазол (сульфаметоксазол + триметоприм)
Механизм действия ко-тримоксазол а обусловлен двойным блокированием метаболизма микроорганизмов. Триметоприм обратимо ингибирует дигидрофолатредуктазу микроорганизмов, нарушает образование из дигидрофолиевой кислоты тетрагидрофолиевой, продукцию нуклеиновых кислот, пиримидиновых и пуриновых оснований; подавляет размножение и рост бактерий. Сульфаметоксазол, который по строению схож с парааминобензойной кислотой, захватывается бактерией и препятствует включению парааминобензойной кислоты в дигидрофолиевую кислоту. В связи с тем что ко-тримоксазол угнетает жизнедеятельность кишечной палочки, снижается образование в кишечнике никотиновой кислоты, рибофлавина, тиамина и прочих витаминов B-комплекса. Это лекарство, помогающее от кишечной инфекции, отпускается по рецепту, применяется с 2‑месячного возраста.
Бактисубтил — споры бактерий Bacillus cereus IP. Рецептурный препарат от кишечной инфекции бактисубтил сохраняет и корригирует физиологическое равновесие кишечной флоры. Споры бактерий, содержащиеся в препарате, устойчивы к действию желудочного сока. Прорастание бактерий в вегетативные формы происходит в кишечнике, затем они высвобождают энзимы, которые расщепляют углеводы, жиры, белки. В результате образуется кислая среда, предотвращающая процессы гниения. Препарат препятствует нарушению синтеза витаминов группы В и Р в кишечнике, его нельзя запивать горячим, а также сочетать с алкоголем. Детям его назначают с семилетнего возраста. Бактисубтил резистентен к действию различных антибиотиков и сульфаниламидных препаратов, поэтому может быть назначен одновременно с ними.
Декстроза + калия хлорид + натрия хлорид + натрия цитрат (регидрон)
Регидратирующее средство для перорального приема восстанавливает водно-электролитное равновесие, нарушенное при обезвоживании организма; корректирует ацидоз. Содержимое одного пакетика растворяют в литре свежепрокипяченной охлажденной питьевой воды. Приготовленный раствор нужно хранить в холодильнике и использовать в течение 24 часов. В раствор нельзя добавлять никакие другие компоненты, чтобы не нарушить действие препарата. Отпускается без рецепта.
Безрецептурное лекарственное средство природного происхождения, обладающее протективным действием в отношении слизистой оболочки кишечника и выраженными адсорбирующими свойствами. Являясь стабилизатором слизистого барьера, образует поливалентные связи с гликопротеинами слизи и увеличивает продолжительность ее жизни, образуя физический барьер, который защищает слизистую оболочку пищеварительного тракта от отрицательного действия ионов Н+, соляной кислоты, желчных солей, микроорганизмов, их токсинов и других раздражителей. Обладает селективными сорбционными свойствами, защищает слизистую оболочку пищеварительного тракта от отрицательного воздействия. В терапевтических дозах не влияет на моторику кишечника.
Профилактика кишечных инфекций, в том числе и острых
Для профилактики кишечных инфекций важно регулярно мыть руки и проводить влажную уборку в квартире. Лучше сразу же выкидывать продукты с истекшим сроком годности, не покупать их в местах с непонятными условиями хранения — как бы ни были привлекательны, скажем, грибочки у бабушки возле метро — а фрукты и овощи есть только тщательно вымытыми.
Избежать распространения болезни поможет ранняя диагностика и изоляция больного с кишечной инфекцией. В очаге инфекции нужно обработать поверхности дезинфицирующими растворами, прокипятить посуду. Выписку пациентов проводят только после отрицательного результата контрольного обследования кала. Всем, кто перенес кишечную инфекцию, в течение месяца необходимо регулярно проходить диспансерное наблюдение в поликлинике.
Проблема острых кишечных инфекций является одной из актуальнейших в отечественном здравоохранении. С одной стороны, уровень заболеваемости остается достаточно высоким, без тенденции к отчетливому снижению, с другой – отмечается появление сероваров, обусловливающих тяжелое течение болезни (S. flexneri 2a, энтерогеморрагическая эшерихия OI57 и др.). Кроме того, получают широкое распространение кишечные инфекции, которые прежде не диагностировались или встречались редко (ротавирусный гастроэнтерит, клебсиеллез и др.).
К сожалению, в лечении острых кишечных инфекций допускается много ошибок, порожденных недостаточной квалификацией специалистов; отжившими догматическими представлениями о сущности патологического процесса; погоней за рекламой суперсовременных лекарственных средств; непониманием сущности регидратационной терапии, прежде всего оральной.
Крайне важно, чтобы практические врачи осознали все опасности, возникающие при развитии кишечного дисбактериоза в случае бесцельного, а порой бесконтрольного применения антибиотиков, особенно при лечении сальмонеллеза и пищевых токсикоинфекций. В лечении острых кишечных инфекций появились новые подходы, основной акцент делается на патогенетическую терапию.
Одной из целей патогенетической терапии острых кишечных инфекций является купирование диарейного синдрома. Предложено множество антидиарейных препаратов, при использовании которых должны учитываться патогенетические особенности указанного синдрома.
Известно, что циклические нуклеотиды способствуют регуляции секреции воды и электролитов в кишечнике. По современным представлениям эндотоксины сальмонелл воздействуют на аденилатциклазу, находящуюся на наружной поверхности мембран энтероцитов. В результате активации аденилатциклазы усиливается образование циклического аденозинмонофосфата (цАМФ). Изменения мембранных белков и биполяризация клеток мембран способствуют повышению проницаемости последних для воды и электролитов, что ведет к диарее. Определенная роль в изменении проницаемости клеточных мембран принадлежит простагландинам, функционально связанным с циклическими нуклеотидами, что приводит к повышенному образованию цАМФ и развитию диареи. Таким образом, избыток гуморального регулятора обмена может стать фактором патогенеза болезни. В связи с этим было предложено использовать индометацин при диарейном синдроме в качестве ингибитора биосинтеза простагландинов.
Рекомендуется так же применение карболонга – порошка из активированных косточковых углей. Он обладает высокими сорбционными свойствами. Его назначают по 5–10 г на прием 3 раза в день.
Одним из эффективных сорбентов является полифепан. Препарат получают при переработке лигнина – продукта гидролиза углеводных компонентов древесины. Выпускается в виде гранул (содержит 40% полифепана) или пасты (50% полифепана). Назначают внутрь взрослым по 1 столовой ложке 3–4 раза в день; перед употреблением препарат тщательно размешивают в течение 2 мин в стакане воды.
Наиболее эффективным сорбентом является диосмектит. Кроме того, диосмектит обладает значительной обволакивающей способностью. Известна способность диосмектита защищать эпителий кишечных ворсинок от разрушения. Препарат выпускается в виде порошка в пакетах, содержащих 3 г лекарственного средства. Содержимое пакета растворяют в 100 мл воды и размешивают. Взрослому рекомендуют принимать 3–4 пакета (9–12 г) в день. Препарат не имеет противопоказаний к применению, его можно назначать беременным и кормящим матерям. При тяжелом течении сахарного диабета применение диосмектита опасно, так как в 1 пакетике содержится 0,75 г глюкозы.
К группе сорбентов относится аттапульгит. Препарат выпускается в таблетках. Начальная доза для взрослого – 2 таблетки, затем назначают по 2 таблетки после каждого акта дефекации. Максимальная суточная доза – 12 таблеток, максимальная продолжительность лечения 2 дня.
Другой группой антидиарейных препаратов являются лекарственные средства, оказывающие опиоидное действие. К ним относят лоперамид и тримебутан. Способность тормозить перистальтику кишечника является характерной особенностью опиатов. Действие лоперамида наступает быстро и продолжается 4–6 ч. Его назначают взрослым при острой диарее, вначале 2 капсулы, а затем по 1 капсуле после каждого акта дефекации, но не более 6 капсул в сутки. Не рекомендуется применение препарата вместе с атропинсодержащими средствами. Лоперамид противопоказан беременным и кормящим грудью женщинам, а также больным неспецифическим язвенным колитом. Группа атропинсодержаших антидиарейных препаратов представлена двумя лекарственными средствами – лиспафеном и реасеком.
Лиспафен уменьшает секрецию желез, понижает тонус гладкой мускулатуры и двигательную активность желудка и кишечника. Взрослым назначают по 2 таблетки 3 раза в день, максимальная суточная доза – 12 таблеток. Реасек назначают по 1 таблетке 2–3 раза в день. К указанной группе препаратов относится тримебутин малеат. В 1 таблетке содержится 100 мг препарата. Тримебутан оказывает положительное действие на регуляцию перистальтики кишечника. При гиперкинетическом состоянии он оказывает спазмолитическое, при гипокинетическом – стимулирующее действие. Воздействует на гладкую мускулатуру всего желудочно–кишечного тракта. Лечебный эффект основан на нормализации моторики кишки, применяется по 1–2 таблетки 3 раза в день. Противопоказан беременным и кормящим грудью женщинам.
В группу лекарственных средств, обладающих обволакивающим и вяжущим свойствами, входит порошок Кассирского и десмол. Антидиарейный порошок (состав: Bismuti subnitrici 0,5; Dermatoli 0,3; Calcii carbonici I 0; Ac. ascorbinici 0,3; Ac. nicotinici 0,01) назначают по 1 порошку 3–4 раза в день.
В отдельных случаях тяжелого течения диареи используются большие дозы висмута – по 2 г 3 раза в сутки. В последние годы для лечения острых диарейных заболеваний успешно применяют висмута субсалицилат, одна таблетка препарата содержит 262 мг активного вещества. Препарат принимают по 2 таблетки 3–4 раза в день. Он оказывает обволакивающее и противовоспалительное действие, повышает выработку слизи и улучшает ее защитные свойства. Наш опыт применения висмута субсалицилата подтверждает эффективность препарата.
Новым средством для лечения диареи, оказывающим патогенетическое воздействие на процессы всасывания и секрецию в кишечнике, является октреотид. Этот гормон увеличивает скорость всасывания воды и электролитов в тонкой кишке, снижает концентрацию вазоактивных пептидов в крови, уменьшает частоту актов дефекации и массу кала. Выпускается в виде свободного пептида – оректида в ампулах, содержащих 0,05, 0,1 и 0,5 мг. Вводится подкожно 1–2 раза в сутки; при необходимости дозу препарата увеличивают.
Проблема дисбактериоза и эубиотики
Острые кишечные инфекции сопровождаются развитием дисбактериоза, либо это состояние развивается после применения антибиотиков. Лечение больных, страдающих кишечным дисбактериозом, требует комплекса терапевтических мер и индивидуально подобранных препаратов с учетом заболевания, на фоне которого возник дисбактериоз. В комплекс терапии дисбактериоза кишечника необходимо включать средства для нормализации кишечной флоры и курс лечения антибактериальными препаратами при появлении патогенной флоры.
Схема лечения дисбактериоза с учетом стадии заболевания:
I стадия – назначение биопрепаратов и лекарств, нормализующих моторную функцию кишечника (спазмолитики, вяжущие, ферменты), а также витаминов и противоаллергических средств;
II стадия –тактика такая же, как в I стадии, но добавляется колибактерин. При отсутствии эффекта через 3–4 недели назначают невиграмон или нитроксалин;
Ill–IV стадии –назначение поливалентного бактериофага, после отмены которого используют ко–тримоксазол (часто в сочетании с метронидазолом); при отсутствии эффекта назначают антибиотики. Одновременно с антибиотиками применяют биопрепараты.
Нормализация кишечной флоры осуществляется эубиотиками. Различают четыре поколения эубиотиков, применяемых для лечения дисбактериоза: I – классические эубиотики (коли–бактерин, бифидумбактерин, лактобактерин); II – самоэлиминирующиеся эубиотики (бактисубтил, биоспорин, споробактерин); III – комбинированные эубиотики (Аципол и др.); IV поколение – иммобилизованные на сорбенте живые бактерии, представители нормальной микрофлоры – бифидумбактерин форте.
Эффективность эубиотиков определяется биологическими свойствами штаммов микроорганизмов: колонизирующей способностью, антимикробной активностью, особенностью воздействия на иммунную систему и другие защитные механизмы [5].
Аципол – эубиотик III поколения, представляющий собой биомассу, состоящую из смеси живых антагонистических активных штаммов ацидофильных лактобацилл и инактивированных прогреванием кефирных грибков. Препарат оказывает многофакторное лечебное действие, отличается высокой активностью в отношении патогенной и условно–патогенной флоры, корригирует нормальную микрофлору кишечника, повышает иммунологическую резистентность организма. Аципол принимают по 1 таблетке 3 раза в сутки вместе с пищей.
Эубиотики обычно назначают в сочетании с ферментами (абомин, ораза, фестал и др.) и антигистаминными препаратами (пипольфен, хлоропирамин, клемастин).
При стафилококковом дисбактериозе лечение обязательно должно включать применение стафилококкового бактериофага. В тяжелых случаях целесообразно назначать антибиотики (оксациллин, цефалоспорины I и II поколений, карбопенемы, ванкомицин, рифампицин) и фторхинолоны.
При протейном дисбактериозе используют поливалентный бактериофаг (протейный, стафилококковый, синегнойный), в тяжелых случаях – антибиотики (ампициллин, карбенициллин, цефалоспорины I и II поколений), в более легких – ко–тримоксазол–480 и полимиксин М.
При синегнойном дисбактериозе используют полимиксин В, тетрациклин, рифампицин, лонгацеф.
В случаях энтеробактериального или бактериоидного дисбактериоза целесообразно применение цефалексина или цефадина, при клостридиозе – метронидазола и ко–тримоксазол–480.
При дисбактериозе эшерихиозной этиологии рекомендуются препараты висмута, а при заболеваниях, обусловленных гемолитическими штаммами – лактобактерин. Антибактериальная терапия осуществляется невиграмоном, нитроксалином, ко–тримоксазолом–480, энтероседивом. Иногда дает эффект коли–бактериофаг.
Для борьбы с дисбактериозом кишечника рекомендуют применение нормазе. Этот препарат представляет собой раствор лактулозы (дисахарид) из молекул галактозы и фруктозы. Способность лактулозы стимулировать рост лактобацилл в толстой кишке, в то же время снижая концентрацию гнилостных бактерий, позволяет восстановить нормальный биоценоз в кишечнике. Продукты метаболизма нормазе стимулируют перистальтику. Суточная доза нормазе для взрослых – 75 мл. Длительность лечения 2–3 недели.
В целях восстановления и профилактики нарушений микроэкологии кишечника в последние годы был предложен пищевой биококтейль (NK). Этот препарат по существу является эубиотиком. При острой диарее его рекомендуют принимать по 2–3 столовые ложки каждые 3–4 ч в течение 1–2 дней, а затем по 1–2 столовые ложки 3 раза в день в течение 1–3 месяцев. При иммунодефицитах, нарушениях обмена и длительной антибиотикотерапии принимают по 1 столовой ложке 2–3 раза в день в течение 1–3 месяцев. Эубиотики обычно назначают в сочетании с ферментами (абомин, ораза, фестал, дигестал, мезим и др.) и антигистаминными препаратами.
В последние годы широкую популярность приобрели ферментные препараты креон и панцитрат–10000. Каждая капсула креона содержит 300 мг панкреатина в микросферах, устойчивых к желудочному соку, что соответствует 8000 ед. липазы, 9000 ед. амилазы и 4500 ед. протеазы. Вначале принимают по 1–2 капсулы во время еды, а затем дневную дозу увеличивают до 3–15 капсул. Активным веществом панцитрата–10000 является панкреатин. Одна капсула препарата содержит 10000 ед. липазы, 9000 ед. амилазы и 500 ед. протеазы. Обычная дозировка препарата – по 2–4 капсулы во время каждого приема пищи.
Этиотропное лечение острых кишечных инфекций
Кишечные антисептики
В настоящее время применяются три препарата этой группы: интестопан, интетрикс и энтероседив.
В последние годы для лечения диарейных заболеваний предложен эрцефурил (нифураксазид), являющийся производным нитрофурана. Этот препарат действует преимущественно в просвете кишечника, показан при лечении диареи бактериального происхождения. По данным исследователей, он активен в отношении кампилобактерий, эшерихий (энтеротоксигенных, энтеропатогенных и энтероинвазивных), сальмонелл, шигелл, холерного вибриона и иерсиний (J. enterocolitica).
Популярным препаратом этой группы является фуразолидон. Препарат эффективен в отношении грамположительных и грамотрицательных бактерий, лямблий и трихомонад. Из числа возбудителей острых кишечных инфекций наиболее чувствительны к нему бактерии дизентерии, брюшного тифа, паратифов А и В. Устойчивость к нему микроорганизмов развивается медленно. Фуразолидон был рекомендован к применению в качестве препарата выбора для лечения острой дизентерии, так как он оказывает минимальное побочное действие на организм, особенно на желудочно–кишечный тракт.
Эффективность лечения острых кишечных инфекций вышеуказанными группами лекарственных средств различна. Терапия кишечными антисептиками всегда носит вспомогательный характер.
Антибиотики и другие антибактериальные препараты
Для лечения острых кишечных инфекций используются различные антибактериальные средства: 1) b–лактамные антибиотики: пенициллины природные, пенициллины полусинтетические, ингибиторы b–лактамаз, цефалоспорины I – IV поколений, карбапенемы, монобактамы; 2) антибиотики других классов: аминогликозиды, тетрациклины, макролиды, рифампицины, линкозамины, хлорамфеникол, полимиксины, гликопептиды; 3) синтетические антибактериальные средства: сульфаниламиды, хинолоны, фторхинолоны, нитрофураны, производные хиноксалина, производные 8–оксихинолина.
Учитывая, что в большинстве случаев острые кишечные инфекции вызываются грамотрицательными микроорганизмами, целесообразно привести перечень антибактериальных средств, действующих на них бактерицидно или бактериостатически: аминопенициллины, цефалоспорины, монобактамы, карбапенемы, аминогликозиды, тетрациклины, хлорамфеникол, полимиксины, хинолоны, фторхинолоны, нитрофураны, комбинированные препараты сульфамидов с триметопримом.
При неосложненном течении острых кишечных инфекций нешигеллезной и нехолерной этиологии лечение должно быть только патогенетическим. В тяжелых случаях особенно при наличии тяжелых фоновых и сопутствующих заболеваний, целесообразно использование кишечных антисептиков. К сожалению, до сегодняшнего дня антибиотики широко применяются для лечения острых кишечных инфекций, что способствует развитию дисбактериоза и более медленной репарации слизистой оболочки кишечника. Нет единства взглядов и на лечение сальмонеллеза. Наша точка зрения, основанная на многолетнем опыте лечения острых кишечных инфекций, заключается в том, что должна проводиться только патогенетическая терапия. Это относится и к гастроинтестинальной форме сальмонеллеза. Единственным исключением является генерализованная форма сальмонеллеза, при которой показана антибиотикотерапия. Мы также резко отрицательно относимся к использованию антибиотиков для лечения носительства при острых кишечных инфекциях.
Таким образом, лечение острых кишечных инфекций направлено на поддержание деятельности ряда функциональных систем, в том числе систем, обеспечивающих уровень АД, массу циркулирующей крови, поддержание оптимальных величин дыхательных показателей, уровня осмотического давления и системы выделения. Используя современные подходы в лечении острых кишечных инфекций, можно избежать развития таких грозных осложнений, как инфекционно–токсический шок, гиповолемический шок, острая почечная недостаточность. Аккуратность и рациональность в применении антибактериальной терапии позволяет избавить наших пациентов от дисбактериоза, адекватно проведенная пероральная регидротация в короткие сроки справляется с основными симптомами острых кишечных инфекций.
Форма выпуска, упаковка и состав препарата Бактисубтил ®
Капсулы твердые желатиновые, корпус и крышечка белого цвета; содержимое капсул - аморфный порошок бело-серого или бело-желтого цвета, со специфическим запахом.
| 1 капс. | |
| лиофильно высушенные споры Вacillus cereus IP 5832 | 35 мг |
Вспомогательные вещества: кальция карбонат - 25 мг, каолин - 100 мг.
Состав оболочки капсулы: титана диоксид (E171), желатин.
20 шт. - блистеры (1) - пачки картонные.
Фармакологическое действие
Эубиотик. Бактерии Bacillus cereus IP 5832 выделяют антибактериальные вещества широкого спектра действия, подавляющие развитие патогенных и условно патогенных бактерий, оказывающие противомикробное, противодиарейное действие, восстанавливает кишечную микрофлору. Споры бактерий, содержащиеся в препарате, устойчивы к действию желудочного сока. Их прорастание в вегетативные формы бактерий происходит в кишечнике.
Фармакокинетика
Показания препарата Бактисубтил ®
- лечение острой и хронической диареи различного генеза;
- лечение колитов, энтероколитов;
- профилактика и лечение дисбактериозов кишечника (в т.ч. развившихся в результате антибиотико- или химио-, или радиотерапии).
| Код МКБ-10 | Показание |
| A09 | Другой гастроэнтерит и колит инфекционного и неуточненного происхождения |
| K52 | Другие неинфекционные гастроэнтериты и колиты |
| K59.1 | Функциональная диарея |
| K63.8 | Другие уточненные болезни кишечника |
| Y40 | Антибиотики системного действия |
| Y43.1 | Противоопухолевые антиметаболиты |
| Y43.3 | Другие противоопухолевые препараты |
| Y84.2 | Радиологическая процедура и лучевая терапия |
Режим дозирования
Бактисубтил ® назначают детям старше 7 лет и взрослым.
Детям старше 7 лет назначают по 1-2 капсулы 2-3 раза/сут в течение 7-10 сут.
Подросткам и взрослым назначают по 2 капсулы 2-4 раза/сут в течение 7-10 сут.
Бактисубтил ® следует принимать за 1 ч до еды.
Нельзя запивать Бактисубтил ® горячей жидкостью или принимать его с алкогольными напитками.
Побочное действие
При применении препарата в соответствии с рекомендуемым режимом дозирования побочные эффекты не установлены.
Противопоказания к применению
- первичные иммунодефициты;
- повышенная чувствительность к компонентам препарата.
Применение при беременности и кормлении грудью
Применение у детей
Особые указания
Препарат применяется по назначению врача. Пациенты не должны принимать препарат бесконтрольно или по совету третьих лиц.
Если при лечении улучшение не наступает в течение 3 дней, то препарат следует отменить.
Лекарственное взаимодействие
Пациент должен сообщать лечащему врачу о параллельно принимаемых лекарственных препаратах.
Условия хранения препарата Бактисубтил ®
Препарат следует хранить в недоступном для детей, сухом, защищенном от света месте при температуре ниже 25°С.
Срок годности препарата Бактисубтил ®
Транспортирование: при температуре ниже 25°С.
Условия реализации
Информация о препаратах, отпускаемых по рецепту, размещенная на сайте, предназначена только для специалистов. Информация, содержащаяся на сайте, не должна использоваться пациентами для принятия самостоятельного решения о применении представленных лекарственных препаратов и не может служить заменой очной консультации врача.
Свидетельство о регистрации средства массовой информации Эл № ФС77-79153 выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) 15 сентября 2020 года.

National Medical Research Center for Preventive Medicine, Moscow
Key words: inflammatory bowel diseases, irritable bowel syndrome, intestinal microbioma, probiotic, prebiotic, synbiotic, diarrhea.
For citation: Evsyutina Yu.V. Probiotics in the prevention and treatment of diseases of the gastrointestinal tract // RMJ. 2018. № 3. P. 18–22.
В обзоре рассматриваются опыт применения пробиотиков и пребиотиков при различных патологиях желудочно-кишечного тракта, а также требования, предъявляемые к пробиотикам.
Введение
Желудочно-кишечный тракт (ЖКТ) — самый густо населенный бактериями человеческий орган (в толстой кишке их число достигает 1014 КОЕ) [1]. Микробиота (совокупность микроорганизмов) ЖКТ играет важную роль как в поддержании здоровья, так и в развитии патологических реакций [2]. Микробиота выполняет разнообразные функции, главными из которых являются участие в метаболических и пищевых процессах, регуляция адаптивного иммунного ответа, защита от патогенных микроорганизмов, участие в сигнальных путях при воспалительных процессах [3].
Роли кишечной микробиоты в развитии заболеваний посвящено огромное число исследований, в части из них микробиом изучается в качестве терапевтической мишени. В настоящее время рассматривают 4 способа воздействия на кишечную микробиоту: назначение антибиотиков, пребиотиков (пищевых ингредиентов, которые индуцируют рост и метаболическую активность полезных бактерий), пробиотиков (полезных живых бактерий) и трансплантация фекальной микробиоты. Помимо этого, возможно использование комбинированной терапии — синбиотиков, которые включают пребиотики и пробиотики.
Пробиотики привлекают внимание исследователей на протяжении многих лет. К настоящему времени получены данные о положительных эффектах пробиотиков у пациентов с воспалительными заболеваниями кишечника (ВЗК), паучитом, синдромом раздраженной кишки (СРК), антибиотикоассоциированной диареей, инфекционной диареей, печеночной энцефалопатией и аллергическими заболеваниями [4–7].
Наиболее изученными пробиотическими культурами являются молочнокислые бактерии Lactobacillus и Bifidobacterium (в частности, Bifidobacterium breve,
B. longum, B. infantis, Lactobacillus acidophilus, L. plantarum, L. paracasei, L. bulgaricus, L. rhamnosus GG (LGG), L. casei), непатогенные штаммы Escherichia coli, к примеру, E. coli Nissle 1917, Streptococcus (S. salivarius и S. thermophilus), Clostridium butyricum и Saccharomyces boulardii. Помимо пробиотиков, получаемых из пищевых продуктов, ученые разрабатывают генно-инженерные штаммы, которые могут секретировать иммуномодуляторы (такие как интерлейкин-10 (IL-10), трефоловые факторы, дефензины) или продуцировать поверхностные белки, к примеру, липотейхоевую кислоту [8].
Результаты исследований наглядно продемонстрировали несколько положительных механизмов действия пробиотиков. Отмечаются подавление роста и эпителиальной адгезии/инвазии патогенных бактерий; улучшение барьерной кишечной функции; модулирование иммунной системы, поскольку пробиотики могут индуцировать синтез протективных цитокинов, включая IL-10 и трансформирующий фактор роста β (TGF-β), и подавлять синтез провоспалительных цитокинов (фактор некроза опухоли α (TNF-α)) в слизистой оболочке у пациентов с паучитом, язвенным колитом (ЯК), болезнью Крона (БК). По данным исследований на животных, S. boulardii могут ограничивать миграцию Т-хелперов 1 типа в кишечной зоне воспаления при ВЗК. Пробиотики способны изменять восприятие боли — некоторые штаммы Lactobacillus индуцируют экспрессию микроопиоидных и каннабиноидных рецепторов в кишечном эпителии и обеспечивают обезболивание в кишечнике аналогично эффектам морфина [9–12].
Остановимся более подробно на опыте применения пробиотиков и пребиотиков при паучите, ВЗК, инфекционной диарее, Clostridium difficile-ассоциированных заболеваниях, СРК.
Паучит
У некоторых пациентов с ЯК и семейным аденоматозным полипозом в качестве хирургического лечения проводят удаление ободочной и прямой кишки с образованием резервуара, сделанного из петли тонкой кишки и выполняющего роль прямой кишки. Такая операция носит название илеоанального резервуарного анастомоза. Резервуарный илеит (паучит) — это воспаление хирургически сформированного резервуара [13]. Наиболее часто встречающимися симптомами паучита являются повышение частоты стула, тенезмы (чувство постоянной потребности в дефекации), недержание, боль в животе, повышение температуры тела. Распространенность паучита составляет примерно 20% у пациентов с ЯК в течение первого года после формирования анастомоза и 50% после 5 лет, при этом у больных семейным аденоматозным полипозом частота осложнения не превышает 1%.
Изучение микробиома у пациентов с паучитом выявило повышение количества Clostridium perfringens и отсутствие Streptococcus [14, 15]. Результаты небольших контролируемых исследований свидетельствуют, что комбинированный пробиотик, содержащий 4 штамма Lactobacillus (L. casei, L. plantarum, L. acidophilus и L. delbrueckii subsp. bulgaricus), 3 штамма Bifidobacterium (B. longum, B. breve и B. infantis) и Streptococcus thermophilus, может быть эффективен в профилактике рецидивов паучита после антибиотикотерапии. Так, Т. Mimura et al. изучали эффективность данного пробиотика у 36 пациентов с рецидивирующим или рефрактерным паучитом [16]. После достижения ремиссии пациенты были рандомизированы в группу плацебо или пробиотика, принимаемых 1 раз в день. Терапия продолжалась на протяжении 1 года. Анализ показал, что в группе пробиотической терапии большое число пациентов находилось в ремиссии (85% в сравнении с 6%), также у данной группы пациентов было достоверно выше качество жизни. В другом исследовании пациенты с ЯК получали данный комбинированный пробиотик в дозе 3 г/сут или плацебо сразу после закрытия илеостомы на протяжении 1 года. Отмечено, что на фоне терапии пробиотиком пациенты имели меньше эпизодов паучита (10% по сравнению с 40% соответственно) [17]. Необходимо отметить, что систематический обзор также продемонстрировал эффективность комбинированного пробиотика в профилактике как дебюта, так и рецидивов паучита [18].
Язвенный колит
У пациентов с ЯК изучалось применение пробиотиков и пребиотиков. К примеру, E. coli Nissle 1917 показал эффективность, аналогичную таковой низкой дозы 5-аминосалициловой кислоты, в профилактике рецидива ЯК у взрослых и у детей [19, 20]. В другом рандомизированном исследовании терапия с применением B. longum была ассоциированна с улучшением гистологической картины и показателей иммунной активации [21].
Эффективность вышеупомянутого пробиотика, содержащего 8 штаммов бактерий (4 штамма Lactobacillus, 3 штамма Bifidobacterium и Str. thermophilus), была изучена в рандомизированном клиническом исследовании с участием 77 пациентов. Было установлено, что пробиотик эффективнее плацебо снижает активность заболевания и индуцирует ремиссию (43% и 16% соответственно) [22]. Аналогичные результаты были получены в рандомизированном исследовании А. Tursi, включавшем 144 пациента [23].
В другом исследовании, оценивающем эффективность приема пробиотика L. reuteri у детей с ЯК, показано статистически значимое снижение клинической и эндоскопической активности заболевания в сравнении с таковым при применении плацебо [24]. Однако не все исследования по изучению пробиотиков демонстрируют положительный результат. В работе S. Wildt et al. применение L. acidophilus и B. animalis subsp. lactis не привело к улучшению контроля за ремиссией при сравнении с плацебо [25].
Несмотря на большое количество изучаемых штаммов и положительный результат отдельных исследований, в двух систематических обзорах было сделано заключение, что на настоящий момент мы имеем недостаточное количество данных для того, чтобы рекомендовать пробиотики для индукции и поддержания ремиссии при ЯК [26, 27].
Болезнь Крона
Эффективность пробиотиков в качестве дополнения к традиционной терапии для индукции клинической ремиссии изучалась в 4 относительно небольших исследованиях. Это были пробиотики S. boulardii, LGG, B. longum, B. breve, L. casei. В 3 из 4 исследований было показано симптоматическое улучшение [28].
Эффективность различных пробиотиков в поддержании ремиссии была изучена в 9 исследованиях. У пациентов с БК оценивали эффекты S. boulardii, E. coli Nissle, комбинированного пробиотика, содержащего 8 штаммов бактерий, и LGG. В большинстве из работ не было выявлено преимуществ от применения пробиотиков [28].
В 6 исследованиях оценивали эффективность пробиотических штаммов в поддержании хирургически индуцированной ремиссии у пациентов с БК. В частности, исследователи определяли влияние комбинированного пробиотика, содержащего 8 штаммов бактерий, LGG, L. johnsonii. Данные оказались разочаровывающими, т. к. эффективность различных штаммов не нашла подтверждения [28].
Таким образом, результаты исследований свидетельствуют о том, что применение пробиотиков не рекомендовано для индукции клинической ремиссии у пациентов с БК. За некоторым исключением (подтверждена целесообразность применения Saccharomyces boulardii у некурящих пациентов) пробиотики не оказывают влияния на поддержание лекарственно-индуцированной ремиссии у пациентов с колитом и энтероколитом [28]. Также важно отметить, что получено недостаточное количество данных для назначения пробиотиков с целью профилактики послеоперационного рецидива БК.
Инфекционная диарея
Результаты многочисленных систематических обзоров демонстрируют умеренную эффективность пробиотиков в уменьшении продолжительности инфекционной диареи. Метаанализ 2010 г., включавший 63 рандомизированных контролируемых исследования, показал, что у детей и взрослых пробиотики снижают риск диареи длительностью 4 дня или более на 59% (относительный риск (ОР) 0,41, 95% доверительный интервал (95% ДИ) 0,32–0,53) и средний период диареи на 25 ч (95% ДИ 16–34 ч). Двумя наиболее изученными пробиотиками являются LGG и S. boulardii [29].
Еще один метаанализ 9 исследований, который оценивал эффективность некоторых штаммов лактобактерий в снижении длительности симптомов у детей с острой инфекционной диареей, заслуживает нашего внимания [30]. Пробиотическая терапия была ассоциированна со снижением длительности диареи на 0,7 дня (95% ДИ 0,3–1,2) и частоты диареи с 2 до 1,6 в день. Важно отметить, что для достижения положительного результата в виде снижения продолжительности диареи на полдня минимальная доза пробиотика в течение первых 48 ч составила 10 млрд КОЕ.
Пробиотики могут играть определенную роль в ускоренном выздоровлении при острой ротавирусной диарее у детей [30–32]. Так, в двойном слепом плацебо-контролируемом исследовании с участием 230 детей пробиотик, содержащий 8 штаммов бактерий, достоверно снизил частоту стула [30]. В другом рандомизированном исследовании LGG продемонстрировала дозозависимое снижение количества ротавируса в кале [33].
Синдром раздраженной кишки
СРК — одно из самых часто встречающихся функциональных гастроинтестинальных заболеваний, поражающее 11% населения всего мира. В патогенезе СРК немаловажную роль играет нарушение микробиома, поэтому применение у таких пациентов пробиотиков и пребиотиков активно изучается.
Метаанализ 16 рандомизированных контролируемых исследований показал, что большинство из них имели методологические ограничения. В двух исследованиях продемонстрирована эффективность B. infantis [34]. Действие пробиотика B. infantis также было изучено в 4-недельном исследовании, где он сравнивался с плацебо у 362 пациентов. Анализ продемонстрировал достоверное клиническое преимущество в группе, получавшей пробиотик, однако четкого дозозависимого эффекта выявлено не было [35]. Еще в одном исследовании, включавшем 60 пациентов с СРК, сравнивалась эффективность L. plantarum и плацебо [36].
На фоне пробиотической терапии отмечены снижение метеоризма и абдоминальной боли, а также поддержание лучшего функционирования ЖКТ на протяжении последующих 12 мес. Снижение интенсивности абдоминальной боли и тенденция к нормализации частоты дефекаций на фоне применения L. plantarum у пациентов с СРК и запором продемонстрированы в плацебо-контролируемом исследовании I. M. Carroll et al. [37].
У пациентов с СРК изучалось применение и других пробиотических штаммов. Так, J.S. Yoon et al. показали, что назначение в течение 4 нед. комбинации B. longum,
B. bifidum, B. lactis, L. acidophilus, L. rhamnosus и Streptococcus thermophilus ассоциированно с уменьшением абдоминальной боли и дискомфорта, а также вздутия живота [38]. Однако не все исследования демонстрируют эффективность пробиотиков. Примером может служить двойное слепое перекрестное исследование, в котором сравнивались LGG и плацебо. Анализ не выявил статистически значимых различий между группами по динамике интенсивности и частоты боли, тенезмов и вздутия [39].
Clostridium difficile-ассоциированные заболевания
Йогурт и пробиотики
Согласно данным National Institutes of Health survey (США), число американцев, использующих пробиотики и пребиотики, увеличилось в 4 раза — с 865 тыс. в 2007 г. до 4 млн в 2012 г. Многие из них покупают йогурты и сыры с содержанием пробиотических культур. Необходимо отметить, что на выживание полезных бактерий в ферментируемых продуктах оказывают влияние многие факторы: условия и время хранения, выбранный штамм, взаимодействие между бактериями, кислотность, доступность питательных веществ, наличие индукторов роста, концентрация сахара и др. Существует ряд нормативных требований к пробиотическим йогуртам, в частности, к числу жизнеспособных бактерий и показателю рН [50]. Результаты исследований на людях и животных демонстрируют, что количество живых клеток не менее 106 КОЕ/мл оказывает положительное действие. Однако проведенные работы свидетельствуют о более низком содержании пробиотиков в йогуртах и об их низкой способности противостоять агрессивным внутренним факторам. Так, к примеру, в двух исследованиях N. P. Shah et al. показали, что в изученных ими йогуртах содержится небольшое количество L. acidophilus и Bifidobacteriа [51, 52].
Требования, предъявляемые к пробиотикам
В 2001 г. была предпринята первая попытка стандартизировать требования к пробиотикам. Рабочая группа Joint Food and Agriculture Organization, относящаяся к Организации Объединенных Наций и Всемирной организации здравоохранения, разработала соответствующие рекомендации [53]. Основными положениями рекомендаций являлись необходимость определения рода и вида пробиотического штамма при помощи фенотипических и генотипических тестов; исследования in vitro для определения пробиотического эффекта; обоснование клинической пользы пробиотического штамма в исследованиях на людях. Помимо этого, к пробиотическим штаммам предъявляются минимальные требования по безопасности — данные об антимикробной резистентности, метаболической активности, нежелательных явлениях во время клинических исследований, продукции токсинов и отсутствия осложнений в виде проявления пробиотическими штаммами патогенных свойств в исследованиях на животных [53].
Помимо вышеуказанных требований, пробиотики должны отвечать еще нескольким критериям. Так, на момент продажи в препарате должно содержаться не менее 1 млрд бактериальных клеток, в препарате не должны содержаться вещества, не указанные на этикетке (дрожжи, плесень и др.), капсула или оболочка таблетки должна обеспечивать доставку бактериальных клеток в кишечник. Всем вышеуказанным требованиям отвечает Максилак ® . Это синбиотик, содержащий в 1 капсуле 9 пробиотических штаммов (Lactobacillus helveticus, Lactobacillus lactis, Bifidobacterium longum, Bifidobacterium breve, Lactobacillus rhamnosus, Streptococcus thermophilus, Bifidobacterium bifidum, Lactobacillus plantarum, Lactobacillus casei) и пребиотический компонент олигофруктозу [54]. Максилак ® является самым высокодозированным продуктом с 9 штаммами пробиотиков, содержащим 4,5 млрд полезных бактерий в 1 капсуле. Для обеспечения доставки бактерий в кишечник при производстве синбиотика Максилак ® используется инновационная технология MURE ® (Multi Resistant Encapsulation), которая защищает содержимое капсул и сохраняет их жизнеспособность даже при воздействии агрессивных факторов внешней и внутренней среды. Важно отметить, что эффективность технологии MURE ® была доказана в исследовании in vitrо. Согласно его результатам, пробиотические штаммы, содержащиеся в синбиотике Максилак ® , устойчивы к воздействию соляной кислоты желудка, солей желчных кислот и ферментов поджелудочной железы. Помимо защиты от внутренних агрессивных факторов оболочка MURE ® также защищает бактерии от воздействия агрессивных факторов внешней среды, благодаря чему Максилак ® можно хранить при комнатной температуре. Хорошо известно, что лактазная недостаточность нередко встречается у пациентов — в европейской популяции ее распространенность достигает 25%. Ошибочно считать, что лактазная недостаточность обусловлена только генетическими мутациями. Причинами вторичной лактазной недостаточности являются поражения слизистой оболочки ЖКТ (ВЗК, энтериты, целиакия, синдром короткой кишки, СРК и др.). При назначении терапии пациентам с лактазной недостаточностью нужно помнить, что в состав многих препаратов входит лактоза. При назначении синбиотика Максилак ® этого можно не опасаться — он не содержит лактозу, а значит, не противопоказан таким пациентам.
Заключение
Нарушение микробиоты играет важную роль в развитии заболеваний ЖКТ. Одним из перспективных методов коррекции микрофлоры является назначение пробиотиков и пребиотиков. Положительные эффекты пробиотиков заключаются в изменении иммунной системы слизистой оболочки, подавлении роста патогенных бактерий, а также снижении восприятия боли. Добавление пребиотиков к пробиотикам оказывает положительное влияние на исход терапии, т. к. пребиотики активируют рост и метаболическую активность полезных бактерий.
Читайте также:

