Беэр с а биология возбудителя описторхоза
Обновлено: 23.04.2024
Описторхоз (Opisthorchosis) – биогельминтоз, зооноз, вызываемый трематодами Opisthorchisfelineus (двуустка кошачья, двуустка сибирская), характеризующийся преимущественным поражением гепатобилиарной системы и поджелудочной железы.
Название протокола: Описторхоз у взрослых.
Код протокола:
Код МКБ-10:
В 66.0 Описторхоз
Сокращения, используемые в протоколе:
АСТ - аспартатаминотрансфераза
АЛТ - аланинаминотрансфераза
ДНК - дезоксирибонуклеиновая кислота
ЖВП - желчевыводящие пути
ЖКТ - желудочно-кишечный тракт
IgM - иммуноглобулин класса М
IgG - иммуноглобулин класса G
ИФА - иммуноферментный анализ
КТ - компьютерная томография
МРТ - магнитно-резонансная томография
ОАК - общий анализ крови
ОАМ - общий анализ мочи
ПЦР - полимеразная цепная реакция
РЛА - реакция латекс-агглютинации
СОЭ - скорость оседания эритроцитов
УЗИ - ультразвуковое исследование
ЭКГ - электрокардиография
Дата разработки: 2015 год.
Категория пациентов: взрослые.
Пользователи протокола: терапевты, врачи общей практики, врачи/фельдшеры скорой неотложной помощи, инфекционисты, гастроэнтерологи, невропатологи, психиатры, хирурги, аллергологи-иммунологи, дерматовенерологии, пульмонологи, кардиологи, онкологи, организаторы здравоохранения.
Примечание: в данном протоколе используются следующие классы рекомендаций и уровни доказательств:
Классы рекомендаций:
Класс I – польза и эффективность диагностического метода или лечебного воздействия доказана и и/или общепризнаны.
Класс II – противоречивые данные и/или расхождение мнений по поводу пользы/эффективности лечения.
Класс IIа – имеющиеся данные свидетельствуют о пользе/эффективности лечебного воздействия.
Класс IIb – польза/эффективность менее убедительны.
Класс III – имеющиеся данные или общее мнение свидетельствует о том, что лечение неполезно/неэффективно и в некоторых случаях может быть вредным.
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут быть также личинки других аскарид — кошки (T. mystax), коровы, буйвола, (T. vitulorum). Однако роль этих возбудителей в патологии человека практически не изучена
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
 |
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
- Географическое распространение и эпидемиология
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
| Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
- Патогенез и патологическая анатомия
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
 |
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).
Долгое время возбудитель описторхоза – широко распространенного паразитического заболевания, вызванного потреблением инфицированной рыбы, изучался главным образом медиками и паразитологами. Однако современные молекулярно-генетические методы в сочетании с биоинформационными подходами позволяют получить принципиально новые данные о биологии и структурно-функциональной организации генома этого паразита, в том числе определить молекулярные основы его патогенной и канцерогенной активности. Это открывает широкие перспективы для разработки новых методов профилактики и лечения описторхоза
Описторхоз – это тяжелое паразитическое заболевание, с очаговым характером распространения, которое вызывается печеночными сосальщиками. Эти паразитические трематоды (иначе – плоские черви) принадлежат к семейству Opishtorchiidae. Интерес к описторхозу не случаен – он продиктован высокой социальной значимостью этого заболевания для нашей страны, особенно для Западной Сибири.
Систематическое изучение распространенности описторхоза в России началось еще в 1920-х гг. За сорок лет Союзные гельминтологические экспедиции (ГСЭ), организованные по инициативе и при участии академика К. И. Скрябина, практически полностью обследовали территорию СССР. В результате выяснилось, что в нашей стране ареал основного возбудителя этого заболевания – Opisthorchis felineus (кошачьей или сибирской двуустки), огромен и простирается от р. Бирюса на востоке до западных ее границ
Здесь, в Обь-Иртышском речном бассейне, еще в 1929 г. был обнаружен крупнейший природный очаг описторхоза. И за прошедшие десятилетия эпидемиологическая ситуация ничуть не улучшилась: по данным Роспотребнадзора, в 2010 г. в нижнем течении Иртыша и среднем течении Оби было заражено до 90—95 % сельского населения, в том числе дети дошкольного возраста. Показатели заболеваемости в разных населенных пунктах этого очага превышают общероссийские в 3—28 раз (О санитарно-эпидемиологической обстановке…, 2008 г.).
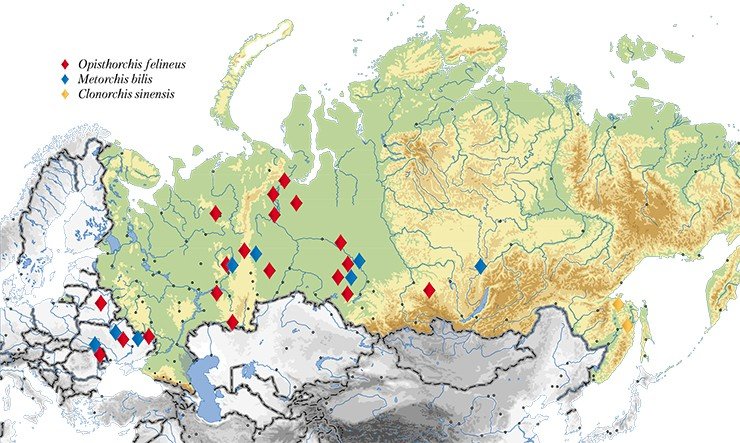
Учитывая широкую географию распространения паразита, для специалистов представляет несомненный интерес выяснить, существуют ли генетические различия, характеризующие популяции из разобщенных зон его ареала. Эти, с первого взгляда, сугубо теоретические исследования имеют и выраженный прикладной аспект. Поскольку именно генетические отличия между паразитами могут обусловливать такие значимые медицинские характеристики, как разнообразие клинических проявлений заболевания, разную вероятность формирования лекарственной устойчивости у паразита, а также его различную иммуногенность (способность вызывать наработку специфических антител). Все эти сведения будут полезны для прогнозирования течения заболевания и формирования иммунного ответа у зараженного человека, а также для разработки диагностических средств и создания вакцин.
Именно такое комплексное исследование проблемы описторхоза и его возбудителей проводится с 2005 г. в Институте цитологии и генетики СО РАН (Новосибирск). Работа по анализу популяционно-генетической структуры гельминтов началась с формирования уникальной коллекции описторхов из разных географических зон – Западной Сибири, европейской части России и Северного Казахстана. На сегодня в ней представлено около 300 образцов Opisthorchis felineus – основного возбудителя описторхоза в нашей стране, и около 300 других видов описторхид, включая эпидемиологически значимые.
Метод как основа
Для оценки генетического разнообразия гельминтов из разных мест обитания был использован метод сравнительного анализа геномных маркеров, в качестве которых выступают фрагменты ДНК. Этот метод, широко использующийся в современной молекулярной биологии, позволяет достаточно надежно судить о степени родства как отдельных индивидов, так и их групп. Поэтому его используют для определения близкородственных видов и реконструкции их эволюционной истории.
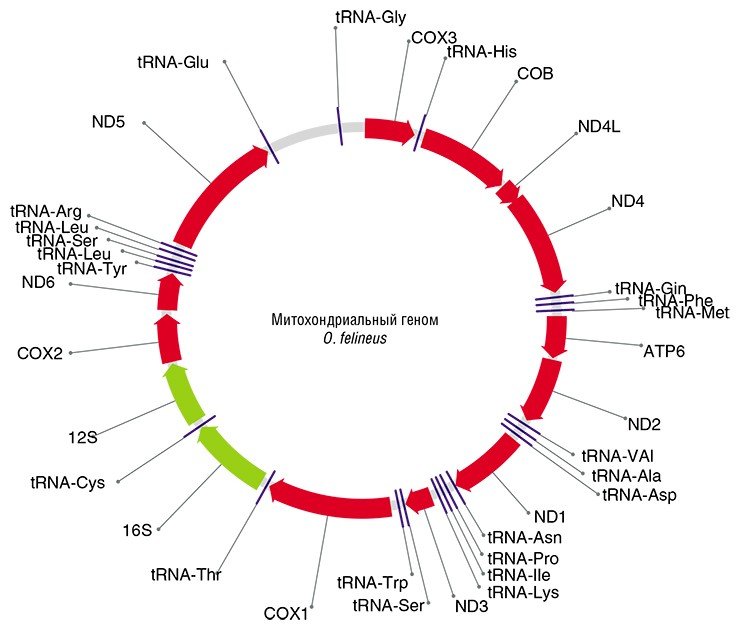
Этому требованию отвечают не кодирующие белок последовательности ядерной ДНК, а также собственная ДНК клеточных органелл – митохондрий. Последняя наследуется строго по материнской линии с цитоплазмой яйцеклетки и не участвует в рекомбинационном процессе (обмене участками хромосом при клеточном делении). Скорость накопления нейтральных мутаций в митохондриальных генах в 5—10 раз выше, чем в генах ядерной ДНК.

Принято считать, что число накопленных однонуклеотидных замен в селективно нейтральных участках ДНК линейно зависит от времени. Следовательно, произведя подсчеты этих замен, можно получить приблизительную датировку эволюционных событий.
В результате было найдено восемь подходящих генетических маркеров, из них три (два митохондриальных и один ядерный) были выбраны для генотипирования коллекционных образцов описторхид. Нужно добавить, что хотя в последнее десятилетие аналогичные маркеры использовались при исследованиях популяционной структуры и филогеографии других паразитических трематод в Европе, Восточной и Юго-Восточной Азии, Африке, и Америке, исследования такого рода в отношении O. felineus ранее не проводились.
Последующая эволюционная история O. felineus, по-видимому, была весьма драматичной. Дело в том, что ранее было высказано предположение о существовании трех подвидов описторха – сибирского, казахского и восточно-европейского, обитающих соответственно в Обь-Иртышском и Енисейском, Нура-Сарысукском, Волжском, Донском и Уральском речных бассейнах (Беэр, 2005). Поэтому ожидалось, что коллекционные образцы из столь разнесенных в пространстве популяций продемонстрируют заметные генетические различия, поскольку экологически условия обитания также значительно разнятся. Но вопреки предположениям исследованные выборки описторхов характеризовались крайне низким генетическим разнообразием, в отличие от других уже изученных видов трематод (Брусенцов и др., неопубликованные данные).
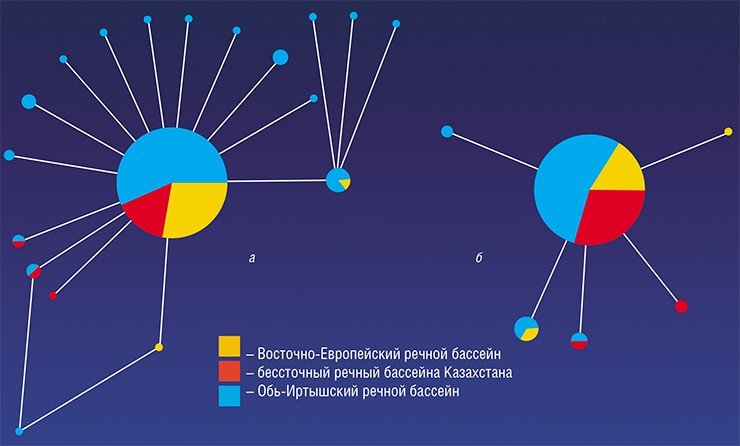
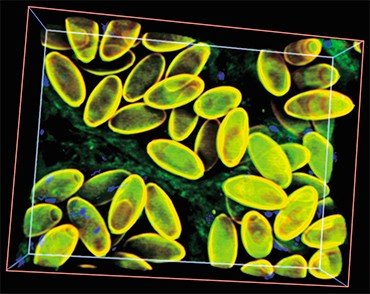
С наступлением потепления и формированием новых речных бассейнов последовало восстановление численности предковой популяции. Согласно расчетам, 21—25 тыс. лет назад в истории вида начался (и продолжается до сих пор) период демографического взрыва, которому, вероятно, в немалой степени способствовал факультативно гермафродитный способ размножения описторха.
К сожалению, проведенное исследование не дает возможности точно указать локализацию предковой популяции и проследить пути расселения паразита. Но, учитывая сложный жизненный цикл O. felineus, представляется очевидным, что направление и скорость его экспансии определялись миграционными способностями его хозяев. Тот факт, что описторхоз сегодня распространен только в некоторых географических зонах, во многом обусловлен средовыми предпочтениями его первого промежуточного хозяина – пресноводных моллюсков битиний, которые в морской воде погибают. Однако одним из окончательных хозяев описторха является человек, для которого географические изолирующие барьеры практически отсутствуют.
В одной пробирке
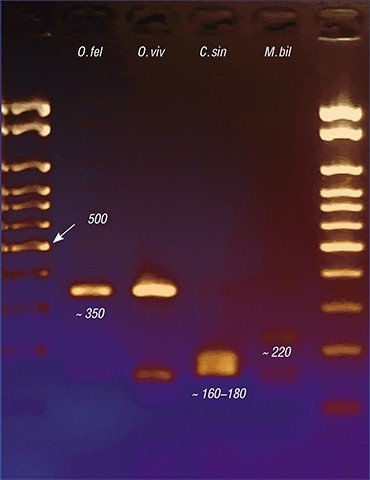
С помощью метода генетических маркеров удалось решить и актуальную медицинскую задачу точной видовой идентификации описторхид. Дело в том, что, наряду с описторхом, в России, а также в Казахстане и странах Восточной Европы встречается еще один эпидемиологически значимый вид – меторх (Мetorchis bilis). А на Дальнем Востоке – еще и клонорх (C. sinensis), о котором упоминалось выше, обычный для стран Юго-Восточной Азии.
Все эти трематоды вызывают заболевания с очень сходной клинической картиной, поэтому на основе одних лишь симптомов врач не может поставить точный диагноз. Под микроскопом же яйца этих гельминтов практически неразличимы между собой, так что результат микроскопического анализа фекалий или содержимого двенадцатиперстной кишки, взятого при дуоденальном зондировании, во многом зависит от квалификации лаборанта. Ситуацию усугубляет возможность одновременного заражения разными видами описторхид.
Сегодня наиболее точной является ДНК-диагностика трематодозов. За рубежом такие эффективные тест-системы начали интенсивно разрабатываться еще в 1990-е гг. Российские ученые начали подобную работу позже, но в последние годы и у нас, в частности в ИЦиГ СО РАН, активно идет процесс создания ПЦР-дигностикумов, с помощью которых можно выявлять в лабораторном материале генетические фрагменты, строго специфичные для определенного вида возбудителя. Поскольку метод позволяет использовать одновременно генетические маркеры на разных гельминтов, для точной диагностики паразитических агентов достаточно одного анализа.
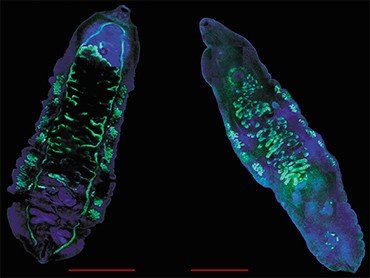
Установление вида паразита может иметь большое значение. Например, оно позволяет определить источник и место заражения. Но самое главное – возбудители описторхоза – меторхоза и клонорхоза различаются по ряду биологических характеристик, что может влиять на течение и прогноз заболевания, возникновение осложнений и степень чувствительности паразитов к лекарственным препаратам.
Так, недавно в эксперименте на золотистых хомячках было показано, что два вида описторхид – наш O. felineus и O. viverrini, встречающийся в странах Юго-Восточной Азии, различаются по агрессивности воздействия на организм хозяина (Lvova et al., 2012). Кстати сказать, в той же Юго-Восточной Азии помимо высокопатогенной O. viverrini широко распространена еще одна похожая трематода – Haplorchis taichui, заражение которой не вызывает тяжелого заболевания (Lovis et al., 2009). Этот пример показывает, насколько важна дифференциальная диагностика трематодозов для назначения адекватного лечения.
Кроме того, даже при низкой степени зараженности хроническая инвазия описторхидами может приводить к серьезным последствиям для здоровья. Однако, как правило, врачи бессильны обнаружить яйца описторхид в лабораторном материале таких пациентов с помощью обычной световой микроскопии, и диагноз зачастую ставится только посмертно (Müller et al., 2007). ПЦР-диагностика же является в этом случае гораздо более чувствительным методом.
Итак, несмотря на свою драматическую эволюционную историю, паразитическая трематода O. felineus не только выжила, но, даже потеряв часть своего генофонда, сегодня является весьма процветающим видом с высокими адаптационными способностями, в том числе высокой инвазионностью – способностью внедряться в организм хозяина.
Разработанные новосибирскими учеными наборы для ПЦР-диагностики описторхоза прошли стадию лабораторных испытаний, сейчас завершается их тестирование на клиническом материале. С их помощью уже удалось успешно выявить у группы пациентов случаи смешанных трематодных инвазий (Brusentsov et al., 2010), что, несомненно, говорит о необходимости их включения в арсенал методов лабораторной диагностики описторхоза. Ведется разработка производственной технологии выпуска диагностикумов.
Повысить точность ИФА можно путем клонирования генов, кодирующих специфичные для описторха антигены. В ИЦиГ СО РАН уже получены такие генно-инженерные белки-антигены О.felineus, пригодные для создания диагностикумов нового поколения. Их можно использовать для детекции даже незначительного количества специфических антипаразитарных антител в сыворотке крови. Однако в медицинскую практику такие ИФА-диагностикумы поступят еще не скоро.
КОММЕНТАРИЙ СПЕЦИАЛИСТА
Комплексные молекулярно-генетические исследования проблемы описторхоза и его возбудителей, проводимые новосибирскими учеными (при участии научных команд из других городов), – крупный и очень серьезный проект, включающий такую дорогую и в хорошем смысле амбициозную составляющую, как расшифровка генома описторха, возбудителя этого паразитоза в нашей стране.
Нужно отметить, что получение нового диагностического инструмента – это далеко не единственный среди всех возможных практический выход этого проекта. Полученные в ходе проекта знания о молекулярно-генетическом разнообразии паразита в дальнейшем должны стать основой для выявления терапевтических мишеней лечения описторхоза – проблемы, еще более актуальной, чем его точная диагностика. Ведь сейчас при медикаментозной терапии описторхоза практически используется единственный препарат – празиквантель, который имеет ряд негативных побочных эффектов.
Но, безусловно, нельзя умалять и значение нового, высокоспецифичного и чувствительного метода, благодаря которому врач может точно выявить возбудителя заболевания и своевременно назначить соответствующее лечение. Используемые сегодня для диагностики описторхоза методы копроовоскопии (анализ кала на яйца глистов) требуют высокого уровня подготовки лаборантов, и специалистов такого уровня действительно мало. ДНК-диагностика требует более сложного оборудования, но при этом позволяет уменьшить влияние на результат “человеческого фактора”. Для широкого применения ДНК-диагностики требуется решить задачу выделения ДНК из клинического материала (фекалий). Эта проблема тоже была решена в ходе выполнения проекта.
Безусловно, существуют методы выявления антител к описторхозу методом ИФА. Но не совсем корректно сравнивать два разных метода диагностики – ПЦР и ИФА, которые, по сути, являются (или должны стать) составляющими одного диагностического процесса. ИФА в большей степени подходит для контроля лечения, поскольку позволяет вести мониторинг активности иммунной системы, ПЦР же – для скрининга, первичного выявления заболевания.
Важность наличия точного диагностического инструмента в том, что во многих случаях описторхоз протекает бессимптомно. А поскольку доказано, что одним из тяжелейших последствий описторхоза может быть холангиокарцинома – злокачественная опухоль желчных протоков, то населению эндемичных очагов описторхоза желательно регулярно обследоваться на наличие паразитов, а в случае заболевания – в обязательном порядке проводить дегельминтизацию.
Д. м. н. А. Э. Сазонов, Главный научный сотрудник Центральной научно-исследовательской лаборатории
Сибирского государственного медицинского университета (Томск)
Внедрение новых диагностических технологий, несомненно, повлияет на качество лечения и продолжительность реабилитации пациентов. Этому есть много примеров, наиболее яркие из которых связаны с диагностикой бактериальных инфекций, перешедшей из чашек Петри в пробирки для ПЦР. Новые технологии не отменят традиционные, но позволят намного повысить чувствительность и точность анализов, особенно в сложных клинических случаях.
Юрлова Н. И. Обская болезнь описторхоз // Наука из первых рук. 2008. №2 (20). С. 12—21.
Пальцев А. И. Системному заболеванию – системный подход // Наука из первых рук. 2008. №2 (20). C. 22—27.
Колчанов Н. А., Мордвинов В. А. Паразитоз от А до Т // Наука из первых рук. 2008. №2 (20). C. 28—41.
Беэр С. А. Биология возбудителя описторхоза. КМК, 2005. 336 с.
Брусенцов И. И., Катохин А. В., Сахаровская З. В. и др. ДНК-диагностика микст-инвазий Opisthorchis felineus и Metorchis bilis с помощью метода ПЦР // Медицинская паразитология и паразитарные болезни. 2010. № 2. С.10—13.
Ключевые слова
Об авторах
Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина
Россия
кандидат ветеринарных наук, Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина, 117218, г. Москва, ул. Б. Черемушкинская, 28
Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина
Россия
доктор биологических наук, Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина, 117218, г. Москва, ул. Б. Черемушкинская, 28
Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина
Россия
доктор ветеринарных наук, Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина, 117218, г. Москва, ул. Б. Черемушкинская, 28
Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина
Россия
старший научный сотрудник, Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина, 117218, г. Москва, ул. Б. Черемушкинская, 28
Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина
Россия
старший научный сотрудник, Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина, 117218, г. Москва, ул. Б. Черемушкинская, 28
Список литературы
2. Буряк М.В. Изучение роли домашних плотоядных животных в распространении описторхоза в Курской области // Рос. паразитол. журнал. – 2008. – № 4. – С. 31–34.
3. Сафиуллин Р.Т., Мусатов М.А. Паразитарные болезни пушных зверей, средства и методы их лечения. – М.: Колос, 2009. – 152 с.
Рецензия
Для цитирования:
Андреянов О.Н., Горохов В.В., Сафиуллин Р.Т., Хрусталев А.В., Москвин А.С. ВОЗБУДИТЕЛЬ ОПИСТОРХОЗА Opisthorchis felineus НА ТЕРРИТОРИИ РЯЗАНСКОЙ ОБЛАСТИ. Российский паразитологический журнал. 2013;(2):6-9.
For citation:
Andrejanov O.N., Gorohov V.V., Safiullin R.T., Hrustalev A.V., Moskvin A.S. Opisthorchis felineus in Ryazan region. Russian Journal of Parasitology. 2013;(2):6-9. (In Russ.)
Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Цель исследований: провести анализ литературных источников на установление роли описторхоза в здравоохранении, оценке актуальности гистологических и гистохимических методов при определении эффективности препаратов против гельминтов – возбудителей описторхоза.
Материалы и методы. Проведён анализ источников литературы по изучению описторхоза, распространению его возбудителя и значению для здравоохранения. Изучена официальная документация годовых отчетов, представленных на официальных сайтах.
Ключевые слова
Об авторе
Оксана Ивановна Бибик
650029, г. Кемерово, ул. Ворошилова 22а
Список литературы
1. Бабаева Е. Ю., Чернышёва Е. С., Николаева С. А. Комплексное использование синтетических антигельминтиков и растительных препаратов при глистных инвазиях // Вестник РУДН, серия Медицина. 2015. № 2. С. 93–99.
3. Базин И. С., Гарин А. М. Лечение холангиоцеллюлярного рака желчных протоков, рака желчного пузыря и рака Фатерова сосочка // Русский медицинский журнал. 2002. № 24. С. 1103–1108.
4. Балашева И. И., Миронова З. Г. Особенности течения и терапии описторхоза у детей. Томск. 1990. 152 с.
7. Бибик О. И. Патоморфология и гистохимическая реактивность органов и тканей трематод после действия антигельминтиков: автореф. дис… канд. биол. наук. М., 1997. 13 с.
8. Бибик О. И. Морфофункциональная характеристика органов и тканей паразита и хозяина при трематодозах после химиотерапии антигельминтиками // Российский паразитологический журнал. 2008. № 1. С. 99–106.
10. Бибик О. И., Начева Л. В. Паразитарные болезни, распространённые на территории Кузбасса (распространённость, меры борьбы и профилактики). Методические рекомендации (для врачей практического здравоохранения и ветеринарной медицины, студентов, ординаторов и аспирантов соответствующего профиля). Кемерово, 2010. 63 с.
14. Богданов А. О., Прокудина Д. В., Байков А. Н., Салтыкова И. В. Молекулярные механизмы, опосредующие развитие холангиокарциномы в ходе хронической инвазии печёночными сосальщиками // Сибирский онкологический журнал. 2015. № 6. С. 83–90.
15. Беэр С. А. Биология возбудителя описторхоза. М., 2005. 336 с.
16. Бычков В. Г. Описторхоз и рак печени у населения гиперэндемичного очага. Новосибирск, 1992. 175 с.
17. Гузеева Т. М. Состояние заболеваемости паразитарными болезнями в Российской Федерации и задачи в условиях реорганизации службы // Медицинская паразитология и паразитарные болезни. 2008. № 1. С. 3–10.
19. Летюшев А. Н. Критерии оценки активности эпидемического процесса описторхоза в крупном промышленном центре Западной Сибири и оптимизация системы эпидемиологического надзора: дис. … д-ра мед. наук. Тюмень, 2017. 205 с.
20. Либерман Е. Л., Медведева И. Н. Показатели инвазии массовых видов карповых рыб Нижнего Иртыша метацеркариями сем. Opisthorchiidae // Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство. 2017. № 4. С. 37–42.
22. Начева Л. В., Бибик О. И. Микроморфологические исследования органов и тканей разных видов трематод до и после воздействия антигельминтиками // Труды Всероссийского института гельминтологии им. К.И. Скрябина. 2006. Т. 44. С. 162–169.
28. Плотникова Е. Ю., Баранова Е. Н. Описторхоз: осложнения и проблемы лечения // Гастроэнтерология Санкт-Петербурга. 2018. С. 14–18.
29. Сергиев В. П. Регистрируемая и истинная распространенность паразитарных болезней // Медицинская паразитология и паразитарные болезни. 1991. № 2. С. 3–5.
30. Щекина Е. Г. Гельминтозы: современный взгляд на проблему // Провизор. 2007. № 12. С. 30–34.
31. Andrews R. H., Sithithaworn P., Petney T. N. Opisthorchis viverrini: an underestimated parasite in world health. Trends in Parasitology. 2008. 24 (11): 497–501.
32. Chiu A., Neff M., Garcia G. Late complications of infection with Opisthorchis viverrini. Western Journal of Medicine. 1996; 164 (2): 174–176.
33. Dechakhamphu S., Pinlaor S., Sitthithaworn P., Nair J., Bartsch H., Yongvanit P. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiol Biomarkers Prev. 2010; 19 (1): 310–318. doi: 10.1158/1055-9965.EPI-09-0849.
34. Elkins D. B., Mairiang E., Sithithaworn P., Mairiang P., Chaiyakum J., Chamadol N., Loapaiboon V., Haswell-Elkins M. R. Cross-sectional patterns of hepatobiliary abnormalities and possible precursor conditions of cholangiocarcinoma associated with Opisthorchis viverrini infection in humans. American Journal of Tropical Medicine and Hugiene. 1996; 55 (3): 295–301. DOI: 10.4269/ajtmh.1996.55.295
35. Fukase K., Ohtsuka H., Onogawa T., Oshio H., Ii T., Mutoh M., Katayose Y., Rikiyama T., Oikawa M., Motoi F., Egawa S., Abe T., Unno M. Bile acids repress E-cadherin through the induction of Snail and increase cancer invasiveness in human hepatobiliary carcinoma. Cancer Science. 2008; 99 (9): 1785–1792. doi: 10.1111/j.13497006.2008.00898.x.
36. Jing H., Lee S. NF-κB in cellular senescence and cancer treatment. Molecules and Cells. 2014; 37 (3): 189–195. doi: 10.14348/molcells.2014.2353.
37. Jusakul A., Loilome W., Namwat N., Haigh W. G., Kuver R., Dechakhamphu S., Sukontawarin P., Pinlaor S., Lee S. P., Yongvanit P. Liver flukeinduced hepatic oxysterols stimulate DNA damage and apoptosis in cultured human cholangiocytes. Mutation Research. 2012; 731 (12): 48–57. doi: 10.1016/j.mrfmmm.2011.10.009.
38. Kaewpitoon N., Kaewpitoon S. J., Pengsaa P., Sripa B. Opisthorchis viverrini: the carcinogenic human liver fluke. World Journal of Gastroenterology. 2008; 14 (5): 666–674.
39. Kim S. S., Kim S. J., Rim H. J. Electronmicroscopic studies on the effect of praziquantel to Clonorchis sinensis. Korea University Medical Journal. 1982; 19: 91–105.
40. Laha T., Sripa J., Sripa B., Pearson M., Tribolet L., Kaewkes S., Sithithaworn P., Brindley P. J., Loukas A. Asparaginyl endopeptidase from the carcinogenic liver fluke, Opisthorchis viverrini, and its potential for serodiagnosis. International Journal of Infectious Diseases. 2009; 12: 49–59. doi: 10.1016/j.ijid.2008.03.033
41. Lovis L., Mak T. K., Phongluxa K., Ayé Soukhathammavong P., Vonghachack Y., Keiser J., Vounatsou P., Tanner M., Hatz C., Utzinger J., Odermatt P., Akkhavong K. Efficacy of praziquantel against Schistosoma mekongi and Opisthorchis viverrini: a randomized, single-blinded dosecomparison trial. PLoS One. 2012; 6:e 1726.
42. Maksimova G. A., Zhukova N. A., Kashina E. V., Lvova M. N., Katokhin A. V., Tolstikova T. G., Mordvinov V. A. Role of opisthorchis felineus on induction of bile duct cancer. Parazitologiia. 2015; 49 (1): 3–11.
43. Marcos L. A., Terashima A., Gotuzzo E. Update on hepatobiliary flukes: fascioliasis, opisthorchiasis and clonorchiasis. Current Opinion in Infectious Diseases. 2008; 21(5): 523–30.
44. Mathema V. B., Na-Bangchang K. Current insights on cholangiocarcinoma research: a brief review. Asian Pacific Journal of Cancer Prevention. 2015; 16 (4): 1307–1313.
45. Pal S., Bhattacharjee A., Ali A., Mandal N. C., Mandal S. C., Pal M. Chronic inflammation and cancer: potential chemoprevention through nuclear factor kappa B and p53 mutual antagonism. Journal of Inflammation (London). 2014; 11: 1–28. doi: 10.1186/1476-9255-11-23. eCollection 2014.
46. Patel T. Cholangiocarcinoma. Nature Clinical Practice Gastroenterology & Hepatology. 2006; 3 (1): 33–42.
47. Pinlaor S., Hiraku Y., Ma N., Yongvanit P., Semba R., Oikawa S., Murata M., Sripa B., Sithithaworn P., Kawanishi S. Mechanism of NOmediated oxidative and nitrative DNA damage in hamsters infected with Opisthorchis viverrini: a model of inflammation-mediated carcinogenesis. Nitric Oxide. 2004; 11 (2): 175–183.
48. Pinlaor S., Hiraku Y., Yongvanit P., TadaOikawa S., Ma N., Pinlaor P., Sithithaworn P., Sripa B., Murata M., Oikawa S., Kawanishi S. iNOSdependent DNA damage via NFkappaB expression in hamsters infected with Opisthorchis viverrini and its suppression by the antihelminthic drug praziquantel. International Journal of Cancer. 2006; 119 (5): 1067–1072.
49. Saijuntha W., Sithithaworn P., Wongkham S., Laha T., Pipitgool V., Tesana S., Chilton N. B., Petney T. N., Andrews R. H. Evidence of a species complex within the food-borne trematode Opisthorchis viverrini and possible co-evolution with their first intermediate hosts // International Journal for Parasitology. 2009; 37: 695–703. DOI: 10.1016/j.ijpara.2006.12.008
50. Sriamporn S. Epidemiologic study of liver cancer using a population-based cancer registry as a guide in Khon Kaen, Thailand. Public Health Reports. 1993; 5 (1): 51–58.
51. Sripa B., Brindley P. J., Mulvenna J., Laha T., Smout M. J., Mairiang E., Bethony J. M., Loukas A. The tumorigenic liver fluke Opisthorchis viverrini – multiple pathways to cancer. Trends in Parasitology. 2012; 28 (10): 395–407. doi: 10.1016/j.pt.2012.07.006.
52. Sripa B., Kaewkes S., Sithithaworn P., Mairiang E., Laha T., Smout M., Pairojkul C., Bhudhisawasdi V., Tesana S., Thinkamrop B., Bethony J. M., Loukas A., Brindley P. J. Liver Fluke Induces Cholangiocarcinoma. PLoS Medicine. 2007; 4 (7): 1148–1155.
53. Tielens A. G., van den Heuvel J. M., van den Bergh S. G. The energy metabolism of Fasciola hepatica during its development in the final host. Molecular and Biochemical Parasitology. 1984; 13 (3): 301–307.
54. Watanapa P., Watanapa W. B. Liver flukeassociated cholangiocarcinoma. British Journal of Surgery. 2009; 962–970.
Читайте также:

