Белки могут быть источниками инфекции
Обновлено: 24.04.2024
Белки представляют основу структурных элементов клеток и тканей. Функции их разнообразны, они принимают участие в обмене веществ, сократимости, росте, размножении, мышлении.
Еще одна функция белков — транспортировка необходимых соединений или химических элементов. Гемоглобин, например, переносит кислород, он же транспортирует углекислый газ.
При попадании в организм чужих белков или клеток вырабатываются особые белки — антитела, которые связывают и обеззараживают чужеродные вещества.
В раннем детстве потребность в белке максимальная. С возрастом она уменьшается, так как ткани наращиваются медленнее. К моменту зрелости главной становится не строительная функция, а энергетическая.
Организм не может принять белка больше, чем ему необходимо, и если потребление белка с возрастом не уменьшается, то образуются конечные продукты белкового обмена: мочевая кислота, мочевина, аммиак, креатинин, креатин и др. При избытке этих соединений выведение их затруднено, и они задерживаются в организме, постепенно накапливаясь и нарушая обменные процессы.
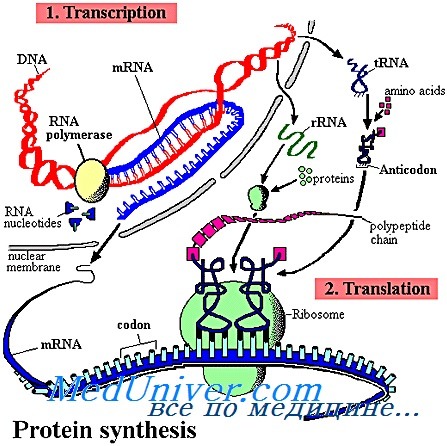
Все огромное множество белков — это комбинации 20 аминокислот, из них 10 аминокислот не синтезируются организмом и могут быть получены только из продуктов питания. Эти незаменимые аминокислоты должны поступать в составе потребляемых нами белков.
Белки пищи могут быть животного и растительного происхождения. Ценность пищевого рациона определяется наличием в белке незаменимых аминокислот.
К полезным животным белкам относятся постная говядина, курятина и индюшатина без кожи, яйца, молочные и кисломолочные продукты.
Рыба является не только источником белка, но и обеспечивает нас полезными омега-3-жирными кислотами.
Белки растительного происхождения (фасоль, соя, горох, чечевица) сочетают в себе высококачественный белок и растворимое волокно, которое очищает организм от холестерина.
Орехи и семена богаты не только белками, но и мононенасыщенными жирами.
Грецкие орехи содержат еще и омега-3-жирные кислоты. Это делает их особенно полезными, однако они содержат много калорий, поэтому потреблять их в большом количестве не следует.

Инфекционные болезни могут развиваться не только из-за бактерий, вирусов и других хорошо известных врачам микроорганизмов - это ошеломляющее заявление в медицинской среде было сделано после того, как в 1982 году профессор неврологии и биохимии Стэнли Прузинер (США) обнаружил белковые соединения, способные вызывать заболевания. Открытие белков-прионов было настоящим прорывом в медицине, доказательством чему стало получение учёным Нобелевской премии в 1997 году.
Прионы: биологическая сущность, свойства, среда обитания таинственных молекул
Как можно заразиться прионами?
На сегодняшний день выделяют следующие основные пути заражения инфекционным белком-прионом:
1. Трансмиссивный. В этом случае молекулы белка передаются от одного вида млекопитающего к другому - например, от инфицированной коровы или овцы человеку. Заражение происходит при употреблении в пищу мяса или молока заражённого животного, либо использовании его тканей (роговицы, препаратов крови и т.п.), применении во время оперативных вмешательств биологического шовного материала.
2. Наследственный. Заболевание развивается на фоне генетической мутации, затрагивающей область 20-й хромосомы. Несмотря на слабую изученность функционирования этого участка генома, достоверно известно его участие в синтезе нормального прионного белка. В случае генных мутаций вместо здорового приона образуется патологический, а это приводит к развитию болезней.
3. Спорадический. При этом аномальный белок появляется в организме спонтанно, без видимых причин.
Вне зависимости от способа появления аномальный белок может стать причиной заражения других людей.
Прионные заболевания: особенности течения, лечения, прогноз
Отличительной особенностью болезней, вызываемых прионами, является длительный инкубационный период - от 2-3 месяцев до нескольких десятилетий. Подавляющее большинство прионных заболеваний человека являются спорадическими и имеют семейный характер наследования.
Куру, синдром Герстманна-Штреусслера-Шейнкера, болезнь Крейтцфельдта-Якоба, скрэпи – прионы вызывают заболевания, сопровождаемые поражением центральной нервной системы. Для них характерны такие признаки как деменция (слабоумие), зрительные и мозжечковые нарушения. При этом у больного могут отмечаться двигательные расстройства, бессонница, галлюцинации, нарушение речи.
К сожалению, эффективных методов лечения прионных болезней на сегодняшний день нет, хотя учёные пытаются предотвращать переход нормального белка в аномальный. Пациентам назначается симптоматическая терапия с использованием противосудорожных средств для облегчения страданий. Прогноз пока неутешителен, так как все вышеперечисленные заболевания завершаются летальным исходом.
Перспективы
Раскрытие загадочных явлений, которыми окутаны прионы, возможно, поможет в понимании ряда серьёзных биомедицинских проблем человечества.
История

Гистологический препарат головного мозга, на котором видны микрополости


Как уже было сказано выше, основы знаний о прионах заложил Стенли Прузинер. Немного из его биографии. Родился в США в 1942 году. Его предки - эмигранты из российской империи, еврейского происхождения, вынужденные покинуть страну из-за еврейских погромов. Сам Стенли Прузинер в 1968 г. закончил Университет Пенсильвании и работал ординатором-неврологом в Медицинской школе Калифорнийского университета (Сан-Франциско). В 1970 впервые встретился с болезнью Крейтцфельдта — Якоба. У пациента, находившегося на лечении у Прузинера, никак не выявлялся возбудитель. Плотно занявшись этим исследованием, невролог обратился к трудам другого врача – Сиггурдсона, выявившего определенные закономерности у непонятных на тот момент болезней.
Такими закономерностями стали:
- необычно продолжительный (месяцы и годы) инкубационный период;
- медленно прогрессирующий характер течения;
- необычность поражения органов и тканей;
- неизбежность смертельного исхода.
Что же такое прионы и каков их механизм действия на организм (современные представления)?
На самом деле в организме человека и многих других живых существ есть белки PrPC. По-русски – нормальная форма прионных белков (открыты были после исследований Сиггурдсона, поэтому такая странность в название). Известна его длина, последовательность аминокислот, вторичная структура. Важно знать, что конечная структура состоит из трёх α-спиралей и двухцепочечного антипараллельного β-листа. Обладают интересным свойством, а именно осаждаются высокоскоростным центрифугированием, что является стандартным тестом на наличие прионов. Есть данные, что PrP играет важную роль в прикреплении клеток, передаче внутриклеточных сигналов, а потому может быть вовлечён в коммуникацию клеток мозга. Тем не менее, функции PrP исследованы недостаточно.

(a) норма (b) патология
Считается, что прионное заболевание может быть приобретено 3 путями: в случае прямого заражения, наследственно или спорадически (спонтанно) или их комбинациями. Спорадическая (то есть спонтанная) прионная болезнь возникает в популяции у случайной особи. Таков, например, классический вариант болезни Крейтцфельдта — Якоба. Существуют две основные гипотезы относительно спонтанного появления прионных болезней. Согласно первой из них спонтанное изменение происходит в самом доселе нормальном белке в мозге, то есть имеет место посттрансляционная модификация. Альтернативная гипотеза гласит, что одна или несколько клеток организма в какой-то момент претерпевают соматическую мутацию (то есть, не передающуюся наследственно) и начинают производить дефектный белок PrPSc. Как бы то ни было, конкретный механизм спонтанного возникновения прионных болезней неизвестен. Вторая – заражение. По данным современных исследований, основной путь приобретения прионных заболеваний — поедание заражённой пищи. Считается, что прионы могут оставаться в окружающей среде в останках мёртвых животных, а также присутствуют в моче, слюне и других жидкостях и тканях тела (кровь, ликвор). Из-за этого заражение прионами может произойти и в ходе пользования нестерильными хирургическими инструментами. Это усложняет стерилизацию хирургических инструментов или устройств на скотобойне. Прионы в большинстве своём устойчивы к протеазам, высокой температуре, радиации и хранению в формалине, хотя эти меры и снижают их способность к заражению. Эффективная дезинфекция против прионов должна включать гидролиз или повреждение/разрушение их третичной структуры. Это можно достичь обработкой хлорной известью, гидроксидом натрия и сильнокислыми моющими веществами. Пребывание в течение 18 минут при температуре 134 °C в герметичном паровом автоклаве не может деактивировать прионы. В качестве основного современного метода для деактивации и денатурации прионов в настоящее время изучается озоновая стерилизация. Ренатурация полностью денатурированного приона до инфективного состояния зафиксирована не была, однако для частично денатурированных прионов в некоторых искусственных условиях это возможно. Еще стоит помнить, что эти белки могут долго сохраняться в почве за счёт связывания с глиной и другими почвенными минералами. Не впадайте в паранойю, но теоретически они могут быть повсюду. В 2011 году было сообщено об открытии прионов, передающихся по воздуху в частицах аэрозоля (то есть воздушно-капельным путём). Также в 2011 году было опубликовано предварительное доказательство того, что прионы могут передаваться с получаемым из мочи человеческим менопаузальным гонадотропином, применяемым для лечения бесплодия. Теоретически с помощью всего одного больного животного с прионной болезнью, можно уничтожать целые нации и страны, просто добавляя его костную муку в кормовые добавки и продавая их в нужное государство. Сходная ситуация произошла в конце 80-х годов в Британии (эпидемия коровьего бешенства). Тогда, скорее всего по незнанию (а не по злому умыслу) произошел вышеуказанный процесс, унесший жизни около 200 человек (на 2009 год) и 179 тыс. голов крупного рогатого скота.

Клиника
Поговорим о болезнях и клинических проявлениях. Теоретически может возникать у всех живых существ, обладающих PrPc Вот некоторые примеры. У овец и коз, как это уже говорилось выше, главное проявление - это скрейпи. Для коров характерно коровье бешенство (губчатая энцефалопатия крупного рогатого скота) У норок- Трансмиссивная энцефалопатия норок. И так далее. Зафиксированы проявления заболеваний у кошек, диких парнокопытных, страусов. Но нас интересуют болезни человека.
Болезнь Крейтцфельдта — Якоба. Код по МКБ-10 A81.0; F02.1. Код А соответствует инфекционным болезням (А81 – инфекционные болезни нервной системы). Код F – психические расстройства, F02 – деменции.

Темно зеленый распространение К-Я
Светло зеленый - коровьего бешенства
Основные клинические критерии для постановки диагноза:
Выделяют несколько клинических форм:
Спонтанная — классическая (sCJD) Согласно современным представлениям (прионной теории), прионы при этой форме заболевания возникают в мозге спонтанно, без какой-либо видимой внешней причины. Болезнь обычно поражает людей в возрасте старше 50 лет и проявляется с вероятностью 1-2 случая на миллион жителей. Вначале проявляется в форме кратких потерь памяти, изменениями настроения, потерей интереса к происходящему вокруг. Далее симптомы деменции прогрессируют со всеми вытекающими последствиями.
Наследственная (fCJD) Болезнь возникает в семьях, где наследуется повреждение гена для прионового белка. Дефектный прионовый белок является намного более подверженным спонтанному превращению в прион. Признаки и ход болезни подобны классической форме.
Ятрогенная (1CJD) Болезнь обусловлена непреднамеренным внесением прионов в тело пациента при медицинском вмешательстве. Источником прионов ранее были некоторые лекарства, инструменты или мозговые оболочки, которые забирались у мертвых людей и использовались для закрытия раны при операциях на мозге. Признаки и ход болезни подобны классической форме. Новый вариант (nvCJD) Болезнь появилась впервые в 1995 году в Великобритании и с того момента от нее умерло не более 100 человек. Вероятнее всего, что они заразились мясными продуктами, содержащими бычьи прионы.
- психические расстройства и сенсорные нарушения,
- характерны глобальные когнитивные нарушения и атаксия.
- описано несколько случаев заболевания, дебютировавшего с корковой слепоты (вариант Heidenhain).
- эписиндром представлен также миоклоническими припадками.
- мозжечковая симптоматика выявляется в 100 %.
- Пациент страдает от всё более тяжёлой бессонницы, панических атак и фобий. Эта стадия длится в среднем 4 месяца.
- Панические атаки становятся серьёзной проблемой, и к ним присоединяются галлюцинации. Эта стадия длится в среднем 5 месяцев.
- Полная неспособность спать, сопровождаемая быстрой потерей веса. Эта стадия длится в среднем 3 месяца.
- Пациент перестаёт говорить и не реагирует на окружающее. Это последняя стадия болезни, длящаяся в среднем 6 месяцев, после чего пациент умирает.
Куру, почти не встречается в настоящее время, в связи с искоренением каннибализма. Интересно, что в 2009 году американские учёные сделали неожиданное открытие: некоторые члены племени форе, благодаря появившемуся у них в сравнительно недавнем времени новому полиморфизму гена PRNP, имеют врождённый иммунитет к куру.
В настоящее время нет ни одного средства останавливающего или тормозящего развитие прионных болезней.
Болезни из-за мутации белков. Примеры
Белки выполняют поразительное количество разнообразных функций. Мутации фактически в каждом функциональном классе белков могут вести к генетическим заболеваниям. Выяснение того, что болезнь вызвана аномалией в белке конкретного класса, часто оказывается полезным для понимания патогенеза, наследования и для разработки лечения.
В дальнейших статьях на сайте мы описываем генетические болезни, при которых играют роль белки из групп; ряд других белков из числа указанных на рисунке и болезни, связываемые с ними, описаны в разделе описаний случаев.
Можно сделать два обобщения об отношениях между местом экспрессии белка и местом болезни. Во-первых, мутация в тканеспецифичном белке чаще всего вызывает болезнь, ограниченную этой тканью, хотя могут быть вторичные эффекты в других тканях. В то же время соотношение между местом экспрессии белка и местом патологических изменений при генетической болезни в некоторых случаях может оказаться непредсказуемым.
Например, мутация в тканеспецифичном белке может первоначально приводить к аномалиям в клетках и органах, в норме совсем не экспрессирующих этот белок; забавно, но ткань, экспрессирующая мутантный белок, может остаться полностью незатронутой патологическим процессом. Эта ситуация обсуждается позже на примере ФКУ. ФКУ вызвана отсутствием активности ФАГ в печени, но высокими уровнями фенилаланина в крови повреждается не печень, а мозг (не экспрессирующий данный фермент).
Следовательно, невозможно сделать вывод о том, что болезнь в органе обязательно вызвана мутацией в гене, экспрессирующемся только в затронутом органе.
Во-вторых, хотя обслуживающие белки по определению экспрессируются в большинстве или во всех тканях, генетические болезни, вызванные их повреждениями, редко приводят к патологическим изменениям в каждой ткани. (Мутации в генах, существенных для каждой ткани, например гене актина или ДНК-полимеразы, в большинстве случаев несовместимы с живорождением.) В основном клинические эффекты мутаций в обслуживающих белках часто ограничены одной или несколькими тканями.
В принципе, существуют по крайней мере две причины ограниченного влияния мутаций в некоторых тканях. В некоторых случаях это может быть генетигеская избыточность, т.е. ситуация, когда в ткани экспрессируются другие гены с перекрывающейся биологической активностью, уменьшая влияние снижения функции мутантного гена до субклинического уровня. Кроме того, конкретная ткань может быть затронута, когда белок сильно экспрессируется именно в ней, выполняя специальные функции.
Как мы увидим позже, такую ситуацию наблюдают при болезни Тея-Сакса; мутантный фермент при этом заболевании — гексозаминидаза А, фермент экспрессируется практически всех клетках, но его отсутствие приводит к фатальной нейродегенерации, оставляя невредимыми остальные типы клеток.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

