Бета-гемолиз стрептококков проявляет себя на кровяном агаре в виде
Обновлено: 19.04.2024
Тема эта очень узконаправленная, и вопрос в том, насколько она может быть интересна широкому кругу читателей. Однако ради одних только отдаленных последствий заболеваний, вызванных S. agalactiae, ее стоит рассмотреть.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Для начала капелька истории.
Микробиологические аспекты
Согласно современной классификации S. agalactiae относится к стрептококкам группы В и является единственным представителем в указанной группе. Общим с остальными стрептококками является то, что и этот зверь плохо растет в лабораторных условиях на обычных питательных средах, и ему тоже необходимы специальные среды с 5% бараньей кровью (вопрос капризности стрептококков мы обсуждали в первой статье этого года).
Несмотря на капризы вне естественной среды обитания (коей является кишечник), внутри организма человека S. agalactiae проявляет одно из своих главных свойств – устойчивость к фагоцитозу нейтрофилами и моноцитами, что позволяет ему спокойно выживать и колонизировать доступные слизистые оболочки.
Клинические аспекты
S. agalactiae способен вызывать следующие состояния:
- неонатальный сепсис
- менингиты у новорожденных
- хориоамниониты
- аборты в поздние сроки беременности
- спонтанные аборты
- инфекции мочевыводящих путей
- эндокардиты
- сепсис (у матерей)
- инфекции кожи и мягких тканей, как осложнение после кесарева сечения
- маститы и эндометриты у родильниц
- септический артрит
Наиболее чувствительны к S. agalactiae:
- беременные женщины
- новорожденные
- больные с сахарным диабетом
- дети с низкой массой тела и дистрофией
- пожилые пациенты
- иммунокопрометированные пациенты (вне зависимости от причины этих состояний)
Давайте рассмотрим наиболее уязвимые (и актуальные) категории, а именно беременных женщин и новорожденных.
Как мы знаем, основным местом жительства S. agalactiae в организме человека является ЖКТ, еще точнее – кишечник. Считается, что именно оттуда и происходит колонизация влагалища. Правда, тут же у автора возникает логичный вопрос – как? Стрептококки ног не отрастили, данный представитель также не является исключением. Проблемы с гигиеной? В таких масштабах и в странах с нормальным доступом к воде? Ответ нашелся достаточно быстро – колонизации S. agalactiae наиболее подвержены женщины, ведущее бурную сексуальную жизнь в течение года до развития заболевания/беременности, причем ведущие ее с многочисленными непостоянными партнерами. А судя по наличию кишечной флоры в непредназначенной для ее жизни локации, практики этой самой жизни тоже весьма разнообразны. Поэтому при сборе анамнеза, если, конечно, удастся, стоит выяснять регулярность анальных практик (автор с уверенностью может утверждать, что это сложно), и если удалось выяснить этот аспект, в голове должен прозвучать звоночек о том, что пациентка оказывается в группе риска, особенно если она уже беременна. Хотя следует отметь, что роль именно полового пути до сих пор вызывает определенные споры (даже несмотря на многочисленные исследования связи с ЗППП и с носительством S. agalactiae в уретре мужчин). Но автор согласен оставить этот вопрос дискутабельным.
Когда лучше всего определять факт носительства S. agalactiae для принятия адекватных мер по профилактике вышеперечисленных состояний? На 35-37 неделе беременности. Но следует учитывать, что носительство может быть непостоянным (транзиторным или перемежающимся), что затрудняет его обнаружение в скрининговых исследованиях, то есть если при исследованиях его нет, это не значит, что его там действительно нет, особенно если дама вела активную добеременную жизнь.
Какие факторы могут влиять на наличие носительства S. agalactiae?
- Женщины старшего возраста с репродуктивными проблемами ранее
- Расовые различия – у белых женщин частота колонизации в разы меньше (автор уже не может угадать, откуда его читают, поэтому решил указать и этот фактор)
- Количество предыдущих беременностей
Можно ли проводить скрининг до беременности? Можно, но смысла в нем не будет, ибо даже фаза менструального цикла влияет на выявляемость S. agalactiae.
Какие именно осложнения вызывает носительство S. agalactiae у беременных:
- преждевременные роды
- длительный безводный период
- малый вес новорожденных
- мертворождение
А к числу факторов риска развития этих состояний относят:
- кесарево сечение
- сахарный диабет
- общее снижение иммунитета
- массивную колонизацию S. agalactiae
Учитывая вышеперечисленное, массивная колонизация родовых путей матери создает серьезные угрозы инфекции у новорожденных – почти половина новорожденных от таких матерей будет иметь массированную колонизацию кожи и слизистых оболочек S. agalactiae. Заболеет ли каждый из них? Конечно, нет. Статистика говорит, что из таких детей-носителей заболеет не более 2%, которые будут иметь следующий набор факторов риска:
- Факторы, которые непосредственно связаны с матерью:
- Самый главный – наличие S. agalactiae на слизистой шейки матки у беременных
- Инфекции, связанные с S. agalactiae у ранее рожденных детей
- Длительный безводный период
- Преждевременные роды
- Подъем температуры во время родов
- Бактериурия
- Хориоамнионит
- Факторы, связанные непосредственно с новорожденным:
- Недоношенность и малый вес при рождении
- Кесарево сечение
- Длительное инструментальное обследование внутриутробно
У детей S. agalactiae может стать причиной:
- Менингитов
- Пневмоний
- Остеомиелитов
- Сепсиса
- Заболеваний глаз
- Артритов
- Ангин
- Нейтропений
У новорожденных заболевания могут развиваться в разные сроки. Чаще всего инфекции развиваются в течение первых 12 часов (сепсис, менингит, пневмония и нейтропения). Заражение происходит во время родов или внутриутробно перед родами через разорванный плодный пузырь. Летальность при раннем развитии колоссальная – более 50% и развивается в первые сутки. Как вы помните, в таких сроках антибиотики фактически бессильны (вспоминаем правило 48 часов для бактерицидных препаратов). У половины выживших детей затем могут развиваться осложнения со стороны ЦНС (например, ДЦП).
Значительно реже инфекция раскручивается в поздние сроки (от недели до трех месяцев), и чаще всего это будет менингит. Течет более благоприятно, летальность значительно ниже, но она есть. Также могут встречаться инфекции кожи и мягких тканей, септические артриты. После выздоровления в дальнейшем половина детей наблюдаются у неврологов в связи с серьезными неврологическими осложнениями.
Отдельного упоминания требует внутрибольничное распространение S. agalactiae в случае, когда мать не является его носителем и речь идет об инфекциях, связанных с медицинскими вмешательствами. Со всеми вытекающими, которые мы обсуждали в соответствующей статье.
Что со всем этим делать?
- Скрининг – мазок из влагалища и прямой кишки. То есть активное выявление беременных женщин – носителей S. agalactiae для последующей профилактики в родах, если наличие микроорганизма подтвердится. Руководства и рекомендации говорят о проведении скрининга в сроках 35-37 недель. Положительным считается наличие S. agalactiae в любом локусе.
- Далее должна быть проведена оценка факторов риска – если они есть, то рекомендуется назначение препаратов пенициллинового ряда во время родов (по аналогии с периоперационной антибиотикопрофилактикой, с одной существенной разницей – там препараты назначаются за 30-40 минут до оперативного вмешательства, а здесь непосредственно во время родов, и в идеале внутривенно капельно для создания максимальной времязависимой концентрации в тканях и крови, которые сдержат размножение патогенна).
- Если скрининг не проводился и женщина поступила в роддом как есть, то в случае длительного безводного периода и/или подъема температуры в родах выше 38°С также назначается пенициллин в родах.
- Если на скрининге S. agalactiae не выявлен, а также нет факторов риска (лихорадка и безводный период в родах), то профилактика не проводится.
Если имеется аллергия на пенициллиновый ряд, используем клиндамицин, так как эритромицин нам не помощник в виду высочайшего уровня резистентности у почти всех стерептококков.
К сожалению, профилактика не всесильна. Конечно, она предупреждает раннее развитие инфекции, но ничего не может сделать с мертворождением, преждевременными родами или инфекциями, развивающимися в более поздние сроки. Так что вопрос инфекций, связанных с S. agalactiae, будет еще достаточно длительное время очень актуальным, и в нем, к сожалению, нет простых решений.
Стрептококки группы А. Streptococcus pyogenes. Пиогенные стрептококки. Инфекции вызываемые стрептококками. Эпидемиология стрептококков. Патогенез поражений стрептококками.
Эпидемиология стрептококков
Стрептококки группы А обнаруживают повсеместно. Они часто колонизируют кожные покровы и слизистые оболочки человека, а в холодный сезон частота носительства в носоглотке у школьников может достигать 25%. Резервуаром служит больной человек или носитель; основные пути передачи — контактный (с заносом в рот грязными руками) и воздушно-капельный, а также через инфицированные пищевые продукты, хранящиеся при комнатной температуре (например, молоко).

Инфекции вызываемые стрептококками
Патогенез поражений стрептококками
Первый этап инфекционного процесса — адгезия микроорганизма к эпителию слизистых оболочек. Основные адгезины — липотейхоевые кислоты, покрывающие поверхностные фимбрии. Не менее важную роль в прикреплении к субстратам играют гиалуронидаза, стрептокиназа и стрептодорназа.
Белок М стрептококков [от англ. mucoid, слизистый, так как колонии штаммов-продуцентов имеют слизистую консистенцию] по структуре напоминает фимбрии грамотрицательных бактерий. Белок М— основной фактор вирулентности и типоспецифтеский Аг. AT к нему обеспечивают длительную невосприимчивость к повторному заражению, однако выделяют более 80 сероваров белка М, что значительно снижает эффективность гуморальных защитных реакций. Белок М ингиби-рует фагоцитарные реакции, непосредственно действуя на фагоциты либо маскируя рецепторы для компонентов комплемента и опсонинов, адсорбируя на своей поверхности фибриноген, фибрин и продукты его деградации. Белок также проявляет свойства суперантигена, вызывая поликлональную активацию лимфоцитов и образование AT с низким аффинитетом. Подобные свойства играют существекную роль в нарушении толерантности к тканевым изоантигенам и развитии аутоиммунной патологии.
Капсула стрептококков — второй по значимости фактор вирулентности. Она защищает бактерии от антимикробного потенциала фагоцитов и облегчает адгезию к эпителию. Капсула образована гиалуроновой кислотой, аналогичной входящей в состав соединительной ткани. Соответственно капсула проявляет минимальную иммуногенную активность и не распознаётся как чужеродный агент. Интерес представляет способность бактерий самостоятельно разрушать капсулу при инвазии в ткани за счёт синтеза гиалуронидазы. Роль гиалуронидазы в патогенезе поражений изучена плохо: с одной стороны, она участвует в разрушении соединительнотканной стро-мы, с другой — имеет сходство со многими аутоантигенами и, возможно, участвует в запуске аутоиммунных реакций.
С5а-пептидаза стрептококков — третий фактор патогенности, подавляющий активность фагоцитов. Фермент расщепляет и инактивирует С5а компонент комплемента, выступающий мощным хемо-аттрактантом.
Стрептолизин О стрептококков[от англ. oxygen sensitive, чувствительный к кислороду] проявляет свойства гемолизина, разрушая эритроциты в анаэробных условиях. Проявляет иммуногенные свойства, титры AT к нему имеют прогностическое значение. Стрептолизин S [от англ. stable, устойчивый] резистентен к кислороду, не несёт антигенной нагрузки и вызывает поверхностный гемолиз на кровяных средах. Оба фермента разрушают не только эритроциты, но и другие клетки; например, стрептолизин О вызывает повреждение кардиомиоцитов, а стрептолизин S — фагоцитов, поглотивших бактерии.
Эритрогенные (пирогенные) токсины стрептококков весьма схожи с токсинами стафилококков. Имму-нологически их разделяют на три типа (А, В и С); способность к образованию токсинов детерминирована заражением бактериальной клетки умеренным фагом, несущим ген токсинообразо-вания. Эритрогенные токсины проявляют свойства суперантигенов: оказывают митогенное действие на Т-клетки, а также стимулируют секрецию макрофагами ИЛ-1 и ФНО.
Кардиогепатический токсин стрептококков синтезируют некоторые штаммы стрептококков группы А. Он вызывает поражения миокарда и диафрагмы, а также образование гигантоклеточных гранулём в печени.
Прочие экзоферменты стрептококков. Стрептокиназа (фибринолизин) активирует плазминоген, что приводит к образованию плазмина и растворению фибриновых волокон (фермент не проявляет прямой фибринолитической активности). Гиалуронидаза облегчает перемещение бактерий по соединительной ткани. Роль ДНКазы (стрептодорназа) и НАДаз изучена плохо, но выявление AT к стрептодорназе В используют в диагностике различных осложнений, вызванных стрептококками группы А. Медицинское применение нашла очищенная смесь стрептокиназы, стрепто-дорназы и других протеолитических ферментов стрептококков (стрсптокиназа-стрептодорназа), используемая для рассасывания тромбов, фибринозных и гнойных экссудатов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Первичная идентификация бактерий. Гемолиз. Гемолизины бактерий. альфа-Гемолиз. бета-Гемолиз.
Гемолиз
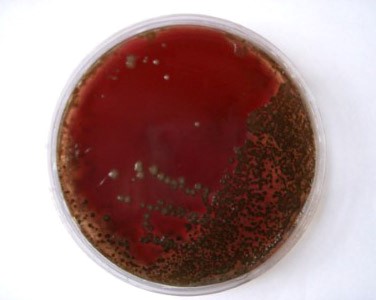
Некоторые бактерии выделяют гемолизины — вещества, разрушающие эритроциты. На КА их колонии окружают зоны просветления. Образование гемолизинов (и соответственно — размеры зон гемолиза) может быть вариабельным, и для адекватного определения гемолитической активности следует просматривать чашки с посевами против источника света (рис. 11-14). Активность гемолизинов может проявляться в полном или неполном разрушении эритроцитов.

альфа-Гемолиз
Разрушение эритроцитов может быть неполным, с сохранением клеточной стромы. Подобный феномен называют а-гемолиз. Просветление среды вокруг колоний обычно незначительно, позднее среда вокруг колоний может приобретать зеленоватую окраску. Подобный рост характерен для пневмококка, а также для группы так называемых зеленящих стрептококков.
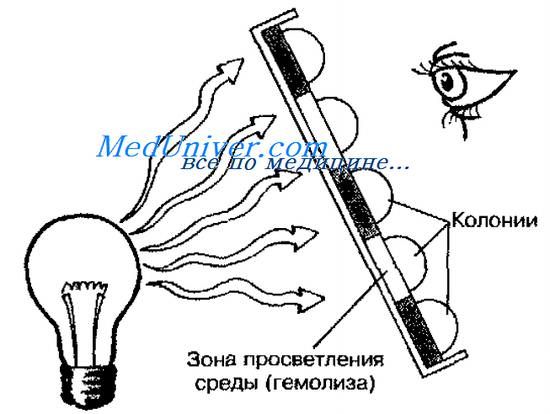
бета-Гемолиз
Гораздо большая группа бактерий вызывает полное разрушение эритроцитов, или бета-гемолиз. Их колонии окружены прозрачными зонами различного размера. Например, Streptococcus pyogenes и Staphylococcus aureus образуют большие зоны гемолиза, a Listeria monocytogenes или Streptococcus agalactiae — небольшие, диффузные зоны. Для определения гемолитической активности не следует применять шоколадный агар (ША, так как образующиеся зоны а- или бета-гемолиза не имеют характерных особенностей и вызывают одинаковое позеленение среды.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Стрептококковые инфекции вызванные Streptococcus pyogenes: диагностика, лечение, профилактика
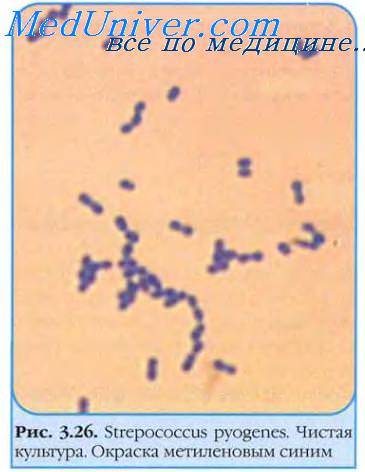
Стрептококки — грамположительные кокки, располагающиеся в микропрепарате в виде цепочки или парами. Факультативные анаэробы требовательны к питательным средам. Хорошо растут на средах с большим содержанием крови. Колонии бета-гемолитического стрептококка на кровяном агаре окружены зоной полного гемолиза, а-гемолитического стрептококка — зоной частичного гемолиза.
Дальнейшая идентификация основана на изучении биохимических и серологических (классификация Лэнсфилд) свойств возбудителя. Исследуемый материал — мазок из зева, раневое отделяемое, кровь и др.
Стрептококковые инфекции вызванные Streptococcus pyogenes
Носительство в глотке S. pyogenes протекает бессимптомно примерно у 5—30% населения. Передача инфекции осуществляется посредством аэрозольного и контактного механизмов. Заражение может произойти в любом возрасте, но чаще всего инфекция возникает у детей.
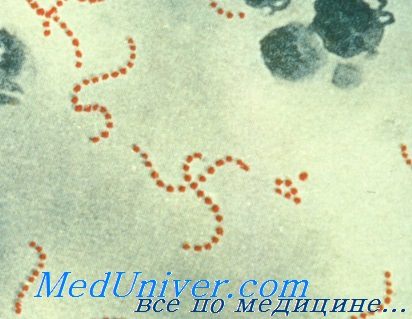
Патогенез стрептококковых инфекций вызванных Streptococcus pyogenes
S. pyogenes имеет углеводный (полисахаридный) группоспецифический антиген А (антиген Лэнсфилд) и группоспецифический белковый М-антиген, и располагающиеся на поверхности микроорганизма М-протеином (антиген), препятствующий лейкоцитарному фагоцитозу.
Антитела к М-протеину и располагающимся на поверхности микроорганизма М-протеину (антиген) формируют устойчивый иммунитет к последующей инфекции, вызванной микроорганизмами с такими же типами М-протеина. Кроме того, S. pyogenes продуцируют несколько токсинов: эритрогенный токсин (вызывает сыпь при скарлатине) и пирогенные экзотоксины А, В и С. Адгезию обеспечивают рецепторы к фибронектину.
Возбудители способны долгое время персистировать внутри клеток эпителия зева, а потому некоторые антибиотики (не проникающие внутриклеточно) не избавляют пациента от носительства.
Клинические признаки стрептококковых инфекций вызванных Streptococcus pyogenes
S. pyogenes входит в число десяти самых смертоносных возбудителей в мире. Он вызывает три вида патологических состояний:
• Инфекционное заболевание. S. pyogenes — самая частая причина развития бактериального фарингита. Кроме того, он вызывает рожу, импетиго, целлюлит, раневые инфекции и реже некротизирующий фасцит и пневмонию. Иногда развивается септицемия, приводящая к метастазирующим инфекциям (остеомиелит). Инфекционный процесс, обусловленный S. pyogenes, характеризуется острым началом с деструкцией поражённых тканей и быстро прогрессирующим течением.
Неотъемлемой частью патогенеза, развивающегося выраженного интоксикационного синдрома, является способность S. pyogenes продуцировать токсины.
• Токсин — индуцированные синдромы, протекающие на фоне инфекционного заболевания. Инфекционное заболевание, связанное с S. pyogenes, может протекать в виде генерализованного процесса или, оставаясь локализованным, сопровождаться системными проявлениями, связанными с действием экзотоксинов.
Например, действие эритрогенного токсина обусловливает возникновение сыпи при скарлатине, а пирогенные токсины становятся причиной стрептококкового шока, часто приводящего к смерти пациента вследствие полиорганной патологии. • Постинфекционные аутоиммунные заболевания. Перекрёстное взаимодействие антител к антигенам бактерии и структурным компонентам собственных тканей организма иногда приводит к развитию аутоиммунных заболеваний: ревматической лихорадке, гломерулонефриту или узловатой эритеме.
Достаточно редкая в странах с развитой рыночной экономикой ревматическая лихорадка — частая причина смерти и инвалидизации населения в регионах с низким уровнем жизни и нищетой.
Профилактика стрептококковых инфекций вызванных Streptococcus pyogenes
Распространение S. pyogenes в хирургических отделениях и родильных домах происходит достаточно быстро. Именно поэтому больных и носителей стрептококковой инфекции нужно немедленно изолировать в отдельные боксы на срок не менее 48 ч от начала проведения эффективной антибиотикотерапии. Своевременное полноценное лечение позволяет избежать развития вторичных аутоиммунных заболеваний (ревматическая лихорадка).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В этой статье мы поговорим о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Почему за исключением S. pyogenes? Да потому что данного возбудителя мы рассмотрели в отдельной статье. Кроме того, мы уже говорим практически на одном языке, а потому можем себе позволить поговорить о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Микробиологические аспекты
Для начала разберемся с классификациями, чтобы понимать принципы разнесения стрептококков по группам. Так сложилось, что для классификации стрептококков используются их фенотипические характеристики, а именно характеристики по гемолитическим свойствам:
- β-гемолитические стрептококки вызывают полный гемолиз эритроцитов питательной среды с формированием прозрачной зоны вокруг колоний на кровяном агаре
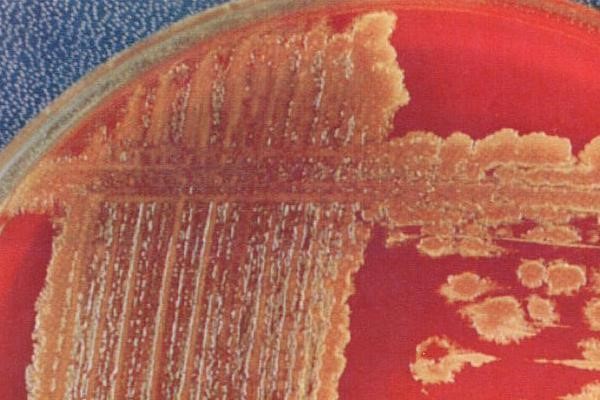
- α-гемолитические (зеленящие) образуют зеленоватый ореол вокруг колоний в результате неполного разложения гемоглобина
- γ-гемолитические по-другому именуются негемолитическими, то есть ничего никуда из крови не разлагают.
Собственно, почему кровь? Дело в том, что стрептококки крайне требовательны к питательным средам и к условиям, в которых их растят. И чтобы они выросли, в питательные среды (в основном, жидкие) необходимо или добавлять мясной экстракт, или использовать коммерческие питательные среды с добавлением крови барана, или 5%-й кровяной агар – и все это с большим количеством дополнительных компонентов. Для определения характера гемолиза традиционно используется среда с 5%-й дефибринированной кровью барана.
Подобное разделение по группам и типам гемолиза является решающим для деления стрептококков, имеющих медицинское значение, позволяя разделить патогенные и условно-патогенные микроорганизмы. Про патогенные мы уже поговорили ранее, теперь будем вести разговор о более обширной группе условно-патогенных представителей и начнем со стрептококков групп A, C, D и F, оставив для отдельного разговора группу В и единственного ее представителя – S. agalactiae.
Основными характеристиками представителей этих групп является то, что все они:
- Обладают β-гемолитической активностью
- Относятся к нормальной микрофлоре человека и животных
- Могут вызывать оппортунистические инфекции в различных локализациях
- Fc-антиген, способный взаимодействовать с Fc-фрагментом IgG, тем самым угнетая систему комплемента и подавляя активность фагоцитов. Кроме того, он же активирует выработку аутоиммунных антител, которые в дальнейшем участвуют в развитии иммунного воспаления;
- Р-антиген, обладающий иммуносупрессивной активностью и являющийся общим для всех стрептококков. Он подавляет выработку антител и усиливает реакции гиперчувствительности замедленного типа.
Кроме того, стрептококки имеют такой фактор патогенности, как М-протеин, который нарушает фагоцитарную активность путем маскировки рецепторов для комплемента, что очень затрудняет борьбу с этими возбудителями.
Клинические аспекты
1. Streptococcus dysgalactiae – объединяет двух представителей Streptococcus dysgalactiae subsp. dysgalactiae и Streptococcus dysgalactiae subsp. equisimilis. Первый живет на животных (и вызывает маститы у коров, на человеке в качестве возбудителя пока не ловили), второй на человеке – в верхних дыхательных путях и влагалище – и может быть причиной менингита, септических артритов и инфекций кожи (при условии наличия соответствующей симптоматики и в отсутствии других вероятных возбудителей).
2. Стрептококки группы Anginosus (S. anginosus, S. constellatus, S. intermedius) относятся к представителям нормальной флоры человека. Обрести зубы и стать возбудителями инфекции их могут заставить травмы, оперативные вмешательства, сахарный диабет, онкологические заболевания и иммунодефициты различной этиологии. Сами по себе на человека не бросаются и обнаружение оных вне клинической картины истребления не требует.
- S.anginosus – в норме обитает в полости рта, верхних дыхательных путях и влагалище. При патологии может быть высеян из урогенитальной и желудочно-кишечной локализаций.
- S. constellatus – в норме живет в верхних дыхательных путях и ЖКТ. При патологических процессах могут быть обнаружены где угодно.
- S. intermedius – в норме обитает в полости рта и верхних дыхательных путях. При патологических процессах в основном высевается из мозга, из крови при эндокардитах и из печеночных абсцессов (проще говоря оттуда, где в норме все должно быть стерильно).
3. S. equi клинического значения не имеет, так как является зоонозом и вызывает ветеринарные проблемы у коров, лошадей, морских свинок, овец и коз. Иногда – при употреблении зараженных молочных продуктов – может быть обнаружен у людей, больных нефритом.
4. S. canis, как понятно из названия, выделяют от собак. У людей могут вызывать инфекции мягких тканей, пневмонии, сепсис, остеомиелит.
5. S. iniae – обнаруживается у дельфинов и рыб. А также у людей, занятых на обработке замороженной рыбы. Крайне редко вызывает заболевание (описаны всего несколько случаев), хорошо лечится бета-лактамами и макролидами.
6. И несколько чисто зоонозных представителей, не имеющих медицинского значения, но иногда сеющихся с людей, которые за этими животными ухаживают или лечат:
- S. porcinus – вызывает абсцессы глотки свиней, пневмонию и аборты;
- S. didelphis – вызывает инфекции кожи, печени, легких и селезенки у опоссумов;
- S. phocae – выделяется у морских котиков при пневмонии у оных.
Как мы увидели, в большинстве своем перечисленные возбудители относятся к нормальной микрофлоре верхних дыхательных путей, кожи, ЖКТ и урогенитального тракта, а чтобы они вызвали заболевание, во внутреннюю среду организма должно проникнуть очень большое количество оных, при этом иммунная система должна быть подавлена тем или иным образом. Чаще всего такую роль играют медицинские вмешательства (инъекции, операции, катетеризация сосудов, гемодиализ и т. п.) на фоне тяжелых основных или сопутствующих заболеваний. Тогда стрептококки способны вызвать инфекции кожи и мягких тканей, верхних дыхательных путей, эндокардиты и сепсис, инфекции урогенитального тракта, при этом строгой локализации процесса соответствующим возбудителем уже не будет, а будет инфекция, связанная с медицинским вмешательством.
Что делать?
Как можно раньше провести бактериологическую диагностику и главным в ней будет правильная техника взятия биологического материала, чтобы точно исключить его контаминацию ни в чем не повинными мирными соседями, просмотрев истинного возбудителя. Техника взятия материала и правила транспортировки в лабораторию подробно расписаны здесь.
Чем лечить?
Этот вопрос мы можем задать только тогда, когда точно понимаем, что именно вышеуказанные зверушки являются возбудителями и никто за ними не прячется. Хорошая новость в том, что стрептококки до сих пор сохранили высокую чувствительность к бета-лактамам вообще и к пенициллинам в частности, то есть лечить их дешево. Плохая новость в том, что фактически утеряна чувствительность к макролидам, и поэтому они не могут быть препаратами выбора – это обязательно надо учитывать при назначении стартовой терапии.
Кроме того, стрептококки продолжают демонстрировать высокую чувствительность к ванкомицину, но в виду неоднозначности самого препарата в плане безопасности его применения, им тоже не следует злоупотреблять и включать его в схему лечения только в случае наличия аллергии к пенициллиновому ряду.
Итак, мы закончили краткое рассмотрение представителей стрептококков групп A, C, D, F и G, и нам осталось рассмотреть только одного представителя из группы В, а именно S.agalactiae, чем мы и займемся в следующей статье.
Читайте также:

