Бетадин от золотистого стафилококка
Обновлено: 25.04.2024
Проблема вагинальных инфекций знакома практически каждой женщине. Одно из первых мест в структуре заболеваний женских половых органов в настоящее время занимает бактериальный вагиноз, который, по данным литературы, диагностируется у 30–57,6% женщин репродуктивного возраста [1].
Особое коварство данного патологического процесса состоит в том, что он может спровоцировать различные осложнения при планировании ребенка и во время беременности, да и просто причиняет женщине ежедневные бытовые неудобства. Поэтому вопрос эффективного лечения данной патологии весьма актуален. Сегодня на рынке представлен широкий спектр препаратов для лечения вагинальных инфекций. Но далеко не все из них одинаково эффективны [3].
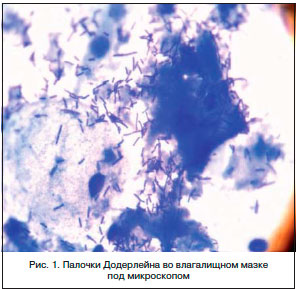
В терапии вагинальных инфекций традиционно применяют две группы препаратов: антибактериальные и антисептические. Антибиотики влияют только на бактерии, не включая вирусы (герпес, вирус папилломы человека) и других представителей патогенной флоры. К тому же антибиотики не создают условий для развития лактобактерий – типичных представителей нормального биоценоза влагалища (рис. 1). Кроме того, залогом успешного лечения является нормализация pH среды влагалища.
Бетадин ® выпускается в виде вагинальных свечей и содержит 200 мг поливинилпирролидона йода, который давно известен своим бактерицидным действием. Высвобождаясь из комплекса с поливинилпирролидоном при контакте с кожей и слизистыми, йод образует с белками клетки бактерий йодамины, коагулирует их и вызывает гибель микроорганизмов. Оказывает бактерицидное действие на грамположительные и грамотрицательные бактерии (за исключением Mycobacterium tuberculosis), анаэробы. Также активен в отношении грибов, вирусов, простейших. Суппозитории изготовлены на водорастворимой основе и при соприкосновении с кожей и слизистыми не оказывают раздражающего действия. Кроме того, находящийся в комплексе с поливинилпирролидоном йод высвобождается постепенно и равномерно.
По сравнению с другими антисептиками Бетадин ® обладает рядом существенных преимуществ:
- эффективнее подавляет размножение микроорганизмов даже в большом разведении;
- физико-химические условия в очаге воспаления мало влияют на действие препарата Бетадин ® ;
- активен в отношении вирусов герпеса и папилломавирусной инфекции;
- нормализует кислотность вагинальной среды и создает условия для быстрого восстановления нормальной микрофлоры влагалища, что является важным фактором для отсутствия рецидивов вагинальной инфекции после лечения.
Препарат отлично зарекомендовал себя в лечении и профилактике инфекций женской половой сферы. Причем начать лечение можно сразу после визита к врачу, не дожидаясь результатов анализов, т. к. Бетадин ® эффективен практически при всех вагинальных инфекциях. А в повседневной жизни женщины препарат обеспечивает профилактику инфекций, передающихся половым путем.
Более того, данный препарат достаточно удобен, поскольку его можно использовать и во время менструации, и в первом триместре беременности, когда лечение воспалений приобретает особую актуальность.
С целью оценки эффективности и переносимости препарата Бетадин ® при лечении бактериального вагиноза нами было проведено специальное исследование.
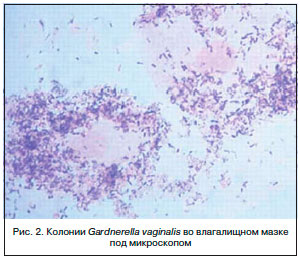
Бактериальный вагиноз (другие названия: вагинальный дисбиоз (дисбактериоз)) – это инфекционный невоспалительный синдром, характеризующийся резким снижением или отсутствием лактофлоры и ее заменой на полимикробные ассоциации анаэробов и Gardnerella vaginalis (рис. 2), концентрация которых достигает 109–1011 КОЕ/мл вагинального отделяемого [1, 2, 4].
Особенностью микрофлоры влагалища является ее изменчивость под действием как экзогенных, так и эндогенных факторов. На микроценоз оказывают влияние физиологические и гормональные изменения (пубертатный период, беременность, менопауза), фазы менструального цикла, различные нарушения менструальной функции, снижение активности иммунных факторов вследствие перенесенных заболеваний, нерегулярного и несбалансированного питания, дисбактериоза кишечника, гиповитаминоза, хронического стресса. Большое значение имеют степень половой активности, использование антибактериальных препаратов, гормонотерапия, хирургические вмешательства. При бактериальном вагинозе, развившемся в результате действия одного или сочетания перечисленных факторов, происходит элиминация лактобацилл, сопровождающаяся колонизацией влагалища строгими анаэробами: Fusobacterium, Mobiluncus, Peptostreptococcus и Gardnerella vaginalis [3, 5].
Факторами риска развития бактериального вагиноза являются:
- ранее перенесенные заболевания половых органов инфекционно-воспалительного характера;
- длительный и бесконтрольный прием антибактериальных препаратов;
- наличие различных нарушений менструального цикла;
- наличие фоновых процессов шейки матки;
- длительное применение внутриматочной контрацепции;
- применение комбинированных оральных контрацептивов.
Нами были обследованы 142 пациентки в возрасте от 18 до 47 лет с клиническими признаками бактериального вагиноза. Диагноз был установлен при помощи микроскопии влагалищных мазков, бактериологического исследования цервикальной слизи, определения количества лактобактерий, обследования на инфекции, передающиеся половым путем, методами полимеразной цепной реакции (ПЦР), реакции иммунной флюоресценции (РИФ).
В качестве основного симптома при бактериальном вагинозе выступали обильные выделения из половых путей белого или серого цвета (93%), иногда пенящиеся (38%), часто с неприятным запахом (76%). Выделения усиливались перед менструацией или после полового акта. Пациентки с длительным существованием процесса (16%) отмечали желто-зеленую окраску влагалищных выделений, а также их густую, тягучую, липкую консистенцию. При осмотре в зеркалах выделения равномерно распределялись по стенкам влагалища и влагалищной части шейки матки и легко удалялись со слизистой марлевым тампоном.
Другие жалобы – на зуд (46%), нарушения мочеиспускания (18%), боли во время полового акта (7%) – встречались гораздо реже. У 14% женщин с бактериальным вагинозом жалобы отсутствовали. Диагноз у последних был поставлен на основании данных микроскопии влагалищных мазков и результатов бактериологического исследования цервикальной слизи.
Таким образом, в зависимости от наличия жалоб бактериальный вагиноз подразделяется на два варианта: бессимптомный и с клиническими проявлениями.
- При бессимптомном течении заболевания отмечается отсутствие клинических проявлений наряду с положительными результатами лабораторных анализов.
- При варианте с выраженными клиническими проявлениями отмечаются длительно существующие (в течение 2–3 лет) выделения – обильные, жидкие, белого или сероватого цвета, с неприятным запахом гнилой рыбы. Характерно частое сочетание с патологическими процессами шейки матки (псевдоэрозией, лейкоплакией, эндоцервицитом, эндометриозом) и рецидивирующее течение. Нередко возникают нарушения менструального цикла по типу олигоменореи или неполноценной второй фазы цикла.
Лечение бактериального вагиноза проводится в два этапа и сводится к:
- селективной деконтаминации (выборочное устранение возбудителей заболевания), для чего назначаются препараты с антимикробным действием, направленные на снижение количества анаэробных микроорганизмов;
- восстановлению нормального или максимально приближенного к норме микробиоценоза влагалища с помощью эубиотиков. Микробиоценоз – микроорганизмы и продукты их жизнедеятельности, которые в нормальном состоянии находятся на слизистых влагалища [6].
Лечение бактериального вагиноза в настоящем наблюдении проводилось согласно протоколу, представленному фармацевтической компанией Egis. Всем пациенткам назначался Бетадин ® по 1 свече в сутки во влагалище в течение 14 дней. Эффективность терапии оценивали на основании клинических данных и результатов лабораторных исследований.
До лечения при микроскопии влагалищного мазка количество лейкоцитов колебалось от 8 до 22 в поле зрения, что соответствовало второй (43%) и третьей (57%) степени чистоты влагалищного содержимого. На этом фоне в бактериальных посевах у 37% женщин была выявлена Candida albicans, у 19% – Staphylococcus epidermidis в концентрации 106 КОЕ, у 17% – Enterococcus fecalis и у 23% – Staphylococcus saprophyticus (104 КОЕ). В 67% наблюдений в большом количестве были выявлены ключевые клетки (гарднереллы), в 11% определялись условно-патогенные штаммы уреаплазмы, а в 6% – микоплазмы, выявленные методами ПЦР и РИФ. Лактобактерии отсутствовали у 27%, в концентрации 102 КОЕ обнаружены у 22%, 103 КОЕ – у 36%, 104 КОЕ – у 13% и только у 2% пациенток лактобактерии были выявлены в концентрации 105 КОЕ.
После проведенного лечения при первом и втором контрольных обследованиях методом РИФ мы не выявили условно-патогенные микроорганизмы.
После проведенной терапии уже на втором визите жалоб не предъявляла ни одна пациентка. Анализ лабораторных данных показал, что через 1 нед. после проведенной терапии только у 2 пациенток был высеян Staphylococcus epidermidis, а при втором контрольном визите у всех женщин отсутствовала условно-патогенная флора и был отмечен рост титра лактобактерий.
После курса лечения препаратом Бетадин ® проводили терапию эубиотиками, на фоне которых нормализовался биоценоз влагалища, титр лактобактерий при повторном исследовании был в пределах нормы.
Через 4 нед. после проведенной терапии у 96% пациенток пейзаж влагалищного мазка нормализовался: количество лейкоцитов было 2–6 в поле зрения. В бактериальных посевах после лечения условно-патогенная флора не выявлялась.
До лечения ни в одном наблюдении не был выявлен нормальный титр лактобактерий. Независимо от схемы лечения, с применением эубиотиков или без них, при контрольном исследовании у 69% женщин титр лактобактерий был в пределах нормы.
Через 1 мес. после терапии жалобы на умеренные выделения из половых путей, не сопровождавшиеся зудом и неприятным запахом, предъявляли лишь 5% женщин. Кроме того, в процессе терапии препаратом Бетадин ® пациентки в подавляющем большинстве наблюдений не отмечали каких-либо побочных реакций, связанных с применением свечей, в виде неприятных ощущений в области наружных половых органов и влагалища (жжения, зуда, отека и т. д.).
Таким образом, проведенные нами исследования показали высокую эффективность препарата Бетадин ® при лечении бактериального вагиноза и смешанной урогенитальной инфекции. У 100% пациенток через 1 мес. после терапии полностью исчезли клинические симптомы бактериального вагиноза и у 96% нормализовался микробный пейзаж влагалища.
Успешное лечение бактериального вагиноза зависит от правильной диагностики и патогенетически обоснованной терапии (т. е. лечения, воздействующего на все звенья процесса развития дисбактериоза влагалища) [7]. Для предупреждения возникновения новых эпизодов бактериального вагиноза рекомендуется использование вагинальных антисептиков (свечи Бетадин ® ) и пробиотиков.
Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.
Владелец регистрационного удостоверения:
Произведено:
По лицензии:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Бетадин ®
Суппозитории вагинальные торпедообразные, гомогенные, темно-коричневого цвета.
Вспомогательные вещества: макрогол 1000 - 2800 мг.
7 шт. - блистеры (1) - пачки картонные.
7 шт. - блистеры (2) - пачки картонные.
Фармакологическое действие
Оказывает антисептическое, дезинфицирующее, противогрибковое и антипротозойное действие. Блокирует аминогруппы клеточных белков. Обладает широким спектром противомикробного действия. Активен в отношении бактерий (в т.ч. кишечной палочки, золотистого стафилококка), грибов, вирусов, простейших.
Высвобождаясь из комплекса с поливинилпирролидоном при контакте с кожей и слизистыми оболочками, йод образует с белками клетки бактерий йодамины, коагулирует их и вызывает гибель микроорганизмов.
Оказывает быстрое бактерицидное действие на грамположительные и грамотрицательные бактерии (за исключением Mycobacterium tuberculosis).
Фармакокинетика
При местном применении почти не происходит абсорбции йода со слизистой оболочки.
Показания активных веществ препарата Бетадин ®
Острый или хронический вагинит (смешанная, неспецифическая инфекция); бактериальный вагиноз (вызванный Gardnerella vaginalis); кандидоз; инфекция Trichomonas vaginalis; инфекции влагалища после терапии антибиотиками или стероидными препаратами; профилактика перед хирургическими или диагностическими вмешательствами во влагалище.
Открыть список кодов МКБ-10| Код МКБ-10 | Показание |
| A59 | Трихомоноз |
| B37.3 | Кандидоз вульвы и вагины |
| N76 | Другие воспалительные болезни влагалища и вульвы |
| N77.1 | Вагинит, вульвит и вульвовагинит при инфекционных и паразитарных болезнях, классифицированных в других рубриках |
| N89.8 | Другие невоспалительные болезни влагалища |
| Z29.8 | Другие уточненные профилактические меры |
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Интравагинально 1-2 раза/сут. Длительность лечения устанавливают индивидуально.
Не следует прекращать применение суппозиториев во время менструации.
Побочное действие
Местные реакции: редко - зуд, гиперемия, реакции повышенной чувствительности.
В редких случаях применение возможно развитие реакции гиперчувствительности, например, контактный дерматит с образованием псориазоподобных красных мелких буллезных элементов. При возникновении таких явлений применение препарата следует прекратить.
Длительное применение повидон-йода может приводить к абсорбции значительных количеств йода. В некоторых случаях описано развитие вызванного йодом гипертиреоза, преимущественно у пациентов с ранее имевшимся заболеванием щитовидной железы.
Противопоказания к применению
Повышенная чувствительность к йоду; нарушение функции щитовидной железы (узловой коллоидный зоб, эндемический зоб и тироидит Хашимото, гипертиреоз); острые заболевания щитовидной железы; аденома щитовидной железы; герпетиформный дерматит Дюринга; перед и во время применения радиоактивного йода для лечения карциномы щитовидной железы или сцинтиграфии; беременность, период грудного вскармливания; девочки, не достигшие подросткового возраста.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение при нарушениях функции почек
Осторожность следует соблюдать при регулярном применении препарата у пациентов с ранее диагностированной почечной недостаточностью.
Применение у детей
Применение повидон-йода разрешено с периода новорожденности, но с учетом формы выпуска - суппозитории вагинальные - не рекомендуется применять у девочек в возрасте до 8 лет и следует соблюдать осторожность при введении девственницам.
Применение у пожилых пациентов
С осторожностью применять у пациентов пожилого возраста во избежание риска обострения хронических заболеваний.
Особые указания
В связи с окислительными свойствами повидон-йода его следы могут приводить к ложноположительным результатам некоторых типов исследований для обнаружения скрытой крови в кале, а также крови или глюкозы в моче.
Во время применения повидон-йода может снизиться поглощение йода щитовидной железой, что может повлиять на результаты некоторых диагностических исследований (например, сцинтиграфии щитовидной железы, определения белково-связанного йода, измерений с применением радиоактивного йода), а также может взаимодействовать с препаратами йода, применяемыми для лечения заболеваний щитовидной железы. Для получения неискаженных результатов сцинтиграфии щитовидной железы после длительной терапии повидон-йодом рекомендуется выдержать достаточно длительный период времени без этого препарата.
При нарушении функции щитовидной железы, препарат может применяться только по указанию врача. Если во время курса лечения возникнут симптомы гипертиреоза, необходимо проверить функцию щитовидной железы.
Осторожность следует соблюдать при регулярном применении препарата у пациентов с ранее диагностированной почечной недостаточностью.
Следует избегать регулярного применения препаратов, содержащих повидон-йод, у пациентов, получающих препараты лития.
Лекарственное взаимодействие
Несовместим с другими дезинфицирующими и антисептическими средствами, особенно содержащими щелочи, ферменты и ртуть.
Совместное применение повидон йода и перекиси водорода, а также ферментных препаратов, содержащих серебро и таулоридин, для обработки ран, а также антисептических препаратов, приводит к взаимному снижению эффективности.
В присутствии крови бактерицидное действие может уменьшаться, однако при увеличении концентрации активного вещества, бактерицидная активность может быть увеличена.
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
Сначала повторим общеизвестные факты: S.aureus относится к грамположительным коккам и являются чуть ли не основной причиной большого количества инфекций кожи и мягких тканей, а так же ведущей причиной послеоперационных раневых инфекций.
Выделяют следующие разновидности золотистого стафилококка:
- Дикий S.aureus
- MSSA – метициллин-чувствительные стафилококки
- MRSA – метициллин-резистентные, которые обладают устойчивостью ко всему бета-лактамному ряду, сохраняя клинически важную чувствительность к ванкомицину, линезолиду и тигециклину
- VRSA и VISA – ванкомицин-устойчивые штаммы, к счастью, крайне редко встречающиеся и в основном наблюдающиеся в отделениях онкогематологии научно-исследовательских центров у пациентов, проходящих курс полихимиотерапии с последующей трансплантацией костного мозга
И сейчас обсудим первые три более подробно, так как именно они являются той причиной, ради которой повторно поднята данная тема, в том числе и по просьбам читателей (за что выражаем отдельную признательность).
Первое, что необходимо не просто запомнить, а буквально зазубрить наизусть – золотистый стафилококк, он же S.aureus, является нормальным жителем на неповрежденной коже и слизистых оболочках. Еще раз – нормальным, но только на неповрежденной коже и вне зависимости от антибиотикочувствительности пойманных экземпляров. Если кожа по тем или иным причинам поражается (например, сахарным диабетом) или повреждается, стафилококк тут же из милого соседа превращается в злейшего врага. Все как у людей – стоит дать слабину, и ближайшие соседи начнут добивать с ласковой улыбкой.
Таким образом, когда вы получаете результат микробиологического исследования образца, взятого с кожи (или из носоглотки), и видите там золотистого стафа, то должны понимать, кто перед вами, и насколько этот кто-то имеет отношение к текущему процессу.
Второе: если клиника отсутствует, а стафилококк посеялся, надо сделать что? Правильно, повторить посев еще раз. Золотистый стафилококк – это один из немногих микробов, чье наличие в отделяемом материале надо проверять дважды. Единственное исключение – это кровь, взятая непосредственно из сосудистого русла, чаще всего из вены. Наличие стафилококка в крови является поводом к немедленному назначению антибактериальной терапии, так как прямо указывает на наличие инфекции кровотока, а уж какого она генеза, спонтанного или ятрогенного, разбираться будете позже. Во всех остальных ситуациях проводится пересев с тщательным соблюдением техники забора материала (со стенок раны, а не гной, состоящий из дохлых нейтрофилов и нападавших сверху стафилококков) и правил асептики и антисептики, чтобы собственными стафилококками с кожи вновь забранный материал не контаминировать.
Чтобы понять, друг перед нами или враг, познакомимся со стафилококками более подробно.
- Дикий S.aureus, не видавший ни одного антибиотика, выглядит так
.jpg)
.jpg)
И нет, автор не сошла с ума – резистентность к ванкомицину у природных диких золотистых стафилококков – совершенно нормальное явление. Более того, попытка лечить такого возбудителя ванкомицином считается грубейшей ошибкой и закончится полным провалом в силу природной устойчивости к данному препарату. Это третье, о чем помнить необходимо.
Где мы встречаем таких S.aureus чаще всего? В носоглотках грудных младенцев или в их же кале, если придумали посеять. Почему? Потому что это представитель нормальной микрофлоры кожи, и ребенок сглатывает то, что живет в его носоглотке или слизывает с кожи матери. Надо лечить? В данной ситуации – ни в коем случае, иначе побьете нормальную микрофлору кожи и слизистых, и если очень повезет, то для ребенка это пройдет без последствий, но, скорее всего, получим стафилококка, вооруженного пенициллиназами, или MSSA. Повторимся еще раз – только в случае отсутствия клинической картины можно принимать такого рода решения. Во всех иных случаях необходима антибактериальная терапия, причем на длительный (до 28 суток) период времени.
.jpg)
.jpg)
При каких состояниях мы можем увидеть подобных возбудителей?
- Практически при всех инфекциях кожи и мягких тканей
- При внутрибольничных раневых инфекциях
- При диабетической стопе
- У внутривенных наркоманов
Типичным для клинической картины будет довольно агрессивное течение заболевания с яркими клиническими проявлениями ввиду того, что именно такой вид стафилококка обладает определенным набором ферментов, очень быстро расплавляющим окружающие ткани с образованием полостей и большим количеством гнойного отделяемого.
на антибиотикограмме будет выглядеть приблизительно так, оксациллин-резистентный, но ванкомицин-чувствительный (хотя при таком значении МПК уже возможны варианты)
.jpg)
Когда встречается? Все многообразие ятрогенных ВБИ к вашим услугам – почти все раневые инфекции и послеоперационные гнойные осложнения вне зависимости от их локализации. Повторимся в очередной раз – руки надо мыть, и мыть правильно. А еще закрывать маской не только рот, но и нос всем, кто хоть как-то касается открытых ран вне зависимости от причин их образования, так как стоит ране появиться, как стафилококк мгновенно превращается в зверя, осложняющего течение любого послеоперационного периода, особенно после операций, связанных с установками импланта. Более подробно о лечении предлагаем почитать в первой статье.
- В последнем пункте автор, по идее, должна была бы предложить испугаться самыми страшными ванкомицин-резистентными стафилококками и предложить схватиться за голову, но глядя на следующий набор антибиотикограмм, мы предлагаем посмотреть на то, что обычно сваливается с рук медицинского персонала в раны пациентов или контаминирует их биологический материал, который собран или хранится неправильно. Слава микробиологии, что подобные возбудители для пациентов, которые сохранили хоть какие-то остатки неспецифического иммунитета, не опасны, так как проходя эволюционные пути борьбы с ванкомицином, они почти полностью теряют факторы вирулентности. Но так как такие находки – это будни любой микробиологической лаборатории, то и вы о них тоже должны иметь представление. Уточним еще раз – это результаты посевов при полном отсутствии клинической картины бактериальной инфекции.
.jpg)
.jpg)
.jpg)
.jpg)
А теперь, тихо-тихо прошепчем, что иногда так может выглядеть приболевший микробиологический анализатор, который все, что в него не поставят, может определять как подобную страшную зверюгу. Хотя у вашего анализатора может быть какая-то своя болячка, и эти болячки лучше все-таки знать. Именно такого рода антибиотикограммы, как ничто другое наглядно показывают необходимость развития клинического мышления для умения отличать истинного возбудителя от контаминанта или нормального жителя человеческого организма, а также необходимости понимания, как работают методы микробиологической диагностики и варианты их ограничения.
Подведем краткие итоги нынешнего разговора:
- Стафилококк на неповрежденной коже и в носоглотке является нормальным представителем микромира, и лечить его не надо, более того, это может наносить прямой вред (как минимум кошельку)
- Существует целый перечень профессий, где носительство стафилококка строго нежелательно, и именно для этого проводятся контролирующие посевы среди медицинского персонала и работников пищевой отрасли
- Необходимо уверенно различать не только дикие и внутрибольничные штаммы, но и градацию по MRSA и MSSA, так как это прямо влияет на решение о применении конкретных препаратов при проведении эрадикационной терапии
- Антибиотикотерапия стафилококковых инфекций должна быть длительной, а не прерываться через 7-10 дней, даже если пациент демонстрирует положительную динамику. Недобитые золотистые стафилококки умеют метастазировать. Более подробно смотрим предыдущую статью
- Так как S.aureus занимает одно из ведущих мест в структуре внутрибольничных инфекций, особенно связанных с установкой имплантов, правила асептики и антисептики при работе с оными должны соблюдаться максимально жестко, иначе можно повторить дело Хабаровского кардиоцентра
Надеемся, что наш сегодняшний разговор был полезен и прояснил наиболее частые вопросы, связанные с микробиологическими особенностями S.aureus.
История применения антибактериальных препаратов переживает определенную цикличность. В доантибиотиковую эру среди возбудителей тяжелых инфекций преобладали Гр(+) возбудители, потом пришли антибиотики, и во время второй мировой основными возбудителями стали Гр(-) возбудители (по принципу «свято место пусто не бывает), но тут Гр(+) опять подняли голову, т.к. выяснилось, что свыше 80% штаммов стафилококков продуцируют пенициллиназу и разрушают бензилпенициллин и аминопенициллины.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Staphylococcus aureus делится на две группы – мецитиллинчувствительные (MSSA) и мецитиллинрезистентные (MRSA):
1. MSSA вырабатывают беталактамазы – пенициллиназы, которые разрушают незащищенные пенициллины, но сохраняют высокую чувствительность к оксациллину и цефазолину. Кроме того они обладают лейкоцидином Пантона-Валентайна, который вызывает распад тканей практически в любом очаге, что служит косвенным подтверждением стафилококковой инфекции еще до получения микробиологического анализа.
2. MRSA в свою очередь подразделяются на госпитальные, которые характеризуются тем, что:
- являются полирезистентными, т.е. нечувствительные ко всему классу бета-лактамов, включая карбапенемы;
- у них отсутствует лейкоцидин Пантона-Валентайна, поэтому реже возникают деструктивные процессы (пациенты просто тихо и долго гниют, в отличие от инфекций, вызванных дикими штаммами)
- вызывают нозокомиальные пневмонии, инфекции кожи, ран, сепсис, бак эндокардит протезированных клапанов, инфекции имплантов.
и внебольничные MRSA, характеризующиеся:
- полирезистентностью;
- наличием лейкоцидина Пантона-Валентайна, благодаря которому они более агрессивны и вызывают некротизирующие заболевания кожи, сосудов и легких (особенно четко роль лейкоцидина Пантона-Валентайна видна в развитии некротизирующей пневмонии);
- в основном характерны для наркоманов и лиц без определенного места жительства.
Факторами риска MRSA инфекций являются
- назофарингеальная колонизация MRSA;
- лечение бета-лактамами (выбивается чувствительная флора и ее место занимает MRSA;
- нахождение в ОРИТ;
- повреждение кожи при длительной госпитализации более 2-х недель (п/о раны, ожоги, язвы);
- внутрисосудистые катетеры и импланты;
- мед. работники и члены их семей (соседи – реаниматологи или хирурги, если семьи между собой общаются)
Для чего мы все это вспоминаем? Дело в том, что основные проблемы, связанные со стафилококковой инфекцией, это:
- Широкое распространение в медицине и как следствие недооценка проблемы.
- Назначение эмпирической терапии без учета риска MRSA, и как следствие – отсрочка адекватной терапии, что в случае золотистого стафилококка в прямом смысле смерти подобно.
- Клиническая эффективность антибиотика in vitro не всегда тоже самое что in vivo (мы все таки отличаемся от чашки Петри).
- Неадекватное дозирование и длительность терапии (недостаточные дозы и короткие курсы) – отсюда осложнения и рецидивы.
- Высокая летальность при неадекватной терапии
Проводить антистафилококковую терапию меньше 3-х, а то и 4-х недель нельзя, так как для этого возбудителя характерно развитие метастатических очагов и весь процесс пойдет по новому, только с учетом еще и того, что возбудитель окажется резистентным к ранее проводимой терапии.
Когда можно лечить 2 недели стафилококковую инфекцию?
- В/в катетер или другой источник инфекции удален (хорошо если катетер, а если речь об импланте – его же не удалишь).
- Инфекционный эндокардит исключен по данным чрезпищеводной ЭХО-КГ.
- Отсутствуют импланты (протезированный клапан, кардиостимулятор, А-В фистула).
- Нормализация температуры и отрицательная гемокультура в течение 72 ч после удаления источника инфекции.
- Нет признаков метастатических очагов на других органах и тканях.
Во всех остальных случаях лечим 21-28 дней. А что происходит у нас? Максимум 10-14 дней пролечили и отпустили.
Антистафилококковые препараты мы обязаны назначить сразу как только получили положительную гемокультуру на стафилококк однократно! И только потом проводим повторную проверку, так как максимально раннее начало антибактериальной терапии в 2-3 раза снижает летальность.
Итак, как уже стало понятно, основную проблему представляют устойчивые формы S.aureus. Для их эрадикации были синтезированы и предлагаются к использованию следующие препараты
- Гликопептиды – Ванкомицин (1958 год) – категория доказательств IА
- Стрептогранины – Синерцид (в РФ отсут)
- Оксазолиндиноны – Линезолид – категория доказательств IА
- Липопептиды – Даптомицин – категория доказательств IА – Тигециклин – категория доказательств IIВ
1. Ванкомицин
Внедрен в практику в 1958 году, а первый устойчивый штамм стафилококка поймали только в 1996 году. Проблема с ванкомицинустойчивыми штамма стафилококка в том, что до сих пор нет отработанных схем преодоления этой самой устойчивости. Помимо прочего у возбудителей непрерывно нарастает МПК (минимальная подавляющая концентрация) к ванкомицину и сейчас при МПК 2 мы говорим о резистентном штамме.
Еще одна проблема – это плохо очищенные формы препарата. Если ванкомицин плохо очищен, то риск токсических нефропатий достигает 20%. К сожалению надо констатировать тот факт, что Ванкомицин отечественного разлива относится к плохо очищенным формам.
Основным и самым грозным осложнением является развитие острой почечной недостаточности, а она развивается у 40% пациентов, если дозировка препарата составляет более 4 гр/сут. А потому вводить данный препарат можно только под контролем клиренса креатинина (КК). То есть первый анализ мы проводим до введения препарата, второй через 2-3 дня и смотрим, если имеет место падение КК: если он падает на 25% – это говорит о нефротоксичном действии препарата, если на 50%, то препарат следует немедленно отменить.
Ванкомицин является бактериостатическим антибиотиком, эффективность действия мы оцениваем не ранее чем через 72 часа, а то и на 5-е сутки от начала терапии. Доза должна подбираться в соответствии с МПК возбудителя и под постоянным контролем клиренса креатинина. То есть для использования этого препарата нам необходимы хорошая клиническая и микробиологическая лаборатории.
Современные рекомендации по дозированию препарата выглядят следующим образом:
У Вас есть возможность это делать? У меня такой возможности не было и нет до сих пор, а потому мы до сих пор используем этот препарат как саперы на минном поле, где ошибиться можно только один раз.
Активность против MSSA у Ванкомицина сопоставима с плацебо, а значит применять его можно только при верифицированной MRSA, либо комбинировать с препаратами, активными против MSSA (цефазолином, например)
Следует так же помнить о том, что Ванкомицин, в виду строения его молекулы, а особенно ее размера, плохо проникает в ткани и проблемными его локализациями будут дыхательные пути, ЦНС, клапаны сердца и кости. А потому быстрого действия там не дождешься и терапия требуется очень и очень длительная.
В заключении хотелось бы сказать, что препарат хорош, но будет лучше, если вы его не будете назначать в самостоятельном режиме, а вызовете врача – клинического фармаколога, ибо назначение и дозировка таких вот препаратов входит в его непосредственные обязанности.
Что делать если клин. фарма нет, а пациент есть. И что надо соблюсти, чтобы безопасно применять ванкомицин?
- Использовать хроматографически очищенные препараты – Ванкоцин, Эдицин (в настоящих условиях это практически невозможно, торги они не выигрывают)
- Требуется коррекция гиповолемии, сердечной недостаточности (перфузия почек должна быть нормальное, иначе усугубим нефротоксический эффект)
- Избегать комбинаций с нефро- или ототоксичными препаратами (аминогликозидами, НПВС и т.д.)
- Коррекция режима дозирования по клиренсу креатинина. Если в течение 2-3-х дней он снизился вдвое от изначального, а данных за то, что он мог рухнуть не только от Ванко нет – это проявление нефротоксичности препарата.
2. Линезолид
Является чистым бактериостатиком. Производителем неоднократно заявлялось, что препарат эффективнее Ванкомицина, однако проведенные независимые метаанализы клинических исследований хорошего качества рандомизированных и с двойным слепым контролем показали, что единственное, где Линезолид имеет преимущество – это вентилятор-ассоциированный пневмонии, вызванные MRSA. В других случаях, в т.ч. и стафилококковой пневмонии, преимуществ нет никаких. Зато стоимость лечения повышается в разы.
Еще один момент, о котором умалчивается – это безопасность применения Линезолида. Да, нефротоксичности нет, но по данным того же метаанализа частота возникновения тромбоцитопений при его использовании в 11,72 раза выше чем в группе плацебо.
Таким образом, Линезолид является препаратом выбора при нозокомиальной вентилятор-ассоциированной MRSA пневмонии, где при его использовании летальность ощутимо ниже, чем при использовании ванкомицина.
3. Тигециклин (или тайгециклин)
Давайте разберемся и с ним, тем более к вам будут часто приходить и рассказывать про него как про самый препаратистый антибиотик в мире.
- Препарат позиционируется как новый класс антибиотиков, на деле это производный тетерациклина со всеми исходящими отсюда последствиями.
- Он является бактериостатиком, как все тетрациклины
- Имеет хорошую тканевую фармакокинетику, но при этом крайне низкие концентрации в плазме крови (ангиогенные инфекции из его показаний выпадают сразу)
А теперь о том, куда его следует применять:
- В качестве средства целенаправленной этиотропной терапии НИ, вызванных полирезистентными бактериями:
- БРЛС: альтернатива карбопенемам
- Ацинетобактер – альтернатива сульбактаму
- Клебсиела и E.coli – устойчивые к карбопенемам
- Stenotrophomonas maltophilia
Повторюсь еще раз, место его применения это ЦЕЛЕНАПРАВЛЕННАЯ ЭТИОТРОПНАЯ ТЕРАПИЯ, т.е. когда микроб четко установлен в результате бактериологического исследования вместе с чувствительностью к антибиотикам.
Повторюсь еще раз – место этого препарата в лечении грам-отрицательной инфекции, но никак не стафилококков. Да и вообще это препарат крайне глубокого резерва, как по характеристикам, так и по цене, т.к. в ближайшие 10 лет не будет ни одного нового препарата с Гр(-) активностью, так как их просто нет даже в проекте (медицина традиционно не успевает за возбудителями, а только пытается их догонять, о чем мы в самом начале и говорили, прослеживая эволюцию возбудителей)
4. Даптомицин.
Препарат появился у нас недавно, хотя во всем мире применяется уже очень давно (в Штатах с 2003 года)
Препарат относится к классу липопептидов и от всех имеющихся на данный момент антиMRSA препаратов отличается тем, что является бактерицидным. И этот самый эффект развивается у него очень быстро и нам не надо ждать нескольких дней. То есть антибактериальный эффект мы можем оценивать как и у всех бактерицидных препаратов через 48 часов от начала применения, а это очень важно у больных в тяжелом состоянии. Еще одним несомненным плюсом является то, что не происходит лизиса клеток и не увеличивается интоксикация.
Основными показаниями к применению являются:
- Эндокардит,
- Менингит,
- Остеомиелит,
- Инфекции у больных с нейтропенией,
- Сепсис стафилококковой этиологии
Также препарат может использоваться в эмпирической терапии (кстати, единственный из всех имеющихся на данный момент) Гр(+)инфекций, так как активность против MSSA и MRSA одинаковая.
Кроме того, препарат проявляет активность против MRSA в биопленках, а значит нет необходимости в удалении протезов и имплантов. А значит Даптомицин показан при ангиогенных инфекциях (бактериемиях), остеомиелите, бактериальном эндокардите.
- Препарат откровенно дорог
- В связи с крупным размером молекулы имеются проблемы с тканевой кинетикой, а потому пневмонии и инфекции ЦНС на данный момент мы им не лечим.
- Побочные эффекты – миалгии, производитель говорит о необходимости следить за КФК и обращать пристальное внимание на пациентов уже имеющих подобные проблемы.
- Описано несколько случаев эозинофильных пневмоний, а потому и на это следует обращать внимание, так как при своевременной диагностике и вовремя назначенной терапии, данный вид пневмонии проходит без следа.
Итак, сводя все к общему знаменателю:
Ванкомицин мы используем тогда, когда у нас верифицирован MRSA стафилококк, имеется хорошая микробиологическая лаборатория, которая нам даст его МПК и это МПК не будет больше 2 (иначе он уже резистентен), в наличие есть клинический фармаколог, который посчитает дозу, будет ее контролировать и корригировать согласно изменениям клиренса креатинина. Но при этом мы помним о том, что препарат не работает на MSSA. И конечно же мы продолжаем помнить о его высокой нефротоксичности, если не имеем возможности пользоваться высокоочищенными формами.
Тигециклину нечего делать антистафилококковой терапии, этот препарат предназначен только для этиотропной терапии Гр(-)инфекции.
В связи с высокой активностью против MRSA и MSSA, быстрым бактерицидным эффектом является препаратом выбора при ангиогенных инфекциях, сепсисе и инфекционном эндокардите, а также препаратом выбора при эмпирической терапии MRSA+MSSA. Не использовать при лечении нозокомиальных пневмоний и инфекций ЦНС.
Ю.В. Гавриленко, к.м.н., кафедра детской оториноларингологии, аудиологии и фониатрии Национальной медицинской академии последипломного образования им. П.Л. Шупика, г. Киев Проблема хронического тонзиллита по-прежнему требует особого внимания оториноларинголога, а также педиатра и семейного врача. Это объясняется не только достаточно высокой распространенностью данного заболевания, но и современной точкой зрения на функцию лимфаденоидной ткани, этиологию, патогенез и способы лечения ее хронического воспаления (Лайко А.А., 2008; 2013; Мельников О.Ф., Заболотная Д.Д., 2012; 2013).
 Ю.В. Гавриленко |
Актуальность
В последнее время в тактике лечения хронического тонзиллита, особенно в детском возрасте, стало преобладать щадящее отношение к лимфаденоидным органам. Это стимулирует поиск новых патогенетических способов воздействия на воспалительный очаг и обусловливает необходимость отдавать предпочтение органосберегающим методам лечения. В связи с широким применением в клинической практике комбинированных антисептиков местного действия одной из первоочередных задач клинической иммунологии является изучение влияния препаратов и их компонентов на функциональные свойства клеток лимфоидного ряда, на которые приходится около 85% всего клеточного состава миндалин глоточного кольца и которые во многом определяют состояние локального иммунитета в ротоглотке (Быкова В.П., 2008; Мельников О.Ф., Заболотная Д.Д., 2012; Brandtzaeg, 2003; 2013).
Учитывая вышеизложенное, можно считать, что вопросы, касающиеся поиска более надежных методов местного лечения хронического тонзиллита, по-прежнему очень актуальны.
Хронический тонзиллит является самым распространенным заболеванием, которое требует проведения курсов профилактического лечения, составляющими которого, в частности, являются промывание лакун небных миндалин и полоскание ротоглотки. Часто данные манипуляции выполняются в сочетании с физиотерапевтическим воздействием в виде фонофореза на подчелюстную область с лекарственными препаратами, что также улучшает эффективность проводимой терапии.
Традиционно среди оториноларингологов наиболее широко используемым препаратом для промывания лакун небных миндалин является раствор фурацилина, который обладает рядом преимуществ и недостатков.
Цель данной работы – сравнить эффективность применения раствора фурацилина и препарата Бетадин ® (производства компании EGIS) при местном лечении пациентов с хроническим тонзиллитом.
Бетадин ® – препарат, действующим веществом которого является повидон-йод (1 мл раствора содержит 100 мг повидон-йода).
Повидон-йод – комплекс йода и полимера поливинилпирролидона. Обладает сильным бактерицидным действием, имеет широкий спектр противомикробной активности в отношении бактерий, вирусов, грибов и простейших. Одним из важных свойств повидон-йода является его воздействие на резистентные штаммы микроорганизмов, в то время как к самому препарату устойчивость не развивается. Другая особенность этого препарата заключается в наличии антибактериального эффекта в сочетании с низкой токсичностью, что определяет его широкое локальное использование при различной гнойно-воспалительной и хирургической патологии. В результате действия повидон-йода выделяется меньше токсинов, в связи с чем улучшение общего состояния пациента возможно еще до выраженного подавления роста микрофлоры.
Материал и методы
Дизайн: открытое сравнительное исследование эффективности препарата Бетадин ® (производства компании EGIS) при промывании лакун небных миндалин в дозе 20 капель на 200 мл физраствора 1 раз в сутки через день в течение 10 дней в сравнении с раствором фурацилина в концентрации 1:5000. Санацию лакун небных миндалин указанными препаратами назначали в качестве монотерапии. В 2013 году на базе ЛОР-отделения детской клинической больницы № 1 г. Киева было обследовано 35 пациентов с хроническим тонзиллитом (рис. 1, 2). Длительность заболевания – от 2 до 5 лет. Все пациенты были разделены на две группы. В основную группу включили 18 больных (средний возраст – 14,12±3,24 года), которым проводилась санация лакун небных миндалин препаратом Бетадин ® . Группу сравнения составили 17 пациентов (средний возраст – 15,35±1,7 года), которым проводилось промывание лакун небных миндалин раствором фурацилина. Достоверных различий по возрасту между больными двух групп не было (р>0,05).
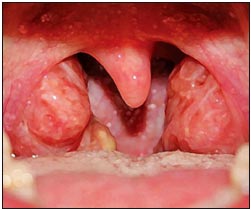 Рис. 1. Хронический тонзиллит в сочетании с гипертрофией небных миндалин 2 ст. | 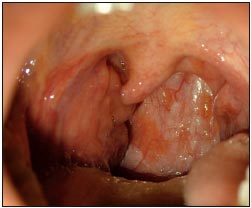 Рис. 2. Хронический тонзиллит в сочетании с подострым фарингитом |
Критерии включения в исследование:
Клиническими признаками хронического тонзиллита являлись: утолщение, застойная гиперемия передних небных дужек, спаянность с небными дужками небных миндалин, наличие патологического содержимого (жидкий гной, казеозно-гнойные пробки) в лакунах небных миндалин.
- наличие признаков декомпенсации хронического тонзиллита (частые ангины, паратонзиллит);
- паратонзиллярный абсцесс в анамнезе;
- длительный субфебрилитет;
- регионарный лимфаденит;
- наличие патологии со стороны почек, суставов, сердца.
У всех пациентов определялась клиническая картина хронического тонзиллита, флора и чувствительность к антибиотикам содержимого лакун небных миндалин. Оценку указанных параметров выполняли перед началом санации небных миндалин и после окончания курса лечения. Для определения флоры в лакунах небных миндалин проводили посев содержимого на агаровые среды. Забор содержимого из лакун небных миндалин осуществлялся утром, натощак.
Статистическую обработку результатов исследования выполняли в пакете прикладных программ Statistics for Windows 6.0 (2000), использован t-критерий Стьюдента для независимых выборок при уровне значимости 0,05.
Результаты и обсуждение
Результаты обследования содержимого крипт небных миндалин на флору и чувствительность к антибиотикам в основной группе были следующими: Staphylococcus aureus обнаружен у 9 больных (49,5%), Streptococcus viridans – у 4 (22%), Klebsiella pneumoniae – у 3 (16,5%), смешанная флора Candida + Klebsiella pneumoniаe – у 1 (5,5%), Staphylococcus aureus + Candida – у 1 (5,5%). В группе сравнения при первичном исследовании содержимого лакун небных миндалин у 6 (35,3%) пациентов был обнаружен Staphylococcus aureus, у 2 (11,7%) – Streptococcus viridans, у 2 (11,7%) – Enterobacter, у 3 (17,6%) – Neiseria spp., у 2 (11,7%) – Klebsiella pneumoniae, у 1 (5,8%) – Candida, 1 (5,8%) больной имел сочетанную микрофлору Neiseria spp. + Candida.
При повторном исследовании содержимого крипт небных миндалин после курса местного лечения с применением раствора Бетадин ® в основной группе показатели были следующие: Staphylococcus aureus обнаружен у 2 (11%) детей, Streptococcus viridans выделен у 1 (5,5%) ребенка, Klebsiella pneumoniae – у 1 (5,5%) обследуемого, у 15 (78%) пациентов патогенная и условно-патогенная микрофлора не выявлена. В группе сравнения после санации лакун небных миндалин раствором фурацилина Staphylococcus aureus обнаружен у 5 (29,4%) больных, Streptococcus viridans выделен у 2 (11,7%), Klebsiella pneumoniae – у 2 (11,7%), патогенная микрофлора отсутствовала у 8 (48,2%) обследуемых (табл. 1, 2).
Таблица 1. Результаты исследования содержимого крипт небных миндалин у пациентов основной группы
| До санации лакун небных миндалин раствором Бетадин | После санации лакун небных миндалин раствором Бетадин | |
| Staphylococcus aureus | 49,5% (n=9) | 11% (n=2) |
| Streptococcus viridans | 22% (n=4) | 5,5% (n=1) |
| Klebsiella pneumoniae | 16,5% (n=3) | 5,5% (n=1) |
| Candida + Klebsiella pneumoniаe | 5,5% (n=1) | |
| Candida + Staphylococcus aureus | 5,5% (n=1) | |
| Патогенная и условно-патогенная микрофлора не выявлена | 78% (n=15) |
Таблица 2. Результаты исследования содержимого крипт небных миндалин у пациентов группы сравнения
| До санации лакун небных миндалин раствором фурацилина | После санации лакун небных миндалин раствором фурацилина | |
| Staphylococcus aureus | 6 (35,3%) | 29,4% (n=5) |
| Streptococcus viridans | 2 (11,7%) | 11,7% (n=2) |
| Enterobacter | 2 (11,7%) | |
| Neiseria spp. | 3 (17,6%) | |
| Klebsiella pneumoniae | 2 (11,7%) | 11,7% (n=2) |
| Candida | 1 (5,8% | |
| Neiseria spp. + Candida | 1 (5,8%) | |
| Патогенная микрофлора не выявлена | 48,2% (n=8) |
Сравнение результатов посевов после проведенного курса санации показало, что регистрируемое количество пациентов, не имеющих патогенной микрофлоры в лакунах небных миндалин, было больше при использовании полосканий и промываний физиологическим раствором в разведении с препаратом Бетадин ® (78%), чем при таком же местном применении раствора фурацилина (48,2%).
Выводы
Использование препарата Бетадин ® при местном лечении хронического тонзиллита у детей способствует более быстрому исчезновению жалоб у пациентов и клиническому уменьшению выраженности воспалительного процесса.
Результаты исследования содержимого лакун небных миндалин на наличие флоры и чувствительность к антибиотикам свидетельствуют об отсутствии патогенной микрофлоры на фоне применения препарата повидон-йода у 78% больных, а при использовании раствора фурацилина – у 48,2%.
Таким образом, на основании полученных данных можно сделать вывод о более выраженной эффективности местного применения препарата Бетадин ® в сравнении с фурацилином при лечении хронического тонзиллита у детей.
Читайте также:

