Билирубиновая интоксикация у месячного ребенка
Обновлено: 19.04.2024
В чем заключаются трудности диагностики гельминтозов? Какова терапия гельминтозов? На фоне глобальных экологических изменений, широкого применения иммунных, антибактериальных и прочих лекарственных препаратов, частых нарушений адаптационных процессов
В чем заключаются трудности диагностики гельминтозов?
Какова терапия гельминтозов?
На фоне глобальных экологических изменений, широкого применения иммунных, антибактериальных и прочих лекарственных препаратов, частых нарушений адаптационных процессов (болезни адаптации), постоянного стресса, повышения уровня образованности и культуры населения многие давно известные заболевания человека изменили свою клиническую картину. Некоторые симптомы практически перестали встречаться, другие, наоборот, стали выходить на первый план. Это относится и к заболеваниям, вызываемым гельминтами, в частности, круглыми паразитическими червями (нематодами). В умеренном поясе наиболее широко распространенные нематоды — аскарида и острицы.
Гельминты могут вызывать нарушения функции желудочно-кишечного тракта (ЖКТ), быть причиной аллергических (или псевдоаллергических) реакций или усугублять их, вызывать интоксикацию, а также быть фактором, ослабляющим иммунитет [2]. В настоящее время редко встречаются случаи массивной инвазии, когда диагностика не вызывает затруднений, а клубки гельминтов вызывают обтурации кишечника, — значительно чаще гельминты стали являться причиной развития аллергических проблем. При этом гельминтозы относятся к тем заболеваниям, которые трудно диагностировать в связи с объективными и субъективными трудностями (длительные периоды отсутствия яйцекладки, возможность отсутствия среди паразитирующих особей самок, вероятность технических ошибок). Поэтому важно знать клиническую картину данных заболеваний, чтобы иметь возможность назначать углубленное обследование или эффективную терапию по совокупности косвенных признаков, даже не имея прямых доказательств наличия гельминтоза.
С целью оценить клиническую картину при нематодозах проанализированы жалобы, анамнез и результаты осмотра 150 детей, у которых были обнаружены аскариды (116 детей), острицы (27 детей), аскариды и острицы (7 детей). Гельминты выявлены стандартными методами: обнаружение яиц аскарид в фекалиях методом мазка или яиц остриц в соскобе на энтеробиоз, а также визуальное обнаружение аскарид или остриц в фекалиях, рвотных массах или при оперативном или эндоскопическом вмешательстве в брюшной полости или в области прямой кишки [3].
Среди детей было 67 мальчиков, 83 девочки. Распределение по возрасту представлено в табл. 1. Преобладали дети младшего дошкольного возраста (от одного до трех лет), их количество составило 63%. Именно в этом возрасте — наибольшие эпидемиологические предпосылки появления нематодозов.
У 150 детей с доказанными инвазиями аскаридами и/или острицами отмечались следующие клинические проявления.
У 107 детей (71,3%) были аллергические проблемы: кожные высыпания, диатез, атопический дерматит, нейродермит — у 99 (66%), из них у 18 эти проблемы носили периодический характер, у двух детей, кроме кожных высыпаний, отмечались конъюнктивиты; у десяти (6,7%) отмечалась доказанная пищевая аллергия на какие-то продукты с высоким уровнем специфических IgE в сыворотке крови; у шести детей (4%) отмечался астматический компонент или был установлен диагноз бронхиальная астма.
Бруксизм (скрежетание зубами) — симптом, который часто связывается с глистными инвазиями, но фактически является неспецифическим признаком интоксикации центральной нервной системы и может сопровождать любые хронические интоксикации — отмечался у 25 детей (16,7%).
Нарушения ночного сна отмечались у 81 ребенка (54%): беспокойство к вечеру, затруднения засыпания — у 15 детей (10%); беспокойный ночной сон (вскрикивания, постанывания, метания во сне, пробуждения, плач, бессонница, кошмарные сновидения) — у 76 (50,7%). Некоторые родители старших детей затруднялись охарактеризовать ночной сон ребенка, т. к. ребенок спит в другой комнате. Проблемы с засыпанием и ночным сном — важный симптом глистных инвазий, т. к. известно, что кишечные нематоды (в том числе аскариды и острицы) часто активизируются именно ночью.
У 54 детей (36%) отмечались зуд и/или покраснения в области заднего прохода (анальная эскориация) — у 43 детей (28,7%); зуд — у 38 (25,3%); оба симптома — у 27 (18%). Анальная эскориация и зуд считаются симптомами энтеробиоза (острицы), но при этом из 54 детей, у которых отмечались данные симптомы, энтеробиоз был доказан у 17 детей (31,5% от числа детей с этими симптомами). У других 37 детей (68,5% от числа детей с данными симптомами) было доказано наличие аскаридоза, но ни визуально, ни в анализах не были обнаружены острицы. Это может свидетельствовать либо о том, что в данных случаях присутствовали острицы, которые не были диагностированы, т. е. гельминтоз был смешанным, либо о том, что анальная эскориация и зуд — симптомы, характерные не только для энтеробиоза, но и аскаридоза.
У 29 детей (19,3%) отмечались признаки общего ослабления иммунитета: часто или длительно болеющие дети (по общепринятой классификации Monto J. et al., 87) — 18 детей (12%); рецидивирующие стоматиты, гингивиты отмечались у 13 детей (8,7%); кариес зубов — у шести (4%); рецидивирующие гнойные заболевания кожи или слизистых — у трех (2%).
У 15 детей (10%) имелись результаты исследования иммунного статуса по крови: у 13 детей было снижено количество Т-клеток; у всех 15 детей было снижено количество Т-хелперов, причем у шести из них — существенно; у 12 детей было снижено хелперно-супрессорное соотношение; у семи детей отмечалось снижение уровня IgA (секреторный иммуноглобулин), в том числе у трех — существенное, у остальных же восьми детей уровень IgA в сыворотке крови был либо нормальным, либо повышенным; у шести детей отмечалось снижение количества лимфоцитов, в том числе у одного ребенка была выраженная лимфо- и нейтропения. Эти результаты подтверждают известные данные о том, что аскариды и острицы угнетающе влияют на функции иммунитета, а также что у людей с ослабленным иммунитетом большая вероятность появления гельминтоза [1].
У большинства детей отмечалось более одного симптома. Обобщенные данные по клинической картине представлены в табл. 2.
Терапия во всех случаях состояла из двух этапов: сначала — антигельминтная терапия, причем назначались два разных препарата (декарис и вермокс) с интервалом три — пять дней между ними, чтобы максимально охватить различные стадии жизни гельминтов; через некоторое время после антигельминтной терапии — препараты для микробиологической и функциональной коррекции. Соответственно оценивались результаты противоглистной терапии, результаты всего лечения, а также катамнез в течение шести месяцев после терапии. В большинстве случаев улучшение наступало быстро в процессе лечения. У 36 детей только после антигельминтной терапии существенно уменьшились или полностью исчезли аллергические проявления, у 39 детей после первого этапа терапии нормализовалась работа ЖКТ, у 41 ребенка сразу прекратились боли в животе, по остальным симптомам также наступало улучшение после противоглистных препаратов. Это подтверждает то, что симптомы были вызваны наличием гельминтов.
У 92 детей после всего лечения не было никаких жалоб; о 37 нет данных об изменениях состояния в процессе и после лечения; у 16 детей эффект был неполным, т. е. какие-то симптомы сохранялись и после окончания лечения; у четырех детей эффект от терапии оказался нестойким, поскольку возникли рецидивы после окончания лечения; у трех детей эффекта от терапии не было.
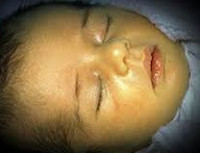
Желтуха новорожденных – физиологическое или патологическое состояние, обусловленное гипербилирубинемией и проявляющееся желтушным окрашиванием кожи и видимых слизистых у детей в первые дни их жизни. Желтуха новорожденных характеризуется повышением концентрации билирубина в крови, анемией, иктеричностью кожных покровов, слизистых оболочек и склер глаз, гепато- и спленомегалией, в тяжелых случаях – билирубиновой энцефалопатией. Диагностика желтухи новорожденных основывается на визуальной оценке степени желтухи по шкале Крамера; определении уровня эритроцитов, билирубина, печеночных ферментов, группы крови матери и ребенка и др. Лечение желтухи новорожденных включает грудное вскармливание, инфузионную терапию, фототерапию, заменное переливание крови.
Общие сведения
Желтуха новорожденных – неонатальный синдром, характеризующийся видимой желтушной окраской кожи, склер и слизистых оболочек вследствие повышения уровня билирубина в крови ребенка. По наблюдениям, на первой неделе жизни желтуха новорожденных развивается у 60 % доношенных и 80% недоношенных детей. В педиатрии наиболее часто встречается физиологическая желтуха новорожденных, составляющая 60–70 % всех случаев синдрома. Желтуха новорожденных развивается при повышении уровня билирубина свыше 80-90 мкмоль/л у доношенных и более 120 мкмоль/л у недоношенных младенцев. Длительная или выраженная гипербилирубинемия оказывает нейротоксическое действие, т. е вызывает повреждение головного мозга. Степень токсического воздействия билирубина зависит, главным образом, от его концентрации в крови и длительности гипербилирубинемии.

Классификация и причины желтухи новорожденных
Прежде всего, неонатальная желтуха может быть физиологической и патологической. По происхождению желтухи новорожденных делятся на наследственные и приобретенные. На основании лабораторных критериев, т. е. повышения той или иной фракции билирубина различают гипербилирубинемии с преобладанием прямого (связанного) билирубина и гипербилирубинемии с преобладанием непрямого (несвязанного) билирубина.
К конъюгационным желтухам новорожденных относятся случаи гипербилирубинемии, возникающие вследствие пониженного клиренса билирубина гепатоцитами:
- Физиологическую (транзиторную) желтуху доношенных новорожденных
- Желтуху недоношенных новорожденных
- Наследственные желтухи, связанные с синдромами Жильбера, Криглера-Найяра I и II типов и др.
- Желтуху при эндокринной патологии (гипотиреозе у детей, сахарном диабете у матери)
- Желтуху у новорожденных с асфиксией и родовой травмой
- Прегнановую желтуху детей, находящихся на естественном вскармливании
- Медикаментозную желтуху новорожденных, обусловленную назначением левомицетина, салицилатов, сульфаниламидов, хинина, больших доз витамина К и др.
Гемолитическая желтуха новорожденных характеризуется повышением уровня билирубина вследствие усиленного разрушения (гемолиза) эритроцитов ребенка. К такого вида гипербилирубинемиям относят:
- Гемолитическую болезнь плода и новорожденных
- Эритроцитарные ферменто- и мембранопатии
- Гемоглобинопатию (серповидно-клеточную анемию, талассемию)
- Полицитемию
Механические желтухи новорожденных обусловлены нарушением отведения билирубина с желчью по желчным путям и кишечнику. Они могут возникать при пороках (атрезии, гипоплазии) внутрипеченочных и внепеченочных протоков, внутриутробной желчнокаменной болезни, сдавлении желчных ходов извне инфильтратом или опухолью, закупорке желчных протоков изнутри, синдроме сгущения желчи, пилоростенозе, кишечной непроходимости и пр.
Желтухи смешанного генеза (паренхиматозные) возникают у новорожденных с фетальным гепатитом, обусловленным внутриутробными инфекциями (токсоплазмозом, цитомегалией, листериозом, герпесом, вирусными гепатитами А, В, D), токсико-септическим поражением печени при сепсисе, наследственных заболеваниях обмена веществ (муковисцидозе, галактоземии).
Симптомы желтухи новорожденных
Физиологическая желтуха новорожденных
Транзиторная желтуха является пограничным состоянием периода новорожденности. Сразу после рождения ребенка избыток эритроцитов, в которых присутствует фетальный гемоглобин, разрушается с образованием свободного билирубина. Вследствие временной незрелости фермента печени глюкуронилтрансферазы и стерильности кишечника связывание свободного билирубина и его выведение из организма новорожденного с калом и мочой снижено. Это приводит к накоплению лишнего объема билирубина в подкожно-жировой клетчатке и окрашиванию кожи и слизистых в желтый цвет.
Физиологическая желтуха новорожденных развивается на 2-3 сутки после рождения, достигает своего максимума на 4-5 сутки. Пиковая концентрация непрямого билирубина составляет в среднем 77-120 мкмоль/л; моча и кал имеют нормальную окраску; печень и селезенка не увеличены.
При транзиторной желтухе новорожденных легкая степень желтушности кожных покровов не распространяется ниже пупочной линии и обнаруживается только при достаточном естественном освещении. При физиологической желтухе самочувствие новорожденного обычно не нарушается, однако при значительной гипербилирубинемии может отмечаться вялое сосание, заторможенность, сонливость, рвота.
У здоровых новорожденных возникновение физиологической желтухи связывается с временной незрелостью ферментных систем печени, поэтому не считается патологическим состоянием. При наблюдении за ребенком, организации правильного вскармливания и ухода проявления желтухи стихают самостоятельно к 2-хнедельному возрасту новорожденных.
Желтуха недоношенных новорожденных характеризуется более ранним началом (1–2 сутки), достижением пика проявлений к 7 суткам и стиханием к трем неделям жизни ребенка. Концентрация непрямого билирубина в крови недоношенных выше (137-171 мкмоль/л), его прирост и снижение происходит медленнее. Вследствие более длительного созревания ферментных систем печени у недоношенных детей создается угроза развития ядерной желтухи и билирубиновой интоксикации.
Наследственные желтухи
Наиболее распространенной формой наследственной конъюгационной желтухи новорожденных является конституциональная гипербилирубинемия (синдром Жильбера). Данный синдром встречается в популяции с частотой 2-6%; наследуется по аутосомно-доминантному типу. В основе синдрома Жильбера лежит дефект активности ферментных систем печени (глюкуронилтрансферазы) и, как следствие, - нарушение захвата билирубина гепатоцитами. Желтуха новорожденных при конституциональной гипербилирубинемии протекает без анемии и спленомегалии, с незначительным подъемом непрямого билирубина.
Наследственная желтуха новорожденных при синдроме Криглера-Найяра связана с очень низкой активностью глюкуронилтрансферазы (II тип) или ее отсутствием (I тип). При I типе синдрома желтуха новорожденных развивается уже в первые дни жизни и неуклонно нарастает; гипербилирубинемия достигает 428 мкмоль/л и выше. Типично развитие ядерной желтухи, возможен летальный исход. II тип синдрома, как правило, имеет доброкачественное течение: неонатальная гипербилирубинемия составляет 257-376 мкмоль/л; ядерная желтуха развивается редко.
Желтуха при эндокринной патологии
Обычно возникает у детей с врожденным гипотиреозом в связи с дефицитом гормонов щитовидной железы, нарушающим созревание фермента глюкуронозилтрансферазы, процессы конъюгации и экскреции билирубина. Желтуха при гипотиреозе выявляется у 50-70% новорожденных; проявляется на 2-3-й сутки жизни и сохраняется до 3-5 месяцев. Кроме желтухи, у новорожденных отмечается вялость, пастозность, артериальная гипотония, брадикардия, грубый голос, запоры.
Ранняя желтуха может возникать у новорожденных, матери которых страдают сахарным диабетом, вследствие гипогликемии и ацидоза. Проявляется затяжным желтушным синдромом и непрямой гипербилирубинемией.
Желтуха у новорожденных с асфиксией и родовой травмой
Гипоксия плода и асфиксия новорожденных задерживают становление ферментных систем, следствием чего является гипербилирубинемия и ядерная желтуха. Различные родовые травмы (кефалогематомы, внутрижелудочковые кровоизлияния) могут являться источниками образования непрямого билирубина и его усиленного проникновения в кровь с развитием желтушного окрашивания кожи и слизистых. Выраженность желтухи новорожденных зависит от тяжести гипоксически-асфиксического синдрома и уровня гипербилирубинемии.
Прегнановая желтуха
Синдром Ариеса, или желтуха детей, находящихся на естественном вскармливании, развивается у 1-2% новорожденных. Может возникать на первой неделе жизни ребенка (ранняя желтуха) либо на 7-14 день (поздняя желтуха новорожденных) и сохраняться 4-6 недель. Среди возможных причин прегнановой желтухи новорожденных называют присутствие в молоке материнских эстрогенов, препятствующих связыванию билирубина; неустановившуюся лактацию у матери и относительное недоедание ребенка, вызывающие обратное всасывание билирубина в кишечнике и его поступление в кровяное русло и др. Считается, что факторами риска желтухи у новорожденных, находящихся на грудном вскармливании, служат позднее (позже 12ч жизни) отхождение мекония, задержка пережатия пуповины, стимуляция родов. Течение такого вида желтухи новорожденных всегда доброкачественно.
Ядерная желтуха и билирубиновая энцефалопатия
При прогрессирующем повышении концентрации непрямого билирубина в крови может происходить его проникновение через гематоэнцефалический барьер и отложение в базальных ядрах головного мозга (ядерная желтуха новорожденных), обусловливающее развитие опасного состояния - билирубиновой энцефалопатии.
На первом этапе в клинике преобладают признаки билирубиновой интоксикации: вялость, апатия, сонливость ребенка, монотонный крик, блуждающий взгляд, срыгивания, рвота. Вскоре у новорожденных появляются классические признаки ядерной желтухи, сопровождающиеся ригидностью затылочных мышц, спастичностью мышц тела, периодическим возбуждением, выбуханием большого родничка, угасанием сосательного и других рефлексов, нистагмом, брадикардией, судорогами. В этот период, который длится от нескольких дней до нескольких недель, происходит необратимое поражение ЦНС. В течение последующих 2-3 месяцев жизни в состоянии детей наблюдается обманчивое улучшение, однако уже на 3-5 месяце жизни диагностируются неврологические осложнения: ДЦП, ЗПР, глухота и т. д.
Диагностика желтухи новорожденных
Желтуха выявляется еще на этапе пребывания ребенка в родильном доме врачом-неонатологом или педиатром при посещении новорожденного вскоре после выписки.
Для визуальной оценки степени желтухи новорожденных используется шкала Крамера.
- I степень – желтушность лица и шеи (билирубин 80 мкмоль/л)
- II степень – желтушность распространяется до уровня пупка (билирубин 150 мкмоль/л)
- III степень - желтушность распространяется до уровня коленей (билирубин 200 мкмоль/л)
- IV степень - желтушность распространяется на лицо, туловище, конечности, за исключением ладоней и подошв (билирубин 300 мкмоль/л)
- V - тотальная желтушность (билирубин 400 мкмоль/л)
Необходимыми лабораторными исследованиями для первичной диагностики желтухи новорожденных являются: билирубин и его фракции, общий анализ крови, группа крови ребенка и матери, тест Кумбса, ПТИ, общий анализ мочи, печеночные пробы. При подозрении на гипотиреоз необходимо определение тиреоидных гормонов Т3, Т4, ТТГ в крови. Выявление внутриутробных инфекций осуществляется методом ИФА и ПЦР.
В рамках диагностики механических желтух новорожденным проводится УЗИ печени и желчных протоков, МР-холангиография, ФГДС, обзорная рентгенография брюшной полости, консультация детского хирурга и детского гастроэнтеролога.
Лечение желтухи новорожденных
Для предотвращения желтухи и уменьшения степени гипербилирубинемии все новорожденные нуждаются в раннем начале (с первого часа жизни) и регулярном грудном вскармливании. У новорожденных с неонатальными желтухами частота рекомендуемых кормлений грудью составляет 8–12 раз в сутки без ночного перерыва. Необходимо увеличение суточного объема жидкости на 10-20% по сравнению с физиологической потребностью ребенка, прием энтеросорбентов. При невозможности оральной гидратации проводится инфузионная терапия: капельное введение глюкозы, физ. раствора, аскорбиновой кислоты, кокарбоксилазы, витаминов группы В. С целью повышения конъюгации билирубина новорожденному с желтухой может назначаться фенобарбитал.
Самым эффективным методом лечения непрямой гипербилирубинемии является фототерапия в непрерывном или прерывистом режиме, способствующая переводу непрямого билирубина в водорастворимую форму. Осложнениями фототерапии могут являться гипертермия, дегидратация, ожоги, аллергические реакции.
При гемолитической желтухе новорожденных показано заменное переливание крови, гемосорбция, плазмаферез. Все патологические желтухи новорожденных требуют незамедлительной терапии основного заболевания.
Прогноз желтухи новорожденных
Транзиторная желтуха новорожденных в подавляющем большинстве случаев проходит без осложнений. Однако нарушение механизмов адаптации может привести к переходу физиологической желтухи новорожденных в патологическое состояние. Наблюдения и доказательная база свидетельствуют об отсутствии взаимосвязи вакцинации от вирусного гепатита В с желтухой новорожденных. Критическая гипербилирубинемия может привести к развития ядерной желтухи и ее осложнений.
Дети с патологическими формами неонатальной желтухи подлежат диспансерному наблюдению участкового педиатра и детского невролога.
Гипербилирубинемия – это увеличение содержания в крови билирубина больше 20,5 мкмоль/л. Чаще всего является показателем инфекционной или воспалительной патологии печени, желчевыводящих путей. Также причиной могут выступать метаболические расстройства, гемолитические анемии, другие болезни органов ЖКТ. Ведущим клиническим признаком является желтуха. Остальные симптомы определяются основным заболеванием. Уровень билирубина исследуется в биохимическом анализе крови натощак. Лечение зависит от патологии, на фоне которой развилась гипербилирубинемия.
Гипербилирубинемия
Гипербилирубинемия (ГБН) – это не самостоятельное заболевание, а лабораторный синдром, возникающий при многих нозологических формах. Билирубин – это пигмент желтого цвета, который образуется из гемоглобина эритроцитов, подвергшихся разрушению ретикуло-эндотелиальной системой (синусоиды селезенки). Затем он метаболизируется печенью и экскретируется с желчью. Его повышение подтверждает наличие у пациента истинной желтухи. Определение концентрации фракций билирубина (неконъюгированного, конъюгированного) оказывает помощь в установлении происхождения желтухи (надпеченочной, печеночной, подпеченочной).
Причины гипербилирубинемии
Гипербилирубинемия практически всегда свидетельствует о патологии. Однако есть исключения. Например, причиной гипербилирубинемии может быть длительное голодание (дефицит альбумина, клеточных белков-переносчиков), применение лекарственных препаратов, вызывающих конкурентное торможение захвата гепатоцитами билирубина (рентгеноконтрастные вещества, средства для лечения гельминтозов).
У новорожденных причиной гипербилирубинемии является физиологическая желтуха, развивающаяся вследствие незрелости ферментных систем метаболизма билирубина. Причины патологической гипербилирубинемии следующие (перечислены в порядке частоты развития):
- Болезни печени. Наиболее частая причина гипербилирубинемии. Разрушение мембран гепатоцитов приводит к высвобождению билирубина и его попаданию в кровоток. Это происходит при любых инфекционных поражениях печени (вирусных, бактериальных, протозойных гепатитах), алкогольном, аутоиммунном гепатите, циррозе.
- Заболевания желчевыводящих путей. Вторая по частоте причина гипербилирубинемии. В результате внутрипеченочного и внепеченочного холестаза, который наблюдается при холецистите, желчнокаменной болезни, холангите, повышается проницаемость желчных капилляров. Под действием высокого гидростатического давления билирубин диффундирует в кровеносные сосуды.
- Гемолитические анемии (ГА). При усиленном разрушении эритроцитов (гемолизе) в крови нарастает количество свободного билирубина. Это характерно как для врожденных (наследственный микросфероцитоз, серповидно-клеточная анемия, талассемии), так и для приобретенных гемолитических анемий (пароксизмальная ночная гемоглобинурия, аутоиммунные, лекарственные ГА).
- Наследственные энзимопатии. Генетически обусловленные дефекты ферментов печеночного метаболизма билирубина приводят к нарушению его захвата гепатоцитами, конъюгации с глюкуроновой кислотой или секреции в желчь. Данная группа болезней носит название доброкачественные гипербилирубинемии (синдром Жильбера, Криглера-Найара, Дабина-Джонса).
- Метаболические расстройства. Это редкие наследственные заболевания, поражающие паренхиму печени, при которых в кровь попадает связанный билирубин. К ним относятся гемохроматоз, болезнь Вильсона-Коновалова, лизосомные болезни накопления (болезнь Гоше, Ниманна-Пика).
- Патология верхних отделов ЖКТ. Некоторые болезни органов пищеварения (псевдотуморозный панкреатит, опухоль поджелудочной железы, стеноз большого дуоденального сосочка) могут создавать механическое препятствие оттоку желчи за счет сдавления желчных протоков, тем самым приводя к их переполнению, диффузии желчного пигмента в капилляры.
Патогенез
Особенности патогенеза (механизмов возникновения) гипербилирубинемии определяются причиной. Свободный (непрямой, неконъюгированный) билирубин плохо растворяется в воде, но зато обладает высокой липофильностью, т.е. хорошо растворяется в жирах. Поэтому он может взаимодействовать с фосфолипидами клеточных мембран, особенно клеток головного мозга, благодаря чему проникает через гематоэнцефалический барьер, где разобщает процессы окислительного фосфорилирования и снижает синтез АТФ.
Этим объясняется токсичность свободного билирубина для клеток нервной системы. Наиболее ярко это проявляется у новорожденных детей. Билирубин способен окрашивать кожные покровы, видимые слизистые, мочу, а также кал в характерный желтый или темно-коричневый цвет. При длительном холестазе, вызывающем увеличение концентрации связанного билирубина, может нарушаться катаболизм, экскреция холестерина, что ведет к его накоплению в крови, прогрессированию атеросклероза.
Классификация
В зависимости от того, какая фракция желчного пигмента увеличена, различают:
- Непрямую гипербилирубинемию. Повышен неконъюгированный (не связанный) билирубин. Причиной являются патологии, вызывающие надпеченочную желтуху ‒ гемолитические анемии, доброкачественные гипербилирубинемии.
- Прямую гипербилирубинемию. Сопровождается увеличением уровня конъюгированного (связанного) билирубина. Причиной выступают болезни, приводящие к печеночно-клеточной и подпеченочной желтухе. Наиболее частые из них ‒ это вирусный, алкогольный гепатит, холецистит.
Отдельно выделяется билирубиновая энцефалопатия (ядерная желтуха). Она встречается при гемолитической болезни новорожденных, причиной которой является несовместимость эритроцитарных антигенов (резус-конфликт) матери и плода. Данное заболевание очень тяжелое, оно характеризуется поражением подкорковых ядер, коры головного мозга и требует немедленного лечения.

Симптомы гипербилирубинемии
Накопление желтого пигмента в коже, слизистых оболочках, биологических жидкостях приводит к изменению их окраски, что является основным симптомом гипербилирубинемии. Желтушность склер – наиболее ранний признак, он возникает, когда концентрация билирубина превышает нормальные показатели в 2 раза. Также рано начинают окрашиваться нёбо, задняя часть языка. Кожа приобретает желтый цвет при уровне выше 80-85 мкмоль/л.
Остальные симптомы зависят от причины, вызвавшей гипербилирубинемию. У пациентов с гемолитическими анемиями наблюдается лихорадка (вследствие пирогенной активности свободного билирубина), увеличение селезенки, анемичный синдром – бледность кожи, учащение сердцебиения, снижение артериального давления. При болезнях печени и ЖП пациентов часто беспокоит тяжесть или тупая боль в правом подреберье, приступы желчной колики, нестерпимый кожный зуд.
У больных доброкачественными гипербилирубинемиями в клинической картине преобладает астеновегетативный синдром (общая слабость, сонливость, ухудшение концентрации внимания). У взрослых, в отличие от новорожденных, несмотря на высокую концентрацию желчного пигмента, энцефалопатия не развивается.
Осложнения
Наиболее частые и опасные осложнения связаны не с самой гипербилирубинемией, а с причиной, ее вызвавшей. Тяжелые неблагоприятные последствия гипербилирубинемии возникают у новорожденных при ядерной желтухе. Глубокое повреждение подкорковых ядер и коры больших полушарий головного мозга без своевременного лечения могут привести к нейросенсорной тугоухости, судорогам, а в некоторых случаях, к летальному исходу. Из-за ухудшения экскреции холестерина в желчь возрастает его плазменная концентрация, в результате чего ускоряется процесс формирования атеросклеротической бляшки. Это повышает риск инфаркта миокарда, ишемического инсульта.
Диагностика
Профиль специалиста, который курирует пациента с гипербилирубинемией, определяется вызвавшей ее причиной. Чаще всего такими больными занимаются гастроэнтерологи, гематологи. При обследовании больного внимательно осматриваются кожные покровы, слизистые оболочки глаз, рта, проводится пальпация живота на предмет гепатоспленомегалии, симптомов поражения желчных путей (Мерфи, Ортнера, Кера). Для выяснения причины гипербилирубинемии назначается дополнительное обследование, включающее:
- Лабораторные исследования. В общем анализе крови оценивается уровень эритроцитов, гемоглобина, в мазке крови изучается морфология эритроцитов. В биохимии крови определяются значения фракций билирубина, печеночных трансаминаз, щелочной фосфатазы, гамма-глутамилтранспептидазы. Проверяются показатели обмена железа (ферритин, трансферрин). В анализе мочи измеряется концентрация уробилина, билирубина. С помощью ИФА выявляются антитела к антигенам вирусов гепатита A, B, C, аутоиммунные антитела (ANCA, AMA).
- Инструментальные исследования. На УЗИ органов брюшной полости обнаруживается увеличение, диффузные изменения паренхимы печени, наличие камней, утолщение стенок желчного пузыря. При гемолитической анемии значительно выражена спленомегалия. При некоторых патологиях желчных протоков, поджелудочной железы на ретроградной панкреатохолангиографии отмечаются участки стеноза, расширения протоков.
- Провокационные пробы. Для диагностики доброкачественных гипербилирубинемий, вызванных генетическими дефектами энзимов метаболизма билирубина, проводятся специальные пробы (проба с 48 часовым голоданием, внутривенным введением раствора никотиновой кислоты, бромсульфалеина). При повышении уровня билирубина более, чем на 50%, проба считается положительной.
Лечение гипербилирубинемии
Консервативная терапия
Для нормализации показателей желчного пигмента необходимо бороться с причиной гипербилирубинемии. В зависимости от состояния пациента, он может проходить лечение как амбулаторно, так и в стационаре. Чаще всего таких больных госпитализируют в гастроэнтерологическое отделение. Применяются следующие методы лечения:
- Диета. При заболевании печени и желчного пузыря любой этиологии назначается стол №5 по Певзнеру, при котором питание должно быть частым, малыми порциями. Обязательно исключается алкоголь, жирные, жареные блюда, копчености. Следует избегать употребления продуктов, вызывающих спазм желчного пузыря (помидоры, орехи).
- Непосредственное снижение билирубина в крови. Для лечения ГБН очень эффективная фототерапия ультрафиолетовыми лампами. Под действием УФ-лучей свободный билирубин, накапливаемый в коже, становится водорастворимым, благодаря чему быстро выводится из организма через почки. При неэффективности данного лечения прибегают к переливанию плазмы или крови. Для снижения концентрации непрямого билирубина при доброкачественной ГБН применяется фенобарбитал.
- Противовирусное лечение. Для лечения вирусных гепатитов применяются лекарственные препараты, подавляющие жизнедеятельность вируса гепатита – пелигированный интерферон-альфа, ламивудин, рибавирин. Для лечения гепатита С эффективна трехкомпонентная терапия с энтекавиром.
- Лечение холестаза. При многих заболеваниях, сопровождающихся застоем желчи, необходимо использование медикаментов, стимулирующих желчную экскрецию. Это ЛС, содержащие желчные кислоты (урсодезоксихолевая кислота, аллохол, холензим), растительные желчегонные препараты (кориандр, календула, тысячелистник), секвестранты ЖК (холестирамин).
- Предотвращение гемолиза. Для лечения гемолитических анемий применяются глюкокортикостероиды, внутривенное введение иммуноглобулина, гидроксимочевина. Для лучшей стабилизации мембран эритроцитов назначается постоянный прием фолиевой кислоты.

Хирургическое лечение
Основной метод лечения желчнокаменной болезни и калькулезного холецистита – это оперативное удаление желчного пузыря (лапароскопическая холецистэктомия). В случае безуспешности консервативных методов лечения гемолитической анемии прибегают к удалению селезенки (спленэктомии). Опухоли поджелудочной железы или 12-перстной кишки, вызывающие сдавление протоков, также подлежат оперативному удалению.
Прогноз и профилактика
Прогноз и продолжительность жизни при гипербилирубинемии определяется причиной, т.е. основным заболеванием. Например, гемолитическая болезнь новорожденных, вирусные гепатиты B, C, некоторые формы гемолитических анемий (гемоглобинопатии) характеризуются высокой частотой летального исхода. Доброкачественные гипербилирубинемии, хронический холецистит, напротив, имеют благоприятный прогноз, никак не влияют на продолжительность жизни.
Для профилактики гипербилирубинемии следует ограничить употребление алкоголя, жирной пищи. Резус-отрицательным беременным женщинам для предотвращения развития ГБН вводится антирезусный иммуноглобулин (анти-D-иммуноглобулин).
2. Дифференциальный диагноз внутренних болезней: Алгоритмический подход/ Хили П.М., Джекобсон Э.Дж. - 2014.
3. Дифференциальная диагностика внутренних болезней/ под ред. В.В. Щёкотова, А.И. Мартынова, А.А. Спасского - 2017.
Что такое синдром Жильбера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Синдром Жильбера — это генетический пигментный гепатоз с аутосомно-доминантным типом наследования, протекающий с повышением уровня неконъюгированного (свободного) билирубина, чаще проявляющееся в период полового созревания и характеризующийся доброкачественным течением [1] .
Краткое содержание статьи — в видео:
Синонимы названия болезни: простая семейная холемия, конституциональная или идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха.
По распространённости данное заболевание встречается не менее, чем у 5 % населения, в соотношении мужчин и женщин — 4:1. Впервые заболевание описал французский терапевт Августин Жильбер в 1901 году.
Чаще синдром Жильбера проявляется в период полового созревания и характеризуется доброкачественным течением. Основным проявлением этого синдрома является желтуха.
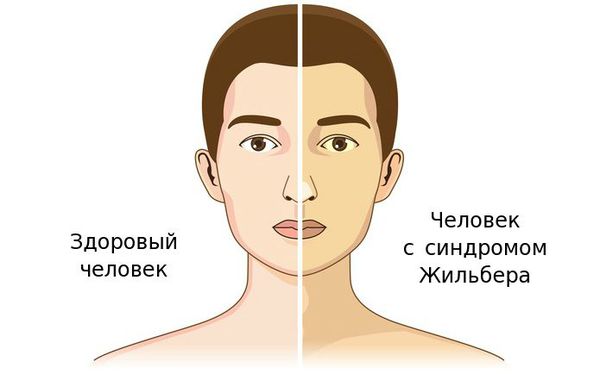
К провоцирующим факторам проявления синдрома можно отнести:
- голодание или переедание;
- жирную пищу;
- некоторые лекарственные средства;
- алкоголь;
- инфекции (грипп, ОРЗ, вирусный гепатит);
- физические и психические перегрузки;
- травмы и оперативные вмешательства.
Причина заболевания — генетический дефект фермента УДФГТ1*1, который возникает в результате его мутации. В связи с этим дефектом функциональная активность данного фермента снижается, а внутриклеточный транспорт билирубина в клетках печени к месту соединения свободного (несвязанного) билирубина с глюкуроновой кислотой нарушается. Это и приводит к увеличению свободного билирубина.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Жильбера
Некоторые специалисты трактуют синдром Жильбера не как болезнь, а как физиологическую особенность организма.
До периода полового созревания данный синдром может протекать бессимптомно. Позже (после 11 лет) возникает характерная триада признаков:
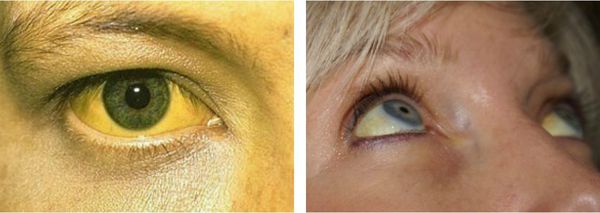
- желтуха различной степени выраженности;
- ксантелазмы век (жёлтые папулы);
- периодичность появления симптомов [1] .
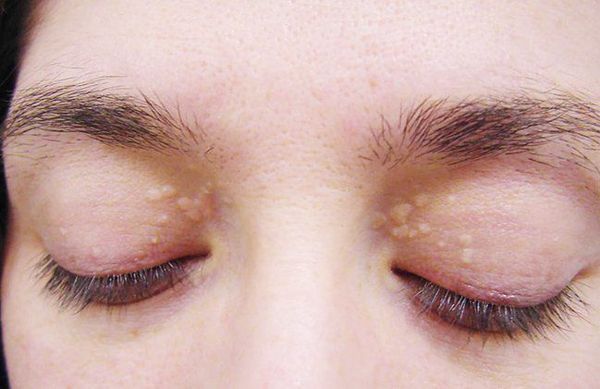
Желтуха чаще всего проявляется иктеричностью (желтушностью) склер, матовой желтушностью кожных покровов (особенно лица), иногда частичным поражением стоп, ладоней, подмышечных впадин и носогубного треугольника.
Заболевание нередко сочетается с генерализованной дисплазией (неправильным развитием) соединительной ткани.
Усиление желтухи может наблюдаться после перенесения инфекций, эмоциональной и физической нагрузки, приёма ряда лекарственных препаратов (в частности, антибиотиков), голодания и рвоты.
Клиническими проявлениями заболевания общего характера могут быть:
- слабость;
- недомогание;
- подавленность;
- плохой сон;
- снижение концентрации внимания.
В отношении ЖКТ синдром Жильбера проявляется снижением аппетита, изменением привкуса во рту (горечь, металлический привкус), реже возникает отрыжка, тяжесть в области правого подреберья, иногда наблюдается боль ноющего характера и плохая переносимость лекарственных препаратов.
При ухудшении течения синдрома Жильбера и существенном повышении токсичной (свободной) фракции билирубина может появляться скрытый гемолиз, усиливая при этом гипербилирубинемию и добавляя в клиническую картину системный зуд.
Патогенез синдрома Жильбера
В норме свободный билирубин появляется в крови преимущественно (в 80-85 % случаев) при разрушении эритроцитов, в частности комплекса ГЕМ, входящего в структуру гемоглобина. Это происходит в клетках макрофагической системы, особенно активно в селезёнке и купферовских клетках печени. Остальная часть билирубина образуется из разрушения других гемсодержащих белков (к примеру, цитохрома P-450).
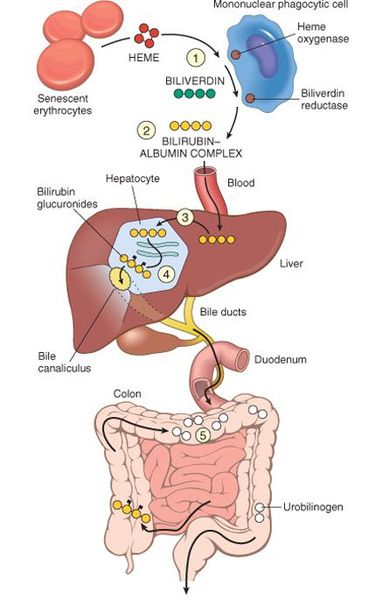
У взрослого человека в сутки образуется приблизительно от 200 мг до 350 мг свободного билирубина. Такой билирубин слаборастворим в воде, но при этом хорошо растворяется в жирах, поэтому он может взаимодействовать с фосфолипидами ("жирами") клеточных мембран, особенно головного мозга, чем можно объяснить его высокую токсичность, в частности токсичное влияние на нервную систему.
Первично после разрушения комплекса ГЕМ в плазме билирубин появляется в неконъюгированной (свободной или несвязанной) форме и транспортируется с кровью при помощи белков альбуминов. Свободный билирубин не может проникнуть через почечный барьер за счёт сцепления с белком альбумином, поэтому сохраняется в крови.
В печени несвязанный билирубин переходит на поверхность гепатоцитов. С целью снижения токсичности и выведения в клетках печени свободного билирубина при помощи фермента УДФГТ1*1 он связывается с глюкуроновой кислотой и превращается в конъюгированный (прямой или связанный) билирубин. Конъюгированный билирубин хорошо растворим в воде, он является менее токсичным для организма и в дальнейшем легко выводится через кишечник с желчью.
При синдроме Жильбера связывание свободного билирубина с глюкуроновой кислотой снижается до 30% от нормы, тогда как концентрация прямого билирубина в желчи увеличивается.
В основе синдрома Жильбера лежит генетический дефект — наличие на промонторном участке A(TA)6TAA гена, кодирующего фермент УДФГТ1*1, дополнительного динуклеотида ТА. Это становится причиной образования дефектного участка А(ТА)7ТАА. Удлинение промонторной последовательности нарушает связывание фактора транскрипции IID, в связи с чем уменьшается количество и качество синтезируемого фермента УДФГТ1, который участвует в процессе связывания свободного билирубина с глюкуроновой кислотой, преобразуя токсичный свободный билирубин в нетоксичный связанный.
Вторым механизмом развития синдрома Жильбера является нарушение захвата билирубина микросомами сосудистого полюса клетки печени и его транспорта глутатион-S-трансферазой, которая доставляет свободный билирубин к микросомам клеток печени.
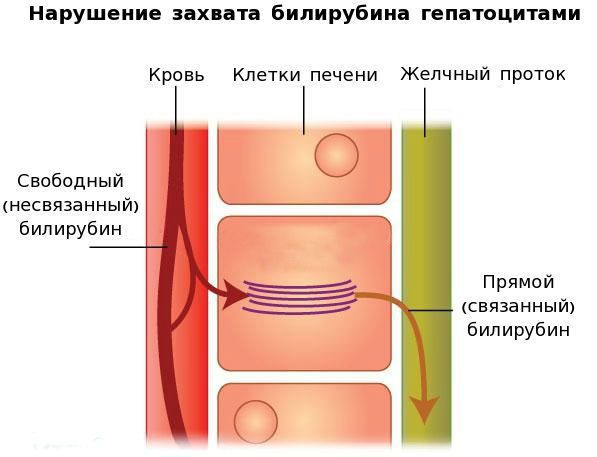
В конечном итоге вышеперечисленные патологические процессы приводят к увеличению содержания свободного (несвязанного) билирубина в плазме, что обуславливает клинические проявления заболевания [6] .
Классификация и стадии развития синдрома Жильбера
Общепринятой классификации синдрома Жильбера не существует, однако условно можно разделить генотипы синдрома по полиморфизму.
Читайте также:

