Биохимические маркеры отравления лекарственными и наркотическими веществами
Обновлено: 23.04.2024
Методы токсикологического скрининга (анализа) и их эффективность
Использовать токсикологический анализ без понимания его ограничений опасно. Токсикологический скрининг характеризуется хорошей специфичностью. Специфичность пропорциональна процентной доле пациентов, в организме которых токсичные вещества присутствуют, но результат анализа отрицательный (хорошая специфичность означает, что тест дает мало ложноположительных результатов).
Однако чувствительность его низка, поскольку многие случаи присутствия токсичных веществ не выявляются. Чувствительность — это доля больных с данным токсином, для которых получен положительный результат (если она высока, ложноотрицительных результатов мало).
Диагностическая ценность отрицательного результата (т. е. доля истинно отрицательных результатов среди всех отрицательных) составляет около 40 %. Для повышения чувствительности и диагностической ценности скрининга необходимы совершенствование аналитических методов, тесное взаимодействие между врачами и лабораториями, правильное взятие проб и понимание ограничений и ценности конкретных тестов.
Ограничения методов токсикологического скрининга
Для скрининга токсинов токсикологические лаборатории применяют несколько методов, поскольку единственного точного и недорогого метода для выявления всех токсинов не существует. Эти методы различаются по стоимости, точности, сложности, скорости и специфичности. Надежность отдельного теста зависит от опыта аналитика, оборудования, метода и числа обрабатываемых заказов.
Трудности возникают в связи с изменениями биологических жидкостей при их хранении, переносом веществ из пробирки в пробирку и стандартами, используемыми при анализе.
Порча колонок для газожидкостной хроматографии приводит к появлению неизвестных остатков, а ионизация газов чревата расщеплением химикатов. Кроме того, лабильные метаболиты подвергаются химическим изменениям, зависящим от используемой аналитической методики. Таким образом, для правильного использования лаборатории необходимо знакомство с ее специфическими потребностями, процессами и ограничениями. Для интерпретации результатов токсикологического скрининга важно знать ответы на следующие вопросы.
1. Какой метод используется для каждой категории веществ и какова его специфичность?
2. Какие вещества выявляются при токсикологическом скрининге и какие его варианты доступны (например, специально для агентов, вызывающих кому, эпилептические припадки; психоактивных средств)?
3. Какая информация необходима в запросе?
4. Какие образцы лучше всего подходят для конкретного анализа?
5. Какие тесты дают количественные и качественные результаты и насколько быстро?
Сравнение аналитических методов токсикологического скрининга
Чаще всего используемая в качестве аналитического метода хроматография основана на разделении веществ при прохождении потока жидкости или газа через твердую (стационарную) фазу, содержащую неизвестный агент. Иммуноанализ (иммуноферментный, радиоиммуноанализ) чувствителен, но менее специфичен, чем хроматография или масс-спектрометрия.
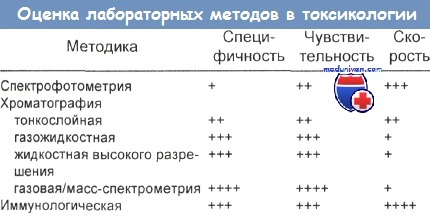
Тонкослойная хроматография
Тонкослойная хроматография (ТСХ) — это простой и недорогой метод качественного скрининга, не дающий количественных результатов. Разделение фракций основано на различной абсорбции веществ при прохождении растворителя через стационарный сорбент (обычно кремниевую кислоту или оксид алюминия). Каждому веществу соответствуют характерное расстояние миграции после нанесения образца на исходную линию и применения соответствующего растворителя. Анализ занимает 2 ч, а его результаты должны интерпретироваться опытным персоналом.
В продаже имеются системы ТСХ для токсикологического скрининга, которые требуют меньше профессиональной подготовки, чем необходима для стандартной ТСХ.
Ультрафиолетовая спектрофотометрия
Ультрафиолетовая спектрофотометрия (УФС) — это простой, экономичный количественный метод, позволяющий выявить токсические уровни ацетаминофена и салицилата в крови, а также повышенный уровень фенотиазина в моче.
Однако точность результата сильно снижается при потреблении нескольких веществ, что в настоящее время ограничивает применимость данного анализа.
Газожидкостная хроматография
Газожидкостная хроматография (ГЖХ) — очень точный и специфичный метод, но требующий довольно много времени. Жидкий или растворенный образец впрыскивают в колонку, он переводится в пар нагреванием. Поток инертных газов пофракционно изгоняет образец из колонки, и появление на выходе различных фракций регистрируется химическими детекторами.
Сравнение времени удержания и площади пиков с известными стандартами позволяет идентифицировать вещества и определить их количества. Этим методом эффективно определяется уровень в крови летучих жидкостей (метанола, этанола, этиленгликоля).
Жидкостная хроматография высокого давления (разрешения)
Жидкостная хроматография высокого разрешения (ЖХВР) по скорости, специфичности и стоимости сходна с газожидкостной хроматографией, но позволяет определить не только летучие вещества. Высокое давление (7000—42 000 кПа) облегчает движение образца через колонку, что способствует разделению сложных соединений, включая конъюгированные метаболиты.
Радиоиммуноанализ
Радиоиммуноанализ самый медленный и дорогой метод, но зато очень точный. Смешивание известных количеств специфичного к веществу антитела с этим же веществом, несущим радиоактивную метку, позволяет анализировать осадок с помощью счетчиков гамма-квантов. Уровень излучения обратно пропорционален количеству выявляемого вещества. Этот тест прекрасно подходит для определения крайне низких концентраций, например каннабинолов, ЛСД, дигоксина, параквата.
Иммуноферментный анализ
Быстрый, дорогой и простой метод, обеспечивающий среднюю точность и специфичность результатов, иммуноферментный анализ (ИФА), основан на том, что количество присутствующего в образце вещества пропорционально степени ингибирования реакции фермента с субстратом. Известное количество искомого вещества метят, химически присоединяя к ферменту.
Специфичные к веществу антитела, добавляемые к образцу, связывают этот комплекс, снижая тем самым его ферментативную активность. Свободное вещество в составе образца конкурирует с тем, что помечено ферментом, а это ограничивает вызываемую антителом инактивацию последнего.
Ферментативная активность, коррелирующая с концентрацией вещества в образце, измеряется по изменению поглощения, происходящему при каталитическом действии фермента на субстрат. ИФА предпочтительнее радиоиммунологического метода в неотложных ситуациях благодаря своей простоте и быстроте получения данных о концентрации токсичного агента.
При его использовании не нужна сложная стадия разделения, обязательная для последнего метода. В мелких лабораториях применяется система st (single test) с компактным спектрофотометром, а в крупных больницах — система dan (drugs of abuse), предназначенная специально для случаев токсикомании. Отрицательный результат, впрочем, не исключает присутствия очень малых количеств искомого агента.
Перекрестные реакции с антителами, способные привести к ложноположительному результату, дают следующие вещества:
• наркотики:
маковое семя,
декстрометорфан,
хлорпромазин,
дифеноксилат;
• амфетамины:
эфедрин,
фенилэфрин,
псевдоэфедрин,
N-ацетилпрокаинамид,
хлорохин,
прокаинамид;
• фенциклидин:
декстрометорфан,
дифенгидрамин,
хлорпромазин,
доксиламин,
тиоридазин.
Самая распространенная причина ложноположительного результата — перекрестная реакция антитела с веществом, которое по структуре сходно с искомым агентом, например с компонентами макового семени, включающими опийные алкалоиды, что дает положительный результат скрининга на опиаты.
Хорошо известна также способность противозастойных капель для носа, в частности эфедрина и фенилпропаноламина, показывать при скрининге мочи положительную реакцию на амфетамины. К такому ложноположительному результату может привести перекрестная реакция антител с L-эфедрином и фенметразином.
Причины ложноотрицательного результата токсикологического скрининга
Причины ложноотрицательных результатов анализа можно разделить на три категории: технологические недостатки, токсикокинетические свойства и предумышленная порча или подмена образца.
Технологические недостатки:
— метод не рассчитан на данное вещество,
— вещество структурно не соответствует прототипу данного класса соединений, например фентанилу,
— низкое качество лабораторной работы.
Токсикокинетические свойства:
— большой объем распределения,
— короткое время полувыведения.
Предумышленная порча или подмена образца:
— предъявление "чистой" мочи другого человека,
— предъявление не мочи, а другой жидкости,
— питье большого количества жидкости,
— прием диуретиков,
— добавка в мочу отбеливателя, едкого агента, "чая" из желтокорня, лимонного сока, соли, мыла или уксуса.
Атомно-абсорбционная спектрофотометрия
Атомно-абсорбционная спектрофотометрия — это обычный метод выявления неорганических агентов (например, свинца, ртути, таллия, кадмия), плохо подходящий для токсикологического скрининга, поэтому большинство его вариантов тяжелых металлов не выявляют.
Плазменная атомно-эмиссионная спектроскопия с индуктивным сопряжением (ПАЭС-ИС) — новый метод, позволяющий проводить одновременный анализ нескольких элементов и полезный в промышленности. Он определяет содержание в одной пробе 17 элементов: алюминия, бария, кадмия, хрома, меди, железа, лантана, свинца, марганца, молибдена, никеля, платины, серебра, стронция, олова, титана и цинка.
Газовая хроматография — масс-спектрометрия
Вероятно, лучшим методом, определяющим присутствие в пробе определенного вещества, является газовая хроматография с масс-спектрометрией (ГХ-МС), однако высокие капитальные и эксплуатационные издержки ограничивают применение его эталонными центрами.
К веществам, знание уровня которых в крови может быть полезным для лечения отравлений, относятся ацетаминофен, салицилаты, карбоксигемоглобин, метгемоглобин, метанол, этиленгликоль, литий, железо, паракват, дигоксин, теофиллин и фосфорорганические соединения. Специфическое применение этой информации рассмотрено в соответствующих отдельных статьях на сайте (рекомендуем пользоваться формой поиска на главной странице сайта).
Гипокальциемия при отравлении
Гипокальциемия особенно часто наблюдается при отравлении фтороводородом, оксалатами, этиленгликолем и органическими соединениями олова, причем нередко у больных в критическом состоянии, сочетающемся с сердечно-сосудистой или нервно-мышечной недостаточностью.
Кристаллурия при отравлении
Кристаллурия может быть следствием отравления сульфаниламидами, четыреххлористым углеродом, примидоном и ампициллином. Массивная кристаллурия обычно связана с потреблением оксалатов или этиленгликоля.
Анализ пота при отравлении
К веществам, выявляемым путем анализа "пятен пота", относятся кокаин, героин, метамфетамин, фенциклидин и тетрагидроканнабинол.
Тесты у постели больного с отравлением
К тестам на присутствие в организме отравляющего вещества, не требующим отправки образцов в лабораторию, относятся определение специфического запаха, скрининг хлоридом трехвалентного железа на салицилаты (положительный результат подтверждает их наличие в сыворотке), нитропруссидная проба на кетоны (Ацетест), визуальное исследование крови на эритроцитарные аномалии, микроскопическое исследование мочи на кристаллы, проверка с помощью тест-палочки на острый некроз скелетных мышц или гемолиз, диагностическое использование налоксона, проверка тест-палочкой на этанол, применение индикаторной трубки для выявления этанола, метанола и изопропанола, а также некоторые другие тесты, ценность которых еще недостаточно изучена (на ацетаминофен, цианид, салицилат свинца, теофиллин — описаны в отдельных статьях на сайте (рекомендуем пользоваться формой поиска на главной странице сайта).
ЭКГ при отравлении
Электрокардиомониторинг полезен для обнаружения фармакогенных аритмий и нарушений калиевого, магниевого и кальциевого баланса.

Учебное видео расшифровки ЭКГ при электролитных нарушениях

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Также рекомендуем "N"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Сравнение процедур пробоподготовки при химико-токсикологическом исследовании мочи на наличие наркотических средств, психотропных веществ и их метаболитов
Журнал: Судебно-медицинская экспертиза. 2019;62(4): 42‑46
Сравнили методики пробоподготовки для ненаправленного химико-токсикологического исследования мочи методами газовой хроматографии с масс-селективным детектированием и высокоэффективной жидкостной хроматографии с масс-селективным детектированием. Методы предназначены для аналитической диагностики наличия в организме человека наркотических средств, психотропных веществ и их метаболитов.
В последние годы растет число синтетических психоактивных соединений. Это осложняет работу рутинных химико-токсикологических лабораторий, в которых исследуют биологические образцы, взятые от пациентов в состоянии интоксикации или в рамках проводимых медицинских освидетельствований на состояние опьянения.
Вновь появляющиеся психоактивные вещества практически не изучены: неизвестны клинические признаки интоксикации, пути метаболизма в организме человека, их фармакокинетические и фармакодинамические свойства. Большинство этих соединений нельзя обнаружить с помощью иммунохроматографических тестов, поэтому каждое химико-токсикологическое исследование становится ненаправленным и выполняется с применением хромато-масс-спектрометрического оборудования. Рутинный химико-токсикологический анализ стал в 2—3 раза более продолжительным по времени. В этих условиях актуальна задача разработки таких методов пробоподготовки и анализа, которые помогут не только повысить информативность химико-токсикологического исследования, но и увеличить пропускную способность лаборатории.
Задачи исследования:
— провести сравнительную оценку изолирования методами ЖЖЭ и ТФЭ наркотических, психотропных веществ и их метаболитов из мочи для исследования методами ГХМС и ВЭЖХ—МС/МС;
— апробировать процедуры подготовки проб для ГХМС и ВЭЖХ—МС/МС в ненаправленном химико-токсикологическом исследовании реальных образцов мочи.
Материал и методы
Процедура ЖЖЭ. 3 мл мочи подвергали минеральному гидролизу с 200 мкл 10Н КОН 30 мин при температуре 50 °C. Экстрагировали 1,5 мл смеси дихлорметан/гептан/изопропанол в соотношении 6:3:1 при рН 8,0—9,0. После центрифугирования верхний органический слой переносили в емкость для упаривания. Водную фазу вновь подкисляли до рН 2,0—3,0 и экстрагировали 1,5 мл смеси гептан/этилацетат в соотношении 7:1. После центрифугирования верхний органический слой объединяли с предыдущим экстрактом и упаривали в вакуумном экстракторе при температуре 45 °C. Для ВЭЖХ—МС/МС сухой экстракт растворяли в 400 мкл ацетонитрила. Для ГХМС проводили дериватизацию с 50 мкл 1% ТМХС в БСТФА и 50 мкл этилацетата в течение 30 мин при температуре 100 °C. Финальный объем доводили до 200 мкл этилацетатом [1].
Процедура ТФЭ. Патрон для ТФЭ (SampliQ Evidex, 200 мг, 3 мл) предварительно концентрировали последовательным пропусканием 1 мл метанола, 2 мл воды и 2 мл 0,1 М фосфатного буфера с рН 6,0. Затем 3 мл мочи подвергали минеральному гидролизу с 200 мкл 10Н КОН в течение 30 мин при температуре 50 °C. Доводили значение рН до 6,0—7,0 концентрированной НСl и добавляли 3 мл 0,1 М фосфатного буфера рН 6,0. После центрифугирования супернатант загружали в патрон для ТФЭ со скоростью 1—2 мл/мин. Промывали патрон последовательным пропусканием 3 мл воды и 2 мл 0,1 М ацетатного буфера рН 4,0. После вакуумного подсушивания в течение 1 мин патрон промывали 0,5 мл метанола и продолжали подсушивать еще в течение 5 мин. Элюирование проводили 2 мл смеси дихлорметан/аммиак концентрированный в соотношении 98:2. Упаривали в вакуумном экстракторе при температуре 45 °C. Для ВЭЖХ—МС/МС сухой экстракт растворяли в 400 мкл ацетонитрила, а для ГХМС проводили дериватизацию с 50 мкл 1% ТМХС в БСТФА и 50 мкл этилацетата 30 мин при температуре 100 °C. Финальный объем доводили до 200 мкл этилацетатом.
Процедура ПВ 4:1 для ВЭЖХ—МС/МС. 400 мкл мочи и 100 мкл ацетонитрила перемешивали 10 с и центрифугировали в течение 10 мин при 15 000 об/мин. Затем 400 мкл супернатанта переносили в виалу для хроматографирования.
Процедура ПВ 1:1 для ВЭЖХ—МС/МС. 250 мкл мочи и 250 мкл ацетонитрила перемешивали 10 с и центрифугировали в течение 10 мин при 15 000 об/мин. Затем 400 мкл супернатанта переносили в виалу для хроматографирования.
Метод ГХМС. Анализатор — Agilent 7890A/5975C с кварцевой капиллярной колонкой Rxi-5ms длиной 30 м, диаметром 0,25 мм, толщиной пленки нанесенной неподвижной фазы (5%-фенил)-полиметилсилоксана 0,25 мкм. Анализ в режиме постоянного потока газа-носителя гелия 1,2мл/мин. Объем вводимого образца 1 мкл, без разделения потока. Температура инжектора 280 °C, интерфейса 280 °C. Программа термостатирования колонки: 1 мин при температуре 100 °C, увеличение температуры до 290 °C со скоростью 25 °C в 1 мин, 7 мин при температуре 290 °C. Режим сканирования по полному ионному току (SCAN). Температура источника ионов 230 °C, температура анализатора 150 °C. Диапазон масс m/z 41—650 а.е.м. Идентификацию целевых соединений выполняли с помощью программ AMDIS и MSD ChemStation с использованием библиотек масс-спектров MWP2011, NIST11, Wiley 9, SUDMED_2288_AMDISLIB/NISTLIB/ACSLIB_20160314 [1—3].
Метод ВЭЖХ—МС/МС. Применялся метод, представленный в информационном письме ННЦ наркологии Минздрава России в 2014 г. [4].
Результаты
Для изолирования и концентрирования целевых соединений протестировали два метода: ЖЖЭ при рН 8,0—9,0 и при рН 2,0—3,0 после щелочного гидролиза и ТФЭ при рН 6,0—7,0 после щелочного гидролиза. Как видно из данных табл. 1 и 2, более эффективным методом изолирования и концентрирования из мочи наркотических средств, психотропных веществ и их метаболитов при химико-токсикологическом скрининге можно считать ТФЭ.
Провели сравнительную оценку процедур ЖЖЭ, ТФЭ и ПВ для ВЭЖХ—МС/МС. Установили, что несомненным преимуществом прямого ввода образца для метода ВЭЖХ—МС/МС является возможность выявления и идентификации глюкуронидов целевых соединений (в том числе этилглюкуронида). Способы подготовки проб без концентрирования позволили выявить методом ВЭЖХ—МС/МС лишь часть каннабимиметиков, присутствовавших в образцах (см. табл. 1, 2). Очевидно, несмотря на привлекательность данного способа пробоподготовки, для определения продуктов метаболизма синтетических каннабимиметиков и тетрагидроканнабинола необходимы процедуры изолирования после предшествующего гидролиза и концентрирования.
Психостимуляторы aPVP и MDPV выявляли независимо от способа пробоподготовки и инструментального метода. Методы изолирования и концентрирования не имеют никакого преимущества в интенсивности отклика соединений на хроматограмме по сравнению с методом прямого ПВ (см. табл. 1, 2).
Выводы
1. Для идентификации маркеров наркотических средств и психоактивных веществ в моче методом ГХМС более эффективна (в 1,5—2 раза) процедура пробоподготовки ТФЭ, чем ЖЖЭ. Для исследования методом ВЭЖХ—МС/МС эффективность процедур пробоподготовки ЖЖЭ и ТФЭ практически равнозначна.
2. Преимущество процедур ПВ 4:1 и ПВ 1:1 для метода ВЭЖХ—МС/МС состоит в возможности определения глюкуронидов целевых соединений. Нецелесообразно применять только этот метод при проведении скринингового химико-токсикологического исследования, так как он позволяет выявить методом ВЭЖХ—МС/МС часть маркеров каннабимиметиков, присутствующих в образцах мочи (в данном эксперименте 11 из 15 целевых аналитов).
3. Сочетание ГХМС с процедурой пробоподготовки ТФЭ и одновременно ВЭЖХ—МС/МС с процедурой пробоподготовки ПВ 4:1 позволяет в 1,5 раза повысить выявляемость целевых соединений при проведении ненаправленного химико-токсикологического исследования.
Алматинский филиал РГКП "Центр судебной медицины" Минздрава Республики Казахстан Казахского национального медицинского университета им. С.Д. Асфендиярова, Алматы
Казахский национальный медицинский университет им. С.Д. Асфендиярова;
Алматинский филиал "Центр судебной медицины" Минздрава Республики Казахстан
Алматинский филиал РГКП "Центр судебной медицины" Минздрава Республики Казахстан Казахского национального медицинского университета им. С.Д. Асфендиярова, Алматы
Казахский национальный медицинский университет им. С.Д. Асфендиярова;
Алматинский филиал "Центр судебной медицины" Минздрава Республики Казахстан
Казахский национальный медицинский университет им. С.Д. Асфендиярова;
Алматинский филиал "Центр судебной медицины" Минздрава Республики Казахстан
Алматинский филиал РГКП "Центр судебной медицины" Минздрава Республики Казахстан
Алматинский филиал РГКП "Центр судебной медицины" Минздрава Республики Казахстан
Изменение биохимических и химико-токсикологических показателей перикардиальной жидкости при смертельных отравлениях наркотиками
Журнал: Судебно-медицинская экспертиза. 2014;57(1): 34‑36
Алтаева А.Ж., Жунисов С.С., Айдаркулов А.Ш., Селивохина Н.В., Кидралиев Р.Р., Дарикулова Б.У., Загуменникова А.А. Изменение биохимических и химико-токсикологических показателей перикардиальной жидкости при смертельных отравлениях наркотиками. Судебно-медицинская экспертиза. 2014;57(1):34‑36.
Altaeva AZh, Zhunisov SS, Aĭdarkulov ASh, Selivokhina NV, Kidraliev RR, Darikulova BU, Zagumennikova AA. Changes in the biochemical, chemical and toxicological characteristics of pericardial fluid in the case of fatal drug intoxication. Sudebno-Meditsinskaya Ekspertisa. 2014;57(1):34‑36. (In Russ.).
Алматинский филиал РГКП "Центр судебной медицины" Минздрава Республики Казахстан Казахского национального медицинского университета им. С.Д. Асфендиярова, Алматы
Цель исследования - установление наличия и определение вида наркотического вещества и изучение изменений количества ферментов АсТ, АлТ и КФК в перикардиальной жидкости и разработка критериев судебно-медицинской диагностики смертельных отравлений наркотическими веществами. Исследовали перикардиальную жидкость и кровь, изъятые при судебно-медицинской экспертизе 247 трупов (87,04% мужчин и 12,96% женщин) в возрасте от 13 до 35 лет, умерших от отравления наркотиками (142 человека - группа "отравление") и других причин (105 человек - группа "контроль"). При исследовании перикардиальной жидкости использовали методы газожидкостной хроматографии для установления наличия и определения вида наркотических веществ, а также биохимический, колориметрический методы для определения количества ферментов АсТ, АлТ и КФК. В группе "контроль" ни в одном из 105 случаев наркотические вещества или следы их метаболитов не обнаружены, показатели количества ферментов не превышали норму. В группе "отравление" во всех исследованных образцах достоверно установлены изменения показателей биохимического состава перикардиальной жидкости и крови и значительное повышение количества ферментов АсТ, АлТ и КФК по сравнению с нормой. В группе "контроль" показатели количества ферментов не превышали норму. В группе "отравление" выявлены значительные повышения количества ферментов АсТ, АлТ и КФК в перикардиальной жидкости и крови по сравнению с нормой. Полученные результаты исследования позволяют предложить достоверные критерии судебно-медицинской диагностики смертельных отравлений наркотическими веществами по изменениям химико-токсикологических и биохимических показателей перикардиальной жидкости.
Алматинский филиал РГКП "Центр судебной медицины" Минздрава Республики Казахстан Казахского национального медицинского университета им. С.Д. Асфендиярова, Алматы
Казахский национальный медицинский университет им. С.Д. Асфендиярова;
Алматинский филиал "Центр судебной медицины" Минздрава Республики Казахстан
Алматинский филиал РГКП "Центр судебной медицины" Минздрава Республики Казахстан Казахского национального медицинского университета им. С.Д. Асфендиярова, Алматы
Казахский национальный медицинский университет им. С.Д. Асфендиярова;
Алматинский филиал "Центр судебной медицины" Минздрава Республики Казахстан
Казахский национальный медицинский университет им. С.Д. Асфендиярова;
Алматинский филиал "Центр судебной медицины" Минздрава Республики Казахстан
Алматинский филиал РГКП "Центр судебной медицины" Минздрава Республики Казахстан
Алматинский филиал РГКП "Центр судебной медицины" Минздрава Республики Казахстан
Цель исследования - биохимическое и химико-токсикологическое изучение ПЖ для совершенствования судебно-медицинской диагностики смерти от отравления наркотиками.
В соответствии с поставленной целью определены следующие задачи.
1. Установить наличие и определить вид наркотического вещества в ПЖ методом тонкослойной хроматографии у лиц, умерших от отравления наркотическими веществами.
2. Изучить изменения некоторых биохимических показателей ПЖ у лиц, умерших от отравления наркотическими веществами.
3. Разработать критерии судебно-медицинской диагностики смертельных отравлений наркотическими веществами по биохимическим и химико-токсикологическим показателям в ПЖ.
Материал и методы
Вскрытие трупов проводили по методу Шора. В обеих группах для сравнительного исследования брали кровь (КР) и ПЖ одноразовыми стерильными шприцами вместимостью 5-10 мл или в стерильные пластиковые пробирки с герметичной крышкой. Объекты в течение 1 ч отправляли в лабораторию для химико-токсикологических и биохимических исследований.
Для обнаружения наркотических веществ и установления их вида использовали химико-токсикологический метод тонкослойной хроматографии: 10 мл ПЖ подкисляли 10% раствором щавелевой кислоты до pH 2,0, перемешивали и извлекали хлороформом по 5×10×10 мл сначала из кислого раствора, затем из щелочного. Подщелачивание проводили 25% раствором аммиака до pH 9,0-10,0 по УИ. Затем 1/10 часть кислого хлороформного извлечения, полученного из объекта, после предварительного упаривания током теплого воздуха до 0,5 мл, наносили в ряд точек на две хроматографические пластинки с закрепленным слоем силикагеля КСК, забуференного 0,1 н. раствором борной кислоты. Рядом на те же пластинки наносили спиртовые 0,05% растворы свидетелей фенобарбитала и этаминал-натрия. Пластинки хроматографировали в двух системах: хлороформ - н-бутанол - 25% раствор аммиака (70:40:5) и ацетон-хлороформ (1:9). После высушивания обе пластинки последовательно опрыскивали 0,02% раствором дифенилкарбазона в хлороформе и 2% раствором сульфата ртути в 8% растворе серной кислоты. В зонах исследуемых проб красно-фиолетовых пятен не наблюдали. У свидетелей отмечали красно-фиолетовые пятна: с Rf 0,44 у фенобарбитала и с Rf 0,93 у этаминал-натрия (1-я пластинка) и с Rf 21 у фенобарбитала, и с Rf 0,38 у этаминал-натрия (2-я пластинка). После этого 1 мл щелочного хлороформного извлечения из объекта наносили в ряды точек на предметном стекле, хлороформ испаряли, сухие остатки растворяли в капле 0,01 н. раствора соляной кислоты. В 1-й ряд точек добавляли по капле раствора йодида висмута в йодиде калия (реактив Драгендорфа); во 2-й - по капле раствора йода в йодиде калия и наблюдали помутнение капель в извлечении ПЖ. Далее 1/10 часть щелочного хлороформного извлечения из ПЖ после предварительного упаривания током теплого воздуха до 0,5 мл наносили в ряд точек на две хроматографические пластинки с закрепленным слоем силикагеля КСК, забуференного 0,1 н. раствором едкого натра, и на пластинку Sorbfil.
На 1-й пластинке рядом с пробами в качестве свидетелей наносили 0,05% хлороформные растворы морфина, кодеина, димедрола и героина. Пластинку хроматографировали в системе толуол-ацетон-этанол - 25% раствор аммиака (45:45:7:3), после высушивания опрыскивали реактивом Драгендорфа (приготовлен по прописи ГФ Х издания) и наблюдали оранжевые пятна во всех извлечениях с Rf 0,24. Отмечали также аналогичного цвета пятна у свидетелей морфина с Rf 0,26, кодеина с Rf 0,32, димедрола с Rf 0,75 и героина с Rf 0,60. На 2-й пластинке в качестве свидетелей использовали 0,05% хлороформные растворы морфина и димедрола. Пластинку хроматографировали в системе этилацетат-этанол- 25% раствор аммиака (85:10:5), после высушивания обрабатывали реактивом Марки (формалинсерная кислота) и наблюдали фиолетовое окрашивание пятен с Rf 0,33 в извлечении ПЖ. У свидетелей выявили красно-фиолетовое окрашивание пятен у морфина с Rf 0,33 и лимонно-желтое у димедрола с Rf 0,85.
Для определения содержания ферментов АсТ, АлТ, КФК использовали колориметрический метод. Сравнивали количество ферментов в ПЖ с нормальными показателями ферментов в крови.
Результаты и обсуждение
Содержание фермента КФК у мужчин и женщин в обеих группах не исследовали, так как подавляющее большинство составляли мужчины (87,04%), что не позволило объективно оценить полученные результаты.
Выводы
3. Таким образом, обнаружение наркотиков и трехкратное увеличение содержания ферментов АсТ, АлТ и КФК в ПЖ можно считать достоверными критериями диагностики смерти от отравления наркотическими веществами. Следовательно, при судебно-медицинской экспертизе смертельных отравлений наркотическими веществами необходимо использовать ПЖ в качестве объекта экспертизы как для химико-токсикологических, так и для биохимических исследований.
Анализ мочи для диагностики наркотиков, психоактивных веществ
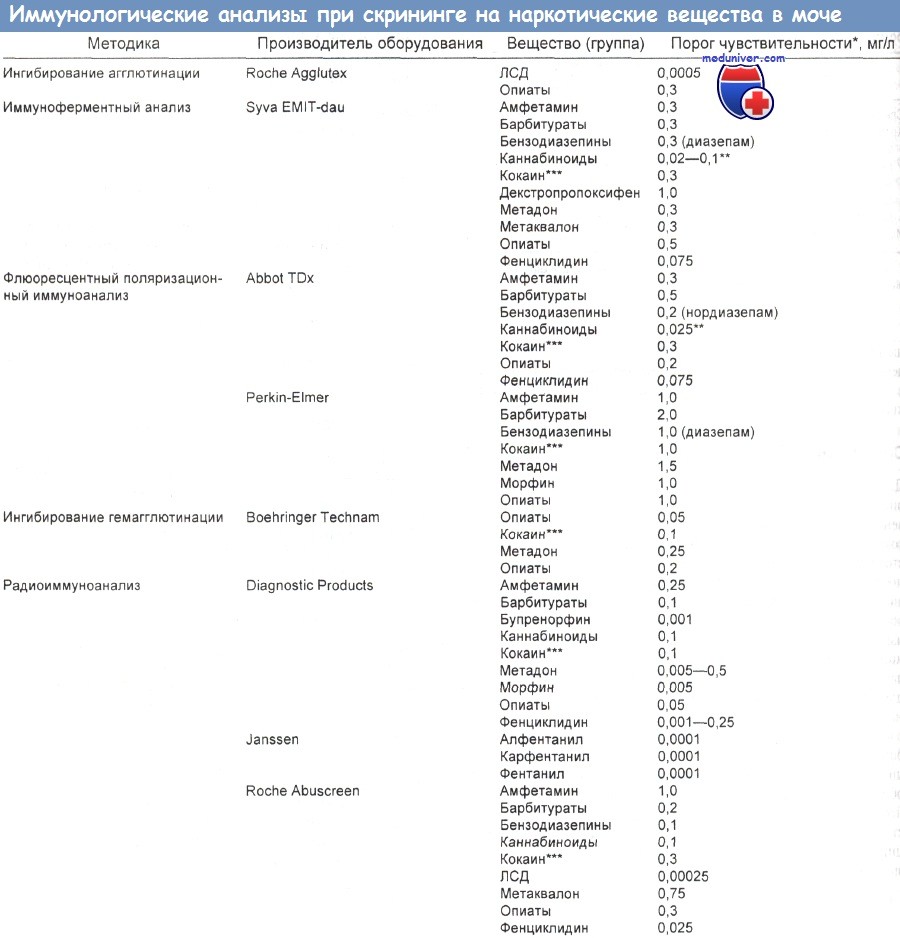
Сведения о скрининге на злоупотребление психоактивными веществами (ПВЗ) и его диагностике обобщены в таблице ниже.
- Анализы мочи для диагностики отравления психоактивными веществами (ПВЗ). Анализы мочи на психоактивные вещества (ПВЗ) включают два типа процедур: скрининговые (первичные) и окончательные (подтверждающие).
Для скрининга обычно используют быстрые и недорогие методы. Окончательные анализы призваны хотя бы частично отсеять ложноположительные результаты.
- Проверка на рабочем месте. Обязательные нормативы Федеральных программ по наркологической проверке на рабочих местах требуют применения для скрининга иммуноаналитических методов, а для подтверждения результатов — газовой хроматографии или масс-спектрометрии.

- Скрининговые анализы. Показания. Вескими основаниями для проведения скрининга на психоактивные вещества (ПВЗ) являются заметное ухудшение или отклонения в поведении, настроении, рассудительности и мышлении (галлюцинации, паранойя, шизофрения) у молодого человека; ухудшение успеваемости или прогулы учебы/работы; антиобщественное поведение, например хроническая ложь, воровство и неуважение чужих прав; неоднократное насилие в отношении людей или посягательства на чужую собственность; серьезные депрессивные или биполярные расстройства настроения; попытки самоубийства; необъяснимое утомление у человека; хронический вазомоторный ринит; припадки или кома неясной этиологии; недавнее окончание лечения по поводу зависимости от марихуаны, кокаина или опиатов.
Взятие проб. Непрерывный контроль. Путь пробы мочи для анализа на психоактивные вещества (ПВЗ) необходимо документировать с момента ее забора на протяжении всей транспортировки в этикетированной запечатанной таре и во время анализа. Если пробу берут без наблюдения, необходимо сразу же зарегистрировать рН, температуру и плотность. У свежей мочи температура должна составлять 33—36 °С, а рН — от 4,6 до 8,0.
Хранение. Пробу мочи можно хранить при комнатной температуре до 3 сут или в холодильнике до 1 нед, а для длительного хранения (недели — месяцы) лучше всего замораживать при температуре —6,6 °С или ниже. Если планируется анализ на ЛСД, мочу надо держать в темном месте.
Наблюдение после анализа. Если проба оказалась положительной, окончательные выводы следует делать, исходя из результатов дополнительных периодических или нерегулярных анализов.
Пороговый уровень. Пороговый уровень устанавливается изготовителем аналитического оборудования и показывает, при какой выявленной концентрации вещества высока статистическая вероятность того, что результат не является ложноположительным. Результаты ниже стандартного порогового уровня считаются отрицательными, даже если более чувствительный метод или иной пороговый уровень отнес бы их к положительным.
Пороговый уровень устанавливают с учетом чувствительности конкретного аналитического метода, перекрестных реакций, накопленного опыта и методики, выбранной для подтверждения результатов (обычно это газовая хроматография — масс-спектрометрия).

- Окончательные анализы. Стандартным методом окончательного токсикологического анализа считается газовая хроматография — масс-спектрометрия (ГХ/МС). Она способна определить большинство ПВЗ и их метаболиты с чувствительностью до нескольких нанограммов на миллилитр. Положительный результат иммуноанализа подтверждают самыми точными методами ГХ/МС, включающими ионизацию путем электронной бомбардировки, трехионный мониторинг и определение ионных соотношений.
Если речь не идет о судебно-медицинской экспертизе, результаты тонкослойной хроматографии (TCX) можно подтверждать жидкостной хроматографией высокого разрешения (ЖХВР) или газожидкостной хроматографией (ГЖХ). ГЖХ полезна для выявления в моче и крови алкоголя и летучих вдыхаемых веществ. При ЖХВР ультрафиолетовый, флюоресцентный или электрохимический детектор, установленный на выходе из колонки, позволяет измерять концентрации психоактивных веществ (ПВЖ) с большими чувствительностью и специфичностью, чем ТСХ. При ГЖХ также применяют разные типы детекторов, например азотно-фосфорный.
Перекрестно реагирующие вещества. Широко распространенные вещества, дающие перекрестные реакции при скрининговом иммуноанализе, приведены в таблице ниже.


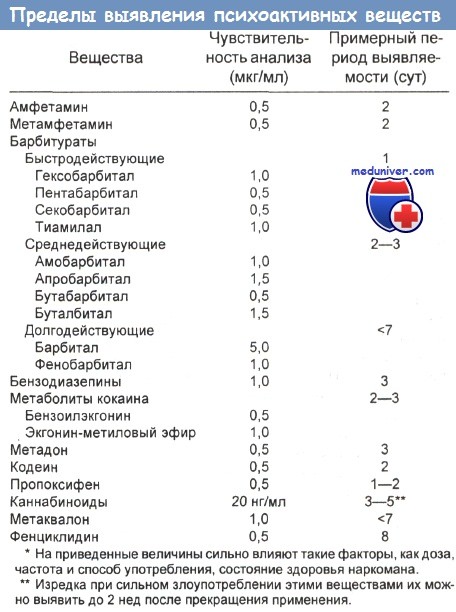
- Время получения результатов. Время выявления психоактивными веществами (ПВЗ) в моче при использовании их пороговых уровней указано в таблице ниже. Пределы обнаружения обычных психоактивными веществами (ПВЗ) приведены в таблице ниже. Проблемы, с которыми приходится сталкиваться при анализе проб мочи у работников промышленности, источники ошибок при таких исследованиях обобщены в ниже. Способы фальсификации сдаваемых на анализ проб рассмотрены в следующей отдельной статье на сайте.
Пробы мочи, направляемые на анализ психоактивных веществ (ПВЗ), необходимо проверять на креатинин. Если его уровень ниже 4,0 ммоль/л, отрицательные результаты по психоактивными веществами (ПВЗ) могут быть недействительными.

Рекомендации по скринингу мочи на психоактивные вещества:
1. Определите, нужен ли скрининг. Оправдан ли он интересами здравоохранения или производственными проблемами, связанными со злоупотреблением психоактивными веществами?
2. Определите цель скрининга. Должен ли анализ выявлять только официально запрещенные средства или будет частью более общей программы по борьбе со злоупотреблением психоактивными веществами, включая алкоголь, безрецептурные или рецептурные лекарства?
3. Определите необходимый тип анализа. Какие вещества он должен выявить?
4. Определите частоту скрининга. Проводить ли его при приеме на работу, периодически или в связи с несчастными случаями и авариями на производстве? В настоящее время, по-видимому, юридически почти решен вопрос о необходимости проведения скрининга мочи при приеме на работу; однако остаются существенные проблемы, касающиеся рандомизированного периодического скрининга.
5. Выберите подходящую лабораторию, способную обеспечить бесперебойное обслуживание и проведение окончательных (подтверждающих) анализов при положительных результатах первичного скрининга.
6. Составьте протокол работы в случае положительных результатов анализа еще до внедрения программы скрининга. (Неразумно дожидаться результатов скрининга при приеме на работу, чтобы потом обсуждать, как поступить с кандидатом на место.)
7. Определите стоимость программы, учитывая возможные расходы на окончательные анализы.
8. Помните о не учтенных скринингом веществах, способных влиять на работоспособность, например об алкоголе, рецептурных или безрецептурных лекарствах.
9. Помните об ограничениях скрининга. Возможны ложноположительные результаты. В идеале скрининг должен сочетаться с более широкой программой борьбы со злоупотреблением психоактивными средствами, в том числе с просветительской работой среди служащих и руководителей предприятия.
10. Будьте реалистами. Скрининг не решает проблемы злоупотребления психоактивными веществами.
Источники ошибок при анализе мочи на вызывающие зависимость психоактивные вещества:
• Подмена проб мочи проверяемым (мочой не употребляющего психоактивных веществ человека или яблочным соком)
• Порча пробы путем разведения водой, хлоридом натрия, уксусом, нашатырным спиртом, гидрохлоритом натрия или мыльным раствором
• Помехи, обусловленные применением отпускаемых без рецепта лекарств или потреблением пищевых продуктов, особенно при проверке на амфетамины (симпатомиметики) и опиаты
• Ошибки, связанные со сбором или хранением проб (грязная посуда, неотфильтрованная мутная моча, хранение при комнатной температуре в течение 4 сут и более, действие яркого света (разрушает ЛСД)
• Технические ошибки, связанные с ненадежностью оборудования, его редкой калибровкой, нехваткой положительных и отрицательных контрольных проб, недостаточной "прогретостью" техники, избытком растворителя (тонкослойная хроматография), колебаниями температуры (иммуноанализ с ферментативным усилением), повторным использованием материала из прошлых положительных проб
• Административные ошибки, связанные с анализом не тех проб, неправильной маркировкой, неаккуратной регистрацией результатов, неверным написанием фамилий
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

