Блрс инфекция что это такое
Обновлено: 23.04.2024
Эта информация рассказывает о бактериях, вырабатывающих бета-лактамазу расширенного спектра (ESBL), в том числе о путях их распространения и способах лечения вызываемых ими инфекций.
Что представляет собой бета-лактамаза расширенного спектра?
Некоторые микроорганизмы, к примеру, кишечная палочка (E. coli) и клебсиелла, вырабатывают фермент, называемый бета-лактамазой расширенного спектра (ESBL). Этот фермент делает микроорганизмы более стойкими к антибиотикам.
Микроорганизмы, вырабатывающие ESBL, могут вызывать различные заболевания, например:
- Инфекции мочеполовой системы
- воспаление легких;
- кровяные инфекции;
- раневые инфекции.
В чем состоит разница между колонизацией и инфицированием микроорганизмами, вырабатывающими ESBL?
Человек может быть либо колонизирован, либо инфицирован микроорганизмами, вырабатывающими ESBL. Колонизация означает наличие микроорганизмов на коже или в организме человека при отсутствии каких-либо симптомов заболевания. Инфицирование означает наличие микроорганизмов на коже или в организме, и при этом они вызывают заболевание.
Как распространяются микроорганизмы, вырабатывающие ESBL?
Большинство инфекций, вызываемых вырабатывающими ESBL микроорганизмами, распространяется через прямой контакт с физиологическими жидкостями инфицированного человека (кровь, выделения из раны, моча, стул или флегма). Также они могут распространяться через контакт с оборудованием или поверхностями, которые могут быть заражены бактериями. Они не распространяются при простом контакте, например через прикосновение или объятие.
Кто подвержен риску инфицирования микроорганизмами, вырабатывающими ESBL?
Инфекции, вызываемые вырабатывающими ESBL бактериями, чаще возникают у людей:
- старшего возраста;
- с ослабленной иммунной системой;
- страдающих хроническими заболеваниями, такими как рак и диабет;
- ранее принимавших антибиотики;
- недавно перенесших операцию;
- лежавших в больнице много раз или длительное время;
- с открытыми ранами или язвами;
- с установленными трубками или дренажами.
Каковы симптомы инфекции, вызываемой вырабатывающими ESBL микроорганизмами?
Симптомы будут зависеть от места возникновения и типа инфекции.
Каковы методы лечения инфекции, вызываемой вырабатывающими ESBL микроорганизмами?
Инфекции, вызываемые вырабатывающими ESBL микроорганизмами, лечатся антибиотиками, к которым у них нет устойчивости. Ваш врач выберет для вас лекарство(-а) в зависимости от того, где возникла инфекция, и какой микроорганизм ее вызвал.
Какие меры по изоляции принимаются в больнице, если у меня обнаруживается инфекция, вызываемая вырабатывающими ESBL микроорганизмами?
Меры по изоляции - это мероприятия, которые мы проводим, чтобы предотвратить распространение инфекции среди пациентов. Если во время пребывания в больнице у вас диагностировали инфекцию, вызываемую вырабатывающими ESBL микроорганизмами:
- Вас поместят в отдельную палату.
- На вашей двери повесят табличку с информацией о том, что весь персонал и посетители должны вымыть руки с мылом или протереть их спиртосодержащим антисептиком для рук перед входом и после выхода из вашей палаты.
- Весь персонал и посетители должны надеть желтый халат и перчатки во время пребывания в вашей палате. Они выдаются за пределами вашей палаты и могут быть утилизированы в вашей палате.
- Если вы выходите из палаты для проведения исследований, вам следует надеть желтый халат и перчатки или покрыться чистой простыней.
- Если вы выходите из своей палаты, чтобы прогуляться по отделению, вам следует надеть желтый халат и перчатки.
- Вам запрещен доступ в следующие зоны больницы:
- кладовая для продуктов в вашем отделении;
- центр отдыха в M15;
- детские зоны отдыха в M9;
- кафетерий;
- основной вестибюль;
- любые другие зоны общего пользования на территории больницы.
Соблюдение таких мер может быть прекращено после того, как вы пройдете курс лечения и больше не будете являться источником инфекции для других. Ваш врач или медсестра/медбрат скажут вам, когда можно будет прекратить соблюдать эти меры.
Какие меры по изоляции мне следует принять дома, если у меня обнаружится инфекция, вызываемая вырабатывающими ESBL микроорганизмами?
Если у вас диагностировали инфекцию, вызываемую вырабатывающими ESBL микроорганизмами, соблюдайте следующие предписания:
- Часто мойте руки водой с мылом не менее 20 секунд, особенно после посещения туалета.
- Мойте руки после контакта с кровью, мочой или выделениями из раны.
- Пользуйтесь дезинфицирующим средством, например, Clorox ® или Lysol ® для протирания поверхностей, которые могли быть заражены бактериями.
Где я могу получить дополнительную информацию об инфекциях, вызываемых вырабатывающими ESBL микроорганизмами?
Если у вас есть вопросы, обратитесь к своему врачу или медсестре/медбрату. Кроме того, для получения дополнительной информации вы можете посетить веб-сайт:
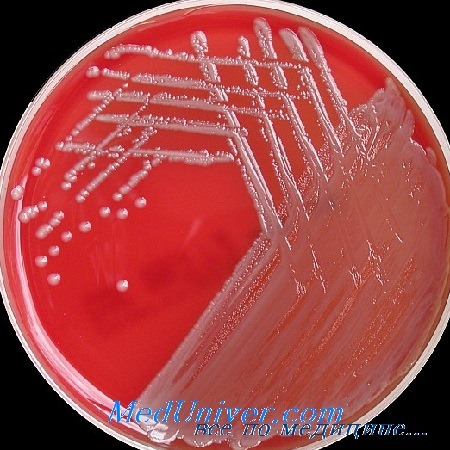
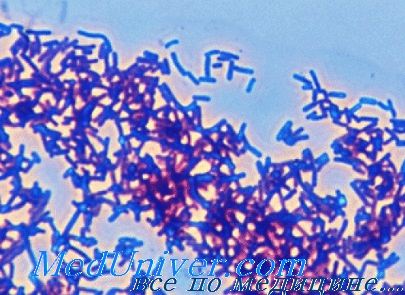
Неферментирующие грамотрицательные палочки рода Acinetobacter как причина раневых инфекций. Резистентность к антибиотикам
Acinetobacter spp. относится к микроорганизмам, свободно живущим в окружающей среде (сапрофиты), па различных объектах в лечебных учреждениях, в воде, пищевых продуктах. Помимо этого Acinetobacter spp. выделяется из различных биотопов (например, с кожи, слизистой оболочки) человека.
Присутствие Acinetobacter spp. в биоматериалах от пациента, находящегося в стационаре, может быть как следствием колонизации слизистых оболочек и кожи, так и причиной инфекционных осложнений различной локализации. У 25% взрослых людей имеет место колонизация кожи, а у 7% детей колонизированы верхние дыхательные пути. Acinetobacter spp., так же как и P. aeruginosa, способна месяцами находиться на различных объектах окружающей среды в жизнеспособном состоянии.
Кроме того, Acinetobacter spp. устойчива ко многим бактерицидным растворам, например к хлоргексидину.По данным CDC (NNIS), за последние 20 лет значение неферментирующих грамотрицательных палочек рода Acinetobacter как возбудителей НКИ значительно позросло во всем мире. При хирургических вмешательствах Acinetobacter spp. выделяют из гнойных ран в 2,1 % случаев. Вид A. baumannii составляет 80% всех видов этого рода, ответственных за ЕКИ, и поэтому выделение любого другого вида этого рода дает основание предполагать, что имеет место коптам и нация исследуемого биоматериала.
Повторное выделение Acinetobacter spp. из любых биоматериалов важно для исключения контаминации или колонизации и, в конечном счете, для правильной трактовки полученных результатов микробиологических исследований. Следует заметить, что наиболее часто Acinetobacter spp. выделяют при пневмонии (Acinetobacter spp. составляет 6,9% всех возбудителей при этой локализации), особенно если ей предшествовала колонизация слизистых верхних дыхательных путей. Летальность при пневмонии, обусловленной Acinetobacler spp., составляет 40-64%.
![бактерии рода актинобактер]()
Быстрое развитие резистентности A. baumannii к большинству антибиотиков (МDR-Acinetobacter) регистрируется во всем мире. Сульбактам имеет более высокую природную бактерицидную активность против MDR-Acinetobacter в сравнении с тазобактамом и клавулановой кислотой, в то же время отмечается увеличение резистентности и к сульбактаму. Комбинация имипенема с амикацином в исследованиях in vitro показала синергизм в отношении MDR-штаммов, тогда как in vivo эффект менее выражен. Комбинация фторхинолонов с амикацином приемлема, когда имеет место низкая МПК фторхинолонов для госпитальных штаммов A baumannii.
При выделении штаммов МDR-A. baumannii применяют комбинацию полимиксипа В с рифампицином (или с имипенемом, или с азитромицином). Имеется небольшое количество исследований по применению тигециклина для лечения инфекций, обусловленных A. baumannii, но уже сейчас использование этого антибиотика связывают с постепенным увеличением резистентности. По данным из Германии, резистентность к тигециклину среди A. baumannii составляет 6%, тогда как к кол истину — 2,8%.
По данным SENTRY 2001-2004 гг. (30 стран Европы), доля штаммов Acinetobacter spp., резистентных к имипенему, меропенему, ампициллину/сульбактаму и полимиксину В составляет 26,3, 29,6, 51,6 и 2,7% соответственно. Важно отметить, что даже в странах с низким уровнем резистентности феномен распространения MDR-, XDR- или PDR-штаммов A. baumannii пока неясен. Одним из факторов риска MDR-A. baumannii считается назначении карбапенемов и цефалоспоринов III поколения.
Кроме того, риск связан с искусственной вентиляцией легких (ИВЛ), длительным пребыванием в реанимации, оперативным вмешательством, контаминацией окружающих объектов.Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клиника инфекций вызванной энтеробактериями. Диагностика, лечение
Выделяют два вида сальмонелл: Salmonella enterica и Salmonella bongori. Вид Salmonella enterica включает подвиды: enterica, salamae, arizonae, diarizonae, houtenae. Наиболее патогенны для человека и других теплокровных животных серовары подвида enterica.
Сальмонеллёз. Сальмонеллы хорошо приспособлены к обитанию в организме различных животных. У человека инфекция обычно не выходит за пределы кишечника. Заболевание характеризуется саморазрешающейся диареей. В некоторых случаях микроорганизмы могут вызывать инвазивные, угрожающие жизни человека заболевания, сопровождающиеся бактериемией, септицемией и остеомиелитом.
Сальмонелл обнаруживают в организме большинства домашних животных. Важными источниками инфекции считают больных людей и реконвалесцентных носителей. Механизм передачи заболевания — фекально-оральный (при употреблении контаминированных продуктов питания). Самые тяжёлые случаи сальмонеллёза наблюдают у пациентов со сниженным иммунитетом и сниженной секрецией желудочного сока, а также у лиц, перенёсших спленэктомию. В некоторых случаях заболевание осложняется реактивным артритом или развивается хроническое носительство.
Брюшной тиф. Возбудители брюшного тифа — серовары typhi и paratyphi подвида Salmonella enterica. Заболевание характеризуется поражением стенки кишечника, затем регионарных лимфатических узлов, сопровождается первичной бактериемией и инфекцией ретикулоэндотелиальной системы. В последующем бактерии попадают в кишечник из жёлчного пузыря, размножаются в пейеровых бляшках (развивается вторичная бактериемия), вызывают изъязвление стенки кишечника, которое может привести к кровотечению или перфорации. Пациенты предъявляют жалобы на высокую температуру, нарушение функций кишечника (диарею или запор) и сыпь (розеолёзные элементы на передней брюшной стенке). Наблюдают гепатоспленомегалию. Иногда брюшной тиф осложняется остеомиелитом и реже менингитом.
Инфекции мочевыводящих путей и пиелонефрит. Большинство инфекций мочевыводящих путей вызвают определённые серотипы Escherichia coli. Они способны к повышенному образованию К-антигена и гемолизина и прикреплению к эпителию мочевыводящих путей посредством пилей (последнее свойство характерно и для некоторых видов протея). При наличии у возбудителя маннозоустойчивых пилей развивается пиелонефрит. Важный фактор вирулентности бактерий рода Proteus — уреаза, снижающая рН и стимулирующая процесс образования камней.
Менингит и абсцессы мозга. Важной причиной менингита у новорождённых (характеризуется высокой смертностью) является Escherichia coli, штаммы которой в большом количестве продуцируют капсульный Kl-антиген. Кроме того, заболевание может быть следствием нейрохирургических вмешательств, операций по протезированию. Следует отметить, что энтеробактерии очень часто присутствуют в патогенной микрофлоре, сопровождающей абсцессы головного мозга.
![Возбудитель сальмонеллеза - Salmonella enterica]()
Возбудитель сальмонеллеза - Salmonella enterica
Остеомиелит и септический артрит. Тяжелейшее осложнение у пациентов с серповидно-клеточной анемией и ВИЧ-инфекцией — остеомиелит или септический артрит, вызванные сальмонеллами. Кроме того, сальмонеллы и другие энтеробактерии часто вызывают инфекции костей и суставов у пожилых пациентов. Иногда эти заболевания возникают вследствие проникающего ранения. Для лечения обычно применяют фторхинолоны, так как они обладают способностью проникать в костную ткань (например, ципрофлоксацин).
Инфекции, вызванные представителями рода Klebsiella. Микроорганизмы рода Klebsiella обычно вызывают внутрибольничные инфекции. Кроме того, они могут быть причиной развития пневмонии (особенно у пациентов, находящихся на искусственной вентиляции лёгких), инфекций мочевыводящих путей, раневых инфекций и бактериемии. У высоковосприимчивых пациентов известны случаи заболеваний, сопровождающихся септицемией и заканчивающихся летальным исходом. Первичная пневмония, вызванная подвидом Pneumoniae вида К. pneumoniae, — редкое и крайне тяжёлое внебольничное заболевание, характеризующееся неблагоприятным исходом. Возбудитель прогрессирующей гранулематозной инфекции слизистой оболочки полости носа — Klebsiella rhinoscleromatis. Большинство случаев заболевания регистрируют в тропических регионах мира. Другой вид — Klebsiella ozanae — возбудитель хронической бронхо-эктатической болезни.
Инфекции, вызванные бактериями родов Enterobacter, Serratia и Citrobacter. Представители этих родов обитают в окружающей среде и могут поражать пациентов лечебных учреждений, вызывая раневые инфекции, бактериемию и внутрибольничную пневмонию. Выбор антибактериального препарата осложняется тем, что большинство возбудителей устойчиво к действию антибиотиков.
Диагностика энтеробактерий:
• Бактериологическое исследование крови или костного мозга (особенно в диагностике брюшного тифа).
• Изучение биохимических свойств возбудителя (например, способности расщеплять углеводы).
• Серотипирование (серотипы различают по липополисахаридному (О) и жгутиковому (Н) антигену) и фаготипирование применяют при эпидемиологических исследованиях.
• Колицинотипирование.
• Современные молекулярно-генетические исследования.Лечение и профилактика инфекции вызванной энтеробактериями
Большинство грамотрицательных энтеробактерии чувствительны к действию аминогликозидов, цефалоспоринов широкого спектра действия, фторхинолонов, бета-лактамов и карбапенемов (например, меропенем). Лечение назначают только после определения чувствительности возбудителя к антимикробным средствам, так как некоторые микроорганизмы способны вырабатывать бета-лактамазу и ферменты, разрушающие аминогликозидные препараты. Возросшая в последнее время устойчивость энтеробактерии к антибиотикам широкого спектра действия обусловлена появлением штаммов, обладающих бета-лактамазами широкого спектра действия.
Препараты выбора при инфекциях мочевыводящих путей — цефалексин, ампициллин, нитрофурантоин или триметоприм.
Для профилактики заболеваний, сопровождающихся диареей, необходимо соблюдать правила личной гигиены, приготовления пищи, а также использовать безопасные источники водоснабжения. Основной метод лечения — пероральная регидратация организма.
Препарат выбора при брюшном тифе — ципрофлоксацин, альтернативные средства — триметоприм или цефалоспорины третьего поколения. В некоторых странах инфекционисты сталкиваются с заболеваниями, вызванными мультирезистентными штаммами возбудителя. Для профилактики заболевания людям, посещающим эти регионы, рекомендуют использовать живую аттенуированную (Ту21А) или бесклеточную (содержит Vi-антиген) вакцины, но вакцинация лишь частично защищает от инфекции.
Видео строение, микробиология возбудителя брюшного тифа (S. typhi)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
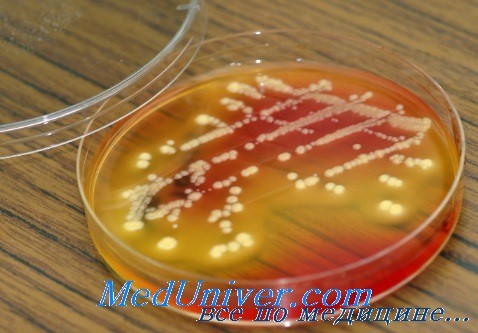
Проблема антибиотикорезистентности. Бета-лактамазы расширенного спектра действия (БЛРС)
В настоящее время четко определены основные серьезные проблемы, связанные с антибиотикорезистентностью бактерий, ответственных за развитие НКИ: MRS A, MRS-КНС, VRE, штаммы грамотрицатсльных палочек, продуцирующих БЛРС (Klebsiella pneumoniae и Е. Coli), мультирезистентные и папрезистентные штаммы энтеробактерий, неферментирующих грамотрицательных палочек А. baumannii и P. aeruginosa, появление штаммов стафилококков и энтерококков, резистентных к ванкомицину и линезолиду (Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings Recommendations of the Healthcare Infection Control Practices).
Ключевая роль лаборатории клинической микробиологии состоит в своевременном и точном выявлении MDR у микроорганизмов, представляющих возбудителей НКИ. Существуют различные доступные в настоящее время методы диагностики резистентности (стенотипический, молекулярный, микробиологические анализаторы MDR, составляет 19 и 33% соответственно. Назначение хиполонов и антипсевдомонадных пенициллинов служит независимым фактором риска резистентности к карбапенемам у зитеробактерий.
По нашим данным, Е. coli, К. pneumoniae и Е. cloacae — это основные виды грамотрицательных палочек из семейства зитеробактерий, которые вызывают послеоперационные РИ у онкологических больных. Все три вида имеют свои особенности, которые необходимо учитывать при назначении антибактериальных препаратов.
![антибиотикорезистентность]()
При определении чувствительности грамотрицательных палочек семейства Enterobacteriaceae весьма важен поиск штаммов, способных вырабатывать ферменты, объединенные в группу бета-лактамаз расширенного действия (БЛРС). Инфекции, обусловленные микроорганизмами, продуцирующими такие ферменты, поддаются терапии ограниченным количеством антимикробных препаратов. Обоснованные рекомендации по выявлению БЛРС фенотипическими методами распространяются только на штаммы Klebsiella spp. и Е. coli. Выработка БЛРС может быть выявлена практически у всех видов этого семейства и даже у целого ряда других грамотрицательных палочек.
Продуценты бета-лактамаз расширенного действия (БЛРС) устойчивы ко всем пенициллинам, цефалоспоринам и монобактамам, даже когда in vitro эти препараты эффективны, Существуют различные методы выявления микроорганизмов, вырабатывающих бета-лактамаз расширенного действия (БЛРС), доступные практическим лабораториям. Ориентировочно можно предположить способность грамотрицательных палочек к продукции бета-лактамаз расширенного действия (БЛРС), если in vitro отмечается снижение чувствительности к таким препаратам, как цефподоксим, цефтазидим, цефтриаксон, цефотаксим или азтреонам.
Далее, при выявлении подавления действия b-лактамаз ингибиторами (например, сульбактамом, клавулановой кислотой, тазобактамом) можно утверждать, что данный штамм вырабатывает БЛРС (CLSI, M100-S18, 2003).
При выявлении продуцентов бета-лактамаз расширенного действия (БЛРС) препаратами выбора служат карбапенемы (имипенем, меропенем). Доля продуцентов бета-лактамаз расширенного действия (БЛРС) у пациентов хирургических отделений отечественных стационаров высока и примерно одинакова как для К.pneumoniae (46,2 %), так и для Е. coli (48,2%). По данным мониторинга антибиотикорезистентности в Европе при НКИ за 2005 2008 гг. (SMART), БЛРС — продуценты Е. coli составляют 10,8% (298 из 2764 штаммов), К. pneumoniae - 19,3% (128 из 662), что статистически значимо ниже частоты выделения подобных штам мов в отечственных клиниках.
Следует отметить высокую чувствительность всех штаммов энтеробактерий отечественных клиниках к карбаненемам. При этом к имипенему отмечается более низкая по сравнению с меропенемом чувствительность, особенно в группе Proteus spp., где чувствительность к меропенему достоверно выше по сравнению с имипенемом (97,7% против 54,2% соответственно).
In vitro чувствительность энтеробактерий к препаратам группы аминогликозидов от 30 до 100% и весьма зависит не только от рода, по и от вида энтеробактерий, что подтверждает необходимость организации микробиологических исследований на высоком уровне, который может быть обеспечен в современных условиях.
Такие же выводы можно сделать и в отношении фторх и полонов (ципрофлоксацин, левофлоксацин). В крупных международных исследованиях отмечается высокий процент устойчивых к ципрофлоксацину штаммов E. coli, что наблюдается и в отечественных клиниках: около половины штаммов кишечной палочки устойчивы к ципрофлоксаципу. Многофакторный анализ показал, что профилактика фторхиполопами достоверно связана с увеличением устойчивости микроорганизмов к фторхинолонам и с продукцией БЛРС Е. coli.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое пиелонефрит острый? Причины возникновения, диагностику и методы лечения разберем в статье доктора Закуцкий А. Н., уролога со стажем в 16 лет.
Над статьей доктора Закуцкий А. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
![Почки при остром пиелонефрите]()
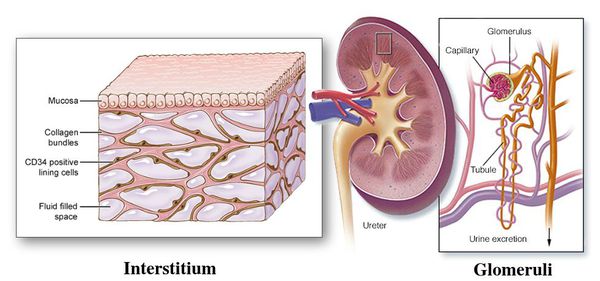
![Пиелонефрит и гломерулонефрит]()
Причина пиелонефрита — бактериальная инфекция. Среди возбудителей заболевания лидирует кишечная палочка (Escherichia coli). Реже встречаются другие микробы, такие как протей, энтерококк, синегнойная палочка и стафилококк. [4]
![Возбудитель пиелонефрита]()
Острый пиелонефрит может возникнуть в любом возрасте и у любого пола. Чаще всего заболевание возникает у женщин активного репродуктивного возраста, что объясняется особенностями строения женской мочеполовой системы. Однако нередко пиелонефрит выявляют у детей и половозрелых мужчин, поэтому возраст и пол заболевавшего не могут быть использованы в качестве дифференциального признака данного заболевания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы острого пиелонефрита
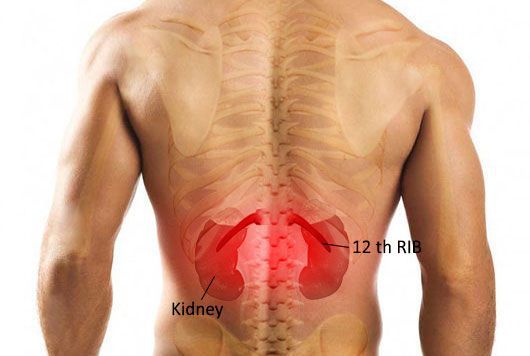
Для острого пиелонефрита типично сочетание высокой температуры с болями в области воспалённой почки. Если почка располагается на своём месте, то боль беспокоит в проекции рёберно-позвоночного угла. При опущении почки боль возникает по фланкам живота. Пиелонефрит может затрагивать как одну почку, так и обе почки, соответственно боль может беспокоить как с одной стороны, так и с обеих сторон одновременно.
![Расположение почек и локализация болей]()
Выраженность боли может быть различной — от умеренной до интенсивной. Как правило, боль носит постоянный характер и не зависит от положения тела или движений. Иными словами, невозможно найти такое положение в кровати, когда боль будет беспокоить меньше или пройдет совсем. Также верно и то, что движения туловищем в виде сгибания, разгибания или поворотов не приводят к обострению болей.
В отдельных случаях боль носит приступообразный характер. Это характерно для пиелонефритов, которые возникают на фоне закупорки мочевых путей камнем. Если при классической почечной колике боль между приступами отступает совсем, то при сопутствующем пиелонефрите болевой синдром сохраняется и между приступами.
Развитие острого пиелонефрита может сопровождаться изменения со стороны мочеиспускания, хотя это не является обязательным условием. Можно отметить появление мути в моче и неприятного запаха. Кроме того, воспалённая моча потенциально способна спровоцировать учащённое мочеиспускание. В целом мочевые симптомы выходят на первый план только в том случае, если острый пиелонефрит осложняет уже имеющееся воспаление мочевого пузыря. [1] [4]
Патогенез острого пиелонефрита
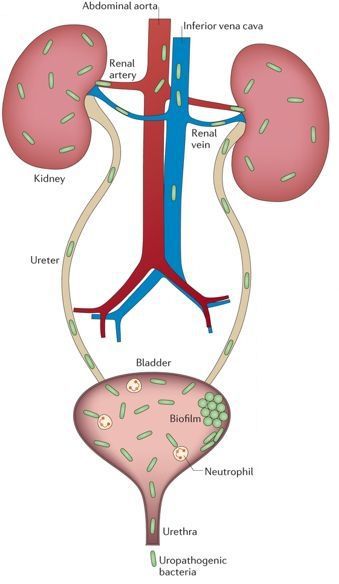
![Распространение микробов в организме]()
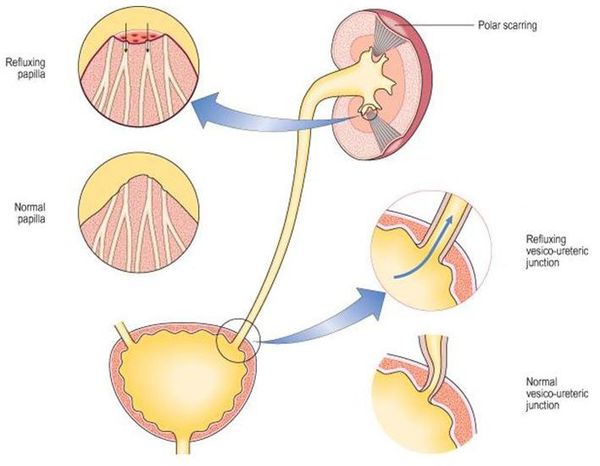
Уриногенный путь передачи особенно характерен для детей из-за широкого распространения пузырно-мочеточникового рефлюкса. Так называют заброс мочи из мочевого пузыря обратно в почку. Несмотря на широкое распространение рефлюкса именно в детском возрасте, многие взрослые страдают аналогичным заболеванием. Особенно часто рефлюкс, то есть обратный заброс мочи, наблюдается при переполнении мочевого пузыря. Поэтому очень важно своевременно опорожнять мочевой пузырь. [8]
![Пузырно-мочеточниковый рефлюкс]()
Классификация и стадии развития острого пиелонефрита
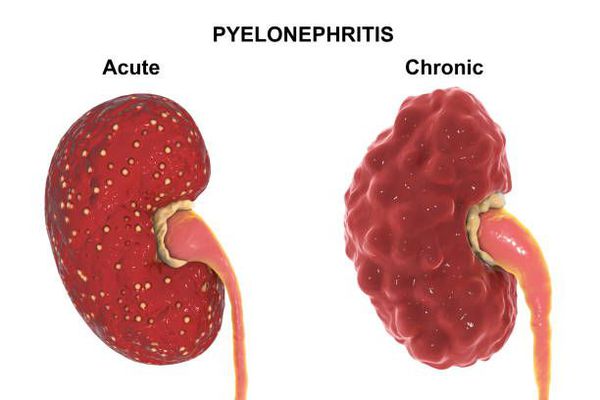
Традиционно острый пиелонефрит подразделяют на серозный и гнойный, хотя гнойный пиелонефрит является скорее осложнением острого пиелонефрита.
Существует несколько форм гнойного пиелонефрита:
- апостематозный пиелонефрит;
- абсцесс почки;
- карбункул почки;
- некротический папиллит;
- эмфизематозный пиелонефрит.
Если гнойников много, и они небольшие по размеру, то говорят об апостематозном пиелонефрите. В том случае, если гнойник большой и одиночный, то мы имеем дело с абсцессом почки.
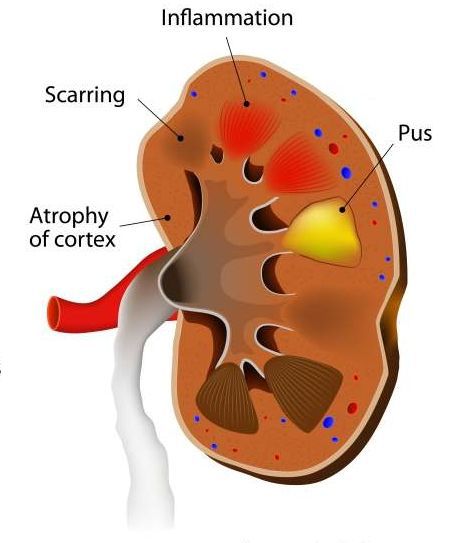
![Атрофия коры/рубцевание/воспаление/гной]()
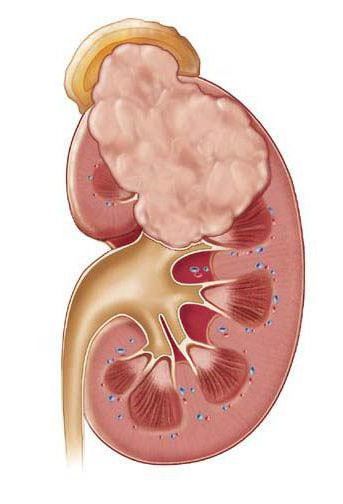
Почечный абсцесс нужно дифференцировать с карбункулом почки. Карбункул — это часть почечной паренхимы, погибшая вследствие закупорки крупного почечного сосуда микробным эмболом. Рано или поздно погибшие от эмболии ткани подвергаются гнойному расплавлению, что приводит к абсцедированию карбункула.
![Карбункул почки]()
Особой формой острого пиелонефрита является некротический папиллит — это грозное и смертельно опасное заболевание. К счастью, эта болезнь встречается настолько редко, что даже опытные урологи со стажем работы в несколько десятков лет могут вспомнить лишь несколько случаев данной формы острого пиелонефрита. При некротической папиллите происходит некроз, то есть омертвление и гибель почечного сосочка. Это сопровождается почечной недостаточностью и появлением крови в моче. Причина некротического папиллита сходна с причиной карбункула: закупорка почечного сосуда микробным эмболом. Только при папиллите страдает сосуд, питающий почечный сосочек. [4]
Осложнения острого пиелонефрита
Местные осложнения острого пиелонефрита включают апостематоз, абсцесс почки, эмфизематозный пиелонефрит, а также тромбоз почечных сосудов либо в виде карбункула почки, либо в виде некротизирующего папиллита. [10]
Эмфизематозный пиелонефрит является исключительно редким заболеванием и отличается от прочих гнойных осложнений пиелонефрита появлением пузырьков газа. Воздушные скопления могут быть в почечной паренхиме, полостной системе почек или даже в паранефральной клетчатке. К счастью, эмфизематозный пиелонефрит встречаются существенно реже других гнойных осложнений почки. [7]
Среди системных осложнений нужно отметить острую почечную недостаточность и синдром системной воспалительной реакции (сепсис). Именно поэтому часть пациентов нуждается в госпитализации в урологические стационары. В условиях стационара проводится регулярный контроль анализов и УЗИ для своевременного выявления осложнений острого пиелонефрита. [4]
Некоторые осложнения пиелонефрита в большей степени ассоциированы с хронической формой этого заболевания, но так как острый пиелонефрит может перейти в хронический, то нельзя не упомянуть о таком важном осложнении как мочекаменная болезнь. В некоторых ситуациях воспаление почечной паренхимы вызывают уреаза-продуцирующие микробы. Уреаза — это фермент, который позволяет бактериям расщеплять мочевину из мочи. После срабатывания фермента мочевина расщепляется до углекислоты и аммиака. Именно эти два компонента запускают сложный биохимический каскад, который приводит к образованию инфекционных камней: струвита и гидроксиапатита. К счастью, самый частый возбудитель пиелонефрита — кишечная палочка — не умеет производить уреазу, этой способностью обладают другие более редкие возбудители пиелонефрита — протей, клебсиелла и синегнойная палочка.
![Острый и хронический пиелонефрит]()
Диагностика острого пиелонефрита
Минимальный объём обследований:
- общий анализ мочи;
- посев мочи на флору с определением чувствительности к антибиотикам;
- клинический анализ крови;
- анализ крови на креатинин;
- УЗИ почек и мочевого пузыря.
Общий анализ мочи
Типичным для пиелонефрита является повышение уровня лейкоцитов и обнаружение бактерий. Могут быть и другие неспецифичные для данного заболевания изменения, включая повышенный уровень белка или положительный тест на нитриты. Обнаружение большого количества эритроцитов требует проведения дифференциальной диагностики с мочекаменной болезнью и гломерулонефритом.
Посев мочи на флору и чувствительность к антибиотикам
Этот анализ имеет смысл сдавать до назначения антибиотиков. Посев мочи позволяет выявить возбудитель пиелонефрита и определить наиболее эффективные антибактериальные препараты.
Клинический анализ крови
Неспецифическим признаком пиелонефрита является повышенный уровень лейкоцитов со сдвигом лейкоцитарной формулы влево. Как правило, больной с острым пиелонефритом повторяет клинический анализ крови два или три раза во время лечения. Данный анализ позволяет оценить эффективность антибактериальной терапии и своевременно сигнализировать о развитии гнойных осложнений в воспаленной почке.
Анализ крови на креатинин
Этот анализ является обязательным для всех пациентов с пиелонефритом прежде всего потому, что в ряде случаев острый пиелонефрит может осложниться развитием острой почечной недостаточности. Кроме того, анализ крови на креатинин необходим для решения вопроса о рентгенологическом исследовании почек с применением контраста.
УЗИ почек и мочевого пузыря
Ультразвуковое исследование позволяет исключить обструктивный пиелонефрит, связанный с нарушением оттока мочи из почки. Кроме того, УЗИ почек необходимо для своевременного выявления апостематоза, абсцесса и карбункула в паренхиме почки. Все вышеперечисленные термины используются для описания осложнений острого пиелонефрита.
Важнейшим преимуществом ультразвукового исследования является возможность повторения этого исследования в динамике без нанесения какого-либо вреда или даже дискомфорта организму. Важно помнить, что нормальные результаты УЗИ не исключают наличие острого пиелонефрита.
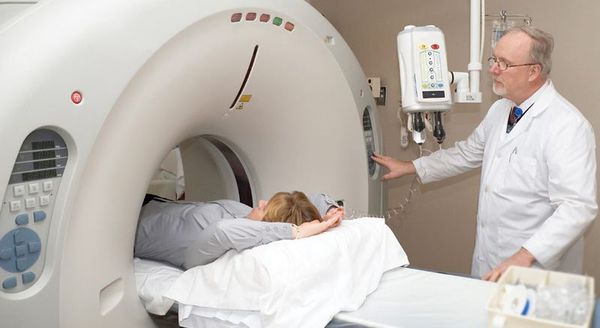
Рентгеновское обследование почек: внутривенная урография или компьютерная томография почек с внутривенным контрастированием.
![Рентгеновское обследование почек]()
Рентгеновское обследование почек является самым точным и достоверным методом диагностики. Традиционный рентген в виде внутривенной урографии подразумевает обязательное внутривенное введение йодсодержащего контраста. Это не всегда возможно из-за сопутствующих причин: аллергия на йод, приём гормонов щитовидной железы и повышенный уровень креатинина в крови. По сути, в настоящее время внутривенная урография необходима только для установления степени нефроптоза при опущении почек.
Значительно более широко применяется КТ почек (компьютерная томография). КТ относится к рентгеновским методам исследования, однако его информативность значительно выше, чем у обычного рентгена. Вопрос о введении йодсодержащего внутривенного контраста решается лечащим урологом индивидуально с каждым пациентом. [2] [4]
Лечение острого пиелонефрита
Стационарное лечение обычно требуется для беременных, детей, пожилых людей, пациентов с ослабленным иммунитетом, плохо контролируемым диабетом, после трансплантации почек и, конечно же, всех людей с обструкцией мочевых путей. Также желательно госпитализировать людей с острым пиелонефритом единственной существующей или единственно функционирующей почки. Здоровые, молодые, небеременные женщины, которые болеют неосложнённым пиелонефритом, могут лечиться амбулаторно.
Обычно острый пиелонефрит требует исключительно медикаментозного лечения. Показания к хирургическому лечению возникают крайне редко.
Первоначальный выбор антибиотика при остром пиелонефрите является эмпирическим. Через 4-7 дней антибактериальная терапия может быть скорректирована по результатам посева мочи. Эмпирический выбор антибиотика остаётся на усмотрение лечащего врача.
В национальных рекомендациях в качестве средства выбора при остром пиелонефрите указаны фторхинолоны второго и третьего поколения. [4] Тоже самое сказано и в рекомендациях Европейской ассоциации урологов. Между тем, ещё в 2016 году FDA (Управление по контролю качества пищевых продуктов и лекарственных препаратов) рекомендовала отказаться от использования данных антибиотиков из-за большого количества осложнений в отношении связок, суставов и периферических нервов. [6] Поэтому в качестве первой линии терапии рекомендуют использовать цефалоспорины третьего поколения.
Часто можно встретить комбинацию из двух антибиотиков для лечения острого пиелонефрита. Как правило, комбинируют цефалоспорины с фторхинолонами или аминогликозидами. Аминогликозиды в виде амикацина обладают явным нефротоксическим действием, поэтому их использование для эмпирической терапии оправдано только в тяжёлых случаях. В целом выбор антибиотика — на усмотрение лечащего врача. [9]
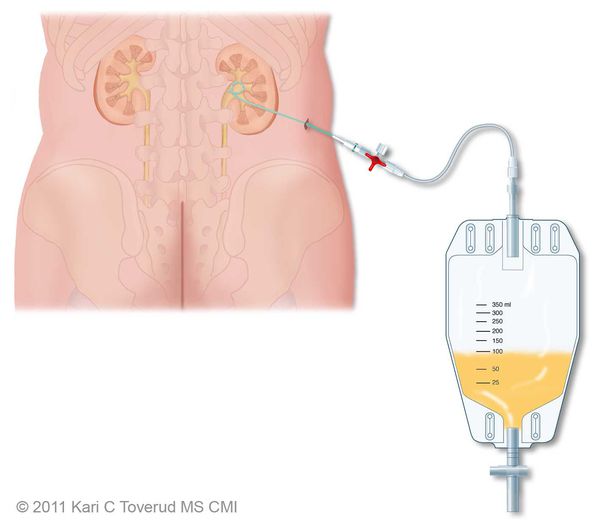
Показания к оперативному лечению возникают при гнойной форме воспаления и остром вторичном пиелонефрите. При вторичном пиелонефрите главная цель хирургического вмешательства состоит в дренировании мочи. Это можно сделать как путём установки почечного стента, так и благодаря чрезкожной пункционной нефростомии.
![Чрезкожная пункционная нефростомия]()
Гнойная форма острого пиелонефрита требует ревизии и декапсуляции почки, вскрытия гнойных очагов или даже нефрэктомии при гнойном разрушении большей части почки. [4]
Прогноз. Профилактика
Прогноз при пиелонефрите благоприятный. Большинство острых пиелонефритов успешно лечатся амбулаторно, и лишь небольшая доля случаев требует госпитализации. Тем не менее сохраняется определённый процент летальный исходов. Причиной неблагоприятного течения заболевания являются возраст старше 65 лет, присоединение острой почечной недостаточности, несвоевременно выявленные гнойные осложнения, требующие хирургического вмешательства, и тяжёлые сопутствующие заболевания наподобие декомпенсированного сахарного диабета. [5]
Составление плана индивидуальной профилактики начинается с изучения истории конкретного заболевания. В частности, необходимо ответить на вопрос, каким образом бактерии попали в почку: с кровью или с мочой? При гематогенном пути заражения необходимо санировать имеющиеся в организме очаги хронической инфекции, исключить переохлаждение и проводить профилактику сезонных простудных заболеваний. При уриногенном пути заражения необходимо заняться профилактикой воспалительных заболеваний мочевого пузыря.
В случае вторичной формы острого пиелонефрита целесообразно восстановить нормальный отток мочи из поражённой почки.
Вне зависимости от пути попадания микробов в почку всем пациентам рекомендуется потреблять достаточное количество жидкости и разнообразные урологические сборы растительного происхождения. [4]
Читайте также: