Болезнь лайма поражение периферической нервной системы
Обновлено: 12.05.2024
Для цитирования: Шавловская О.А. Тиоктовая кислота: антиоксидантная терапия неврологических заболеваний. РМЖ. 2014;13:960.
Тиоктовая () кислота синтезируется ворганизме ивыполняет роль коэнзима вокислительном декарбоксилировании [17–19]. Она представляет собой этилендиаминовую соль кислоты, которая, являясь простетической группой мультиферментных комплексов, играет важную роль вметаболизме клетки. Тиоктовая () кислота— эндогенный антиоксидант (связывает свободные радикалы), ворганизме образуется при окислительном декарбоксилировании [18, 19]. Именно этим фактом, впервую очередь, обусловлен возрастающий интерес клиницистов ктиоктовой кислоте, что открывает новые возможности вприменении тиоктовой кислоты втерапии заболеваний ипатологических состояний, воснове которых лежит дисбаланс гомеостаза. Свойство нормализации клеточного метаболизма утиоктовой кислоты реализуется врезультате непосредственной инактивации свободных радикалов засчет ихсвязывания препарата [17]. Утиоктовой кислоты отмечены также свойства, потенцирующие противовоспалительное действие глюкокортикостероидов, ииммуностимулирующее действие. Кроме того, тиоктовая кислота близка пофармакологическим свойствам квитаминам группы Виобладает способностью уменьшать уровень сахара вкрови иувеличивать содержание гликогена впечени [18].
Тиоктовая кислота является одним из самых сильных антиоксидантов, используемых в лечении диабетической нейропатии [2, 25]. Тиоктовая кислота является коэнзимом ключевых ферментов цикла Кребса, что объясняет ее эффективность. Дополнительным преимуществом в механизме действия тиоктовой кислоты считается ее четко зафиксированный эффект утилизации глюкозы [15]. Высокая эффективность и патогенетическое действие тиоктовой кислоты доказаны многочисленными экспериментальными и клиническими исследованиями. В основе адекватного и рационального применения препаратов тиоктовой кислоты лежат результаты многочисленных исследований (ALADIN I, ALADIN II, ALADIN III, ORPIL, NATHAN, DECAN, SYDNEY), в которых отрабатывалась доза, кратность приема и длительность курса (табл. 1).
В рамках многоцентрового рандомизированного двойного слепого исследования (SYDNEY II) проведена оценка эффективности тиоктовой кислоты в терапии больных с диабетической полинейропатией (ДПН) [1, 3]. Исследование проводилось в период с 2004 по 2006 г., в нем приняли участие 87 пациентов с сахарным диабетом (СД) и типа, находившихся на стационарном (НУЗ ЦКБ № 1 ) и амбулаторном лечении (кафедра эндокринологии ГОУ ДПО РМАПО Росздрава). В ходе исследования SYDNEY сделано заключение, что внутривенное введение кислоты в течение 3 нед. вызывает достоверное ослабление мучительных для пациентов невропатических симптомов и неврологической объективной симптоматики. Учитывая дозозависимый эффект развития побочных явлений, оптимальной является дозировка 600 мг тиоктовой кислоты. Авторы сделали вывод: в результате комплексного исследования пациентов с СД и типа отмечено, что наиболее ранним поражения чувствительного нерва при СД является снижение потенциала действия. Уменьшение боли происходило со нед. приема тиоктовой кислоты в дозе 1800 мг/сут, с нед. приема — в дозе 1200 мг и только к нед. — на фоне приема 600 мг тиоктовой кислоты [3]. У пациентов с ДПН (n=24), участвующих в исследовании, при использовании тиоктовой кислоты в дозе 1800 мг/сут в течение 3 нед. уменьшались нейропатические симптомы и неврологический дефицит, по частоте развития побочных эффектов таковые сопоставимы с группой плацебо [29].
Инструкция по применению препарата Тиогамма® одобрена Фармакологическим государственным комитетом Минздрава России, перерегистрация (для таблетированных форм), (для инъекционных форм) [19]. Препарат назначается 1 р./сут 300–600 мг, принимают его не разжевывая, запивая небольшим количеством жидкости. Согласно данным исследования ALADIN I [28], действие кислоты на позитивные невропатические симптомы в дозах 600 и 1200 мг практически не отличается. В проведенном исследовании при клиническом внутривенном введении кислоты побочные эффекты (головная боль, тошнота, рвота) чаще развивались при дозировке 1200 мг (32,6%), чем 600 мг (19,8%), при введении плацебо (20,7%) [28]. Cделан вывод, что дозировка кислоты в 600 мг и с точки зрения клинической эффективности, и с учетом возможности развития побочных эффектов является оптимальной.
Клиническое использование тиоктовой () кислоты (в частности, Тиогаммы®) основано на множестве биохимических и физиологических эффектов этого вещества [6]. Основные механизмы действия Тиогаммы®, согласно изложенным в Методических рекомендациях (2004) [8], могут быть представлены следующим образом:
- влияние на энергетический метаболизм, обмен глюкозы и липидов (участие в окислительном декарбоксилировании кетокислот) с активацией цикла Кребса; усиление захвата и утилизации глюкозы клеткой и потребления кислорода; повышение основного обмена; нормализация глюконеогенеза и кетогенеза; торможение образования холестерина;
- цитопротективное действие: повышение антиоксидантной активности (прямое и опосредованное через системы витаминов , цистин/цистеин и глютатионовую); стабилизация митохондриальных мембран;
- влияние на реактивность организма: стимуляция ретикулоэндотелиальной системы; иммунотропное действие; противовоспалительная и обезболивающая активность (связанная с антиоксидантным действием);
- нейротропные эффекты: стимуляция роста аксонов, положительное влияние на аксональный транспорт, уменьшение вредного влияния на нервные клетки свободных радикалов, нормализация аномального поступления глюкозы к нерву, предупреждение и уменьшение повреждения нервов при экспериментальном диабете;
- гепатопротективное действие: накопление гликогена в печени, торможение накопления липидов в печени (при некоторых патологических состояниях), повышение активности ряда ферментов, улучшение функциональной активности печени;
- дезинтоксикационное действие (ФОС, свинец, мышьяк, ртуть, сулема, цианиды, фенотиазиды и др.).
Основные показания к применению препарата Тиогамма® в лечении заболеваний, сопровождающихся неврологической симптоматикой, сфокусированы на диабетической и алкогольной полинейропатии [18]. В настоящее время тиоктовая () кислота, в частности Тиогамма®, является наиболее эффективным средством в лечении периферической полинейропатии, что подтвердили широкомасштабные многоцентровые многолетние исследования, такие как ALADIN Study ( Acid in Diabetic Neuropathy) [16]. Однако антиоксидантная активность тиоктовой кислоты используется во многих областях медицины [10] (табл. 2).
Эффективность Тиогаммы® при ДПН убедительно продемонстрирована во многих клинических исследованиях. В Софийском медицинском университете (Болгария) Т. Танковой и соавт. (2000) проведено рандомизированное открытое исследование [7–9] по оценке эффективности препарата Тиогамма® по схеме назначения: после периода внутривенных инфузий препарат назначался внутрь. Использовалась постоянная доза 600 мг/сут, внутривенное введение осуществлялось в течение 10 дней, прием внутрь — еще 50 дней. Выраженный клинический эффект проявляется после первых 10 дней терапии. При сравнении с контрольной группой у пациентов, получавших Тиогамму®, на 40% снизилась интенсивность спонтанных болевых ощущений в ногах, на 35% возросла существенно сниженная до лечения вибрационная чувствительность, определявшаяся в различных зонах стопы. К концу курса терапии отмечена положительная динамика в уменьшении выраженности болевого синдрома по ВАШ, увеличении вибрационной чувствительности. Также получена положительная динамика показателей, характеризующих тяжесть поражения вегетативной нервной системы: за 60 дней терапии проявления вегетативной нейропатии сократились на 40% и в 2,5 раза уменьшилось падение систолического артериального давления при ортостатической пробе, что свидетельствует об улучшении функции вегетативной нервной системы.
В рамках другого моноцентрового рандомизированного двойного слепого исследования обследованы 120 больных СД и типа, из них 60 человек получали плацебо и 60 — кислоту (в дозе 600 мг в 225 мл физиологического раствора при времени внутривенного капельного введения 30–40 мин) [1]. Проведено изучение влияния данного препарата на клинические проявления ДПН, электромиографические (ЭМГ) показатели, показатели количественного сенсорного и автономного тестирования у 60 больных СД и типа. Длительность исследования составила 4 нед. Позитивные нейропатические симптомы были выбраны в качестве основного критерия клинической эффективности исследуемого препарата в связи с тем, что именно они в первую очередь нарушают качество жизни больного. Улучшение показателя дистальной латенции при свидетельствуют о том, что основные неприятные ощущения (боль, жжение, онемение, парестезии), ухудшающие качество жизни больного, уменьшались на фоне терапии кислотой, за счет улучшения функции периферических нервов. Таким образом, показана высокая эффективность препарата в отношении большинства изученных показателей состояния периферических нервов. Сделан вывод о том, что препараты тиокотовой () кислоты могут с успехом использоваться в лечении симптомной ДПН.
В другом исследовании [14] 50 больным с диабетической и гипотиреоидной дистальной симметричной сенсомоторной полинейропатией назначался препарат Тиогамма® сначала в дозе 600 мг (что эквивалентно 1167,70 меглюминовой соли кислоты) внутривенно, капельно в течение 10 дней по 1 инъекции в день, скорость введения составляла не более 50 мг/мин. Также важно отметить, что отличительной особенностью препарата Тиогамма® является форма выпуска, которая позволяет вводить препарат внутривенно, капельно, не требуя предварительного разведения. Затем в течение 30 дней больные принимали Тиогамму® по 600 мг утром и натощак. В ходе исследования автор пришел к выводу, что среди всех форм ДПН наибольший эффект применения препарата Тиогамма® был отмечен при лечении острой сенсорной полинейропатии и радикулоплексопатии, при лечении прогрессирующей сенсомоторной полинейропатии применение Тиогаммы® также показало статистически значимый терапевтический результат. В отношении гипотиреоидной полинейропатии Тиогамма® показала высокую эффективность, в частности для снижения и устранения болевого синдрома, однако положительная динамика при лечении Тиогаммой® четко коррелировала с адекватной заместительной терапией тиреоидными гормонами.
Спектр применения препаратов, содержащих тиоктовую кислоту, как в качестве монотерапии, так и в составе комплексной терапии, постоянно расширяется. В сравнительном открытом рандомизированном исследовании [5], проведенном на кафедре профзаболеваний ГМА им. , оценивалась эффективность препарата, активным веществом которого является тиоктовая кислота, в комплексной терапии проявлений вибрационной болезни (синдром полинейропатии конечностей, ангиодистонический синдром). Применение в дозировке 600 мг ежедневно в составе комплексной терапии в течение 21 дня достоверно снижает частоту субъективных жалоб пациентов, приводит к стойкому уменьшению рецидивов болевого синдрома в конечностях, урежению частоты приступов ангиоспазмов, усиливая эффект терапии в целом. Таким образом, была показана эффективность данного препарата в отношении сосудистого тонуса, кровенаполнения и венозного оттока, что, по мнению авторов, обусловливает развитие противовоспалительного, противоотечного, анальгезирующего эффектов и способствует нормализации гомеостаза.
Исследования М. Senoglu и соавт. (2009) [27] показали эффективность кислоты в отношении таких клинических симптомов, как боль, парестезии, гипостезия у пациентов с компрессионной радикулопатией вследствие дискорадикулярного конфликта. Данные результатов проведенного исследования коррелируют с исследованием, в котором M. Ranieri и соавт. (2009) [26] оценивали эффективность дополнительного использования комбинации и кислоты в реабилитационной программе пациентов с дискогенной радикулопатией при сравнении с аналогичной группой пациентов, получавших только реабилитационную программу. Описан случай эффективного применения препарата тиоктовой кислоты (600 мг/сут. в течение 1 мес.) в составе комплексной терапии у больного с болезнью Лайма III стадии (нейроборрелиоз, изменения ЦНС, поражение ЧМН, периферическая полинейропатия нейроборрелиозом) [4].
Заключение
Имеющиеся сегодня данные позволяют рекомендовать назначение врачом препарата Тиогамма® в лечении пациентов с нейропатией соматогенного происхождения. С высокой степенью эффективности успешно применяется разработанная схема назначения препарата Тиогамма®: внутривенные инфузии готового раствора препарата Тиогамма® в течение 10 дней (во флаконах 50 мг раствора для инфузий 12 мг/мл, что эквивалентно 600 мг тиоктовой кислоты, при времени внутривенного капельного введения 30–40 мин) с последующим назначением таблетированной формы препарата (600 мг/сут) в течение 50 дней. С точки зрения клинической эффективности и с учетом возможности развития побочных эффектов дозировка тиоктовой () кислоты в 600 мг/сут является оптимальной. Индивидуальный подход режима дозирования: при выраженной болевой симптоматике — более короткий по продолжительности курс с высокой дозировкой препарата (1800 мг/сут в течение 4 нед.), при менее выраженных симптомах — более длительный курс с меньшей суточной дозировкой (600 мг/сут в течение 3 мес.).
Важно отметить, что отличительной особенностью препарата Тиогамма® является форма выпуска, которая позволяет вводить препарат внутривенно, капельно, не требуя предварительного разведения.
Кафедра нервных болезней и медицинской генетики с курсом нейрохирургии Ярославской государственной медицинской академии
Кафедра нервных болезней и медицинской генетики с курсом нейрохирургии Ярославской государственной медицинской академии
Кафедра нервных болезней и медицинской генетики с курсом нейрохирургии Ярославской государственной медицинской академии
Кафедра нервных болезней и медицинской генетики с курсом нейрохирургии Ярославской государственной медицинской академии
Лайм-боррелиоз у больных рассеянным склерозом: особенности клиники, диагностики и терапии
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2012;112(2‑2): 64‑68
Баранова Н.С., Спирин Н.Н., Фадеева О.А., Шипова Е.Г., Степанов И.О. Лайм-боррелиоз у больных рассеянным склерозом: особенности клиники, диагностики и терапии. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2012;112(2‑2):64‑68.
Baranova NS, Spirin NN, Fadeeva OA, Shipova EG, Stepanov IO. Lyme disease in patients with multiple sclerosis: clinical, diagnostic and therapeutic features. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2012;112(2‑2):64‑68. (In Russ.).
Кафедра нервных болезней и медицинской генетики с курсом нейрохирургии Ярославской государственной медицинской академии
Лайм-боррелиоз является одним из самых распространенных природно-очаговых трансмиссивных заболеваний в Российской Федерации. У пациентов с рассеянным склерозом (РС) боррелиозная инфекция в ряде случаев может выступать в качестве триггерного фактора, а также неблагоприятно влиять на клиническое течение основного заболевания. Обследованы 100 пациентов с достоверным диагнозом РС, из них у 19 человек было установлено сочетание РС с лайм-боррелиозом. Обсуждены вопросы верификации боррелиозной инфекции, клинические проявления и показания для антибактериальной терапии лайм-боррелиоза при РС.
Кафедра нервных болезней и медицинской генетики с курсом нейрохирургии Ярославской государственной медицинской академии
Кафедра нервных болезней и медицинской генетики с курсом нейрохирургии Ярославской государственной медицинской академии
Кафедра нервных болезней и медицинской генетики с курсом нейрохирургии Ярославской государственной медицинской академии
Кафедра нервных болезней и медицинской генетики с курсом нейрохирургии Ярославской государственной медицинской академии
Лайм-боррелиоз (ЛБ) - болезнь Лайма, иксодовый клещевой боррелиоз - это инфекционное природно-очаговое трансмиссивное заболевание, характеризующееся стадийностью и тенденцией к хроническому течению, возбудителем которой является Borrelia burgdorferi sensu lato, а переносчиком - иксодовые клещи.
За 25 лет изучения в России ЛБ показано, что эта инфекция - одна из наиболее распространенных на территории страны и встречается по крайней мере в 70 субъектах Российской Федерации. Регистрируемая заболеваемость ЛБ в 2002 г. превысила заболеваемость клещевым энцефалитом [4]. В Ярославской области заболеваемость ЛБ является одной из самых высоких по России, причем данная тенденция сохраняется на протяжении ряда лет - ежегодно уровень заболеваемости превышает средний показатель по стране в 3-6,4 раза [5].
В 1930 г. в Европе была предложена теория, согласно которой этиологическим агентом рассеянного склероза (РС) являлась спирохета [10]. Позднее G. Steiner выделил Spirochaeta myelophthora у больных РС. Дальнейшие исследования отвергли инфекционную этиологию РС, но вопросы влияния развившейся у больного боррелиозной инфекции на возникновение и течение РС остаются не до конца изученными [12].
Возможно, что при наличии генетической предрасположенности к РС, боррелиозная инфекция может быть причиной высокой продукции цитокинов, приводящей к демиелинизации и деструкции олигодендроцитов, а также аутоиммунного повреждения центральной нервной системы [9]. В то же время ЛБ может развиться у больного с уже достоверным РС и неблагоприятно повлиять на клиническое течение основного заболевания. У пациентов с РС при сочетании с ЛБ могут наблюдаться признаки поражения серого вещества головного мозга (например, в виде эпилептических приступов), а также симптомы лайм-артрита, лайм-кардита, хронического атрофического акродерматита и др.
Цель исследования - выявление особенностей клинической картины, диагностики и терапии РС в сочетании с ЛБ.
Материал и методы
Обследовали 100 пациентов, 25 мужчин и 75 женщин в возрасте от 17 до 57 лет (средний - 36,8±10,6 года) с достоверным РС по критериям Мак-Дональда [11].
Больных обследовали с помощью традиционных клинических методов для оценки соматического и неврологического статуса, а также с использованием шкалы функциональных систем Куртцке [7], расширенной шкалы инвалидности при РС - EDSS [8]. Проводилось МРТ головного и спинного мозга, стимуляционная электронейромиография (ЭНМГ) периферических нервов, исследование цереброспинальной жидкости - ЦСЖ (клинический анализ и определение уровня антител классов IgG и IgM к B. burgdorferi методом иммуноферментного анализа - ИФА).
Серологическая диагностика ЛБ основывалась на двухэтапном определении в сыворотке крови антител к B. burgdorferi. В качестве первого теста использовался метод ИФА или реакции непрямой иммунофлюоресценции (НРИФ) или иммуноблоттинг (ИМБ). При положительных серологических результатах выполнялось повторное исследование (через 1 мес и позже после первого теста) методом ИФА и/или ИМБ.
У 65 (65%) больных РС антитела к B. burgdorferi в сыворотке крови отсутствовали (группа РС 1); 16 (16%) первоначально серопозитивных больных РС имели отрицательные серологические результаты при повторном обследовании и отсутствие клинических признаков ЛБ, в связи с чем данные пациенты были включены в группу больных РС с ложноположительными серологическими результатами (группа РС 2). У 19 (19%) серопозитивных больных, у которых повышенные титры антител к боррелиям сохранялись при повторном обследовании, либо изначально были очень высокими (в 5-6 раз выше нормы) было диагностировано сочетание достоверного РС и ЛБ (группа РС 3).
Для статистической обработки информации был использован пакет прикладных программ Statistica 6.0 (Statsoft Inc., США).
Результаты и обсуждение
В группе РС 2 (РС с ложноположительными серологическими результатами) по сравнению с группой РС 1 была статистически достоверно большая продолжительность заболевания (Ме=13 [8,5;16,5] и Ме=7 [2;10] лет соответственно, р=0,008). Повышение частоты ложноположительных серологических реакций на ЛБ наблюдается с увеличением длительности болезни, что может быть обусловлено расширением спектра продуцируемых аутоантител и развитием перекрестных иммунологических реакций (феномен расширения эпитопа). Группы РС 1 и РС 2 были сопоставимы по полу, возрасту дебюта заболевания, а также по соотношению ремиттирующей и прогрессирующих форм РС. Не было выявлено других клинических (EDSS, частота встречаемости и тяжесть отдельных неврологических синдромов в дебюте и на момент осмотра) и нейровизуализационных (данные МРТ головного и спинного мозга) отличий группы РС 2 от группы РС 1.
В группу РС 3 (сочетание достоверного РС и ЛБ) вошли 19 пациентов, 8 мужчин и 11 женщин в возрасте от 20 до 50 лет (средний - 37±9 лет). С целью выявления симптомов ЛБ у пациентов группы РС 3 был изучен эпидемиологический анамнез и соматический статус.
Укус клеща в анамнезе в эндемичном по ЛБ регионе был у 11 (57,9%) из 19 больных, в 10 случаях - до дебюта, в 1 наблюдении - после начала РС. Временной интервал от момента укуса клеща до появления симптомов РС составил от 3 до 23 лет (Ме=5 [4;9] лет).
У 1 больного в анамнезе был острый период ЛБ (с развитием типичной мигрирующей эритемы, астении и кардиалгий), пролеченный ампициллином в дозе 2 г в сутки на протяжении 14 дней.
Особенностью клинической картины поздней стадии ЛБ является полиорганность проявлений. Наиболее характерным считается развитие сочетанного поражения нервной системы и суставов в виде полиарталгий, реже - артритов [1, 2]. На момент осмотра 6 (31,6%) больных предъявляли жалобы на боли преимущественно в крупных суставах (плечевых, локтевых, коленных, тазобедренных) легкой или умеренной степени выраженности. При оценке сердечно-сосудистой системы у 2 больных была выявлена синусовая брадикардия и у 1 пациента (имевшего острый период ЛБ в анамнезе) наблюдалось нарушение сердечного ритма по типу желудочковых экстрасистол, однако достоверной связи описанных симптомов с ЛБ установлено не было. По данным клинического обследования ни у одного из 19 больных не было обнаружено признаков поражения печени (лайм-гепатит) или глаз (конъюнктивит, иридоциклит и др.), описанных в литературе при ЛБ [1].

С целью объективной балльной оценки данных, полученных при анализе анамнеза, клинического и инструментального обследования больных, результатов серологического исследования крови на наличие антител к B. burgdorferi, нами был использован фрагмент шкалы относительной ценности отдельных диагностических критериев ЛБ (Lyme borreliosis diagnostic criteria relative value) [6] (табл. 1).
Антибактериальная терапия была проведена 14 (73,7%) больным группы РС 3. Лечение цефтриаксоном в дозе 2 г в сутки внутривенно получили 12 человек (длительность курса составила от 7 до 21 дней, в среднем - 18±5 дней), амоксиклавом в общепринятой дозировке в течение 30 дней - 1 пациент, доксициклином в дозе 200 мг в сутки на протяжении 30 дней - 1 человек.
Впоследствии при наблюдении (через 1 мес и позже) у всех 14 (100%) пролеченных антибиотиками больных было выявлено снижение титров антител к B. burgdorferi в сыворотке крови, кроме того, у 7 (50%) пациентов отмечалось клиническое улучшение в виде уменьшения общей слабости и выраженности атаксии.
По данным оценки по шкале относительной ценности отдельных диагностических критериев ЛБ, суммарный балл у 9 (47,3%) больных группы РС 3 был 4, у 4 (21,1%) - 5, у 2 (10,5%) - 6, у 4 (21,1%) - 7 и более баллов. С учетом этой оценки и наличия эффекта от антибактериальной терапии нами была предложена следующая градация достоверности ЛБ у исследуемых больных группы РС 3: 1. Субклинический (лабораторно подтвержденный) ЛБ: наличие антител к B. burgdorferi в сыворотке крови, подтвержденное методом ИМБ. 2. Возможный ЛБ: а) 5-6 баллов по шкале относительной ценности отдельных диагностических критериев ЛБ без проведения антибактериальной терапии (оценить ее эффективность невозможно); б) 4 балла по шкале относительной ценности отдельных диагностических критериев ЛБ и положительный эффект от проведенной антибактериальной терапии (выражающийся, как минимум, в снижении уровня противоборрелиозных антител при динамическом исследовании сыворотки крови). 3. Достоверный лайм-боррелиоз: а) 5-6 баллов по шкале относительной ценности отдельных диагностических критериев ЛБ и положительный эффект от антибактериальной терапии; б) 7 и более баллов по шкале относительной ценности отдельных диагностических критериев ЛБ, с или без положительного эффекта от антибактериальной терапии.

Таким образом, из 19 больных РС, включенных в группу РС 3, 2 (10,5%) пациента имели субклинический ЛБ, 8 (42,1%) - возможный ЛБ, 9 (47,4%) - сочетание достоверных РС и ЛБ (табл. 2). Клиническое улучшение после проведенной антибактериальной терапии относительно чаще наблюдалось в подгруппе больных РС в сочетании с достоверным ЛБ - у 5 (71,4%) из 7 пролеченных пациентов по сравнению с подгруппой больных РС в сочетании с возможным ЛБ - у 2 (28,6%) из 7 пролеченных пациентов (р>0,05).
Люмбальная пункция была выполнена 8 больным группы РС 3. По данным клинического анализа ЦСЖ количество клеток было от 1 до 8 в 1 мкл (Ме=2), цитоз во всех случаях был лимфоцитарным. Уровень белка ЦСЖ колебался от 278 до 600 мг/л (в среднем 414±95 мг/л). Исследование ЦСЖ методом ИФА, выполненное у 2 пациентов, не выявило диагностически значимого повышения антител к B. burgdorferi.
Для выявления особенностей поражения нервной системы при сочетании РС с ЛБ было проведено сравнение групп РС 3 и РС 1. Данные группы были сопоставимы по возрасту дебюта РС и возрасту больных на момент осмотра, средней продолжительности заболевания, соотношению больных с различными типами течения РС и степени инвалидизации по шкале EDSS на момент осмотра (табл. 3). Частота развития отдельных синдромов поражения центральной нервной системы (вестибуло-мозжечковых нарушений, сенсорных расстройств, пирамидных нарушений, дисфункции ствола головного мозга, зрительных нарушений и дисфункции стволовых структур) на момент осмотра в сравниваемых группах была без достоверных различий (табл. 4). В то же время в группе РС 3 по сравнению с группой РС 1 на момент осмотра нарушения чувствительности наблюдались относительно чаще (в 84,2 и 46,2% наблюдений соответственно, р>0,05) и были более выраженными по шкале Куртцке (Ме=1 и Ме=0 соответственно, р<0,01). Признаки поражения периферической нервной системы в виде полиневропатии достоверно чаще встречались в группе РС 3 по сравнению с группой РС 1 - у 12 (63,2%) и 16 (24,6%) пациентов соответственно (р<0,01).
Полиневропатия считается одним из типичных проявлений ЛБ и, по данным литературы, наблюдается с частотой до 63,9% всех случаев хронического нейроборрелиоза [3]. Клинические проявления полиневропатии наблюдались преимущественно в виде сенсорных нарушений, реже - в сочетании или изолированно в виде вегетативных проявлений либо снижения сухожильных рефлексов. Ни у одного больного в сравниваемых группах не было отмечено развития периферических парезов. По данным ЭНМГ, полиневропатия в сравниваемых группах носила преимущественно аксональный характер (в 5 из 6 ЭНМГ-исследований в группе РС 1 и в 7 из 10 ЭНМГ-исследований в группе РС 3). Статистически значимых различий по данным МРТ-исследований головного и спинного мозга в группах РС 1 и РС 3 выявлено не было.
Таким образом, в эндемичном по иксодовым клещевым боррелиозам регионе у 19% пациентов с РС наблюдалось его сочетание с ЛБ, что способствовало более раннему и тяжелому поражению сферы чувствительности, развитию полиневропатии и артралгий.
У больных РС при наличии укуса клеща и мигрирующей эритемы в анамнезе, артралгий, полиневропатии и радикулопатии необходимо исключать ЛБ с применением двухэтапного метода серологической диагностики.
Антибактериальную терапию следует проводить больным РС с клиническими проявлениями ЛБ и наличием диагностических титров антител к B. burgdorferi (в случае очень высоких титров по данным скринингового исследования методом НРИФ или ИФА и/или сохранения положительных серологических реакций при динамическом обследовании).
В случаях субклинического ЛБ требуется динамическое наблюдение с повторным серологическим обследованием (1 раз год), антибактериальная терапия показана при появлении клинической симптоматики, особенно в сочетании с повышением титров антител к B. burgdorferi.
Для цитирования: Антелава О.А., Ушакова М.А., Ананьева Л.П. и др. Клиническая манифестация нейроинфекции при болезни Лайма на фоне иммуносупрессивной терапии. РМЖ. 2014;7:558.
Лайм-боррелиоз (ЛБ), или болезнь Лайма (Lyme disease), Лаймовский боррелиоз, или иксодовый клещевой боррелиоз – это инфекционное природно-очаговое трансмиссивное мультисистемное инфекционное полиорганное воспалительное заболевание, вызываемое спирохетами рода Borrelia, переносчиками которых являются иксодовые клещи. ЛБ характеризуется стадийностью, склонностью к хронизации и рецидивирующему течению [1].
Особое место в клинической картине болезни занимает поражение нервной системы, или нейроборрелиоз, частота выявления которого зависит от географической зоны, наблюдается в России у 10–60% больных [5]. Колебание в частоте его развития связано с особенностью геновидов боррелии и недостаточной изученностью проблемы в ряде регионов. Наиболее высокая частота поражения нервной системы наблюдается на Северо-Западе и в Центре России – 43–64%.
Широкий спектр клинических симптомов и синдромов при нейроборрелиозе объясняется способностью Воrreliа burgdorferi поражать все отделы нервной системы на любой стадии болезни [6, 7]. При нейроборрелиозе описаны:
- сенестонейропатии, нейропатии и радикулопатии;
- поражения черепно-мозговых нервов (ЧМН): моно(поли)неврит (лицевого, языкоглоточного, блуждающего нервов, зрительного, слухового нервов);
- синдром Банавартца (менингорадикулоневрит);
- периферические невриты, плексит. У 1/3 больных выявляется периферический судорожный синдром (тремор кистей рук и судороги в мышцах голеней);
- миелит;
- миелорадикулоневрит;
- лимфоцитарный менингит;
- очаговый или диффузный энцефалит;
- пароксизмальные расстройства сознания;
- эпилептические припадки, церебральный васкулит;
- прогрессирующий энцефаломиелит.
Хронический боррелиоз, или III стадия ЛБ, развивается у 10% больных через 6 мес. – 2 года после острого периода [8]. Наиболее изученными в этом периоде являются хронические неврологические синдромы, напоминающие по срокам развития третичный период нейросифилиса, названные хроническим нейроборрелиозом. При этом развиваются хронический энцефаломиелит, спастический парапарез, некоторые расстройства памяти, деменция, хроническая аксональная полирадикулопатия. Эта стадия характеризуется чередованием ремиссий и рецидивов, однако в некоторых случаях болезнь имеет непрерывно рецидивирующий характер.
Частота развития хронических форм нейроборрелиоза, по данным разных авторов, составляет от 4 до 20% всех больных ЛБ. Однако имеются данные о том, что реальный показатель может быть значительно выше и после перенесенной безэритематозной формы заболевания достигать 85% [9–11]. Считается, что диагностика этих форм заболевания затруднена в связи с отсутствием общепринятых критериев диагностики и недоступных для широкой практики методов идентификации инфекции [12].
Для хронической нейроинфекции наиболее характерно постепенное поражение нервной системы с развитием патологического процесса, имитирующим другие нозологические формы, в частности рассеянный склероз, рассеянный энцефаломиелит. Большинство больных c хронической нейроинфекцией не указывают на предшествующую мигрирующую эритему или укус клеща. Полагают, что укусы самцов и незрелых особей клещей часто проходят незаметно для людей [13]. Кроме того, могут встречаться безэритематозные формы ЛБ в 2–20% случаев [14–15]. Известно, что в 6–8% случаев возможно субклиническое течение боррелиозной инфекции, при этом отсутствуют клинические проявления болезни. Отсутствие симптомов болезни не исключает развития в последующем II и III стадий заболевания. Все это является фактором риска развития хронической нейроинфекции, т. к. обусловливает отсроченную диагностику [16–18]. Латентный период инфекции при позднем нейроборрелиозе может составлять от 1,5 до 17 лет. Столь длительное латентное течение заболевания связывают с возможным переходом боррелии в неактивные L-формы с последующей их активацией [19–21].
Впервые хронический боррелиозный энцефаломиелит был описан R. Ackermann et al. в 1985 г. [23]. Позже была изучена группа из 44 больных, у которых встречались преимущественно церебральные проявления, напоминающие мультифокальный энцефалит, или спинальные симптомы. В настоящее время частота выявления энцефаломиелита при ЛБ невысока и составляет в среднем 4–5% от всех случаев нейроборрелиоза. Хроническое течение ЛБ в России изучено мало, что связано с отсутствием общепринятых критериев диагностики и недоступных для широкой практики методов идентификации инфекции [24].
В литературе выделяют разные варианты течения нейроинфекции при хроническом ЛБ, включая прогрессирующий энцефаломиелит, хроническую радикулополиневропатию, хронический лимфоцитарный менингит, церебральный васкулит, энцефалопатию и др. Прогрессирующий энцефаломиелит при ЛБ нередко имитирует рассеянный склероз [25, 26]. Согласно наблюдению ряда исследователей, при хроническом ЛБ процесс носит генерализованный характер поражения нервной системы, несмотря на то, что клинически определяется изолированное поражение какого-либо нерва [27, 28]. Пo данным магнитно-резонансной томографии (МРТ) отмечаются поражения очагового характера преимущественно белого вещества головного мозга [29], которые могут определяться после длительного латентного периода.
Ведущие симптомы прогрессирующего боррелиозного энцефаломиелита – это спастические пара- и тетрапарезы, атаксия, дисфункция тазовых органов, когнитивные расстройства в виде снижения памяти и концентрации внимания. Больше чем у 50% больных ЛБ с поражением ЦНС наблюдаются сопутствующее поражение корешков и периферических нервов, множественные парезы черепных нервов, преимущественно вестибулокохлеарного.
Диагностические критерии хронической нейроинфекции включают:
- Наличие признаков поражения ЦНС при боррелиозе после перенесенных I и II стадий заболевания.
- Развитие неврологической симптоматики позднее 6 мес. от появления мигрирующей эритемы и/или факта присасывания клеща или сохранение симптоматики на протяжении более 6 мес.
- Обнаружение умеренных или высокоположительных титров антител к Borrelia burgdorferi в сыворотке крови больного при двукратном обследовании.
- Исключение другой этиологии патологического процесса, протекающего в нервной системе, который мог явиться причиной развития имеющейся у больного клинической симптоматики.
Поражение нервной системы на поздних стадиях ЛБ у 40% больных бывает изолированным и почти в 60% сочетается с экстраневрональными проявлениями ЛБ [6, 30]. Наиболее часто отмечаются поражения опорно-двигательного аппарата в виде артралгии, миалгии и других проявлений. В связи с развитием ревматических синдромов до 30% больных с ЛБ ежегодно обращаются к ревматологам.
Особая сложность диагностики наблюдается при отсроченном развитии поражения нервной системы, когда трудно определить связь развития поражения нервной системы с фактом присасывания клеща, особенно в случае безэритематозных форм. Также позитивность по антителам к Borrelia burgdorferi в ликворе выявляется только у 18% больных ЛБ [31–35].
В патогенезе хронического нейроборрелиоза играют роль проникновение инфекции и лимфоцитов в ткани нервной системы, чему способствуют активация или повреждение эндотелиальных клеток, нарастание уровня растворимой формы одной из основных клеточных молекул адгезии – ICAM-1, металлопротеиназы-9 [32]. В ряде исследований имеются доказательства развития аутоиммунных процессов в виде обнаружения антител, направленных против протеинов Borrelia burgdorferi и белков нервной ткани, вызывающих воспаление и демиелинизацию [33]. Высказывается предположение о возможном участии боррелии в инициации аутоиммунного процесса в результате активации миелин-специфичных Т-клеток и обнаружения аутореактивных антител к миелину и компонентам миелина при ЛБ [34]. По мере прогрессирования заболевания расширяется спектр антител ко многим белкам боррелии, что может приводить к перекрестному реагированию иммунной системы с антигенами боррелии и макроорганизма. Ведущая роль в этом отводится длительной персистенции возбудителя в тканях и его внутриклеточному расположению [35].
Комплексная оценка эпидемиологических, клинико-лабораторных и инструментальных данных, отражающих поражения нервной системы при хроническом ЛБ, демонстрирует отличие клинической картины хронической нейроинфекции в России от таковой в Европе в виде более частого поражения периферической нервной системы (радикулополиневропатии) и энцефалопатии, а также отсутствия сочетания полиневропатии с хроническим атрофическим акродерматитом.
Факторами риска развития хронического нейроборрелиоза названы: множественные присасывания клещей, отсутствие у больных мигрирующей эритемы на месте присасывания клеща в острый период ЛБ, раннее развитие признаков диссеминации, отсроченный и неполный курс лечения в острый период заболевания.
Спектр редких проявлений хронического нейроборрелиоза включает изолированное поражение черепных нервов, множественные мононевропатии, церебральный васкулит, синдромы паркинсонизма и бокового амиотрофического склероза, описан миастеноподобный синдром как проявление хронического ЛБ [36].
Представляют клинический интерес особенности течения хронической микст-инфекции ЛБ с клещевым энцефалитом и эрлихиозом, анаплазмозом. Так, в единичных случаях возможно хроническое течение клещевой микст-инфекции с характерными клинико-лабораторными проявлениями данных заболеваний. Показано, что в единичных случаях возможно хроническое течение клещевого энцефалита и ЛБ с типичными клиническими проявлениями последних. В случае возможной хронической микст-инфекции ЛБ и эрлихиоза по сравнению с изолированным течением ЛБ преобладает системность проявлений в сочетании с общеинфекционным синдромом и изменением лабораторных показателей крови (лейкопения, повышение уровня трансаминаз).
Диагностика и течение ЛБ в целом и нейроборрелиоза в частности при ревматических заболеваниях осложняется некоторым атипизмом клинический картины и скоростью прогрессирования ее проявлений, связанных со скомпрометированностью иммунной системы этой группы пациентов на фоне терапии высокими дозами глюкокортикоидов (ГК) и цитостатиками.
Клинический случай
Пациент Г., 1972 г. р. Анамнез болезни: считает себя больным с июля 2013 г., когда без объективной причины возникли повышение температуры до 37,4°С, параорбитальный отек, первые признаки мышечной слабости, утомляемость, боли в области правого тазобедренного сустава. При обследовании (июль 2013 г.) в общем анализе крови: гемоглобин – 148 г/л, скорость оседания эритроцитов (СОЭ) – 8 мм/ч, лейкопения – 2,82х109 (норма 4,0–9,0), тромбоцитопения, аспартатаминотрансфераза (АСТ) – 49 Ед/л (норма до 35 Ед/л), аланинаминотрансфераза (АЛТ) – 26,2 Ед/л, показатели креатинфосфокиназы (КФК) не исследовали. Белковые фракции: альбумины – 57,3%, (норма 55,7–66,1%), α1 – 6,3% (норма 2,9–11,8%), α2 – 9,1% (норма 7,1–11,8%), β1 – 5,5% (норма 4,7–7,2%), β2 – 5,9% (норма 3,2–6,5%), γ – 15,9% (норма 11,1–18,8%). Общий анализ мочи – без особенностей.
С августа 2013 г. – нарастание параорбитального отека, эритема на лице, груди (в зоне декольте), шее, лихорадка, общая слабость, утомляемость, появление признаков мышечной слабости преимущественно нижних конечностей. При обследовании в сентябре 2013 г. впервые выявлено повышение КФК до 841 Ед/л, лактатдегидрогеназы (ЛДГ) – до 657 Ед/л, креатинина – до 118 мкмоль/л (61–115), сохранялись тромбоцитопения (150х109) и лейкопения (2,8х109).
С учетом наличия в клинической картине параорбитального отека, эритемы на лице и в зоне декольте, проксимальной мышечной слабости, миопатических изменений по данным игольчатой электромиографии, повышения уровня КФК у больного диагностирован дерматомиозит (ДМ), начата терапия ГК в дозе 40 мг/сут, на фоне которой отмечены нормализация температуры тела и уменьшение отека вокруг глаз, снижение уровня КФК, АСТ, АЛТ, нормализации уровня лейкоцитов и тромбоцитов. Однако через 2 нед., на фоне быстрого снижения ГК, при достижении дозы преднизолона 30 мг/сут вновь отмечались возобновление лихорадки, усиление выраженности параорбитального отека, появление и нарастание признаков язвенно-некротического васкулита параорбитальной области (рис. 1 а, б). В связи с обострением заболевания и нарастанием признаков язвенно-некротического васкулита параорбитальной области было назначено повышение дозы ГК до 60 мг/сут, к терапии добавлен циклофосфамид 1000 мг в сочетании с метилпреднизолоном 500 мг в/в капельно 1 р./мес.
За период наблюдения пациенту проведен онкопоиск, включающий КТ грудной клетки, консультации специалистов, в т. ч. уролога – патологии не выявлено. Тогда же (до начала терапии циклофосфамидом в октябре 2013 г.) больному впервые выполнена МРТ головного мозга, каких-либо изменений не выявлено.
На фоне вышеуказанной терапии наблюдались: нормализация температуры тела, заживление язвенно-некротических изменений (рис. 2), нарастание мышечной силы, снижение КФК – 145 Ед/л, ЛДГ– 256 Ел/л, АСТ – 26 Ед/л, АЛТ – 35 Ед/л. Показатели гемоглобина и СОЭ, как и в начале заболевания, сохранялись в пределах нормы.
В январе 2014 г. проведена повторная МРТ головного мозга, при которой выявлено появление множественных инфильтративных очагов в кортикальном слое лобных областей, левой теменной области, супраорбитальный области, признаков отека мозга, нарушение гемодинамики (рис. 4 а–г).
Обращали на себя внимание высокие титры к Borrelia burgdorferi: IgМ – 45,0 Ед/мл (норма 12–17), IgG – 78,7 Ед/мл (до 15), однако исследование спинномозговой жидкости показало отрицательный результат.
Зараженность эрлихиозом и анаплазмозом исключена в лабораторном обследовании.
Таким образом, с учетом неоднократно подтвержденной в динамике позитивности по антителам к Borrelia burgdorferi при проведении как иммуноферментного анализа, так и методики иммуночипа, МРТ- и клинической картины очагового демиелинизирующего поражения ЦНС, факта пребывания пациента в течение более чем 2-х лет в эндемичном районе (в центре европейской части России) и после исключения других причин патологического процесса, протекающего в нервной системе, который мог бы явиться причиной развития имеющейся клинической симптоматики, у больного был диагностирован ЛБ III стадии с поражением нервной системы по типу нейроборрелиоза, наиболее вероятно в виде энцефаломиелита.
Полученные результаты обследования потребовали коррекции лечения: циклофосфамид был отменен, начато снижение дозы ГК и подключение антибактериальной терапии: цефтриаксон 4,0 г/сут в/в капельно № 30, а также ипидакрин 20 х 2 р./сут – 1 мес., тиоктовая кислота 600 мг/сут – 1 мес., витамин Е 400 мг/сут.
В настоящее время на фоне вышеуказанной антибактериальной терапии, приема преднизолона 40 мг/сут (снижение дозы продолжает) и отмены циклофосфамида отмечена стабилизация клинической картины, некоторое уменьшение выраженности амимии и признаков полинейропатии нижних конечностей.
Диагностическая и терапевтическая особенность ведения пациента обусловлена сложностью проведения дифференциальной диагностики. Так, с одной стороны, присутствие в клинической картине выраженного язвенно-некротического васкулита, энантемы, лихорадки, неоднократно выявляемых до лечения ГК лейкопении, тромбоцитопении, требовали исключения прежде всего системной красной волчанки, а также системного васкулита, однако отрицательные результаты анти-ДНК, антинуклеарного фактора, Sm, р-АNCA в иммунологическом анализе крови не позволили с уверенностью говорить об обсуждаемых диагнозах. С другой стороны, с учетом множественного прогрессирующего поражения головного мозга в круг дифференциального диагноза были включены рассеянный склероз и прогрессирующая мультифокальная лейкоэнцефалопатия. Последняя является прогрессирующим демиелинизирующим заболеванием ЦНС, вызываемым реактивацией латентно существующего JC-вируса семейства Papovaviridae, рода Polyomavirus и проявляющимся на фоне иммуносупрессии: СПИД, лимфомиелопролиферативные заболевания, злокачественные опухоли, трансплантация органов и аутоиммунные воспалительные заболевания [37]. При анализе клинико-лабораторной картины, данных анамнеза вопрос диагноза был решен в пользу ЛБ, о чем свидетельствовали картина МРТ-изменений (консультация по поводу результатов МРТ головного мозга в Центре неврологии, г. Москва), наличие высоких титров классов IgG и IgМ к Borrelia burgdorferi, а также клинически-положительная динамика неврологического статуса на фоне антибактериальной терапии.
Остается актуальным вопрос причинно-следственного диагноза. Можно ли рассматривать дебют ДМ как самостоятельный, с последующей манифестацией нейроинфекции на фоне иммуносупрессивной терапии? Или латентно протекающий ЛБ послужил триггером для ревматического заболевания?
Так, на сегодняшний день наиболее вероятным остается диагноз ДМ (параорбитальный отек, эритема в зоне декольте, на шее, язвенно-некротический васкулит, проксимальная мышечная слабость, первично-мышечные электромиографические изменения, повышение КФК).
Клещевой иксодовый боррелиоз (болезнь Лайма) III стадия: нейроборрелиоз, изменения ЦНС (по данным МРТ – очаговые изменения в кортикальном слое лобных областей, левой теменной области, супраорбитальной области), поражение ЧМН, периферическая полинейропатия; миопатический синдром, высокая серопозитивность по антителам к боррелиям классов IgG и IgМ.
Описанный случай интересен не только как клиническое наблюдение – манифестация латентно протекающего ранее ЛБ в виде быстропрогрессирующей нейроинфекции на фоне иммуносупрессивной терапии. Представляют интерес также широта дифференциально-диагностического поиска, осложненного некоторым атипизмом дебюта и течения ДМ, и начало наблюдения авторами за больным уже на фоне лечения ГК.
Что такое болезнь Лайма? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Болезнь Лайма (иксодовый клещевой боррелиоз) — опасное инфекционное трансмиссивное заболевание острого или хронического течения, вызываемое бактериями рода Borrelia, которые поражают кожу, суставы, сердце и нервную систему. Клинически характеризуется полиморфизмом проявлений и без лечения приводит к стойкому нарушению жизнедеятельности и инвалидизации человека.
Возбудитель боррелиоза
род — Borrelia (тип Спирохет)
виды — более 10, из них наиболее этиологически значимые Borrelia burgdorferi (наиболее распространён), Borrelia azelii, Borrelia garinii.
Грамм-отрицательны. Культивируются в видоизменённой среде Kelly (селективная среда BSK-KS). Любит жидкие многокомпонентные среды. Жгутиконосцы. Небольшого диаметра, что позволяет им обходить большинство бытовых бактериальных фильтров. Borrelia burgdorferi состоит из плазмоцилиндра, покрытого клеточной мембраной, имеющей в составе термостабильный ЛПС. Температурный оптимум — 33-37°С. Сходствует со штопорообразной извитой спиралью. Вид завитков неравномерный, вращательные движения медленные.
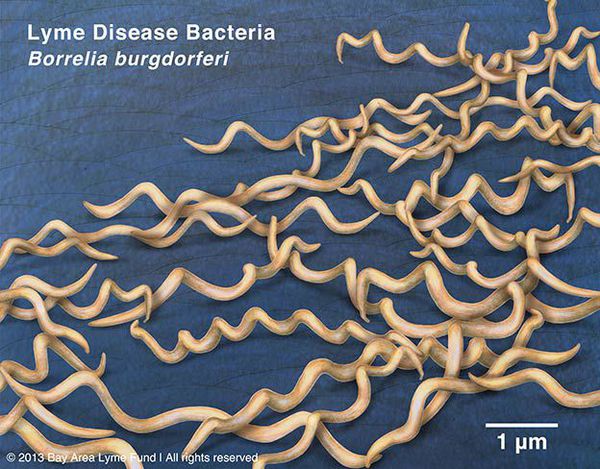
Группы антигенов: поверхностные Osp A, Osp B, Osp С (обуславливают различия штаммов). Этиологические агенты генетически гетерогенны (то есть комплекс Borrelia burgdorferi sensu lato — вызывает группу этиологически самостоятельных иксодовых боррелиозов).
Хорошо красятся анилиновыми красителями. Неплохо выдерживают низкие температуры. Фенол, формалин, спирт и другие обеззараживающие вещества, а также ультрафиолетовое излучение вызывают быструю гибель. Является внутриклеточным паразитом. [2] [3] [5]
Эпидемиология
Природно-очаговое заболевание. Источник инфекции — различные животные (олени, грызуны, волки, домашние и дикие собаки, еноты, овцы, птицы, крупный и мелкий рогатый скот и другие). Переносчики — иксодовые клещи (таёжный и лесной): Ixodes demine (США), Ixodes ricinus и Ixodes persulcatus (Россия и Европа).

Род Ixodes — это темно-коричневый клещ с твёрдым, чуть больше булавочной головки телом, похож на корочку на ссадине или кусочек грязи. В тканях животных возбудитель присутствует в очень небольшом количестве (сложно обнаружить). Исходя из географии заболевания боррелии расселяются с мигрирующими птицами, прикрепившись к ним. Возможен симбиоз нескольких видов боррелий в одном клеще. Возбудитель передаётся среди клещей трансовариальным способом, то есть от самки к потомству. Живут дклещи о 2 лет, часто находятся на кустарниках не выше одного метра от земли. Перезимовать способны только самки, самцы погибают после спаривания. В эндемичных районах заражённость клещей достигает 70%, в остальных регионах — от 10%. Высокая частота инфицированности клеща не является постулатом высокой заболеваемости людей после укуса, так как лишь у немногих клещей боррелии находятся в слюнных железах. Сосание крови осуществляется длительное время и боррелии поступают в ткани не сразу, поэтому ранее удаление клеща существенно снижает риск передачи.
Заразен ли боррелиоз
Механизмы передачи инфекции:
- трансмиссивный (инокуляция — при укусе; очень редка контаминация — при втирании остатков клеща в рану);
- вертикальный (трансплацентарно — от матери к плоду);
- алиментарный путь (через молоко больного животного).
Между людьми боррелиоз не распространяется (исключая вертикальный механизм). Через грудное молоко, слюну и половые жидкости боррелиоз не передаётся.
Распространённость
География распространения достаточно широкая: США, Прибалтика, лесная Европа, Северо-Запад и Центр России, Предуралье, Урал, Западная Сибирь, Дальний Восток.
Сезонность весенне-летняя и осенняя (то есть во время тепла, когда клещи активны). Иммунитет нестерильный. Повторные заболевания возможны через 5-7 лет. [1] [4]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы болезни Лайма
Инкубационный период в различных источниках колеблется от 1 до 50 дней (в практической деятельности следует придерживаться срока 1-30 дней).
Синдромы заболевания:
- общей инфекционной интоксикации;
- эритемы (покраснение кожи);
- артрита;
- регионарной лимфаденопатии (увеличение лимфоузлов);
- поражения нервной системы;
- поражения сердечно-сосудистой системы;
- гепатолиенальный (увеличение печени и селезёнки).
Периоды развития заболевания имеют достаточно условный характер, в основном ограничены лишь временными рамками:
- ранний (локализованная и диссеминированная стадии);
- поздний;
- резидуальный.
Локализованная стадия раннего периода
Начинается остро или подостро с невысокой лихорадки (субфебрильная температура тела — 37,1-38°C), головной боли, слабости, дискомфорта в мышцах и суставах. Редко бывает тошнота и рвота. Катар (воспаление) верхних дыхательных путей возникает очень редко, иногда бывает регионарная лимфаденопатия, гепатолиенальный синдром.
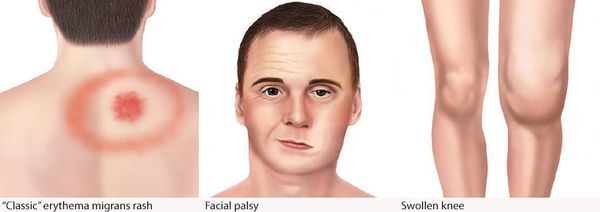
Самым ярким признаком данной фазы болезни (однако не всегда!) является выход на поверхности кожи мигрирующей кольцевидной эритемы (патогномоничный признак заболевания). Вначале в месте локализации укуса клеща возникает первичный аффект (покраснение 2-4 мм красноватого цвета), затем появляется пятно или папула интенсивного розово-красного цвета, в продолжении нескольких суток распространяющаяся во все стороны на много сантиметров в диаметре. Края пятна становятся чётко очерченными, ярко-красными, чуть возвышающимися над уровнем неизменённой кожи. Чаще в центре пятно медленно бледнеет, становится цианотичным (синеет), и образование приобретает характерный вид кольцевидной эритемы овальной или округлой формы.

В месте локализации эритемы не исключается зуд, слабая болезненность. При отсутствии антибиотикотерапии эритема визуализируется в течение нескольких дней, при их отсутствии может держаться до двух месяцев и более. В исходе — слабая непродолжительная пигментация, шелушение. У части больных появляется несколько эритем меньшего диаметра (обычно в более поздний период).
Диссеминированная стадия раннего периода
Эта стадия начинается на 4-6 неделе болезни (при отсутствии профилактической и лечебной терапии предшествующего периода). В этот период происходит угасание предшествующей симптоматики (синдрома общей инфекционной интоксикации, лихорадки и эритемы). Выявляются неврологические нарушения:
- мягкотекущий энцефалит,
- мононевропатии,
- серозные менингиты,
- энцефаломиелит с радикулоневритическими реакциями,
- лимфоцитарный менингорадикулоневрит, характеризующийся болями в месте укуса, сильными корешковыми болями с нарушением чувствительности и двигательной функции шейного и грудного отделов спинного мозга — так называемый синдром Бэннуорта, включающий триаду: корешковые боли, периферический парез (чаще лицевого и отводящего нервов) и лимфоцитарную клеточную реакцию с содержанием клеток от 10 до 1200 в мм3) при выполнении люмбальной пункции.
Возможно поражение сердечно-сосудистой системы — кардиалгии, сердцебиения, повышение артериального давления, миокардиты, AV-блокады (нарушения передачи нервного импульса в проводящей системе сердца).
Иногда бывают поражения кожи (уртикарные и другие высыпания). Может наблюдаться боррелиозная лимфоцитома (доброкачественный лимфаденоз кожи) — синюшно-красный кожный инфильтрат с лимфоретикулярной пролиферацией, преимущественно располагающийся на мочке уха или соске груди. Редко возникают поражения глаз в виде конъюнктивита, хориоидита, ирита.

Не исключаются лёгкие гепатиты, нарушение работы почек.
Поражения суставов в виде реактивного артрита (в основном крупные суставы) в виде болей и ограничения подвижности, без внешних изменений, длительностью от недели до трёх месяцев. При отсутствии лечения болезнь Лайма переходит в хроническую форму.
Поздний период лаймборрелиоза

Боррелиоз у беременных
Заражение женщины во время беременности (и до неё при отсутствии лечения) повышает риск гибели плода и выкидыша. Возможно внутриутробное поражение плода с развитием энцефалита и кардита, однако величина риска этого остаётся неясна.
Отличия боррелиоза у детей
Болезнь Лайма у детей чаще всего развивается в возрасте от 3 до 10 лет. При этом часто появляется мигрирующая эритема (покраснение кожи), расположенная в верхней половине тела. Интоксикация, как правило, сильнее, чем у взрослых. Могут увеличиваться лимфатические узлы возле места укуса клеща. Без лечения до 20 % случаев болезни Лайма переходит в хроническую форму.
Дифференциальный диагноз:
- в первую фазу — лихорадочные состояния с экзантемой, клещевой энцефалит, рожистое воспаление, эризипелоид, целлюлит;
- во вторую стадию — серозные менингиты другой этиологии, клещевой энцефалит, ревмокардит;
- в третью стадию — ревматизм и сходные заболевания, ревматоидный артрит, болезнь Рейтера. [3][6]
Отличия от клещевого энцефалита
При клещевом энцефалите присутствует выраженная лихорадка, общемозговая и неврологическая симптоматика, при боррелиозе — поражения кожи, суставов и сердца.
Патогенез болезни Лайма
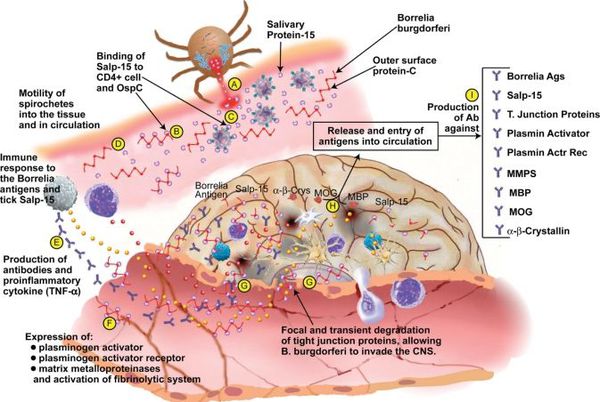
В случае прогрессирования боррелиоза (отсутствия лечения) происходит дальнейшее размножение боррелий, расширение спектра антител к антигенам спирохет и их длительная выработка (хронизация инфекции). Появляются циркулирующие иммунные комплексы, усиление продукции T-хелперов, лимфоплазматические инфильтраты (уплотнения ткани) в органах.
Ведущую роль в патогенезе артритов несут липополисахариды, стимулирующие синтез ИЛ-1 клетками моноцитарно-макрофагального ряда, Т- и В-лимфоцитов, простагландинов и коллагеназы синовиальной тканью (то есть происходит активация воспаления в полости суставов). Циркулирующие иммунные комплексы накапливаются в органах, привлекают нейтрофилы, которые вырабатывают медиаторы воспаления, вызывая воспалительные и дистрофические изменения в тканях. Возбудитель может сохраняться в организме десятилетия, поддерживая иммунопатологический процесс. [2] [3] [6]
Классификация и стадии развития болезни Лайма
1. По форме:
- манифестная;
- латентная (симптомы отсутствуют, только лабораторные изменения);
2. По течению:
- острое (до трёх месяцев)
- подострое (от трёх до шести месяцев);
- хроническое (более шести месяцев) — непрерывное и рецидивирующее.
3. По периодам:
- ранний (острая и диссеминированная стадии);
- поздний;
- резидуальные явления.
4. По клиническим признакам (при остром и подостром течении):
5. По преимущественному поражению какой-либо системы:
- нервной системы;
- опорно-двигательного аппарата;
- кожных покровов;
- сердечно-сосудистой системы;
- комбинированные.
6. По степени тяжести:
Осложнения болезни Лайма
Осложнения не характерны, но существуют резидуальные (остаточные) явления заболевания — стойкие, необратимые изменения органического характера (кожи, суставов, сердца, нервной системы при отсутствии явного воспалительного процесса и зачастую самого возбудителя). Они возникают не во время разгара болезни, а спустя длительное время (годы) и снижают работоспособность человека, вплоть до инвалидности. К ним относятся деформирующие артриты с органическими изменениями суставов, истончение кожи, нарушение мнестических функций, памяти, снижение работоспособности.
Диагностика болезни Лайма
К какому врачу обращаться при подозрении на боррелиоз
При укусе клеща и подозрении на клещевой боррелиоз необходимо обратиться к инфекционисту.
Какие исследования может назначить врач
- общеклинический анализ крови с лейкоцитарной формулой (нейтрофильный лейкоцитоз, повышение СОЭ);
- биохимический анализ крови (повышение островоспалительных белков, РФ, сиаловых кислот);
- серологические тесты (ИФА классов IgM и IgG, при сомнительных данных выполнение иммуноблоттинга. ПЦР крови, синовиальной жидкости, ликвора).
- МРТ ГМ (признаки атрофии коры головного мозга, дилатации желудочковой системы, воспалительные изменения, арахноидит).
В практической деятельности следует подходить к диагностике комплексно, учитывая совокупность данных, а не только результаты одного вида исследований. Например, в случаях, когда у пациентов при регулярных исследованиях неоднократно выявляются изолированные повышенные титры IgM (даже при подтверждении иммуноблоттингом) при отсутствии IgG, то это следует расценивать как ложноположительный результат. Причинами этого явления могут быть системные аутоиммунные заболевания, онкология, иные инфекционные заболевания, туберкулёз и другие, зачастую причины остаются невыясненными. [1] [4]
Через какое время после укуса клеща сдавать анализ на боррелиоз
Анализы следует сдавать сразу после укуса клеща и повторно три недели спустя.
Лечение болезни Лайма
Может проводиться как в инфекционном отделении больницы (при тяжёлом процессе), так и в амбулаторных условиях.
Показана диета № 15 по Певзнеру (общий стол). Режим отделения.
Медикаментозное лечение. Антибактериальная терапия
Наиболее важным и эффективным является применение этиотропной терапии (устраняющей причину) в как можно более ранние сроки от момента укуса клеща. Является достаточно дискутабельным вопрос о применении антибактериальной терапии в ранние сроки (до пяти дней от момента укуса) у необследованных лиц (или до момента получения результатов обследования клеща). Однако с практической точки зрения, учитывая возможность полиэтиологического характера возможного заражения человека (клещевой боррелиоз, моноцитарный эрлихиоз, гранулоцитарный анаплазмоз и другое) и серьёзные прогнозы при развитии системного клещевого боррелиоза, данное превентивное (профилактическое) лечение вполне обосновано. Применяются препараты широкого спектра действия, например, тетрациклинового, цефалоспоринового и пенициллинового рядов.
При развитии поздних стадий системного клещевого боррелиоза эффективность антибиотикотерапии существенно снижается (однако показания сохраняются), так как основное значение приобретают процессы аутоиммунных поражений при малоинтенсивном инфекционном процессе. Курсы лечения длительные (до одного месяца и более), в совокупности с препаратами улучшения доставки антибиотиков в ткани, десенсибилизирующей, противовоспалительной, антиоксидантной терапией.
В случае развития гипериммунного аутопроцесса (патологически усиленного иммунитета) назначаются средства, снижающие реактивность иммунной системы.
После перенесённого заболевания устанавливается диспансерное наблюдение за человеком до двух лет с периодическими осмотрами и серологическим обследованием. [1] [5]
Пробиотики
При лечение антибактериальными препаратами следует принимать пробиотические средства.
Дезинтоксикационная терапия
Выраженная интоксикация при болезни Лайма встречается редко, поэтому дезинтоксикационная терапия обычно не требуется.
Симптоматическое лечение
Для уменьшения симптомов боррелиоза могут применяться нестероидные противовоспалительные средства и противоаллергические препараты.
Общеукрепляющая терапия и физиотерапия
При лечении хронических форм боррелиоза можно применять средства общеукрепляющей терапии: витамины и иммуностимуляторы. Также могут назначаться физиотерапевтические процедуры: электрофорез, УФ-облучение, магнитотерапия, УВЧ, парафиновые аппликации, массаж, ЛФК. Эти методы популярны в России, однако исследований, подтверждающих их эффективность при восстановлении после болезни Лайма, недостаточно.
Прогноз. Профилактика
Неспецифическая профилактика — использование защитной плотной одежды при посещении лесопарковой зоны, отпугивающих клещей репеллентов, периодические осмотры кожных покровов (раз в два часа). Централизованная обработка лесных и парковых угодий акарицидными средствами. При обнаружении присосавшегося клеща незамедлительно обратиться в травматологическое отделение для удаления клеща и отправки его на обследование и параллельно обратиться к врачу-инфекционисту для наблюдения, обследования и получения рекомендаций по профилактической терапии.
Специфическая — профилактическое использование антибиотиков в ранние сроки после укуса клеща по назначению врача. [4] [5]
Создаётся ли иммунитет после перенесённого боррелиоза
Повторно заболеть можно через 5-7 лет, в некоторых случаях раньше.
Существует ли прививка от боррелиоза
Вакцины от болезни Лайма сейчас нет. Компании Valneva, Pfizer и MassBiologics разработали вакцины-кандидаты, которые проходят клинические испытания [7] .
Читайте также:

