Болезни рахит туберкулез могут быть причиной
Обновлено: 24.04.2024
Рахит – это заболевание обмена веществ, которое наблюдается у детей в возрасте до трех лет. При рахите нарушается формирование костей и зубов на фоне снижения уровня витамина D и недостаточного усвоения кальция и фосфора. Это приводит к размягчению и деформации костей, неправильным росту и смене молочных зубов, а также к нарушениям раннего развития ребенка.
Своевременная диагностика позволяет провести эффективное лечение с минимальным ущербом для здоровья и предотвратить тяжелые последствия, которые могут сохраниться до конца жизни.
Причины рахита
Для лучшего понимания природы рахита необходимо понять роль витамина Д в обменных процессах организма, который отвечает за фосфорно-кальциевый обмен, а именно за всасывание этих микроэлементов из кишечника и их отложение в костной ткани и зубах. В незначительном количестве он поступает в организм с пищей, но основная его часть синтезируется в коже под действием ультрафиолета. Переход витамина Д в активную форму происходит в печени и почках под воздействием специального фермента – гидроксилазы.
- несбалансированный рацион питания ребенка;
- недостаточное пребывание на солнце;
- рождение раньше срока;
- генетическая предрасположенность;
- нарушение усвоения витамина Д из пищи [1].
При низком уровне кальция активируется паратгормон, который еще больше усиливает вымывание кальция из организма. Из-за нарушений формирования костной ткани происходит разрастание хрящей, что приводит к утолщению трубчатых костей в местах сочленения с суставами.
Если образовавшийся дефицит кальция организм восполняет путем резорбции (рассасывания) костей, то снижение уровня фосфора ничем не компенсируется. Именно с недостатком этого микроэлемента связывают непосредственную причину развития рахита. В частности, низкий уровень фосфора приводит к повреждению нервных волокон и вызывает неврологические явления и снижение мышечного тонуса.
Также нарушения кальций-фосфорного обмена могут быть обусловлены рядом других патологий.
К предрасполагающим факторам относятся проживание на территории, для которой характерны влажность, преимущественно пасмурная погода, высокий уровень загрязнения воздуха. Неблагоприятными периодами считаются осень и зима, когда солнечная активность и продолжительность прогулок на свежем воздухе уменьшаются. Риск заболевания рахитом и тяжесть его течения также повышаются при искусственном вскармливании по сравнению с грудным кормлением.
Симптомы рахита
- Нарушение развития костей ног: позднее начало самостоятельной ходьбы, О-образное или Х-образное искривление ног после начала ходьбы, нарушение походки (переваливающаяся), появление болей и/или судорог в ногах, частые переломы, дисплазия тазобедренных суставов.
- Нарушение развития зубов: позднее прорезывание, неправильный порядок прорезывания, нарушение прикуса, раннее выпадение молочных зубов, кариес.
- Нарушение формирования черепа: позднее зарастание родничка, вытянутая форма черепа, высокий лоб.
- Нарушение развития мышц: утомляемость (ребенок быстро просится на руки), мышечная слабость (грудничок плохо держит голову, с трудом переворачивается и садится).
- Неврологические нарушения: беспокойство, капризность, беспричинный плач, плохой сон, повышенная потливость.
- Другие патологии: например, деформированная грудная клетка, выпуклый живот, утолщения на ребрах и руках, выпадение волос, нарушения функции внутренних органов.
Различают три степени выраженности рахита: легкую (I), среднюю (II) и тяжелую (III). Рахит I степени проявляется неврологическими симптомами (нарушение поведения и сна). Для II степени характерны поражения костной и мышечной ткани. При рахите III степени тяжесть и разнообразие симптомов нарастают вплоть до выраженного отставания в физическом и умственном развитии и смертельного исхода из-за структурно-функциональных изменений в органах.
По течению заболевание бывает острым (быстрое нарастание симптомов), подострым (более медленное развитие заболевания) и хроническим (с периодами клинического улучшения) [3].
По лабораторным показателям различают рахит со снижением уровня фосфора (фосфопенический) или кальция (кальцийпенический), а также заболевание может протекать без заметных изменений уровня этих микроэлементов в крови [1].
Диагностика рахита
Первичный осмотр ребенка, беседа с родителями и дополнительные обследования позволяют выявить признаки рахита и диагностировать заболевание с высокой точностью.
Лабораторные анализы при рахите включают определение уровня 25-гидроксикальциферола (основного метаболита витамина D), электролитов (кальций в крови и моче, фосфор в крови и моче), щелочной фосфатазы, а также паратгормона (выделяется паратиреоидными железами и регулирует обмен кальция и фосфора).
Из инструментальных методов применяют УЗИ внутренних органов, измерение плотности костей (денситометрию), при необходимости – рентгенограмму и компьютерную томографию трубчатых костей.
- врожденная ломкость костей;
- метафизарная дисплазия;
- гипотиреоз;
- гипо и гиперфосфатазия;
- наследственные рахитоподобные заболевания;
- наследственные фосфат-диабет;
- почечный тубулярный ацидоз.
Лечение рахита
Если заболевание вызвано нарушениями со стороны какого-либо органа, то в первую очередь устраняют такую патологию.
Витамин Д в терапии рахита играет решающую роль. Его назначают детям сразу после рождения вместе с препаратами кальция и магния.
Огромное значение имеет правильное питание. Рекомендуются грудное вскармливание или тщательный подбор детской смеси, своевременный и сбалансированный прикорм, включающий богатые кальцием и фосфором продукты (рыба, мясо, печень, овощные и фруктовые пюре, молочные продукты).
Также показаны гимнастика для разработки и укрепления мышц, суставов и позвоночника, массаж, лечебные ванны.
Диспансеризацию детей, перенесших рахит, проводят в течение первых 2-3 лет жизни. Она включает регулярные осмотры (каждые 3 месяца) и, по решению врача, повторные лабораторные анализы [2].
Госпитализация ребенка необходима при рахите II или III степени, а также, если стандартные методы лечения не дают желаемого эффекта [2].
Что такое рахит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Федотовой Натальи Николаевны, педиатра со стажем в 11 лет.
Над статьей доктора Федотовой Натальи Николаевны работали литературный редактор Вера Васина , научный редактор Наталья Бычкова и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Рахит (Rickets) — это заболевание, которое возникает при нарушениях обмена фосфора и кальция, из-за чего растущая костная ткань не минерализируется [6] . Болезнью страдают только дети, преимущественно грудного и раннего возраста.
К рахиту приводит дефицит витамина D, а именно его активных метаболитов — кальцитриола и кальцидиола. При заболевании повышается нервная возбудимость, деформируются кости и снижается мышечный тонус [13] [14] [15] [16] [17] .
![Рахит [18]](https://probolezny.ru/media/bolezny/rahit/rahit-18_s.jpg)
Распространённость рахита
Рахит встречается во всём мире, но чаще всего его выявляют у народов Крайнего Севера. В этих районах не хватает солнечного света, а 90 % образующегося в организме витамина D вырабатывается в коже под влиянием ультрафиолета. По последним данным, частота рахита в России колеблется от 54 до 66 %, но преобладают лёгкие и стёртые формы [13] .
Причины и факторы риска рахита
Выделяют первичный и вторичный рахит. Разница между ними — в причинах заболевания, которые, в свою очередь, связаны с возрастом ребёнка.
Причины первичного витамин D-дефицитного рахита:
- Ребёнок мало времени проводит на свежем воздухе, ему не хватает солнечного света. Постоянное пребывание в помещении — это важный фактор развития рахита.
- Пищевые факторы:
- питание неадаптированными молочными смесями, в которые в том числе не добавлен витамин D;
- длительное исключительно молочное вскармливание (женским или коровьим молоком), введение прикорма позднее 6-месячного возраста;
- применение только вегетарианского прикорма: овощей, фруктов, злаков, бобовых [1] .
К предрасполагающим причинам относятся факторы, связанные с беременностью и родами:
- возраст матери младше 17 и старше 35 лет [13] ; ;
- плацентарная недостаточность;
- несбалансированное питание беременной, недостаток двигательной активности и свежего воздуха;
- недоношенность (преждевременные роды);
- большая масса плода при рождении (более 4 кг);
- низкая масса тела при рождении (менее 1,5 кг).
Причины вторичного витамин D-дефицитного и минералдефицитного рахита:
- Синдром мальабсорбции — нарушенное всасывание питательных веществ в тонком кишечнике; синдром мальдигестии — недостаточность пищеварения (глютеновая энтеропатия, муковисцидоз и другие заболевания) [15] .
- Повышенная проницаемость кишечной стенки и хронические неспецифические воспалительные заболевания кишечника (болезнь Крона, неспецифический язвенный колит).
- Лактазная недостаточность — в организме отсутствует, недостаточно вырабатывается или слабо активен фермент лактаза, расщепляющий молочный сахар (лактозу).
- Тяжёлые и длительно текущие энтериты с выраженным дисбактериозом и диареей.
- Гипофосфатемия как генетическая патология, наследуемая по Х-сцепленному доминантному типу.
- Хронические болезни печени и почек: хронический гепатит, в том числе аутоиммунный; первичный склерозирующий холангит; наследственное заболевание печени, обусловленное недостаточностью a-1-антитрипсина; нефрогенные остеопатии — аномалии развития почек (поликистоз, гипоплазия почек), интерстициальный нефрит, тубулопатии.
- Медикаментозные факторы:
- приём противосудорожных средств (Фенобарбитала и Дифенина) от полугода;
- длительное применение диуретиков (зависит от частоты приёма и дозы; но обычно с ними назначаются витамин D и микроэлементы);
- внутривенное питание более пяти дней.
- Экологические факторы:
- повышенное содержание в почве, воде и пище тяжёлых металлов: стронция, свинца, цинка;
- избыток фосфора в продуктах питания;
- недостаток кальция в почве и воде и, соответственно, в овощах.
Также к развитию рахита предрасполагают:
- недостаточная двигательная активность ребёнка (тугое пеленание, отсутствие гимнастики);
- нарушения обмена веществ;
- полигиповитаминозы (дефицит многих витаминов);
- хронические инфекции.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы рахита
Клинические проявления рахита зависят от периода его развития. Выделяют начальный период, период разгара, выздоровления и остаточных явлений.
Начальный период
Симптомы заболевания отчётливо видны в 3–4-месячном возрасте, но первые признаки проявляются уже в 1–1,5 месяца. К таким проявлениям относятся:
- повышенная нервная возбудимость: ребёнок становится беспокойным, пугливым, раздражительным, излишне чувствительным к внешним факторам; у него нарушается сон, он часто вздрагивает, особенно при засыпании, громком звуке или внезапной вспышке света;
- снижение аппетита;
- сильная потливость, особенно во сне и при кормлении; пот приобретает кислый запах, становится липким;
- облысение затылка (из-за повышенной потливости головки, беспокойства и трения о постель или шапочку);
- резкий запах мочи;
- сниженный тонус мышц; .
Начальный период рахита длится от 1,5 недель до месяца.
Период разгара
Далее наступает период разгара, во время которого возникают изменения со стороны скелета:

![Костные утолщения запястий при рахите [19]](https://probolezny.ru/media/bolezny/rahit/kostnye-utolsheniya-zapyastiy-pri-rahite-19_s.jpg)
Период выздоровления
Исчезают признаки активного рахита, такие как потливость, повышенная нервная возбудимость, сниженный мышечный тонус, размягчение костей и др. Обычно этот период наступает после лечения, но может возникать и спонтанно.
Период остаточных явлений
Патогенез рахита
Витамин D поступает в организм с едой и пищевыми добавками, а также образуется в коже под воздействием солнечного света. Чтобы поступивший из пищи витамин D стал активным, ему предстоит пройти две последовательные реакции окисления:
- первая реакция протекает в печени, в результате образуется кальцидиол;
- вторая реакция проходит в почках и завершается выработкой активной формы — кальцитриола.
Кальцитриол контролирует обмен кальция в организме. При низкой концентрации ионов кальция он способствует его мобилизации из костной ткани. Также кальцитриол повышает содержание кальция и фосфора во внеклеточной жидкости, что укрепляет растущие кости.
В метаболизме витамина D важная роль принадлежит паратгормону — гормону паращитовидной железы. При дефиците витамина D развивается гипокальциемия, из-за чего избыточно вырабатывается паратгормон, что ведёт к потере фосфора и снижает отложение кальция в костях.
На начальной стадии рахита снижается концентрация кальция в сыворотке крови. При этом активируется паратгормон, что возвращает уровень кальция в норму, но содержание фосфора остаётся низким. Щелочная фосфатаза просачивается во внеклеточную жидкость, её концентрация повышается от умеренной до очень высокой [2] . Щелочная фосфатаза вырабатывается остеобластами — сверхактивными клетками костной ткани, играющими важную роль в её формировании и обновлении. Чем выше их активность, тем больше концентрация щелочной фосфатазы в крови, поэтому её уровень высок после переломов.
Классификация и стадии развития рахита
В клинической педиатрии многие годы используется классификация рахита, принятая на VI Всесоюзном съезде детских врачей в 1947 году по предложению педиатра С. О. Дулицкого. В ней предусмотрено уточнение периода болезни, её течения и степени тяжести [15] .
По периоду заболевания различают начальный период, период разгара, выздоровления и остаточных явлений.
По характеру течения выделяют:
По тяжести течения рахита выделяют:
Осложнения рахита
У детей, страдающих рахитом, может возникнуть спазмофилия — состояние, при котором появляются судороги и другие признаки повышенной нервно-мышечной возбудимости.
Для спазмофилии характерны:
- лицевой феномен Хвостека — мышцы лица сокращаются в ответ на удар молоточком в области перед ухом, где проходит лицевой нерв ;
- симптом Эрба — мышцы сокращаются при воздействии электрического тока силой менее 5 мА.
Смазмофилия возникает из-за снижения уровня ионов кальция в крови менее 1,0 ммоль/л (общего кальция ниже 1,8 ммоль/л) на фоне увеличения pH крови и других тканей организма.
Спазмофилию могут провоцировать острые респираторные вирусные инфекции, гипервентиляция лёгких, нервно-психическое возбуждение, рвота, терапия витамином D одновременно с ультрафиолетовым облучением (УФО) [13] .
Диагностика рахита
Для диагностики рахита врач собирает анамнез (историю болезни), осматривает ребёнка и назначает лабораторно-инструментальные исследования.
Лабораторная диагностика:
- анализ крови на содержание кальция — на начальной стадии рахита его уровень снижен (2,0 ммоль/л), но на момент постановки диагноза часто повышается до нормы (2,2 – 2,7 ммоль/л), что связано с активной секрецией гормонов паращитовидной железы;
- определение уровня фосфора в сыворотке крови — обычно его уровень ниже возрастной нормы (1,5 – 1,8 ммоль/л);
- исследование концентрации в крови щелочной фосфатазы — обычно её содержится примерно в два раза больше, чем в норме (более 400 ЕД/л);
- исследование содержания в крови паратгормона — обычно также повышено;
- определение уровня метаболита витамина D (кальцитриола) в крови — может быть нормальным или повышенным из-за активной работы паращитовидной железы.
![Снимок коленного сустава при рахите [20]](https://probolezny.ru/media/bolezny/rahit/snimok-kolennogo-sustava-pri-rahite-20_s.jpg)
Перечисленные исследования позволяют как уточнить диагноз, так и контролировать эффективность лечения [16] .
Дифференциальная диагностика
Рахит следует отличать от следующих заболеваний:
- Гипофосфатазия — редкое генетическое врождённое заболевание, при котором нарушается минерализация костей скелета и зубов, возникают системные осложнения: проблемы с дыханием, судороги, слабость мышц, боль в костях и кальциноз почек.
- Синдром Янсена — редкая аутосомно-доминантная форма нарушения развития костей, для которой характерно поражение метафизов и непропорционально низкий рост.
- Гипофосфатемический рахит, устойчивый к витамину D, — наследственная группа заболеваний, при которых из организма избыточно выводится фосфор. Болезнь может развиться из-за поломок в различных генах, которые регулируют обмен фосфора. В результате нарушается минерализация костной ткани и не хватает энергии мышцам, так как молекула АТФ (аккумулятор энергии в организме) включает фосфор. Когда ребёнок начинает ходить, под тяжестью собственного тела у него появляются рахитические деформации ног.
- Дефицит кальция — признаки нехватки кальция и витамина D одинаковы. Отличить состояния можно, сдав анализ крови.
- Дефицит фосфора — может развиться у недоношенных детей, находящихся на грудном вскармливании и не получающих минеральных добавок. Симптомы также схожи с дефицитом витамина D, поэтому такое состояние можно ошибочно принять за рахит.
Лечение рахита
Для лечения и профилактики назначают витамин D: минимум 1000 МЕ в сутки для детей грудного возраста, 1500 – 2000 МЕ — детям от года до трёх лет. Используются капли — Аквадетрим, Вигантол, ДеТриФерол. Аквадетрим также есть в таблетках. Препараты применяют ежедневно в течение нескольких месяцев, пока концентрация щелочной фосфатазы не приблизится к норме.
Также рекомендуется регулярно гулять на свежем воздухе, проводить общий массаж и заниматься лечебной гимнастикой. В первый год жизни ребёнка следует кормить грудью или адаптированной смесью и своевременно вводить прикормы [5] . Остаточные явления рахита устраняются с помощью лечебной физкультуры и массажа.
Ребёнку, страдающему рахитом, обязательно проводится санация очагов инфекции (например, носоглотки, кишечника, мочевыводящей системы). Детям с перинатальным поражением центральной нервной системы, т .е. возникшим во время беременности и родов, нужно своевременно проходить неврологическое лечение и реабилитацию.
Повышенная чувствительность и передозировка витамином D может привести к повышенному уровню кальция в крови и моче. При этих состояниях нарушается сердечный ритм, появляется тошнота, рвота, головная боль, слабость, раздражительность, снижается вес, усиливается жажда, учащается мочеиспускание, образуются почечные камни, повышается уровень кальция в почках и мягких тканях, возникает почечная недостаточность, анорексия, гипертония, запор или жидкий стул.
При хронической передозировке витамином D возникает деминерализация костей, кальций откладывается в почках, сосудах, сердце, лёгких, кишечнике и нарушается работа органов [6] . Развивается полиурия и полидипсия — обильное выделение мочи и очень сильная жажда. Повышенная концентрация кальция в крови и моче способствует нефрокалькулёзу и нефрокальцинозу. Всё это может привести к смерти пациента, поэтому принимать витамин D нужно под контролем врача и с наблюдением за лабораторными показателями [17] .
Прогноз. Профилактика
Дети с витамин D-дефицитным рахитом, как правило, хорошо реагируют на адекватное лечение препаратами витамина D. Однако как во время выздоровления, так и в период остаточных явлений, у них могут сохраняться, а иногда даже усиливаться кариес, деформация грудной клетки и костей таза, нарушение осанки и искривление ног.
У женщин, перенёсших в детстве рахит, может развиться поясничный лордоз — искривление поясничного отдела позвоночника, при котором этот отдел как бы уходит вперёд, к животу. Из-за этого могут быть сужены размеры входа и выхода из малого таза, что осложняет вынашивание плода и роды, часто требуется операция кесарева сечения [15] .
Профилактика рахита
Профилактику рахита нужно начинать ещё до рождения ребёнка. Пища беременной женщины должна содержать достаточно калорий, белков, жиров, углеводов, минеральных солей и витаминов. Обязательны прогулки на свежем воздухе и здоровый образ жизни. Специфическая профилактика в этом периоде заключается в приёме витамина D. Учитывая, что в России часто встречается его дефицит, всем женщинам, готовящимся к зачатию, желательно получать витамин D в профилактических дозах (не менее 600–800 МЕ витамина D в сутки). При наступлении беременности дозу увеличивают до 800–1200 МЕ в сутки.
Постнатальная профилактика рахита начинается сразу после рождения ребёнка. Предпочтительнее естественное вскармливание, но важно своевременно ввести прикорм. Также нужно заниматься гимнастикой, принимать воздушные ванны, проводить массаж, водные процедуры, гулять на свежем воздухе и поддерживать положительный эмоциональный тонус ребёнка.
Специфическая профилактика рахита заключается в приёме витамина D [15] . Искусственные заменители грудного молока, хотя и обогащены им (в среднем 40–45 МЕ на 100 мл), суточную потребность не покрывают. Шестимесячный ребёнок, находящийся на искусственном вскармливании, получает не более 15–20 % необходимого витамина D. Относительно низкая его усвояемость приводит к тому, что это количество оказывается ниже ещё в два раза. Даже самые лучшие смеси не способны обеспечить ребёнка достаточным количеством этого витамина.
Согласно международным рекомендациям, чтобы предотвратить рахит, нужен ультрафиолетовый свет или 10 мкг (400 МЕ) препарата витамина D ежедневно и нормальное поступление кальция и фосфора [11] [12] . В день достаточно 20 минут ультрафиолетового облучения, попадающего на лицо светлокожего ребёнка, и на несколько минут больше для детей с повышенной пигментацией.
В руководстве по клинической практике Эндокринного общества США сказано, что детям первого года жизни в сутки требуется принимать 400–1000 МЕ витамина D, а детям от года — 600–1000 МЕ [9] . Европейское общество детской гастроэнтерологии, гепатологии и питания также рекомендует приём витамина D по 400 МЕ/сутки детям первого года жизни [10] .
Отечественные рекомендации отличаются из-за климатических особенностей. Профилактические дозы витамина D составляют:
- детям 1–12 месяцев — 1000 МЕ/сутки без перерыва на летние месяцы (не требует пересчёта у детей на смешанном и искусственном вскармливании);
- детям 1–3 лет — 1500 МЕ/сутки без перерыва на летние месяцы;
- детям 3–18 лет —1000 МЕ/сутки без перерыва на летние месяцы.
- беременным женщинам — 2000 МЕ на весь период беременности [14] .
Для Европейского севера России рекомендованы следующие дозы в зависимости от возраста ребёнка:
- 1–6 месяцев (вне зависимости от вида вскармливания) – 1000 МЕ/сутки;
- 6–12 месяцев – 1500 МЕ/сутки;
- 1–3 года – 1500 МЕ/сутки;
- дети старше 3 лет – 1500 МЕ/сутки.
Туберкулез – это инфекционное заболевание, вызываемое палочкой Коха (Mycobacterium tuberculosis). Патоген чаще всего поражает легкие, но существуют и другие формы: туберкулез костей, суставов, почек, кожи и других органов.
Процент смертности от туберкулеза по всему миру высок, он входит в десятку заболеваний, приводящих к летальным исходам [1]. Это не только медицинская, но и социальная проблема, поскольку на заболеваемость, помимо состояния здоровья, также влияют социальные и экономические причины, качество питания и образ жизни. Ключевыми факторами риска считаются вредные привычки, ослабленная иммунная система и хронический стресс.
Как передается туберкулез
Возбудитель передается от человека к человеку воздушно-капельным путем при чихании и кашле и просто при разговоре, а также иногда контактно (через поврежденную кожу или внутриутробно). Бактерии туберкулеза долго сохраняются активными во внешней среде в плохо проветриваемом помещении и попадают в организм здорового человека через предметы быта и продукты питания.
Заражение туберкулезом еще не означает начало заболевания: оно развивается только у 5-15% инфицированных. До развития первых симптомов может пройти несколько недель или месяцев, и основным фактором риска считается ослабление иммунных сил организма [1].
Классификация туберкулеза
- открытая форма (больной активно выделяет микобактерии в воздух и заражает других людей);
- закрытая форма (больной является носителем и не выделяет возбудителя в окружающую среду).
- первичное заражение с локальным воспалением в области проникновения и вовлечением близлежащих лимфоузлов;
- латентный период с образованием очагов воспаления в других органах;
- активная инфекция с ухудшением общего состояния здоровья, образованием каверн (полостей) в легких и множественными поражениями в других органах [2].
Симптомы туберкулеза
Признаки заражения различаются в зависимости от органа, пораженного микобактерией. Общие симптомы включают утомляемость, сниженную трудоспособность, плохой аппетит, повышенную температуру тела, потерю веса, появление румянца на щеках.
- затяжной кашель на протяжении нескольких недель (сухой или мокрый);
- кровохаркание;
- боль в области груди;
- затрудненное дыхание;
- увеличение периферических лимфоузлов (в области головы, шеи и конечностей);
- ночная потливость;
- периодическое повышение температуры.
Диагностика туберкулеза
Это заболевание, особенно закрытая форма, сложно диагностируется. Переход из латентной фазы в активную смазанный, а клинические симптомы не позволяют установить точный диагноз или отсутствуют. В связи с этим решающее значение имеет лабораторная диагностика.
Квантифероновый тест на туберкулез. Этот современный иммунологический метод позволяет выявить латентный туберкулез, а также туберкулезное поражение других органов. Введения туберкулина не требуется, поэтому этот тест подходит уязвимым группам пациентов (беременные и кормящие женщины, пожилые люди, ВИЧ-инфицированные, люди с непереносимостью туберкулина). Для диагностики используется венозная кровь. Наличие в организме активного туберкулеза обуславливает появление в крови особых белков, входящих в состав микобактерий. Т-лимфоциты реагируют на присутствие этих белков и в результате такой сенсибилизации начинают усиленно вырабатывать интерферон-гамма. Квантифероновый тест основан на измерении уровня интерферона-гамма, повышение которого указывает на наличие туберкулезной инфекции в пробе крови.
Метод T-SPOT.TB. Позволяет диагностировать латентную и активную формы легочного и внелегочного туберкулеза. Для исследования используют венозную кровь. В основе метода лежит оценка количества самих сенсибилизированных Т-лимфоцитов. Он также не дает ложноположительных результатов и подходит уязвимым группам пациентов.
Анализ мокроты. Для проведения теста необходимо собрать утреннюю мокроту, которая отделяется при кашле. Во взятом образце определяют наличие самих микобактерий. Анализ подходит только для диагностики туберкулеза легких.
Анализ мочи. Выявляют изменения параметров, характерные для туберкулеза: появление лейкоцитов, эритроцитов, бактерий, белка, гноя, сдвиг реакции мочи в кислую сторону.
Отрицательные лабораторные анализы не гарантируют отсутствие туберкулеза. Пациенты с подозрением на заболевание проходят флюорографию и/или рентгенографию легких. Для выявления внелегочных форм туберкулеза проводят МРТ, КТ и другие инструментальные исследования. Также применяют биопсию (взятие образца тканей) для микроскопических исследований и посевов на питательные среды.
Дифференциальную диагностику проводят с широким рядом заболеваний в тех случаях, когда ни одно исследование не подтвердило наличие микобактерий, присутствуют атипичные симптомы или отсутствует адекватный ответ на противотуберкулезное лечение.
Лечение туберкулеза
- Медикаментозная терапия. Противотуберкулезные препараты разделяют на основные (назначаются пациентам с первичным заражением), резервные (назначаются при неэффективности препаратов основной группы или их непереносимости) и комбинированные (многокомпонентные препараты с фиксированной дозой отдельных компонентов).
- Химиотерапия. Направлена на уничтожение микобактерий или подавление их размножения.
- Симптоматическое лечение конкретных нарушений и симптомов.
- Физиотерапия при туберкулезе легких с целью улучшения питания тканей и стимуляции их восстановления (ингаляции, ароматерапия, электролечение, лазеротерапия, дарсонвализация, магнитотерапия) [3].
Полное выздоровление не гарантирует отсутствие рецидива заболевания в будущем.
Туберкулез легких – это инфекционная патология, вызываемая бациллой Коха, характеризующаяся различными в клинико-морфологическом отношении вариантами поражения легочной ткани. Многообразие форм туберкулеза легких обусловливает вариабельность симптоматики. Наиболее типичны для туберкулеза легких респираторные нарушения (кашель, кровохарканье, одышка) и симптомы интоксикации (длительный субфебрилитет, потливость, слабость). Для подтверждения диагноза используются лучевые, лабораторные исследования, туберкулинодиагностика. Химиотерапия туберкулеза легких проводится специальными туберкулостатическими препаратами; при деструктивных формах показано хирургическое лечение.
МКБ-10
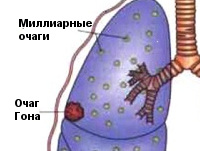

Общие сведения
На сегодняшний день туберкулез легких представляет не только медико-биологическую, но и серьезную социально-экономическую проблему. По данным ВОЗ, туберкулезом инфицирован каждый третий житель планеты, смертность от инфекции превышает 3 млн. человек в год. Легочный туберкулез является самой частой формой туберкулезной инфекции. Удельный вес туберкулеза других локализаций (суставов, костей и позвоночника, гениталий, кишечника, серозных оболочек, ЦНС, глаз, кожи) в структуре заболеваемости значительно ниже.

Причины
Характеристика возбудителя
Отличительной чертой МБТ является их высокая устойчивость к внешним воздействиям (высоким и низким температурам, влажности, воздействию кислот, щелочей, дезинфектантов). Наименьшую стойкость возбудители туберкулеза легких демонстрируют к солнечному свету. Для человека опасность представляют туберкулезные бактерии человеческого и бычьего типа; случаи инфицирования птичьим типом микобактерий крайне редки.
Пути заражения
Основной путь заражения при первичном туберкулезе легких – аэрогенный: от больного открытой формой человека микобактерии распространяются с частичками слизи, выделяемыми в окружающую среду при разговоре, чихании, кашле; могут высыхать и разноситься с пылью на значительные расстояния. В дыхательные пути здорового человека инфекция чаще попадает воздушно-капельным или пылевым путем.
Меньшую роль в инфицировании играют алиментарный (при употреблении зараженных продуктов), контактный (при использовании общих предметов гигиены и посуды) и трансплацентарный (внутриутробный) пути. Причиной вторичного туберкулеза легких выступает повторная активация ранее перенесенной инфекции либо повторное заражение.
Факторы риска
Однако попадание МБТ в организм не всегда приводит к заболеванию. Факторами, на фоне которых туберкулез легких развивается особенно часто, считаются:
- неблагоприятные социально-бытовые условия
- курение и другие химические зависимости
- недостаточное питание
- иммуносупрессия (ВИЧ-инфекция, прием глюкокортикоидов, состояние после трансплантации органов)
- онкологические заболевания и др.
В группе риска по развитию туберкулеза легких находятся мигранты, заключенные, лица, страдающие наркотической и алкогольной зависимостью. Также имеет значение вирулентность инфекции и длительность контакта с больным человеком.
Патогенез
При снижении местных и общих факторов защиты микобактерии беспрепятственно проникают в бронхиолы, а затем в альвеолы, вызывая специфическое воспаление в виде отдельных или множественных туберкулезных бугорков или очагов творожистого некроза. В этот период появляется положительная реакция на туберкулин - вираж туберкулиновой пробы. Клинические проявления туберкулеза легких на этой стадии часто остаются нераспознанными. Небольшие очажки могут самостоятельно рассасываться, рубцеваться или обызвествляться, однако МБТ в них длительно сохраняются.
Классификация
Первичный туберкулез легких - это впервые развившаяся инфильтрация легочной ткани у лиц, не имеющих специфического иммунитета. Диагностируется преимущественно в детском и подростковом возрасте; реже возникает у лиц старшего и пожилого возраста, которые в прошлом перенесли первичную инфекцию, закончившуюся полным излечением. Первичный туберкулез легких может принимать форму:
- первичного туберкулезного комплекса (ПТК)
- туберкулеза внутригрудных лимфоузлов (ВГЛУ)
- хронически текущего туберкулеза.
Вторичный туберкулез легких развивается при повторном контакте с МБТ или в результате реактивации инфекции в первичном очаге. Основные вторичные клинические формы представлены:
Отдельно различают кониотуберкулез (туберкулез, развивающийся на фоне пневмокониозов), туберкулез верхних дыхательных путей, трахеи, бронхов; туберкулезный плеврит. При выделении больным МБТ в окружающую среду с мокротой говорят об открытой форме (ВК+) туберкулеза легких; при отсутствии бацилловыделения – о закрытой форме (ВК–). Также возможно периодическое бацилловыделение (ВК±).
Течение туберкулеза легких характеризуется последовательной сменной фаз развития:
- 1) инфильтративной
- 2) распада и обсеменения
- 3) рассасывания очага
- 4) уплотнения и обызвествления.
Симптомы туберкулеза легких
Первичный туберкулезный комплекс
Первичный туберкулезный комплекс сочетает в себе признаки специфического воспаления в легком и регионарный бронхоаденит. Может протекать бессимптомно или под маской простудных заболеваний, поэтому выявлению первичного туберкулеза легких способствуют массовые скрининги детей (проба Манту) и взрослых (профилактическая флюорография).
Чаще возникает подостро: больного беспокоит сухой кашель, субфебрилитет, утомляемость, потливость. При острой манифестации клиника напоминает неспецифическую пневмонию (высокая лихорадка, кашель, боль в груди, одышка). В результате лечения происходит рассасывание или обызвествление ПТК (очаг Гона). В неблагоприятных случаях может осложняться казеозной пневмонией, образованием каверн, туберкулезным плевритом, милиарным туберкулезом, диссеминацией микобактерий с поражением почек, костей, мозговых оболочек.
Туберкулез внутригрудных лимфоузлов
Признаки туберкулезной интоксикации включают отсутствие аппетита, снижение массы тела, утомляемость, бледность кожи, темные круги под глазами. На венозный застой в грудной полости может указывать расширение венозной сети на коже грудной клетки. Данная форма нередко осложняется туберкулезом бронхов, сегментарными или долевыми ателектазами легких, хронической пневмонией, экссудативным плевритом. При прорыве казеозных масс из лимфоузлов через стенку бронхов могут формироваться легочные очаги туберкулеза.
Очаговый туберкулез легких
Клиническая картина очагового туберкулеза малосимптомна. Кашель отсутствует или возникает редко, иногда сопровождается выделением скудной мокроты, болями в боку. В редких случаях отмечается кровохарканье. Чаще больные обращают внимание на симптомы интоксикации: непостоянный субфебрилитет, недомогание, апатию, пониженную работоспособность. В зависимости от давности туберкулезного процесса различают свежий и хронический очаговый туберкулез легких.
Течение очагового туберкулеза легких относительно доброкачественное. У больных с нарушенной иммунной реактивностью заболевание может прогрессировать в деструктивные формы туберкулеза легких.
Инфильтративный туберкулез легких
Клиническая картина инфильтративного туберкулеза легких зависит от величины инфильтрата и может варьировать от нерезко выраженных симптомов до острого лихорадочного состояния, напоминающего грипп или пневмонию. В последнем случае отмечается выраженная высокая температура тела, ознобы, ночная потливость, общая слабость. Со стороны органов дыхания беспокоит кашель с мокротой и прожилками крови.
В воспалительный процесс при инфильтративной форме туберкулеза легких часто вовлекается плевра, что обусловливает появление болей в боку, плеврального выпота, отставание пораженной половины грудной клетки при дыхании. Осложнениями инфильтративного туберкулеза легких могут стать казеозная пневмония, ателектаз легкого, легочное кровотечение и др.
Диссеминированный туберкулез легких
Может манифестировать в острой (милиарной), подострой и хронической форме. Тифоидная форма милиарного туберкулеза легких отличается преобладанием интоксикационного синдрома над бронхолегочной симптоматикой. Начинается остро, с нарастания температуры до 39-40 °С, головной боли, диспепсических расстройств, резкой слабости, тахикардии. При усилении токсикоза может возникать нарушение сознания, бред.
При легочной форме милиарного туберкулеза легких с самого начала более выражены дыхательные нарушения, включающие сухой кашель, одышку, цианоз. В тяжелых случаях развивается острая сердечно-легочная недостаточность. Менингеальной форме соответствуют симптомы поражения мозговых оболочек.
Подострое течение диссеминированного туберкулеза легких сопровождается умеренной слабостью, понижением работоспособности, ухудшением аппетита, похуданием. Эпизодически возникают подъемы температуры. Кашель продуктивный, не сильно беспокоит больного. Иногда первым признаком заболевания становится легочное кровотечение.
Хронический диссеминированный туберкулез легких при отсутствии обострения бессимптомен. Во время вспышки процесса клиническая картина близка к подострой форме. Диссеминированный туберкулеза легких опасен развитием внелегочного туберкулеза, спонтанного пневмоторакса, тяжелых легочных кровотечений, амилоидоза внутренних органов.
Кавернозный и фиброзно-кавернозный туберкулез легких
Характер течения кавернозного туберкулезного процесса волнообразный. В фазу распада нарастают интоксикационные симптомы, гипертермия, усиливается кашель и увеличивается количество мокроты, возникает кровохарканье. Часто присоединяется туберкулез бронхов и неспецифический бронхит.
Фиброзно-кавернозный туберкулез легких отличается формированием каверн с выраженным фиброзным слоем и фиброзными изменениями легочной ткани вокруг каверны. Протекает длительно, с периодическими обострениями общеинфекционной симптоматики. При частых вспышках развивается дыхательная недостаточность II-III степени.
Осложнениями, связанными с деструкцией легочной ткани, являются профузное легочное кровотечение, бронхоплевральный свищ, гнойный плеврит. Прогрессирование кавернозного туберкулеза легких сопровождается эндокринными расстройствами, кахексией, амилоидозом почек, туберкулезным менингитом, сердечно-легочной недостаточностью – в этом случае прогноз становится неблагоприятным.
Цирротический туберкулез легких
Является исходом различных форм туберкулеза легких при неполной инволюции специфического процесса и развитии на его месте фиброзно-склеротических изменений. При пневмоциррозе бронхи деформированы, легкое резко уменьшено в размерах, плевра утолщена и нередко обызвествлена.
Изменения, происходящие при цирротическом туберкулезе легких, обусловливают ведущие симптомы: выраженную одышку, тянущую боль в груди, кашель с гнойной мокротой, кровохарканье. При обострении присоединятся признаки туберкулезной интоксикации и бацилловыделение. Характерным внешним признаком пневмоцирроза служит уплощение грудной клетки на стороне поражения, сужение и втянутость межреберных промежутков. При прогрессирующем течении постепенно развивается легочное сердце. Цирротические изменения в легких необратимы.
Туберкулома легкого
Представляет собой инкапсулированный казеозный очаг, сформировавшийся в исходе инфильтративного, очагового или диссеминированного процесса. При стабильном течении симптомы не возникают, образование выявляется при рентгенографии легких случайно. В случае прогрессирующей туберкуломы легкого нарастает интоксикация, появляется субфебрилитет, боль в груди, кашель с отделением мокроты, возможно кровохарканье. При распаде очага туберкулома может трансформироваться в кавернозный или фиброзно-кавернозный туберкулез легких. Реже отмечается регрессирующее течение туберкуломы.
Диагностика
Диагноз той или иной формы туберкулеза легких выставляется врачом-фтизиатром на основании совокупности клинических, лучевых, лабораторных и иммунологических данных. Для распознавания вторичного туберкулеза большое значение имеет подробный сбор анамнеза. Для подтверждения диагноза проводится:
- Лучевая диагностика.Рентгенография легких является обязательным диагностической процедурой, позволяющей выявить характер изменений в легочной ткани (инфильтративный, очаговый, кавернозный, диссеминированный и т. д.), определить локализацию и распространенность патологического процесса. Выявление кальцинированных очагов указывает на ранее перенесенный туберкулезный процесс и требует уточнения данных с помощью КТ или МРТ легких.
- Анализы. Обнаружение МБТ достигается неоднократным исследованием мокроты (в т. ч. с помощью ПЦР), промывных вод бронхов, плеврального экссудата. Но сам по себе факт отсутствия бацилловыделения не является основанием для исключения туберкулеза легких. Современные иммунологические тесты позволяют выявить туберкулезную инфекцию почти со 100%-ной вероятностью. К ним относятся QuantiFERON и Т-спот. ТБ.
- Туберкулинодиагностика. К методам туберкулинодиагностики относятся диаскин-тест, пробы Пирке и Манту, однако сами по себе данные методы могут давать ложные результаты. Иногда для подтверждения туберкулеза легких приходится прибегать к пробному лечению противотуберкулезными препаратами с оценкой динамики рентгенологической картины.
По результатам проведенной диагностики туберкулез легких дифференцируют с пневмонией, саркоидозом легких, периферическим раком легкого, доброкачественными и метастатическими опухолями, пневмомикозами, кистами легких, абсцессом, силикозом, аномалиями развития легких и сосудов. Дополнительные методы диагностического поиска могут включать бронхоскопию, плевральную пункцию, биопсию легкого.

Лечение туберкулеза легких
Во фтизиатрической практике сформировался комплексный подход к лечению туберкулеза легких, включающий медикаментозную терапию, при необходимости - хирургическое вмешательство и реабилитационные мероприятия. Лечение проводится поэтапно: сначала в тубстационаре, затем в санаториях и, наконец, амбулаторно. Режимные моменты требуют организации лечебного питания, физического и эмоционального покоя.
- Противотуберкулезная терапия. Ведущая роль отводится специфической химиотерапии с помощью препаратов с противотуберкулезной активностью. Для терапии различных форм туберкулеза легких разработаны и применяются 3-х, 4-х и 5-тикомпонентные схемы (в зависимости от количества используемых препаратов). К туберкулостатикам первой линии (обязательным) относятся изониазид и его производные, пиразинамид, стрептомицин, рифампицин, этамбутол; средствами второго ряда (дополнительными) служат аминогликозиды, фторхинолоны, циклосерин, этионамид и др. Способы введения препаратов различны: перорально, внутримышечно, внутривенно, эндобронхиально, внутриплеврально, ингаляторно. Курсы противотуберкулезной терапии проводят длительно (в среднем 1 год и дольше).
- Патогенетическая терапия. При туберкулезе легких включает прием противовоспалительных средств, витаминов, гепатопротекторов, инфузионную терапию и пр. В случае лекарственной резистентности, непереносимости противотуберкулезных средств, при легочных кровотечениях используется коллапсотерапия.
- Хирургическое лечение. При соответствующих показаниях (деструктивных формах туберкулеза легких, эмпиеме, циррозе и ряде др.) применяются различные оперативные вмешательства: кавернотомию, торакопластику, плеврэктомию, резекцию легких.
Профилактика
Профилактика туберкулеза легких является важнейшей социальной проблемой и приоритетной государственной задачей. Первым шагом на этом пути является обязательная вакцинация новорожденных, детей и подростков. При массовых обследованиях в дошкольных и школьных учреждениях используется постановка внутрикожных туберкулиновых проб Манту. Скрининг взрослого населения осуществляется путем проведения профилактической флюорографии.
Туберкулез у детей – специфическое инфекционно-воспалительное поражение различных тканей и органов, вызываемое микобактериями туберкулеза. Основными клиническими формами туберкулеза у детей служат ранняя и хроническая туберкулезная интоксикация, первичный туберкулезный комплекс, туберкулезный бронхоаденит, острый милиарный туберкулез; реже встречаются туберкулезный менингит, мезаденит, туберкулез периферических лимфоузлов, кожи, почек, глаз, костно-суставной системы. Диагностика туберкулеза у детей включает микроскопию, бакпосев, ПЦР исследование биологических сред; постановку туберкулиновых проб, рентгенографию, томографию, бронхоскопию и пр. При туберкулезе у детей показано назначение туберкулостатических препаратов.
МКБ-10
Общие сведения

Причины
Микобактерия туберкулеза (туберкулезная палочка, палочка Коха) благодаря наличию кислотоустойчивой стенки может сохранять жизнеспособность и вирулентность в различных условиях внешней среды – при высушивании, замораживании, воздействии кислот, щелочей, антибиотиков и т. п. Способность к образованию L-форм обусловливает широкий диапазон изменчивости морфологических свойств и приспосабливаемость к существованию в различных условиях. Высокопатогенными для человека являются 2 вида возбудителя: Mycobacterium tuberculosis humans (человеческого типа) и Mycobacterium bovis (бычьего типа).
Микобактерии туберкулеза могут попадать в организм ребенка аэрогенным, алиментарным, контактным, смешанным путем, в соответствии с чем образуется первичный очаг воспаления. У детей может иметь место внутриутробное трансплацентарное инфицирование туберкулезом или итранатальное, во время родов при аспирации околоплодных вод.
К группе повышенного риска по заболеваемости туберкулезом принадлежат дети:
- не получившие вакцинацию БЦЖ в период новорождённости;
- ВИЧ-инфицированные;
- длительно получающие лечение гормонами, цитостатиками, антибиотиками;
- проживающие в неблагоприятных санитарно-эпидемиологических и социальных условиях;
- часто болеющие дети;
- страдающие сахарным диабетом и др.
В большинстве случае дети заражаются туберкулезом дома и в семье, однако возможны эпидемические вспышки в детских садах и школах, внутрибольничное инфицирование, заражение в других общественных местах. Наиболее восприимчивыми к туберкулезу оказываются дети в возрасте до 2-х лет – для них характерны генерализованные формы инфекции (милиарный туберкулез, туберкулезный сепсис). Среди детей старше 2-х лет чаще встречается туберкулез органов дыхания (75% случаев), значительно реже – все другие формы.
Патогенез
Вначале туберкулез у детей манифестирует как общая инфекция, затем при благоприятных для возбудителя условиях развиваются очаги поражения (туберкулезные бугорки) в том или ином органе. Исходом первичного туберкулезного процесса может служить полное рассасывание, фиброзная трансформация и кальцинация очагов, где нередко сохраняются живые микобактерии туберкулеза. При реинфицировании происходит обострение и прогрессирование туберкулезного процесса, нередко с диссеминацией микобактерий и образованием множественных очагов в других органах (вторичный туберкулез).
Классификация
Классификация форм туберкулеза у детей учитывает клинико–рентгенологические признаки, течение, протяженность (локализацию) процесса:
I. Ранняя и хроническая туберкулезная интоксикация детей и подростков.
II.Туберкулезное поражение органов дыхания у детей:
- первичный туберкулезный комплекс
- туберкулезный бронхоаденит (туберкулез внутригрудных лимфатических узлов)
- туберкулез легких (милиарный, диссеминированный, инфильтративный, очаговый, кавернозный, фиброзно-кавернозный, цирротический, туберкулема)
- туберкулезный плеврит
- туберкулез трахеи, туберкулез бронхов, верхних дыхательных путей и др.
III.Туберкулез других локализаций у детей:
- туберкулез нервной системы (туберкулезный менингит, миелит, лептоменингит, менингоэнцефалит)
- костно-суставной туберкулез
- туберкулез органов мочеполовой системы
- туберкулез кожи и подкожной клетчатки
- туберкулез кишечника, брюшины и брыжеечных лимфоузлов
- туберкулез периферических лимфоузлов
- туберкулез глаз (кератит, кератоконъюнктивит, эписклерит, хориоретинит, иридоциклит)
По периоду течения туберкулезного процесса различают фазу инфильтрации, распада, обсеменения, рассасывания, уплотнения, рубцевания, обызвествления. По факту бацилловыделения различают туберкулезный процесс с выделением M. tuberculosis (БК+) и без выделения M. tuberculosis (БК ).
В рамках данного обзора остановимся на основных формах туберкулеза органов дыхания у детей. Туберкулез почек, туберкулез гортани, генитальный туберкулез рассмотрены в соответствующих самостоятельных статьях.
Симптомы туберкулеза у детей
Ранний период первичной туберкулезной инфекции
Начальная фаза взаимодействия возбудителя и макроорганизма длится от 6 до 12 месяцев от момента инфицирования ребенка микобактериями туберкулеза. В этом периоде выделяют бессимптомный этап (около 6-8 недель) и вираж туберкулиновых проб - переход реакции Манту из отрицательной во впервые положительную. Ребенок с виражом туберкулиновых реакций подлежит направлению к фтизиатру и наблюдению специалистом в течение года. В дальнейшем у таких детей сохраняется состояние инфицированности микобактериями туберкулеза либо, при неблагоприятных условиях, развивается та или иная локальная форма туберкулеза.
Туберкулезная интоксикация детей и подростков
Представляет собой промежуточную форму между первичным инфицированием и развитием локального туберкулезного процесса, определяемого рентгенологическими и другими методами. Клиническое течение данной формы туберкулеза у детей характеризуется неспецифическими проявлениями: недомоганием, раздражительностью, ухудшением аппетита, головной болью, тахикардией, диспепсией, остановкой или снижением массы тела, склонностью к интеркуррентным заболеваниям (ОРВИ, бронхитам).
Если признаки туберкулезной интоксикации у детей сохраняются более 1 года, состояние расценивается как хроническое.
Первичный туберкулезный комплекс
Данная форма туберкулеза у детей характеризуется триадой признаков: развитием специфической реакции воспаления в очаге внедрения инфекции, лимфангитом и поражением региональных лимфоузлов. Развивается при сочетании массивности и высокой вирулентности туберкулезной инфекции со снижением иммунобиологических свойств организма. Первичный туберкулезный комплекс может локализоваться в легочной ткани (95%), кишечнике, реже – в коже, миндалинах, слизистой оболочке носа, в среднем ухе.
Заболевание может начинаться остро или подостро; маскироваться под грипп, острую пневмонию, плеврит либо протекать бессимптомно. Клинические проявления включают интоксикационный синдром, субфебрилитет, кашель, одышку. Изменения в первичном очаге проходят инфильтративную фазу, фазу рассасывания, уплотнения и кальцинации (формирования очага Гона).
Туберкулезный бронхоаденит
Бронхоаденит или туберкулез внутригрудных лимфатических узлов у детей протекает со специфическими изменениями лимфоузлов корня легкого и средостения. Частота этой клинической формы туберкулеза у детей достигает 75-80%.
Кроме субфебрилитета и симптомов интоксикации, у ребенка появляется боль между лопаток, коклюшеподобный или битональный кашель, экспираторный стридор, обусловленные сдавлением увеличенными внутригрудными лимфоузлами трахеи и бронхов. При осмотре обращает внимание расширение подкожной венозной сети в верхних отделах груди и спины.
Осложнениями туберкулезного бронхоаденита у детей могут являться эндобронхит, ателектазы или эмфизема легких. Данный клинический вариант туберкулеза у детей требует дифференциации с саркоидозом Бека, лимфогранулематозом, лимфосаркомой, неспецифическими воспалительными аденопатиями.
Диагностика
- Скрининг на туберкулез. В настоящее время для массового выявление туберкулеза среди детей в качестве основных скрининг-тестов используются проба Манту с 2 ТЕ и диаскин-тест. При желании родителей они могут быть заменены на исследования крови на туберкулез (T-spot, квантиферон-тест). В возрасте 15 и 17 лет подросткам выполняется профилактическая флюорография.
- Рентгенография грудной клетки. При различных формах туберкулеза органов дыхания у детей позволяет визуализировать изменения во внутригрудных лимфоузлах или легких. При необходимости исследование дополняется линейной или компьютерной томографией органов грудной полости.
- Эндоскопия.Бронхоскопия ребенку необходима для оценки косвенных признаков туберкулезного процесса (выявления признаков эндобронхита, деформации трахеи и бронхов увеличенными лимфоузлами) и получения смывов для исследований.
- Лабораторная диагностика. Для выделения возбудителя из различных биологических сред (мокроты, мочи, испражнений, крови, плевральной жидкости, промывных вод бронхов, отделяемого костных секвестров, спинномозговой жидкости, мазка из зева и мазка с конъюнктивы) осуществляется микроскопическое, бактериологическое, ИФА, ПЦР-исследование. Забор и исследование материала на КУБ производится не менее 3 раз.
- Специфическая диагностика. В условиях диспансера детям с подозрением на инфицированность или туберкулез проводится индивидуальная туберкулинодиагностика (повторная реакция Манту, проба Пирке, проба Коха).
Лечение туберкулеза у детей
Принципы терапии туберкулеза у детей подразумевают поэтапность, преемственность и комплексность. Основные этапы включают лечение в условиях стационара, специализированного санатория и противотуберкулезного диспансера. Длительность курса терапии составляет в среднем 1,5-2 года. Важная роль в организации лечения туберкулеза у детей отводится санитарно-диетическим мероприятиям (высококалорийному питанию, пребыванию на свежем воздухе, обучению режиму кашля).
Комплексная терапия туберкулеза у детей включает химиотерапевтическое, хирургическое и реабилитационное воздействие. Режим специфического противотуберкулезного лечения (комбинация препаратов, длительность приема, необходимость госпитализации) определяется детским фтизиатром на основании формы заболевания и наличия бацилловыделения.
Дети с виражом туберкулезных реакций не нуждаются в госпитализации и лечатся амбулаторно одним противотуберкулезным препаратом (изониазидом, фтивазидом) в течение 3-х месяцев. Диспансерное наблюдение продолжается 1 год, после чего при отрицательных данных клинико-лабораторного обследования ребенок может быть снят с учета. В остальных случаях в соответствии с индивидуальными показаниями используются комбинации из 2-х, 3-х и 4-х и более противотуберкулезных препаратов, основными из которых являются стрептомицин, рифампицин, изониазид, пиразинамид и этамбутол. Курс лечения туберкулеза у детей подразделяется на фазу интенсивной терапии и фазу поддерживающей терапии.
В случае сохранения выраженных остаточных явлений через 6-8 месяцев после активной терапии туберкулеза у детей решается вопрос о хирургическом вмешательстве.
Прогноз и профилактика
Исходом и лечения может являться значительное улучшение, улучшение, отсутствие перемен, ухудшение течения туберкулеза у детей. В большинстве случаев при правильном лечении достигается полное выздоровление. Серьезный прогноз туберкулеза может ожидаться у детей раннего возраста, при диссеминации процесса, развитии туберкулезного менингита.
Специфическая профилактика туберкулеза у детей начинается в период новорожденности и продолжается в подростковом возрасте (см. Вакцинация против туберкулеза). Большую роль в вопросе профилактики туберкулеза у детей играет систематическая туберкулинодиагностика, улучшение санитарно-гигиенических условий, рациональное вскармливание, физическое закаливание детей, выявление взрослых больных туберкулезом.
Читайте также:

