Брадикардия у детей при отравлении
Обновлено: 05.05.2024
Отравление блокаторами кальциевых каналов и их побочные эффекты
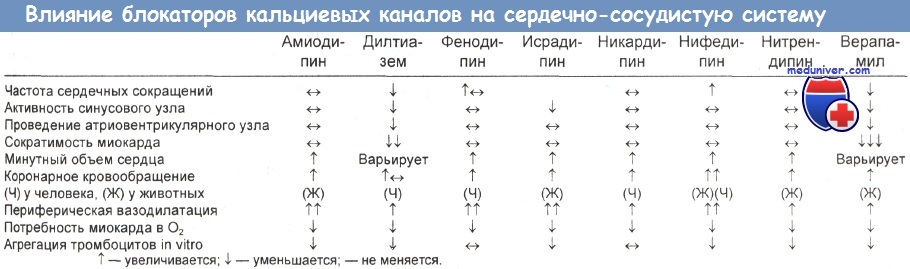
При передозировках блокаторов кальциевых каналов часто наблюдаются брадикардия (депрессия синусового узла, депрессия предсердно-желудочкового узла, аритмии). Острые передозировки дилтиазема и нифедипина отмечаются редко.
а) Структура и классификация. Блокаторы кальциевых каналов, выпускаемые в США, включают фенилалкиламины (верапамил), дигидропиридины (нифедипин, никардипин, нимодипин, амлодипин, бепридил, фелодипин, израдипин) и бензотиазепины (дилтиазем).
Флунаризин, двуфтористое производное пиперазина, обладающее способностью блокировать вход кальция, может быть применен для лечения ряда неврологических и цереброваскулярных расстройств, например мигрени, припадков и головокружения, но он может индуцировать паркинсонизм. Циннаризин — это антагонист Н1-рецептора, обладающий свойствами блокатора кальциевых каналов.
б) Токсичная доза. Передозировка дилтиазема (4,8 г) приводит к снижению уровня сывороточного кальция. Одна капсула нифедипина, содержащая 10 мг лекарства, оказалась летальной для 14-месячного ребенка. Токсичность не зависит от концентрации препарата в плазме.
У 50-летнего мужчины, проглотившего 5880 мг дилтиазема с пивом, развилась гипотензия и был короткий период желудочковой асистолии; больной выжил.
- Нифедипин. Нифедипин, проглоченный 14-месячным ребенком в количестве 800 мг (70 мг/кг), вызвал кому, гипотензию, гипергликемию, предсердно-желудочковую блокаду III степени, остановку сердца, припадки и дефекты поля зрения; ребенок медленно выздоровел. Доза 200 мг нифедипина вызвала синусовую тахикардию у ребенка в возрасте 1 года, а у 72-летнего мужчины — гипотензию.
9-летний ребенок проглотил 100 мг нифедипина без токсических симптомов. 25-Летний мужчина проглотил 50 мг нифедипина без каких-либо симптомов. У взрослого человека с хронической почечной недостаточностью 280 мг нифедипина вызвали глубокую гипотензию, но тканевая перфузия оставалась нормальной.
- Верапамил. Доза 960 мг медленно высвобождающегося препарата ве-рапамила вызвала у 66-летнего пациента брадикардию, головокружение и угнетение дыхания. Доза 1,9 г оказалась нетоксичной для 33-летней женщины. Двухлетний ребенок проглотил 240 мг верапамила без каких-либо признаков токсичности.
Исследование, в котором были изучены 18 случаев проглатывания детьми блокаторов кальциевых каналов, показало, что проглатывание одной таблетки нифедипина (10 мг) или верапамила (80 мг или 120 мг) обычно не оказывает значительного действия на детей, но проглатывание верапамила детьми в возрасте до 2 лет приводило к летальному исходу. 73-Летняя женщина проглотила 2,88 г медленно высвобождающегося верапамила и через 24 ч была доставлена в клинику.
Внутривенное введение глюкагона (5 мг, затем 3 мг/ч), по-видимому, оказало благотворное действие при лечении гемодинамической раздражимости.
в) Летальная доза. Дилтиазем в дозах до 12 г вызывал брадикардию, гипотензию, атриовентрикулярную блокаду I, II и III степени, синусовую брадикардию, остановку синусового узла с узловым ускользанием и асистолию. У большинства пациентов в течение 3 дней улучшились признаки и симптомы. В 6 случаях из тридцати девяти передозировки привели к летальному исходу.
Мужчина в возрасте 33 лет проглотил 4,16 г верапамила. У него развилась асистолия, и он умер после проведенного лечения — промывания желудка, применения сиропа ипекакуаны, активированного угля, хлорида кальция, атропина, налоксона, инфузионной терапии, дофамина, чрескожной кардиостимуляции, внутривенного введения калия и эпинефрина.
У 22-летнего пациента, проглотившего 7,2—9,6 г медленно высвобождающегося верапамила, развилось угнетение дыхания, и он умер. Одна капсула нифедипина (10 мг) оказалась смертельной для 14-месячного ребенка.
г) Токсикокинетика. Блокаторы кальциевых каналов хорошо абсорбируются перорально и подвергаются экстенсивному гепатическому метаболизму и клиренсу первого порядка. Они все активно связываются с белками, но различаются по объему распределения. Степень связывания дилтиазема с белками составляет 80—90 %, а объем распределения — приблизительно 5,3 л/кг.
Клиренс дилтиазема после перорального приема протекает в соответствии с кинетикой реакций первого порядка, период полужизни составляет 5—10 ч независимо от принятой дозы. Однако для медленно высвобождающихся препаратов время максимальной абсорбции задерживается и период полужизни может быть более длительным из-за продолжающейся желудочно-кишечной абсорбции.
Токсическое действие медленно высвобождающихся блокаторов кальциевых каналов может быть задержано более чем на 12 ч после приема препарата. Все пациенты с передозировками медленно высвобождающихся блокаторов кальциевых каналов должны быть госпитализированы и находиться под наблюдением, даже если нет явных симптомов.
- Беременность и лактация. Пациентка, родившая близнецов, в период беременности принимала дилтиазем. Младенцы родились на 37-й неделе беременности. Во время беременности, в неона-тальном периоде и в последующие 6 мес не было признаков неблагоприятного действия ни на материнский организм, ни на плод. Менее 5 % терапевтической дозы нифедипина попадает в материнское молоко. Его пиридиновый метаболит также экскретируется в материнское молоко.
Концентрации нифедипина и его метаболита могут достичь максимальных значений, близких к обнаруживаемым в крови матери.
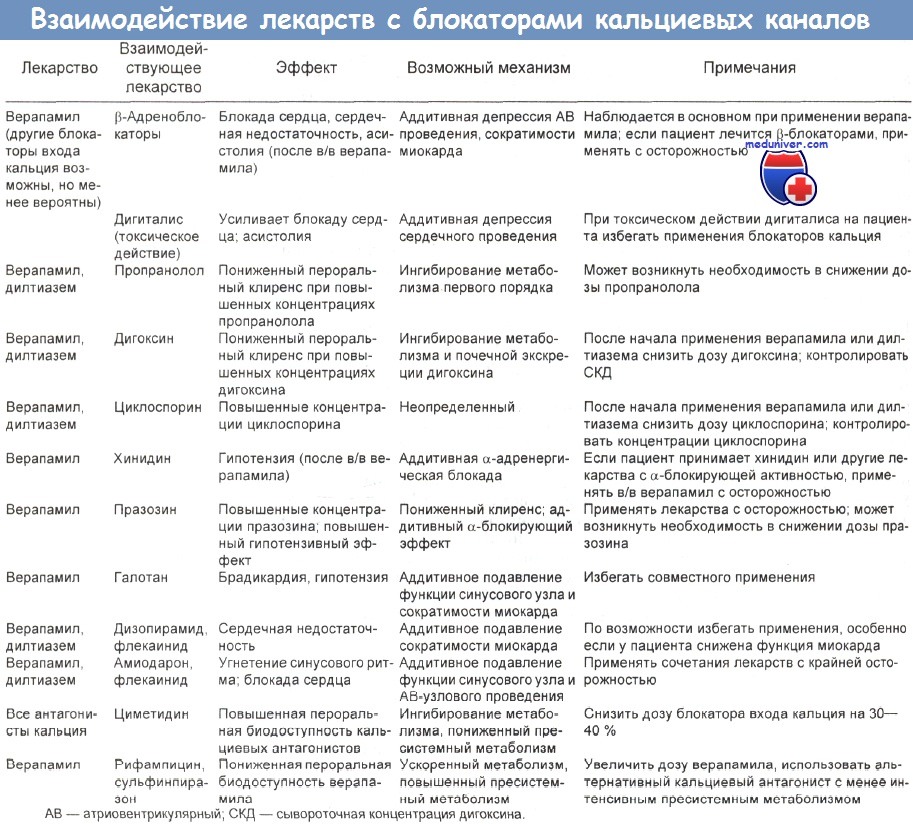
- Взаимодействие лекарственных средств. В таблице ниже приведены данные о взаимодействии лекарственных средств с участием блокаторов кальциевых каналов.
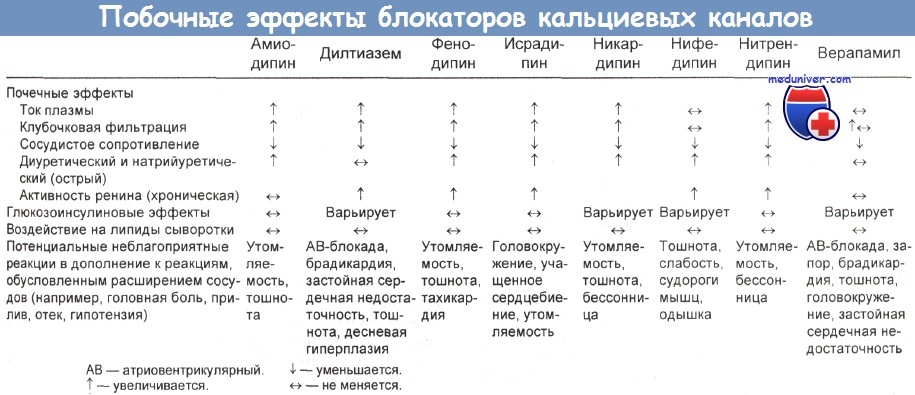
д) Механизм действия. Сердечно-сосудистые и почечные, метаболические и неблагоприятные эффекты блокаторов кальциевых каналов суммированы в таблице ниже. Ионы кальция (Са2+) играют определяющую роль в регулировании клеточного движения и транспорта, электрической активации возбудимых клеток и различных ферментативных реакций. Кальциевые каналы регулируют движение Са2+ из внеклеточного пространства во внутриклеточное.
Существует 3 основных типа кальциевых каналов: рецепторзависимые кальциевые каналы, зависимые от растяжения кальциевые каналы и чувствительные к напряжению (потенциалзависимые) кальциевые каналы. Рецепторзависимые кальциевые каналы стимулируются определенными лигандами, например нейрогормонами. Зависимые от растяжения кальциевые каналы могут стимулироваться при растягивании стенок некоторых сосудов.
Чувствительные к напряжению (потенциалзависимые) кальциевые каналы реагируют на изменения напряжения в клеточных мембранах, например такие, как деполяризация мембраны при открывании натриевых каналов. Потенциалзависимые кальциевые каналы состоят из гомологичных белковых субъединиц, обнаруживаемых также в натриевых и калиевых каналах.
Существует по меньшей мере 3 подтипа потенциалзависимых кальциевых каналов, классифицируемых по их проводимости и чувствительности к напряжению, — подтипы L, N и Т. Блокаторы кальциевых каналов воздействуют только на L-каналы.
Внеклеточная концентрация Са2+ примерно в 5000—10 000 раз выше концентрации внутри клеток, и этот градиент поддерживается обменными насосами Са 2+ /2Н+-АТФаза и 3Na 2+ /Ca 2+ . Открывание кальциевого канала обеспечивает приток Са2+ и повышает концентрацию Са2+ в цитозоле.
Антагонисты кальциевых каналов представляют собой разнородный класс лекарственных средств, которые блокируют движение ионов кальция из внеклеточной среды внутрь клеток через так называемые "медленные каналы". Эти средства очень сильно различаются по своей структуре. Они ингибируют фазу 0 деполяризации в пейсмекерных клетках сердца и фазу 2 плато в миоцитах, клетках Пуркинье и клетках гладких мышц стенок сосудов. Действуя таким образом, они вызывают расширение сосудов и обусловливают подавление сократимости миокарда, синусового и предсердно-желудочкового узлового проведения.
Лекарственные средства, входящие в класс блокаторов кальциевых каналов, различаются по своему фармакологическому действию. Нифедипин оказывает более сильное сосудорасширяющее действие, чем другие препараты, расслабляя гладкую мускулатуру периферических сосудов. Верапамил оказывает более сильное воздействие на коронарное кровообращение, снижая проводимость атриовентрикулярного узла и сократимость миокарда.
Дилтиазем влияет как на коронарное, так и на периферическое кровообращение, хотя воздействие на коронарные сосуды преобладает, т. е. в спектре препаратов этого типа он располагается ближе к верапамилу. Дилтиазем и верапамил оказывают отрицательное инотропное действие.

е) Клиническая картина. Факторы, предрасполагающие к токсическому действию блокаторов кальциевых каналов, перечислены в таблице ниже.
- Синдром отмены. Отмена препаратов, блокирующих кальциевые каналы, у пациентов с тяжелой гипертензией, даже в отсутствие в анамнезе стенокардии или инфаркта миокарда, может спровоцировать инфаркт миокарда. После отмены лекарств, блокирующих кальциевые каналы, у пациентов с нормальной коронарной ангиографией, лечившихся по поводу ишемической боли в груди, обострились стенокардия и инфаркт миокарда. Конкретный механизм интоксикации не установлен.
Препараты верапамила пролонгированного действия способны индуцировать образование конкремента из-за желатинового покрытия пилюль. Гипотензия и брадиаритмии могут развиться даже через 18 ч после приема препарата, несмотря на промывание желудка и применение активированного угля.
Интоксикация медленно высвобождающимся верапамилом может вызвать атриовентрикулярную блокаду, брадикардию, приводящую к асистолии или гипертензии, остановку сердца в систоле или функциональный ритм с предсердно-желудочковой диссоциацией даже через 26 ч после первых очищающих и поддерживающих процедур, призванных стабилизировать состояние пациента. Тяжелая гипотензия может привести к инфаркту головного мозга после передозировки верапамила.
- Медленно высвобождающийся верапамил. Проявления передозировок верапамила быстрого и пролонгированного действия сходны. При передозировках верапамила пролонгированного действия часто отмечается замедленное и более длительное проявление токсических признаков и симптомов.
При передозировках, в 5—10 раз превышающих терапевтическую дозу, клинические проявления обычно обнаруживаются через 30—60 мин после приема препарата. Признаки токсического действия на центральную нервную систему включают сонливость, спутанность сознания и в редких случаях припадки. Кома обычно вторична относительно острой сердечно-сосудистой недостаточности. Признаки желудочно-кишечной интоксикации могут включать тошноту и рвоту.
К числу метаболических токсических эффектов относятся гипергликемия, являющаяся следствием пониженного образования инсулина, и метаболический ацидоз, являющийся вторичным относительно молочнокислого ацидоза, развивающегося вследствие слабой тканевой перфузии. Гипотензия — это наиболее распространенный показатель токсического воздействия на сердечнососудистую систему. Она вызывается главным образом расширением сосудов и пониженной сократимостью миокарда.
ж) Лабораторные данные. Стандартные методы анализа лекарственных средств непригодны для обнаружения блокаторов кальциевых каналов.
- Аналитические методы. Для определения концентраций верапамила, норверапамила и его дезалкилированных производных в плазме целесообразно применять метод ВЭЖХ с обращенной фазой. Порог обнаружения для всех соединений ниже 5 нг/мл.
Для количественного анализа дилтиазема и его метаболитов применим метод газовой хроматографии. Методами ВЭЖХ установлено, что дилтиазем устойчив по меньшей мере в течение 6 нед при температурах ниже 25 °F (-3,89 °С).
- Уровни в крови:
Верапамил. Данные об уровнях верапамила подтверждают факт интоксикации, но не могут помочь при неотложной терапии.
Дилтиазем. Терапевтический диапазон концентраций дилтиазема в крови примерно от 100 до 200 мкг/л. Анализ литературных данных показывает, что при концентрациях дилтиазема в крови до 500 мкг/л у асимптоматических пациентов могут наблюдаться блокада сердца I степени и синусовая брадикардия. При концентрациях от 500 до 1000 мкг/л наблюдается гипотензия. При концентрациях от 1000 до 1500 мкг/л отмечались аномалии проводимости и гипотензия.
При концентрациях выше 1500 мкг/л возникает необходимость использования временных водителей ритма. При концентрациях выше 6100 мкг/л большая часть пациентов умирают.
Нифедипин. Примерно через 2 ч после приема 250 мг нифедипина с этиловым спиртом концентрация нифедипина в крови 34-летнего пациента составила 181 нг/мл (терапевтический уровень 25—100 нг/мл). Через 2 ч концентрация снизилась до 70 нг/мл. Пациент выздоровел. Через 10 ч после приема сверхвысокой дозы нифедипина таблеток пролонгированного действия (600 мг) концентрация нифедипина в крови возросла до 604 нг/мл, уровень основного метаболита составлял 100 нг/мл.
- Гипергликемия. Гипергликемия и метаболический ацидоз могут развиться при очень больших передозировках верапамила. Гипергликемия развивается также после передозировок нифедипина. При сильных передозировках необходимо контролировать концентрации Са2+, Mg2+, К+ и Na+.
- Сывороточный кальций. После передозировок обычно выявляются аномальные концентрации кальция в сыворотке. После того как 24-летний пациент проглотил 4 г верапамила, концентрация Са2+ в сыворотке составляла 1,5 ммоль/л (6,1 мг/100 мл). Электрокардиограмма показала предсердно-желудочковую блокаду III степени. После внутривенного вливания 10 мл 10 % глюконата кальция сердечный ритм преобразовался в предсердно-желудочковую блокаду II степени.
Кальций может улучшить проведение, но обычно он мало влияет на гипотензию. В случае тяжелой гипокальциемии благоприятное действие может оказать применение высоких доз кальция, однако, хотя введение солей кальция часто бывает очень полезным в качестве одного из первоочередных мероприятий при лечении передозировок верапамила, в случаях, не поддающихся лечению, следует предусмотреть возможность использования инотропных препаратов или электрокардиостимуляции.
- Электрокардиограмма. Электрокардиографические аномалии после передозировок верапамила включают пролонгированное проведение (удлиненные интервалы QRS, P—R, Q—T), различные степени предсердно-желудочковой блокады и ассистолию.
Видео фармакологические, побочные эффекты блокаторов кальциевых каналов
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Брадикардия – вид аритмии, с частотой сердечных сокращений менее 60 ударов в минуту. Встречается как вариант нормы у тренированных спортсменов, но чаще сопровождает различную сердечную патологию. Проявляется слабостью, полуобморочными состояниями и кратковременной потерей сознания, холодным потом, болями в области сердца, головокружением, нестабильностью АД. При выраженной брадикардии (чсс менее 40 ударов в минуту), ведущей к развитию сердечной недостаточности, может потребоваться операция по имплантации электрокардиостимулятора.
Общие сведения
Брадикардия – вид аритмии, с частотой сердечных сокращений менее 60 ударов в минуту. Встречается как вариант нормы у тренированных спортсменов, но чаще сопровождает различную сердечную патологию. Проявляется слабостью, полуобморочными состояниями и кратковременной потерей сознания, холодным потом, болями в области сердца, головокружением, нестабильностью АД. При выраженной брадикардии (чсс менее 40 ударов в минуту), ведущей к развитию сердечной недостаточности, может потребоваться операция по имплантации электрокардиостимулятора.
Независимо от причины, в основе брадикардии лежит нарушение способности синусового узла вырабатывать электрические импульсы с частотой выше 60 в минуту либо неадекватное их распространение по проводящим путям. Умеренная степень брадикардии может не вызывать расстройства гемодинамики. Редкий сердечный ритм при брадикардии приводит к недостатку кровоснабжения и кислородному голоданию органов и тканей, нарушая их полноценное функционирование.
У физически тренированных людей встречается физиологическая брадикардия, рассматриваемая как вариант нормы: у четверти молодых здоровых мужчин ЧСС составляет 50-60 в минуту; во время сна под влиянием физиологических колебаний вегетативной регуляции происходит урежение сердечного ритма на 30%. Однако, чаще брадикардия развивается на фоне уже имеющихся патологических процессов.

Классификация брадикардии
По локализации выявленных нарушений различают брадикардию синусовую, связанную с нарушениями автоматизма в синусовом узле, и брадикардию при блокадах сердца (синоатриальной или атриовентрикулярной), при которых нарушается проведение импульсов между синусовым узлом и предсердиями или предсердиями и желудочками. Частота сердечных сокращений может уменьшаться при физиологических условиях (у спортсменов, во сне, в покое) – это функциональная или физиологическая брадикардия; патологическая брадикардия сопровождает течение различных заболеваний.
Патологическая брадикардия может протекать в острой форме (при инфаркте миокарда, миокардитах, интоксикациях и т. д.) и исчезать после излечения вызвавшего ее заболевания, или хронической форме (при возрастных склеротических заболеваниях сердца). По причинам развития синусовой брадикардии выделяют следующие формы: экстракардиальную (нейрогенную), органическую (при поражениях сердца), лекарственную, токсическую и синусовую брадикардию спортсменов. Иногда по этиологии брадикардию подразделяют на токсическую, центральную, дегенеративную и идиопатическую.
Причины брадикардии
Экстракардиальная форма брадикардии может развиваться при нейроциркуляторной дистонии, неврозах с вегетативной дисфункцией, давлении на каротидный синус (при ношении тугого воротника или галстука), надавливании на глазные яблоки (рефлекс Ашнера), повышенном внутричерепном давлении (при менингите, ушибе мозга, субарахноидальном кровоизлиянии, отеке или опухоли мозга), язвенной болезни желудка и 12-перстной кишки. Брадикардия, развивающаяся при микседеме, пропорциональна выраженности гипотиреоза.
Причинами органической формы брадикардии могут являться инфаркт миокарда, миокардиодистрофии, миокардит, кардиосклероз. Эти заболевания приводят к дегенеративным и фиброзным изменениям в синусовом узле или нарушениям проводимости в миокарде, сопровождаясь развитием брадикардии.
При органическом поражении водителя ритма развивается синдром слабости синусового узла, и частота генерации импульсов в нем резко снижается. Это состояние сопровождается синусовой брадикардией - ритмичными, но очень редкими сокращениями сердца; сменой бради- и тахикардии или чередованием спонтанных водителей ритма. Крайняя степень поражения синусового узла проявляется отказом функции автоматизма, в результате чего им перестают вырабатываться электрические импульсы сердца.
При поражении проводящих путей миокарда развивается блокада проведения импульсов, в результате чего часть сигналов, генерируемых синусовым узлом, блокируется и не может достичь желудочков - развивается брадикардия. Развитию лекарственной формы брадикардии может способствовать прием сердечных гликозидов, хинидина, β-адреноблокаторов, симпатолитических препаратов (например, резерпина), блокаторов кальциевых каналов (например, верапамила, нифедипина), морфина.
Токсическая форма брадикардии развивается при выраженных интоксикациях, вызванных сепсисом, гепатитом, уремией, брюшным тифом, отравлением фосфорорганическими соединениями, и замедляющих процессы автоматизма и проведения в сердечной мышце. К этой группе иногда также относят брадикардию, вызванную гиперкальциемией или выраженной гиперкалиемией.
Так называемая, брадикардия спортсменов, характеризуется ЧСС до 35-40 в минуту даже в дневное время. Ее причиной служат особенности вегетативной регуляции сердечного ритма у людей, профессионально занимающихся спортом. Также к брадикардии могут приводить естественные процессы старения в организме; иногда причины брадикардии так и остаются невыясненными - в этих случаях говорят о ее идиопатической форме.
Симптомы брадикардии
Умеренно выраженная брадикардия обычно не сопровождается нарушениями кровообращения и не ведет к развитию клинической симптоматики. Возникновение головокружения, слабости, полуобморочных и обморочных состояний наблюдается при брадикардии с ЧСС менее 40 ударов в минуту, а также на фоне органических поражений сердца. Также при брадикардии появляются усталость, затрудненное дыхание, боли в груди, колебания АД, нарушение концентрации внимания и памяти, кратковременные расстройства зрения, эпизоды спутанного мышления.
В целом проявления брадикардии соответствуют тяжести нарушений гемодинамики, развивающихся на ее фоне.
На ослабление сократительной функции миокарда и замедление кровообращения первым реагирует головной мозг, испытывая гипоксию. Поэтому брадикардия нередко приводит к приступам потери сознания, судорог (приступы или продромы Морганьи-Адемса-Стокса), которые могут продолжаться от нескольких секунд до 1 минуты. Это самое опасное состояние при брадикардии, требующее оказания неотложных медицинских мероприятий, т. к. при затянувшемся приступе может наступить остановка дыхательной деятельности.
Диагностика брадикардии
Характерные для брадикардии признаки выявляются при сборе жалоб пациента и объективном обследовании. При осмотре определяется редкий пульс, который при синусовой брадикардии имеет правильный ритм, выслушиваются сердечные тоны обычной звучности, нередко обнаруживается дыхательная аритмия. Пациентам с выявленной брадикардией рекомендована консультация кардиолога.
Электрокардиографическое исследование при брадикардии позволяет зафиксировать редкую ЧСС, наличие синоатриальной или атриовентриуклярной блокады. Если в момент регистрации ЭКГ эпизоды брадикардии не выявляются, прибегают к проведению суточного мониторирования ЭКГ.
При органической форме брадикардии проводят УЗИ сердца. Методом ультразвуковой ЭхоКГ определяется снижение фракции выброса менее 45%, увеличение размеров сердца, склеротические и дегенератвные изменения миокарда. С помощью проведения нагрузочной велоэргометрии оценивается прирост ЧСС в связи с заданной физической нагрузкой.
При невозможности выявления преходящих блокад методами ЭКГ и холтеровского мониторирования, проводится чреспищеводное электрофизиологическое исследование проводящих путей сердца. С помощью проведения ЧПЭФИ можно определить органический или функциональный характер брадикардии.
Лечение брадикардии
Функциональная и умеренная брадикардия, не сопровождающаяся клиническими проявлениями, не требуют терапии. При органической, экстракардиальной, токсической формах брадикардии проводится лечение основного заболевания. При лекарственной брадикардии требуется коррекция дозировки или отмена препаратов, замедляющих сердечный ритм.
При проявлениях гемодинамических нарушений (слабости, головокружениях) проводится назначение препаратов красавки, корня женьшеня, экстракта элеутерококка, изопреналина, эфедрина, кофеина и других в индивидуально подобранных дозах. Показаниями к активному лечению брадикардии служат развитие стенокардии, артериальной гипотонии, обмороков, сердечной недостаточности, желудочковой аритмии.
Возникновение приступа Морганьи—Адамса—Стокса требует консультации кардиохирурга и решения вопроса об имплантации электрокардиостимулятора – искусственного водителя ритма, вырабатывающего электрические импульсы с физиологической частотой. Адекватный и постоянный заданный сердечный ритм способствует восстановлению нормальной гемодинамики.
Прогноз и профилактика брадикардии
Неблагоприятно влияет на прогноз течения брадикардии наличие органических поражений сердца. Значительно отягощает возможные последствия брадикардии возникновение приступов Морганьи—Адамса—Стокса без решения вопроса о проведении электростимуляции. Сочетание брадикардии с гетеротопными тахиаритмиями повышает вероятность тромбоэмболических осложнений. На фоне стойкого снижения ритма возможно развитие инвалидизации пациента. При физиологической форме брадикардии или ее умеренном характере прогноз удовлетворительный.
Своевременное устранение экстракардиальных причин, органических поражений сердца, токсических воздействий на миокард, правильный подбор дозировок лекарственных средств позволят предотвратить развитие брадикардии.
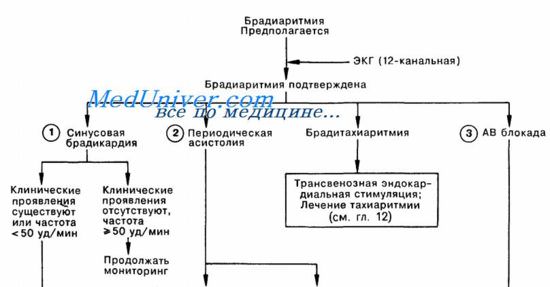
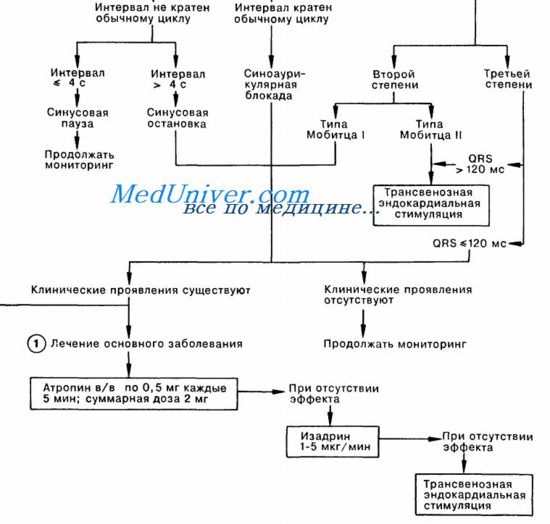
Неотложная помощь при брадикардии и блокаде сердца у пациента с отравлением
Брадикардия без гипотензии у больных с оттравлением тебует внимательного наблюдения. Тяжелую брадикардию с гипотензией обычно купируют внутривенным введением сульфата атропина.
Доза для взрослых составляет 0,5—1 мг, а для детей - 0,01—0,03 мг/кг при максимальном суммарном количестве 1 мг и минимальном 0,1 мг. По показаниям можно повторить введение до четырех раз.
Блокада сердца при отравлении. Под этим состоянием понимается не только сердечная блокада третьей степени, или предсердно-желудочковая диссоциация, но и блокада второй степени. Бессимптомным больным с таким нарушением необходим наружный кардиостимулятор и постоянное наблюдение.
При брадикардии с гипотензией или усилении сердечной блокады может потребоваться временное лечение атропином. Окончательное лечение подразумевает устранение причины этого состояния. Если оно стойкое, необходимо трансвенозное введение кардиостимулирующего зондаэлектрода.
При полной или усиливающейся блокаде сердца пациента необходимо поместить на кушетку с аппаратурой для всестороннего мониторинга.
Схема неотложной помощи при брадикардии и блокаде сердца у пациента

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Вернуться в оглавление раздела "Токсикология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Отравление дигоксином (дигиталисом) и его побочные эффекты
Дигоксин — несомненно, наиболее широко применяемый препарат наперстянки в США. Дигитоксин более популярен в странах Латинской Америки, Европы и в Канаде. Его токсичность значительно варьирует из-за неполярной структуры и обусловленных этим токсико-кинетических свойств. К редко применяемым препаратам наперстянки относятся листья наперстянки, уабаин, ланатозид С, десланозид и гиталин. Следующие растения содержат сердечные гликозиды: олеандр обыкновенный (Nerium oleander), наперстянка пурпурная (Digitalis purpurea), ландыш майский (Convallaria majalis), желтый олеандр (Thevetia peruviana) и ургинея приморская (Urginea maritima).
Дигоксин выпускается в виде таблеток по 0,125; 0,25 и 0,5 мг, а также в виде эликсира — 0,05 мг/мл.
а) Токсичная доза. Если ребенок с массой тела 10 кг проглотит дигоксин в количестве 0,05 мг/кг (например, одну таблетку 0,5 мг), следует ожидать, что концентрация дигоксина у него в крови превысит верхний терапевтический предел на 2 нг/мл. Хотя дети переносят передозировки дигоксина лучше, чем взрослые, возможность серьезных последствий означает, что при любом потенциальном или предположительном проглатывании препарата в дозе, превышающей указанный предел, следует проводить деконта-минацию кишечника и вести наблюдение в отделении неотложной помощи.
Любой суицидальный прием препарата пациентом, регулярно принимающим дигоксин, следует рассматривать как серьезную передозировку. У таких пациентов трудно прогнозировать токсические эффекты из-за разнообразия факторов, предрасполагающих к отравлению наперстянкой.
б) Токсикокинетика. Существуют значительные различия между кинетикой дигоксина и дигитоксина.
- Всасывание. Дигоксин. Биодоступность зависит от степени растворения таблеток; этот фактор в настоящее время более стандартизован и варьирует в пределах от 50 до 80 %. В число индивидуальных факторов, обусловливающих снижение абсорбции, входят одновременный прием пищи, синдромы мальабсорбции, антациды и пониженная желудочно-кишечная моторика.
Дигитоксин. После перорального приема отмечается превосходная абсорбция. Латентный период после пероральных доз составляет 1—2 ч, максимальное воздействие наблюдается в период между 4 и 12 ч.
- Распределение:
Дигоксин. Для дигоксина характерен большой кажущийся объем распределения (у взрослых 7—8 л/кг; у новорожденных — 10 л/кг; у грудных детей — 16 л/кг). Объем распределения снижается при заболеваниях почек, гипотиреозе, при терапии хинидином, а также у пожилых людей (в связи со снижением мышечной массы). Первоначальный объем распределения невелик, что может привести к чрезмерно высоким концентрациям непосредственно после приема. Большая часть дигоксина распределяется в скелетных мышцах (приблизительно 65 % абсорбированной дозы). Соотношение миокард: плазма составляет примерно 30:1.
Дигитоксин. Для дигитоксина характерны высокая степень связывания с белками и относительно небольшой кажущийся объем распределения.
- Выведение:
Дигоксин. Через почки выделяется 60—80 % дигоксина в неизмененном виде. Терминальный период полужизни составляет в среднем около 36 ч. Экскреция желчи и энтерогепатическая циркуляция не имеют существенного значения при терапевтических дозах. Проводившиеся исследования показывают, что желчевыделение варьирует в зависимости от заболеваний печени и метода отбора проб. В зависимости от метода отбора проб экскреция желчи составляет от 8 до 30 % через 24 ч после перорального приема терапевтической дозы.
Дигитоксин. Печень метаболизирует дигитоксин, удаляя сахар (дигитоксозу) с образованием эпидигитоксигенина, который соединяется с неактивным метаболитом. Дигоксин — побочный продукт метаболизма дигитоксина (около 8 %). Энтерогепатическая циркуляция, вероятно, обусловливает длительный период полувыведения (около 100 ч). Верапамил и дилтиазем (но не нифедипин) снижают непочечный клиренс в среднем на 29 и 21 % соответственно.
- Беременность. После того как женщина на восьмом месяце беременности проглотила 8,9 мг дигитоксина, наблюдались клинические признаки интоксикации организма матери и плода наперстянкой. Новорожденный младенец умер через 3 дня после родов.

в) Взаимодействие лекарственных средств. В таблице ниже представлены типы взаимодействий, влияющих на токсикокинетику сердечных гликозидов наперстянки.
- Эритромицин. Эритромицин подавляет развитие Eubacterium lentum, под воздействием которых в кишечнике дигоксин превращается в продукты его восстановления. Это может привести к повышению концентраций дигоксина в сыворотке.
- Эритромицин + тетрациклин. У некоторых пациентов эритромицин и тетрациклин могут вызвать удвоение концентрации дигоксина, вероятно, вследствие уничтожения флоры кишечника, которая в норме снижает концентрацию дигоксина и уменьшает его абсорбцию.
г) Механизм действия. На рисунке ниже схематически изображено теоретически предполагаемое прямое воздействие наперстянки на сердце. Гипомагниемия, возможно, чаще, чем гипокалиемия, усиливает токсическое воздействие дигоксина.

д) Клиническая картина отравления дигоксином. Факторы, предрасполагающие к интоксикации наперстянкой, приведены в таблице ниже. Смертность выше у пациентов, имеющих 5 прогностических признаков: пожилой возраст, заболевание сердца, принадлежность к мужскому полу, предсердно-желудочковая блокада высокой степени и гиперкалиемия. Различия между острым и хроническим отравлением дигоксином представлены в таблице ниже.
- Регулярное применение. Хроническое токсическое действие наперстянки часто не сильное, и его бывает трудно диагностировать, поскольку побочные эффекты похожи на симптомы основного заболевания.
- Влияние на сердечно-сосудистую систему. Отравление наперстянкой может вызвать аритмию любого типа. Классический ритм при интоксикации дигоксином — это сочетание подавляющего и возбуждающего эффектов (например, непароксизмальная предсердная тахикардия с блокадой 2:1). Преждевременная желудочковая экстрасистолия — наиболее распространенное нарушение ритма при интоксикации наперстянкой, тогда как преждевременная предсердная и узловая экстрасистолы наблюдаются реже. Эти экстрасистолы бывают многофокусными или бигеминальными.
Наиболее распространенные устойчивые ритмы — узловые выскальзывающие ритмы, затем по степени распространенности следует эктопическая предсердная тахикардия с некоторой степенью предсердно-желудочковой блокады. Регуляризация ритма на фоне фибрилляции желудочков и приема дигоксина означает развитие узлового ритма в связи с интоксикацией наперстянкой. Дальнейшая интоксикация обусловливает повышенный неправильный ритм (усиленный автоматизм), узловую тахикардию и блокаду выхода Венкебаха.
При отравлениях наперстянкой могут наблюдаться все степени предсердно-желудочковой блокады и может потребоваться временная кардиостимуляция. Нарушениям ритма часто сопутствует гипокалиемия. Желудочковая тахикардия и фибрилляция желудочков относятся к числу наиболее тяжелых аритмий, индуцированных наперстянкой.
- Неспецифические эффекты и влияние на пищеварительный тракт. В число распространенных неспецифических и желудочно-кишечных симптомов интоксикации препаратами наперстянки входят недомогание, усталость, слабость, анорексия, тошнота, рвота и головная боль.
- Влияние на зрение. Наблюдаются следующие нарушения зрения: скотома, неясность зрения, фотофобия с цветовой аберрацией и транзиторная слепота.
- Влияние на психосенсорные механизмы. Регулярно отмечаются спутанность сознания, галлюцинации и делирий, но судороги наблюдаются редко.
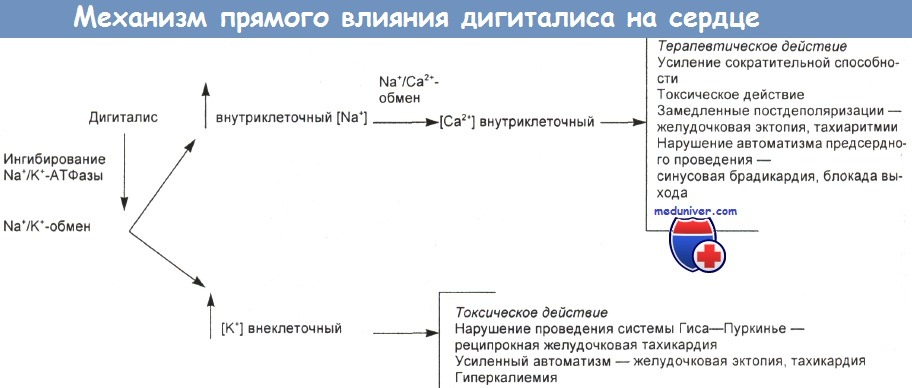
Теоретически допускаемый механизм прямого воздействия дигиталиса на сердце
Клиническая картина. Тошнота и рвота — наиболее типичные желудочно-кишечные проявления отравления наперстянкой. Могут отмечаться изменения психического состояния. Типичны признаки воздействия на сердечно-сосудистую систему, их проявление может задержаться на период до 6 ч. У детей отмечаются брадикардия и замедление проведения, но эндогенные водители ритма обычно обеспечивают адекватное распространение импульса и предотвращают гемодинамические нарушения. В число распространенных нарушений ритма входят брадикардия (21—75 %), блокада сердца (23—56 %) и тахиаритмии (30—42 %). У детей желудочковые аритмии наблюдаются реже.
- Смертные случаи. Летальный исход при массивных передозировках у взрослых является следствием обострения терапевтических эффектов:
• недостаточность нагнетательной функции сердца, обусловленная отрицательным инотропным эффектом (10 % смертных случаев);
• нарушение проведения с тяжелой предсердно-желудочковой блокадой (20 % смертных случаев);
• желудочковые аритмии из-за увеличенного автоматизма (70 % смертных случаев).

ж) Лабораторные данные отравления дигоксином:
- Аналитические методы. Концентрации свободного дигоксина наиболее точно измеряются в присутствии Fab-фрагмента (антигенсвязывающего домена) в многократных дозах с использованием ультрафильтрации с флюоресцентным поляризационным иммуноанализом. Радиоиммуноанализ не следует применять для измерения сывороточных концентраций свободного или суммарного дигоксина, так как при наличии в Fab незанятых участков связывания этот метод дает ложные результаты.
- Уровни дигоксина в сыворотке. Уменьшение количества ионов К+ в красных кровяных тельцах под воздействием сердечных гликозидов может быть с успехом использовано в качестве маркера воздействия наперстянки на Na+-, К+-АТФазу. Исчезновение ионов К+ из красных кровяных телец позволяет прогнозировать тяжесть отравления наперстянкой; оно, по-видимому, отражает исчезновение ионов К+ из миокардиоцитов, которое может происходить параллельно с тахиаритмией и нарушениями проведения. Клиническую пригодность этого маркера необходимо подтвердить дополнительными исследованиями.
- Уровни дигитоксина в сыворотке. Взрослого пациента, проглотившего 35 мг дигитоксина, лечили Fab-фрагментами антител (Digitalis antidote ВМ, 80 мг). Всего было введено 11 доз по 80 мг фрагментов Fab. Свободную фракцию сывороточного дигитоксина определяли с помощью иммунофлюоресцентного анализа Baxter-Status с усиленным разделением ферментов, а определение суммарного дигитоксина осуществлялось с помощью флюоресцентного поляризационного иммуноанализа. Пациент выздоровел.
Через 8 ч после приема молодым пациентом 250 мг дигитоксина уровень сывороточного дигитоксина поднялся до 360 ммоль/л. Пациенту ввели в 3 приема (всего 1440 мг) дигоксинспецифические Fab-фрагменты (Digitalis antidote ВМ, 480 мг). Синусовый ритм стабилизировался, и симптомы у пациента исчезли.
Показано, что дигитоксинспецифические Fab-фрагменты моноклональных антител могут быть использованы в случаях индуцированного отравления животных дигитоксином.
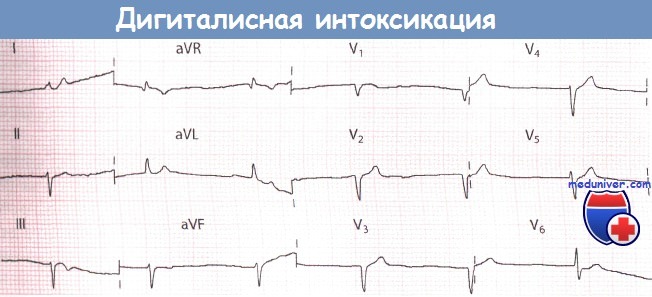
Ритм из АВ-соединения у пациента, получавшего дигоксин по поводу фибрилляции предсердий (ФП).
Содержание дигоксина в плазме крови 5,9 нмоль/л.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

