Бронхит при герпетической инфекции
Обновлено: 24.04.2024
В статье представлены данные о значимости инфекции при формировании бронхообструктивного синдрома у детей. Особое внимание уделено рецидивирующим эпизодам обструктивного бронхита. Представленный клинический пример подтверждает оптимальную тактику ведения
Management strategy for recurrent broncho-obstructive syndrome in children T. A. Ruzhentsova, N. A. Meshkova, E. K. Shushakova
The article presents the data on infection significance in broncho-obstructive syndrome formation in children. Special attention is paid to the recurrent episodes of obstructive bronchitis. The introduced clinical case proves the optimum management strategy using, mainly, etiotropic therapy. It was shown, that, in revealing the virus of herpes 6th type, inosine pranobex is effective.
Согласно данным Российского респираторного общества, 25% детей переносит бронхообструктивный синдром в возрасте до 6 лет, причем более чем у половины из них этот симптомокомплекс рецидивирует [1].
Бронхиальной обструкции способствуют прежде всего анатомо-физиологические особенности раннего возраста: гиперплазия желез, выделение вязкой мокроты, малый диаметр просвета дыхательных путей, возрастная физиологическая недостаточность местного иммунитета. Стоит отметить, что любое неблагоприятное воздействие на дыхательные пути ребенка: инфекции, загрязненный или холодный воздух, приводит к повышению вязкости и количества секрета, что влечет за собой застой слизи и нарушение проходимости бронхиального дерева [2]. Бронхообструктивный синдром может быть вызван спазмом на уровне мелких бронхов аллергического происхождения (у детей раннего детства проявляется нетипично в силу слабого развития гладких миоцитов бронхов), аспирацией инородного тела, врожденными аномалиями и патологиями дыхательных путей [3]. Из всех перечисленных факторов в настоящее время в формировании бронхиальной обструкции особо значимую роль играют инфекционно-воспалительные очаги. Значение имеют как бактерии, так и вирусы: респираторно-синцитиальный вирус, парагрипп, вирусы группы герпеса. Нередко у детей отмечается вторичный иммунодефицит, способствующий длительной персистенции возбудителей, пролонгированному течению острых респираторных инфекций с быстрым присоединением осложнений, в том числе и обструктивного бронхита. В таких случаях часто в течение года регистрируются многократные эпизоды ОРВИ с практически непрерывно протекающим бронхообструктивным синдромом.
Частота проявления бронхиальной обструкции на фоне вирусных инфекций у детей достигает 50%. В 30–50% таких случаев сложно провести дифференциальную диагностику с бронхиальной астмой [3].
В настоящее время появляются новые подтверждения значимости вирусов группы герпеса, инфицированность которыми очень высока. От 0,5% до 2,5% новорожденных являются носителями цитомегаловируса (ЦМВ). В первый год жизни вероятно приобретение данной инфекции от окружающих. Частота выявления ЦМВ у детей старше года достигает 60% [4]. Заражение может произойти воздушным, контактно-бытовым и оральным путями, в том числе через грудное молоко матери. ЦМВ выявляется в грудном молоке у 30% инфицированных женщин [4]. В работе В. К. Котлукова и соавт. отмечена непосредственная связь цитомегаловирусной инфекции (ЦМВ-инфекции) у детей раннего возраста с частой заболеваемостью респираторной патологией и рецидивирующим бронхообструктивным синдромом [5]. Первичное инфицирование ЦМВ влечет за собой иммуносупрессорный эффект, влекущий за собой развитие новых инфекций [6, 7]. Также известно, что как первичное инфицирование, так и латентная персистенция в организме инициируют развитие хронического воспаления I типа [8]. Объясняется это появлением Т-лимфоцитов, лишенных антигена CD-28.
В целом клинические проявления ЦМВ-инфекции очень неспецифичны и разнообразны, что затрудняет раннюю своевременную диагностику этого заболевания [9].
К той же группе относится и вирус герпеса 6-го типа (ВГЧ 6-го типа). Он может становиться причиной различных симптомов, помимо хорошо известной внезапной экзантемы. В РФ, по данным проведенных исследований, антителами к ВГЧ 6-го типа обладают 72–95% детей в возрасте до 3 лет [10]. В исследовании, проведенном на базе ФГБУ НИИ вирусологии им. Д. И. Ивановского, бронхообструктивный синдром на фоне ОРВИ с выявленисм маркеров активности ВГЧ 6-го типа был зафиксирован у 31 из 95 детей (33%). Большие концентрации ДНК вируса в слюне детей до 3 лет подтверждают тот факт, что слюнные железы играют роль резервуара для вируса [11, 12]. При исследованиях роли герпесов были получены результаты, говорящие о том, что у детей с рецидивирующими респираторными заболеваниями необходимо проводить диагностику для уточнения типа и варианта течения герпетической инфекции [13].
В другой работе было показано, что частые рецидивы респираторных заболеваний у детей в 87% случаев обусловлены тем или другим типом герпесвирусов: Эпштейна–Барр, ЦМВ или ВГЧ 6-го типа, в 44% случаев при этом присоединяется бактериальная флора [14].
Стандартная терапия бронхообструктивного синдрома включает применение бронхолитиков и кортикостероидов. Однако, эффективно снимая симптомы обструкции, эти препараты не подавляют вирусный процесс. В отсутствие эффективной противовирусной терапии сохраняющийся этиологический фактор способствует повторению эпизодов обструкции, может приводить к непрерывно рецидивирующему течению с формированием типичной картины бронхиальной астмы. В то же время правильно подобранная этиотропная терапия способна снизить частоту рецидивов бронхообструкции вплоть до полного прекращения. Как правило, вместе с этим существенно снижается общая частота острых респираторных инфекций. Эффективность противовирусной терапии для профилактики повторных эпизодов бронхообструкции показывает следующий клинический пример.
Мальчик Ж., 4 лет, впервые консультирован врачами ФБУН ЦНИИЭ Роспотребнадзора 8 апреля 2015 г. Со слов мамы, беспокоит сильный приступообразный, преимущественно сухой кашель, в том числе и в ночное время, умеренная потливость.
Из анамнеза жизни: родился доношенным, получал грудное вскармливание до 5 месяцев, до 2 лет на учете у специалистов не состоял, перенес 1 эпизод ОРВИ, развитие — по возрасту, вакцинирован согласно календарю. Аллергических реакций отмечено не было. Сопутствующей патологии нет.
Объективно: состояние среднетяжелое. Температура тела 37 °C. Кожные покровы бледные, периорбитальный цианоз. Частота дыхательных движений 30 в минуту. Дыхание через нос, выдох удлинен, слышен на расстоянии. Лимфатические узлы увеличены в переднешейной группе до 2,5 см в диаметре, плотные, безболезненные. Зев обычной окраски. Миндалины увеличены до 2-й степени, рыхлые, налетов нет. Аускультативно дыхание жесткое, рассеянные сухие свистящие хрипы над всеми отделами легких. Тоны сердца звучны, ритмичны, 102 удара в минуту. Живот мягкий. Стул и мочеиспускание в норме. Очаговой неврологической и менингеальной симптоматики нет.
По результатам дополнительного обследования: на рентгенограмме органов грудной клетке очаговых и инфильтративных теней нет. В анализе крови клиническом: гемоглобин — 128 г/л, лейкоциты — 5,6 × 10 9 , нейтрофилы сегментоядерные — 19%, эозинофилы — 3%, моноциты — 9%, лимфоциты — 69%, СОЭ — 7 мм/ч. По анализу мазка из зева методом полимеразно-цепной реакции обнаружен ВГЧ 6-го типа в количестве 7 × 10 6 копий/мл, другие показатели: ЦМВ, вирус Эпштейна–Барр — отрицательно. В анализе крови обнаружены антитела к ВГЧ 6-го типа IgG — 5,8 (коэффициент позитивности, норма 0–0,79), антитела к ВГЧ 6-го типа IgМ — отсутствуют, ДНК ВГЧ 6-го типа в крови отсутствует.
Проведено лечение: инозин пранобекс 50 мг/кг в сутки в 3 приема в течение 10 дней с повторением курса через 8 дней, монтелукаст 5 мг в сутки на ночь в течение 1 месяца. Во время лечения было рекомендовано при отсутствии затрудненного дыхания и приступов кашля ингаляции Беродуала не применять, будесонид продолжать.
После курса лечения кашель стал значительно реже, ночные приступы отсутствовали, температура тела устойчиво в норме. Аускультативно хрипы не выслушивались, дыхание имело жесткий оттенок. На этом фоне была рекомендована отмена будесонида с продолжением приема монтелукаста. Через еще 1 месяц жалобы отсутствовали, аускультативных отклонений не было, терапия полностью отменена. При лабораторном обследовании в мазке из зева ВГЧ 6-го типа не обнаружен.
При последующем наблюдении за ребенком в течение 4 лет отмечались редкие эпизоды ОРВИ: 2–3 в год, 2 раза к назофарингиту присоединялся бронхообструктивный синдром. С учетом ранее выявленной инфекции ВГЧ 6-го типа курсы инозина пранобекса и монтелукаста в этих ситуациях повторяли, при повторных осмотрах через 7 дней обструктивных хрипов не регистрировали. В период между эпизодами ОРВИ кашля не было, в поддерживающей терапии ребенок не нуждался.
Таким образом, представленный клинический пример подчеркивает важность и эффективность этиотропной терапии при бронхообструктивном рецидивирующем синдроме у детей. Многочисленные исследования и наблюдения показывают необходимость при хронических или рецидивирующих бронхитах целенаправленного поиска инфекционных агентов, в первую очередь вирусов группы герпеса с последующим соответствующим лечением. Антагонисты лейкотриеновых рецепторов (монтелукаст) имеют достаточно активное противовоспалительное действие, которое часто необходимо при бронхитах. Комплексное противовирусное и иммуномодулирующее действие инозина пранобекса в ситуации с длительным бронхообструктивным синдромом обеспечивает устойчивый результат при персистирующих вирусных инфекциях, в частности, обусловленных ВГЧ 6-го типа.
Литература
Т. А. Руженцова* , 1 , доктор медицинских наук, профессор
Н. А. Мешкова**
Е. К. Шушакова*
* ФБУН ЦНИИЭ Роспотребнадзора, Москва
** ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России, Москва
Тактика ведения рецидивирующего бронхообструктивного синдрома у детей/ Т. А. Руженцова , Н. А. Мешкова, Е. К. Шушакова
Для цитирования: Лечащий врач № 10/2019; Номера страниц в выпуске: 17-19
Теги: вирус герпеса, бронхиальная обструкция, дети.
Клиника и диагностика поражений вирусом простого герпеса при иммунодефиците
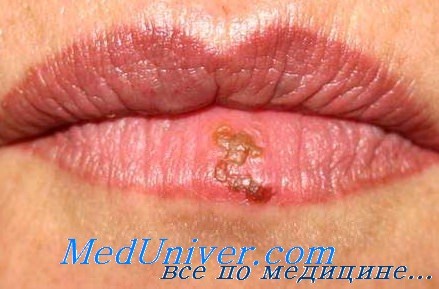
Поражение лица и ротоглотки наиболее типично для реактивации герпесвирусной инфекции. Морфология герпетических высыпаний зависит от типа пораженной эпителиальной ткани. На красной кайме губ и коже лица первичными элементами являются мелкие везикулы, которые возникают последовательно, имеют тенденцию к быстрому слиянию и формированию крупного вялого пузыря. Эти элементы умеренно болезненны, типично ощущение жжения.
После отторжения некротизированного эпителия обнажаются эрозированные кровоточащие поверхности, по краям которых появляются новые мелкие везикулы, и элемент начинает расти от центральной части к периферии.
Суперинфицирование элементов часто приводит к возникновению глубоких некрозов, заживающих с формированием рубца. Поражение лица вирусом герпеса следует дифференцировать от поражения зигомицетами (Absidia, Rhisopus, Mucor) и Aspergillus, которые вызывают тяжелые некрозы тканей лица, расплавление хрящей и костей лицевого скелета с быстрым обезображиванием внешнего облика пациента.
На слизистой оболочке рта наиболее типичным является возникновение нескольких одинаковых поверхностных некротических элементов диаметром 1—3 мм, которые затем углубляются и увеличиваются в размерах, часто сливаются. В самых тяжелых случаях значительная площадь полости рта поражена крайне болезненными глубокими некрозами серого цвета с кровоточащими участками эрозий.
В прошлом, до введения всеобщей профилактики ацикловиром, у больных после ТКМ герпетические поражения ротоглотки нередко становились причиной обструкции верхних дыхательных путей, в связи с чем возникала необходимость в протективной интубации трахеи.
Процесс заживления глубоких некрозов часто проходит стадию отторжения фибриновых пленок с обнажением ригидных сосудов десен, что может быть чревато значительной кровопотерей, особенно у детей младшего возраста. Мы наблюдали кровотечения из язв на деснах в объеме до 400 мл в сутки. Кроме того, заживление язв нередко сопровождается обильной саливацией: потерей до 700—900 мл слюны в сутки, что может стать причиной обезвоживания у детей.
Знание закономерностей развития герпетического стоматита позволяет сделать вывод, что при нейтропении лечение его нельзя ограничивать ацикловиром: необходимо назначать препараты, активные в отношении стрептококков, анаэробов, грамотрицательной флоры и грибов. Монотерапии, отвечающей таким требованиям, не существует, поэтому при фебрильной нейтропении, сопровождающейся стоматитом, мы наряду с ацикловиром всегда используем бета-лактам с расширенным спектром антианаэробной активности (пиперациллин/тазобактам, имипенем, амоксициллин/клавуланат) либо к другим бета-лактамам добавляем метронидазол.
Часто драматического улучшения удается добиться при использовании клиндамицина или пенициллина. Кроме того, мы рекомендуем и сами всегда используем системную противогрибковую терапию.
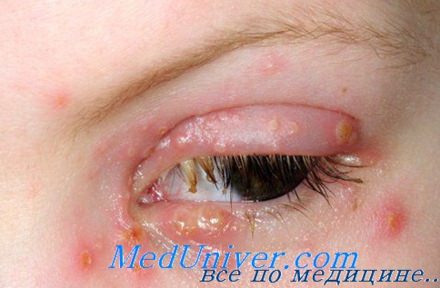
Поражение вирусом простого герпеса пищевода
При распространении инфекции из полости ротоглотки поражается верхний сегмент пищевода. Другой путь — контаминация инфицированной герпес-вирусом слюной эрозированного (в результате желудочно-пищеводного рефлюкса или рвоты) пищевода. В этом случае поражается нижний сегмент пищевода. Клиническая картина среднего и дистального эзофагита очень типична: больные жалуются на ощущение кома за грудиной, сильное жжение и боли, которые значительно усиливаются после глотания и рвоты.
Следует отметить, что последняя локализация — одно из самых опасных проявлений герпесвирусной инфекции, поскольку именно дистальный эзофагит служит воротами для развития инвазивных бактериальных и грибковых инфекций. По морфологической картине (язвенно-некротические элементы, захватывающие все слои пищевода) отличить герпетическое поражение от цитомегаловирусного, бактериального или грибкового не представляется возможным. Без проведения биопсии установить точный микробиологический диагноз невозможно.
Если принято решение выполнить эзофагоскопию и биопсию, то для диагностики герпес-вирусного поражения необходимо получить биоптат эпителия края язвы, а для диагностики ЦМВ-поражения — ее дна. Это связано с тем, что герпес-вирус поражает эпителий, а цитомегаловирус — строму.
При герпетическом эзофагите, как и при герпетическом стоматите, особенно больным с фебрильной нейтропенией, наряду с ацикловиром всегда следует назначать антимикотик системного действия (амфотерицин В внутривенно в дозе 0,3—0,5 мг/кг в сутки, флюконазол внутривенно или внутрь, возможно вориконазол и итраконазол) и системные антибиотики, обладающие антианаэробной активностью.
Важную роль играют антацидная и антирефлюксная (ранитидин или омепразол, дофаминовые антагонисты) терапия и адекватное обезболивание наркотиками.
Поражение бронхиального дерева и легких вирусом простого герпеса
Чаще всего герпетический трахеобронхит развивается у иммунокомпрометированных больных с герпетическим эзофагитом, которые интубированы и находятся на искусственной вентиляции легких. Наблюдаются также фокальные герпетические пневмонии. Диффузные пневмонии с развитием дыхательной недостаточности, напротив, являются следствием диссеминированной герпетической инфекции у больных с глубоким дефицитом клеточного или гуморального иммунитета.
Поражение вирусом простого герпеса центральной нервной системы
Герпетический энцефалит — очень редкое проявление реактивации герпесвирусной инфекции у онкогематологических больных. Он не отличается от энцефалита у иммунокомпетентного хозяина, т. е. характеризуется энцефалитическим синдромом и признаками воспаления и некроза на компьютерных и ядерно-магнитных томограммах. Поражение спинного мозга вирусом герпеса является казуистикой. Описаны случаи восходящего поперечного миелита.
Диагностика поражений вируса простого герпеса
Известно несколько методов быстрой и специфической диагностики герпесвирусной инфекции. Классическим методом является выделение вируса, основанное на его цитопатическом действии на чувствительные культуры клеток млекопитающих. Этот метод достаточно быстрый (90 % позитивных результатов в первые 3 дня, 100% —в первые 7 дней культивирования) и весьма специфичный.
Существует более быстрый метод (комбинация иммуноферментного и культурального методов), которым выявляют наличие вирусных антигенов в чувствительной клеточной культуре, зараженной исследуемым материалом. Этот метод аналогичен описанному ранее методу shell vial для ЦМВ и позволяет получить результаты в течение суток.
Следует отметить, что, как и при ЦМВ-инфекции, серологические данные (наличие специфического IgM или повышение титра IgG) и выделение вируса простого герпеса со слюной не несут полезной оперативной информации. Особенно важно это при диагностике герпесвирусного энцефалита. Нам доводилось наблюдать неадекватную интерпретацию серологических тестов у больных с энцефалитическим синдромом и необоснованное назначение ацикловира в высоких дозах. Единственным надежным методом диагностики является проведение биопсии ткани головного мозга и вирусологического исследования.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ознобы. Герпес - Herpes labialis. Бронхит. РОЭ.
Настоящие потрясающие ознобы наблюдаются часто при следующих заболеваниях:
- Бактериемия различного происхождения.
- Сепсис, затяжной септический эндокардит, бактериальная пневмония, менингококковый менингит, рожа, оспа, ткалярия, пиелит.
- Болезнь Вейля — Васильева.
Они бывают редко при туберкулезе, паратифе, брюшном тифе (еще реже, чем при паратифе), риккетсиозах, вирусных заболеваниях и никогда не бывают при истинном ревматизме:
Herpes labialis
Герпес часто наблюдается при бактериальной пневмонии, но также почти при всех лихорадочных заболеваниях дыхательного тракта, за исключением вирусной и риккетсиозной пневмоний, которые, можно сказать, почти никогда не сопровождаются герпесом. При менингококковом менингите герпес почти обязателен. При брюшном и сыпном тифе герпес наблюдается очень редко, так же как и при бруцеллезе и лептоспирозных заболеваниях. Но так как при многих лихорадочных заболеваниях глотка уже рано инфицируется бактериями (особенно при пиемических процессах), что может вести к образованию герпеса, то дифференциально-диагностическое значение herpes labialis сравнительно незначительно.
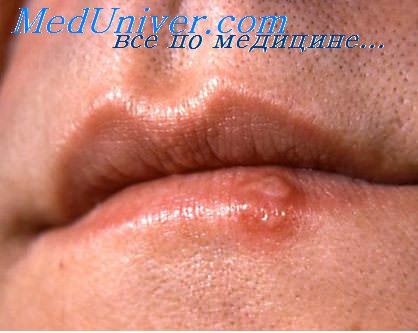
Бронхит
РОЭ. Ускорение РОЭ.
Ускорение РОЭ зависит прежде всего от повышения содержания фибриногена и глобулинов за счет уменьшения альбуминов. Такие сдвиги белков плазмы могут иметь место не только при воспалительных процессах, но также и при многих других патологических состояниях и всегда выраженнее при опухолях с распадом ткани и при диспротеинемиях, патогенез которых недостаточно выяснен. Об этом факте врач никогда не должен забывать при истолковании ускоренной РОЭ.
РОЭ резко ускорена при ограниченных нагноительных процессах (за исключением аппендицита в первой стадии), при большинстве бактериальных инфекций (пневмония, менингококковый менингит, пиелит), лептоспирозах, умеренно ускорено также при бруцеллезе, туберкулезе (необязательно); особенно высокие величины находят при ревматизме и многих других, невоспалительных процессах, которые сопровождаются диспротеинемиями (злокачественные опухоли, болезни печени и т. д.). Наивысшие значения находят при миеломе. Среди лихорадочных заболеваний РОЭ, наоборот, не ускорена при многих вирусных заболеваниях, особенно при полиомиелите, также не всегда при туберкулезе (даже при многих открытых формах отмечена низкая РОЭ). Брюшной тиф и паратиф также в первые дни не дают ускорения РОЭ.
Если РОЭ не идет параллельно остальной клинической картине, надо всегда выяснить, нет ли одновременно каких-либо факторов, которые могли бы объяснить, например, очень низкую РОЭ. Сюда относятся прежде всего полиглобулия и сердечная недостаточность. Высокая РОЭ иногда обусловлена клеточными факторами (анемия). При ускорений РОЭ у лиц без каких-либо болезненных проявлений, будет ли это потому, что ускоренная РОЭ в период реконвалесценции еще не пришла в норму, или потому, что повышение ее выявили при каком-либо общем проверочном обследовании, могут встать очень трудно разрешимые дифференциально-диагностические вопросы. Здесь необходимо исключить: 1. Воспалительные процессы:
а) тонзиллиты, скрытые нагноительные процессы в придаточных полостях носа;
б) зубные гранулемы (повышена только незначительно);
в) флебиты при варикозных расширениях вен (пальпация!);
г) холецистит (холецистограмма);
д) скрытые туберкулезные процессы (легкие, гениталии);
е) ревматические поражения (анамнез);
ж) бруцеллез (агглютинация);
з) поражения печени и почек.
2. Новообразования:
а) гипернефрома (внутривенная пиелограмма);
б) опухоли желудочно-кишечного тракта;
в) опухоли половой системы;
г) опухоли другой локализации.
3. Анемии.
4. Острые инфаркты миокарда.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Иммуноглобулин Е при вирусных инфекциях.
Что касается данных о выработке иммуноглобулина Е при вирусных инфекциях, то они немногочисленны и противоречивы. Большинство исследований посвящено определению уровня общего IgE. Так, имеются сведения о последовательном снижении уровней IgE (на 35-87%) в фазу выздоровления по сравнению с острой фазой респираторной вирусной инфекции у лиц без атонии. В то же время А. Курашвили и соавт. (1984) опубликовали данные о том, что острая фаза гриппа сопровождается снижением уровня общего IgE, а в период реконвалесценции у больных бронхиальной астмой этот уровень превышает нормальные показатели у здоровых доноров. По-видимому, указанные обстоятельства объясняются выраженным супрессорным воздействием вируса гриппа на гуморальный иммунитет.
Уровень общего IgE при частых рецидивах герпетической инфекции оказался повышенным независимо от наличия или отсутствия атопии.
Противоречивость данных об уровне IgE при вирусных инфекциях легко объяснима, учитывая неспецифичность изучаемых параметров иммуноглобулина, а также разнообразие вирусных агентов.

Наиболее детально проанализирован специфический IgE ответ при респираторно-синцитиачьной инфекции. Рядом зарубежных и отечественных исследователей показано, что при PC-инфекции возникает преимущественно местный, а не гуморальный IgE к вирусу (слизистая респираторного тракта, бронхоальвеолярный лаваж, бронхиальные и назофарингеальные смывы). При хронической обструктивной болезни легких и облитерирующем бронхиолите наиболее значительные уровни IgE к PC-вирусу регистрировали в жидкости бронхоальвеолярного лаважа, что соответствовало и основной локализации вируса (либо его антигенов) в глубоких отделах респираторного тракта, а не верхних дыхательных пугях. Следует отметить, что IgE-ответ на PC-вирус отмечался и у практически здоровых лиц, но преимущественно в смывах верхних дыхательных путей, при этом уровень специфического IgE и продолжительность его обнаружения значительно уступали показателям, полученным при наличии бронхоспазма и верифицированной бронхиальной астмы.
При сравнительном изучении уровней специфических IgE к различным респираторным вирусам было выяснено, что специфический ответ при PC-инфекции значительно выше, чем при гриппе, парагриппе и аденовирусе вне зависимости от наличия или отсутствия бронхоспазма. Объяснением подобного явления служат уникальные биологические свойства РСВ, который обладает слабо выраженной интерферониндуцирующей способностью (не только а, но и у-интерферон) в отличие от других респираторных вирусов. Слабая индукция интерферона-у (ИФ-у) - главного ингибитора IgE при респираторно-синцитиальной инфекции - естественно, ведет к длительной продукции указанного иммуноглобулина, тогда как при гриппе и парагриппе через неделю от начала инфицирования уровни ИФ-у оказывались в 10-12 раз выше и приостанавливали дальнейший синтез специфического IgE.
Оригинальные исследования были проведены сотрудниками Института вирусологии им. Д.И. Ивановского и НИИ пульмонологии МЗ РФ. Обследовали больных с различными вариантами бронхиальной астмы. В результате выявлены коррелятивные связи между подъемом уровней интерлейкина-4 (индуктора IgE), IgE и предшественника ИФ-у белка-неоптерина. Низким уровням неоптерина, как правило, сопутствовали высокие концентрации как общего, так и специфического IgE. Таким образом, PC-вирус в силу своих уникальных биологических свойств представляет особую опасность в плане развития аллергических реакций и атопических заболеваний, в том числе атопической бронхиальной астмы. Однако PC-вирус является наиболее частой причиной не только атонической, но и неатопической астмы. По мнению Н. Lindemann респираторные вирусы в 90,0% случаев обусловливают формирование инфекционно-аллергической астмы. Тогда как на долю бактериальной флоры остается всего 10,0%. Лидером среди респираторных вирусов является РСВ (60,0-70,0%). Чаще поражаются дети в возрасте 4-5 месяцев, при этом тотально поражается весь эпителий дыхательных путей, включая бронхиолы диаметром 75-300 мкм. Примерно у половины детей, перенесших PC-вирусный бронхиолит, по данным Zweimann et al., (1971) в течение ближайших 5 лет формируется либо хронический обструктивный бронхит, либо бронхиальная астма (особенно при наличии у родителей атопии).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

