Цефазолин или цефтриаксон от золотистого стафилококка
Обновлено: 18.04.2024
Антибиотики для лечения энтерококковых (Enterococcus spp.) раневых инфекций. Резистентность к ванкомицину
Проблема энтерококковых нозокомиальных инфекций (НКИ) состоит во множественной устойчивости возбудителя к антимикробным препаратам. В такой ситуации появление штаммов VRE представляет серьезную задачу, учитывая, что частота регистрации VRE растет во всем мире. По нашим данным, при послеоперационных РИ доля VRE составляет 2,5% (8 из 323 штаммов) для Е. faecalis и 72,2% (267 из 370) для Е. faecium.
Выделено шесть фенотипов резистентности к ванкомицину: VanA, VanB, VanC, VanD, VanE, VanC. Наиболее часто регистрируются VRE фенотипов VanA (резистентность к ванкомиципу и тейкопланину) и VanВ (резистентность только к ванкомицииу). Фенотипы VanA и VanB считаются самыми распространенными в клинических условиях и обычно связаны с видами Е. faecium и Е. faecalis, тогда как резистентность к ванкомицину фенотипа VanC является природной характеристикой Е. gallinarum (генотип VanC1) и Е. casseliflavus, E.gallinarum (генотипы VanC2 и VanC3).
В условиях стационара 3-47 % пациентов только колонизированы VRE, но при этом не имеют энтерококковых инфекций. В то же время длительная колонизация считается очень серьезным обстоятельством, которое способствует широкому распространению ванкомицин-резистентных штаммов бактерий в клинике. Полирезистентность к антибиотикам значительно чаще регистрируется среди штаммов Е. faecium (в т. ч. и к ванкомицину), нежели Е. faecalis. При этом Е. faecalis имеет больше факторов вирулентности (например, цитолизин, внеклеточный супероксид-анион и др.). Тем не менее летальность при энтерококковых инфекциях, обусловленных штаммами VRE, примерно в 2 раза выше, чем ванкомицин-чувствительными (36,6 vs 16,4% соответственно).
Энтерококки отличаются природной устойчивостью ко многим группам антимикробных препаратов (например, аминогликозиды, цефалоспорины). Остается неясным целесообразность применения таких антибиотиков, как тетрациклипы, макролиды (эритромицин и др.), рифампицин, при энтерококковых инфекциях. Пенициллин и ампициллин - препаратами выбора для лечения энтерококковых инфекций обладают перекрестной резистентностью. Энтерококки способны продуцировать /3-лактамазы. Поэтому при инфекциях, обусловленных штаммами, резистентными к пенициллину/ампициллину, следует назначать ингибиторзащищенные аминоменициллипы (амоксициллин/клавуланат, амоксициллин/сульбактам или ампициллин/сульбактам).
По отечественным данным только 9,8% штаммов Е. durans и 3,8% Е. faecium чувствительны к пенициллину/ампициллину, тогда как в случае Е. faecalis — 91,3 %.
Энтерококки обладают природной устойчивостью к аминогликозидам, но эти препараты широко применяют в комбинированной терапии генерализованных инфекций, обусловленных энтерококками, благодаря выраженному синергизму между аминогликозидами и ванкомицином или ампициллином. Синергизм наблюдается при условии, что МПК аминогликозидов не более 500 мкг/мл для гептамицина и 1000 мкг/мл для стрептомицина. По отечественным данным доля чувствительных к ампициллину штаммов энтерококков невысока: 15,8% Е. faecium, 29,4% Е. durans и 59,3% Е. faecalis. Чувствительность энтерококков к вапкомиципу следующая: 50% для Е. durans, 97,5% для Е. faecalis и только 27,8% для Е. faecium.
Очевидно, что синергизм комбинаций аминогликозидов с ванкомицином или ампициллином следует ожидать только в случае инфекций, обусловленных Е. faecalis.
Линезолид считается средством выбора для терапии энтерококковых инфекций, обусловленных устойчивыми к ванкомицину штаммами. По нашим данным, чувствительность энтерококков к линезолиду высокая: 84,3% для Е. durans, 94,3% для Е. faecalis и 95,4 % для Е. faecium.
Не выявлено ни одного штамма энтерококка, устойчивого к тигециклипу.
По данным кооперированных зарубежных исследований, анаэробы в структуре возбудителей послеоперационных раневых инфекций (РИ) составляют всего 3%. Среди грамотрицательных анаэробных микроорганизмов группа В. fragilis стоит па 1-м месте по частоте выделения из биоматериалов при нозокомиальных инфекциях (НКИ), остальные грамотрицательные анаэробы, такие, например, как Eusobaclerium, Prevotella и Porphyromonas spp., тоже могут вызывать инфекции. Грамположительные анаэробные кокки (как правило, Peptostreptococcusspp.) -основные среди грамположительных анаэробов возбудители, которые выделяются из ран, абсцессов, крови.
В литературе даны многочисленные рекомендации по предупреждению послеоперационных раневых инфекций. Тем не менее лечение подобных инфекций по-прежнему остается одной из сложных проблем хирургии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Антибиотики цефалоспорины для лечения заболеваний уха, горла, носа
Цефалоспорины являются еще одной группой бета-лактамных антибиотиков, они подразделяются на первое, второе, третье и четвертое поколения. Упрощая, можно сказать, что цефалоспорины первого поколения обладают наибольшей активностью в отношении грамположительной флоры, в то время как цефалоспорины четвертого поколения наиболее эффективны против грамотрицательной флоры.
а) Цефалоспорины первого поколения. К ним относятся цефалексин (кефлекс, Shionogi) и цефазолин (анцеф, GlaxoSmithKline; кефзол, EliLilly).
Клиническое применение. Активны в отношении стафилококков, стрептококков и негоспитальных штаммов Proteus, Klebsiella и Е. coli. Активность в отношении других кишечных грамотрицательных и анаэробных организмов низкая. Благодаря антистафилококковой активности, цефазолин часто используется для профилактики гнойных осложнений после хирургических операций.
б) Цефалоспорины второго поколения. Группа включает в себя цефуроксим (цефтин, GlaxoSmithKline), цефпрозил (цефзил, Bristol-MyersSquibb) и цефаклор (цеклор, EliLilly).
Клиническое применение. По сравнению с препаратами первого поколения чуть более активны в отношении грамотрицательной флоры (Proteus, Klebsiella, представители Neisseria и Moraxella cаtarrhalis). Активность в отношении грамположительной флоры несколько меньше.
в) Цефалоспорины третьего поколения. К ним относятся цефподоксим (вантин, Pfizer), цефтриаксон (роцефин, Genentech), цефтазидим (фортас, Covis Pharmaceuticals), цефдинир (омницеф, Abbott Laboratories) и цефотаксим (клафоран, Sanofi-Aventis).
Клиническое применение. Данные препараты менее активны в отношении золотистого стафилококка, но способны подавлять рост стрептококков и имеют расширенный спектр действия в отношении грамотрицательной флоры. Цефтриаксон обладает активностью в отношении пневмококков, Н. Influenzae и Neisseria meningitidis, также он способен проникать через гематоэнцефалический барьер, поэтому часто используется при менингите и внутричерепных или внутриорбитальных осложнениях синусита и среднего отита.
Цефтриаксон может использоваться для лечения гонорейного фарингита. Цефподоксим и цефднир часто используются в лечении острого отита и синусита, т. к. по сравнению с другими цефалоспоринами третьего поколения они обладают более широким спектром действия в отношении грамположительной флоры. Пероральные цефалоспорины не способны подавлять рост резистентных к пенициллину пневмококков.
г) Цефалоспорины четвертого поколения. Цефепим (максипим, Elan Pharmaceuticals) является единственным представителем группы цефалоспоринов четвертого поколения. Он обладает наибольшей эффективностью в отношении синегнойной палочки, поэтому может использоваться как замена аминогликозидам (в отличие от которых, у цефепима нет отои нефротоксических свойств).
Также к нему восприимчивы другие грамотрицательные организмы, которые зачастую отличаются высокой резистентностью к антибиотикам, например, Enterobacter и Citrobacter. Также цефепим активен в отношении золотистого стафилококка и пневмококков.
д) Побочные эффекты антибиотиков цефалоспоринов. Из-за схожести химического строения цефалоспорины не стоит использовать в случае наличия в анамнезе анафилактических реакций на пенициллины. Впрочем, сыпь возникает лишь у 5-10% пациентов, в прошлом отмечавших появление крапивницы после приема пенициллинов. Из-за широкого спектра действия цефалоспоринов и следующего за их использованием размножением некоторых грибков и бактерий, возможно развитие кандидоза слизистых оболочек и кожи, а также псевдомембранозного колита, вызванного Clostridium difficile.
Использование цефтриаксона может приводить к развитию желчного осадка, особенно у пациентов, находящихся на полностью парентеральном питании. Подобно пенициллинам, использование цефалоспоринов может приводить к развитию интерстициального нефрита, анемии и лейкопении, поэтому требуется соответствующий мониторинг лабораторных показателей.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цефалоспорины. Классификация и свойства цефалоспоринов. Фторхинолоны. Особенности фторхинолонов.
Цефалоспорины являются бета-лактамными антибиотиками, используемыми при внебольничных, госпитальных пневмониях, а также пневмониях при иммунодефицитах. Они оказывают бактерицидное действие, превосходя пенициллины по антибактериальной активности и показателям фармакокинетики.
Наибольшее распространении получило деление цефалоспоринов на геренации (поколения), основанное на спектре их антимикробного действия.
Цефалоспорины 1 поколения (цефазолин, цефалотин, цефалексин и др.) обладают высокой активностью против грамположительных кокков и некоторых грамотрицательных бактерий - Н.influenzae, E.coli, Proteus. Они устойчивы к действию пенициллиназы стафилококков, но разрушаются бета-лактамазами грамнегативных микроорганизмов. Эти средства могут быть использованы как препараты резерва при внебольничных первичных превмониях.
Цефалоспорины 2 поколения (цефуроксим, цефамандол, цефоксетил, цефаклор и др.) имеют широкий спектр действия, активны в отношении грамотрицательных и грамположительных микроорганизмов, выделяющих бета-лактамазы. Они используются в качестве средств 1 ряда при внегоспитальной пневмонии у больных пожилого возраста, имеющих сопутствующие заболевания.
Цефалоспорины 3 поколения обладают преимущественной активностью в отношении грамотрицательных бактерий и некоторых анаэробов. Поэтому они рассматриваются в качестве средств первого ряда при госпитальных пневмониях и пневмониях на фоне иммунодефицитов. Их недостатком является слабая активность в отношении стафилококков, продуцирующих бета-лактамазы.
К этой группе относятся цефтазидим (фортум), цефотаксим (клафоран тарцефоксим, Polfa), цефтриаксон (лонгацеф), цефоперазон (цефобид), цефтибутен (цедекс). Цефтазидим обладает наиболее высокой активностью против синегнойной палочки. Поэтому он является препаратом выбора при лечении пневмоний у больных, находящихся на искусственной вентиляции легких в отделениях реанимации. Цефтриаксин имеет наибольший период полувыведения и может назначаться 1 раз в сутки. Цефоперазон метаболизируется в печени и выделяется с желчью, поэтому он может назначаться в обычных дозах у, больных почечной недостаточностью.

В последние годы синтезированы цефалоспорины 4 поколения (цефепим, цефпиром), которые высокоактивны против грамположительных и грамотрицательных микроорганизмов. Место этих средств в лечении пневмоний требует уточнения.
Цефалоспорины характеризуются хорошей переносимостью. Побочные реакции при их приеме у больных возникают редко. Следует отметить, что эти препараты вызывают перекрестные с пенициллинами реакции гиперчувствительности (в 5-10% случаев). Поэтому их не следует назначать больным с аллергическими реакциями на пенициллин.
Госпитальная (нозокомиальная) пневмония - это заболевание, возникающее у пациентов, находящихся в стационаре 2 и более дня. Как правило, она является осложнением тяжелых соматических болезней (сахарный диабет, опухоли, хронические обструктивные болезни легких, инсульты, комы, сердечная недостаточность и др.), развивается в послеоперационном периоде, при проведении искусственной вентиляции легких (ИВЛ) в отделениях реанимации.
Как правило, госпитальные пневмонии вызываются грамотрицательной флорой (в том числе Ps.aeruginosae), анаэробами и стафилококками. Поэтому препаратами выбора у больных являются цефалоспорины 3 поколения, фторхинолоны, комбинации пенициллинов и ингибиторов бета-лактамаз (аугментин, уназин, тазоцин, тиментин и др.).
Фторхинолоны - бактерицидные средства, активные в отношении грамнегативных (в том числе Ps.aeruginosae) и части грампозитивных микроорганизмов, микоплазм, хламидий, легионелл. Механизм их действия заключается в инактивации ДНК-гираз, которые катализируют спирализацию ДНК микробов. Одно из достоинств фторхинолонов -хорошее проникновение в легочную ткань.
Наиболее изученными представителями этого класса соединений являются ципрофлоксацин (ципробай, ципринол и др.), офлоксацин (таре-вид), пефлоксацин (пефлацин, абактал), ломефоксацин (максаквин), флерофлоксацин. Следует помнить, что ципрофлоксацин и пефлоксацин тормозят клиренс теофиллина, что требует уменьшения дозы последнего при их совместном применении.
Основной недостаток большинства фторхинолонов - относительно невысокая активность в отношении пневмококков. В последние годы синтезирован спарфлоксацин (загам), который высокоэффективен при инфекциях, вызываемых этими микроорганизмами.
Побочные эффекты, возникающие при приеме фторхинолонов (дисфункции пищеварительной системы, фотосенсибилизация и др.), встречаются относительно редко.
При тяжелом течении госпитальных пневмоний используются комбинации препаратов первого ряда с аминогликозидами и карбапенемы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Проблема рациональной антибиотикотерапии остается одной из самых сложных в клинической практике. Если ранее врач в вопросе выбора лекарственного препарата ориентировался на его эффективность, переносимость и безопасность, то сегодня этого оказыва
 |
Проблема рациональной антибиотикотерапии остается одной из самых сложных в клинической практике. Если ранее врач в вопросе выбора лекарственного препарата ориентировался на его эффективность, переносимость и безопасность, то сегодня этого оказывается недостаточно. Фактор удобства приема препарата и, что особенно непривычно для нашего понимания, вопросы цены и стоимости лечения в условиях серьезного ограничения финансирования здравоохранения часто могут оказаться определяющими. На приобретение лекарственных средств лечебные учреждения тратят 15–20% своего бюджета, причем 50–60% этих расходов приходится на долю антибактериальных препаратов, что заставляет пересмотреть существующие и искать новые подходы к их применению.
ЦА занимают одно из важных мест в лечении инфекций верхних и нижних дыхательных путей. Наиболее ответственным этапом в антибактериальной терапии данной категории пациентов является выбор первоначального препарата. От адекватности выбора зависит эффективность и безопасность лечения, а также его комфортность, переносимость, стоимость, эпидемиологическая ситуация.
Анализ имеющихся данных об использовании ЦА в России за 1997–1998 гг. позволяет выявить предпочтения врачами того или иного препарата (группы препаратов) и определенных методов его введения. Как видно из рис. 1, при назначении цефалоспориновых антибиотиков подавляющее большинство врачей выбирают парентеральные препараты.
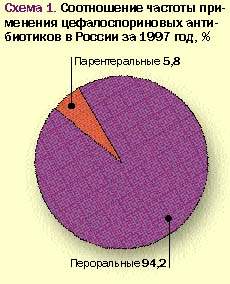 |
Данный факт лишь подтверждает, что в нашей стране пероральные лекарственные средства, и особенно пероральные цефалоспорины, очень мало популярны и практически не используются. Такое отношение к таблетированным формам отражает некоторый консерватизм практических врачей, связанный с тем, что еще 15-20 лет назад существовавшие тогда пероральные средства не выдерживали сравнения с парентеральными препаратами ни по эффективности терапии, ни по ее переносимости. Лишь последние десятилетия с момента создания первого перорального цефалоспорина — цефалексина и появления новых пероральных бактерицидных препаратов эта лекарственная форма несколько укрепила свои позиции не только в амбулаторной, но и в стационарной практике. Однако радикально на положении дел это не сказалось.
Очевидно, что такая форма назначения препаратов имеет безусловные преимущества. Это проявляется и в возможности амбулаторного ведения больного, и в удобстве приема препарата, и в снижении риска постинъекционных осложнений и длительности пребывания в стационаре, и даже в избавлении от психологического дискомфорта, связанного с инъекциями.
Наличие антибактериальных препаратов в двух формах — для парентерального и перорального применения — делает возможным их использование для проведения так называемой ступенчатой терапии. Суть такого лечения состоит в назначении внутривенного или внутримышечного препарата и в последующем, через двое-трое суток после достижения клинического эффекта, переводе на пероральный прием. Возможность проведения ступенчатой терапии одним и тем же препаратом является существенным преимуществом данного лекарственного средства перед его аналогами. Ступенчатая терапия предоставляет клинические и экономические преимущества как пациенту, так и лечебному учреждению.
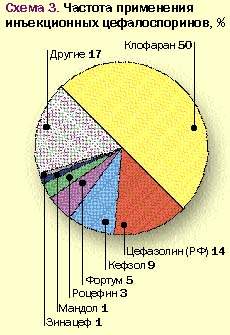
На основании приведенных данных трудно понять логику выбора цефалоспоринового антибиотика того или иного поколения и принципы, которыми руководствуется врач при назначении препарата. Анализ использования цефалоспориновых антибиотиков по поколениям (см. рис. 2 и 3) свидетельствует о предпочтительном назначении препаратов I и III поколений, причем из препаратов III поколения (61%) половина приходится на цефотаксим, а из препаратов I поколения большая часть приходится на цефазолин.
 |
Таким образом, ориентировочная этиология бронхолегочной инфекции служит основанием для выбора среди ЦА конкретного препарата (или поколения препаратов) с соответствующей антимикробной активностью.
При обострениях хронического бронхита особое значение приобретают препараты, высокоустойчивые к действию b-лактамаз, продуцируемых как грамотрицательными, так и грамположительными микроорганизмами (цефуроксим аксетил), и обладающие высокой активностью против Н.influenzae (цефтибутен).
 |
Общие принципы выбора первоначального ЦА сохраняются и у больных пневмонией на фоне тяжелых сопутствующих заболеваний (ХОЗЛ, сердечная недостаточность, сахарный диабет, алкогольная интоксикация и др.) и в возрасте старше 60 лет. Этиологическое значение в данной клинической ситуации приобретают Н.influenzae, S.аureus, некоторые грамотрицательные микроорганизмы (Е.соli, Сlebsiella), возрастает частота бета-лактамазопродуцирующих бактерий. В связи с этим возрастает значение препаратов, активных в отношении названных возбудителей. Известно, что противомикробное действие ЦА при переходе активности от первого поколения к последующим характеризуется снижением противостафилококковой активности и преобладанием активности против некоторых грамотрицательных микроорганизмов. Ценным свойством является устойчивость ЦА II поколения к b-лактамазам. В связи с этим врач должен ориентиро-ваться в данной ситуации на цефалоспорины II или по крайней мере III поколения.
| Цефалоспорины, открытые более 50 лет тому назад, продолжают занимать прочные позиции в лечении различных бактериальных заболеваний, несмотря на появление новых антимикробных средств. Цефалоспориновые антибиотики подразделяются на четыре поколения, отличающиеся по спектру действия, антибактериальной активности, стабильности в присутствии b-лактамаз, фармакокинетическому профилю. Все это наряду с многообразием лекарственных форм и стоимостью определяет их различные показания. Очевидно, что по мере появления новых поколений цефалоспориновых антибиотиков в клинической практике возникает немаловажная проблема дифференцированного назначения препарата с учетом свойств как самого антибиотика, так и особенностей инфекционно- воспалительного процесса у конкретного больного |
Таким образом, рациональный выбор первоначального ЦА для лечения инфекций верхних и нижних дыхательных путей определяется в первую очередь вероятностью этиологической роли того или иного микроорганизма в конкретной клинической ситуации. Такой подход требует от практического врача (а именно от него зависит адекватный выбор препарата) умения выявлять особенности каждого случая пневмонии (эпидемиологическую обстановку, фоновую патологию, факторы риска и др.) и ориентировки в антимикробном спектре назначаемого антибиотика. Однако в клинической практике при выборе ЦА, как, впрочем, и других антибиотиков, приходится наряду с ориентировочной этиологией бронхолегочной инфекции учитывать и другие факторы. Среди последних имеет значение фармакокинетика препарата, наличие разнообразных лекарственных форм, риск развития побочных эффектов, стоимость и др.
В настоящее время не окончательно определено место пероральных препаратов III поколения в клинической практике, так как их сравнительная клиническая и бактериологическая эффективность мало отличается от препаратов II поколения. Более того, как было сказано выше, преимущество цефалоспоринов III поколения состоит в их высокой активности в отношении b-лактамазопродуцирующих бактерий, наиболее часто вызывающих серьезные стационарные инфекции. Но поскольку в этом случае больные находятся в стационаре, то уже более обоснованно получают парентеральную терапию. В то же время ввиду сниженной активности в отношении грамположительных бактерий, часто являющихся причиной именно амбулаторной инфекции, назначение препаратов III поколения имеет меньше преимуществ перед препаратами II поколения.
Цель антибактериальной терапии состоит не только в достижении клинического эффекта, но и в полной эрадикации возбудителя, т. е. бактериологической эффективности. Это в основном определяется адекватным дозированием препарата для достижения необходимой концентрации в очаге инфекции. Высокая степень накопления препарата в тканях является необходимым требованием к лекарственному веществу.
ЦА первого поколения хуже проникают в ткани, что уменьшает степень бактериальной эрадикации.
Данные о биодоступности оральных ЦА следует иметь в виду при дифференцированном назначении их больным с сопутствующей патологией кишечника, связанной с нарушением всасывания, а также при одновременном приеме антисекреторных препаратов, антацидов, с учетом влияния пищи на всасывание ЦА.
Знание путей элиминации ЦА наряду с оценкой функционального состояния печени и почек (возраст, сопутствующая патология) также может определять выбор более адекватного для данной ситуации препарата. Выбирая ЦА для лечения тяжелых госпитальных пневмоний, например, у новорожденных и стариков или у больных с патологией почек, при наличии почечной недостаточности предпочтение следует отдать цефоперазону с учетом его преимущественно билиарной экскреции.
При дифференцированном выборе ЦА необходимо учитывать риск развития побочных эффектов. Наиболее типичны реакции гиперчувствительности (лихорадка, кожная сыпь), гематологические синдромы (цитопения, эозинофилия), нарушения со стороны желудочно-кишечного тракта (тошнота, рвота, диарея), печени (повышение активности трансаминаз), почек (повышение уровня креатинина), ЦНС (головная боль), флебиты при внутривенном введении. Поэтому анамнестические и клинико-лабораторные данные о наличии у больных какой-либо патологии должны влиять на выбор соответствующего препарата.
Флебиты часто возникают при введении цефалотина, цефотаксима, цефепима. Цефуроксим, цефоперазон, цефтибутен могут вызывать анемию (чаще гемолитическую), а при назначении цефалотина, цефамандола, цефотаксима, цефтазидима иногда выявляются фиксированные на эритроцитах антитела. Повышение активности печеночных ферментов возможно на фоне лечения цефоперазоном, цефтриаксоном, цефтазидимом, цефуроксимом. Уровень креатинина может повышаться при лечении цефалексином и цефподоксимом. Оральные цефалоспорины чаще всего вызывают нарушения со стороны желудочно-кишечного тракта (тошнота, рвота, диарея). При лечении парентеральными ЦА отмечено увеличение протромбинового времени, за исключением цефтазидима, не влияющего на синтез факторов протромбинового комплекса и показатели свертываемости крови. Возможны реакции гиперчувствительности (кожная сыпь, лихорадка, эозинофилия) на фоне применения почти всех ЦА III поколения.
Таким образом, дифференцированный выбор ЦА для лечения инфекций верхних и нижних дыхательных путей должен базироваться на учете и адекватной оценке многих факторов, включающих как особенности клинической ситуации, так и антимикробную активность и фармакокинетические характеристики назначаемого препарата.
Читайте также:

