Цефтриаксон при хламидийной пневмонии
Обновлено: 19.04.2024
О.А. Мубаракшина, Ю.М. Дронова
Воронежская государственная медицинская академия им. Н.Н. Бурденко, Воронеж
В обзоре рассмотрены актуальные вопросы этиологии, диагностики и лечения микоплазменных инфекций дыхательных путей. Отражены особенности клинического течения, основные подходы к лекарственной терапии, показания к назначению антибактериальных средств. Продемонстрирована высокая эффективность и безопасность макролидов в лечении респираторного микоплазмоза. Обосновано применение рокситромицина как одного из препаратов выбора. Указаны механизмы его действия, спектр антибактериальной активности и фармакокинетические особенности. Отражены фармакоэкономические преимущества препарата Эспарокси в лечении внебольничных инфекций дыхательных путей, в том числе микоплазменной этиологии.
Микоплазменная инфекция дыхательных путей (ДП), или респираторный микоплазмоз, – антропонозное инфекционное заболевание, протекающее по типу инфекции верхних (риносинусит, назофарингит, ларингит, тонзиллит, трахеит) и нижних ДП (бронхит, пневмония) [1].
Респираторный микоплазмоз является одной из наиболее частых внебольничных инфекций ДП. Так, его частота при острых респираторных заболеваниях составляет 10–16% во внеэпидемический период, а во время эпидемических вспышек может достигать 25–50% [1]. Распространенность респираторного микоплазмоза зависит от возраста. Наиболее часто острые респираторные инфекции, обусловленные Mycoplasma. pneumoniae, встречаются у детей старше 5 лет, подростков и в возрасте до 40 лет. Поражение ДП микоплазмами может происходить по типу моноинфекции, но нередко встречаются ассоциации микоплазм с вирусами (гриппа, парагриппа, аденовируса, респираторно-синцитиального вируса) и бактериями (Streptococcus pneumoniae, Haemophilus influenzae, Chlamydia рneumonia, Moraxella catarrhalis) [1, 2].
Респираторная микоплазменная инфекция, как правило, имеет легкое и среднетяжелое течение. Осложнения и случаи летальных исходов отмечаются обычно редко. В частности, летальность при микоплазменной пневмонии составляет 1,4%. Более тяжелое течение микоплазмоза ДП наблюдается при наличии микробных ассоциаций [3]. Кроме того, наличие иммунодефицитных состояний в отсутствие специфической антибактериальной терапии могут приводить к генерализации инфекции, хронизации воспалительного процесса и микробному носительству. Установлено, что микоплазмы могут быть причиной иммунных нарушений в организме человека [4].
Микробиологическая характеристика возбудителя Возбудителем респираторного микоплазмоза является M. pneumoniae – бактерия, относящаяся к роду Mycoplasma семейства Mycoplasma-taceae класса Mollicutes. Данный микроорганизм представляет собой прокариот, занимающий промежуточное положение между вирусами и бактериями, характеризующийся выраженной полиморфностью строения и очень мелкими размерами – от 125 до 250 мкм. Микоплазма не имеет клеточной стенки, что обусловливает пластичность клетки, а также высокую чувствительность к воздействию факторов внешней среды и природную устойчивость к бета-лактамным антибиотикам. Данный микроорганизм не способен синтезировать стерины, необходимые для образования липидных слоев цитоплазматической мембраны. В результате этого восполнение потребностей в стеринах возбудитель осуществляет за счет утилизации их из инфицированных тканей макроорганизма. M. pneumoniae является мембранным паразитом, способным персистировать во внутриклеточных инвагинатах. Это приводит к тому, что клиническое улучшение, наступающее после активной антибактериальной терапии, не всегда сопровождается гибелью M. pneumoniae, что может способствовать переходу острой формы инфекции в хроническую [5, 6].
Эпидемиология респираторного микоплазмоза
Считается, что источником инфекции являются больные люди с манифестной и субклинической формой заболевания. Передача инфекции обычно осуществляется воздушно-капельным путем при тесных контактах между людьми, что обусловлено нестойкостью возбудителя в окружающей среде. Возможен также контактно-бытовой путь через контаминированные возбудителем руки или предметы обихода. Для M. pneumoniae типичны семейные очаги инфекции, при этом наибольший уровень заболеваемости отмечают в организованных коллективах закрытого типа (школьники, студенты, военнослужащие и др.). Наибольшая распространенность инфекции отмечается в осенне-зимний период [4, 5, 7].
Многие авторы отмечают генетическое детерминирование чувствительности организма человека к микоплазмам, причем человеческая популяция по этому признаку неоднородна. Лица с иммунодефицитами на фоне системных, лимфопролиферативных и соматических заболеваний, ВИЧ-инфекции, лица с синдромом Дауна чаще подвергаются инфицированию M. pneumoniae. Постинфекционный иммунитет обычно длится 5–11 лет и более [8].
Патогенез микоплазменной инфекции ДП
Инфицирование организма человека M. pneumoniaе и развитие клинически манифестных форм респираторного микоплазмоза обусловлены снижением активности иммунной системы. Возбудитель способен поражать эпителий слизистой оболочки всех отделов ДП с развитием в них перибронхиальных и периваскулярных воспалительно-инфильтративных процессов, тромбозов артериол и венул. Микоплазмы активируют процессы перекисного окисления липидов, вызывают блокаду механизмов мукоцилиарного клиренса и в итоге – гибель эпителиоцитов. Позднее происходит вовлечение в воспалительный процесс альвеолоцитов. Иммунные клеточные реакции в очагах повреждений, вызванных M. pneumonia, позволяют относить их к изменениям, протекающим по типу гиперчувствительности замедленного типа. Исходами тяжелого респираторного микоплазмоза нередко являются интерстициальный легочный фиброз, деформирующий бронхит и бронхоэктазы [9]. Присутствие в организме микоплазм негативно влияет на работу самой иммунной системы, вызывая супрессию Т-клеточного и фагоцитарного звеньев иммунитета. Параллельно происходят сдвиги в гуморальном звене, о чем свидетельствуют увеличение В-лимфоцитов (CD20+), повышение уровней IgM и циркулирующих иммунных комплексов [10]. Клинически это может выражаться развитием нереспираторных аутоиммунных проявлений микоплазмоза – миокардитом, менингоэнцефалитом, артритом, нефритом, гепатитом, иммунными цитопениями, бронхиальной астмой, синдромом Стивенса–Джонсона [8, 11].
Клиническая картина и диагностика респираторного микоплазмоза
Инкубационный период заболевания составляет от 1 до 4 недель. Период, когда возможно заражение при поражении микоплазменной инфекцией верхних ДП, – 5–7 дней, при микоплазменной пневмонии – до 2–3 недель. Выраженность клинических проявлений инфекций, вызванных M. рneumonia, достаточно вариабельна и может характеризоваться субклиническим или манифестным течением. Основным симптомом болезни является длительный, изнуряющий малопродуктивный кашель. Манифестные формы респираторного микоплазмоза могут проявляться острыми воспалительными изменениями верхних ДП: риносинусит, назофарингит, ларингит, тонзиллит, трахеит. Следует отметить, что симптоматика микоплазменных поражений верхних ДП имеет мало специфических черт и практически не отличается от респираторных инфекций другой этиологии [12, 13].
Микоплазменная инфекция нижних отделов органов дыхания сопровождается развитием воспаления бронхов и легких. Клинический дебют микоплазменного бронхита и пневмонии напоминает развитие микоплазменной инфекции верхних ДП, однако в этих случаях более длительно сохраняется фебрильная лихорадка. При этом симптомы интоксикации обычно выражены умеренно. Через несколько дней от начала заболевания появляется приступообразный, сухой и навязчивый кашель, который обычно сохраняется достаточно длительно – от нескольких недель до нескольких месяцев. Кашель обычно с течением времени усиливается и постепенно увлажняется, появляется вязкая и скудная слизисто-гнойная мокрота. При аускультации легких выслушиваются рассеянные сухие и разнокалиберные влажные хрипы [14].
Особенностью МП является скудность физикальных данных и несоответствие их выраженным рентгенологическим изменениям в легких [15].
В формуле крови лейкоцитоз отсутствует или незначительный, может определяться лейкопения, обнаруживаются умеренный лимфоцитоз, увеличение СОЭ. В подавляющем большинстве случаев пневмония протекает нетяжело, характеризуется отсутствием дыхательной недостаточности или слабой ее выраженностью. Нарушения со стороны сердечно-сосудистой системы обычно не выражены. При этом у пациентов с иммунодефицитами имеется риск развития осложнений – экссудативный плеврит, миокардит, перикардит, менингоэнцефалит, миелит, нефрит, полиартрит. Опираясь только на клинические данные, диагноз МП поставить практически невозможно, но рентгенологически данная пневмония диагностируется легко [16]. Особенностью ее является также отсутствие эффекта от традиционной стартовой антибактериальной терапии, проводимой антибиотиками группы пенициллинов или цефалоспоринов [8, 13, 15, 16].
На рентгенограммах при микоплазменном поражении бронхов отмечаются характерные признаки бронхита. Особенностью рентгенологической картины микоплазменной пневмонии являются двусторонние интерстициальные изменения, иногда сочетающаяся с лимфаденопатией средостения. При своевременной адекватной этиотропной терапии микоплазменная пневмония довольно быстро регрессирует клинически, но рентгенологическая картина сохраняется в течение 4–6 недель [16, 17].
Решающую роль в выявлении микоплазменной инфекции отводится лабораторной диагностике. Для достоверной этиологической идентификации необходимо проведение серологического исследования (иммуноферментный анализ парных образцов сыворотки крови) в комплексе с методами, основанными на выявлении ДНК микроорганизма с помощью полимеразной цепной реакции [4, 5, 8, 15, 17].
Лечение микоплазменной инфекции ДП
Центральное место в лечении респираторного микоплазмоза занимает антибактериальная терапия. Однако если инфекция ограничивается верхними ДП, можно не прибегать к антибиотикам, ограничившись только симптоматическими средствами: противокашлевыми препаратами при наличии сухого навязчивого кашля, отхаркивающими препаратами при кашле с трудноотделяемой мокротой, местными сосудосуживающими средствами при рините, антисептиками для полоскания горла, физиотерапевтическими процедурами в период реконвалесценции. Антибактериальные препараты показаны прежде всего пациентам, имеющим факторы риска осложненного течения: иммунодефицитные состояния, серповидно-клеточную анемию, синдром Дауна. Антибиотики также необходимы в случае тяжелого течения инфекции, сопровождающегося выраженными симптомами интоксикации, дыхательной недостаточностью, высокой температурой, значительным лейкоцитозом и нейтрофильным сдвигом влево при наличии гнойной мокроты. Микоплазменная пневмония является абсолютным показанием к проведению антибактериальной терапии [3, 8, 15-17].
Продолжительность антибактериальной терапии при микоплазменной пневмонии не имеет каких-либо отличительных особенностей и определяется общепринятыми критериями. При нетяжелом течении заболевания терапия антибиотиками может быть завершена по достижении стойкой нормализации температуры тела в течение 48–72 часов, при таком подходе она составляет обычно не более 7–10 дней. При тяжелой пневмонии, наличии осложнений, внелегочных очагов инфекции продолжительность применения антибактериальных средств определяется индивидуально [18].
Внелегочные проявления респираторного микоплазмоза, такие как полиморфная эритема, миелит, энцефалит, гемолитическая анемия, являются показанием к назначению препаратов группы кортикостероидных гормонов. При наличии брнхообструктивного синдрома показаны бронхолитические препараты [17].
Роль макролидов в лечении респираторного микоплазмоза
Микробиологические характеристики M. pneumoniae объясняют отсутствие эффекта от стандартной терапии β-лактамными антибиотиками, действующими на клеточную стенку бактерии, и приводят к необходимости использования препаратов, способных проникать в пораженные клетки, накапливаться в них и блокировать внутриклеточный синтез белка. Из всего арсенала антимикробных средств такими свойствами обладают макролиды, тетрациклины и фторхинолоны. Тем не менее макролиды являются средством выбора, поскольку обладают рядом положительных свойств, выгодно отличающих их от других антибиотиков. Это особенности спектра действия, удачные фармакокинетические и фармакодинамические характеристики, благоприятный профиль безопасности. Макролиды являются самой безопасной группой антибактериальных препаратов. В отличие от тетрациклинов и фторхинолонов они могут быть назначены детям, беременным и лактирующим женщинам. Использование фторхинолонов детьми возможно только по жизненным показаниям. Тетрациклины назначают детям старше 8 лет, по антимикоплазменной активности они существенно уступают другим классам антибиотиков [15, 17–19].
В то же время макролиды обладают высокой эрадикационной активностью в отношении M. pneumoniae. Их спектр антибактериальной активности включает и другие возбудители, часто находящиеся в ассоциации с микоплазмами – S. pneumoniae, включая пенициллинорезистентные штаммы, H. influenzae, C. pneumoniae, M. catarrhalis [19]. К преимуществам макролидов относятся небольшая кратность применения, возможность более коротких курсов лечения, редкое проявление нежелательных реакций. При использовании макролидов минимален риск неблагоприятного влияния на функцию почек, кроветворение, хрящевую ткань, центральную нервную систему. Тяжелые токсико-аллергические синдромы, анафилактические реакции и антибиотик-ассоциированная диарея, свойственные другим классам антимикробных препаратов, при лечении макролидными антибиотиками встречаются крайне редко [20].
Известны иммуномодулирующие свойства макролидов. Положительное влияние препаратов на показатели иммунной системы отмечается у рокситромицина, кларитромицина и азитромицина [21].
Рокситромицин – эффективный макролид в лечении микоплазменных инфекций ДП
В настоящее время для лечения инфекций верхних и нижних ДП, в т.ч. микоплазменной этиологии, успешно применяется макролидный антибиотик рокситромицин [22]. Данный препарат представляет собой полусинтетическое производное природного эритромицина, относится к 14-членным макролидам. Модификация лактонного кольца макролида привела к появлению преимуществ у рокситромицина по сравнению с эритромицином, в частности к расширению спектра антибактериальной активности за счет грамотрицательной флоры (H. influenzae, Neisseria spp., М. сatarrhalis) и улучшению показателей фармакокинетики [23].
Рокситромицин, как и все макролиды, оказывает бактериостатическое действие за счет нарушения синтеза белка микробной клеткой путем связывания молекулы препарата с 50S-субъединицей рибосомы. При этом рокситромицин способен создавать более высокие внутриклеточные концентрации по сравнению с эритромицином, что обеспечивает большую активность препарата против внутриклеточных бактерий – микоплазм. По сравнению с другими макролидами, в частности азитромицином и кларитромицином, рокситромицин не уступает им по антимикоплазменной активности [24].
Заслуживает внимания также эффективность рокситромицина в отношении других бактерий, нередко сочетающихся с M. pneumoniae. Рокситро-мицин высокоактивен в отношении S. рneumoniae, М. сatarrhalis, С. рneu-moniae, Legionella spp. По активности в отношении данных возбудителей рокситромицин не отличается от азитромицина и кларитромицина [25]. Несмотря на то что in vitro рокситромицин проявляет относительно невысокую активность в отношении H. influenzae, клиническая эффективность антибиотика у больных с инфекциями респираторного тракта, вызванными данным микроорганизмом, по данным мета-анализа контролируемых исследований составляет около 80% [26].
По данным некоторых авторов, рокситромицин обладает противовоспалительной активностью. Считается, что она может быть связана с его способностью ингибировать выработку цитокинов и антиоксидантными свойствами [27]. Согласно данным экспериментальных исследований, по выраженности противовоспалительного эффекта рокситромицин превосходит кларитромицин и азитромицин [28]. По сравнению с эритромицином при приеме внутрь рокситромицин имеет более высокую биодоступность. Он является более устойчивым к действию кислоты желудочного сока, быстрее и полнее всасывается в желудочно-кишечном тракте. Пища, как правило, не влияет на полноту абсорбции рокситромицина, но может понижать ее скорость [29].
Стандартной суточной дозой рокситромицина являются 300 мг. Причем, по данным рандомизированного исследования, которое включило 1588 пациентов с различными инфекциями, эффективность антибиотика одинаково высока вне зависимости от того, назначался ли он однократно в дозе 300 мг или в два приема по 150 мг [30]. Благодаря улучшенным параметрам абсорбции и распределению рокситромицин имеет более высокие концентрации в тканях и жидкостях организма по сравнению с другими макролидами. Высокие концентрации препарата, превышающие МПК90 для чувствительных микроорганизмов, создаются в миндалинах, придаточных пазухах носа, легких, а также в других органах и средах [31].
Рокситромицин способен в значительной степени проникать внутрь клеток, особенно в нейтрофильные лейкоциты и моноциты, стимулируя их фагоцитарную активность. Отношение концентрации антибиотика в цитоплазме нейтрофилов к концентрации во внеклеточной жидкости для рокситромицина составляет 21,9, а для эритромицина – около 6,6 [32].
Важным достоинством рокситромицина является его хорошая переносимость. Нежелательные реакции развиваются лишь у 3–4% пациентов, причем 75–80% этих случаев – легкие диспепсические явления [33]. Рокситромицин в меньшей степени, чем эритромицин, угнетает систему цитохромов Р450. Это имеет важное клиническое значение, поскольку данный препарат имеет небольшую вероятность взаимодействия с лекарственными средствами, метаболизирующимися в печени при участии микросомальных ферментов. В исследованиях не выявлено клинически значимого взаимодействия данного антибиотика с теофиллином, варфарином, оральными контрацептивами и карбамазепином [34].
На сегодняшний день российский фармацевтический рынок предлагает несколько торговых наименований препарата рокситромицин. Следует помнить о том, что эффективность и безопасность фармакотерапии во многом определяются качеством производства лекарственного средства. Одним из наиболее качественных генериков рокситромицина является немецкий препарат Эспарокси, биоэквивалентный оригинальному средству и находит широкое применение в Европе. Необходимо отметить выгодные фармакоэкономические характеристики данного препарата. При западноевропейском качестве стоимость Эспарокси ниже, чем у оригинального препарата и других генериков, поэтому лечение им инфекций ДП различной, в т.ч. микоплазменной, этиологии является эффективным, безопасным и экономически оправданным.
Литература
Об авторах / Для корреспонденции
Урогенитальная хламидийная инфекция, по данным ВОЗ, является одной из самых распространенных инфекций, передаваемых половым путем. Особенности клинического течения (скудная симптоматика или ее полное отсутствие как у мужчин
Урогенитальная хламидийная инфекция, по данным ВОЗ, является одной из самых распространенных инфекций, передаваемых половым путем. Особенности клинического течения (скудная симптоматика или ее полное отсутствие как у мужчин, так и у женщин) и трудности лабораторной диагностики приводят к тому, что инфицированные лица обращаются к специалистам несвоевременно. Это затрудняет лечение и увеличивает риск развития осложнений.
Профессор А. Л. Машкиллейсон еще в 80-х гг. прошлого века указывал на необходимость выбора терапевтической тактики с учетом клинической формы хламидиоза. Это положение не потеряло своей актуальности до сегодняшнего дня. Современная классификация урогенитального хламидиоза, согласно МКБ-Х, подразумевает деление на хламидийную инфекцию нижних отделов (неосложненную) и инфекцию верхних отделов мочеполового тракта (осложненную). Терапевтический подход к лечению каждой из этих форм различается.
- наличие инфекции в организме (в течение многих месяцев и даже лет);
- многократное неэффективное лечение различными антибиотиками;
- иммунологические нарушения;
- высокие титры сывороточных и местно-секретируемых противохламидийных антител (в особенности IgA);
- возможное отсутствие хламидийной инфекции у половых партнеров больных хламидиозом, несмотря на половые контакты без использования презерватива.
Таким образом, терапевтические подходы к лечению урогенитального хламидиоза можно разделить на три основные группы:
1) лечение больных с хламидийной инфекцией нижних отделов урогенитального тракта;
2) лечение больных с хламидийной инфекцией верхних отделов урогенитального тракта;
3) лечение больных персистирующим и рецидивирующим урогенитальным хламидиозом.
Во всех этих изданиях для антибактериальной терапии хламидийной инфекции рекомендуются антибиотики следующих фармакологических групп: тетрациклины, макролиды и фторхинолоны. Ниже мы постараемся пояснить различия в терапевтических подходах к лечению различных форм урогенитальной хламидийной инфекции.
Лечение больных хламидийной инфекцией нижних отделов урогенитального тракта
При лечении этой формы инфекции, как правило, достаточно одной лишь антибактериальной терапии и нет необходимости в дополнительных терапевтических мероприятиях.
Антибиотики тетрациклинового ряда
Препараты тетрациклинового ряда — это основные лекарственные средства, применяемые для лечения больных хламидиозом. Согласно всем упоминавшимся выше рекомендациям, для лечения больных урогенитальным хламидиозом препаратом выбора является доксициклин. Он назначается в дозе 100 мг два раза в сутки не менее семи дней. Первая доза составляет 200 мг. Преимущество использования доксициклина в его достаточно высокой эффективности (по данным литературы, 95—100%) и относительно небольшой стоимости лечения. У больных хламидиозом можно использовать другие препараты этой группы: тетрациклин (препарат рекомендуется ФР в качестве альтернативного) — по 500 мг четыре раза в сутки 7—10 дней, метациклин — по 300 мг четыре раза в сутки 7—10 дней.
У доксициклина, по сравнению с тетрациклином, выше биодоступность, он имеет более длительный период полувыведения и лучше переносится. Кроме того, при использовании доксициклина, и в этом его отличие от других тетрациклинов, нет необходимости соблюдать диету, назначаемую из-за связывания тетрациклинов с ионами Са. Следует помнить, что все препараты тетрациклинового ряда противопоказаны при почечной недостаточности, беременности и для лечения детей до восьми лет. Наиболее частыми побочными эффектами при приеме лекарственных средств тетрациклинового ряда являются тошнота, рвота, диарея, аллергические реакции. В период лечения препаратами этой группы больным необходимо избегать инсоляции из-за возможности фотосенсибилизации.
Макролиды
К числу наиболее активных противохламидийных препаратов принадлежат макролиды. К препаратам выбора при лечении хламидиоза относят азитромицин. Высокая терапевтическая концентрация азитромицина в тканях достигается после однократного приема стандартной дозы антибиотика и сохраняется в местах воспаления не менее семи суток. ФР и другие руководства рекомендуют для лечения больных хламидиозом нижних отделов мочеполового тракта однократный прием 1,0 г азитромицина за 1 ч до еды или через 2 ч после.
В качестве альтернативных препаратов в ФР представлены: спирамицин который назначается по 3 млн МЕ три раза в сутки в течение 10 дней; рокситромицин — по 150 мг два раза в сутки 10 дней; эритромицин — по 500 мг четыре раза в сутки 10 дней. Также при лечении больных хламидийной инфекцией используют другие препараты группы макролидов: джозамицин — по 500 мг два раза в сутки 10 дней, кларитромицин — по 250 мг два раза в сутки 10 дней, мидекамицин — по 400 мг три раза в сутки 10 дней. Преимуществами всех современных макролидных антибиотиков перед эритромицином являются улучшенная фармакокинетика, хорошая переносимость и меньшая кратность приема.
При приеме макролидов могут наблюдаться побочные эффекты со стороны желудочно-кишечного тракта (тошнота, рвота, диарея) и печени (повышение активности трансаминаз, холестаз, желтуха). Разумеется, возможны и аллергические реакции.
Фторхинолоны
Следующую группу препаратов, обладающих противохламидийной активностью, составляют фторхинолоны. Препаратам той группы свойственна различная, в том числе и достаточно высокая, чтобы излечивать эту инфекцию, активность in vitro в отношении Chlamydia trachomatis. Однако единственным препаратом данной группы, который современные руководства рекомендуют для лечения хламидиоза, да и то в качестве альтернативного, является офлоксацин. Его назначают по 400 мг два раза в день в течение 10 дней. Преимуществом офлоксацина перед другими фторхинолонами можно считать его практически 100-процентную биодоступность.
Из других препаратов этой группы применяют пефлоксацин — по 400 мг два раза в сутки 10 дней и ломефлоксацин — по 400 мг один-два раза в сутки 10 дней.
Такие ограничения в использовании фторхинолонов для лечения хламидийной инфекции связаны с тем, что в сравнении с антибиотиками других вышеперечисленных групп после подобной терапии слишком высок процент рецидивов.
Показанием к использованию фторхинолонов при хламидиозе может быть смешанная гонорейно-хламидийная инфекция или сочетание Chlamydia trachomatis с другими микроорганизмами, демонстрирующими чувствительность к этим антибиотикам (требующая терапии сопутствующая кокковая или палочковая флора).
Группа фторхинолонов является сегодня одним из наиболее активно развивающихся классов противомикробных препаратов. Появляются все новые и новые поколения фторхинолонов. Хинолоны последних поколений (III и IV) превосходят предшествующие препараты этой группы по активности в отношении хламидий и кратности применения.
Препараты из группы фторхинолонов противопоказаны беременным и детям до 12 лет, больным с нарушением функции печени и почек. Из побочных реакций после приема фторхинолонов могут наблюдаться диспептические расстройства, тошнота, рвота, головокружение, аллергические реакции, тендиниты. Для всех препаратов этой группы, за исключением моксифлоксацина, характерен фотосенсибилизирующий эффект, о чем необходимо напоминать больному.
Лечение хламидиоза у беременных и новорожденных
В огромном числе наблюдений, проводившихся за почти 50 лет существования эритромицина, показана его безопасность, благодаря чему этот антибиотик можно считать едва ли не единственным лекарственным средством, разрешенным к применению у беременных и новорожденных.
По всем существующим сегодня рекомендациям, включая рекомендации ФР, беременным женщинам эритромицин назначают по 500 мг четыре раза в сутки 7 дней или по 250 мг четыре раза в сутки 14 дней. Для детей до 8 лет (с массой тела до 45 кг) разовая доза составляет 50 мг на 1 кг массы тела, кратность — каждые 6 ч в течение 10—14 дней. Детям старше 8 лет назначают такой же курс эритромицина, как и взрослым.
Достаточно высокой терапевтической эффективностью и лучшей, чем у эритромицина, переносимостью обладает еще один давно известный представитель макролидов — спирамицин. Его назначают по 3 млн МЕ три раза в сутки 7—10 дней.
Лечение больных с хламидийной инфекцией верхних отделов урогенитального тракта
При лечении больных с данной клинической формой хламидийной инфекции используют все перечисленные выше антибиотики, но менее продолжительными курсами (до трех недель), чем при неосложненных формах заболевания. Более удобен в этих случаях азитромицин, который ФР рекомендует назначать курсами: три курса по 1 г один раз в неделю.
В многоцентровом исследовании, проведенном в различных регионах России (г. Екатеринбург, Ставрополь и Москва), была показана высокая эффективность такой схемы применения азитромицина при осложненных формах хламидиоза (применялся препарат сумамед фирмы ПЛИВА, Хорватия), что и позволило внести соответствующие дополнения в рекомендации.
Лечение больных с осложненной формой хламидийной инфекции должно быть комплексным, поскольку процесс связан не только с наличием инфекции, но и с теми неблагоприятными последствиями, которые она вызывает при длительном течении болезни. Поэтому для достижения клинического излечения назначение антибактериальных препаратов в таких случаях должно сочетаться с комплексом противовоспалительных, симптоматических и физиотерапевтических мероприятий, выбор которых зависит от характера патологии.
Лечение больных с персистирующим и рецидивирующим урогенитальным хламидиозом
Персистенция хламидий требует особого подхода к больному. Применения одних антибиотиков при этой форме инфекции, как правило, недостаточно, поскольку все эффективные в отношении хламидий антибиотики обладают бактериостатическим действием и способны оказывать эффект только в процессе осуществления жизненного цикла хламидий. Поскольку при персистенции данный жизненный цикл приостанавливается на неопределенное время, использование антибиотиков в этот период не способно привести к гибели микроорганизмов, остановившихся в своем развитии. Однако лечить данную инфекцию необходимо, так как сохранение хламидий в организме может сопровождаться иммунными нарушениями, что ведет к различным осложнениям, в частности бесплодию.
При лечении таких состояний обычно рекомендуют сочетанную терапию антибиотиками и иммунокорректорами. Были предложения назначать антибиотики в различных сочетаниях длительными курсами. Последний подход имеет существенные отрицательные стороны: длительный прием антибиотиков неблагоприятно воздействует на работу всех систем организма: желудочно-кишечный тракт (нарушая работу печени и микроэкологию кишечника), нервную, мочевыделительную, иммунную (угнетая иммунитет и аллергизируя организм больного) системы. Кроме того, при персистирующей инфекции антибиотики в качестве монотерапии вообще могут быть неэффективны, исходя из особых биологических свойств возбудителя, о чем уже говорилось выше.
Наши исследования показали, что примерно у 75% больных персистирующим хламидиозом встречаются различные нарушения иммунного статуса. Они выражаются, в первую очередь, в изменении числа CD4+ и CD8+ Т-клеток и нарушении их соотношения примерно у 50% больных. По сравнению с контрольной группой, у больных наблюдается статистически достоверное снижение относительных и абсолютных показателей естественных киллеров (CD16+) (что очень важно с точки зрения продукции интерферона), HLA DR-клеток, В-клеток (CD72+ и CD21+).
Наши наблюдения, основанные на лечении более 1000 больных персистирующим хламидиозом, показывают, что наиболее оптимальна в этих случаях комбинированная терапия, основанная на сочетании антибиотиков и иммунных препаратов. При антибиотикотерапии используют стандартные для осложненной инфекции курсы и дозировки перечисленных выше антибиотиков. Но начинать лечение желательно с курса иммунотерапии. Из иммунных препаратов наибольшей эффективности можно добиться, применяя полиоксидоний и a-интерферон. На основании собственных исследований мы предлагаем следующие варианты предшествующей назначению антибиотиков иммунотерапии:
- полиоксидоний назначается по 6 мг в/м один раз в сутки; первые две инъекции ежедневно, затем три инъекции через день, остальные два раза в неделю, всего на курс 10 инъекций. После четвертой инъекции начинают курс антибактериальной терапии;
- интерферон альфа-2b назначается в виде ректальных суппозиториев двумя 5-ти дневными циклами с интервалом в две недели между ними в суммарной дозе 10 млн МЕ на курс. После окончания иммунотерапии проводится курс антибактериальной терапии. Причем оптимальным в этой ситуации оказался курс азитромицина по схеме лечения осложненных форм (по 1,0 г на 1-й, 7-й и 14-й дни).
Указанные подходы позволяют повысить эффективность лечения персистирующей и рецидивирующей хламидийной инфекции до 90%.
В ближайшие две недели после окончания лечения следует использовать метод выделения хламидий в культуре клеток, потому что только он дает возможность определить наличие в организме пациента жизнеспособных форм хламидий. Положительный результат остальных методов, включая полимеразую цепную реакцию (ПЦР) или прямую иммунофлюоресценцию (ПИФ), не обязательно говорит о том, что лечение было неэффективным, а может рассматриваться лишь как свидетельство того, что не произошла полная элиминация хламидий или их фрагментов. Следовательно, эти методы позволяют судить об эффективности проведенного лечения не ранее чем через 30 дней после окончания антибиотикотерапии.
Таким образом, соблюдение определенных правил ведения больных с урогенитальным хламидиозом позволяет добиваться полного излечения даже в тех ситуациях, когда хламидии сохраняются у пациента в течение продолжительного времени, а сам инфекционный агент оказывается устойчив к обычной антибактериальной терапии.
М. А. Гомберг, доктор медицинских наук
А. М. Соловьев, кандидат медицинских наук
ЦНИКВИ, МГМСУ, г. Москва
Ноников В.Е.
ФГУ “ЦКБ с поликлиникой” УД Президента РФ, Москва
Рассматриваются принципы диагностики пневмоний с позиций доказательной медицины. Приведены данные об этиологии внебольничных пневмоний. Подчеркивается, что особенностью современной эпидемиологической обстановки является значительное увеличение частоты микоплазменных и хламидийных заболеваний нижних отделов дыхательных путей. Рассмотрены вопросы выбора антибиотика первого ряда для лечения пневмоний. Изложены особенности спектра действия и особенности применения макролидов, которые широко используются в поликлиниках и стационарах. Представлены преимущества диспергируемой формы джозамицина (Вильпрафена солютаба). Сформулированы программы антибактериальной терапии внебольничных пневмоний на дому и в условиях стационара. Приведены собственные данные по многолетнему опыту лечения пневмоний.
Пневмония относится к числу распространенных заболеваний и занимает 4–5-е места в структуре смертности развитых стран. Летальность при пневмониях составляет 2–5 % и возрастает до 15–20 % среди лиц пожилого и старческого возраста. Основу эффективного лечения пневмоний составляет антибактериальная химиотерапия. Повсеместное распространение получила сугубо прагматическая дифференциация пневмоний на внебольничные, развившиеся вне стен стационара, и внутрибольничные, или госпитальные [3–6]. Столь условное деление пневмоний является оправданным, потому что различаются их этиологические агенты. Суждение о месте развития пневмонии врач может вынести незамедлительно после сбора анамнеза и, следовательно, более обоснованно подойти к выбору антибактериального средства.
Этиология и проблемы диагностики
Внебольничные пневмонии (ВП) обычно вызываются пневмо-, стрептококками, гемофильными палочками. В последние годы повысилась эпидемиологическая значимость таких агентов, как микоплазма, хламидии, легионелла. Эти внутриклеточные инфекции передаются воздушно-капельным путем. Рост их частоты обусловлен значительным увеличением числа зарубежных поездок граждан нашей страны и усилением миграционных процессов. Факторами риска возникновения воздушно-капельных инфекций являются авиаперелеты и системы кондиционирования воздуха. У молодых лиц ВП чаще вызываются моноинфекцией, а у лиц старше 60 лет – ассоциациями возбудителей, 3/4 которых представляют собой сочетание грамположительной и грамотрицательной флоры [1].
Принято выделять ряд клинических ситуаций, при которых развитие ВП чаще обусловлено определенными агентами. У лиц молодого возраста, не отягощенных сопутствующими заболеваниями, ВП часто вызывают пневмококки, а также микоплазма и хламидии в силу большей социальной активности. У лиц старше 60 лет при ВП из мокроты обычно выделяют пневмококки и гемофильные палочки. При предшествующих заболеваниях, особенно у лиц, страдающих хронической обструктивной болезнью легких, вероятными патогенами являются пневмококки, гемофильные палочки, моракселла. Развитие пневмонии в условиях семейной вспышки острой респираторно-вирусной инфекции настораживает в отношении не только вирусной природы заболевания, но и таких агентов, как микоплазма и хламидии. При контактах с птицами высока вероятность хламидийной инфекции, причем следует учитывать, что значительная часть городских голубей инфицирована этим патогеном. Аспирационный синдром нередко является причиной пневмонии, вызванной грамотрицательной флорой и/или анаэробами.
Диагностика пневмонии обычно [2, 6] основывается на таких признаках, как повышение температуры до фебрильных и субфебрильных цифр, кашель (чаще с отделением мокроты); реже отмечаются озноб, плевральная боль, одышка. При долевых пневмониях выявляются признаки консолидации легочной ткани – укорочение перкуторного звука, бронхиальное дыхание, усиление голосового дрожания. Наиболее часто при аускультации выявляются локальные мелкопузырчатые хрипы или характерный феномен крепитации. У лиц пожилого и старческого возраста классические проявления пневмонии могут отсутствовать. Возможны лихорадка, гипотермия, спутанность сознания, одышка (или сочетание этих симптомов).
Внелегочные проявления помогают пониманию природы болезни. Так, буллезный отит и полиморфная эритема характерны для микоплазмоза, узловатая эритема часто наблюдается при туберкулезе, ретинит типичен для цитомегаловирусной инфекции и токсоплазмоза, кожные сыпи обычны при кори и ветряной оспе.
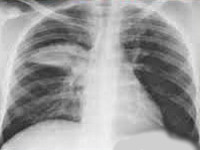
Диагноз пневмонии подтверждается данными рентгенологического исследования, проведение которого значительно уменьшает вероятность диагностических ошибок. При рентгенографии легких выявляются инфильтративные изменения легочной паренхимы, устанавливается локализация и распространенность воспалительного процесса. При вирусных и микоплазменных ВП у части больных рентгенологически выявляются интерстициальные воспалительные изменения, которые иногда описываются как “усиление рисунка”. Рентгенологическое исследование выявляет и такие осложнения пневмонии, как плеврит и абсцедирование.
Типичными являются изменения лейкоцитарной формулы: лейкоцитоз более 10,0 х 1000/мкл, сдвиг лейкоцитарной формулы влево (более 10 % палочкоядерных нейтрофилов), токсическая зернистость нейтрофилов. Следует отметить, что при микоплазменных и хламидийных пневмониях нередко воспалительные сдвиги в лейкоцитарной формуле минимальны или могут отсутствовать. При ВП повышается уровень С-реактивного белка, фибриногена.
Для установления этиологии пневмонии проводят посев мокроты, что обеспечивает точную диагностику, если осуществляется до начала антибактериальной терапии. Бактериологические исследования не позволяют выявить внутриклеточные агенты (микоплазму, хламидии и легионеллу) и для идентификации этих возбудителей применяют серотипирование – определение в сыворотке крови специфических антител к этим микроорганизмам.
Антибактериальная терапия
Существенным является тот факт, что врач может оценить клиническую ситуацию (эпидемиологические, клинические и рентгенологические особенности, предшествующие заболевания, факторы риска) значительно раньше, чем будут получены лабораторные данные, касающиеся этиологического фактора. Даже в условиях современного клинического стационара лишь у половины больных пневмонией удается достоверно расшифровать этиологию, причем этиологическая диагностика может длиться до 10–14 дней (максимальные сроки выделения гемокультуры или определение антител в парных сыворотках). Поэтому почти всегда выбор антибиотика первого ряда осуществляется эмпирически. Правильное суждение о природе заболевания является решающим при назначении препарата, потому что спектр действия антибактериальных средств хорошо известен. При этом всегда необходимо учитывать аллергологический анамнез.
В последние годы стала проблемой приобретенная резистентность к антибиотикам. Причинами этого явления являются неправильный выбор антибиотика, использование препаратов в недостаточной суточной и курсовых дозах, а также частое и необоснованное применение антибактериальных средств. Во многих регионах нашей страны отмечаются значительные уровни резистентности к тетрациклинам и ко-тримоксазолу (Бисептолу) из-за многолетнего шаблонного применения этих препаратов.
Максимальная эффективность антибиотиков отмечается в тех случаях, когда препарат активен в отношении возбудителя ВП, создает достаточные концентрации в очаге инфекции и действующие концентрации поддерживаются в течение необходимого времени. При лечении госпитализированных больных ВП чаще всего назначают цефалоспорины III поколения, несколько реже – макролиды. Третье место по частоте применения занимают фторхинолоны. В амбулаторной практике чаще всего используют макролиды и фторхинолоны. Д
ля амбулаторного лечения ВП рекомендуется пероральная терапия макролидами, цефалоспоринами, респираторными фторхинолонами и аминопенициллинами, усиленными ингибиторами β-лактамаз [3–5]. Оптимальными антибиотиками для подавления внутриклеточных агентов (легионеллы, микоплазмы, хламидий) являются макролиды, которые одновременно являются и альтернативными препаратами лечения стрептококковой (пневмококковой) инфекции у лиц с аллергией на β-лактамы. В зависимости от числа атомов углерода в кольце макролиды разделяют на 14-членные (кларитромицин, рокситромицин, эритромицин), 15-членные (азитромицин) и 16-членные (джозамицин, мидекамицин, спирамицин). Все макролиды подавляют пневмо-, стрепто-, стафилококки и внутриклеточные агенты. Считается, что азитромицин и кларитромицин активны и в отношении гемофильных палочек. Макролиды создают высокие концентрации в легочной паренхиме и макрофагах. Доказано, что макролиды обладают постантибиотическим эффектом, т. е. после отмены препарата в легочной паренхиме сохраняется эффективная концентрация антибиотика. Это в наибольшей степени доказано в отношении азитромицина, что определило ряд рекомендаций по 5-дневной терапии ВП этим антибиотиком. Азитромицин принимают один раз в сутки по 500 мг. Кларитромицин назначают по 500 мг 2 раза в сутки, а его пролонгированную форму (Клацид СР) – по 1,0 г один раз в сутки.
Значительный интерес представляют диспергируемые таблетки джозамицина (Вильпрафен солютаб), которые можно принимать как в виде таблеток по 1,0 г каждые 12 часов, так и в растворе (таблетки Вильпрафена солютаба легко растворяются в воде). Диспергируемые таблетки обеспечивают равномерность и стабильность всасывания, что создает предсказуемую клиническую эффективность. Для этого препарата характерна более высокая активность в отношении некоторых стрептококков и стафилококков по сравнению с 14и 15-членными макролидами [3]. При применении этой лекарственной формы снижается время нахождения препарата в кишечнике, что уменьшает риск развития побочных эффектов со стороны желудочно-кишечного тракта. Таким образом, технология солютаб улучшает биодоступность, тем самым повышая эффективность, и уменьшает побочные эффекты. Джозамицин считается [3–4] наиболее безопасным для лечения беременных.
В своей практике мы чаще всего применяем азитромицин, кларитромицин и Вильпрафен солютаб. Последний из перечисленных макролидов особенно удобен для лиц пожилого и старческого возраста, которые предпочитают принимать таблетки, растворенные в воде. По тем же показаниям, что и макролиды, могут назначаться тетрациклины (доксициклин), однако следует помнить о нередкой резистентности грамположительной флоры к этому препарату.
Если есть предположение, что причиной пневмонии является смешанная флора, логично использовать амоксициллин/клавуланат по 1000 мг 2 раза в сутки. Недостатком β-лактамных антибиотиков является то, что они не подавляют внутриклеточные агенты.
В последние годы значительный интерес вызывают фторхинолоны последних поколений, к которым относятся доксициклин и моксифлоксацин. Эти препараты эффективно подавляют грамположительные микроорганизмы, их применение высокоэффективно в отношении внутриклеточных микроорганизмов – легионелл, микоплазм, хламидий. Левофлоксацин дозируется по 500 мг/сут, а моксифлоксацин по 400 мг/ сут. Из-за широкого спектра действия в отношении актуальных для пульмонологии патогенов эти фторхинолоны получили название “респираторных” и также рекомендуются [4–5] в качестве препаратов для лечения ВП.
В отношении анаэробной флоры, нередко ответственной за аспирационные пневмонии, активны метронидазол, клиндамицин, цефепим, карбапенемы. Пневмоцистные пневмонии лучше всего лечить ко-тримоксазолом (Бисептолом).
Больные ВП подлежат госпитализации при среднетяжелом и тяжелом течении заболевания, при наличии серьезных фоновых заболеваний, пожилом и старческом возрасте, по социальным показаниям. Жизненной необходимостью в таких ситуациях является подавление всех возможных возбудителей пневмонии, потому что в случае ошибки при выборе антибиотика исход терапии может быть фатальным. При госпитализации больных ВП мы назначаем им парентерально цефалоспорины III–IV поколений (цефотаксим, цефтриаксон, цефепим) в сочетании с пероральным приемом макролидов (азитромицин, кларитромицин, Вильпрафен солютаб) или цефалоспорины III–IV поколений парентерально в сочетании с ципрофлоксацином. В последующем, при улучшении состояния больного, уточнении клинической ситуации или возбудителя пневмонии, объем антибактериальной химиотерапии уменьшается до необходимого минимума. Такой подход к лечению пневмоний тяжелого течения общепризнан [3–5] и называется “деэскалационной антибактериальной терапией”. Эта тактика не может применяться при аллергии к β-лактамным антибиотикам: в такой клинической ситуации (при тяжелом течении пневмонии) назначают внутривенную терапию левофлоксацином или ципрофлоксацином по 400 мг 2 раза в сутки.
При лечении ВП мы нередко применяем ступенчатую антибактериальную терапию, которая начинается [1, 2, 4] с парентерального (обычно внутривенного) применения антибиотика в течение 2– дней. При улучшении состояния пациент продолжает терапию, используя антибиотик перорально. Применение антибактериальных химиопрепаратов в режиме ступенчатой терапии позволяет обеспечить эффективную терапию, экономически более рентабельную по сравнению с парентеральным применением антибиотиков.
При неосложненной ВП длительность антибактериальной терапии составляет 7–0 дней. Пневмонии, вызванные внутриклеточными микроорганизмами, требуют более длительного применения антибиотиков. При микоплазменной и хламидийной ВП длительность антибактериальной терапии составляет 14, а при легионеллезе –21 день.
Клинический опыт показывает, что эмпирическая антибактериальная терапия пневмоний должна быть ранней и ориентированной на подавление широкого спектра потенциальных этиологических агентов. От правильного выбора антибактериальных препаратов первого ряда во многом зависят результаты лечения.
Информация об авторе:
Ноников Владимир Евгеньевич – доктор медицинских наук, профессор, заведующий отделением
пульмонологии ФГУ “ЦКБ с поликлиникой” УД Президента РФ.
Тел. 8 (495) 414-06-83, e-mail: nonikov@cch.p
Хламидийная пневмония – это инфекционно-воспалительный процесс в легких, вызванный облигатными внутриклеточными бактериями рода Chlamydia и Chlamydophila. Для хламидийной пневмонии характерны респираторные проявления (ринит, трахеобронхит), малопродуктивный кашель, субфебрильная и фебрильная температура, внелегочные симптомы (артралгия, миалгия). При постановке диагноза учитываются аускультативные и рентгенологические данные, однако решающая роль принадлежит лабораторной диагностике (ИФА, МИФ, ПЦР и др.). Для терапии хламидийной пневмонии применяются антимикробные средства (макролиды, тетрациклины, фторхинолоны), иммуномодуляторы, физиопроцедуры.
МКБ-10
Общие сведения
Хламидийная пневмония – этиологическая разновидность атипичной пневмонии, возникающая при инфицировании дыхательных путей различными видами хламидий - Ch. рneumoniae, Ch. psittaci и Ch. trachomatis. Считается, что ежегодно среди внебольничных пневмоний от 5 до 15% случаев вызываются хламидиями; во время эпидемических вспышек этот показатель может составлять 25%. Чаще всего заболевают взрослые, случаи хламидийной пневмонии у новорожденных связаны с заражением от матерей, больных урогенитальным хламидиозом.
Бессимптомное носительство хламидий в носоглотке определяется более чем у половины взрослых и 5-7% детей, поэтому вероятность передачи инфекции с респираторными секретами очень высока. Описаны внутрисемейные вспышки хламидийной пневмонии, а также случаи массовой заболеваемости в изолированных коллективах.

Причины
Характеристика возбудителя
Из всего многообразия представителей семейства Chlamydiaceae в этиологическом отношении практический интерес для пульмонологии представляют три типа хламидий: Chlamydophila pneumoniae, Сhlamydia trachomatis и Chlamydophila psittaci.
- Ch. pneumoniae служит самым частым возбудителем респираторных хламидиозов (в том числе хламидийного фарингита, синусита, бронхита, пневмонии) у пациентов всех возрастов.
- С Сh. trachomatis связана заболеваемость трахомой, мочеполовым хламидиозом, венерической лимфогранулемой, а также хламидийной пневмонией среди новорожденных и грудничков до 6 месяцев. Также с этим типом хламидий ассоциированы пневмонии у иммунокомпрометированных лиц и сотрудников лабораторий.
- Ch. psittaci рассматривается как возбудитель орнитоза (пситтакоза), часто протекающего в форме тяжелой интерстициальной пневмонии.
Механизм передачи
Пути заражения каждой разновидностью хламидий отличаются, однако все типы могут распространяться гематогенным путем. Передача Ch. pneumoniae от человека к человеку осуществляется преимущественно воздушно-капельным и контактно-бытовым путями. Инфицирование штаммом Ch. psittaci происходит воздушно-пылевым или фекально-оральным путем при вдыхании пыли или употреблении пищи, содержащей биологические секреты птиц-переносчиков инфекции (попугаев, канареек, кур, уток, голубей, воробьев и др.).
Инфицирование новорожденных Ch. trachomatis происходит в процессе родов от матерей с урогенитальной хламидийной инфекцией. При интранатальном заражении у 15-25% младенцев возникает хламидийный назофарингит и конъюнктивит, которые часто осложняются пневмонией.
Патогенез
Все хламидии являются облигатными грамотрицательными микроорганизмами, паразитирующими внутри клеток хозяина. В макроорганизме хламидии могут существовать в инфекционной форме (элементарные тельца) и вегетативной форме (ретикулярные тельца). Элементарные тельца проникают внутрь клетки путем стимуляции эндоцитоза, где преобразуются в ретикулярные тельца. Последние обладают высокой метаболической активностью и способностью к внутриклеточному бинарному делению.
Цикл размножения длится около 48 часов, после чего ретикулярные тельца вновь превращаются в элементарные, происходит разрыв мембраны клетки хозяина с выходом элементарных телец новой генерации во внеклеточную среду. Далее цикл инфицирования новых клеток повторяется.
Симптомы хламидийной пневмонии
Пневмония, вызванная Chlamydophila pneumoniae
Хламидийной пневмонией, вызванной Ch. pneumoniae, чаще болеют дети и молодые люди в возрасте от 5 до 35 лет. Среди причин внебольничной пневмонии в этой возрастной группе хламидии уступают только Mycoplasma pneumoniae.
Начало болезни острое или постепенное. В первом случае симптомы интоксикации и поражения дыхательных путей достигают максимальной выраженности уже на 3-и сутки. При подостром течении хламидийная пневмония манифестирует с респираторного синдрома (ринита, назофарингита, ларингита), познабливания, субфебрилитета, в связи с чем в первую неделю болезни у пациентов ошибочно диагностируется ОРЗ. Главным образом, больных беспокоит заложенность носа, нарушением носового дыхания, умеренные слизистые выделения из носа, осиплость голоса.
Пневмония, вызванная Сhlamydia trachomatis
Начало часто постепенное; у детей хламидийной пневмонии нередко предшествует конъюнктивит, острый средний отит или бронхит этой же этиологии. Ранним признаком становится сухой кашель, который, усиливаясь, приобретает приступообразный характер. На фоне кашлевых приступов у ребенка возникает тахипноэ, цианоз и рвота, однако репризы отсутствуют. Постепенно отмечается усугубление одышки, увеличение ЧД до 50-70 в минуту, дыхание становится кряхтящим. Вместе с тем, общее состояние обычно остается удовлетворительным, симптомы интоксикации и дыхательная недостаточность выражены слабо.
Аускультативная и рентгенологическая картина двусторонней хламидийной пневмонии разворачивается к исходу первой – в начале второй недели. В разгар заболевания могут появиться симптомы энтероколита, гепатоспленомегалия. Выздоровление часто затягивается на многие недели и месяцы. При тяжелых формах хламидийной пневмонии может возникать пневмоторакс, плеврит, абсцедирование. Из внелегочных осложнений встречаются миокардиты, эндокардиты, менингоэнцефалиты. Дети, перенесшие хламидийную пневмонию, вызванную Ch. trachomatis, в дальнейшем чаще страдают бронхиальной астмой и другими хроническими обструктивными заболеваниями легких.
Пневмония, вызванная Chlamydophila psittaci (Орнитоз)
Варианты клинического течения орнитоза различны – от бессимптомного до тяжелого. Самым ярким симптомом выступает высокая (до 39,5-40°С и выше) температура тела, сопровождающаяся ознобами и сильнейшей интоксикацией (резкой слабостью, головной болью, артралгиями, миалгиями). В отсутствие других симптомов данное состояние нередко расценивается как лихорадка неясного генеза.
В дальнейшем более чем в половине случаев возникает малопродуктивный кашель, боль в груди, увеличение печени и селезенки. Характерными признаками, указывающими на хламидийную этиологию пневмонии, служат признаки нейротоксикоза, пятнистая сыпь на коже, носовые кровотечения. Часто возникают расстройства пищеварения: тошнота, рвота, абдоминальные боли, поносы или запоры.
Клинико-рентгенологические изменения могут сохраняться в течение 4-6 недель. Типичными осложнениями орнитоза выступают гепатит, ДВС-синдром, венозные тромбозы, гемолитическая анемия, полиневропатии, миокардит.
Диагностика
Затруднения при установлении этиологического диагноза связаны с тем, что в отличие от бактериальных пневмоний, при хламидийной пневмонии отсутствуют отчетливые физикальные и рентгенологические признаки, а также характерные изменения в периферической крови. В этих условиях терапевтам и пульмонологам приходится ориентироваться, главным образом, на указания анамнеза, особенности клинической картины и подтверждать свои подозрения лабораторными методами (ИФА, ПЦР и др.).
- Физикальный осмотр. Аускультативные данные вариабельны: дыхание может быть жестким, бронхиальным или ослабленным везикулярным; хрипы в разгар заболевания чаще влажные или крепитирующие. Перкуторный звук обычно притуплен.
- Рентгенография. При рентгенографии легких выявляется очаговая, сегментарная или долевая инфильтрация либо интерстициальные изменения.
- Лабораторная диагностика. Наиболее специфичным и чувствительным является культуральный метод выделение возбудителя, однако из-за длительности и трудоемкости диагностики на практике обычно ограничиваются серотипированием. Стандартом на сегодняшний день служат ИФА и МИФ (реакция микроиммунофлюоресценции). При проведении ИФА на активность хламидийной инфекции указывает повышение титра специфических IgМ, IgG и IgА более 1:16, 1:512 и 1:256 соответственно; МИФ - повышение титра IgG/IgА в парных сыворотках крови в 4 и более раз. ПЦР-анализ позволяет быстро и безошибочно идентифицирвоать ДНК возбудителя, однако не позволяет отличить персистирующую инфекцию от активной.
Дифференциальную диагностику хламидийной пневмонии следует проводить с гриппом, коклюшем; вирусной, микоплазменной, легионеллезной, грибковой пневмонией и другими атипичными легочными инфекциями.
Лечение хламидийной пневмонии
Сложность эффективного лечения хламидийной пневмонии сопряжена с тем, что хламидии присутствуют в организме одновременно как во внеклеточных, так и внутриклеточных формах, поэтому необходимо воздействовать на оба этих звена. Кроме этого, активизация инфекции, как правило, происходит на фоне угнетения иммунитета, что также требует коррекции иммунного ответа.
Средствами эрадикационной терапии при хламидийной пневмонии признаны антимикробные препараты из групп макролидов, фторхинолонов и тетрациклинов. Наиболее предпочтительны среди них макролиды, т. к. могут применяться для терапии новорожденных, детей и беременных. Из препаратов этой группы наибольшей активностью в отношении хламидий обладают кларитромицин, джозамицин, эритромицин, спирамицин.
Также успешно справляются с хламидийной инфекцией фторхинолоны (ципрофлоксацин, офлоксацин, левофлоксацин) и тетрациклины (доксициклин, моноциклин), однако прием последних исключается при беременности и печеночной недостаточности. Длительность курса противомикробного лечения хламидийной пневмонии составляет не менее 2–3 недель.
С целью коррекции иммунологических расстройств, а также предупреждения рецидива инфекции, помимо антимикробных средств, назначаются иммуномодуляторы, витамины, пробиотики. В период реконвалесценции большое внимание уделяется физиотерапии, дыхательной гимнастике.
Прогноз
У пациентов молодого возраста с отсутствием сопутствующей патологии хламидийная пневмония обычно оканчивается выздоровлением. Среди пожилых летальные исходы возникают в 6-10% случаев. Наблюдения специалистов указывают на возможную этиологическую роль Ch. pneumoniae в развитии атеросклероза, саркоидоза легких, ишемического инсульта, болезни Альцгеймера, поэтому перенесенная хламидийная пневмония может иметь далеко идущие последствия. Однозначно доказано отрицательное влияние респираторного хламидиоза на течение бронхиальной астмы и частоту ее обострений.
Читайте также:

