Частое мочеиспускание при цитомегаловирусе
Обновлено: 18.04.2024
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова"
Институт химической физики им. Н.Н. Семенова РАН, Москва
Совершенствование терапии цитомегаловирусной инфекции у мужчин
Журнал: Клиническая дерматология и венерология. 2016;15(3): 48‑52
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Увеличилось количество сексуально активных мужчин с хроническими воспалительными заболеваниями органов малого таза (ВЗОМТ), при обследовании которых в соскобах из уретры выявлялись ДНК цитомегаловируса (ЦМВ). Цель исследования — совершенствование подходов к диагностике и терапии цитомегаловирусной инфекции урогенитального тракта. Материал и методы. Под наблюдением находились 56 пациентов с ВЗОМТ, обусловленными патогенной, условно-патогенной микрофлорой и ЦМВ. Назначали 0,004% раствор Панавира по 5 мл внутривенно, антибактериальные препараты. Результаты. Комплексная терапия с применением антибактериальных препаратов и 0,004% раствор Панавира по 5 мл внутривенно у пациентов с инфекцией ЦМВ в урогенитальном тракте показала эффективность в 84,61% случаев.
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова"
Институт химической физики им. Н.Н. Семенова РАН, Москва
Выделяют два периода жизни человека, наиболее уязвимых для инфицирования, — детский возраст до 5—6 лет, когда передача инфекции происходит от матери к ребенку или от детей, выделяющих вирус. Вторым критическим периодом является возраст 16—30 лет: в данной группе лиц передача вируса осуществляется от лиц с латентным или субклиническим течением инфекции, главным образом половым путем как при гомо-, так и гетеросексуальных контактах.
Среди условий, способствующих реактивации ЦМВИ, выделяют: стрессы (психотравмы, длительные интеллектуальные и физические перегрузки, хронический дефицит сна); инфекции, имеющие повреждающее действие на иммунную систему; нарушения метаболизма вследствие заболевания органов эндокринной системы (гипотиреоз, тиреотоксикоз, недостаточность половых гормонов, сахарный диабет) или дефицита белков, микроэлементов, витаминов; истощение антиоксидантной системы в результате хронической инфекции, радиационных поражений, заболеваний внутренних органов, токсического действия продуктов свободнорадикального окисления; интоксикации различного генеза. К ятрогенным факторам относят длительный прием иммуносупрессантов, включая глюкокортикоиды и цитостатики.
По данным Е.А. Григорьевой и соавт. (2003), к ухудшению состояния больных ЦМВИ приводили интеркуррентные заболевания, хронические воспалительные заболевания гениталий. Вторичный иммунодефицит, проявляющийся резким угнетением фагоцитарной активности нейтрофилов крови, функциональной активности Т-лимфоцитов и недостаточностью иммунного ответа, способствует реактивации ЦМВ, способного в свою очередь вызывать депрессию практически всех звеньев иммунитета: угнетение клеток-киллеров, дисфункцию макрофагов, дефицит продукции интерлейкинов. Отмечено, что при ассоциации с другими возбудителями ЦМВ может приобретать цитопатические свойства, поддерживать воспалительную реакцию, снижать эффективность специфической терапии (Дерябин П.Г., 2003; Чернова Н.И., 2013). Полное выздоровление происходит лишь в том случае, если из организма удален возбудитель и выключены иммунопатологические механизмы, а временный дефект иммунологической реактивности ликвидирован. Следовательно, диагностика ЦМВИ заключается не только в детекции ЦМВ в организме пациента, но и в определении факторов, способствующих повышению вирусной активности, которая обусловливает патологические изменения в органах.
Решение этих задач зависит от мастерства врачей, чья недостаточная компетентность может приводить к диагностическим ошибкам, следовательно, к неправильному лечению. При назначении терапии следует учитывать, что наибольшую эффективность следует ожидать от препаратов, сочетающих этиотропный и иммуномодулирующий эффекты. Наряду с созданием новых химических средств идет интенсивный поиск среди соединений растительного происхождения. В данном аспекте определенный интерес представляет отечественный препарат Панавир — очищенный экстракт побегов растения Solanum tuberosum, биологически активный полисахарид, основное действующее вещество которого — гексозный гликозид, полученный методом ферментативного гидролиза с последующей газожидкостной хроматографией, состоящий из глюкозы, рамнозы, арабинозы, маннозы, ксилозы, галактозы, уроновых кислот, результат более чем десятилетних исследований ученых НИИ физико-химической медицины РАМН. Доклинические исследования на моделях вирусных инфекций на протяжении ряда лет проходили в основном в НИИ вирусологии им. Д.И. Ивановского и в НИИ физико-химической медицины РАМН. Так, под руководством проф. А.А. Кущ в лаборатории клеточной инженерии ГН НИИ вирусологии им. Д.И. Ивановского была показана высокая противовирусная активность Панавира в отношении ЦМВ. Препарат в определенном диапазоне доз полностью предотвращал вирус-индуцированное цитопатическое действие (ЦПД) в культурах клеток, обладал способностью тормозить развитие ЦПД в клетках, повышал жизнеспособность клеток в присутствии вирусов. В экспериментах in vitro было показано, что препарат обладает относительно низким цитотоксическим и антипролиферативным действием в отношении целого ряда клеточных культур (перевиваемые клетки линии Vero, диплоидные клетки фибробластов эмбрионов человека, клетки SW-13). В ходе токсикологических исследований было выявлено, что ЛД50 в несколько тысяч раз выше оптимальной терапевтической дозы, а также было показано, что Панавир не обладает тератогенными, мутагенными свойствами, не изменяет реологические показатели крови. Доклинические исследования in vitro и in vivo выявили противовирусные свойства препарата в отношении инфекций, вызываемых самыми разными вирусами, как ДНК-, так и РНК-содержащими, например, вирусами простого герпеса (ВПГ) 1-го и 2-го типов, ЦМВ, вирусом гепатита С, гриппа А, В, аденовирусами, что свидетельствует о поливалентном характере противовирусной активности нового препарата. Характерными особенностями механизма противовирусной активности Панавира являются его влияние на ингибирование синтеза вирусных белков и доказанное повышение жизнеспособности клеток в культуре в присутствии вирусов, снижение титров вирусов в культуре клеток и в эксперименте на животных, увеличение латентного периода развития экспериментальной инфекции in vitro и in vivo, митогенная активность в реакции бласттрансформации лимфоцитов, способность модулировать уровень лейкоцитарных интерферонов α и γ. Противовирусное действие Панавира включает несколько механизмов:
1) препятствие адгезии вируса на поверхности клетки;
2) блокада пенетрации вируса в клетку;
3) нарушение синтеза капсидных белков и заключительной сборки вируса.
В ходе исследований, проведенных в ЦНИКВИ Минздрава России, на кафедре кожных и венерических болезней МГМСУ, Уральском НИИ дерматовенерологии, МОНИКИ, Научном центре акушерства и гинекологии, показана высокая эффективность Панавира в терапии пациенток с генитальной герпетической, папилломавирусной, цитомегаловирусной инфекциями.
При ЦМВИ Панавир назначают в форме 0,004% раствора по 5 мл внутривенно по схеме: три инъекции через 48 ч в течение 1-й недели и две инъекции с интервалом 72 ч в течение 2-й недели (всего пять инъекций на курс).
Цель исследования — совершенствование терапии ЦМВИ у мужчин.
Материал и методы
Под наблюдением находились 56 мужчин в возрасте от 20 до 35 лет с ЦМВИ урогенитального тракта (УГТ).
Лабораторная диагностика
1. Микроскопическое исследование с целью определения эпителия, лейкоцитарной реакции, морфотипа биоты, внутриклеточных грамотрицательных диплококков (Neisseria gonorrhoeae), Trichomonas vaginalis.
2. Культуральное исследование с целью выявления роста N. gonorrhoeae, T. vaginalis, Ureaplasma urealyticum, Mycoplasma hominis, условно-патогенной микрофлоры.
3. Молекулярно-генетическое исследование с целью детекции ДНК Chlamydia trachomatis, N. gonorrhoeae, T. vaginalis, Mycoplasma genitalium, Ureaplasma spp., Gardnerella vaginalis, M. hominis, вируса папилломы человека (ВПЧ) и ВПГ (качественное и количественное).
4. Для детекции ЦМВИ использовали иммуноферментный анализ (ИФА) с выявлением в сыворотке крови специфических анти-ЦМВ классов IgM (качественный анализ) и IgG (количественный анализ). Вирусологическое выявление ЦМВ проводили на культуре фибробластов легких эмбриона человека, при исследовании крови, слюны, мочи, эякулята. ДНК ЦМВ в отделяемом из УГТ определяли посредством полимеразной цепной реакции (ПЦР). Всем пациентам проведено микроскопическое и бактериологическое исследование клинического материала из уретры.
На протяжении исследования проводилось четыре визита, включающих однократный осмотр во время лечения, далее через 30, 60 и 90 дней после лечения с лабораторным контролем на 30-й и 90-й день лечения.
Больные были разделены на две группы: в 1-ю вошли 14 мужчин без ИППП, во 2-ю — 42 человека с инфекционными заболеваниями УГТ. Антимикробная терапия определялась чувствительностью микрофлоры к антибиотикам, возможностью создания в очаге инфекции концентрации препаратов, подавляющих жизнедеятельность микроорганизмов, отсутствием или маловыраженным побочным действием на организм больного. Учитывая этиологию, патогенез, клиническую симптоматику, терапия проводилась в соответствии с клиническими рекомендациями: джозамицин по 500 мг 3 раза в сутки или доксициклина моногидрат по 100 мг в сутки. В зависимости от топического диагноза курс составлял 10—20 сут. Препараты применялись в комбинации с метронидазолом по 500 мг 2 раза в день 5—10 дней.
Всем больным с ИППП был назначен 0,004% раствор Панавира по 5 мл внутривенно — три инъекции через 48 ч в течение 1-й недели и две инъекции с интервалом 72 ч в течение 2-й недели.
Оценка эффективности терапии основывалась на данных динамики субъективных и объективных симптомов и результатов лабораторной диагностики.
На протяжении исследования проводилось четыре визита, включающих два осмотра до лечения, далее через 30 (с лабораторным контролем) и 90 дней после проведенной терапии.
Результаты
Средний возраст пациентов составил 29,15±4,18 года. Количество холостых и состоящих в браке оказалось одинаковым (по 50%). При анализе данных сексуального анамнеза мужчин, обратившихся за медицинской помощью, было констатировано, что 100% пациентов имели незащищенные орогенитальные контакты с новым партнером, при этом женатые мужчины имели связи вне брака, 12 человек отмечали случайные половые контакты.
Основные жалобы были представлены дискомфортом в уретре и промежности, наличием выделений, а также дизурическими расстройствами разной степени выраженности. Длительность перечисленных симптомов отмечалась в среднем от 3 мес до 2 лет. В результате проведенной терапии было установлено, что применение комплексной терапии способствовало купированию дискомфорта в области гениталий у большинства пациентов обоих групп.
У пациентов 2-й группы в отделяемом уретры отмечался лейкоцитоз от 10 до 80 в поле зрения. При культуральном исследовании рост T. vaginalis регистрировался у 22 обследованнных, условно-патогенной микрофлоры — у 100%. Через 30 и 90 дней после лечения нормализация лейкоцитоза отмечалась у 34 пациентов. При бактериологическом обследовании более высокие количественные показатели для таких возбудителей, как Streptococcus fаecalis, Staphylococcus epidermidis, Candida albicans, отмечены у 8 больных.
До лечения при помощи ПЦР выявлены С. trachomatis у 12 больных, а также ВПЧ, ВПГ у 33 пациентов 2-й группы (табл. 1).

Таблица 1. Результаты исследования ПЦР
В большинстве случаев была диагностирована микстинфекция, включающая 3—4 ассоцианта. Через 30 и 90 дней после проведенной терапии результаты были отрицательными у 42 (100%) больных.
При включении в исследование у всех мужчин (n=56, или 100%) были положительными анти-ЦМВ IgG и отрицательными IgМ. При обследовании крови, мочи, слюны, эякулята, соскобов из уретры с помощью молекулярно-генетического и вирусологического методов ЦМВ наиболее часто (78,69%) определялся в эякуляте и соскобах из уретры (60,66%) у пациентов с ИППП, тогда как у мужчин без патогенной микрофлоры в соскобах из уретры и в моче (14,29%) (табл. 2).

Таблица 2. Выявление маркеров CMV
Все пациенты переносили лечение хорошо, побочных эффектов или аллергических реакций отмечено не было.
Заключение
Результаты исследования демонстрируют высокую эффективность предложенного комплексного метода лечения генитальной бактериально-вирусной инфекции с использованием противовирусного препарата Панавир в форме 0,004% раствора по 5 мл внутривенно и антибактериальных препаратов.
Как показывает наблюдение за пролеченными больными в течение 90 дней, возникновение реактивации ЦМВИ после комплексной терапии с применением системного введения препарата Панавир в форме 0,004% раствора по 5 мл внутривенно произошло у 4 (9,52%) больных ИППП и у 4 (28,57%) — без ИППП.
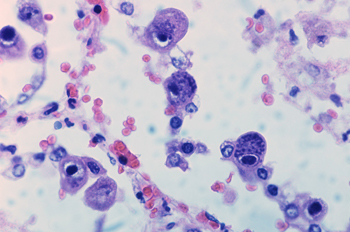
Цитомегаловирусная инфекция (ЦМВИ) – хроническая инфекционная болезнь вирусной этиологии, характеризующаяся многообразием форм патологического процесса от латентной инфекции до клинически выраженного генерализованного заболевания (цитомегаловирусная болезнь). Тяжесть и спектр проявлений ЦМВИ весьма разнообразны.
Продолжительность инкубационного периода при заражении ЦМВ составляет 4-12 недель. Клиническая картина приобретенной ЦМВИ у взрослых зависит от формы инфекции (первичное заражение, реинфекция, реактивация латентного вируса), путей и механизмов заражения (аспирация инфицированной слюны, гемотрансфузии, половой путь, трансплантация инфицированного органа), состояния иммунной системы (отсутствие или наличие иммуносупрессии и степень ее выраженности).
Первично латентная цитомегалия – самая частая форма инфекции. Латентная цитомегаловирусная инфекция продолжается пожизненно и клинически не проявляется, однако под влиянием каких-либо причин может активизироваться и переходить в манифестную клинически выраженную форму.
Первичное инфицирование ЦМВ иммунокомпетентных лиц обычно протекает бессимптомно или с нерезко выраженным мононуклеозоподобным синдромом. Данным синдромом острая ЦМВИ проявляется лишь у 5% взрослых (соответственно, не более, чем у 3-5% беременных). Основные отличительные признаки — высокая лихорадка, слабость, утомляемость, сильное недомогание, выраженный и длительный астенический синдром, в крови — относительный лимфоцитоз, атипичные лимфоциты.
Острая форма ЦМВИ чаще всего наблюдается у лиц, зараженных вирусом при переливании крови от больного человека или половым путем. Обычно ее течение похоже на простуду и сопровождается такими симптомами, как слабость, общее недомогание, головные боли и насморк. Часто возникает воспаление и увеличение слюнных желез с обильным отделением слюны и белесоватыми налетами на деснах и языке.
Характерны высокая лихорадка длительностью более двух недель, общее недомогание, выраженная утомляемость, лимфаденопатия. Отмечаются головная боль, миалгии, артралгии, гепатоспленомегалия, повышение активности аминотрансфераз и щелочной фосфатазы. Возможно развитие гепатита и пневмонии. Большинство больных выздоравливает полностью, хотя астенический синдром сохраняется длительное время. При отсутствии выраженных иммунологических нарушений острая ЦМВИ переходит в латентную с пожизненным присутствием
Острая ЦМВИ у беременных протекает бессимптомно или с умеренно выраженными признаками фарингита, незначительного повышения температуры тела, признаками астении. Заражение вирусом в первые 20 недель беременности может быть причиной самопроизвольного выкидыша, внутриутробной гибели плода, мертворождения, пороков развития. При заражении в более поздние сроки у ребенка может быть врожденная цитомегалия, симптомы которой обнаруживаются с первых дней внеутробной жизни.
У людей с нормальным иммунитетом (иммунокомпетентных) ЦМВИ, как правило, протекает латентно. Однако на фоне имеющихся иммунологических нарушений резко повышается риск развития клинически выраженных (манифестных) форм заболевания. Например, манифестная ЦМВИ занимает одно из первых мест в структуре оппортунистических заболеваний у ВИЧ-инфицированных пациентов. Кроме того, клинически выраженная ЦМВИ — одно из самых частых и серьёзных инфекционных осложнений при трансплантации органов или в случае проведения длительной иммуносупрессивной терапии.
Развитие тяжёлой ЦМВИ описано у онкогематологических больных, пациентов, страдавших пневмоцистной пневмонией, туберкулёзом, лучевой болезнью, ожоговой травмой, у лиц, находящихся на длительной кортикостероидной терапии, перенёсших различные стрессовые ситуации.
Развитие манифестной ЦМВИ в этом случае может быть обусловлено первичным инфицированием ЦМВ, повторным попаданием вируса в организм (реинфекцией) или реактивацией вируса в заражённом организме . Вероятность возникновения и тяжесть течения ЦМВИ связывают со степенью иммуносупрессии.
Через 1-3 месяца при наличии выраженной иммуносупрессии наступает тяжелая органная патология с тенденцией к генерализации процесса.
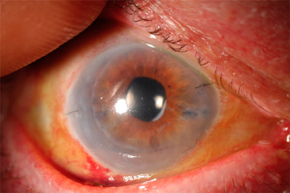
При генерализованной форме чаще наблюдается поражение легких, почек и кишечника, реже - печени и других органов. Один из тяжёлых признаков ЦМВИ — ретинит. Потеря зрения необратима, поскольку данный процесс развивается в результате воспаления и некроза сетчатки. Как возможные клинические симптомы ЦМВИ диагностируют также восходящий миелит и полиневропатию (подострого течения); энцефалит, характеризующийся деменцией; цитомегаловирусный гепатит с одновременным поражением жёлчных путей и развитием склерозирующего холангита; адреналит, проявляющийся резкой слабостью и снижением АД. Иногда возникает эпидидимит, цервицит, панкреатит.
По оценкам специалистов, только в США ежегодно рождается 30—40 тысяч детей с врожденной ЦМВ-инфекцией, т. е. она далеко опережает по частоте и значимости все остальные врожденные инфекции. Важно отметить, что врожденная цитомегаловирусная инфекция всегда имеет генерализованный характер, тогда как приобретенная может быть локализованной с изолированным поражением слюнных желез.
Для врожденной цитомегалии характерна внутриутробная задержка развития, желтуха, увеличение печени и селезенки, уменьшение числа тромбоцитов, ретикулоцитоз и прогрессирующая анемия. Врожденная генерализованная ЦМВИ характеризуется также геморрагическими высыпаниями на коже и слизистых оболочках, кровоизлияниями во внутренние органы и головной мозг, значительной анемией, развитием очагов миелоэритробластоза в печени и почках.
Самое тяжелое проявление данной формы — энцефалит, который практически не встречается при приобретенной цитомегаловирусной инфекции. Часто развиваются микроцефалия, расширение желудочков мозга, нейросенсорная тугоухость. Отмечается поражение глаз - увеит, помутнение хрусталика и субатрофия радужной оболочки.
Резервуаром цитомегаловируса в природе является только человек — хронический носитель вируса или больной какой-либо из форм этого заболевания. Передача инфекции осуществляется практически через все биологические жидкости и выделения организма, а также посредством органов и тканей, используемых для трансплантации. Из зараженного организма вирус выделяется с мочой, слюной, слезной жидкостью, кровью, спермой и др. Инфекция передается различными путями - воздушно-капельным, половым, контактным, пероральным, парентеральным, внутриутробным, трансфузионным или трансплантационным.
Если иммунитет заразившегося человека нормальный, то цитомегалия чаще всего протекает в латентной, то есть скрытой форме, без видимых клинических проявлений заболевания. Инфекция существует в виде бессимптомного вирусоносительства, ничем не обнаруживая себя и не вызывая каких-либо патологических явлений. У взрослого человека и ребенка старшего возраста благодаря высокой эффективности иммунного ответа, значительно чаще наблюдается латентное течение ЦМВИ.
В случае иммуносупрессии, т.е. при ослаблении иммунной системы, резистентность организма снижается и активируется латентная инфекция, которая может представлять серьезную угрозу жизни. В группе риска - новорожденные дети, беременные женщины, онкобольные, пациенты после трансплантации органов или костного мозга/стволовых клеток, больные СПИДом, а также пациенты, подвергшихся переливанию крови. На фоне резкого снижения иммунитета, цитомегалия может перейти в клинически выраженное заболевание разной степени тяжести, вплоть до генерализованных форм с тяжелыми поражениями внутренних органов, центральной нервной системы и в ряде случаев летальными исходами.
Для человека с неповрежденной иммунной системой уменьшить риск заражения цитомегаловирусной инфекцией поможет выполнение обычных правил личной гигиены: мытье рук после посещения мест общего пользования (туалет, общест венный транспорт и т.д.), перед едой, а также использование чистой посуды. В транспланталогии важной мерой профилактики ЦМВИ является подбор серонегативного донора, если серонегативен реципиент.
Генерализованная форма ЦМВИ (цитомегалии, цитомегаловирусной инфекции), как правило, возникает на фоне какого-либо другого заболевания, резко снижающего иммунитет (лейкозы, злокачественные опухоли, СПИД), или после тяжелых хирургических операций. Следствием цитомегалии в этом случае могут быть воспаление надпочечников, селезенки, поджелудочной железы, почек и других внутренних органов. ЦМВИ также может проявляться в виде гепатита. Доказано, что до 30% гепатитов неясной этиологии обусловлены поражением печени герпесвирусами, а именно цитомегаловирусом или вирусом простого герпеса.
Как сопутствующие явления возникают пневмонии, поражения сосудов глаза, стенок кишечника, головного мозга и периферических нервов. В составе крови уменьшается количество тромбоцитов. Кроме основного заболевания и ЦМВИ, ухудшение состояния больного может вызвать наслаивающаяся септическая бактериальная инфекция.
По статистике Всемирной Организации Здравоохранения генерализованная форма цитомегалии является причиной наибольшего количества летальных случаев в мире после гриппа и ОРВИ.
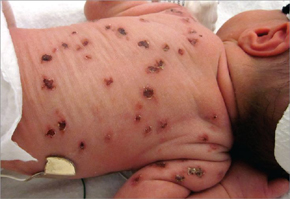
Внутриутробная ЦМВИ считается наиболее опасной, так как может вызвать серьезные поражения плода вплоть до его гибели или привести к рождению детей с тяжелыми неврологическими расстройствами, патологией зрительного и слухового нервов, различными соматическими повреждениями. Характер поражения зависит от сроков инфицирования плода ЦМВ. На ранних сроках (4–6 недель беременности) возможна его гибель или самопроизвольный выкидыш. При инфицировании цитомегаловирусом (ЦМВ) в поздние сроки беременности прогноз более благоприятен. Инфицирование ЦМВ плода во второй половине беременности может не приводить к клинически выраженной патологии при рождении, но быть причиной развития заболевания в первые недели - месяцы жизни ребенка.
Инфицирование в первые 3 месяца гестации может привести к тератогенному действию на плод, а в более поздние сроки – к врожденной цитомегалии, не сопровождающейся пороками развития. У части детей внутриутробное инфицирование ЦМВ проявляется лишь к 5–7 годам в виде нарушения зрения, ухудшения слуха, судорожных расстройств, или задержки физического и умственного развития.
В связи с этим крайне важно обследование женщин на ранних сроках беременности (оптимально – при ее планировании) с целью установления иммунного статуса в отношении ЦМВИ и выявления группы риска, требующей более серьезного и регулярного обследования вплоть до родов.
Возможность онкогенного действия вируса окончательно не изучена. Полагают, что выделение вируса цитомегалии из опухоли больных саркомой Капоши, карциномы простаты, злокачественной лимфомы, рака шейки матки, аденокарциномы толстой кишки и др. является косвенным свидетельством этиологической роли отдельных штаммов ЦМВ человека в развитии онкологических заболеваний.
Цитомегаловирусная инфекция наиболее часто поражает реципиентов трансплантируемых органов. У 38–96% пациентов после трансплантации встречается активная форма ЦМВИ, при которой каждый орган может быть вовлечен в инфекционный процесс. Клинически выраженная ЦМВИ – одно из серьезных инфекционных осложнений при трансплантации солидных органов и костного мозга, являясь одной из частых причин длительной госпитализации больных и их смерти.
Имеются данные, подтвержденные при экспериментальной инфекции у животных, что у больных, перенесших пересадку сердца, ЦМВИ является одной из причин атеросклероза. Доказано, что сосудистые поражения почечного трансплантанта с дисфункцией почки обусловлены ЦМВИ.
Период максимального риска инфицирования приходится на 1–4-й мес. после трансплантации. Максимальный риск заболевания выше при первичном инфицировании. При первичном инфицировании заболевание протекает более тяжело, чем при активизации латентной ЦМВИ.
Основными проявлениями ЦМВИ у больных после трансплантации органов является гепатит, пневмония, ретинит, тяжелые поражения желудочно-кишечного тракта, лейкопения. Присоединение бактериальной, грибковой или протейной инфекции на фоне ЦМВИ могут приводить к угрожающим жизни последствиям. Так, у пациентов после трансплантации костного мозга самым тяжелым осложнением считается интерстициальная пневмония, которая диагностируется в 15–20% случаев. У 80–90% больных пневмония заканчивается летальным исходом.
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Особенности течения цитомегаловирусной инфекции урогенитального тракта у сексуально активных женщин
Журнал: Клиническая дерматология и венерология. 2013;11(3): 69‑75
Чернова Н.И. Особенности течения цитомегаловирусной инфекции урогенитального тракта у сексуально активных женщин. Клиническая дерматология и венерология. 2013;11(3):69‑75.
Chernova NI. Specific features of cytomegalovirus infection of the urogenital tract in sexually active women. Klinicheskaya Dermatologiya i Venerologiya. 2013;11(3):69‑75. (In Russ.).
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Цитомегаловирусная инфекция (ЦМВИ) — широко распространенное инфекционное заболевание человека, с вертикальным, половым, парентеральным, оральным путями передачи, реализующимися через кровь, цервикальный и вагинальный секреты, сперму и женское молоко. В большинстве случаев инфекция протекает без клинических проявлений. При иммуносупрессии, вызванной разными причинами, цитомегаловирус (ЦМВ) способен привести к развитию заболевания с многообразными симптомами, что обусловлено его способностью инфицировать практически все системы органов (ретинит, увеит, серонегативный мононуклеоз, пневмония, гепатит, болезни желудочно-кишечного тракта, центральной нервной системы, посттрансфузионный синдром) [1—5].
В среднем у 90—95% взрослого населения обнаруживаются антитела к ЦМВ. В литературе приводятся многочисленные данные об особенностях течения ЦМВИ у новорожденных, беременных и иммунонекомпетентных пациентов. В настоящий момент обследованию на ЦМВИ подлежат следующие категории граждан: женщины при подготовке к беременности, беременные и пациенты с выявленными иммунодефицитными состояниями. Изучению значимости ЦМВ в патологии взрослого населения уделяется особое внимание [6—9]. Однако не учитывается, что ЦМВ нередко способствует хроническому воспалительному поражению органов малого таза и гениталий, что обусловливает низкую эффективность терапии инфекций, передаваемых половым путем (ИППП), и снижение репродуктивной способности пациентов.
Цель настоящего исследования — определение форм течения ЦМВИ урогенитального тракта у сексуально активных женщин репродуктивного возраста.
Материал и методы
Под наблюдением находились 356 пациенток с ЦМВИ, которая характеризовалась наличием в крови анти-CMV IgG.
Для выявления достоверных триггерных клинических и лабораторных факторов, ассоциирующихся с ЦМВИ урогенитального тракта, данные опроса и обследования больных сравнивали с результатами аналогичных исследований, проведенных в контрольной группе, которая состояла из 120 женщин. Критериями отбора являлись: репродуктивный возраст, отсутствие беременности, лактации, системной и местной антибактериальной терапии в течение 1 месяца до начала данного обследования, нормальное состояние микрофлоры урогенитального тракта и исключенная ЦМВИ.
Результаты
Важное значение для выяснения характера ЦМВИ имеют сведения о перенесенных соматических и инфекционных заболеваниях. Частота экстрагенитальной патологии косвенно отражает состояние противоинфекционной защиты организма и иммунной системы в целом.

При анализе соматической патологии (табл. 2) наиболее часто в основной группе по сравнению с контрольной отмечались инфекционные вирусные заболевания (82,58% случаев), патология желудочно-кишечного тракта (55,9%) и заболевания органов дыхания (20,51%). У пациенток с ЦМВИ в 4,2 раза чаще отмечалась патология эндокринной системы (в 31,46% случаев; p<0,05).
Подробному анализу были подвергнуты данные о гинекологических заболеваниях, которые относятся к факторам, влияющим на состояние системного и локального иммунитета.

Среди перенесенных гинекологических заболеваний наиболее часто встречались патология шейки матки (44,10% случаев; p<0,05) и воспалительные заболевания органов малого таза (75%; p<0,05) по сравнению с контролем (табл. 3). Кроме того, у женщин с ЦМВИ чаще наблюдались ИППП (в 55,34% случаев; p<0,05) и бесплодие (28,65%; p<0,05).

При изучении особенностей сексуального анамнеза (табл. 4) выявлено, что у пациенток с ЦМВИ в 3 раза чаще (p<0,05) отмечалось раннее начало половой жизни. Соотношение женщин по количеству половых партнеров в обеих группах было сопоставимым. В ходе анализа особенностей сексуальных предпочтений установлено, что пациентки основной группы чаще практиковали аногенитальные контакты (p<0,05).
Незащищенные половые контакты (включая без использования презерватива с последующей обработкой раствором мирамистина) в анамнезе имели более 84% пациенток с ЦМВ и 70% женщин из группы контроля (p<0,05).
Таким образом, вероятным предрасполагающим фактором для ЦМВИ урогенитального тракта являлось раннее начало половой жизни и большое количество незащищенных аногенитальных контактов.
При клиническом обследовании анализировали особенности субъективных ощущений, проводили тщательный общий и гинекологический осмотр.
Таким образом, у пациенток с ЦМВИ при гинекологическом осмотре чаще выявлялся острый или хронический воспалительный процесс в малом тазу.

Результаты микроскопического исследования мазков отделяемого генитального тракта, окрашенных по Граму, представлены в табл. 6.

Анализ результатов культурального исследования отделяемого мочеполового тракта женщин выявил доминирование грибов Candida spp. (48,60%), G. vaginalis (30,62%), T. vaginalis (21,35%). У большинства женщин в биотопах влагалища имела место ассоциация ЦМВИ с условно-патогенными бактериями (Streptococcus, St. aureus, Ureaplasma spp., M. hominis) в высоком титре (более 10 5 КОЕ/мл; табл. 7).

Результаты комплексного обследования этих женщин представлены в табл. 8.
У 71 (19,9%) женщины состояние вагинальной микроэкологии было оценено как нормоценоз. Проанализировав полученные данные, можно было выделить его некоторые особенности, которые в ряде случаев позволили назвать указанное состояние нормоценозом только условно. Так, только у 22 (6,18%) женщин из 356 состояние микроэкологии полностью соответствовало всем критериям нормы репродуктивного возраста: при микроскопии вагинального отделяемого отсутствовала выраженная лейкоцитарная реакция (количество лейкоцитов не превышало 10 в поле зрения), эпителий был представлен клетками поверхностного и промежуточного слоев, количество микрофлоры было умеренным при абсолютном преобладании морфотипа лактобактерий. Морфотипы условно-патогенных микроорганизмов (УПМ) не определялись. При культуральном исследовании титр лактобацилл составлял 10 6-8 КОЕ/мл вагинального отделяемого, а концентрации УПМ были низкими (менее 10 3 КОЕ/мл).
Наиболее частой патологией среди 356 обследованных пациенток с ЦМВИ оказался кандидоз (57,30%), в большинстве случаев сопровождавшийся умеренным повышением титра УПМ (Streptococcus группы В в 10 6 КОЕ/мл и St. aureus более 10 6 КОЕ/мл).
Аэробный вагинит (1,12%) как вариант дисбиоза влагалища был обусловлен колонизацией вагинального биотопа высокими титрами E. coli (более 10 7 КОЕ/мл) и стрептококков группы В (10 6 КОЕ/мл). По данным микроскопии в этих случаях также отмечалась выраженная лейкоцитарная реакция (более 40 лейкоцитов в поле зрения).
У 21,06% женщин микроскопически был установлен бактериальный вагиноз, что сопровождалось высокой колонизацией факультативно-анаэробной и анаэробной флоры (более 10 6 КОЕ/мл).
В 0,56% случаев состояние вагинальной микроэкологии было оценено как другой вариант дисбиоза влагалища, когда при минимальном содержании микрофлоры (данные микроскопии) доминировали факультативно-анаэробные и аэробные УПМ (грамположительные кокки), а лактоморфотипы были единичными в поле зрения.
Таким образом, только у 19,9% пациенток с ЦМВИ имелся классический вариант микроценоза, в остальных случаях микрофлора влагалища претерпевала изменения, связанные с нарастанием титра факультативно-анаэробных УПМ. У 80,1% женщин выявлены нарушения микроценоза влагалища, в большинстве случаев связанные с увеличением количества Candida spp. При исследовании отделяемого из уретры с помощью ПЦР идентифицированы возбудители ИППП и УПМ. Наиболее часто выявлялись ДНК HPV (11,52%), T. vaginalis, M. hominis, HSV 1-го и 2-го типов (2,81 и 3,08% соответственно), С. trachomatis были идентифицированы в уретре у 5,34% больных.
В цервикальном канале в 5 раз чаще определялись УПМ и патогены. Так, наиболее часто у женщин с ЦМВИ были выделены вирус папилломы человека (42,13%), T. vaginalis (11,52%), M. hominis (21,63%), С. trachomatis (18,82%) и Ureaplasma spp. (24,44%).
В соскобах из влагалища также наиболее часто определялась ДНК вируса папилломы человека (43,25%), T. vaginalis (21,35%), M. hominis (14,89%), Ureaplasma spp. (19,38%), а также G. vaginalis (25%).
При исследовании проб из прямой кишки были идентифицированы ДНК ВПЧ (28,93%) и M. hominis (11,24%).

Для верификации диагноза ЦМВИ проводили расширенный анализ результатов, полученных разными методами исследования (табл. 9).
При анализе данных с целью выявления маркеров ЦМВИ установлена наибольшая частота обнаружения анти-CMV IgG — 356 (100%) случаев. Анти-CMV IgM были выявлены у 89 (25%) женщин. Обнаружение антител класса G к CMV свидетельствовало как об инфицированности, так и о наличии в большинстве случаев сформированного специфического противовирусного иммунитета. Выявление антител класса М совместно с IgG было одним из признаков реактивации данной вирусной инфекции.
При исследовании материала, полученного из урогенитального тракта с помощью ПЦР, ДНК CMV была обнаружена у 208 (58,43%) женщин.
ЦМВ на культуре фибробластов легких человека при исследовании крови выявлен у 93 (26,12%) женщин, мочи — у 199 (55,90%), слюны — у 204 (57,30%) больных, влагалищного отделяемого — у 225 (63,20%), из цервикального канала — в 268 (75,28%) случаях. В целом ЦМВ был обнаружен у 268 (75,28%) пациенток.
Учитывая этиологию, патогенез и клинические проявления ЦМВИ урогенитального тракта, пациенткам с реактивированной и латентной формой ЦМВИ проводилась комплексная терапия инфекционного процесса в соответствии с клиническими рекомендациями по ведению больных с ИППП. Противовирусное лечение включало использование препарата Панавир. Основное действующее вещество данного препарата — гексозный гликозид, полученный методом ферментативного гидролиза с последующей газожидкостной хроматографией, состоящий из глюкозы, рамнозы, арабинозы, маннозы, ксилозы, галактозы, уроновых кислот. В ряде экспериментальных и клинических исследований установлена противовирусная и иммуномодулирующая активность Панавира. Данный препарат повышает неспецифическую резистентность организма к разным инфекциям и способствует индукции интерферона, Панавир (5 мл 0,004% раствора) применялся парентерально (внутривенно струйно) 1 раз в сутки через 48 ч (3 инъекции в 1-ю неделю лечения), затем — через 72 ч (2 инъекции во 2-ю неделю терапии). Всего на курс пришлось 5 инъекций в течение 2 недель.
При контрольном исследовании, проведенном через 14 дней после лечения, лишь у 2 (8,0%) пациенток с латентной формой ЦМВИ выявлен CMV в культуре клеток отделяемого цервикального канала, ДНК CMV не определялась у 24 (96%) больных. В результате лечения при реактивированной форме ЦМВИ была констатирована негативация IgM анти-CMV в крови у 100% женщин. При исследовании CMV на культуре фибробластов эмбрионов человека вирурия установлена у 1 (5,56%) пациентки, выделение из цервикального канала отмечено у 3 (16,67%). Результаты вирусологического обследования крови, слюны, влагалищных выделений были отрицательными у всех женщин. При проведении ПЦР наличие ДНК CMV выявлено у 2 (11,11%) пациенток, получавших парентерально Панавир.
Таким образом, в ходе исследования определены основные диагностические клинико-лабораторные критерии разных форм ЦМВИ урогенитального тракта сексуально активных женщин репродуктивного возраста, на основании которых возможности определения данной инфекции существенно увеличились. Наличие клинических проявлений при реактивированной ЦМВИ и определение вирусов при подостром или хроническом течении воспалительных заболеваний органов малого таза способствовали определению значимости данной инфекции в развитии патологии гениталий. Применение препарата Панавир в комплексной терапии повышало эффективность лечения в 89,5% случаев, что позволяет рекомендовать препарат Панавир для комплексной терапии ЦМВИ.
Читайте также:

