Чем лечить атопический дерматит с инфекцией
Обновлено: 18.04.2024
Для цитирования: Плиева Л.Р. Применение антибактериальных препаратов в терапии дерматозов. РМЖ. 2014;8:631.
Антибактериальные средства являются одними из главных препаратов в терапевтическом арсенале дерматологов. К ним относятся, прежде всего, различные антибиотики (АБ).
АБ получили широкое распространение при лечении различных кожных заболеваний. Среди всего разнообразия дерматозов, в лечении которых применяются АБ, на первое место, безусловно, стоит поставить гнойничковые заболевания кожи – пиодермии. Однако сфера применения АБ в дерматологии значительно шире: угри, розацеа, туберкулез кожи, лейшманиоз, склеродермия, псориаз, красный плоский лишай, ангииты кожи, саркоидоз кожи, хроническая доброкачественная семейная пузырчатка Гужеро-Хейли-Хейли, болезнь Лайма и др. Кроме того, следует иметь в виду и осложнения вторичной инфекцией распространенных дерматозов, сопровождающихся зудом, например, атопического дерматита, чесотки, экземы или при буллезных дерматозах [1].
Механизм действия АБ сложен и зависит от химической структуры препарата и группы, в которую он входит. Большинство применяемых в настоящее время АБ являются полусинтетическими или полностью синтетическими соединениями, которые иногда значительно активнее, чем их природные аналоги.
Учитывая довольно частые случаи возникновения устойчивости к АБ, перед назначением препарата целесообразно проведение антибиотикограммы, т. е. определения чувствительности к разным АБ штаммов микроорганизмов, выделяемых у больных.
Неправильный выбор АБ, его дозы или продолжительности курса лечения может привести к хроническому течению заболевания, формированию антибиотикорезистентности бактерий к конкретному АБ, а также к значительному учащению побочных явлений, большей частью аллергического характера.
В дерматологической практике нашли применение представители всех групп АБ (пенициллины, тетрациклины, стрептомицины, цефалоспорины, аминогликозиды, макролиды и др.) [2]. Полусинтетические пенициллины весьма эффективны при инфекционных дерматозах, вызванных стафилококками и стрептококками, а также в тех случаях, когда последние осложняют течение неинфекционных дерматозов. В последние годы наблюдают увеличение числа стафилококков, устойчивых к полусинтетическим пенициллинам и производным тетрациклина. При выявлении таких штаммов рекомендуют применять рифампицин и фузидовую кислоту, а также сочетание гентамицина и амикацина с цефалоспоринами. Действительно, препараты группы цефалоспоринов превосходят по антибактериальному и противовоспалительному действию многие из известных АБ. В дерматологии нашли широкое применение цефтриаксон, цефтазидим, цефотаксим, цефуроксим и др. [1].
В последнее время с успехом применяют комбинации АБ, например смесь равных количеств эритромицина и окситетрациклина дигидрата. Причиной высокой лечебной активности комбинированного применения АБ является одновременное действие компонентов на отдельные структурные элементы, ферментные системы и биохимические процессы в клетках микробов-возбудителей. Кроме того, применение сочетания АБ с различной направленностью действия тормозит развитие антибиотикоустойчивости микроорганизмов, способствует восстановлению их чувствительности к АБ. Этим объясняется хороший терапевтический эффект эрициклина, назначаемого при хронических формах пиодермии, в т. ч. в комбинации с иммуномодуляторами.
АБ, особенно широкого спектра действия, при длительном применении могут вызвать кандидоз различной локализации. Основной причиной развития кандидоза при лечении АБ является дисбактериоз, возникающий в результате подавления ими кишечных микроорганизмов – конкурентов дрожжеподобных грибов, вследствие чего нарушается процесс образования этими бактериями витаминов комплекса В, преимущественно В1 и В2. В то же время АБ оказывают стимулирующие влияние на рост дрожжеподобных грибов как в пищеварительном тракте, так и в других местах. Не исключена возможность и токсического действия АБ на слизистую оболочку пищеварительного тракта, что облегчает внедрение и развитие устойчивых к ним грибов, поэтому при длительном лечении АБ широкого спектра действия с целью профилактики кандидоза больной должен принимать антимикотические препараты.
Кроме АБ к антибактериальным средствам относят также сульфаниламиды, сульфоны, метронидазол, фторхинолоны [3].
Сульфаниламидные препараты, особенно с пролонгированным эффектом, могут применяться при лечении инфекций кожи и заболеваний, передающихся половым путем, но в последнее время их используют гораздо реже АБ. Кроме того, эти средства нередко вызывают сульфаниламидную эритему.
Сульфоны в основном применяются при лепре и герпетиформном дерматите Дюринга, хотя спектр заболеваний, при которых сульфоны дают хороший терапевтический эффект, расширяется; например, получен впечатляющий результат при крапивнице.
Фторхинолоны (офлоксацин, норфлоксацин, ципрофлоксацин и др.) – современные антимикробные препараты с широким спектром действия, позволяющим применять их при различных инфекциях, особенно устойчивых к другим антибактериальным средствам.
Метронидазол является препаратом выбора при лечении угревой сыпи, а также основным средством в терапии трихомониаза и гарднереллеза.
Недостатком АБ любой группы являются осложнения токсико-аллергического характера – дерматиты, токсидермия, вплоть до токсического эпидермального некролиза (синдром Лайелла), крапивница, зуд, анафилактический шок, поэтому для предотвращения подобных осложнений целесообразно назначение совместно с антибактериальными средствами препаратов антигистаминного действия.
Таким образом, антибактериальные препараты занимают прочные позиции в практической деятельности врача-дерматолога при лечении широкого спектра дерматозов.
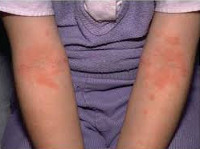
Атопический дерматит у детей – это воспалительное заболевание кожи хронического рецидивирующего течения, возникающее в раннем детском возрасте вследствие повышенной чувствительности к пищевым и контактным аллергенам. Атопический дерматит у детей проявляется высыпаниями на коже, сопровождающимися зудом, мокнутием, образованием эрозий, корок, участков шелушения и лихенизации. Диагноз атопического дерматита у детей основан на данных анамнеза, кожных проб, исследования уровня общего и специфических IgE. При атопическом дерматите у детей показаны диета, местная и системная медикаментозная терапия, физиолечение, психологическая помощь, санаторно-курортное лечение.
МКБ-10
Общие сведения
Атопический дерматит является самым ранним и наиболее частым проявлением реакции гиперчувствительности организма на действие аллергенов окружающей среды: на его долю приходится 80-85% случаев аллергии у детей раннего возраста. Как правило, атопический дерматит у ребенка проявляется уже в течение первого года жизни; может протекать с периодическими обострениями и временным стиханием кожных проявлений до пубертатного периода и даже сохраняться в зрелом возрасте.
Проблема атопического дерматита у детей, в виду своей актуальности, нуждается в пристальном внимании со стороны педиатрии, детской дерматологии, аллергологии-иммунологии, детской гастроэнтерологии, диетологии.

Причины
Возникновение атопического дерматита у детей обусловлено комплексным взаимодействием различных факторов окружающей среды и генетической предрасположенности к аллергическим реакциям. Атопическое поражение кожи обычно возникает у детей с наследственной склонностью к развитию аллергических реакций. Доказано, что риск развития атопического дерматита у детей составляет 75-80% при наличии гиперчувствительности у обоих родителей и 40-50% - при атопии у одного из родителей.
К более частому развитию атопического дерматита у детей приводит гипоксия плода, перенесенная во внутриутробном периоде или во время родов. В первые месяцы жизни ребенка симптомы атопического дерматита могут быть вызваны пищевой аллергией вследствие раннего перевода на искусственные смеси, неправильного введения прикорма, перекармливания, имеющихся нарушений процесса пищеварения и частых инфекционно-вирусных заболеваний. Атопический дерматит чаще возникает у детей с гастритом, энтероколитом, дисбактериозом, гельминтозами.
Нередко к развитию атопического дерматита у детей приводит чрезмерное потребление высокоаллергенных продуктов матерью в период беременности и лактации. Пищевая сенсибилизация, связанная с физиологической незрелостью пищеварительной системы и особенностями иммунного ответа новорожденного, оказывает значительное влияние на формирование и последующее развитие всех аллергических заболеваний у ребенка.
Причинно-значимыми аллергенами могут выступать пыльца, продукты жизнедеятельности домашних клещей, пылевой фактор, бытовая химия, лекарственные средства и др. Спровоцировать обострение атопического дерматита у детей могут психоэмоциональное перенапряжение, перевозбуждение, ухудшение экологической ситуации, пассивное курение, сезонные изменения погоды, снижение иммунной защиты.
Классификация
В развитии атопического дерматита у детей различают несколько стадий: начальную, стадию выраженных изменений, стадию ремиссии и стадию клинического выздоровления. В зависимости от возраста манифестации и клинико-морфологических особенностей кожных проявлений выделяют три формы атопического дерматита у детей:
- младенческую (с периода новорожденности до 3 лет)
- детскую – (с 3 до 12 лет)
- подростковую (с 12 до 18 лет)
Эти формы могут переходить в одна в другую или заканчиваться ремиссией с уменьшением симптомов. Различают легкое, средней степени и тяжелое течение атопического дерматита у детей. Клинико-этиологические варианты атопического дерматита по причинно-значимому аллергену включают кожную сенсибилизацию с преобладанием пищевой, клещевой, грибковой, пыльцевой и другой аллергии. По степени распространенности процесса атопический дерматит у детей может быть:
- ограниченным (очаги локализуются в одной из областей тела, площадь поражения не >5% поверхности тела)
- распространенным/диссеминированным (поражение - от 5 до 15% поверхности тела в двух и более областях)
- диффузным (с поражением практически всей кожной поверхности).
Симптомы
Клиническая картина атопического дерматита у детей достаточно многообразна, зависит от возраста ребенка, остроты и распространенности процесса, тяжести течения патологии.
Типичная локализация очагов – симметрично в области лица (на поверхности щек, лба, подбородка); волосистой части головы; на разгибательных поверхностях конечностей; реже в локтевых сгибах, подколенных ямках и в области ягодиц. Для начальных проявлений атопического дерматита у детей характерны: гнейс - себорейные чешуйки с усиленным салоотделением в зоне родничка, у бровей и за ушами; молочный струп - эритема щек с желтовато-коричневыми корочками. Кожные изменения сопровождаются интенсивным зудом и жжением, расчесами (экскориацией), возможно гнойничковое поражение кожи (пиодермия).
Проявления атопического дерматита у детей подросткового возраста характеризуются резко выраженной лихенизацией, наличием сухих шелушащихся папул и бляшек, локализующихся преимущественно на коже лица (вокруг глаз и рта), шеи, верхней части туловища, локтевых сгибах, вокруг запястий, на тыльной стороне кистей и ступней, пальцах рук и ног. Для этой формы атопического дерматита у детей характерно обострение симптомов в холодное время года.
Диагностика
Диагностика атопического дерматита у ребенка проводится детским дерматологом и детским аллергологом-иммунологом. Во время осмотра специалисты оценивают общее состояние ребенка; состояние кожных покровов (степень влажности, сухости, тургор, дермографизм); морфологию, характер и локализацию высыпаний; площадь поражения кожи, выраженность проявлений. Диагноз атопического дерматита подтверждается при наличии у детей 3-х и более обязательных и дополнительных диагностических критериев.
Вне обострения атопического дерматита у детей применяют постановку кожных проб с аллергенами методом скарификации или прик-теста для выявления IgE-опосредованных аллергических реакций. Определение содержания общего и специфических IgE в сыворотке крови методами ИФА, РИСТ, РАСТ предпочтительно при обострении, тяжелом течении и постоянных рецидивах атопического дерматита у детей.
Атопический дерматит у детей необходимо дифференцировать с себорейным дерматитом, чесоткой, микробной экземой, ихтиозом, псориазом, розовым лишаем, иммунодефицитными заболеваниями.
Лечение атопического дерматита у детей
Лечение направленно на уменьшение выраженности аллергического воспаления кожи, исключение провоцирующих факторов, десенсибилизацию организма, предотвращение и снижение частоты обострений и инфекционных осложнений. Комплексное лечение включает диету, гипоаллергенный режим, системную и местную фармакотерапию, физиотерапию, реабилитацию и психологическую помощь.
- Диета. Помогает облегчить течение атопического дерматита и улучшить общее состояние, особенно у детей грудного и раннего возраста. Рацион питания подбирается индивидуально, исходя из анамнеза и аллергологического статуса ребенка, каждый новый продукт вводится под строгим контролем педиатра. При элиминационной диете из рациона убирают все возможные пищевые аллергены; при гипоаллергенной диете исключают крепкие бульоны, жареные, острые, копченые блюда, шоколад, мед, цитрусовые, консервы и др.
- Медикаментозное лечение. Включает прием антигистаминных, противовоспалительных, мембраностабилизирующих, иммунотропных, седативных препаратов, витаминов и применение местных наружных средств. Антигистаминные препараты 1-го поколения (клемастин, хлоропирамин, хифенадин, диметинден) применяют только короткими курсами при обострении атопического дерматита у детей, не отягощенного бронхиальной астмой или аллергическим ринитом. Антигистаминные препараты 2-го поколения (лоратадин, дезлоратадин, эбастин, цетиризин) показаны при лечении атопического дерматита у детей в сочетании с респираторными формами аллергии. Для купирования тяжелых обострений атопического дерматита у детей используют короткие курсы системных глюкокортикоидов, иммуносупрессивную терапию.
- Местное лечение. Помогает устранить зуд и воспаление кожи, восстановить ее водно-липидный слой и барьерную функцию. При обострениях атопического дерматита у детей среднетяжелой и тяжелой степени применяют аппликации местных глюкокортикоидов, при инфекционном осложнении - в комбинации с антибиотиками и противогрибковыми средствами.
В лечении атопического дерматита у детей используют фототерапию (УФA и УФB облучение, ПУВА-терапию), рефлексотерапию, гипербарическую оксигенацию, курорто- и климатотерапию. Детям с атопическим дерматитом нередко требуется помощь детского психолога.
Прогноз и профилактика
Наиболее выраженные в раннем возрасте проявления атопического дерматита могут уменьшаться или полностью исчезать по мере роста и развития детей. У большинства пациентов симптомы атопического дерматита сохраняются и рецидивируют в течение всей жизни.
Неблагоприятными прогностическими факторами являются: ранний дебют заболевания в возрасте до 2-3 мес., отягощенная наследственность, тяжелое течение, сочетание атопического дерматита у детей с другой аллергической патологией и персистирующей инфекцией.
Цель первичной профилактики атопического дерматита – предотвращение сенсибилизации детей из групп риска путем максимального ограничения высоких антигенных нагрузок на организм беременной и кормящей матери и ее ребенка. Исключительно грудное вскармливание в первые 3 месяца жизни ребенка, обогащение рациона матери и ребенка лактобактериями снижает риск раннего развития атопического дерматита у предрасположенных к нему детей.
Вторичная профилактика заключается в предупреждении обострений атопического дерматита у детей за счет соблюдения диеты, исключения контакта с провоцирующими факторами, коррекции хронической патологии, десенсибилизирущей терапии, санаторно-курортного лечения.
При атопическом дерматите важен правильный ежедневный уход за кожей детей, включающий очищение (непродолжительные прохладные ванны, теплый душ), смягчение и увлажнение специальными средствами лечебной дерматологической косметики; выбор одежды и белья из натуральных материалов.
2. Атопический дерматит у детей: современные клинические рекомендации по диагностике и терапии/ Намазова-Баранова Л.С. и соавт.// Вопросы современной педиатрии. - 2016.
3. Лечение атопического дерматита у подростков и взрослых: проблемы и пути их решения/ Камашева Г.Р., Надеева Р.А., Амиров Н.Б.// Вестник современной клинической медицины. - 2016.
Острые респираторные заболевания (ОРЗ) - достаточно частая патология, встречающаяся у детей всех возрастных групп. В России ежегодно регистрируется около 70 тыс. случаев ОРЗ на 100 тыс. детского населения. Максимальная частота острых респираторных инфекций отмечается в возрасте от 6 мес до 6 лет, среди этой группы наиболее высокий уровень заболеваемости ОРЗ отмечается у детей дошкольного возраста, посещающих организованные коллективы.
Высокая частота инфекционной респираторной патологии у детей связана с особенностями развития иммунной системы, значительной контагиозностью вирусов, нестойким иммунитетом к ряду возбудителей и др. Иммунная система у детей в возрастном интервале, на который приходится наибольшее число случаев ОРЗ, характеризуется максимальным риском развития неадекватных или парадоксальных реакций при встрече с антигеном.
Во второй половине 1-го года жизни происходит утрата пассивного иммунитета, полученного от матери. Способность к формированию собственного активного иммунитета у ребенка развивается постепенно и на большинство антигенов в этот период появляется первичный иммунный ответ с синтезом антител класса IgМ (или IgK), не оставляющий иммунологической памяти. Недостаточность местной защиты слизистых оболочек связана с дефицитом секреторного IgA. В связи с этим чувствительность ребенка к ОРЗ в данный период очень высока. На 2-м году жизни происходит значительное расширение контактов ребенка с окружающим миром и возбудителями инфекций. Иммунный ответ ребенка на инфекционные антигены остается неполноценным: сохраняется первичный характер иммунного ответа (в основном синтез IgМ-антител), что связано с физиологической недостаточностью синтеза IgG. Функциональная активность Т-хелперов в крови нарастает, но сохраняется их дефицит, что проявляется слабостью клеточного звена иммунитета. Недостаток Т-хелперов обусловливает также неадекватную дифференцировку В-лимфоцитов, и при антигенной нагрузке синтезируются преимущественно антитела класса IgK (или IgМ). Местная защита слизистых оболочек все еще остается несовершенной из-за низкого уровня секреторного IgA. Сохраняется высокая чувствительность ребенка к респираторным инфекциям. К 6 годам уровни IgM и IgG в крови ребенка приближаются к таковым взрослого человека, но уровень IgA все еще остается более низким, с чем связана низкая местная защита слизистых оболочек. Однако содержание IgK достигает максимального уровня по сравнению с его концентрацией в другие возрастные периоды. Эти особенности способствуют развитию аллергических реакций у детей этого возраста, сохраняя чувствительность и к респираторным инфекциям.
Высокий риск развития атопических реакций у детей первых лет жизни связан с преобладанием у них дифференцировки Th0 по типу Th2, контролирующих синтез IgK и повышенную секрецию гистамина базофилами и тучными клетками. Низкий уровень секреторного IgA на слизистых оболочках у детей способствует беспрепятственному проникновению аллергенов через слизистые оболочки респираторного и желудочно-кишечного тракта. Возрастные иммунологические особенности предрасполагают к реализации атопического диатеза у детей раннего возраста.
Дети, страдающие атопическими заболеваниями, достоверно чаще болеют острыми респираторными вирусными инфекциями (ОРВИ). У 50% часто болеющих детей определяются повышение уровня IgE и сенсибилизация к ряду аллергенов. Показано, что у больных атопическим дерматитом имеются дисбаланс Th1/Th2-лимфоцитов, нарушение фагоцитоза, других неспецифических факторов иммунитета. Недостаток Т-хелперов приводит к неадекватной реакции В-лимфоцитов и при повышенной антигенной нагрузке вызывает синтез IgK- и IgМ-антител, но не секреторных IgA. Превалирование у часто болеющих детей первичного иммунного ответа обусловливает сниженную способность к синтезу интерферона-γ, что ослабляет противовирусную защиту.
Респираторные возбудители, вторгаясь в слизистую оболочку дыхательных путей, вызывают развитие воспаления, проявляющегося клинической картиной ринита, синусита, фарингита, отита, ларинготрахеита (у детей раннего возраста часто осложняется стенозом гортани), бронхита (у детей, имеющих аллергические заболевания, отмечается склонность к возникновению обструктивных форм). На первом (триггерном) этапе эффективными способами снижения остроты воспаления являются предотвращение колонизации слизистой оболочки патогенной микрофлорой и ограничение ее размножения. Этому способствует орошение слизистой оболочки носа солевыми растворами типа "Маример", "Аква Марис", "Салин" и др. Своевременно проведенные мероприятия сохраняют способность эпителиоцитов слизистой оболочки к продукции защитной слизи, мукоцилиарному клиренсу и существенно сокращают объем повреждений. На последующих этапах происходят образование биологически активных веществ и миграция в слизистую оболочку клеток воспаления, что сопровождается вазодилатацией, увеличением проницаемости сосудов и экссудацией. Это приводит к отеку, гиперсекреции слизи в респираторном тракте. Применение противовоспалительных препаратов в этот период способствует предотвращению дальнейшего запуска синтеза адгезионных молекул, хемокинов и других цитокинов.
Основными направлениями в лечении респираторных инфекций являются этиотропная и патогенетическая терапия. Лечение должно быть комплексным и учитывать индивидуальные особенности ребенка. Этиотропная терапия включает препараты, обладающие противовирусной активностью, и антибактериальные средства при бактериальных осложнениях. Можно использовать препараты Виферон, Гриппферон, Амиксин, Арбидол, Кагоцел, Ингарон, Анаферон детский, Рибомунил, Альгирем.
Патогенетическая терапия включает назначение противовоспалительных средств. В педиатрической практике достаточно широко используется противовоспалительный препарат с комплексным механизмом действия, направленным на подавление инфекционного и неинфекционного воспаления с преимущественным воздействием на слизистую оболочку дыхательного тракта, Эреспал (фенспирида гидрохлорид).
Терапевтический эффект Эреспала обусловлен снижением активности фосфолипазы А2 в результате нарушения транспорта ионов кальция в клетку. Вызванные изменения замедляют скорость образования арахидоновой кислоты, и, как следствие, снижается образование простагландинов, лейкотриенов и тромбоксана - основных факторов, инициирующих сосудистую фазу воспаления. Фенспирид способствует уменьшению степени воспалительного отека тканей и секреторной активности бокаловидных клеток слизистых оболочек. Одновременно Эреспал подавляет синтез гистамина, провоспалительных цитокинов, преимущественно фактора некроза опухоли-ɑ, и уровень активности адренорецепторов, которые стимулируют секрецию вязкой слизи. В результате уменьшается выраженность II фазы воспаления - фазы клеточной инфильтрации. Эффект достигается в том числе за счет уменьшения образования факторов хемотаксиса, включая интерлейкин-8, что значительно снижает альтерацию эпителия респираторного тракта. Препарат обладает преимущественным действием на уровне респираторного тракта, воздействуя на все фазы воспалительного процесса, при минимальном системном эффекте.
Под влиянием Эреспала наблюдаются снижение отека и количества выделяемой вязкой мокроты, что связано с уменьшением образования и выделения секрета (муколитическим и отхаркивающим действием фенспирид не обладает), улучшение мукоцилиарного транспорта, уменьшение степени обструкции дыхательных путей, повышение эффективности кашля.
Отсутствие возрастных ограничений и высокий терапевтический эффект позволяют рассматривать Эреспал в качестве препарата выбора противовоспалительной терапии острых инфекций респираторного тракта у детей. Его хорошая переносимость и клиническая эффективность доказана в ходе европейского многоцентрового исследования у 232 детей первых 6 лет жизни с респираторными заболеваниями разной этиологии, в том числе вирусной и аллергической. В масштабном многоцентровом исследовании, проведенном в 2000 г., приняли участие пациенты и врачи Воронежского пульмонологического центра. Наши собственные исследования и результаты анализа в 9 регионах России 2582 случаев лечения инфекционно-воспалительных респираторных заболеваний у детей в возрасте от первых недель до 16 лет с использованием Эреспала позволили установить целесообразность его применения в качестве противовоспалительной терапии. Острая инфекция верхних отделов респираторного тракта была установлена у 79% детей, острый бронхит - у 20,5%. Легкая степень тяжести ОРЗ отмечена у 1/3 пациентов, тяжелая - у 2%. У остальных детей наблюдалась средняя степень тяжести ОРЗ. Эреспал начинали использовать в стандартной дозе у преобладающего большинства детей на 1-3 сутки болезни. Монотерапию Эреспалом проводили у 33% больных, в сочетании с местным препаратом с антибактериальным противовоспалительным действием (Биопарокс) - у 47%, в сочетании с системными антибиотиками - у 20% детей. Эффективность Эреспала как отличная оценена у 42%, хорошая - у 46% детей. Дети легко переносили лечение, частота нежелательных реакций при монотерапии составила 0,12% (аллергическая сыпь, тошнота, диарея). Использование монотерапии Эреспалом показало его высокую эффективность при острых инфекционно-воспалительных заболеваниях респираторного тракта, особенно при назначении его в первые дни болезни. Фенспирид может быть назначен и как дополнительный противовоспалительный препарат наряду с антибиотиками местного и системного действия.
Лечение ОРВИ у детей с атопическим дерматитом сопряжено с дополнительными трудностями, так как инфекции, как правило, вызывают обострение аллергического процесса, часто протекают с осложнениями в виде обструктивного синдрома на фоне характерных иммунологических нарушений, отита, синусита, не все медикаментозные препараты переносятся ребенком. Учитывая описанный выше комплексный механизм действия Эреспала, целью нашего исследования явилось изучение его влияния на течение ОРВИ и клинические проявления атопического дерматита у детей.
Эреспал использовался при лечении 39 детей с острым бронхитом, имеющих атопический дерматит в стадии неполной ремиссии. Возраст больных составил от 2 до 7 лет. Оценка выраженности симптомов в динамике осуществлялась по балльной системе (от 0 до 5 баллов по возрастающей). Основанием для включения в исследование являлось наличие у больного выраженного кашля разного характера, интоксикации, физикальных изменений в легких.
Пациенты, имеющие клиническую картину острого бронхита, были разделены на две группы: в 1-ю вошли дети с легким течением атопического дерматита (22 человека), во 2-ю - со среднетяжелым (17 детей). Для объективной оценки степени тяжести течения заболевания и эффективности проводимой терапии у детей с атопическим дерматитом мы использовали коэффициент SCORAD. У детей 1-й группы индекс SCORAD составил от 0 до 10 (среднее значение 7,5), 2-й - от 10 до 18 (среднее значение 14,8).
В анамнезе у всех детей имело место ухудшение течения атопического дерматита на фоне ОРВИ. До начала лечения и в процессе проводимой терапии всем больным назначали комплексные общелабораторные исследования, включающие общий анализ крови, клинический анализ мочи, биохимический анализ крови, ультразвуковое исследование брюшной полости, а также другие исследования и консультации специалистов (по необходимости).
Все дети получали Эреспал (суточная доза препарата составляла 4-6 мг/кг в 2 приема) и базисную терапию атопического дерматита в виде Зиртека в возрастной дозировке. Наружная терапия не проводилась. Продолжительность курса терапии Эреспалом составляла в обеих группах 7-10 дней.
В контрольную группу были включены дети с аналогичными клинико-лабораторными и анамнестическими данными: 20 человек с легким течением атопического дерматита (среднее значение индекса SCORAD 7,3) и 18 пациентов со среднетяжелым течением заболевания (среднее значение индекса SCORAD 14,5). Лечение в контрольной группе включало назначение противовирусных препаратов, отхаркивающих средств, Зиртека в возрастных дозировках, симптоматической терапии по показаниям.
В процессе лечения оценивали динамику основных клинических симптомов атопического дерматита у наблюдаемых больных (эритемы, отека, папул, лихенификации, шелушения, зуда и сухости кожи). Статистически значимой динамики клинических признаков атопического дерматита у детей, получавших Эреспал, в обеих подгруппах не установлено, усиления кожных проявлений не наблюдалось ни у одного ребенка. У 10 детей отмечена тенденция к улучшению состояния кожи на фоне приема Эреспала. Побочных явлений при применении Эреспала не выявлено. В контрольной группе у 82% детей со среднетяжелым течением атопического дерматита выявлено усиление клинических проявлений (к 10 дню лечения среднее значение индекса SCORAD составило 20,7), в подгруппе с легким течением заболевания - у 69% больных (среднее значение индекса SCORAD через 10 дней - 13,4).
Таким образом, полученные нами результаты исследования позволяют считать применение Эреспала (фенспирида) у детей с ОРВИ, протекающей на фоне атопического дерматита, целесообразным в качестве противовоспалительной терапии. Это повышает эффективность лечения детей и позволяет значительно уменьшить частоту обострений атопического дерматита на фоне респираторной вирусной патологии.
Литература:
1. Зайцева О.В. Современные подходы к лечению острых респираторных инфекций у детей. Возможности системной противовоспалительной терапии. Вопр. совр. педиатр. 2008; 7:93-8.
2. Малахов А.Б., Кондюрина Е.Г, Ревякина В.А. и др. Современные аспекты профилактики респираторных инфекцийу детей сатопией.Леч. врач. 2007; 7:91-3.
3. Намазова Л.С., Ботвиньева В.В., Вознесенская НИ. Современные возможности иммунотерапии часто болеющих детей с аллергией. Педиатр. фармакол. 2007; 4 (1).
4. Самсыгина ГА, Фитилев С.Б., Левин АМ. Результаты многоцентрового исследования эффективности фенспирида гидрохлорида (Эреспал) при лечении острой респираторной инфекции у детей. Педиатрия. 2002; 2: 81-5.
5. Самсыгина ГА, Коваль Г.С. Часто болеющие дети: проблемы диагностики, патогенеза и терапии. Леч. врач. 2009; 1:10-5.
6. Середа Е.В., Геппе НА., Почивалов А.В. и др. Фенспирид (Эреспал) в терапии бронхитов у детей. Пособие для педиатра. М., 2001.
7. Таточенко В.К Профилактика ОРВИ у детей с аллергией. Справ. педиатра. 2008; 10: 21-5.
Резюме. Рассмотрены подходы к диагностике и терапии атопического дерматита (АтД), фенотипы АтД и современные представления о патогенезе этого заболевания, основные принципы комплексного лечения детей с АтД, включая диетотерапию и препараты для системной и наружной терапии АтД.
Ключевые слова: дети, атопический дерматит, филаггрин, эпидермальный барьер.
Atopic dermatitis, modern strategy in the therapy
V. A. Revyakina, A. V. Taganov, E. D. Kuvshinova, I. A. Larkova, V. A. Mukhortykh
Abstract. Approaches to the diagnostics and therapy of atopic dermatitis (AtD) were studied, as well as AtD phenotypes and modern views on pathogenesis of this disease, main principles of complex therapy for children with AtD, including dietary therapy and preparations for systemic and topical AtD therapy.
Keywords: children, atopic dermatitis, filaggrin, epidermal barrier.
Атопический дерматит (АтД) - широко распространенное хроническое воспалительное заболевание кожи, в развитии которого участвуют сложные генетические и иммунные механизмы 3. Заболевание возникает в раннем детском возрасте, особенно у детей с наследственной предрасположенностью к атопии, характеризуется рецидивирующим течением, возрастными особенностями локализации и морфологии очагов воспаления. Многочисленные исследования и клинические наблюдения свидетельствуют о различных фенотипах АтД, обуславливающих неодинаковый ответ и эффективность на проводимую стандартную терапию, что связано с многообразием триггерных факторов и разнообразием факторов окружающей среды в разных странах мира, влияющих на течение заболевания [4,5]. В настоящее время большинство исследователей выделяют группу больных с ранним дебютом заболевания и высоким риском развития респираторных проявлений аллергии, таких как бронхиальная астма и аллергический ринит. Отмечено, что сопутствующие заболевания достоверно чаще развиваются у детей раннего возраста с тяжелым течением АтД [6].
Таблица 1
Диагностические критерии АтД [17]
Таблица 2
Фенотипы АтД (D. Y. M. Leung и соавт.)
| АтД с дебютом в раннем детском возрасте, спонтанно разрешается до 5-летнего возраста |
| АтД с дебютом в подростковом возрасте или у взрослых, легкой и средней степени тяжести |
| АтД с дебютом в подростковом или взрослом периоде, с тяжелым персистирующим течением |
В зависимости от механизмов развития выделят следующие фенотипы АтД (табл. 3).
Таблица 3
Фенотипы АтД в зависимости от механизмов развития
| Экзогенный (IgE-опосредованный) | Эндогеннный (не IgE-опосредованный) |
| + sIgE-антитела к пищевым и ингаляционным аллергенам | С признаками вторичной инфекции, сопровождающейся колонизацией кожи S. aureus С вирусной инфекцией с развитием тяжелого осложнения - герпетиформной экземы Капоши |
Следует заметить, что различные фенотипы АтД нередко имеют общие черты и симптомы и в большинстве случаев доминирующая клиническая картина определяет соответствующий клинический фенотип заболевания. Очень важно, что выделение клинических фенотипов, установление провоцирующих факторов, определение генетических и биологических маркеров помогают в выборе адекватного лечения и профилактике развития респираторных проявлений аллергии (бронхиальной астмы и аллергического ринита) 24.
Согласно современным представлениям патогенез АтД обусловлен следующими механизмами:
- нарушение эпидермального барьера на разных уровнях: физическом (pH кожи, роговой слой, десмосомы, плотные межклеточные контакты), биохимическом (липиды, органические кислоты, лизосомы, антимикробные пептиды) и иммунном (лимфоциты, нейтрофилы, моноциты, клетки Лангерганса) [26, 27];
- нарушение иммунного ответа;
- особенности микробиома кожи;
- развитие IgE-зависимой специфической сенсибилизации к аллергенам;
- аутоиммунные механизмы развития заболевания.
Иммунопатогенез АтД связан с участием различных популяций иммунокомпетентных клеток. Основными участниками иммунного ответа являются Т-лимфоциты, дендритные клетки, кератиноциты, моноциты и эозинофилы. В настоящее время существует концепция двухфазного иммунного ответа при АтД. Так, в первую фазу иммунного ответа при остром воспалении при АтД происходит активация Th2-иммунного ответа различными антигенами, проникающими через кожу, и выработка специфических IgE антител В-клетками.
Активация синтеза IgE-антител - это ведущее патогенетическое звено в развитии АтД. При хроническом течении АтД происходит переключение Тh2-типа иммунного ответа на Th1-тип в то время, когда продукция цитокинов Тh2-профиля резко уменьшается. Для этой фазы характерно повышение уровней ИЛ-12, ИЛ-5, ИЛ-8 и ИФН-γ, ИЛ-3 и GM-CSF. Иммунный ответ характеризуется не количеством Т-лимфоцитов, а изменением дифференцировки Т-лимфоцитов (Th0) и профиля их цитокинов. Роль ИЛ-4, ИЛ-5, ИЛ-12, ИФН-γ, ИЛ-31, ИЛ-10 в патогенезе АтД изучена достаточно хорошо. В то же время участие ИЛ-17, ИЛ-22 пока не раскрыто. Появляются сведения об участии ИЛ-25 в патогенезе этого заболевания. Исследование роли цитокинов в механизмах развития АтД крайне перспективно, поскольку именно нарушения в этой системе служат мишенью для разработки новых методов терапии. Большинство современных методов лечения АтД относятся к иммунотерапии, поскольку они направлены на коррекцию дисбаланса иммунного ответа и подавление патологических иммунных реакций. Активно развиваются новые иммунологически обоснованные методы терапии, к которым относятся не только традиционные фармакологические препараты, но и биологические агенты (цитокины, антитела и гибридные белки).
Успех терапии АтД во многом определяется комплексным подходом с использованием терапевтических мероприятий, среди которых следует выделить: элиминацию триггерных факторов, диетотерапию, системную и наружную терапию, а также психокоррекцию. В первую очередь следует исключить причинно-значимые в развитии заболевания факторы, необходимо удаление источников различных аллергенов из окружения ребенка.
Основной и неотъемлемой частью комплексного лечения детей с АтД является диетотерапия, основными принципами которой являются:
а) исключение из рациона питания доказанных непереносимых пищевых продуктов с соблюдением длительности элиминации;
б) элиминируемый продукт должен быть заменен на переносимый, сопоставимый по пищевой ценности, содержанию макро- и микронутриентов;
в) полноценное обеспечение физиологических потребностей организма в энергии, основных пищевых веществах, витаминах и минералах;
г) соблюдение квоты белка;
д) обеспечение в диете количества жира, составляющего не более 30% от суточной калорийности рациона;
е) дробный режим питания: 4-6-разовый прием пищи в зависимости от возраста.
Точное установление пищевого продукта, вызывающего развитие аллергических реакций, правильное определение длительности элиминации в значительной мере определяют эффективность диетотерапии.
В клинической практике нередко встречаются ситуации, когда элиминационные диеты назначаются без доказательства причинно-значимой связи с употреблением непереносимого пищевого продукта и развитием симптомов болезни. Все это приводит к необоснованному исключению многих продуктов питания из рациона ребенка и является причиной развития дефицитных состояний и/или недостаточности макро- и микроэлементов с соответствующими функциональными нарушениями. Несбалансированное питание и недостаточное поступление витаминов и микроэлементов существенно отражаются на общем состоянии ребенка, могут приводить к нарушению минерального и костного метаболизма и утяжелению кожного процесса.
Бесспорное преимущество в достижении положительных результатов лечения принадлежит персонализированной диетотерапии, которая дает возможность подбора индивидуального лечебного питания. Для диетотерапии молочной аллергии у детей первого года жизни, находящихся на искусственном вскармливании, используют следующие виды специализированных продуктов:
- гидролизаты белка коровьего молока, состоящие из смеси пептидов, лишенных антигенных детерминант;
- смеси синтетических аминокислот;
- лечебные соевые смеси с учетом возраста ребенка (старше 6 месяцев жизни при отсутствии аллергических реакций на белки сои);
- гипоаллергенные продукты и блюда прикорма - гипоаллергенные каши, плодоовощные и мясные пюре.
Из других методов лечения АтД следует указать фототерапию и системную терапию, которые постоянно совершенствуются. Среди методов фототерапии наиболее эффективными считаются узкополосная средневолновая терапия с длиной волны 311 нм и ультрафиолетовая длинноволновая терапия с длиной волны 340-400 нм.
Препараты для системной терапии АтД, рекомендуемые при тяжелом течении болезни, представлены в табл. 4. Данные препараты обладают выраженным иммуносупрессивным или цитостатическим действием. Они способны подавлять пролиферацию Т-лимфоцитов и высвобождение провоспалительных цитокинов.
Таблица 4
Препараты для системной терапии АтД
| Препарат | Дозировка | Длительность приема |
| Циклоспорин* | 150-300 мг/сутки, у детей 3-6 мг/кг/сутки | 1-4 недели |
| Метотрексат* | 7,5-25 мг/неделю У детей 0,2-0,7 мг/кг/неделю | 4-8 недели |
| Микофенолат мофетил* | 1,0-1,5 г per os дважды в день У детей 30-50 мг/кг/сутки | 4-8 недели |
| Азатиоприн* | 1-3 мг/кг/сутки У детей 1-4 мг/кг/сутки | 4-8 недели |
| Примечание. * При использовании данных препаратов необходим систематический контроль над артериальным давлением, функцией почек и печени, уровнями магния и мочевой кислоты. | ||
Данные литературы свидетельствуют, что каждый из представленных препаратов для системной терапии АтД может быть эффективным для конкретного больного. Однако они имеют ряд побочных реакций, для предупреждения которых следует строго придерживаться выполнения инструкций к данным препаратам. Очень важно оценивать риск и пользу при назначении этих препаратов.
В период обострения АтД, протекающего с выраженным зудом кожных покровов, нарушением сна, имеющих другие аллергические появления, назначаются антигистаминные препараты.
Характерные особенности АтД, отличающие его от других заболеваний кожи, требуют постоянного применения средств наружной терапии. В клиническую практику предложен и внедрен новый подход к проведению наружной терапии АтД. Смысл этого подхода заключается в использовании активных наружных средств не только в период обострений, но и в период ремиссий, когда сохраняются патологические изменения в коже даже без видимых признаков воспаления 31. В соответствии с клиническими проявлениями заболевания и локализацией очагов поражения используются различные лекарственные средства и различные их формы. Для купирования острых проявлений АтД применяются нестероидные и стероидные противовоспалительные наружные средства (табл. 5).
Таблица 5
Противовоспалительные средства наружного применения
Противовоспалительный эффект осуществляется за счет связывания с глюкокортикостероидными (ГКС) рецепторами, расположенными внутри клеток-мишеней. На клеточном уровне выраженное противовоспалительное и антипролиферативное действие топических ГКС связано с ингибированием маркеров воспаления в эндотелиальных клетках и молекул адгезии эндотелия сосудов. Универсальный механизм действия топических ГКС позволяет эффективно контролировать АтД на любой стадии болезни. В настоящее время выделяют несколько классов топических ГКС в зависимости от степени их активности (в Европе I-IV, в США - I-VII).
Топические ГКС применяют строго в соответствии с инструкциями. Они наносятся на пораженные участки кожи 1-2 раза в сутки, длительность до 5-10 дней. Побочные эффекты возникают в случаях неконтролируемого длительного применения без учета локализации очагов поражения.
В настоящее время активно изучаются топические препараты из группы ингибиторов фосфодиэстеразы-4, фермента, который регулирует метаболизм циклического аденозинмонофосфата (цАМФ) в иммунных клетках [40]. Они подавляют все фазы воспаления (синтез и продукция провоспалительных цитокинов, выделение свободных радикалов, пролиферация фибробластов, выделение протеолитических ферментов). Для терапии АтД предложены топические формы (крем ципамфиллина и крем крисоборола), эффективность которых в настоящее время исследуется.
В последние годы большой интерес вызывают препараты таргетной терапии, действие которых направлено на определенные иммунопатогенетические механизмы АтД (табл. 6), а именно повышение устойчивости к воздействию специфических антигенов, подавление ТЪ2-иммунного ответа, а также воздействие на определенные белки, которые участвуют в развитии воспаления.
Таблица 6
Биологические препараты для лечения больных АтД
| Мишень | Лекарственное средство | Фазы исследования |
| ИЛ-5R + ИЛ-13 | Дупилумаб, Питракинра | III |
| ИЛ-13 | Лебрикизумаб, Тралокинумаб | III |
| ИЛ-17 | Секукинумаб | II |
| ИЛ-22 | ILV-094 | II |
| ИЛ-31 | CIM331 (немолизумаб) | II |
| ИЛ-31R | BMS-981164 | I |
| ИЛ-12/ИЛ-23p40 | Устекинумаб | II |
| ТСЛП | Medi9929 | II |
| CR Th2 | QAW039 | II |
| JAK-ингибитор | Pf-04965842 | II-III |
| PDE-4 ингибитор | Топические Ципамфиллин Крисаборол E6005 Пероральный Апремиласт | II |
| IgE-специфическая иммуноабсорбция | ||
| CD20 | Ритуксимаб | |
| Гистамин 4 рецептор | ZPL-389 | II |
| АСИТ у пациентов с сенсибилизацией к аэроаллергенам | Экстракты различных аэроаллергенов | II и III |
Активно изучается эффективность и безопасность целого ряда биологических препаратов (рекомбинантных и человеческих), воздействующих на определенные мишени: антагонисты ИЛ-Ш, ИЛ-2, ИЛ-4, ИЛ-5, ФНО-α и его рецепторов, ИЛ-8, ИЛ-31. Интересны исследования, посвященные изучению применения препаратов ИФН-γ при АтД [41].
Таким образом, очевидно, что системная иммунотерапия не может быть одинаково эффективна для всех больных АтД. Для них нужна индивидуальная схема лечения в зависимости от участия конкретных иммунных механизмов в каждом конкретном случае. Системная иммунотерапия показана при отсутствии контроля заболевания с помощью стандартных схем терапии. Они показаны в тех случаях, когда тяжесть течения АтД существенно влияет на повседневную активность, психоэмоциональное состояние пациента и оказывает негативное влияние на качество жизни больного.
Еще одним методом, широко применяемым при АтД, является энтеросорбция, смысл которой заключается в выведении из организма аллергенов и токсинов. Для этого используются энтеросорбенты - препараты медицинского назначения, обладающие высокой сорбционной емкостью, не разрушающиеся в желудочно-кишечном тракте (ЖКТ) и способные связывать экзо- и эндогенные вещества путем адсорбции, ионообмена или комплексообразования.
Актуальным на сегодняшний день является поиск значимых специфических иммунологических и воспалительных маркеров АтД. Это поможет для разработки новых лекарственных средств направленного действия, а также даст возможность заранее проводить отбор пациентов, которым необходимо лечение определенными препаратами, что существенно повысит эффективность терапии.
Для цитирования: Иванов О.Л., Львов А.Н., Миченко А.В. Атопический дерматит: современные представления. РМЖ. 2007;19:1362.
Введение Атопический дерматит (АД) – наследственное, иммуно–нейро–аллергическое, хроническое рецидивирующее воспалительное заболевание кожи, обусловленное атопией, проявляющееся интенсивным зудом, симпатергической реакцией кожи (белым дермографизмом), преимущественно эритематозно–лихеноидными высыпаниями, в сочетании с другими признаками атопии.
Литература
1. Иванов О.Л., Мареева Е.Б., Кривда А.Ю. Современный антигистаминный препарат зиртек в терапии аллергодерматозов // Росс. журн. кожн. вен. бол., 1999, № 5, с. 23–26.
2. Иванов О.Л., Самгин М.А. Адвантан – препарат выбора для наружной терапии аллергодерматозов у детей // Росс. журн. кожн. вен. бол., 2000, № 3, с. 28–30.
3. Короткий Н.Г., Шарова Н.М., Тихомиров А.А. Новые возможности терапии атопического дерматита у детей в зависимости от его клинико–патогенетических вариантов // Росс. журн. кожн. вен. бол., 2000, № 6, стр. 35–38.
4. Кочергин Н.Г. Атопический дерматит // Росс. журн. кожн. вен. бол., 1998, № 5, с. 59–64.
5. Кочергин Н.Г. Опыт применения неорала при атопическом дерматите у детей // Росс. журн. кожн. вен. бол., 1998, № 2, с. 35–37
6. Кунгуров Н.В. Иммунологические аспекты атопического дерматита // Вестн. дерматол. венерол., 1999, № 3, с. 14–17.
7. Сергеев Ю.В. (ред.) Атопический дерматит (руководство для врачей). – М.: Медицина для всех, 2002. – 183 с.
8. Сергеев Ю.В., Константинова Н.А., Грабовская О.В., Кортукова В.М. Атопический дерматит // Вестн. дерматол. венерол., 1990, № 1, с. 8–11.
9. Скрипкин Ю.К. (ред.) Кожные и венерические болезни (руководство для врачей). – М.: Медицина, 1995. – Т. II, стр. 52–68.
10. Суворова К.Н., Антоньев А.А., Довжанский С.И., Писаренко М.Ф. Атопический дерматит. – Изд–во Сарат. Ун–та, 1989. – 168 с.
11. Bieber T. Topical tacrolimus (FK 506): a new milestone in the management of atopic dermatitis. J Allergy Clin Immunol 1998;102:555–7.
12. European Task Force on Atopic Dermatitis. Severity scoring of atopic dermatitis: the SCORAD index. Dermatology 1993;186:23–31.
13. Hanifin JM, Rajka G. Diagnostic features of atopic dermatitis. Acta Derm Venereol Suppl (Stockh) 1980; 92:44–7.
14. Leung DYM, Rhodes AR, Geha RS, Schneider L, Ring J. Atopic dermatitis. In: Fitzpatrick TB, Eisen AZ, Wolff K, Freeberg IM, Austen KF, editors. Dermatology in general medicine. New York: McGraw–Hill; 1993:1543–64.
15. Rothe MJ, Grant–Kels JM Atopic dermatitis: An update. – Journal of the American Academy of Dermatology, Volume 35, Number 1, July 1996, p. 1–16.
16. Coca A.F., Cooke R.A. On classification of the phenomena of hypersensitiveness. J immunol 1923, 10:445.
17. Ring J., Erstbeschreibung einer “atopischen Familienanamnese” im Julisch–Claudischen Keiserhaus: Augustus, Claudius, Britannicus. Hautarzt 36:47–478.
18. Wallach D., Taieb A., Tilles G. Historie de la dermatite atopique. 2004, Masson, Paris.
19. Buske–Kirschbaum A., Jobst S., Wustmans A. Attenuated free cortisol response to psychological stress in children with atopic dermatitis. Psychosom Med 1997:59:419–426.
20. Amon U., Wolff H.H. Healing of chronic atopic dermatitis lesions in skin areas of paraplegia after trauma. J Dermatol 21(12):982–983.
21. ISAAC S.C. (1998) Worldwide wariation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC (The international Study of Asthma and Allergies in Childhood). Lancet 351:1225–1232.
22. Ring J., Przybilla B., Ruzicka T. Handbook of Atopic eczema. Berlin, Springer 2006.
Читайте также:

