Чем лечить дисбактериоз верхних дыхательных путей
Обновлено: 18.04.2024
В предлагаемом обзоре обобщены последние достижения в области изучения респираторной микробиоты, взаимосвязи микробиома верхних дыхательных путей и легкого, обсуждения возможных механизмов влияния микробиома на астму и аллергию. Идентификация не только па
The role of the respiratory tract microbiome in respiratory health N. G. Astafieva, D. Yu. Kobzev, I. V. Gamova, I. A. Perfilova, E. N. Udovichenko, L. V. Skuchaeva, I. E. Michailova
The proposed review summarizes recent advances in the study of respiratory microbiota, the relationship between the upper respiratory tract microbiome and the lung, and a discussion of the possible mechanisms of influence of the microbiome on asthma and allergies. Identifying not only pathogenic bacteria, but also commensals in the respiratory tract and gastrointestinal tract (Gut- Lung axis) is an innovative approach to finding out their role in the development of inflammation and modulation of the immune response in respiratory allergies.
Микробы, появившиеся около 3,5 млрд лет назад, являются самой древней группой организмов из ныне существующих на Земле. Повсеместная распространенность и суммарная мощность метаболического потенциала микроорганизмов определяют их важнейшую роль в круговороте веществ, поддержании динамического равновесия в биосфере Земли. Человек и микробы существуют друг с другом нераздельно, в организме человека обнаруживаются тысячи видов бактерий, архей, грибов и вирусов. Учитывая их огромное влияние на жизнедеятельность макроорганизма, современная наука рассматривает человека уже как суперорганизм, состоящий не только из соматических клеток, но и из огромного количества микроорганизмов. Тысячелетия взаимодействия микрофлоры и организма человека научили человека с помощью иммунной системы не только эффективно защищаться от патогенов, но и предотвращать аутоиммунные и аллергические заболевания — т. е. развили способность к иммунной регуляции или модуляции. Новые взгляды на взаимодействие иммунной системы с нормальной микробиотой как на самостоятельное явление, устанавливающее взаимоотношения с симбионтными микроорганизмами, являются современным подходом к пониманию живых систем, уточнению разнообразных типов многомерных взаимодействий и более полному пониманию сложных фенотипов аллергических и других иммунозависимых заболеваний. Растущая доступность высокопроизводительных технологий позволила провести общесистемное профилирование генома, транскриптома, эпигенома, микробиома и метаболома, изменила наши представления, обеспечивая фундамент для исследования астмы и аллергии на принципиально ином уровне, исходя из новой парадигмы сложного взаимодействия между микробиомом и его хозяином, которые могут провоцировать или препятствовать формированию респираторного заболевания.
Терминология
В связи с имеющимися в публикациях разночтениями по использованию некоторых терминов в контексте данной статьи предлагаются следующие уточнения.
Нормофлора (нормальная микрофлора) — определенное качественное и количественное соотношение разнообразных популяций микробов отдельных органов и систем желудочно-кишечного тракта и других слизистых тканей, поддерживающее биохимическое, метаболическое и иммунологическое равновесие макроорганизма, необходимое для сохранения его нормального состояния.
Микробиом — все гены, находящиеся внутри данной микрофлоры (микробиоты), это совокупность геномов микроорганизмов, занимающих одну экологическую нишу, например, обитателей кожи человека или его кишечника.
Метагеном — весь генетический материал, получаемый из образца, например, содержимого кишечника. Метагеном — это набор генов всех микроорганизмов, находящихся в образце среды.
Экспосом — различные воздействия, которые могут повлиять на развитие аллергического заболевания. Эти экспозиции включает в себя следующие три вида воздействий: 1) общая среда, включая городскую или сельскую местность, климат, загрязнение воздуха, образование; 2) конкретная внешняя среда, включая диету, физическую активность, воздействие табака, инфекции, род занятий; 3) внутреннее тело, окружающая среда. Эти факторы одновременно в совокупности с иными взаимодействуют друг с другом и влияют на формирование аллергических заболеваний и респираторной патологии. Экспозиционно-ориентированные проекты (Exposome-focused projects) необходимы для изучения сложного взаимодействия генетики, окружающей среды и микробиома [2].
Научные проекты по изучению микробиома человека
Методы исследований и эволюция представлений о микробиоте и микробиоме
На протяжении многих лет, со времен Пастера и Коха, для изучения микробного разнообразия, селективного выделения представителей основных функциональных групп, в том числе патогенных микроорганизмов, использовались бактериоскопические и бактериологические (культуральные) методы. Используемые с конца XIX в. культуральные анализы (посевы) выявляли не более 1% микрофлоры. Особые проблемы возникали при культивировании анаэробов. В 1985–1993 гг. пришедшие на смену классическим микробиологическим подходам физико-химические методы анализа и молекулярно-генетические методы (ПЦР) позволили определить, что в кишечнике, например, обитает около 1000 видов микроорганизмов, 99% из которых анаэробные. При проведении ПЦР в реальном времени одновременно происходят амплификация, детекция и количественное определение специфической последовательности ДНК в образце, автоматическая регистрация и интерпретация полученных результатов [18].
Особой вехой в науке и медицине стали работы по секвенированию генома. Новые открытия позволили осознать, что человек — не только продукт своих собственных генов. Для полного понимания генетического материала нужно секвенировать геномы бактерий человека — из кишечника, с кожи, из носового канала, ротовой полости, дыхательных и мочеполовых путей. К началу XXI в. для исследования микробной популяции кишечника применили метод секвенирования генов 16S рРНК. Ген, кодирующий 16S рибосомальную РНК, стал идеальным маркером для идентификации микроорганизмов. Этот ген есть в геноме всех бактерий и архей, но отсутствует у эукариот и вирусов, имеет как консервативные участки, одинаковые у всех прокариот, так и видоспецифичные. Нуклеотидные последовательности 16S РНК всех известных бактерий общедоступны (генный банк). Секвенирование ДНК (определение нуклеотидной последовательности генов 16S РНК) позволило установить, что в кишечнике живет более тысячи видов микроорганизмов, но только 10% микрофлоры поддается культивированию [19].
На рис. 1 показано соотношение генов организма (22 000) и микробиома (8 000 000), от которого зависит степень их возможного влияния на различные функции.
В любом случае не следует рассматривать микроорганизмы, обитающие в различных локусах организма хозяина, как пассивные участники системы. С функциональной точки зрения их можно оценивать как еще один орган человека. По различным оценкам масса этого органа может достигать нескольких килограммов, а генетическое разнообразие в сотни раз больше генома человека. Изучение функции этого органа в норме и патологии — актуальная задача медицины настоящего и будущего.
Микробиом верхних дыхательных путей и его роль в респираторном здоровье
Наиболее полный анализ микробиоты человека в ходе реализации проекта HMP [5] при рассмотрении 27 отдельных участков тела выявил наличие 22 бактериальных фил, причем большинство последовательностей (92,3%) были связаны только с четырьмя филами:
1) Actinobacteria (36,6%);
2) Firmicutes (34,3%);
3) Proteobacteria (11,9%);
4) Bacteroides (9,5%).
Анализ сайтов распределения бактериальных фил (групп микроорганизмов, объединенных общим родством) у человека по анализу 16S рРНК-секвенирования показал, что самой населенной частью организма является пищеварительный тракт, где обитает 75–78% микроорганизмов — в основном бактерий (Firmicutes, Bacteroides, Actinobacteria и Proteobacteria), в выстилке кишечника обнаруживается от 5000 до 35 000 видов микроорганизмов. Эти факты укладывались в картину традиционных представлений о том, что желудочно-кишечный тракт связан с наиболее высокой бактериальной нагрузкой. Стандартные методы исследования образцов, полученных из локусов с высокой бактериальной нагрузкой, потребовали модификации при изучении сайтов, считавшихся стерильными (легкие), чтобы при обработке ДНК исключать фоновое загрязнение и более четко интерпретировать данные в зависимости от типа образца, объема, анатомического участка и клинических параметров [22].
Изучение физиологической роли микробиоты верхних дыхательных путей (ВДП) представляет особый интерес в свете концепции единства дыхательных путей (United Airways Disease), согласно которой верхние и нижние дыхательные пути считаются единой морфологической и функциональной единицей [23, 24], а связь, существующая между ними, наблюдается в течение многих лет как в отношении здоровья, так и в отношении заболеваний. Анатомические особенности строения дыхательных путей (короткое расстояние от ноздрей до альвеол — 0,5 м, отсутствие каких либо физических барьеров при открытой гортани) обеспечивают быструю микробную иммиграцию в нижние отделы дыхательных путей. Изменения микробных сообществ в ВДП у здоровых индивидов и при патологии позволяют лучше понимать их роль в регуляции иммунного контроля в дыхательных путях.
Связь между носовой микробиотой и реактивным, аллергическим или неаллергическим воспалением как верхних, так и нижних дыхательных путей включает сложную сеть процессов, начиная от рождения до старости. У новорожденных колонизация ВДП происходит в течение первых 2–3 суток. Возрастные особенности расселения микрофлоры представлены в обзорной статье [25].
Сразу же после родов микробиота дыхательных путей новорожденного аналогична материнской. Микробиота новорожденных относительно однородна по всем участкам дыхательных путей, но очень быстро (в течение дней и недель) дифференцируется в сообщества, специфичные для верхних и нижних дыхательных путей. Примерно до трех лет микробиота ВДП похожа на кишечную, после чего она приобретает относительную специфичность [26].
Адекватное созревание микробиома кишечника в ранний период может являться мощным протективным фактором в отношении бронхиальной астмы [27]. Ранняя колонизация кишечника Firmicutes, Clostridia и Bacteroides (преобладание у недоношенных) при снижении уровня Lactobacillus и Bifidobacteria, скудное микробное разнообразие предрасполагают к развитию атопии.
В отличие от традиционно проводимых культуральных исследований по ассоциации конкретных бактериальных паттернов с воспалительными профилями заболеваний, методы молекулярной биологии позволили выявлять более разнообразную микробиоту, чем считалось ранее, в том числе в ВДП, и высказать предположение о дополнительном защитном эффекте микробного разнообразия на астму. Первые результаты секвенирования по отношению к дыхательным путям здоровых субъектов привели к следующим фундаментальным выводам: у здоровых людей не только верхние, но и нижние дыхательные пути в норме содержат различные сообщества микроорганизмов. Дыхательные пути пациентов с респираторными заболеваниями содержат различные бактериальные сообщества, которые относительно обогащены типом Proteobacteria [29].
ВДП являются магистральным путем для осаждения бактериальных клеток из воздуха. Идентифицированы доминантные микроорганизмы на слизистых ВДП по ходу воздушного потока, начиная от ноздрей, полости носа, носоглотки [30]. Типичной резидентной флорой в этих локусах являются представители Actinobacteria, Firmicutes и Proteobacteria.
При заболеваниях ВДП, включая аллергический ринит, хронический риносинусит с полипами или без полипов, муковисцидоз, характер микробиоты и воспалительные профили существенно отличаются [31].
Для понимания их роли в патогенезе астмы важную роль сыграли дополнительные исследования носовых таксонов c помощью секвенирования 16S рибосомной РНК. Существуют различия в микробиоме носа у больных с астмой при обострении и стабильном течении. Носовая микробиота у пациентов со стабильной астмой была обогащена таксонами из Bacteroides и Proteobacteria. При обострении астмы более широко представлены четыре вида — Prevotella buccalis, Dialister invisus, Gardnerella vaginalis, Alkanindiges hongkongensis. Такие различия не исключают возможностей использования назальных таксонов как биомаркеров активности астмы [32].
Существует определенная топографическая непрерывность бактериальных популяций в респираторном тракте человека [33], следующим вслед за носом сайтом, детально изученным, стала микробиота носоглотки.
Микробиота носоглотки рассматривается как детерминанта для распространения инфекции на нижние дыхательные пути, тяжести сопровождающих воспалительных симптомов и риска развития будущей астмы. С одной стороны, носоглотка — резервуар для микробов, связанных с острыми респираторными инфекциями (ОРИ). Но пневмонии, возникающие в результате ОРИ в младенчестве, связаны с развитием астмы. Изучение микробиома носоглотки у 234 детей в течение критического первого года жизни показало, что у большинства младенцев первоначально отмечена колонизация Staphylococcus или Corynebacterium, в последующем — стабильная колонизация Alloiococcus или Moraxella. Вирусы инициировали преходящие вторжения Streptococcus, Moraxella или Haemophilus. Ранняя бессимптомная колонизация Streptococcus была сильным предиктором астмы, а использование антибиотиков нарушало бессимптомные образцы колонизации. В отсутствие эффективных антивирусных терапий нацеливание на патогенные бактерии в микробиоме носоглотки может представлять собой профилактический подход к астме [34].
В систематическом обзоре исследований микробиома околоносовых пазух, в которых использовали глубокое секвенирование гена рибосомальной РНК 16S [35], дана информация о выявлении в среднем 1587 таксонов (диапазон 911–2330). Несмотря на гетерогенность исследований, в каждой выборке контрольных пациентов и пациентов с хроническими риносинуситами были идентифицированы филы Firmicutes, Actinobacteria и Bacteroides. Не было обнаружено существенных различий между микробиотой здоровых и микробиотой пациентов с хроническим риносинуситом, но при некоторых фено/эндотипах хронического риносинусита отмечалось обогащение золотистым стафилококком.
Исследование специфического влияния конкретных бактерий на иммунный ответ слизистых носа и околоносовых пазух проливает новый свет на патофизиологию как хронических ринитов, риносинуситов, так и их влияния на астму [31].
Окончание статьи читайте в следующем номере.
Н. Г. Астафьева* , 1 , доктор медицинских наук, профессор
Д. Ю. Кобзев**, доктор медицинских наук, профессор
И. В. Гамова*, кандидат медицинских наук
И. А. Перфилова*, кандидат медицинских наук
Е. Н. Удовиченко*, кандидат медицинских наук
Л. В. Скучаева*, кандидат медицинских наук
И. Э. Михайлова*
* ФГБОУ ВО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
** Лидс Тринити университет, Лидс, Великобритания
Роль микробиома дыхательных путей в респираторном здоровье (часть 1)/ Н. Г. Астафьева, Д. Ю. Кобзев, И. В. Гамова, И. А. Перфилова, Е. Н. Удовиченко, Л. В. Скучаева, И. Э. Михайлова
Для цитирования: Лечащий врач № 4/2019; Номера страниц в выпуске: 12-15
Теги: микробиом человека, воспаление, бронхиальная обструкция.
Слизистая оболочка верхних дыхательных путей представляет собой первую линию защиты организма против разнообразных патогенных факторов окружающей среды, таких как бактериальные, грибковые, вирусные, промышленные химические раздражители и загрязнения и обеспечивает противовирусный иммунитет. Повреждение слизистой или сухость облегчают проникновение вируса в организм. После того, как враг попал в организм и начал повреждать клетки, огромное значение играет выработка интерферонов, которые обеспечивают их невосприимчивость к действию вируса.
Противовирусный иммунитет – это очень сложный процесс, в котором участвует множество ресурсов иммунной системы. К сожалению, иммунные реакции не всегда срабатывают так, как об этом пишут в учебниках по биологии. Часто какой-либо процесс может быть нарушен, что приводит к осложнениям и проблемам. Когда снижен иммунный ответ, нужны средства, поднимающие иммунитет. Они могут быть природными, либо купленными в аптеке, главное – это эффективность и безопасность.
Слизистая оболочка верхних дыхательных путей большей частью покрыта тонким специализированным эпителием, создающим восприимчивый (чувствительный) барьер, который постоянно бомбардируется экзогенным живым или мертвым антигенным материалом.
Вдыхаемый воздух содержит значительное количество потенциально вредных веществ (газы, взвешенные корпускулярные частицы, бактерии, вирусы, микоплазмы, грибы, в том числе дрожжи, риккетсии, пыльцу, частицы слущенного эпителия человека и животных и др.). Согласно концепции местного иммунитета, слизистые оболочки и кожа как покровы, обращенные во внешнюю среду, защищают внутреннюю среду организма и сохраняют постоянство внутренней среды путем тесного взаимодействия эволюционно выработанного комплекса неспецифических и специфических механизмов защиты.
Местный иммунитет ЛОР-органов - это барьерная функция слизистых оболочек, включающая лимфоэпителиальные органы глотки, расположенные на пересечении воздухоносных и пищепроводных путей, первыми реагирующие на очередное антигенное раздражение (инфекцию) включением механизмов иммунной защиты, и неспецифические защитные факторы слизистой оболочки (мукоцилиарный транспорт, продукция лизоцима, лактоферрина, интерферона и др.)
А теперь непосредственно о микрофлоре верхних дыхательных путей и полости рта. Важно понимать, что ЛОР-органы не являются исключением в отношении микробной стерильности, т. е. в норме мы можем выявлять определенные микроорганизмы в носу, глотке и наружном ухе. Эти микробы в условиях сохранения иммунной резистентности не только не приносят нам никакого вреда, но и наоборот, оказывают положительное влияние. Они образуют так называемую биопленку (толщиной от 0,1 до 0,5 мм) – полисахаридный каркас которой, состоящий из микробных полисахаридов и муцина, предотвращает заселение организма патогенными микроорганизмами. Благодаря выделению микроорганизмами биопленки различных кислот, спирта, лизоцима (антибактериальное вещество) и стимуляции образования иммуноглобулина А тормозится развитие патогенных микробов. Кроме того, нормальные микроорганизмы препятствуют выделению токсинов патогенными бактериями.

Это лишний раз подтверждает важность сбалансированной микрофлоры для полноценной жизнедеятельности всего организма.
Нормальная микрофлора глотки разнообразна, поскольку здесь смешивается микрофлора полости рта и воздухоносных путей. Представителями резидентной микрофлоры считаются: нейссерии, дифтероиды, и гемолитические стрептококки, энтерококки, микоплазмы, коагулазоотрицательные стафилококки, моракселлы, бактероиды, боррелии, трепонемы, актиномицеты. В верхних дыхательных путях преобладают стрептококки и нейссерии, помимо этого встречаются стафилококки, дифтероиды, гемофильные бактерии, пневмококки, микоплазмы, бактероиды. Слизистая оболочка гортани, трахеи, бронхов в норме стерильна. Следует сказать, что вышеуказанный видовой спектр микроорганизмов не является неизменным. Его состав зависит от многих факторов: сопутствующей патологии, возраста, условий внешней среды, условий труда, питания, перенесенных заболеваний, травм и стрессовых ситуаций и т.д.
Такие состояния, как острые и хронические заболевания всего организма, а особенно уха, горла, носа и полости рта, аллергия, неблагоприятные физические факторы (переохлаждение, инсоляция и т. д.), химические агенты, физическое, интеллектуальное и психоэмоциональное перенапряжение, прием антибактериальных, гормональных и цитостатических препаратов, недостаточное питание, гиповитаминоз, профессиональные вредности, курение, алкоголь провоцируют нарушение нормального микробиологического равновесия в ЛОР-органах и являются причинами нарушения качественного и количественного состава микрофлоры ротоглотки. Существует бактериологическое понятие, которое характеризует изменение соотношения представителей нормальной микрофлоры, снижение числа или исчезновение некоторых видов микроорганизмов за счет увеличения количества других и появления микробов – это дисбактериоз.
Терапия дисбактериоза должна быть строго индивидуальной и направленной в первую очередь на ликвидацию источника проблемы. Например, пока не будет адекватно пролечен аденоидит (консервативно или оперативно), от дисбактериоза вряд ли возможно избавиться. Вопрос о необходимости приема антибиотика определяется исключительно течением основного заболевания: если дисбактериоз глотки вызван наличием у ребенка хронического панкреатита, то антибактериальные средства тут неуместны; если же дисбактериоз связан с запущенной формой хронического синусита или аденоидита – без этой группы лекарственных препаратов, скорее всего, не обойтись. Воспалительные очаги в носо- и ротоглотке должны быть обязательно устранены – кариозные зубы пролечены, аденоидные вегетации, небные миндалины санированы и т.д. Помните, что они могут не только вызывать местные воспалительно-инфекционные процессы и дисбактериоз ротоглотки, но и являться источником аутоинфекции и аутоинтоксикации всего организма. Убедительные данные свидетельствуют, что возникновение ряда заболеваний респираторной, желудочно-кишечной, сердечно-сосудистой систем, опорно-двигательного аппарата обусловлено очаговой инфекцией в ротоглотке. Поэтому санация полости рта и ЛОР-органов – это обязательное условие и первый шаг к выздоровлению при многих патологических процессах.
Не стоит также забывать о мерах профилактики развития инфекционно-воспалительных процессов ротоглотки и ЛОР-органов. Так, стандартными мерами профилактики являются: ежедневные гигиенические мероприятия (туалет носа), регулярное посещение врача, рациональное питание, закаливание, создание оптимального микроклимата (влажность, температура), лечение сопутствующей патологии.
Кроме вышеперечисленных мер профилактики, помочь решить проблему инфекционно-воспалительных заболеваний ЛОР-органов и помочь восстановить нормальный микробиоценоз слизистой оболочки может прием средств растительного происхождения на основе прополиса.
Прополис – это смесь природных смол, вырабатываемых пчёлами из соединений, собираемых с разных частей растений, бутонов и выделений. Современные противомикробные применения прополиса включают рецептуры для лечения синдрома простуды (инфекции верхних дыхательных путей, обычная простуда и гриппоподобные инфекции), для заживления ран, лечения ожогов, акне, простого и генитального герпеса, и нейродермита.
В структуре инфекционной заболеваемости детей ведущее место занимают респираторные инфекции [1–3]. Известно, что всеобщей закономерностью является повышенная восприимчивость к ним детей раннего и дошкольного возраста [6–8].
В структуре инфекционной заболеваемости детей ведущее место занимают респираторные инфекции [1–3]. Известно, что всеобщей закономерностью является повышенная восприимчивость к ним детей раннего и дошкольного возраста [6–8]. Именно среди детей указанной возрастной группы формируется особо выделяемая категория (15–30%) часто болеющих детей (ЧБД), вопросы лечения и оздоровления которых до сих пор остаются нерешенными и являются трудной задачей для педиатров [5–7]. У 67% ЧБД преимущественно рецидивирующей патологией становятся заболевания ЛОР-органов [9]. Характер воспалительного процесса в ротоглотке во многом зависит от реактивности иммунной системы, факторов местной защиты, в том числе микробиоценоза слизистой ротоглотки. Течение инфекционного процесса в ротоглотке могут обусловить различные микроорганизмы, в том числе и условно-патогенные [4, 6, 8, 10]. Вместе с тем состояние микробиоты ротоглотки изучено еще недостаточно. Отсутствуют однозначные представления о нормобиозе и значимости выделения различных видов микробов.
Нами проведено исследование микрофлоры задней стенки глотки у здоровых детей и больных различной респираторной патологией, госпитализированных в стационар. Обследован 351 ребенок в возрасте от 2 месяцев до 15 лет (в том числе: здоровые дети — 98, острый тонзиллит — 58, ОРВИ — 128, пневмония — 20, инфекционный мононуклеоз с гнойно-воспалительным поражением ротоглотки — 47). Использовалась стандартная методика забора мазков с миндалин и задней стенки глотки с проведением качественно-количественного определения состава выделенных микроорганизмов. Анализ полученных результатов был проведен по трем группам микроорганизмов (постоянные, добавочные, транзиторные), подразделенных в соответствии с частотой и количеством их обнаружения у здоровых детей по методу Воропаевой Е. А. [11]. По данным автора постоянная (облигатная) микрофлора данного биотопа в основном представлена альфа- и гамма-гемолитическими стрептококками (105–106 КОЕ/мл) и нейссериями (102–104 КОЕ/мл). Добавочную группу составляют стафилококки, коринебактерии и гемофилы, выделяемые у 26,9–46,2% здоровых детей, в количестве 101–104 КОЕ/мл. К случайным (транзиторным) микроорганизмам отнесены Bacillus, грибы рода Candida, Micrococcus, синегнойная палочка, грамотрицательные энтеробактерии в количестве не выше 101–102 КОЕ/мл, в 1,9–25,0%. Частота выделения различных видов микробов и интенсивность обсеменения ими задней стенки глотки у различных групп детей приведена в табл. 1.
Сравнительный анализ полученных результатов обнаружил достоверные различия в состоянии микроэкологии задней стенки глотки в группах здоровых детей и пациентов с респираторной патологией (табл. 2).
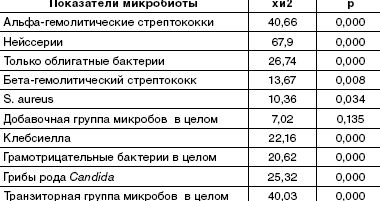
При гнойном или катаральном воспалительном процессе в ротоглотке обнаружено угнетение облигатной ассоциации альфа-гемолитического стрептококка и нейссерий, образующих защитную биопленку. Дисбиоз локуса развивался в 75–100% случаев. Он имел определенные особенности в зависимости от характера инфекционного процесса. Наиболее выраженное угнетение пролиферации облигатных бактерий было обусловлено местным гнойно-воспалительным процессом при ангине и системным поражением при пневмонии (рис. 1).
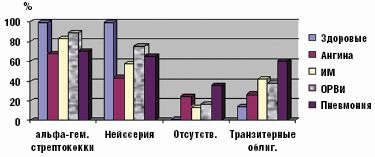
Именно при данной патологии чаще всего отсутствовали облигатные микробы, выделялись монокультуры или ассоциации микроорганизмов, состоящие только из добавочных и/или транзиторных представителей с высокой вероятностью их этиологической значимости, обнаруживались отрицательные посевы (рис. 2). Наиболее устойчивым компонентом облигатной ассоциации был стрептококк, отсутствие нейссерий либо снижение их количества наблюдалось значительно чаще.
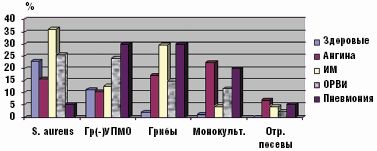
Инициация инфекционного процесса респираторными вирусами способствовала преимущественной пролиферации грамотрицательных бактерий (особенно клебсиеллы) в больших количествах (более 104 КОЕ/мл), а также их ассоциаций (р = 0,000, рис. 2). Синегнойная палочка выделялась только у ЧДБ либо больных пневмонией. Лечение в стационаре способствовало нарастанию частоты обнаружения грамотрицательных микробов в 2–3 раза вне зависимости от этиологии инфекционного процесса. Обнаружение грамотрицательных бактерий у здоровых детей являлось следствием перенесенной ОРВИ (20% против 0, р < 0,001) и сохранялось до двух месяцев. Наиболее часто грамотрицательные бактерии высевались со слизистой ротоглотки у детей первого года жизни (р = 0,002) или часто болеющих (р = 0,004).
Пролиферация грибов рода Candida, особенно в больших количествах (более 102 КОЕ/мл), была характерна для больных инфекционным мононуклеозом, пневмонией, ЧБД — особенно младших возрастных групп (р = 0,000), активировалась на фоне антибактериальной терапии и расценивалась как неблагоприятный фактор, поскольку отсутствовала у здоровых детей из группы эпизодически болеющих.
Наши данные показали, что отсутствие альфа-гемолитических стрептококков и/или нейссерий, обнаружение синегнойной палочки, грибов рода Candida и спорообразующих анаэробов, а также грамотрицательных бактерий нескольких видов или их монокультур является признаком глубокого дисбиоза и требует внимания педиатра. Оценка выраженности дисбиоза ротоглотки у детей, не имеющих признаков острой инфекции на момент обследования, должна проводиться с учетом клинического состояния пациентов их преморбидного состояния и анамнеза. Внимание следует уделять частоте эпизодов ОРВИ в году, срокам и тяжести последнего заболевания, а также наличию хронической патологии ЛОР-органов, поскольку именно наличие этих клинических признаков коррелировало с глубиной дисбиотических нарушений в ротоглотке.
Рассматривая состав микрофлоры слизистой оболочки задней стенки глотки как индикатор инфекционной резистентности детей, мы включали в состав комплексного лечения и реабилитации пациентов иммунотропные средства.
В качестве одного из современных иммуномодуляторов использован препарат Кипферон® суппозитории для вагинального или ректального введения. Кроме того, в терапевтический комплекс включались пробиотики: Полибактерин, Кипацид и Флорин форте.
Кипферон® представляет собой композицию из комплексного иммуноглобулинового препарата (КИП) с высоким содержанием специфических IgG, IgA и IgM и рекомбинантного человеческого интерферона альфа-2b. Содержащийся в препарате рекомбинантный человеческий интерферон альфа-2b обуславливает активацию местного иммунитета, позволяет эффективно устранять очаги воспаления, а КИП — уменьшает количество условно-патогенных микроорганизмов и устойчиво восстанавливает нормальную микрофлору, как минимум на протяжении 2–3 месяцев. У детей с ОРВИ, получавших Кипферон®, после лечения в 3 раза снизилась частота высева S. aureus (от 33,3% до 10%, p < 0,05). Не отмечено угнетение облигатных микроорганизмов. В 2 раза реже регистрировалась транзиторная микрофлора. В группе сравнения, в динамике лечения, возросло число несвойственных для данного биотопа микроорганизмов, в том числе выявлялись ранее отсутствовавшие гемолизирующая кишечная палочка и грибы рода Candida.
У больных тонзиллитом после лечения в 6 раз уменьшилась частота высева S. aureus (от 20% до 3,3%, p < 0,05), реже (6,6% против 24,2%, p < 0,05), чем в контроле, обнаруживались грамотрицательные энтеробактерии.
У больных инфекционным мононуклеозом лечение Кипфероном® способствовало улучшению микробиологических показателей, в том числе снижению числа детей с высоким уровнем (3–6) микробных ассоциантов на слизистой ротоглотки, элиминации S. aureus (от 53,3% до 23,1%), грибов рода Candida, бета-гемолитического стрептококка группы А (от 20% до 0%, p < 0,05).
Микробиологический эффект пробиотиков способствовал высеву исключительно облигатных микробов, отсутствию ассоциаций двух и более транзиторных микробов за счет элиминации микробов добавочной группы, энтеробактерий, синегнойной палочки и грибов рода Candida.
Таким образом, вышеизложенное позволяет считать целесообразным пересмотр значимости выделения отдельных видов микробов со слизистой ротоглотки. Наши исследования свидетельствуют о том, что препараты, действие которых направлено на повышение собственной противоинфекционной резистентности организма ребенка, должны составлять основу реабилитации часто болеющих детей.
По вопросам литературы обращайтесь в редакцию.
Л. В. Феклисова, доктор медицинских наук, профессор
Е. Р. Мескина, кандидат медицинских наук
Л. А. Галкина, кандидат медицинских наук
Е. Е. Целипанова, кандидат медицинских наук
Н. А. Савицкая, кандидат медицинских наук
С. П. Казакова, кандидат медицинских наук
Е. А. Воропаева, кандидат медицинских наук
ГУ МОНИКИ им. М. Ф. Владимирского, Москва
Ключевые слова: микробиота ротоглотки, дети, ОРВИ, инфекционный мононуклеоз, острый тонзиллит, Кипферон ® .
Инфекции верхних дыхательных путей (ИВДП) включают поражение слизистой оболочки респираторного тракта от полости носа до трахеобронхиального дерева, за исключением терминальных бронхиол и альвеол. В связи с тем, что большинство
Инфекции верхних дыхательных путей (ИВДП) включают поражение слизистой оболочки респираторного тракта от полости носа до трахеобронхиального дерева, за исключением терминальных бронхиол и альвеол. В связи с тем, что большинство ИВДП изначально имеют вирусную природу, потенциал применения антибактериальных препаратов (АП) ограничен. Каждый случай назначения АП должен рассматриваться индивидуально. Подобный подход предполагает выделение случаев заболевания, при которых эффект антибактериальной терапии (АТ) преобладает над еe неблагоприятными последствиями.
Диагностика
Диагностическая значимость признаков риносинусита изучена в исследовании J. Williams и M. Lindbaek таблица. Последний выделил четыре симптома, с высокой степенью достоверности прогнозирующие заболевание. К ним относились: двухфазное течение заболевания, гнойная ринорея, гнойное содержимое в полости носа и скорость оседания эритроцитов (СОЭ) > 10 мм/ч. При наличии трех из четырех симптомов специфичность теста составила 81% при чувствительности 66%. В то же время для такого признака, как перимаксиллярный отeк, характерна специфичность 99%. Большинство же других симптомов, выявляемых при осмотре, характеризуются низкой прогностической ценностью.
Диагностика риносинусита строится преимущественно на клинических, анамнестических и лабораторных данных. В то же время частое выявление рентгенологических признаков риносинусита при ОРВИ ограничивает возможности лучевых методов исследования. Именно поэтому рентгенография исключена из перечня рутинных методов диагностики неосложнeнных форм риносинусита. Применение лучевых методов исследования в подавляющем большинстве нецелесообразно и по причине необоснованного повышения стоимости лечения.
Классификация
Согласно методическим рекомендациям, утверждeнным комиссией по антибиотической политике при Министерстве здравоохранения РФ и Российской академией медицинских наук, Межрегиональной ассоциацией по клинической микробиологии и антимикробной химиотерапии, принята классификация, выделяющая:
- Острый синусит ( < 3 мес).
- Рецидивирующий острый синусит (2–4 случая острого синусита за год).
- Хронический синусит (> 3 мес).
- Обострение хронического синусита (усиление имеющихся и/или появление новых симптомов).
В целях оптимизации лечебной тактики можно также предложить выделение следующих форм риносинуситов:
- По месту развития:
A.1. Внебольничный.
A.2. Нозокомиальный. - По длительности сохранения симптомов:
B.1. Острый (длительность < 4 нед).
B.2. Подострый (4–12 нед).
B.3. Хронический (> 12 нед, или ≥ 4 случаев острого рецидивирующего риносинусита длительностью > 7–10 сут при условии сохранения остаточных явлений в синусе через 4 нед после окончания терапии). - По преморбидному фону:
C.1. Риносинусит у лиц с нормальным иммунным статусом.
C.2. Риносинусит у лиц с иммуносупрессией.
C.2.1. Гуморальный иммунодефицит.
C.2.2. Клеточный иммунодефицит.
Вышеприведенные замечания к классификации были представлены в согласительных рекомендациях Американской академии оториноларингологии, Фонда хирургии головы и шеи, а также некоторых других обществ. Синусит подразделяется на четыре категории: острый (бактериальный) риносинусит, хронический риносинусит без полипов, хронический риносинусит с полипами и аллергический грибковый синусит. По мнению зарубежных специалистов, обновлeнная классификация позволяет более прицельно осуществлять лечение заболевания, однако обсуждение еe преимуществ выходит за рамки настоящей статьи.
Тактика АТ риносинусита, как и других инфекций респираторного тракта, зависит от тяжести течения заболевания и осложнений. Степень тяжести оценивается по совокупности симптомов. Например, при подозрении на орбитальные или внутричерепные осложнения течение всегда расценивается как тяжeлое, независимо от выраженности других симптомов.
По тяжести течения выделяют:
- лeгкое течение — заложенность носа, слизистые или слизисто-гнойные выделения из носа и/или в ротоглотку, повышение температуры тела до 37,5 °С, головная боль, слабость, гипосмия; на рентгенограмме околоносовых синусов — толщина слизистой оболочки менее 6 мм;
- среднетяжелое — заложенность носа, гнойные выделения из носа и/или в ротоглотку, температура тела выше 37,5 °С, боль и болезненность при пальпации в проекции синуса, головная боль, гипосмия, недомогание, могут быть иррадиирующие боли в зубы, уши; на рентгенограмме околоносовых синусов — утолщение слизистой оболочки более 6 мм, полное затемнение или уровень жидкости в одном или двух синусах;
- тяжeлое — заложенность, часто обильные гнойные выделения из носа и/или в ротоглотку (но может быть их полное отсутствие), температура тела выше 38 °С, сильная болезненность при пальпации в проекции синуса, головная боль, аносмия, выраженная слабость; на рентгенограмме околоносовых синусов — полное затемнение или уровень жидкости более чем в двух синусах; анализ крови: лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение СОЭ; орбитальные, внутричерепные осложнения или подозрение на них. Крайне серьeзным осложнением является тромбоз кавернозного синуса, летальность при котором достигает 30% и не зависит от адекватности антибактериальной терапии.
Стандартом этиологической диагностики риносинусита является бактериологическое исследование аспирата, полученного при пункции синуса. Диагностически значимый титр составляет 10 5 КОЕ/мл. Возбудителя удаeтся выделить в 60% случаев; по некоторым данным, в 20–30% случаев определяется полимикробная этиология. Последняя более свойственна подострому и хроническому течению заболевания.
Имеется тесная зависимость роли возбудителей от варианта течения заболевания: при остром риносинусите и обострении хронического риносинусита основное значение имеют Streptococcus (Str.) pneumoniae (20–35%) и aemophilus (H.) influenzae (нетипируемые штаммы, 6–26%). Более тяжeлые случаи заболевания чаще связаны со Str. pneumoniae. Гораздо реже причиной риносинусита являются Moraxella (M.) catarrhalis (и другие грамотрицательные бациллы, 0–24%), Str. pyogenes (1–3%; до 20% у детей), Staphylococcus (S.) аureus (0–8%), анаэробы (0–10%). Роль грамотрицательных бактерий (Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Proteus spp., Enterobacter spp., Citrobacter) при остром синусите минимальна, но возрастает при нозокомиальном инфицировании, а также у лиц с иммуносупрессией (нейтропения, СПИД) и лиц, получавших повторные курсы антибактериальной терапии. Возбудителями одонтогенного (5–10% от всех случаев гайморита) верхнечелюстного синусита являются: H. influenzae, реже Str. pneumoniae, энтеробактерии и неспорообразующие анаэробы.
Терапия
АП в сочетании с назальными и/или системными противоотeчными средствами, в том числе и интраназальными стероидами и орошением слизистой носа физиологическим раствором, занимают основное место в терапии острого, а также при обострении хронического, риносинусита. Применяются антихолинергические препараты: ипратропия бромид; местные деконгестанты: оксиметазолина гидрохлорид; системные деконгестанты: фенилпропаноламина гидрохлорид; комбинация псевдоэфедрина гидрохлорид + ацетаминофен. По показаниям (например, в целях этиологической диагностики, особенно при неэффективности терапии на 3-и сутки, подозрении на микоз; при выраженном болевом синдроме, требующем декомпрессии синуса и т. д.) применяются пункция синусов и другие методы лечения.
Заблуждением является назначение (при отсутствии явных признаков аллергического риносинусита) антигистаминных препаратов, способствующих увеличению вязкости секрета и затруднению дренажа пазух. Ещe одна ошибка заключается в профилактическом назначении АП пациентам с ОРВИ в первые сутки манифестации риносинусита. Попытка предотвращения бактериальных осложнений, в том числе и со стороны синусов, лишена смысла.
Антибактериальная терапия. Главная цель АТ состоит:
- в эрадикации возбудителя и восстановлении стерильности синуса;
- сокращении риска хронизации (на настоящий момент недостаточно данных, доказывающих способность АТ предотвращать переход процесса в хроническую форму или предупреждать развитие серьeзных осложнений);
- предотвращении осложнений;
- облегчении клинической симптоматики.
В первые дни болезни, когда наиболее вероятной причиной заболевания являются вирусы, в частности респираторно-синцитиальный вирус, назначения АП не требуется. При сохранении симптомов риносинусита > 7–10 сут, у 60% пациентов можно предполагать наличие бактериальной инфекции. Именно в пределах данной группы целесообразно проведение АТ. Последняя может начинаться и раньше. Основанием для этого служит лихорадка и цефалгия, плохо поддающиеся действию анальгетиков.
При лeгком и среднетяжeлом течении острого риносинусита терапия одинаковая. Препаратом выбора является амоксициллин. Учитывая вариабельность всасывания препарата, для обеспечения качественного лечения представляется целесообразным применение микроионизированной формы, обеспечивающей постоянство абсорбции на уровне 93% (солютаб). Длительность терапии — 7–14 сут. В случае эпидемиологической значимости (предлагается > 5% от выделяемых штаммов) пенициллиноустойчивых Str. pneumoniae минимальная подавляющая концентрация (МПК) пенициллина — 0,12–2,0 мг/л, доза амоксициллина составляет 3 г/сут. В этом случае преимущество высокоадсорбируемой растворимой формы очевидно.
Если в большинстве случаев амоксициллин является адекватным средством терапии острого риносинусита, то в случае подострого течения, как и при наличии нижеперечисленных признаков, требуется применение ингибиторозащищeнных аминопенициллинов (амоксициллин/клавуланат).
К факторам, требующим применения ингибиторозащищeнных аминопенициллинов, относятся:
- применение АП в предшествующий месяц;
- неблагоприятная эпидемиологическая ситуация (резистентность);
- курение;
- данные анамнеза о неэффективности предыдущего (если было) лечения;
- посещение детских дошкольных учреждений;
- возраст менее 2 лет;
- аллергия к амоксициллину;
- поражение лобных или сфеноидальных синусов;
- осложнeнный этмоидальный синусит;
- длительность симптомов > 30 сут.
К альтернативным, не менее эффективным препаратам, применяемым при непереносимости аминопенициллинов, относят:
- макролиды (азитромицин, кларитромицин);
- цефуроксим аксетил, цефпрозил, цефподоксим проксетил;
- доксициклин (применение ограничено в связи с ростом устойчивости пневмококка в России).
Относительно роли цефалоспоринов необходимо отметить следующее. Накапливается всe больше данных о взаимосвязи между уровнем потребления АП и уровнем резистентности микроорганизмов. В аналитическом обзоре J. Granizo продемонстрировано неблагоприятное влияние оральных цефалоспоринов на распространение резистентных к пенициллину штаммов Str. pneumoniae. Поэтому их применение, при наличии амоксициллина (амоксициллина/клавуланата) и современных макролидов, следует ограничивать случаями неэффективности АТ макролидами и непереносимости амоксициллина.
Препараты, применяемые при тяжелом течении риносинусита, вводятся внутривенно. При появлении признаков улучшения, наблюдаемого на 3–5-е сутки, практикуется переход на пероральную форму того же препарата (или амоксициллина/клавуланата при применении цефалоспоринов III поколения). Ступенчатая терапия эффективна, безопасна и позволяет сократить стоимость лечения.
Основными препаратами для лечения тяжeлых форм риносинусита являются:
- ингибиторозащищенные пенициллины (амоксициллин/клавуланат, предпочтительна микроионизированная растворимая форма солютаб);
- цефалоспорины III поколения (цефтриаксон, цефотаксим);
- при аллергии к β-лактамам — левофлоксацин, моксифлоксацин или хлорамфеникол парентерально.
При развитии осложнений со стороны центральной нервной системы (ЦНС) следует отдавать предпочтение цефтриаксону (2–4 г/сут в 2 приема) или цефотаксиму (12 г/сут в 4 приема). При развитии менингита, вызванного резистентными Str. pneumoniae (МПК ≥ 0,12 мкг/мл), дополнительно вводится ванкомицин (2 г/сут в 4 приема). Не исключено применение моксифлоксацина, однако данных, подтверждающих безопасность его применения, недостаточно.
Препараты, применяемые при неэффективности АТ
- При неэффективности амоксициллина или макролидов — амоксициллин/клавуланат или цефалоспорины III поколения;
- при неэффективности ингибиторозащищeнных аминопенициллинов и цефалоспоринов — респираторные фторхинолоны (левофлоксацин, моксифлоксацин) + компьютерная томография/эндоскопия/пункция придаточных пазух для исключения микоза.
В последнее время большие надежды в лечении синуситов, вызванных пенициллиноустойчивыми (МПК > 4 мг/л) пневмококками, возлагаются на респираторные фторхинолоны (гемифлоксацин, моксифлоксацин). Активность препаратов распространяется на пенициллиноустойчивые штаммы Str. pneumoniae, β-лактамазопродуцирующие штаммы H. influenzae, M. catarrhalis, а также на атипичные и анаэробные микроорганизмы.
Как видно, спектр применяемых в лечении синуситов АП представлен весьма широко, и достаточно сложно найти ту грань, когда оправдано применение аминопенициллинов, а когда следует выбрать их ингибиторозащищeнные формы, цефалоспорины или фторхинолоны. Существенную помощь в разрешении этой проблемы могут оказать выводы контролируемых исследований и метаанализов.
Согласно их данным, при нетяжeлых формах заболевания новые АП демонстрируют незначительное преимущество при сравнении с амоксициллином, тем более с его микроионизированной формой, а также с бензилпенициллином при лечении острых неосложнeнных синуситов. Такой вывод соответствует и результатам ретроспективного фармакоэпидемиологического исследования, выполненного в США. Общая эффективность терапии препаратами первой линии у 17329 пациентов оказалась несколько меньшей и составила 90,1%. В то же время у 11773 пациентов, получавших альтернативную терапию, эффект получен в 90,8% случаев. Разница составила 0,7% (95% доверительный интервал, 0,01%–1,40%; p < 0,05). Причиной такого положения дел является присутствие в исследуемых группах лиц, инфекционный процесс у которых мог бы разрешиться и без АТ, так как в 2/3 случаев острого заболевания наблюдается тенденция к спонтанному разрешению.
Оценка качества проводимой терапии. В период первичного осмотра и назначения терапии пациент должен быть проинформирован о возможных вариантах течения заболевания. В большинстве случаев процесс своевременно разрешается и дополнительных врачебных осмотров не требуется.
В случае отсутствия улучшения в первые 3 сут применения АТ осуществляется переход на ингибиторозащищeнный аминопенициллин (предпочтительнее форма солютаб) или макролид.
В этом же случае, как и при ухудшении состояния в любой момент терапии, ведeтся поиск причин ее неэффективности. Чаще всего к ним относятся: некомплаентность пациента, развитие внутричерепных осложнений, ошибочный диагноз, резистентность возбудителя к применяемому препарату (грибы, продукция β-лактамаз).
Причины неэффективности. При вирусной инфекции основными причинами неэффективности АТ неосложнeнного риносинусита является раннее начало терапии, до момента присоединения бактериальной инфекции (как правило, в первую неделю после появления симптомов ОРВИ).
Неэффективность терапии острых бактериальных риносинуситов при назначении незащищeнных пенициллинов может объясняться продукцией β-лактамаз H. influenzae и M. catarrhalis. Характерной причиной неудач при назначении доксициклина и макролидов является распространение устойчивых штаммов Str. pneumoniae и H. influenzae.
Особого внимания требует неэффективность терапии, связанная с нечeтким следованием пациента предписанному режиму терапии (некомплаентность). Чаще всего это отказ от продолжения терапии при первых признаках улучшения, наблюдаемых к 3-м суткам терапии, а также пропуск очередной дозы и/или сокращение частоты приeма препарата. В результате недооценки этих причин нередко назначается терапия ингибиторозащищeнными аминопенициллинами, цефалоспоринами и фторхинолонами.
Известно, что лучшая комплаентность наблюдается при применении препаратов, принимаемых 1 раз в сутки. Это подтверждено результатом недавно выполненного систематического анализа, показавшего комплаентность при применении препарата 1 раз в сутки в пределах 79 ± 14%, 2 раза в сутки — 69 ± 15%, 3 раза в сутки — 65 ± 16% и 4 раза в сутки — 51 ± 20%. В данном случае различие между первыми двумя режимами было статистически недостоверно. Характерно, что комплаентность при лечении инфекций респираторного тракта гораздо выше и достигает 97% (например, при использовании азитромицина). Применение макролидов, по данным сравнительных исследований, вообще характеризуется наилучшей комплаентностью.
Очень часто АП назначаются без явных показаний. Объяснением в большинстве случаев служит личный опыт, подтверждающий увеличение частоты повторных визитов в случае неприменения АТ. Ряд исследований отрицает подобную точку зрения. Оказалось, что пациенты, имеющие хороший контакт с врачом, уяснившие возможные варианты течения заболевания и не получающие АТ, без необходимости не приходят на прием повторно. Более того, не отмечено и увеличения случаев неудовлетворeнности лечением.
Длительность терапии зависит от формы и степени тяжести течения болезни. При остром синусите лечение продолжается от 1 сут (азитромицин 2 г — микросферическая форма) до 3–10 дней.
Выводы
- Симптомы риносинусита чаще всего обусловлены вирусной инфекцией.
- Основные возбудители бактериального риносинусита — Str. pneumoniae, H. influenzae и M. catarrhalis (чаще у детей).
- Диагностика бактериального риносинусита необходима для ограничения применения АП.
- Диагностика базируется на клинических и лабораторных критериях.
- Вероятность бактериального риносинусита возрастает при длительности симптомов > 10 сут.
- Ошибочно рутинное применение при неосложнeнных формах заболевания лучевых методов исследования.
- Культуральное исследование, цель: получение локальных данных по резистентности возбудителей и оценка возможной причины неэффективности терапии.
- АТ показана при бактериальном риносинусите.
- Амоксициллин — препарат выбора, альтернативное средство — амоксициллин/клавуланат (сульбактам), азитромицин, кларитромицин.
- Применение коротких курсов терапии, препаратов с однократным суточным приeмом и максимальной степенью всасывания активных ингредиентов предпочтительно, так как повышает комплаентность пациента, снижая риск нежелательных реакций.
По вопросам литературы обращайтесь в редакцию.
И. А. Гучев, кандидат медицинских наук
А. А. Колосов
421-й военный госпиталь МВО МО РФ, Смоленск
Читайте также:

