Чем опасен токсоплазмоз в хронической форме
Обновлено: 19.04.2024
Токсоплазмоз относится к паразитарным заболеваниям, которыми болеют как животные, так и люди.
Данная инфекция характеризуется множественностью механизмов передачи, разнообразной клинической картиной, кроме того, она может протекать в латентной (скрытой), острой или хронической форме.
Токсоплазмоз выявляется в различных климато-географических зонах. Сезонность заболевания не выражена.
Вызывает заболевание токсоплазма, которая является простейшим микроорганизмом и живет в клетках. Другими словами, токсоплазма – это внутриклеточный паразит.
Окончательным носителем токсоплазмы являются кошки, а также некоторые другие представители семейства кошачьих, а промежуточным - человек, птицы, реже - некоторые млекопитающие (сельскохозяйственные животные, собаки).
Существует несколько путей заражения человека:
- через пищеварительный тракт (например, при контакте с зараженной землей, с кошачьими фекалиями, при употреблении в пищу немытых овощей и фруктов, плохо прожаренного или проваренного мяса и возможно, коровьего молока);
- трансмиссивный или через кровь (контакт с зараженным мясом при наличии порезов и ссадин на руках, через слюну зараженных собак, когда те зализывают свои раны, реже - при гемотрансфузиях и пересадке органов);
- вертикальный (от матери к плоду через плаценту) при условии заражения женщины токсоплазмозом во время беременности.
Общепризнано разделение токсоплазмоза на врожденный и приобретенный.
Заболевание может протекать в острой, подострой, хронической, субклинической, инаппаратной (отсутствие симптомов и формирование иммунитета) формах и в виде носительства.
Токсоплазмоз может быть легкой, средней тяжести и тяжелой формы.
Инкубационный период инфекции составляет от 3-х до 21-го дня, а по мнению некоторых авторов, он может длиться и несколько месяцев.
Острый приобретенный токсоплазмоз
Острые формы заболевания распознаются редко.
Сначала токсоплазмы попадают в регионарные лимфатические узлы, где вызывают их гиперплазию (увеличение). Лимфоузлы на ощупь мягкие, они спаяны с окружающими тканями и безболезненны. Чаще всего поражаются затылочные и шейные лимфоузлы, но возможно вовлечение в процесс паховых, подмышечных и лимфоузлов, находящихся в брыжейке кишечника.
Возможно возникновение розеолезно-папулезной сыпи (в виде узелков и воспалительных пятнышек), а также увеличение печени и селезенки (гепатоспленомегалия).
Из лимфатической системы токсоплазмы проникают в кровь и разносятся по органам.
При поражении головного мозга отмечается различная неврологическая клиническая картина (двигательные и зрительные расстройства, нарушения чувствительности, головокружения).
Церебральные симптомы наблюдаются при энцефалите, менингоэнцефалите и эпендимоэнцефалите (эти состояния могут развиться на фоне токсоплазмоза). В патологический процесс вовлекаются мозговые оболочки, что приводит к их воспалению и повышению внутричерепного давления.
В этих случаях возникают следующие характерные симптомы:
- напряженность затылочных мышц;
- сложность пригнуть голову к груди;
- рвота, сопровождающаяся головной болью и не приносящая облегчения.При этом жалобы на головные боли, как правило, диффузного, разлитого характера.
Эти симптомы часто заставляют врача предполагать наличие опухоли головного мозга.
К перечисленным проявлениям могут добавляться сосудистые кризы, неустойчивость психики с изменениями характера.
Если поражаются задние столбы спинного мозга, возникает тянущая боль при случайном движении по ходу нервов. В случае вовлечения периферических нервов наблюдаются боли и онемение рук и ног по ходу нервов, изменение болевой чувствительности.
Хронический приобретенный токсоплазмоз
Как правило, данная форма протекает либо бессимптомно, либо с субклинической картиной. У больных наблюдается:
- слабость;
- повышенная утомляемость;
- невысокая температура (не превышает 38°C);
- иногда боли в голове.
При тяжелом течении часто в процесс вовлекаются центральная нервная система и глаза. Пациенты предъявляют жалобы:
- на головные боли;
- головокружение;
- раздражительность;
- ослабление памяти и зрения;
- нарушения сна.
Могут встречаться и различные расстройства зрительного анализатора:
Возможно также возникновение:
-
; ; ;
- поражений опорно-двигательного аппарата.
Хронический приобретенный токсоплазмоз характеризуется многолетним течением, постоянными обострениями и наблюдается чаще у людей со сниженным иммунитетом.
Врожденный токсоплазмоз
О врожденном токсоплазмозе у ребенка говорят в случаях, когда мать заразилась инфекцией в период беременности.
Проявления заболевания зависят от срока беременности на момент инфицирования. В сроке от 2-х до 24-х недель беременность, как правило, самопроизвольно прерывается, или же возможно рождение ребенка с грубейшими пороками развития. Наиболее частые – желтуха, глухота, увеличение селезенки и печени, в случае заражения матери в сроки от 24 до 40 недель беременности наблюдается прогрессирующая гидроцефалия.
После пройденного лечения токсоплазмоз переходит в вялотекущую форму, которая характеризуется:
- энцефалитом; ;
- половым инфантилизмом;
- лабильной (неустойчивой) психикой с сохранением интеллектуальных способностей.
Токсоплазмоз при беременности
Всем беременным при постановке на учет необходимо пройти иммунологические исследования:
- либо кожную пробу с токсоплазмином;
- либо серологические реакции с определением титра иммуноглобулинов класса G и М (IgM и IgG).
Если пробы положительные, это означает, что беременная имела контакт с токсоплазмой в прошлом, но в дальнейшем наблюдении по поводу данной инфекции она не нуждается, так как уже получила стойкий иммунитет. При отрицательном результате пробы повторяют во втором и третьем триместре, а в случае появления положительной реакции говорят об инфицировании беременной. Женщине назначают лечение, но не ранее, чем со второго триместра.
Если заражение произошло в первом триместре, беременность необходимо прервать по медицинским показаниям.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
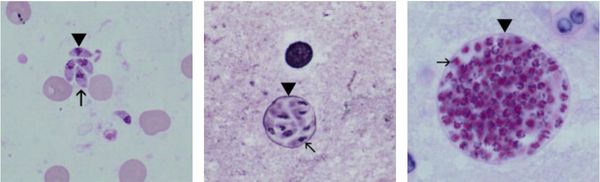
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
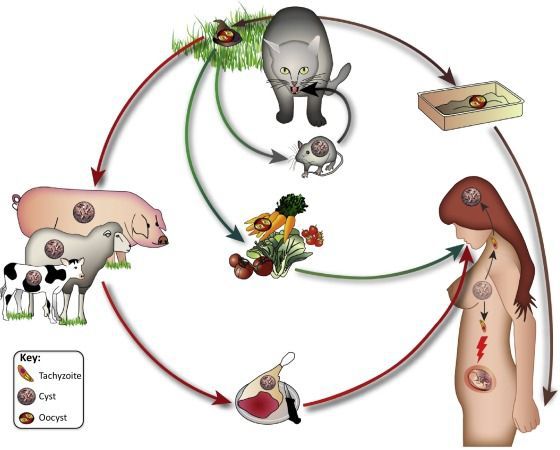
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
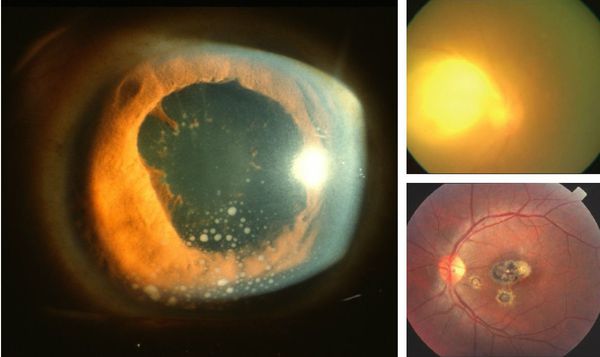
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
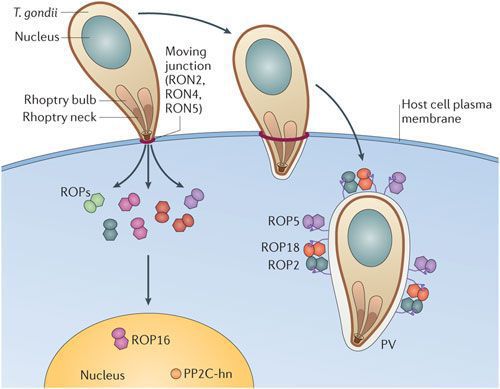
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни.
.jpg)
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни.
Этиология. Возбудитель токсоплазмоза Toxoplasma gondii относится к царству Protozoa, классу Coccidia, отряду Eucoccidiorida, типу Apicomplexa. T. gondii — условно патогенный внутриклеточный паразит, поражающий в организме промежуточных хозяев, в том числе человека, любые ядерные клетки гистеофагоцитарной системы.
Эпидемиология. Пораженность или инфицированность токсоплазмами населения Российской Федерации в среднем составляет около 20,0%. Показатели пораженности выше в регионах с теплым климатом; среди лиц ряда профессиональных групп: рабочие мясокомбинатов и звероводческих ферм, животноводы, ветеринарные работники и др. Инфицированность женщин, как правило, в 2–3 раза выше, чем у мужчин.
Заболеваемость токсоплазмозом во много раз ниже показателей инфицированности, однако трудности диагностики, несмотря на обязательную регистрацию, не позволяют судить об истинном уровне инфекции.
Восприимчивость к токсоплазмозу — практически поголовная. Распространение инфекции — повсеместное в виде носительства и спорадических заболеваний. Основной источник инфекции — дикие и домашние кошки.
Основной фактор передачи токсоплазм — сырое или недостаточно термически обработанное мясо, мясные продукты с находящимися в нем цистами токсоплазм. К дополнительным факторам передачи инфекции относятся плохо вымытая зелень, овощи, фрукты (с земли), грязные руки с находящимися на них ооцистами возбудителя.
Основные пути передачи:
- пищевой — связанный с употреблением в пищу термически плохо обработанного мяса, содержащего цисты паразита;
- контактный — ассоциированный с больными кошками, выделяющими токсоплазмы с фекалиями;
- трансплацентарный — при котором становится возможным проникновение токсоплазм в плод, с последующим развитием врожденного токсоплазмоза у новорожденного;
- парентеральный — при котором не исключается передача инфекции реципиенту при переливании крови, пересадке органов и тканей.
Беременная с токсоплазмозом не представляет эпидемиологической опасности ни для окружающих, ни для медицинского персонала, что делает возможным лечение этих пациентов как в амбулаторных условиях, так и в любом соматическом стационаре.
Патогенез. Вышедшие из цист или ооцист возбудители внедряются в эпителиальные клетки тонкого кишечника, где они размножаются, образую первичный аффект и проникая затем в региональные лимфатические узлы, а из них с током лимфы — в кровь. Диссеминация возбудителя приводит к поражению самых различных органов и тканей.
При беременности, в условиях сниженного иммунитета, наряду с первичным заражением токсоплазмами, опасным является и реактивация паразита (при инфицировании до беременности), что в значительной степени определяет течение и исход беременности.
При выходе токсоплазм из цист происходит диссеминация возбудителей. Их концентрация в тканях ассоциирована со способностью токсоплазм проникать трансплацентарно, что приводит к развитию внутриутробной патологии на любом сроке беременности.
Заражение плода наблюдается у беременных как с первичным инфицированием токсоплазмами, так и реактивацией возбудителя во время беременности у серопозитивных женщин. Поражение плода может возникать на любом сроке гестации, но особую опасность представляет его инфицирование в первом и втором триместрах. При заражении в третьем триместре беременности преобладают бессимптомные формы течения заболевания, а поздние клинические признаки проявляются через месяцы и годы.
Заражение на ранних сроках эмбриогенеза заканчивается спонтанным выкидышем, мертворождением, вызывает тяжелые нарушения развития — анэнцефалию, анофтальмию, гидроцефалию, гепатоспленомегалию и др. (табл.).
Формирование иммунитета приводит к исчезновению возбудителя из крови, прекращается его размножение в клетках. Образуются истинные тканевые цисты, которые могут длительно, десятилетиями, в интактном состоянии сохраняться в организме (носительство токсоплазм).
Клиника. Приобретенный токсоплазмоз по характеру течения делится на острый и хронический. Кроме того, в зависимости от длительности болезни и выраженности клинических симптомов возможно подострое, а также инаппарантное (субклиническое) течение инфекции, которое характеризуется определенной динамикой либо высоким уровнем специфических антител в крови, при отсутствии клинических проявлений болезни. Таким образом, наиболее удобной для практического здравоохранения, с нашей точки зрения, является следующая классификация приобретенного токсоплазмоза: острый, подострый, хронический, инаппарантный и носительство.
Клинические проявления токсоплазмоза у беременных не имеют каких-либо существенных отличий от уже известной клинической картины заболевания.
Лабораторная диагностика. Для лабораторной диагностики токсоплазмоза чаще всего применяют серологические методы: реакцию непрямой иммунофлюоресценции (РНИФ) и иммуноферментный анализ (ИФА). Диагноз подтверждается достоверно нарастающей динамикой показателей этих тестов, их высоким уровнем либо наличием антител класса IgM. Существенное значение в диагностике токсоплазмоза, особенно в дифференциации острого и хронического процессов, имеет определение классов иммуноглобулинов, в частности антител класса IgM. Надежно диагностировать токсоплазменную инфекцию можно лишь при сравнении результатов серологических реакций в динамике. Антитела всех классов существенно повышаются к концу второй — началу третьей недели от момента инфицирования и достигают диагностического уровня. Диагноз токсоплазмоза при наличии соответствующей клиники может быть поставлен при положительной серологической конверсии, когда второй анализ сыворотки становится положительным.
Диагностика токсоплазмоза у беременных женщин включает в себя весь комплекс необходимых клинических, параклинических и специальных (иммунобиологических) исследований, которые применяются для диагностики токсоплазмоза вообще.
Обязательным условием обследования беременной на токсоплазмоз должна быть консультация врача-инфекциониста для подтверждения либо исключения текущего инфекционного манифестного или бессимптомного (инаппарантного) токсоплазменного процесса.
Учитывая исключительную важность результатов иммунологического обследования в диагностике токсоплазмоза у беременных, необходимо правильно интерпретировать полученные данные.
Вариант 3: клинические проявления инфекции отсутствуют; серологические реакции положительные в низких, средних, иногда высоких титрах (РНИФ 1:640, ИФА IgG ≥ 200 Ед/мл; ИФА IgM — положительно). При исследовании парных сывороток (через 3–4 недели) регистрируется достоверное нарастание уровня специфических антител класса IgM.
Заключение: инаппарантный токсоплазмоз — реальная угроза инфицирования плода.
Вариант 4: имеются клинические проявления токсоплазмоза; серологические реакции положительные в низких и средних (иногда высоких) титрах: РНИФ 1:1280, ИФА IgG ≥ 200 Eд/мл; ИФА IgM — положительно, при исследовании парных сывороток в динамике регистрируется достоверное нарастание уровня специфических антител; выявляются специфические антитела класса IgM-класса. Заключение: острый токсоплазмоз.
Рекомендации: экстренная превентивная этиотропная терапия (не ранее чем со II триместра беременности); в I триместр — рассмотреть вопрос о прерывании беременности; проводят кордо- и амниоцентез на 22–23 неделях беременности; новорожденный обследуется на токсоплазмоз, и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 5: имеются клинические проявления инфекции; серологические реакции положительные в высоких или средних показателях; при исследовании парных сывороток в динамике регистрируется снижение уровня специфических антител (РНИФ ≤ 1:1280, ИФА IgG — 200 Eд/мл; ИФА IgM — положительно). Заключение: подострый токсоплазмоз. Рекомендации: этиотропная терапия (не ранее чем со II триместра); в I триместр — ставится вопрос о прерывании беременности; новорожденный обследуется на токсоплазмоз и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 6: имеются клинические проявления токсоплазмоза; серологические реакции положительны в низких или средних показателях (РНИФ 1:640, ИФА IgG — 200 Eд/мл; ИФА IgM — отрицательно); при исследовании парных сывороток (через 3–4 недели) динамики уровня антител нет; антитела класса IgM отсутствуют. Заключение: хронический приобретенный токсоплазмоз. Рекомендации: этиотропная терапия не проводится; при необходимости специфическая терапия вне беременности; прерывание беременности не показано.
Лечение. Показанием к назначению этиотропной терапии у беременных женщин являются острый, подострый и инаппарантный токсоплазмоз. Лечение хронического токсоплазмоза следует проводить строго по клиническим показаниям либо до, либо после беременности. При отсутствии жалоб и клинических показаний не нуждаются в лечении женщины, переболевшие токсоплазмозом до беременности. Эти женщины расцениваются как практически здоровые лица, не требующие специального медицинского наблюдения. Лечение беременных женщин следует проводить не ранее 12–16 недель беременности (со II триместра беременности).
Назначаются препараты группы пириметамина (Фансидар, Ровамицин).
Фансидар содержит сульфадоксин 500 мг и пириметамин 25 мг. Этиотропная терапия состоит из 2–3 циклов. Назначается 1 таблетка 1 раз в 3 дня № 8 таблеток на цикл. Учитывая возможность угнетения кроветворения под действием этиотропных препаратов, рекомендуется назначение фолиевой кислоты (в средних терапевтических дозах), а также проведение общих анализов крови и мочи. При непереносимости препаратов группы пириметаминов назначают Ровамицин, 1 таблетка которого содержит спиромицина 3 млн МЕ. Назначают по 3 млн МЕ 3 раза в день с семидневным перерывом. Хорошая переносимость Ровамицина больными, отсутствие лекарственного взаимодействия, высокая эффективность позволяют назначать его для лечения токсоплазмоза у беременных. При непереносимости пириметаминов возможна замена на антибиотики, например, эритромицин.
Противопоказаниями для назначения Фансидара и его аналогов, а также сульфаниламидных препаратов и антибиотиков являются: нарушения эритропоэза с анемией, заболевания почек с нарушением их функций, заболевания печени, декомпенсация сердечной деятельности.
В зависимости от сроков беременности целесообразно проведение не менее двух полных курсов этиотропной терапии с перерывами между ними 1–1,5 месяца.
Как показала практика, у пациенток с инаппарантным течением острого токсоплазмоза хороший эффект дает комплексное применение Фансидара с иммуномодуляторами (Галовит, Полиоксидоний). Уже после первого цикла лечения наблюдается значительное снижение IgM.
Профилактика врожденного токсоплазмоза. Профилактика врожденного токсоплазмоза должна строиться с учетом того факта, что только первичное заражение женщины во время беременности может привести к инфицированию плода. Оптимально профилактика врожденного токсоплазмоза должна включать в себя обследование женщин детородного возраста на токсоплазмоз до или, в крайнем случае, во время беременности. Неиммунные беременные женщины должны быть обязательно взяты на диспансерное наблюдение и обследоваться на токсоплазмоз 1 раз в триместр.
Литература
- О выявлении и профилактике токсоплазмоза в Москве. Методические рекомендации (№ 25). М., 2007.
- Лысенко А. Я. Клиническая паразитология. Женева, 2002.
- Hill D., Dubey J. P. Toxoplasma gondii: transmission, diagnosis and prevention // Clin. Microbiol. Infect. 2002. № 10.
- Desmonts G., Couvreur J. Toxoplasmosis in pregnancy and its transmission to the fetus // Bull. N. Y. Acad. Med. 1974. № 2.
Ф. К. Дзуцева*
Г. Ю. Никитина**
Ю. В. Борисенко*
Л. П. Иванова***, кандидат медицинских наук, доцент
С. Х. Зембатова***
*Городской центр по токсоплазмозу, **ГКБ им. С. П. Боткина, ***РМАПО, Москва

Toxoplasma gondii - возбудитель токсоплазмоза - это облигатный внутриклеточный апикомплексный паразит с широким географическим распространением и способностью инфицировать практически любой тип клеток в широком диапазоне хозяев, включая людей, домашних животных, домашний скот и диких животных
Паразитическое простейшее Toxoplasma gondii поражает около трети населения развитых стран. Однако, современный человек не является естественным хозяином токсоплазмы. Постоянное присутствие этого паразита в состоянии покоя в головном мозге и мышечных тканях инфицированного человека обычно считается бессимптомным с клинической точки зрения. Скрытый токсоплазмоз, то есть пожизненное наличие кист в головном мозге и мышечных тканях, явно себя не проявляет , но влияет на здоровье человека.Так , например , инфицированные субъекты получают худшие результаты в тестах на психомоторную работоспособность и имеют другие личностные профили, чем субъекты с отрицательным токсоплазмозом.
Пути заражения паразитом
Люди обычно заражаются либо случайно проглатывая инфекционные ооцисты, либо употребляя недоваренное мясо, содержащее тканевые цисты (брадизоиты). Ооцисты токсоплазмы могут быть обнаружены в почве или воде, загрязненной кошачьими фекалиями, что делает потребление сырых овощей и воды из небезопасных питьевых источников важным фактором риска заражения. Потребление сырого или недоваренного мяса также является фактором риска, поскольку домашний скот и дичь часто содержат брадизоиты. Паразит также может передаваться внутриутробно развивающемуся плоду, если женщина заразилась впервые во время беременности. Трансплантация твердых органов, таких как трансплантация сердца, печени и почек, является еще одним средством, при помощи которого может возникнуть инфекция T. gondii , хотя это случается очень редко.
В борьбе с болезнями, их профилактике и ликвидации ключевую роль играет выявление факторов риска инфицирования. Горизонтальная передача T. gondii может происходить при контакте с подстилкой для кошачьих туалетов, потреблении сырого мяса, употреблении сырых или недоваренных овощей, трансплантации органов и переливании крови. Владение кошкой, контакт с наполнителем для кошачьего туалета и обращение с сырым мясом - важные факторы риска заражения токсоплазмоза Поскольку T. gondii размножается половым путем в желудочно-кишечном тракте домашних животных из семейства кошачьих, у лиц, которые владели кошками или регулярно контактировали с наполнителем для кошачьего туалета, риск заражения T. gondii был на 76% и 66% выше, соответственно, по сравнению с людьми, которые не владели кошками и не держали кошек. Кроме того, поскольку T. gondii способен проникать в ткани инфицированных животных, люди, регулярно работающие с сырым мясом, также подвергаются большему риску заражения.
T. gondii способен проникать в любую ядросодержащую клетку, включая незрелые эритроциты. В качестве механизма выживания внутриклеточные паразиты должны покинуть и повторно заразить другие клетки. Механизм выхода T. gondii из инфицированных клеток до сих пор неясен. Некоторые исследования in vitro продемонстрировали, что T. gondii покидает клетку, оказывая натяжение на мембрану клетки-хозяина, часто вызывая разрыв клетки. Другие исследования показали, что паразит покидает клетку-хозяин, разрушая цитоскелет подобно Plasmodium , что приводит к лизису клеток.
Передача паразита при беременности и дети, рожденные с токсоплазмозом
Способность почти всех подклассов IgG - за заметным исключением IgG2 - проникать через плаценту обеспечивает некоторую форму защиты плода . Период беременности, в котором будущая мама заражается, сильно влияет на частоту и тяжесть заболевания. Инфекция в первом триместре беременности несет примерно 6% риск передачи плоду, тогда как во втором и третьем триместрах риск врожденной передачи составляет примерно 33–47% и 60–81% соответственно . В отличие от гестационного риска передачи, риск развития клинических симптомов заболевания (врожденный токсоплазмоз) наивысший, когда инфицирование матери происходит в течение первого триместра, и постепенно снижается во втором и третьем триместрах
Врожденная передача T. gondii сопряжена с риском выкидыша или мертворождения, а дети, рожденные с токсоплазмозом, могут страдать от серьезных симптомов, таких как гидроцефалия, кальцификаты мозга или ретинохориоидит, в более позднем возрасте, если не лечить токсоплазмоз
Группа крови RhD защищает от токсоплазмоза
Наконец, пять независимых исследований, проведенных с участием доноров крови, беременных женщин и военнослужащих, показали, что положительная группа крови RhD, особенно у гетерозигот RhD, защищает инфицированных субъектов от различных эффектов латентного токсоплазмоза, таких как увеличение времени реакции, повышенный риск во время дорожного движения несчастные случаи и чрезмерная прибавка веса при беременности
Токсоплазмоз , как причина дорожных аварий
Лабораторная диагностика токсоплазмоза
Во время острой первичной инфекции T. gondii сначала вырабатывается иммуноглобулин M (IgM) против T. gondii . Однако титры IgM снижаются в течение следующих нескольких месяцев и становятся неопределяемыми в течение года. Иммунная система также продуцирует IgG к T. gondii через несколько недель после первоначального заражения. Уровни антител IgG обычно достигают пика в течение одного или двух месяцев после заражения, но обнаруживаются на протяжении всей жизни инфицированного человека.
Нейроиммунологические эффекты паразита
Эффекты токсоплазмы (паразита ) связаны не с манипуляциями в эволюционном смысле, а просто с неврологическими или точнее нейроиммунологическими эффектами присутствия паразита. Тахизоиты могут проникать в различные типы нервных клеток, такие как нейроны, астроциты и микроглиальные клетки головного мозга, а также клетки Пуркинье в мозжечке. Внутриклеточные тахизоиты манипулируют несколькими признаками механизмов трансдукции, участвующих в апоптозе, функциях противомикробных эффекторов и созревании иммунных клеток.
Скрытый токсоплазмоз связан с иммуносупрессией, что может объяснить повышенную вероятность рождения мальчика у инфицированных токсоплазмой женщин, а также чрезвычайно высокую распространенность токсоплазмоза у матерей детей с синдромом Дауна.
Предполагается, что наличие кист паразитов в головном мозге вызывает повышение концентрации дофамина.
Эпидемиологические исследования
Эпидемиологические исследования указывают на роль токсоплазмоза в этиологии шизофрении, вероятно, во время беременности и в раннем периоде жизни. Эта связь согласуется с исследованиями на животных моделях, указывающими, что воздействие на развивающийся мозг животных инфекционных агентов или иммуномодулирующих агентов может быть связано с изменениями поведения ( психопатологическая симптоматика ) , которые не проявляются, пока животное не достигнет полной зрелости.
Toxoplasma gondii и психические расстройства
Пациенты с психическими расстройствами имеют повышенный уровень токсоплазматических антител, причем разница между случаями и контрольной группой наибольшая у лиц, обследованных незадолго до появления психопатологических симптомов.
Токсоплазмоз и шизофрения
Повышение уровня дофамина в мозге инфицированных субъектов может представлять собой недостающее звено между токсоплазмозом и шизофренией. Токсоплазма также, по-видимому, участвует в возникновении более тяжелых форм шизофрении. По крайней мере 40 исследований подтвердили повышенную распространенность токсоплазмоза среди больных шизофренией. Больные шизофренией, инфицированные токсоплазмой, отличаются от больных шизофренией, не страдающих токсоплазмой, анатомией головного мозга и большей интенсивностью бреда и галлюцинаций
Токсоплазмоз и обсессивно - компульсивное расстройство
Токсоплазмоз и обсессивно-компульсивное расстройство (ОКР): уровень серопозитивности для анти-Т. gondii IgG антител у пациентов с ОКР значительно выше, чем у здоровых добровольцев. Инфекция базальных ганглиев может быть вовлечена в патогенез ОКР у серопозитивных субъектов на токсоплазм.
Токсоплазмоз и личность
Инфицированные паразитом мужчины кажутся более догматичными, менее уверенными, более ревнивыми, более осторожными, менее импульсивными и более упорядоченными, чем другие. И наоборот, инфицированные женщины становятся более теплыми, сознательными, неуверенными в себе, более ханжескими и настойчивыми, чем другие представительницы этого пола. Инфицированные токсоплазмой люди отличаются от неинфицированных контрольных групп по профилю личности, оцененному с помощью двух вариантов опросников 16PF Кеттелла, TCI Клонингера и большой пятерки. Большинство этих различий увеличивается с течением времени с момента начала инфекции, предполагая, что токсоплазма влияет на личность человека, а не личность человека, влияет на вероятность заражения. Недавно в литературе сообщалось об отрицательной связи между инфекцией токсоплазмы и стремлением к новизне.
У людей с положительной реакцией на токсоплазмы были более низкие показатели поиска новизны (NS) (P = 0,035) и более низкие оценки по трем из четырех подшкал, а именно по импульсивности , экстравагантности и беспорядку, чем у субъектов с отрицательной реакцией на токсоплазму.
Токсоплазмоз и цитомегаловирус
Снижение стремления к новизне связано также с цитомегаловирусной инфекцией. Поскольку цитомегаловирус распространяется в популяции путем прямого контакта (а не путем хищничества, как с токсоплазмой), наблюдаемые изменения являются побочным продуктом инфекций головного мозга, а не результатом манипуляционной активности паразита.
Токсоплазмоз и гормоны
Студенты-мужчины, инфицированные токсоплазмой, примерно на 3 см выше, чем испытуемые, свободные от токсоплазмы, и их лица оцениваются женщинами как более мужественные и доминирующие. Эти различия могут быть вызваны повышенной концентрацией тестостерона.
Лечение токсоплазмоза
Влияние антипсихотиков и нормотимиков на паразита
Галоперидол и стабилизатор настроения вальпроевая кислота наиболее эффективно ингибируют рост токсоплазмы in vitro с синергической активностью.
Исследование , проведенные в нашей клинике ( ООО "Психическое здоровье" )
В нашей клинике мы сравнили повышенные титры IgG к токсоплазме с особенностями психопатологической симптоматики и тем или иным психическим расстройством , а также проанализировали общий анализ крови больных токсоплазмозом и рядом психических расстройств.
Оказалось, что для хронического токсоплазмоза характерно : снижение таких показателей общего анализа крови , как MCV и MCH , то есть регистрируются признаки микроцитарной анемии; также снижено, общее количество лейкоцитов , и в частности, нейтрофилов и в то же время повышен MPV ( объем тромбоцитов , указывающий на их большие размеры и повышенную активность). Интересно отметить, что согласно экспериментальным наблюдениям Biswas et al., (2017) истощение нейтрофилов приводит к снижению продукции IFN-γ, что приводит к увеличению паразитарной нагрузки на центральную нервную систему. Несмотря на то, что точные молекулярные процессы, управляющие этими различиями, все еще неясны, появляется все больше доказательств того, что латентный токсоплазмоз может вызывать хроническое воспаление низкой степени тяжести, которое, в свою очередь, может приводить к анемии
Для шизофрении характерны аналогичные изменения ( снижение лейкоцитов и нейтрофилов , повышение MPV, но отсутствуют признаки микроцитарной анемии ( MCV и MCH обычно повышены) . Кровь больного рекуррентной депрессией несколько похожа на кровь больного с хроническим токсоплазмозом ( микроцитарная анемия , повышение MPV ) , однако , повышено количество лейкоцитов и нейтрофилов при рекуррентной депрессии, напротив , в отличие от крови пациентов с повышенными титрами IgG к токсоплазме. По большинству показателей общий анализ крови больного хроническим токсоплазмозом напоминал параметры крови больного с обсессивно - компульсивным расстройством.

Открытие биомаркеров остается серьезной проблемой для медицины, в частности, в контексте хронических заболеваний. Это верно для широко распространенного простейшего Toxoplasma gondii, который устанавливает длительный паразитизм у многоклеточных животных, включая человека. Этот микроб последовательно разворачивает различные генетические программы, управляющие переходом высокого к низкому репликативному потенциалу внутри клеток-хозяев. Являясь медленно реплицирующейся клеткой, стадия развития брадизоита T. gondii сохраняется заключенной в компартмент кисты в тканях, включая нервную систему, поддерживаясь устойчивым иммунным равновесием, которое определяет длительную клинически молчаливую фазу паразитизма.
Серологические исследования показывают, что почти треть населения Земли подверглась воздействию T. gondii.и, возможно, вмещают брадизоиты. Поскольку любое нарушение иммунного баланса вызывает обратный переход от брадизоита к быстро воспроизводящемуся тахизоиту и неконтролируемый рост последнего, эти люди подвержены риску опасного для жизни заболевания. В то время как серологические тесты для отличия недавней инфекции от прошлой доступны, пока нет иммуногенного биомаркера, используемого в серологическом тесте, чтобы установить наличие стойких брадизоитов.
Инфекцирование токсоплазмозом начинается с попадания в организм трансмиссивных зоитов от хозяина к хозяину, которые, достигнув кишечного эпителия, трансформируются в репликативные тахизоиты. В то время как резкое расширение популяции тахизоитов обычно сдерживается иммунной системой хозяина, последняя также направляет дифференциацию некоторых тахизоитов на медленно реплицирующиеся и передаваемые от хозяина к хозяину брадизоиты. В самом деле, эти брадизоиты находятся во внутриклеточных компартментах, называемых цистами, в тканях, включая мозг, сетчатку и скелетные мышцы, и удерживаются почти безмолвным иммунным ответом, управляемым IFNγ, следовательно, они объясняют последующую длительную и так называемую клинически бессимптомную фазу паразитизма. Нарушение этого иммунного баланса вызывает обратный переход от брадизоита к тахизоиту и неконтролируемый рост последнего, вызывая тем самым опасные для жизни и опасные повреждения в вышеупомянутых тканях, примером чего является энцефалит у пациентов со СПИДом.
Рецидивирующие тяжелые глазные заболевания являются распространенной патологией, в частности, для врожденных инфекций T. gondii , в то время как повышенный риск психических расстройств, связанных с шизофренией, также был предложен как следствие персистенции брадизоита в головном мозге. Инфекция токсоплазмой обычно носит субклинический характер, но у некоторых пациентов может наблюдаться шейная лимфаденопатия или заболевание глаз. Активная инфекция характеризуется тахизоитами, а тканевые кисты - латентным заболеванием.
Эпидемиология
Около 11% населения США инфицировано T. gondii ; заражение обычно происходит из-за приема зараженной пищи и воды. Ежегодно в США регистрируется около 85 000 случаев токсоплазмоза пищевого происхождения ). Острая токсоплазмозная инфекция у здоровых взрослых людей из Северной Америки и Европы обычно протекает доброкачественно и бессимптомно. У некоторых пациентов может наблюдаться лимфаденопатия, лихорадка, утомляемость, хориоретинит, миокардит, миозит и гепатоспленомегалия.
Лечение токсоплазмоза
Комбинация пириметамина и сульфадиазина (пир-сульф), направленная на активную стадию инфекции, в настоящее время является золотым стандартом лечения токсоплазмоза, но частота неудач остается значительной. Хотя доступны другие схемы, включая пириметамин в сочетании с клиндамицином, атоваквоном, кларитромицином или азитромицином или монотерапию триметоприм-сульфаметоксазолом (TMP-SMX) или атоваквоном, ни один из них не превосходит пир-сульф, и ни один из режимов не является активным. против скрытой стадии инфекции. Было показано, что инфекция во время беременности с последующим лечением спирамицином при острых материнских инфекциях и пирсульфом для тех, у кого установлена инфекция плода, эффективна для предотвращения вертикальной передачи и минимизации тяжести врожденного токсоплазмоза.
Лечение токсоплазмоза обычно включает комбинации двух противомикробных препаратов, чаще всего ингибиторов дигидрофолатредуктазы (DHFR) (пириметамин и триметоприм) и дигидроптероатсинтетазы (сульфонамиды, такие как сульфадиазин, сульфаметоксазол и сульфадоксин), которые блокируют синтез фолиевой кислоты.
Пириметамин - ключевой ингибитор DHFR, по-видимому, является наиболее эффективным лекарством против T. gondii.и является основой эффективных схем. К ним относятся пириметамин-сульфадиазин (пир-сульф), золотой стандарт, по которому сравниваются другие схемы, и пириметамин в сочетании с клиндамицином, атоваквоном, кларитромицином или азитромицином. Однако в сентябре 2015 года цена на пириметамин, который используется в клинической практике более 6 десятилетий, была увеличена на 5000% за ночь с 13,50 до 750,00 долларов за таблетку компанией Turing Pharmaceuticals (сейчас ее продает Vyera Pharmaceuticals), единственным производителем. Другие схемы включают триметоприм, другой ингибитор DHFR, в комбинации с сульфаметоксазолом (TMP-SMX; также известный как ко-тримоксазол) и атоваквон отдельно или в комбинации с сульфадиазином. Поскольку спирамицин нетоксичен и не проникает через плаценту, он по-прежнему используется в профилактических целях у беременных женщин для предотвращения передачи паразита от матери и плода.
В ретроспективном исследовании 71 пациента с токсоплазмозом , связанным со СПИДом, 87% пациентов имели полное или частичное исчезновение симптомов после 4 недель терапии TMP-SMX (10 мг / кг / день компонента TMP). У 31% пациентов наблюдались побочные кожные реакции, а у 7% был рецидив во время поддерживающего режима. Хотя не было разницы в выживаемости, побочные эффекты были более частыми в группе пир-сульф. Удивительно, но небольшое рандомизированное исследование пир-сульф по сравнению с TMP-SMX обнаружило более высокую смертность в группе TMP-SMX. В другом исследовании было обнаружено, что наносуспензия атоваквона, используемая в качестве поддерживающей пероральной терапии, превосходит стандартную терапию пир-сульфом в сохранении патологии головного мозга и сокращении числа паразитов.
Читайте также:

