Чем отличается бактериофаг стрептококковый от стафилококкового
Обновлено: 24.04.2024
Заболевания ЛОР-органов отличаются значительной распространенностью и активной ролью в формировании многочисленных, порой тяжелых, осложнений.
Высокая частота этих заболеваний во многом связана с острой респираторной инфекцией (ОРИ), занимающей ведущее место в структуре современной патологии человека. По самым скромным подсчетам, ежегодно в мире регистрируется до 10 млрд заболевших ОРИ, а в России — от 27,3 до 41,2 млн человек [1]. Острые респираторные заболевания составляют почти 90% всех инфекционных болезней [2].
Этиологически значимыми возбудителями ОРИ, кроме вирусов, являются стрептококки, стафилококки, гемофильная палочка и другие микроорганизмы [3].
Наряду с типичными и хорошо известными неспецифическими признаками инфекционного заболевания — недомоганием, повышением температуры тела, головной болью, ОРИ проявляется и симптомами, характерными для поражения начальных отделов респираторного тракта и уха.
Одними из наиболее частых заболеваний, ассоциированных с ОРИ, являются воспалительные изменения слизистой оболочки носа (острый ринит) и околоносовых пазух (острый синусит, риносинусит), которые регистрируются у 5—10% больных с ОРИ и входят в десятку наиболее часто встречающихся в амбулаторной практике заболеваний. Риносинусит отличается склонностью к рецидивам и в 10—15% случаев приобретает хроническое течение [4, 5].
Другим не менее частым заболеванием, связанным с ОРИ, является острый тонзиллофарингит (ОТФ), по поводу которого за медицинской помощью ежегодно обращается примерно 10% населения развитых стран [6]. Среди бактериальных возбудителей ОТФ наиболее значимым является бета-гемолитический стрептококк группы, А (БГСА), вызывающий до 30% случаев ОТФ у детей в возрасте 5—15 лет. Реже возникновение ОТФ связано со стрептококками других серологических групп, а также Mycoplasma pneumoniae, Chlamydia pneumoniae, Arcanobacterium hаemolyticum, Haemophilus influenzae, Moraxella catarrhalis и др. [7].
Клиническими проявлениями стрептококкового ОТФ являются воспаление небных миндалин, шейный лимфаденит, лихорадка и отсутствие кашля. Наличие у пациента всех четырех симптомов или трех симптомов и положительного теста на БГСА рассматривается в качестве основания для антибактериальной терапии. Для вирусного фарингита, кроме изменений в глотке, характерны так называемые респираторные симптомы — ринит, дисфония, кашель. Прием антибиотиков в этих случаях, как правило, неэффективен.
Нередко на фоне ОРИ развивается воспаление наружного и/или среднего уха. Удельный вес наружного отита (НО) в структуре обращаемости составляет около 12% [8]. Наиболее распространенными патогенами при бактериальном, НО являются Pseudomonas aeruginosa (50—70%), Staphylococcus aureus (10%), Staphylococcus epidermidis (8—10%), бета-гемолитический стрептококк (5%) [9].
Еще одним частым осложнением инфекции верхних дыхательных путей является острый средний отит (ОСО), занимающий лидирующее положение в структуре современной патологии, в особенности детского возраста. Например, к 3-летнему возрасту 83% детей переносят хотя бы 1 эпизод ОСО, а у 46% — диагностируется 3 и более случаев этого заболевания [10].
Таким образом, актуальность проблемы ОРИ обусловлена, с одной стороны, значительной распространенностью и высокой вероятностью их осложненного течения, а с другой — быстрым формированием на этом фоне бактериально-ассоциированных заболеваний верхних дыхательных путей, в первую очередь острого риносинусита, ОТФ и острого отита.
В практическом отношении поставить этиологически правильный диагноз, т. е. дифференцировать конкретные нозологические формы в зависимости от возбудителя, учитывая только клинические признаки заболевания, крайне сложно. Это обстоятельство нередко является источником ошибочного применения антибактериальных препаратов, до 75% которых, по данным экспертов ВОЗ, используются нерационально [11]. Достаточно яркой иллюстрацией необоснованного применения антибиотиков является их назначение 95% пациентов с симптомами ОТФ [12]. В определенной степени это подтверждается и данными многоцентрового исследования, проведенного в России, — у 95% пациентов боль в горле являлась основанием для назначения антибиотиков [13]. В США этот показатель составил 73% [14].
Очевидно, что эффективное лечение бактериально-ассоциированной патологии ЛОР-органов зачастую невозможно без адекватной антибиотикотерапии. Вместе с тем четкие дифференциально-диагностические критерии, позволяющие с высокой степенью достоверности говорить о наличии вирусной или бактериальной инфекции, например, при остром риносинусите, за исключением культурального исследования аспирата из синуса, отсутствуют. Как правило, в качестве основного признака бактериальной этиологии синусита рассматривается временнoй фактор — сохранение или прогрессирование симптомов заболевания на протяжении 5—7 дней. В связи с этим современные клинические рекомендации и согласительные документы экспертов, представляющих различные медицинские специальности, отмечают важность исключения антибактериальных средств из протоколов лечения неосложненного острого риносинусита в течение первых 5—7 дней развития заболевания, поскольку назначение антибиотиков, как известно, не оказывает влияния на течение и исход вирусной инфекции, а нерациональное применение антибактериальных препаратов способствует быстрой селекции резистентных штаммов этиологически значимых возбудителей инфекционной патологии ЛОР-органов [15, 16].
Следует отметить, что значительные изменения в профиле микробной резистентности отмечаются у наиболее вероятных возбудителей острых заболеваний ЛОР-органов, в частности S. pneumoniae. Устойчивость пневмококков, например, к b-лактамным антибиотикам связана с изменением пенициллинсвязывающих белков, которые являются ферментами, обеспечивающими строительство клеточной стенки бактерий. В то же время пенициллинрезистентные пневмококки часто демонстрируют одновременную устойчивость к макролидам, ко-тримоксазолу, тетрациклинам и в отдельных случаях — к цефалоспоринам III поколения (цефотаксиму, цефтриаксону). Отмечено, что за период с 1994 по 1999 г. резистентность пневмококков к макролидам в США выросла почти в три раза. Рост устойчивости пневмококков к макролидам объясняют, в первую очередь, наличием гена mefE, обусловливающего эффлюкс (активное выведение) макролидов из клетки. В 4 исследованиях, опубликованных в 90-х годах, показано, что более 30% штаммов S. pneumoniaе отличались умеренной устойчивостью к пенициллину по сравнению с 0,02% в период с 1979 по 1987 г. [17]. Схожая ситуация наблюдается и в отношении распространенности антибиотикорезистентных штаммов H. influenzae и M. catarralis [15, 18, 19]. Перечисленные обстоятельства крайне отрицательно сказываются на эффективности антибактериального лечения воспалительных заболеваний ЛОР-органов.
Как известно, механизм действия бактериофагов заключается в их проникновении в бактериальные клетки и взаимодействии с геномом, что приводит, в зависимости от природы фага, к лизогенному или литическому эффекту. При литическом действии бактериофаги начинают размножаться и разрушать бактериальную клетку, а при лизогенном геном фага интегрируется в бактериальный геном и передается из поколения в поколение. При этом в некотором количестве клеток периодически синтезируются вирионы, лизирующие эти клетки и выходящие затем во внешнюю среду. Такие фаги называются умеренными, а фаги, вызывающие литический эффект, — вирулентными [21]. Именно вирулентные бактериофаги используются в лечении и профилактике. Определенные перспективы в повышении эффективности лечения хронического отита связываются с применением поливалентного препарата бактериофагов, предназначенного для воздействия на антибиотикорезистентные штаммы P. aeruginosa [22], интраназальных форм (мази и капли) бактериофагов для профилактики и лечения внутригоспитальных инфекций, вызываемых метициллин-резистентными S. aureus (MRSA) [23].
Получены обнадеживающие результаты изучения активности муреиновой гидролазы (лизина), которая продуцируется стрептококковым бактериофагом С (1), в отношении стрептококков групп А, С и Е. В иследованиях на экспериментальных животных показано, что лизин (муреиновая гидролаза) оказывает летальное действие на стрептококки группы, А in vitro и in vivo без воздействия на другие микроорганизмы. В частности, 1000 единиц (10 нг) этого фермента было достаточно для эрадикации 10 7 стрептококков в течение 5 с. При введении лизина орально в дозе 500 ЕД мышам с высокой степенью колонизации ротоглотки стрептококками, микроорганизмы не обнаруживались уже через 2 ч после начала лечения лизином [24]. Авторы полагают, что применение лизина может быть использовано для элиминации и снижения количества бактерий, колонизирующих слизистую оболочку верхних дыхательных путей как при клинически выраженном заболевании, так и при носительстве, способствуя снижению заболеваемости стрептококковыми инфекциями. Однако бактериофаги обладают более высокой специфичностью действия.
Результаты клинического исследования свидетельствуют о положительном влиянии фаготерапии на клинические проявления хронического тонзиллита и высеваемость S. аureus с поверхности небных миндалин [25]. В частности, на фоне монотерапии стафилококковым бактериофагом у больных, имевших до лечения скудный рост золотистого стафилококка, после применения бактериофага S. аureus не выделялся в течение 1 мес. У 8 пациентов с умеренным ростом на следующий день после окончания фаготерапии наблюдался очень скудный и скудный рост стафилококка у 4 обследованных; у остальных 4 пациентов сохранился умеренный характер роста. В дальнейшем S. aureus не высевался у 2 пациентов через 10 и 30 дней после фаготерапии. Умеренный рост на протяжении всего времени наблюдения сохранился у 1 обследованного. Однако в этом случае, как и у всех пациентов этой группы, по окончании фаготерапии отсутствовали жалобы на боли и дискомфорт, наблюдалась положительная динамика фарингоскопических изменений. У пациентов с обильным ростом S. aureus (7 человек) после применения бактериофага золотистый стафилококк не высевался на следующий день у 1, через 10 дней у 3, через 30 дней у 1 пациента. Очень скудный и скудный рост S. aureus регистрировался у 3 пациентов через 10 и 30 дней после фаготерапии, умеренный — у 2 пациентов на следующий день, у 1 — через 10 и 30 дней после завершения фаготерапии. Обильный рост S. aureus сохранялся у 2 пациентов в течение 1 мес наблюдения. При этом авторы наблюдали снижение степени выделения золотистого стафилококка (с 10 6 до 10 3 КОЕ/мл) и регресс клинической симптоматики хронического тонзиллита. Положительные результаты регистрировались и при сочетании фаготерапии с другими методами лечения хронического тонзиллита, в частности в комбинации с применением аппарата Тонзиллор (10 процедур по стандартной методике). Отмечается эффективность применения внутригортанных инстилляций раствора бактериофага при ларингите [26]. Согласно полученным авторами данным, использование в комплексном лечении таких пациентов специфического бактериофага в виде инстилляций в гортань, а в случае тяжелого обострения — в виде приема внутрь, позволяет существенно сократить продолжительность лечения, повышая его качество, достичь более длительной ремиссии болезни и снизить частоту обострений.
В отличие от антибиотикотерапии, на фоне которой сохранялись признаки воспаления в виде активации нейтрофильного звена иммунной системы, увеличения внеклеточной пероксидазной активности и угнетения процесса фагоцитоза, применение пиобактериофага сопровождалось улучшением показателей завершенности фагоцитоза, что свидетельствует о снижении интенсивности воспаления с восстановлением адекватного иммунного ответа слизистой оболочки носа, а также положительной динамике клинических проявлений заболевания [27].
Включение в схему лечения препарата пиобактериофаг поливалентный (Секстафаг) стимулирует повышение способности Нф к завершенности фагоцитоза и уменьшению уровня ВПА (маркера воспаления). Монотерапия препаратом пиобактериофаг поливалентный не сопровождается снижением фагоцитарных свойств Нф, а показатели местного иммунитета соответствуют ПЗЛ и свидетельствуют о завершении воспалительного процесса. Следовательно, препарат пиобактериофаг поливалентный (Секстафаг), обладает противовоспалительными и иммунорегуляторными свойствами, что проявляется нормализацией показателей местного иммунитета [27].
Гель рекомендуется применять местно (в виде аппликаций) на слизистую оболочку полости носа, поверхности небных миндалин, кожу наружного слухового прохода 2—3 раза в день до исчезновения патологических изменений.
Таким образом, применение бактериофагов при лечении часто встречающихся инфекций ЛОР-органов является одним из перспективных разделов клинической оториноларингологии. Во многом это связано с реальными преимуществами бактериофагов — их высокой специфичностью, отсутствием воздействия на нормальную микрофлору организма, стимулирующим влиянием на гуморальное и клеточное звенья иммунитета, отсутствием токсичности, аллергогенности и тератогенного действия.
К преимуществам бактериофаговой терапии следует отнести и такие ее характеристики, как эффективность против антибиотикорезистентных возбудителей, возможность применения при аллергии к антибиотикам. В связи с этим есть основания полагать, что дальнейшие исследования этого направления будут способствовать повышению эффективности лечения воспалительных заболеваний верхних дыхательных путей и уха.

Стерильный очищенный фильтрат фаголизатов бактерий рода Streptococcus (с активностью по Аппельману - не менее 10 -5) - до 1 мл.
Представляет собой прозрачную жидкость желтого цвета различной интенсивности, возможен зеленоватый оттенок.
Препарат обладает способностью специфически лизировать бактерии рода Streptococcus.
Лечение и профилактика заболеваний, вызванных бактериями Streptococcus в составе комплексной терапии:
заболевания уха, горла, носа, дыхательных путей и легких (воспаления пазух носа, среднего уха, ангина, фарингит, ларингит, трахеит, бронхит, пневмония, плеврит);
хирургические инфекции (нагноения ран, ожоги, абсцесс, флегмона, фурункулы, карбункулы, гидраденит, панариции, парапроктит, мастит, бурсит, остеомиелит);
урогенитальные инфекции (уретрит, цистит, пиелонефрит, кольпит, эндометрит, сальпингоофорит);
энтеральные инфекции (гастроэнтероколит, холецистит), дисбактериоз кишечника;
генерализованные септические заболевания;
гнойно-воспалительные заболевания новорожденных (омфалит, пиодермия, конъюнктивит, гастроэнтероколит, сепсис и др.);
другие заболевания, вызванные стрептококками.
С профилактической целью препарат используют для обработки послеоперационных и свежеинфицированных ран, а также для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Важным условием эффективной фаготерапии является предварительное определение фагочувствительности возбудителя.
Гиперчувствительность к компонентам препарата.
Применение данного препарата при беременности и в период кормления грудью возможно при наличии инфекций, вызванных фагочувствительными штаммами стрептококков (по рекомендации врача).
Препарат используют для приема внутрь (через рот), ректального введения, аппликаций, орошений, введения в полости ран, вагины, матки, носа, пазух носа и дренированные полости.

Тип упаковки Раствор для приема внутрь, местного и наружного применения, фл. 20 мл №4 Производитель Филиал АО "НПО "Микроген" в г. Пермь "Пермское НПО "Биомед" | Филиал АО НПО "Микроген" в г. Н.Новгород "ИМБИО"

Тип упаковки Раствор для приема внутрь, местного и наружного применения, фл.100 мл Производитель Филиал АО "НПО "Микроген" в г. Пермь "Пермское НПО "Биомед" | Филиал АО НПО "Микроген" в г. Н.Новгород "ИМБИО"
Препарат показан для лечения и профилактики гнойно-воспалительных и энтеральных заболеваний, вызванных бактериями рода стафилококков
Лекарственная форма Раствор для приема внутрь, местного и наружного применения, фл. 20 мл №4 Производитель
Филиал АО "НПО "Микроген" в г. Пермь "Пермское НПО "Биомед"
Филиал АО НПО "Микроген" в г. Н.Новгород "ИМБИО"
Стерильный очищенный фильтрат фаголизатов бактерий рода Staphylococcus (с активностью по Аппельману - не менее 10 -5 ) - до 1 мл.
Представляет собой прозрачную жидкость желтого цвета различной интенсивности, возможен зеленоватый оттенок.
Препарат вызывает специфический лизис бактерий Staphylococcus.
Лечение и профилактика гнойно-воспалительных и энтеральных заболеваний, вызванных бактериями рода Staphylococcus у взрослых и детей:
заболевания уха, горла, носа, дыхательных путей и легких (воспаления пазух
носа, среднего уха, ангина, фарингит, ларингит, трахеит, бронхит, пневмония, плеврит);
хирургические инфекции (нагноения ран, ожоги, абсцесс, флегмона, фурункулы, карбункулы, гидроаденит, панариции, парапроктит, мастит, бурсит, остеомиелит);
урогенитальные инфекции (уретрит, цистит, пиелонефрит, кольпит, эндометрит, сальпингоофорит);
энтеральные инфекции (гастроэнтероколит, холецистит), дисбактериоз кишечника;
генерализованные септические заболевания;
гнойно-воспалительные заболевания новорожденных (омфалит, пиодермия, конъюнктивит, гастроэнтероколит, сепсис и др.);
другие заболевания, вызванные стафилококками.
При тяжелых проявлениях стафилококковой инфекции препарат назначается в составе комплексной терапии.
С профилактической целью препарат используют для обработки послеоперационных и свежеинфицированных ран, а также для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Важным условием эффективной фаготерапии является предварительное определение чувствительности возбудителя к бактериофагу и раннее применение препарата.
Индивидуальная непереносимость или чувствительность к любому из компонентов препарата.
Целесообразно применение препарата при наличии инфекций, вызванных фагочувствительными штаммами стафилококков (по рекомендации врача).
Препарат используют для приема внутрь (через рот), ректального введения, аппликаций, орошений, введения в полости ран, вагины, матки, носа, пазух носа и дренированные полости. Перед употреблением флакон с бактериофагом необходимо взболтать и просмотреть. Препарат должен быть прозрачным и не содержать осадка.
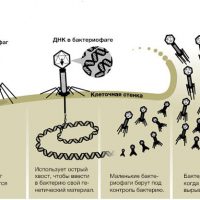
Так мир познакомился с микроорганизмами, питающимися бактериями, которые много тысяч лет делали свое дело слаженно, не давая бактериям уничтожить все живое на земле. В 1921 г. Д. Мэйсон и Р. Брайон впервые описали успешное лечение стафилококковой инфекции кожи с помощью стафилококкового бактериофага. Во время Второй мировой войны бактериофаги использовались при гнойно-септических инфекциях, дизентерии, тифе и др.
Бактериофаги еще в прошлом столетии доказали свою эффективность и безопасность. Почему же бактериофаги до сих пор не стали основными средствами борьбы с инфекцией? Это объясняется несколькими причинами. Главная — открытие новой группы препаратов – антибиотиков, надолго оттеснившее интерес к бактериофагам. Плюс:
- недостаточная информированность врачей и пациентов,
- отсутствие фагов ко многим патогенным бактериям,
- неэффективность лечения в связи с неправильным подбором бактериофагов для лечения конкретного больного,
- недостаточно изученное иммунологическое взаимодействие бактериофагов и организма человека,
- отсутствие нормативно-правовых аспектов применения бактериофагов в лечении инфекций человека.
Что такое бактериофаги![Механизм]()
В 1939 году А. Флемингом был открыт антибиотик, и началась эра антибиотиков в лечении бактериальных инфекций. Появилось большое количество антибиотиков 1, 2, 3, 4 поколений, причем антибиотики последнего поколения, которыми пользуются и сейчас, появились еще в 70-е годы прошлого столетия. На Западе и Америке отказались от бактериофагов и активно начали применять антибиотики.
Но А. Флеминг предупреждал о некоторых обязательных моментах применения антибиотиков:
- строгих показаниях к назначению,
- соблюдении продолжительности и запрете прерывания курса лечения,
- адекватных дозах препарата,
- способах введения,
- назначения их обязательно врачом,
- отпуске антибиотиков исключительно по рецепту.
Несоблюдение хотя бы части этих требований могло привести и, как оказалось, приводит к кризису антибиотиковой эры. Бактерии перестают реагировать на препараты. Пока ещё действуют антибиотики последнего поколения, решая труднейшие клинические проблемы, но рассчитывать на появление новых антибиотиков не приходится.
Россия на сегодняшний день оказалась самой развитой страной в области микробиологии изучения бактериофагов. Бактериофаги – это естественные антагонисты бактерий.
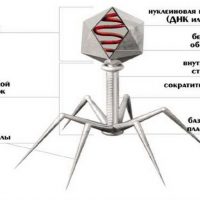
Каков механизм действия бактериофагов
Сегодня многие заболевания вызываются стафилококками, стрептококками, клебсиеллами и другими бактериями, и успешно могут лечиться бактериофагами. Это естественная альтернатива антибиотикам, возврат к природе.
Какие преимущества имеют бактериофаги в лечении бактериальных инфекций
Бактериофаги много тысяч лет делали свое дело, не давая бактериям уничтожить все живое на земле.
Бактериофаги могут применяться и у беременных, и у детей, во всех возрастных группах людей. Противопоказаний к их применению нет.
Фаги совместимы с различными лекарствами, в том числе с антибиотиками, причем они уменьшают непереносимость (резистентность) бактерий к антибиотикам.
Курс лечения бактериофагами более короткий (7-14 дней). Фаги практически не дают побочных явлений. Они определяются бактериальной зараженностью и распадом бактерий с выделением эндотоксина, но они значительно меньше, чем при приеме антибиотиков, эти явления легко снимаются приёмом энтеросорбентов. Бактериофаги можно применять при аллергических реакциях на антибиотики.
Бактериофаги, благодаря своей специфичности воздействия на бактерии, не убивают хорошие бактерии и не изменяют нормальную микрофлору кишечника. Они, в отличие от антибиотиков, не нарушают микробиом человека.
Какие виды бактериофагов известны
Известно, что бактериофаги действуют на один штамм бактерий, поэтому производятся препараты бактериофагов, действующих против разных штаммов одного возбудителя:
- стафилококковый бактериофаг,
- сальмонеллезный бактериофаг,
- стрептококковый бактериофаг,
- клебсиеллёзный бактериофаг (Клебсиелла пневмония),
- бактериофаг псевдомонас (против синегнойной палочки).
Производятся препараты против двух и более возбудителей, поливалентные бактериофаги:
- бактериофаг дизентерийный, действующий на разные штаммы дизентерийной палочки,
- клебсиеллезный бактериофаг против трёх видов клебсиелл,
- бактериофаг бактериальный поливалентный очищенный (действует на стрептококк, стафилококк, протей, клебсиеллу пневмонию, кишечную палочку, синегнойную палочку),
- пиобактериальный комплексный бактериофаг (против стафилококка, стрептококка, двух видов протея, двух видов клебсиеллы, энтерококков, энтеропатогенной кишечной палочки, синегнойной палочки),
- бактериофаг интестин-бактериальный против дизентерийной палочки, сальмонеллы, кишечной палочки, протея, энтерококков, стафилококков, синегнойной палочки,
- пиобактериофаг поливалентный или секстафаг (против стафилококка, стрептококка, протея, синегнойной палочки, клебсиеллы пневмонии, энтеропатогенной кишечной палочки).
Особенность бактериофагов – узкая специфичность, в следствие чего они могут применяться против определенных штаммов бактерий, поэтому необходимо иметь большую коллекцию бактериофагов, из которой можно выбрать подходящий препарат или фаговый коктейль для конкретного пациента. Коллекция бактериофагов составляет более 200 препаратов.
Производителем бактериофагов в России является научно-производственное объединение Микроген — мировой лидер изучения бактериофагов.
При каких заболеваниях применяются бактериофаги
Бактериофаги применяются при:
- трофических язвах,
- раневых инфекциях,
- инфекциях органов дыхания,
- мочеполовой системы,
- желудочно-кишечных тракта,
- болезнях лор-органов и др. заболеваниях.
Инфекции желудочно-кишечного тракта, вызванные сальмонеллой, золотистым стафилококком, протеем, и др. и сопровождающиеся диареей (поносами), успешно лечатся бактериофагами.
Применяться бактериофаги при острых кишечных инфекциях могут:
- в виде монотерапии при легких формах,
- в сочетании с антибиотиками при
- средне-тяжелых формах болезни,
- бактерионосительстве – выделении энтеропатогенных бактерий,
- комплексной терапии условно-патогенной флоры и нарушении микробиома (микрофлоры) кишечника.
Используются бактериофаги в дерматологии, в детской практике, хирургии. С профилактической целью — в детских садах и школах для предотвращения эпидемий, например, дизентерии. Бактериофаги уже более 100 лет на службе человека. Может быть, как раз сейчас начинается эпоха бактериофагов. В новосибирском научном центре разрабатываются технологии персонализированного лечения. Медицинские центры Франции, Бельгии, Швейцарии проводят клинические исследования коктейлей бактериофагов.
![]()
Важным условием успешного лечения бактериофагами является знание микрофлоры тех органов, где предполагается бактериальная инфекция. Ниже приведены необходимые исследования микрофлоры для различных очагов заражения:
Участок заражения Обследование желудочно-кишечный тракт анализ на микробиом толстой кишки (на дисбактериоз) носоглотка мазок на микрофлору урологические заболевания посев мочи,
посев секрета простатыгинекологические заболевания мазки раневые поверхности и язвы,
в том числе при диабетической стопепосев В настоящее время при выявлении бактериального возбудителя болезни есть возможность определить его чувствительность к бактериофагу. Перед началом лечения необходимо пройти это обследование.
Как принимаются бактериофаги
Бактериофаги хранятся в холодильнике при температуре 2-8 градусов.
Бактериофаги — это крупные частицы. Они трудно проникают в ткани органов, поэтому лучше вводить их при лечении прямо к месту локализации инфекции. Это могут быть ингаляции при легочной патологии, промывания при лор-заболеваниях, аппликации при трофических язвах, ожогах, ранах. При инфекциях мочевыводящих путей для достижения успеха препараты бактериофагов вводятся в полость мочевого пузыря (хронический цистит).
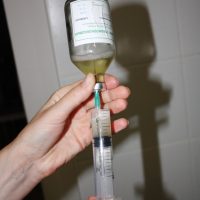
Для внутреннего употребления есть бактериофаги во флаконах по 20 мл, 4 флакона в упаковке. Перед употреблением флакон следует подержать в руке, согреть, перелить в чистую посуду и принять внутрь. Принимать 2 раза в день натощак и после ужина, курс лечения 6 дней.
![Забор бактериофага из 100-мл флакона]()
Есть упаковки по 50 мл и 100 мл. Поскольку следует максимально сохранять стерильность препарата (при помутнении запрещён его приём), необходимый для однократного приёма объём следует набирать в шприц.
В настоящее время проводят лечение бактериофагами диабетической стопы. Из больных тканей берут мазок для выявления конкретных патогенных бактерий. Затем из коллекции бактериофагов подбирают те, которые способны ликвидировать именно эти бактерии. Бактериофаг наносят на стерильную салфетку, прикладывают к ране. Лечение около недели.
Бактериофаги применяются в медицине местно или внутрь. Еще в 30-ые годы прошлого столетия бактериофаги доказали свою безопасность и высокую эффективность в клинических условиях. Но покупать бактериофаги и лечиться самостоятельно не стоит.
Заключение
Не всегда бактериофаги могут заменить антибиотики. Так, если имеет место острая ситуация, когда заподозрена бактериальная инфекция, но нет времени определить бактериальный фон болезни, чтобы подобрать препарат бактериофаг, то применяется лечение антибиотиками. При хронических инфекционных болезнях, когда установлена нечувствительность бактерий к антибиотикам и бактериальный фон заболевания, предпочтение следует отдать бактериофагам.
Хотя бактериофаги, возможно, не смогут полностью заменить антибиотики, но вместе они могут бороться со многими серьезными болезнями в клинической практике.
Читайте также: