Чем волчанка отличается от аллергии
Обновлено: 18.04.2024
Васкулиты кожи — группа заболеваний мультифакторной природы, при которых ведущим признаком является воспаление кровеносных сосудов дермы и подкожной клетчатки.
Васкулиты кожи — группа заболеваний мультифакторной природы, при которых ведущим признаком является воспаление кровеносных сосудов дермы и подкожной клетчатки.
Трудность в освещении этой темы заключается в том, что до настоящего времени нет общепринятой классификации и даже согласованной терминологии васкулитов. В настоящее время описано около 50 различных нозологических форм, и разобраться в этом многообразии непросто. Пестрота клинических проявлений и недостаточно изученные патогенетические механизмы привели к тому, что под разными названиями может скрываться лишь вариант основного типа поражения кожи. Также, помимо первичных васкулитов, в основе которых лежит воспалительное поражение сосудов кожи, выделяют и вторичные васкулиты (специфические и неспецифические), развивающиеся на фоне определенного инфекционного (сифилис, туберкулез и др.), токсического, паранеопластического или аутоиммунного (системная красная волчанка, дерматомиозит и др.) процесса. Возможна трансформация васкулита кожи в системный процесс с поражением внутренних органов и развитием тяжелых, иногда опасных для жизни осложнений.
Васкулиты кожи — заболевания полиэтиологические. Наиболее часто наблюдается связь с фокальной инфекцией (стрептококки, стафилококки, микобактерии туберкулеза, дрожжевые грибы, вирусы и др.). Определенное значение имеет повышенная чувствительность к ряду лекарственных веществ, в частности к антибиотикам и сульфаниламидным препаратам. Нередко, несмотря на тщательно собранный анамнез и проведенное обследование, этиологический фактор остается невыясненным. Среди факторов риска при васкулитах следует учитывать: возраст (наиболее уязвимы дети и пожилые люди), переохлаждение, чрезмерную инсоляцию, тяжелые физические и психические нагрузки, травмы, операции, заболевания печени, сахарный диабет, гипертонию. Патогенетическим механизмом развития васкулитов кожи в настоящее время считается образование циркулирующих иммунных комплексов с последующей их фиксацией в эндотелии, хотя окончательно это доказано не для всех заболеваний данной группы.
Васкулиты кожи — это неоднородная группа заболеваний, и клинические проявления их чрезвычайно разнообразны. Однако существует целый ряд общих признаков, объединяющих эти дерматозы:
1) воспалительный характер изменений кожи;
2) симметричность высыпаний;
3) склонность к отеку, кровоизлияниям и некрозу;
4) первичная локализация на нижних конечностях;
5) эволюционный полиморфизм;
6) связь с предшествующими инфекционными заболеваниями, приемом лекарств, переохлаждением, аллергическими или аутоиммунными заболеваниями, с нарушением венозного оттока;
7) острое или обостряющееся течение.
Поражения кожи при васкулитах многообразны. Это могут быть пятна, пурпура, узелки, узлы, некрозы, корки, эрозии, язвы и др., но основным клиническим дифференциальным признаком является пальпируемая пурпура (геморрагическая сыпь, возвышающаяся над поверхностью кожи и ощущаемая при пальпации).
Общепринятой классификации васкулитов не существует. Систематизируют васкулиты по разным принципам: этиологии и патогенезу, гистологической картине, остроте процесса, особенностям клинических проявлений. Большинство клиницистов пользуются преимущественно морфологическими классификациями кожных васкулитов, в основу которых обычно положены клинические изменения кожи, а также глубина расположения (и соответственно калибр) пораженных сосудов. Выделяют поверхностные (поражение сосудов дермы) и глубокие (поражение сосудов на границе кожи и подкожной клетчатки) васкулиты. К поверхностным относят: геморрагический васкулит (болезнь Шенлейна–Геноха), аллергический артериолит (полиморфный дермальный ангиит), лейкокластический геморрагический микробид Мишера–Шторка, а также хронические капилляриты (гемосидерозы): кольцевидная телеангиэктатическая пурпура Майокки и болезнь Шамберга. К глубоким: кожную форму узелкового периартериита, острые и хронические узловатые эритемы.
Геморрагический васкулит — системное заболевание, поражающее мелкие сосуды дермы и проявляющееся пальпируемой пурпурой, артралгиями, поражением желудочно-кишечного тракта (ЖКТ) и гломерулонефритом. Встречается в любом возрасте, но наибольшему риску подвергаются мальчики в возрасте от 4 до 8 лет. Развивается после инфекционного заболевания, через 10–20 дней. Острое начало заболевания, с повышением температуры и симптомами интоксикации чаще всего наблюдается в детском возрасте. Выделяют следующие формы геморрагического васкулита: кожная, кожно-суставная, кожно-почечная, абдоминально-кожная и смешанная. Течение может быть молниеносным, острым и затяжным. Длительность заболевания различна — от нескольких недель до нескольких лет.
Процесс начинается симметрично на нижних конечностях и ягодицах. Высыпания имеют папулезно-геморрагический характер, нередко с уртикарными элементами, при надавливании не исчезают. Окраска их меняется в зависимости от времени появления. Высыпания возникают волнообразно (1 раз в 6–8 дней), наиболее бурными бывают первые волны сыпи. Суставной синдром появляется либо одновременно с поражением кожи, либо через несколько часов. Чаще всего поражаются крупные суставы (коленные и голеностопные).
Одним из вариантов заболевания является так называемая некротическая пурпура, наблюдаемая при быстром течении процесса, при котором появляются некротические поражения кожи, изъязвления, геморрагические корки.
Наибольшие трудности вызывает диагностика абдоминальной формы геморрагического васкулита, так как высыпания на коже не всегда предшествуют желудочно-кишечным явлениям (рвоте, схваткообразным болям в животе, напряжению и болезненности его при пальпации, кровью в стуле).
Почечная форма проявляется нарушением деятельности почек различной степени выраженности, от кратковременной нестойкой гематурии и альбуминурии до выраженной картины острого гломерулонефрита. Это поздний симптом, он никогда не встречается до поражения кожи.
Молниеносная форма геморрагического васкулита характеризуется крайне тяжелым течением, высокой лихорадкой, распространенными высыпаниями на коже и слизистых, висцерапатиями, может закончиться смертью больного.
Диагностика заболевания базируется на типичных клинических проявлениях, в атипичных случаях проводится биопсия. При абдоминальной форме необходимо наблюдение хирурга. Рекомендуется наблюдение нефролога в течение трех месяцев после разрешения пурпуры.
Патогенетическими факторами болезни считают простуду, фокальные инфекции. Высыпания располагаются обычно симметрично и имеют полиморфный характер (пятна, папулы, пузырьки, пустулы, некрозы, изъязвления, телеангиэктазии, волдыри). В зависимости от преобладающих элементов выделяют три формы заболевания: геморрагический тип, полиморфно-узелковый (соответствует трехсимптомной болезни Гужеро–Дюперра) и узелково?некротический (соответствует узелково?некротическому дерматиту Вертера–Дюмлинга). При регрессе сыпи могут оставаться рубцовые атрофии и рубчики. Заболевание склонно к рецидивам. Нередко перед высыпаниями больные жалуются на недомогание, усталость, головную боль, в разгар заболевания — на боли в суставах (которые иногда припухают) и в животе. Диагностика всех типов заболевания сложна из-за отсутствия типичных, характерных симптомов. При гистологическом исследовании выявляется фибриноидное поражение сосудов мелкого калибра с образованием инфильтративных скоплений из нейтрофилов, эозинофилов, лимфоцитов, плазматических клеток и гистиоцитов.
Геморрагический лейкокластический микробид Мишера–Шторка по клиническому течению сходен с другими формами полиморфных дермальных васкулитов. Признаком, позволяющим выделить это заболевание как самостоятельное, является наличие феномена — лейкоклазии (распад ядер зернистых лейкоцитов, приводящий к образованию ядерной пыли) при гистологическом исследовании. Таким образом, геморрагический лейкокластический микробид может трактоваться как дерматоз, обусловленный хронической фокальной инфекцией (внутрикожные тесты со стрептококковым антигеном положительные), протекающий с выраженной лейкоклазией.
Хронические капилляриты (гемосидерозы), в отличие от остро протекающих пурпур, характеризуются доброкачественным течением и являются исключительно кожными заболеваниями.
Болезнь Шамберга — представляет собой лимфоцитарный капиллярит, который характеризуется наличием петехий и коричневых пурпурных пятен, возникающих чаще всего на нижних конечностях. Пациентов беспокоит исключительно как косметический дефект.
Пурпура Майокки характеризуется появлением на нижних конечностях розовых и ливидно-красных пятен (без предшествующей гиперемии, инфильтрации), медленно растущих с образование кольцевидных фигур. В центральной части пятна развивается небольшая атрофия и ахромия, выпадают пушковые волосы. Субъективные ощущения отсутствуют.
Иногда единственным проявлением заболевания может быть сетчатое или ветвистое ливедо (стойкие фиолетово?красные пятна), локализующиеся на дистальных отделах конечностей, преимущественно на разгибательных поверхностях или пояснице. Характерно обнаружение по ходу ливедо узелков.
Диагностика заболевания основывается на сочетании поражения ряда органов и систем с признаками значительного воспаления, с лихорадкой, изменениями прежде всего в почках, в сердце, наличии полиневрита. Специфических для этой болезни лабораторных показателей не существует. Решающее значение для диагноза имеет динамическое клиническое наблюдение за больным.
Острая узловатая эритема — это панникулит, который характеризуется наличием болезненных розовых узлов на разгибательной поверхности нижних конечностей. Сопровождается лихорадкой, недомоганием, диареей, головной болью, конъюнктивитом и кашлем. Среди взрослых узловатая эритема в 5–6 раз чаще встречается у женщин, пиковый возраст — 20–30 лет. В основе заболевания гиперчуствительность к различным антигенам (бактерии, вирусы, грибы, новообразования и заболевания соединительной ткани). Половина случаев является идиопатическими. Диагностика основывается на данных анамнеза и физического осмотра. Необходимо провести полный анализ крови, рентгенограмму легких (выявляется двусторонняя аденопатия в области корней легких), мазок из зева или быстрый тест на стрептококки.
Хроническая узловая эритема — это группа различных видов узловатых дермогиподермитов. Чаще болеют женщины 30–40 лет. На голенях возникают узлы различной величины с покрасневшей над ними кожей, без наклонности к некрозу и изъязвлению. Воспалительные явления в области высыпаний и субъективные ощущения (артралгии, миалгии) мало выражены. Клинические варианты хронической узловатой эритемы имеют свои особенности, например наклонность узлов к миграции (мигрирующая эритема Беферштедта) или асимметрия процесса (гиподермит Вилановы–Пиноля).
Тактика ведения больного васкулитом кожи
- Классифицировать заболевание (характерная клиническая картина, анамнез, гистологическое исследование).
- Поиск этиологического фактора, но в 30% случаев его установить не удается (поиск очагов хронической инфекции, микробиологические, иммунологические, аллергологические и другие исследования).
- Оценка общего состояния и определение степени активности заболевания: общий анализ крови и мочи, биохимический анализ крови, коагулограмма, иммунограмма. Степень активности васкулитов: I. Высыпания не обильные, температура тела не выше 37,5, общие явления незначительные, СОЭ не выше 25, С-реактивный белок не более ++, комплемент более 30 ед. II. Высыпания обильные (выходят за пределы голени), температура тела выше 37,5, общие явления — головная боль, слабость, симптомы интоксикации, артралгии; СОЭ выше 25, С-реактивный белок более ++, комплемент менее 30 ед., протеинурия.
- Оценка признаков системности (исследование по показаниям).
- Определение вида и режима лечения в зависимости от степени активности: I ст. — возможно лечение в амбулаторных условиях; II ст. — в стационаре. Во всех случаях обострений васкулитов кожи необходим постельный режим, так как у таких больных обычно резко выражен ортостатизм, который следует соблюдать до перехода в регрессирующую стадию. Рекомендуется диета с исключением раздражающей пищи (алкогольные напитки, острые, копченые, соленые и жареные блюда, консервы, шоколад, крепкий чай и кофе, цитрусовые).
- Этиологическое лечение. Если есть возможность устранить причинный агент (лекарство, химикаты, инфекции), то быстро следует разрешение кожных очагов и другого лечения не требуется. Но надо помнить, что при санации очагов инфекции может наблюдаться усиление сосудистого процесса.
- Патогенетическое лечение.
- Профилактические мероприятия: диспансеризация, предупреждение провоцирующих факторов (инфекции, переохлаждение, инсоляции, стрессы и др.), рациональное использование лекарственных средств, трудоустройство, лечебная физкультура, санаторно-курортное лечение.
Лечение геморрагического васкулита
- Глюкокортикостероиды (преднизалон до 1,5 мг/кг) — облегчают проявление кожно-суставного синдрома, но не укорачивают заболевание и не предотвращают поражение почек. Назначаются в тяжелых случаях и под прикрытием гепарина, т. к. повышают свертываемость крови.
- Нестероидные противовоспалительные средства (НПВС) в обычных терапевтических дозировках. Выбор конкретного препарата принципиального значения не имеет (индометацин, диклофенак, ацетилсалициловая кислота).
- Антикоагулянты и антиагреганты. Гепарин при распространенном процессе 300–400 ЕД/кг/сутки. Продолжительность курса должна составлять не менее 3–5 недель. Под контролем коагулограммы.
- Лечебный плазмаферез, когда проявления заболевания не устраняются перечисленными средствами.
- Никотиновая кислота в переносимых дозах в/в капельно.
- Не следует применять: антигистаминные препараты (возможно только в самом начале заболевания), препараты кальция, все витамины.
Лечение васкулитов кожи
1) НПВС (напроксен, диклофенак, Реопирин, индометацин и др.);
2) салицилаты;
3) препараты Са;
4) витамины Р, С, антиоксидантный комплекс;
5) сосудорасширяющие средства (ксантинола никотинат, пентоксифиллин);
6) 2% раствор йодида калия по 1 ст. л. 3 раза в день (узловатая эритема);
7) антикоагулянты и антиагреганты;
8) методы детоксикации в/в капельно;
9) глюкокортикостероиды (ГКС) по 30–35 мг/сутки в течение 8–10 дней;
10) цитостатики;
11) ультравысокочастотная терапия, диатермия, индуктотермия, ультразвук с гидрокортизоном, ультрафиолетовое облучение.
Наружное лечение. При эрозивно-язвенных высыпаниях
1) 1–2% растворы анилиновых красителей;
2) эпителизирующие мази (солкосерил);
3) мази, содержащие глюкокортикоиды, и др.;
4) примочки или мази протеолитическими ферментами (Химопсин, Ируксол);
5) апликации Димексида;
При узлах — сухое тепло.
Лечение не должно заканчиваться с исчезновением клинических проявлений заболевания. Оно продолжается до полной нормализации лабораторных показателей, а в последующие полгода-год больным проводится поддерживающее лечение

Почему красную волчанку называют аллергией на себя?
- Системная форма (поражаются суставы, почки, сердце, лёгкие). Данная форма находится в ведении врачей-ревматологов.
- Дискоидная форма волчанки в компетенции врачей- дерматологов.
Какие факторы могут спровоцировать болезнь?
- Долгое пребывание под солнечными лучами (ультрафиолет)
- Инфекционные заболевания
- Травма
- Сильное перегревание или охлаждение
- Лекарственные средства (изониазид, тетрациклин, метилдопа, атенол).
Проявления на коже:
- Острую кожную волчанку из-за формы распространения сравнивают с крыльями бабочки. Сначала появляется розовая сыпь на лице, которая увеличивается, сливаясь между собой и переходят на область щек и носа. Образуется розово-красная поражённая область (эритема), по очертаниям схожая с бабочкой (крылья -щёки, туловище -нос).
- Подострую форму характеризуют кольцевидные очаги, которые расположены на спине, плечах, в зоне декольте. В данной форме симпотоматика не такая яркая.
- Наличие хронической кожной формы характеризуют фиолетово- красные бляшки, к которым плотно прилегают чешуйки на открытых участках тела (лице, ушных раковинах, в зоне декольте). Заболевание тянется годами, чередуя периоды ремиссий и обострений.
Существуют ли препараты, способные полностью вылечить от красной волчанки?
Нет, лекарства от данной болезни не существует. Но имеются схемы лечения, которые во многом позволяют снизить активность заболевания и предотвращают осложнения.
Пациенты с красной волчанкой должны обязательно защищать кожу: выбирать одежду с длинным рукавом, шляпы с широкими полями и пользоваться солнцезащитным кремом. Не увлекайтесь длительным нахождением под солнцем и не посещайте солярии.

Обзор
Автор
Редакторы

Эта Статья заслужила приз зрительских симпатий.
Однако есть заболевания, возможно, не столь смертельные, но куда сильнее бьющие по нам экономически. Это аутоиммунные заболевания, такие, как рассеянный склероз, системная красная волчанка или диабет 1-го типа. Если рак и инсульты чаще всего встречаются у пожилых людей, то аутоиммунные состояния обычно манифестируют (проявляются в виде симптомов) у молодых людей трудоспособного возраста и либо ложатся тяжким бременем на бюджет страны или больного (россияне, больные диабетом, если не получают инсулин от государства, тратят на поддержание собственной жизни от 1 до 5–6 тысяч рублей в месяц), либо, как в случае рассеянного склероза, просто ставят крест на карьере и жизни пациента.
Особенность аутоиммунных заболеваний состоит в том, что практически ни для одного из них мы за долгие годы исследований и экспериментов не научились достигать стойкой ремиссии. Текущие решения сводятся либо к поддерживающей терапии (как в случае с инсулинозависимым диабетом), либо к попыткам отсрочить терминальную стадию заболевания, на что нацелены препараты от рассеянного склероза. До недавнего времени ситуация выглядела довольно плачевно. Дополнительно усугубляет ее тот факт, что количество людей с аутоиммунными заболеваниями растет каждый год, и мы находимся на пороге настоящей эпидемии.
Однако там, где фармацевтическая отрасль терпит одну неудачу за другой, внезапно сама природа показала, куда смотреть исследователям и откуда брать по-настоящему работающее лекарство.
История вопроса
Чтобы понять, откуда возникла проблема с аутоиммунными заболеваниями, придется заглянуть далеко в прошлое.
Дело в изменившемся в ходе FET образе жизни человека. До этого мы жили небольшими группами, состоявшими не более чем из 50 особей, занимавшими довольно обширные пространства. К тому же мы постоянно меняли место жительства, нигде не оставались надолго. Культура гигиены была довольно низкой — зачем следить за чистотой убежища, если ты уже съел всех мамонтов вокруг и завтра надо искать новое место?
В ходе FET люди начали надолго оставаться на одном месте, формировать более крупные группы для защиты от набегов соплеменников. Скученность и загрязнение места обитания создали оптимальные условия для развития у нас инфекций. Начались эпидемии, которые были тем свирепее, чем больше был город и чем плотнее жили в нем люди.

Довольно долгое время, около 5000 лет, понадобилось человечеству, чтобы научиться справляться с инфекциями. Где-то раньше, где-то позже люди осознали важность гигиены для жизни и здоровья. Были эмпирически найдены лекарства от многих болезней. Можно сказать, весь прогресс медицины и человечества в целом происходил под постоянно довлеющим страхом новых эпидемий.

Рисунок 2. Обложка Le petit journal от 1 сентября 1912 года, посвященного эпидемии холеры в Индии и на Ближнем Востоке в начале 20-го века.
В настоящее время мы настолько чисты, насколько не были никогда в истории. Особенно хорошо это видно в развитых странах. Мы привыкли к тому, что во все дома подведена вода и всегда есть возможность принять ванную или душ. Мы пользуемся мылом, влажными салфетками, асептическими гелями. Мы даже моем наши дороги шампунем!
Казалось бы, ну чистые и чистые, что тут такого? При чем тут аутоиммунные заболевания? Оказывается, связь самая прямая.
Гигиеническая гипотеза
Этот переход стал возможен благодаря появлению антибиотиков и других высокоэффективных противопаразитических лекарств. В развитых странах он завершился к концу 20-го века. Если в середине века в Европе каждый третий житель был поражен гельминтами [1], то в настоящий момент обнаружение носителя этих паразитов скорее редкость. Россия в этом отношении практически не отстает от развитого мира благодаря нашим сильным гигиеническим традициям. Дополнительный вклад вносит городской образ жизни, централизованное снабжение очищенной водой, контроль качества пищи и так далее.

Рисунок 3. Обратное отношение между частотой инфекционных заболеваний и частотой иммунных расстройств с 1950 по 2000 годы. а — Изменение относительного количества заболевших различными инфекционными заболеваниями. б — Относительный рост заболеваемости аутоиммунными заболеваниями за тот же период.
Впоследствии многие исследователи показали то же самое на примере других аллергий и аутоиммунных реакций. К примеру, если детям из неблагополучных по гигиене регионов вроде Чили или Тайланда провести европейскую программу дегельминтизации, у них букетом высыпают аллергии [4].
Наверное, самым интересным примером тут является история с рассеянным склерозом [5–8]. Ученые решили посмотреть, что происходит, когда больной этим страшным заболеванием заражается гельминтами, и начали искать инфицированных червями пациентов с РС. Результаты были ошеломляющи. У пациентов, которые заражались определенными гельминтами (например, власоглавом Trichuris trichiura) течение заболевания практически останавливалось [6]. Во время инфекции у них на 95% снижалось количество новых бляшек в мозге (рис. 4). Результат, недостижимый ни одним современным методом терапии! Если же по каким-то причинам гельминтов требовалось удалить (например, развивалось острое воспалительное поражение кишечника), болезнь возобновлялась с той стадии, на которой остановилась при инфекции.

Рисунок 4. График появления новых бляшек в мозге (когортное исследование 2011 года). Круги — неинфицированные гельминтами пациенты, квадраты — инфицированные, треугольники — инфицированные, но вылеченные от гельминта (момент излечения показан черной стрелкой).
Иммунный ответ
Иммунная система призвана защищать организм от внутренних и внешних врагов. Внешними врагами являются вирусы, бактерии, простейшие и черви, которые постоянно попадают в наш организм и уничтожаются на дальних рубежах. Внутренними врагами являются раковые клетки, а также клетки, зараженные вирусами или внутриклеточными бактериями.
Когда паразит попадает в организм, первым делом его встречает врожденный иммунитет, клетки которого (макрофаги) есть во всех тканях. Антигеном в данном случае служат нехарактерные для нашего организма молекулы — клеточная стенка бактерий, двухцепочечная РНК некоторых вирусов, свободно плавающая в межклеточном пространстве наша ДНК и так далее. При обнаружении пришельцев, клетки врожденного иммунитета пытаются их уничтожить, параллельно выделяя провоспалительные молекулы (рис. 5). Воспаленная ткань блокирует выход паразита из места проникновения в остальной организм и привлекает новые клетки иммунитета к месту повреждения.

Рисунок 5. Фагоцит пожирает бактерии.
Если врожденному иммунитету не удается уничтожить захватчиков, в дело вступает адаптивный иммунитет. Происходит это отнюдь не сразу: активации адаптивного ответа предшествуют 3–4 дня подготовки в лимфоузлах (при этом лимфоузлы увеличиваются в размерах, что является признаком инфекционного заболевания). Начинается все с того, что некоторые из клеток врожденного иммунитета прибывают в лимфоузел, неся на себе антигены из места поражения. Антигенами в данном случае выступают короткие (от 8 до 20 аминокислот) пептиды из белков инфекционного агента и окружающих тканей. По сути, макрофаг (или специализированный активатор адаптивного иммунитета — дендритная клетка) просто захватывает из места воспаления образцы растворенных белков, ошмётков паразита и погибших клеток и приносит в лимфоузел.
В лимфоузле его встречают наивные (неактивированные) клетки адаптивного иммунитета — Т-лимфоциты. Каждый лимфоцит, выйдя из места своего формирования, несет на себе уникальный рецептор, который формируется путем направленного внесения мутаций в геном. Заранее неизвестно, может ли этот рецептор распознать какой-либо антиген, но его вариантов так много (по некоторым оценкам, у нас может быть до 10 48 разных типов этого рецептора, но большая часть их будет нефункциональна), что в течение нескольких часов в лимфоузле обнаруживается как минимум несколько клеток, способных распознать антигены паразита. Затем эти клетки делятся, активируются и отправляются в поврежденную ткань, где отыскивают свои антигены и уничтожают как самих захватчиков, так и зараженные клетки, если мы говорим о вирусе или внутриклеточной бактерии (рис. 6).

Рисунок 6. Т-лимфоциты (красные) убивают раковую клетку (синяя) своего же организма. После получения сигнала раковая клетка начинает распадаться на небольшие пузырьки, которые затем съедят клетки врожденного иммунитета.
Иммунологическая толерантность
Иммунная система — единственная из систем организма, в чью задачу входит уничтожение других живых существ — отдельных клеток или многоклеточных организмов. Причем наши собственные клетки тоже часто должны уничтожаться, если они заражены вирусом, бактерией или превратились в раковые. При этом необходимо избегать иммунного ответа на нормальные клетки. Если такой ответ развивается — возникает аутоиммунное заболевание.
Периферическая толерантность возникает, когда Т-лимфоцит распознает антиген в лимфоузлах, но никакого воспаления в месте, откуда этот антиген попал в лимфоузел, нет. Напротив, высока концентрация противовоспалительных молекул. Такой лимфоцит опять-таки или уничтожается, или превращается в регуляторный.
Паразиты и симбионты
Миллиарды лет эволюции крупные многоклеточные организмы были домом и едой для более мелких одноклеточных и многоклеточных. Человек тут не исключение — ведь мы являемся как хорошим источником пищи, так и отличным защитником для всего, что сумеет поселиться внутри нас или на нас.
Эволюция поделила этих сожителей на 2 большие группы — паразиты и симбионты. Паразиты делают ставку на быстрое размножение. У них есть возможность подавления врожденного иммунитета, а пока адаптивный активируется, они уже успевают размножиться за счет наших ресурсов и передать инфекцию дальше. Так действует, например, вирус гриппа или бактериальная пневмония.
Симбионты же научились подавлять как врожденный, так и адаптивный иммунитеты. Для этого им пришлось умерить свои аппетиты — если клетки организма постоянно повреждаются, то никакие уловки не смогут предотвратить активацию иммунитета. Потому они поселились на поверхностях нашего тела, прежде всего на поверхности ЖКТ, где они получают лишь часть нашей пищи, но не покушаются на сам организм.
Помимо этого, они научились подавлять воспаление, выделяя вещества, которые похожи на наши противовоспалительные молекулы. Макрофаги врожденного иммунитета, столкнувшись с такими бактериями, могут почувствовать антигены клеточной стенки, но не активируются, так как подавлены противовоспалительным фоном вокруг.
Третьим механизмом защиты стала антигенная мимикрия. Для адаптивного иммунитета основным антигеном являются пептиды из белков. И многие наши симбионты в ходе эволюции поменяли свой белковый состав так, чтобы в нем был максимум пептидов, похожих на наши. Таким образом они встают под защиту регуляторных лимфоцитов. Этот механизм характерен для всех видов наших сожителей — бактерий, червей (рис. 7), вирусов и так далее.

Рисунок 7. Власоглав — один из гельминтов, активно изучаемых в рамках гигиенической гипотезы.
В течение миллионов лет каждая особь нашего вида, рождаясь, сразу же вступала в контакт с симбионтами, населявшими кожу, слизистые и кишечники своих собратьев. Со временем организм научился извлекать выгоду из такого постоянного неустранимого сосуществования. В частности, способность бактерий и червей создавать сильный противовоспалительный фон в месте своего обитания стала за это время ключевым фактором создания периферической толерантности. Она распространилась как на антигены самих сожителей, так и на сопутствующие им — антигены пищи (в кишечнике), пыли и пыльцы (в легких) и собственного организма (те самые антигены, которые сожители развили в ходе антигенной мимикрии).
И снова гигиеническая гипотеза
Особенно сильно на риск развития таких заболеваний влияет первый год жизни. Если в этот период ребенок оказывается в деревне, проводит некоторое время в больших группах сверстников (в больнице или в детском саду) и вообще чаще встречается с инфекциями — риск развития аутоиммунных заболеваний серьезно снижается [11], [12].
Разумеется, не только микробиом (совокупность всех симбиотических микроорганизмов конкретного человека) [13] и гельминты влияют на риск развития аутоиммунных и аллергических реакций. Есть и генетическая предрасположенность, и условия, в которых человек впервые встречается с тем или иным внешним антигеном. Есть некоторые микроорганизмы, которые не защищают, а, напротив, провоцируют аутоиммунные заболевания. Например, стрептококк способен вызывать ревматизм, а некоторые стафилококки производят суперантиген, который неспецифически запускает все клоны Т-лимфоцитов с любым рецептором — это тоже может привести к аутоиммунным заболеваниям.
| Заболевание | Количество исследований | Общее количество пациентов | Результаты |
|---|---|---|---|
| Болезнь Крона | 6 | 543 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Неспецифический язвенный колит | 3 | 192 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Рассеянный склероз | 6 | 156 | Показана безопасность, статистически значимые улучшения у части пациентов. |
| Непереносимость глютена (целиакия) | 2 | 35 | Исследования только начались |
| Расстройства аутического спектра | 3 | 90 | Пилотное исследование показало эффективность, подтверждающие только начаты |
| Псориаз | 3 | 55 | Исследования только начались |
| Аллергия на арахис | 1 | 18 | Исследования только начались |
| Бронхиальная астма | 1 | 32 | Зафиксированы статистически недостоверные улучшения |
| Аллергический риноконъюнктивит | 2 | 130 | Эффективность не показана |
| Ревматоидный артрит | 1 | 50 | Исследование только началось |
Что же делать нам, простым смертным, пока ученые по кусочкам разбирают эту тайну и ищут решение? Начать стóит со снижения маниакального стремления к чистоте во всем. Я не предлагаю не мыть руки перед едой. Но довольно часто в последнее время мы перегибаем палку. Антибиотики при каждом чихе, асептические спиртосодержащие гели каждые 10 минут, антибактериальное мыло вместо обычного в ванной. Все эти меры способны спасти вас от эпидемии. Но каждодневное их применение, особенно детьми, способно нанести куда больший урон, чем грипп или пищевое отравление.

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
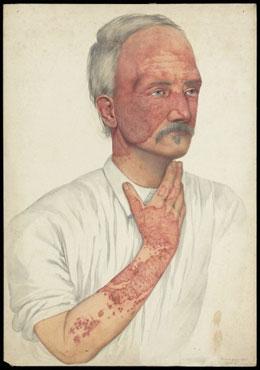
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди
Читайте также:

