Что делать при отравлении висмутом
Обновлено: 18.04.2024
Соединения висмута нашли широкое применение в современной гастроэнтерологии, а наиболее часто используемым препаратом среди них является висмута трикалия дицитрат. Он обеспечивает защиту слизистой от воздействия различных повреждающих факторов и позволяет
Bismuth-based drugs are widely used in modern gastroenterology. Among them the most commonly used is bismuth subcitrate potassium. It protects the mucosa from the effects of various damaging factors, and anti-Helicobacter activity allows to overcome resistance of H. pylori to antibiotics, increasing the efficiency of pharmacotherapy.
Висмут (Bi) — относительно редкий элемент, обладающий не только металлическими свойствами, но и характеристиками, близкими к полупроводникам и изоляторам, поэтому иногда классифицируется как полуметалл или металлоид.
Bi (III) легко гидролизуется в водных растворах и имеет высокое сродство к кислороду, азоту и серосодержащими лигандам, Bi (V) является мощным окислителем в водном растворе и неустойчив в биологических системах [1].
Препараты висмута
Соединения висмута вошли в медицинскую практику со времен средневековья, а первый научный доклад о содержащем висмут препарате для лечения диспепсии был сделан в 1786 г. [1]. На сегодняшний день самое широкое применение соединения висмута нашли в гастроэнтерологии, а наиболее часто используемыми среди них являются висмута субсалицилат и коллоидный субцитрат (висмута трикалия дицитрат, ВТД) [2, 3] (табл. 1).
Висмута субсалицилат во многих странах используется в качестве безрецептурного препарата для быстрого купирования изжоги, тошноты и диареи.
Коллоидный висмута субцитрат нашел применение в первую очередь для лечения заболеваний, ассоциированных с хеликобактерной инфекцией, а также как пленкообразующий гастропротектор. Именно этот препарат представляет наибольший интерес с точки зрения фармакологических свойств и клинического применения.
Перспективным представляется применение радионуклидов висмута (например, 213 Bi) для диагностики и лечения различных опухолей — лимфом, лейкемии [4, 5].
Висмута трикалия дицитрат
Взаимодействие со слизистой
На поверхности слизистой ВТД образует гликопротеин-висмутовые комплексы, по сути представляющие собой диффузионный барьер для HCl, который усиливается за счет дополнительного повышения вязкости пристеночной слизи [6, 7]. Этот процесс является рН-зависимым и ослабевает по мере повышения рН [8]. Если при нейтральном рН ВТД преимущественно находится в коллоидном состоянии, формируя структуры [Bi6O4(cit)4] 6- и [Bi12O8(cit)8] 12- , то при рН < 5 он быстро образует трехмерные полимерные преципитаты оксихлорида и цитрата висмута, оптимум образования которых наблюдается при рН ≈ 3,5 [6, 9].
Одновременно под влиянием ВТД происходит перераспределение продукции муцинов — уровень кислых муцинов, повышенный в пораженном эпителии, снижается при одновременном возрастании количества нейтральных муцинов [12].
Влияние на активность пепсина
Исследования in vitro показали, что ВТД присуща антипепсиновая активность. В концентрации 25 и 50 г/л препарат (после преинкубации с желудочным соком при рН = 4) ингибировал протеолитическую активность пепсина (при рН = 2) соответственно на 29% и 39% [13]. У пациентов с язвой двенадцатиперстной кишки ВТД (120 мг 4 раза/день) уменьшал как базальную, так и стимулированную продукцию пепсина более чем на 30% [14].
Предполагается, что эти эффекты опосредованы как непосредственной инактивацией пепсина вследствие образования комплексов с висмутом, так и снижением активности главных клеток [15].
Связывание желчных кислот
Феномен связывания желчных кислот ВТД был описан после исследований in vitro, и до настоящего времени его клиническая значимость до конца не определена. Тем не менее, при рН = 2 ВТД связывает различные желчные кислоты, особенно гликохенодеоксихолевую (до 50%), резко теряя эту активность при рН = 4 [16].
Влияние на продукцию простагландинов и бикарбоната
Этот компонент механизма действия рассматривается как важный в реализации гастропротекторного действия ВТД и ускорении заживления язвенного дефекта. Дозозависимое увеличение продукции простагландина Е2 было показано в экспериментальных и клинических исследованиях [17, 18]. Так, у больных с язвенным поражением слизистой желудка после трех недель терапии ВТД концентрация простагландина Е2 в слизистой антрального отдела желудка увеличивалась на 54%, а в слизистой двенадцатиперстной кишки на 47% [18].
Одновременно с секрецией простагландинов возрастает и простагландинзависимая продукция бикарбоната, что увеличивает буферную емкость слизи [19, 20]. Этот эффект значительно снижается под влиянием нестероидных противовоспалительных средств.
Влияние на ультраструктуру слизистой
В исследовании M. G. Moshal и соавт. (1979) у больных с язвой двенадцатиперстной кишки применение ВТД в течение шести недель приводило к эпителизации дефекта с формированием нормального эпителия без изменения структуры микроворсинок (в отличие от циметидина) [21]. Предполагается, что наряду с действием классически описываемых фармакологических эффектов висмута, обеспечивающих защиту и восстановление слизистой, ускорению репарации эпителия в зоне язвенного дефекта способствует предохранение висмутом эпидермального фактора роста от гидролитического разрушения [17].
Наряду с этим обсуждается способность ВТД стимулировать мембранный Са 2+ -чувствительный рецептор (CaSR), активируемый в норме внеклеточным Са 2+ и обеспечивающий повышение внутриклеточного Са 2+ , MAP-киназной активности и, в итоге, пролиферацию эпителиальных клеток слизистой желудка [22].
В экспериментальных исследованиях на слизистой толстой кишки мышей показана способность ионов Bi (III) за счет антагонизма с ионами Fe (III) подавлять активность неамидированного гастрина и, таким образом, возможность снижения избыточной гастрин-обусловленной пролиферации клеток [23].
Антихеликобактерная активность
Бактерицидное действие ВТД имеет очень важное значение. Под действием ионов висмута H. pylori теряет способность к адгезии, снижается подвижность микроорганизма, происходит вакуолизация и фрагментация клеточной стенки, подавление ферментных системы бактерий, т. е. достигается бактерицидный эффект (в отношении как вегетативных, так и кокковых форм H. pylori) [24–26]. Этот эффект при монотерапии ВТД хотя и незначителен (находится в пределах 14–40%), но не подвержен развитию резистентности и резко потенцируется при одновременном назначении с антибиотиками.
Висмут проникает в H. pylori, преимущественно локализуясь в области клеточной стенки микроорганизма. Он активно взаимодействует с нуклеотидами и аминокислотами, пептидами и белками H. pylori. Хотя молекулярные механизмы антихеликобактерного действия соединений висмута изучены не полностью, ясно, что основными мишенями в микроорганизме все же являются белковые молекулы (в том числе ферменты). Экспрессия примерно восьми белков подвергается up- или down-регуляции при действии ионов висмута [27, 28].
J. R. Lambert и Р. Midolo сформулировали основные молекулярные механизмы антихеликобактерного действия препаратов висмута [29], впоследствии дополненные другими исследователями [27]:
1) блокада адгезии H. pylori к поверхности эпителиальных клеток;
2) подавление различных ферментов, продуцируемых H. pylori (уреаза, каталаза, липаза/фосфолипаза, алкилгидропероксидредуктаза и др.), и трансляционного фактора (Ef-Tu);
3) прямое взаимодействие с белками теплового шока (HspA, HspB), нейтрофил-активирующим белком (NapA), нарушение структуры и функции других белков;
4) нарушение синтеза АТФ и других макроэргов;
5) нарушение синтеза, структуры и функции клеточной стенки и функции мембраны;
6) индукция свободнорадикальных процессов.
H. pylori характеризуется необычной версией шаперонина GroES (т. е. HpGroES), который обладает уникальным C-концом, богатым гистидином, цистеином и имеющим три металл-связывающих остатка (с Zn (II)), что обеспечивает сворачивание полипептидных цепей с формированием четвертичной структуры белка. Висмут-содержащие препараты прочно прикрепляются на этом сайте, вытесняя связанный цинк и, следовательно, вызывая резкое нарушение функции шаперонина HpGroES [34].
Препараты висмута, проникая в H. pylori, способны индуцировать мощный окислительный стресс в микроорганизме, что приводит к торможению деятельности многих ферментов в целом. Потенцируется прооксидантное действие подавлением активности тиоредоксина и алкилгидропероксидредуктазы (TsaA) микроорганизма [27, 28].
Ингибирование таких важных для микроорганизма ферментов, как протеаза и уреаза, является доказанным фактом в развитии антихеликобактерного эффекта ВТД [4]. В минимальной ингибирующей концентрации ВТД подавляет общую протеазную активность микроорганизма примерно на 87% [28].
Большое внимание привлекает взаимодействие висмута с ферментами цикла трикарбоновых кислот микроорганизма (фумаратредуктазы, фумаразы), обеспечивающего образование ряда биохимических прекурсоров (α-кетоглутарат, сукцинил-КоА, оксалоацетат) и работающего как источник образования АТФ. В результате уменьшается продукция макроэргов и подавляются многие энергозависимые процессы (в том числе репаративные, двигательные), что отражается, например, на скорости колонизации микроорганизмом различных отделов желудка [35, 36]. Потенцируется этот эффект блокадой локализованного в микробной стенке/мембране дитиольного фермента Na + /K + -АТФазы, с которым ионы Bi образуют стабильный комплекс [24].
В качестве еще одной ферментной мишени препаратов висмута рассматривается алкогольдегидрогеназа, участвующая в продукции ацетальдегида, который, секретируясь микроорганизмом, оказывает подавляющее действие на локальные защитные факторы слизистой, ингибируя секрецию белка и нарушая связывание пиридоксальфосфата с зависимыми ферментами [37].
Важное значение имеет также подавление висмутом активности фосфолипаз С и А2 H. pylori [38, 39]. В качестве новых мишеней для антихеликобактерного действия ВТД обсуждаются S-аденозилметионинсинтаза, альдолаза, фруктозобисфосфат и протеин S6 30S-субъединицы рибосомы [39].
Фармакокинетика ВТД
После перорального приема ВТД концентрация висмута в слизи желудка и слизистой сохраняется в пределах трех часов, после чего резко падает вследствие нормального обновления слизи [40]. Несмотря на то, что небольшая часть микропреципитатов ВТД может проникать в микроворсинки и путем эндоцитоза попадать в клетки эпителия, точные механизмы транспорта висмута в системный кровоток до настоящего времени неизвестны. Однако очевидно, что этот процесс происходит преимущественно в верхнем отделе тонкой кишки [41].
Биодоступность препаратов висмута низкая и у ВТД составляет 0,2–0,5% от введенной дозы [42, 43]. Н2-гистаминоблокаторы и ингибиторы протонной помпы могут увеличивать этот показатель [44]. После попадания в кровь препарат больше чем на 90% связывается с белками плазмы.
Измерение концентрации висмута в крови и моче после курсового применения ВТД в дозе 360 мг/сут в течение 4–6 недель показало большую вариабельность этого показателя. Так, концентрация висмута в крови варьировала от 9,3 до 17,7 мкг/л и выходила на плато примерно к 4-й неделе применения препарата [45]. В отдельных исследованиях были зафиксированы более высокие уровни препарата в крови (33–51 мкг/л), однако это не сопровождалось развитием побочных эффектов [46, 47]. Концентрация висмута в крови, как и площадь под фармакокинетической кривой, выше в том случае, если препарат принимается утром, по сравнению с ранним вечерним приемом [48].
В исследованиях на животных показано, что преимущественное накопление препарата происходит в почках и в значительно меньшей концентрации он обнаруживается в легких, печени, мозге, сердце и скелетной мускулатуре [49].
Особенности метаболизма и элиминации висмута изучены недостаточно. Период полувыведения висмута из крови и мочи у пациентов с интоксикацией составляет соответственно 5,2 и 4,5 дня [50]. У здоровых добровольцев и пациентов с гастритом клиренс составляет примерно 22–102 мл/мин (медиана 55 мл/мин) и Т1/2 около 5 дней (Т1/2 β до 21 дня), что свидетельствует о тканевом депонировании препарата и его медленной мобилизации оттуда [51]. На выведение препарата оказывает влияние функция почек, и при ее ухудшении почечный клиренс препарата может снижаться. Некоторые фармакокинетические показатели ВТД приведены в табл. 2.
Клиническая эффективность ВТД
ВТД является важным компонентом клинических схем антихеликобактерной терапии либо в составе традиционной квадротерапии, либо в качестве дополнительного компонента тройной терапии первой линии, что дает прирост эффективности эрадикации на 15–20% [52, 53, 54]. В первую очередь, это обусловлено способностью ВТД преодолевать резистентность H. pylori к антибиотикам (особенно к кларитромицину), а не собственной бактерицидной активностью препарата висмута [55–57]. Интерес представляет также включение ВТД в схемы последовательной антихеликобактерной терапии [58].
Безопасность ВТД
Несмотря на статус тяжелого металла, висмут и его соединения считаются нетоксичными, в отличие от расположенных рядом в периодической таблице мышьяка, сурьмы, свинца и олова. Нетоксичность соединений висмута объясняется преимущественно за счет их нерастворимости в нейтральных водных растворах и биологических жидкостях и крайне низкой биодоступностью. Большинство соединений висмута являются даже менее токсичными, чем хлорид натрия [59].
A. C. Ford и соавт. в рамках метаанализа, проведенного по публикациям баз MEDLINE и EMBASE, включающего 35 рандомизированных контролируемых исследований и 4763 пациента, пришли к выводу, что терапия язвенной болезни желудка с использованием препаратов висмута безопасна и хорошо переносится. Наиболее часто встречающимся побочным эффектом является потемнение стула за счет образования сульфида висмута [60].
Заключение
Уникальность ВТД состоит в том, что он сочетает в себе свойства гастропротекторного и антибактериального препарата. Его многокомпонентный механизм действия обеспечивает защиту слизистой от воздействия различных повреждающих факторов, а антихеликобактерная активность позволяет преодолевать устойчивость H. pylori к антибиотикам, повышая эффективность фармакотерапии. В общем виде совокупность отдельных компонентов механизма действия препарата представлена на рис.
Новые направления создания препаратов висмута для лечения гастроэнтерологических заболеваний включают разработку висмут-содержащих наноструктур (bismuth-containing nanoparticles, Bi NPs). Так, созданный препарат нанотрубок висмута субкарбоната обладает мощным действием в отношении H. pylori (50% ингибирование в концентрации 10 мкг/мл) [62], а Bi NPs потенциально активен против грамотрицательных микроорганизмов, включая P. aeruginosa [63].
Наночастицы висмута в МИК 0,5 ммоль/л способны полностью подавлять формирование биопленки S. mutans, что сравнимо с эффектом применения хлоргексидина [64]. В работе тех же авторов водный коллоид наночастиц Bi2O3 со средним размером 77 нм эффективно угнетал рост и образование биопленок C. albicans, не проявляя цитотоксичности [65]. Делаются попытки синтеза висмут-фторхинолоновых комплексов, активных в отношении фторхинолон-резистентых штаммов микроорганизмов [66].
Исчерпывающие сведения по современным направлениям медицинской химии соединений висмута можно найти в обзоре J. A. Salvador и соавт. [67].
Литература
С. В. Оковитый 1 , доктор медицинских наук, профессор
Д. Ю. Ивкин, кандидат биологических наук
Отравление мышьяком и его побочные эффекты
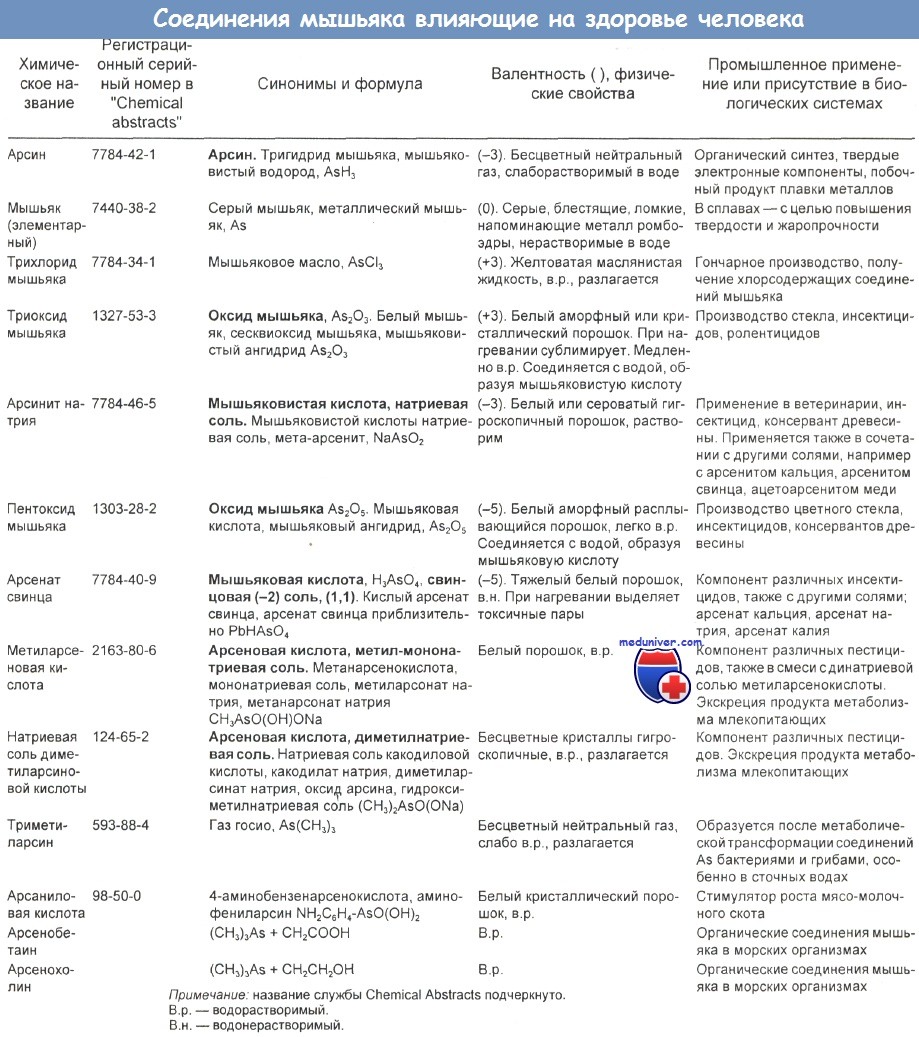
Данные о неорганических и органических соединениях мышьяка представлены в таблице ниже.
Эпидемиологические исследования по изучению роли мышьяка, содержащегося в питьевой воде, позволяют сделать вывод, что мышьяк может вызывать рак кожи, печени, легких, почек и мочевого пузыря. В таблице ниже представлена оценка риска смерти от рака после экспозиции к мышьяку в сопоставлении с экспозицией к содержащемуся в окружающей среде табачному дыму и радоновым излучениям внутри помещений. Клинические признаки острых и хронических отравлений мышьяком в обобщенном виде представлены в отдельной таблице.
а) Токсичная доза мышьяка. Пятивалентный мышьяк As5+ (арсенат, или органическая форма) менее токсичен, чем трехвалентная форма As3+ (арсенит, или неорганическая форма), что обусловлено более низкой растворимостью первого. В целом нерастворимые соли мышьяка (триоксид мышьяка, арсенат свинца) и органические алканарсенаты обладают значительно более слабыми токсическими свойствами, чем растворимые неорганические соединения мышьяка (арсенит натрия, мышьяковая и мышьяковистая кислоты). Наиболее токсичная форма — арсин (AsH3). Существует широкий диапазон токсичности в зависимости от конкретного соединения и формы.
Концентрации менее 1 мг/кг могут обусловить серьезные заболевания у детей; 2 мг/кг могут вызвать смерть. Летальный диапазон — от 120 до 200 мг, хотя у взрослых отмечается выживаемость и при более высоких дозах. Проглатывание 9— 14 мг триоксида мышьяка 16-месячным ребенком вызвало тяжелые признаки отравления, потребовавшие хелатирующей терапии.
Как показали наблюдения Kingstrom и соавт., однократное проглатывание низкой дозы (менее 5 мл) пятивалентного арсената (менее 3 %) — содержащего арсенат натрия средства против муравьев — незначительно токсично, что можно лечить в домашних условиях. Необходимость хелатообразования после экспозиции к пятивалентным соединениям мышьяка должна быть подтверждена дополнительными исследованиями.
Даже в случаях обычной экспозиции (по данным подробного анамнеза) у пациентов, подвергшихся экспозиции к арсенату натрия, содержащемуся в средстве против муравьев, отмечается значительное повышение концентраций мышьяка в 24-часовых пробах мочи (диапазон — от 3500 до 5300 мкг/л, в норме
Газ арсин, который может вытечь из цилиндров и полупроводников на производстве, представляет собой бесцветный, нераздражающий газ, который обладает слабыми обонятельно-предупредительными свойствами, и может выделяться из соединений мышьяка при добавлении кислоты. ВПП-СВВК — 0,05 млн-1. Мгновенная смерть наступает при 150 млн-1. Смерть с обширным гемолизом наступает через 30 мин после экспозиции к 25—50 млн-1 и менее чем через 30 мин после экспозиции к 100 млн-1.
Полупериод существования неорганического мышьяка в крови составляет примерно 2 ч; период полувыведения метилированных метаболитов варьирует от 5 до 20 ч.
- Всасывание. Пятивалентный мышьяк хорошо всасывается в кишечнике, но трехвалентная форма более липидорастворима. Токсичность обусловлена арсенитной формой (As3+), особенно при чрескожной абсорбции. Вдыхание обусловливает хронические симптомы, особенно для газа арсина, вызывающего появление тяжелых симптомов при вдыхании. Соединения мышьяка хорошо всасываются парентерально в течение 24 ч.
- Распределение. Мышьяк первоначально локализуется в крови, связываясь с глобулином. В течение 24 ч происходит перераспределение мышьяка в печень, легкие, стенки кишечника и селезенку, где мышьяк связывается с сульфгидрильными группами тканевых белков. Лишь небольшое количество мышьяка проникает через гематоэнцефалический барьер. Мышьяк замещает фосфор в костях, где он может оставаться годами.
На протяжении 30 ч после проглатывания мышьяк откладывается в волосах. Концентрации мышьяка в срезах волос могут служить показателем времени экспозиции, определяемого по длине от точки роста. Волосы человека, умершего через 6—8 ч после проглатывания сверхвысокой дозы, обычно не содержат мышьяк.
б) Источники органических соединений мышьяка. Два наиболее распространенных органических нетоксичных соединения мышьяка, обнаруживаемых в пище, регулярно потребляемой людьми, — это арсенобетаин и арсенохолин. Значительные концентрации органической кислоты обнаруживают в моллюсках, треске и пикше. После проглатывания арсенобетаин и арсенохолин быстро выводятся в мочу и полностью выводятся в течение 1—2 дней. Остаточные токсичные метаболиты не выявляются. Период полувыведения органического мышьяка составляет от 4 до 6 ч.
- Желудочно-кишечный тракт. Расширение висцеральных сосудов вызывает образование субмукозных везикул. Их разрыв приводит к выделению испражнений в виде рисового отвара и к кровотечению. Впоследствии может развиться энтеропатия с потерей белка.
Несмотря на применение интенсивного лечения при мышьяковой интоксикации и быстрое снижение концентраций мышьяка в крови и моче, неврологические нарушения могут сохраняться. По-видимому, распространение мышьяка в нервных тканях происходит быстро и может оказаться необратимым даже при хелатиро-вании.
- Мышцы. Сообщалось о случаях, когда после сильной передозировки мышьяка острый некроз скелетных мышц приводил к смерти.
- Воздействие на метаболизм и функцию печени. Отмечались отрицательный азотный баланс, жировая дегенерация печени, центральный некроз и цирроз, антагонизм тироидного гормона.
- Дериваты кожи. Наблюдаются алопеция (на поздней стадии), ломкость ногтей, линии Миса (горизонтальные белые линии, которые появляются после экспозиции вследствие роста ногтевого ложа в направлении кнаружи).
в) Беременность и отравление мышьяком. Неорганический мышьяк проникает через плаценту. 22-летняя женщина на 20-й неделе беременности проглотила 340 мг арсената мышьяка. Первоначальная концентрация мышьяка в моче через 24 ч составляла 3030 мкг/л. Был введен димеркапрол. Тоны сердца плода были нормальные. Через 36 нед родился здоровый ребенок. При рождении концентрации мышьяка в суточной порции мочи составляли
В другом случае, когда мать проглотила мышьяк на 30-й неделе беременности, младенец умер вскоре после рождения. Димеркапрол, по-видимому, является средством выбора. D-пеницилламин обладает тератогенными свойствами.

г) Клиника отравления мышьяком:
- Острая экспозиция к газу арсину. В классических случаях клинические проявления мышьякового отравления наступают после латентного периода — до 24 ч, после чего начинаются боли в животе, гемолиз и почечная недостаточность. При чрезмерно сильной экспозиции внезапная смерть может наступить в отсутствие отека легких и гемолиза.
- Болезнь черных ног. Болезнь черных ног — это редкое заболевание периферических артерий, наблюдаемое в эндемическом регионе хронического отравления мышьяком — на Юго-Западном побережье Тайваня. Гуминовая кислота, содержащаяся в колодезной воде, возможно, является главной причиной этой болезни. В развитии болезни, по-видимому, играют роль активация тромбоцитов и гиперкоагуляция.
- Арсенат свинца. Проглатывание арсената свинца может вызвать тошноту, рвоту и боли в брюшной полости. Рвотные массы напоминают молоко из-за образования хлорида свинца. Во рту появляется металлический вкус. Могут отмечаться диарея или запор. Испражнения бывают черного цвета, что обусловлено присутствием сульфида свинца. Могут наблюдаться парестезия и мышечная слабость. В тяжелых случаях происходит острый гемолитический кризис, наблюдаются олигурия и шок. Если пациент выживает, у него развивается синдром хронического свинцового отравления. Курс лечения включает лаваж желудка с последующей хелатирующей терапией с применением как димеркапрола, так и кальций-ЭДТА.

д) Лабораторные данные при отравлении мышьяком:
- Аналитические методы. Современным стандартом является анализ мышьяка методом атомно-абсорбционной спектроскопии, который позволяет измерить общую концентрацию мышьяка, но не проводить разграничение между пятивалентными, трехвалентными или органическими формами мышьяка.
- Уровни в крови. Короткий период полувыведения мышьяка из крови означает, что уровни мышьяка в крови менее пригодны для оценки степени отравления, чем концентрации в моче, если только анализ не проводится в день экспозиции. Концентрации мышьяка в сыворотке (крови) определяются только в первые 2—4 ч после проглатывания, после чего мышьяк в любой из форм трудно обнаружить в крови или сыворотке.
- Уровни в моче. Неорганические As+3 и As+5. As+3 более токсичен, чем As+5. As+3 и As+5 обнаруживаются в организме вскоре после проглатывания. Более чем через 24 ч после проглатывания преобладающими метаболитами являются монометилмышьяк и диметилмышь-як. Повышенные концентрации As+3 и As+5 выявляются в моче примерно через 10 ч и снова становятся нормальными через 20 ч. Концентрации монометилмышьяка и диметилмышьяка достигают максимума через 40—60 ч и возвращаются к исходному уровню через 6—20 дней после проглатывания. Полупериод существования неорганического мышьяка в крови составляет 2 ч, а полупериод существования в крови метилированных метаболитов от 5 до 20 ч. Концентрации мышьяка в сыворотке (или в крови) определяются только в первые 2—4 ч после проглатывания.
Органический As. Период полувыведения арсенобетаина и арсенохолина составляет примерно 4 ч, а через 1—2 дня они полностью выводятся.
В моче: в отсутствие экспозиции — менее 25 мкг в сутки. Токсичные концентрации — от 50 до 50 000 мкг в сутки.
После потребления морских продуктов — от 50 до 2000 мкг в сутки.
- Уровни в волосах. Анализ мышьяка, содержащегося в волосах, является недостаточно надежным методом установления хронической интоксикации. Этот метод не позволяет провести разграничение между мышьяком, откладывающимся из внешней среды, и мышьяком, обнаруживаемым в стержне волоса.
- Ногти. Содержание мышьяка в ногтях может служить показателем степени экспозиции рабочего к мышьяку, содержащемуся в воздухе.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Отравление висмутом и его лечение
Во Франции нейротоксичность была обусловлена применением субстрата, содержащего висмут. Все пациенты выздоровели в период через 2—12 нед после прекращения приема висмута. Висмут стали отпускать строго по рецепту, были введены другие ограничения. В 1980 г. власти Австралии изъяли фармацевтические препараты, содержащие висмут. Канада запретила продажу всех перорально принимаемых солей, за исключением субгаллата, который отпускается только по рецепту врача. В Австралии, Канаде, Франции и Австрии применение препаратов на основе висмута сокращено в связи с выявленной нейротоксичностью.
В США субсалицилат висмута признан безопасным в дозах до 4,8 г в сутки, однако недостаточно данных, которые свидетельствовали бы о его эффективности в качестве противорвотного средства. В Великобритании применение препаратов на основе висмута ограничивается периодом 2—4 нед, а дозы не превышают 4 г в сутки.
а) Группы соединений висмута. Serfontein и Mekel разделили фармакологически активные соединения висмута на следующие 4 группы:
- Группа 1: простые неорганические соли и субсоли висмута, такие как субкарбонат, субнитрат висмута и т. д. Эти соединения нерастворимы в воде в отсутствие комплексообразующих веществ, для висмута характерна минимальная абсорбция, и он фактически нетоксичен.
- Группа 2: преимущественно липидорастворимые органические соединения и комплексы висмута, например субгаллат висмута. Они абсорбируются, что обусловливает высокие концентрации висмута в крови, которые прежде всего нейротоксичны, но, возможно, имеют также и гепатотоксическое действие.
- Группа 3: преимущественно водорастворимые органические соединения и комплексы висмута, которые достаточно устойчивы, чтобы быть абсорбированными, что ведет к накоплению в крови высоких концентраций висмута. Поражение почек — наиболее примечательная особенность синдрома токсичности, развивающегося у людей под воздействием этих соединений.
- Группа 4: водорастворимые органические комплексы висмута, которые разлагаются (подвергаются гидролизу) в желудочно-кишечном тракте до образования простых нерастворимых соединений висмута, например субхлорида и сульфида. Характерные особенности — минимальное всасывание и практически полное отсутствие токсичности. Типичный пример: бицитропептид.

б) Клиническая картина отравления висмутом. Симптомы системной интоксикации подобны таковым у свинца и ртути. Наблюдались усиленное слюноотделение, висмутовые линии (голубоватое окрашивание десен), выделение гноя и выпадение зубов. В редких случаях отмечаются перманентное окрашивание кожи и язвенный стоматит с колитом или без него. Восстановление висмутового субстрата до нитрата может повлечь за собой метгемоглобинемию. В дополнение к дегенерации печени и периферическому невриту наблюдались пониженная функция почек с тяжелым нефрозом и почечной недостаточностью. Описаны случаи миоклонической энцефалопатии.
- Кости. Висмутовую энцефалопатию может осложнить остеоартропатия. При накоплении в костях висмута в большом количесте могут развиться остеопороз и остеомаляция.
У 27-летнего мужчины, проглотившего 100 таблеток De-Nol (коллоидный висмут), развились анорексия, тошнота, рвота, недомогание, слабость в ногах, неясность зрения, жажда и пониженный диурез. Он сохранил ясность восприятия. Концентрация висмута в крови составляла 260 мкг/л. Функция почек и неврологические симптомы нормализовались через 5 сут. По данным клинических исследований с участием пациентов, страдающих от язвы, максимальная концентрация висмута в крови через 2—3 ч после введения достигала 100 мкг/л.
- Энцефалопатия. Несмотря на относительную безопасность перорально принимаемых препаратов висмута, сообщалось о случаях энцефалопатии (иногда с летальным исходом) после проглатывания больших доз или многократного приема его водо- или липидорастворимых солей. Энцефалопатия характеризуется изменением психического состояния, атаксией, миоклоническими судорогами и специфическими энцефалографическими аномалиями. Концентрации висмута в крови варьируют от 1500 до 2000 мкг/л (нормальная концентрация ниже 20 мкг/л). По клинической картине висмутовая энцефалопатия разделяется на 2 клинические стадии:
1. Продромальный период, продолжающийся от 1 нед до нескольких месяцев, во время которого преобладают когнитивные и аффективные расстройства. Больные астеничны, сонливы, депрессивны и беспокойны, иногда отмечаются зрительные галлюцинации и даже бред преследования (3 случая). На этой стадии наблюдаются судорожные подергивания различной степени тяжести (15 пациентов) и реже нарушаются речь и способность писать.
2. Вторая стадия энцефалопатии характеризуется быстрым началом и появляется внезапно в первые 24— 48 ч. Четыре симптома постоянны: спутанность сознания (прогрессирующая до комы или деменции), дизартрия, нарушение способности ходить и стоять, а также псевдотремор, сопровождающийся миоклоническими судорогами. Миоклонические судороги всегда присутствуют в этой фазе. Иногда они преобладают в верхних конечностях и являются дистальными; в других случаях они диффузны и распространяются на лицевые и аксиальные мышцы. Они усиливаются произвольными движениями и раздражителями (изменение положения, шум).
Эти явления обычно нормализуются через несколько дней или месяцев после прекращения приема препаратов висмута.
- Хроническая интоксикация висмутом. Систематический пероральный прием приводит к стоматиту, появлению черных пятен на слизистой оболочке и на деснах (висмутовые линии), саливации и патологическим переломам. У подопытных животных висмут вызывает изменение метаболизма некоторых тяжелых металлов (медь, цинк) и индуцирует образование металлотионоподобных белков низкой молекулярной массы. В опытах на мышах продемонстрировано благоприятное действие хелатирующего вещества D-пеницилламина.
Пероральный прием отпускаемой без рецепта смеси, содержащей субсалицилат висмута (например, Pepto-Bismol), может привести к появлению опасных симптомов (энцефалопатии). Хроническая интоксикация приводит к энцефалопатии и острой нефротоксичности вследствие приема солей висмута внутрь. При приеме терапевтических доз концентрации висмута в крови составляют 10—20 мкг/л, а концентрации в моче не превышают 5 мкг/л, т. е. не являются токсичными. Концентрацию 50 мкг/л предложено считать сигнальной, предупреждающей об опасности.
На самых ранних стадиях отравления благоприятное действие могут оказать хелатообразующие вещества (например, димеркаптопропансульфоновая кислота). Применять БАЛ не рекомендуется по причине его токсичности и необходимости внутримышечного введения.
- Pepto-Bismol. Дозы Pepto-Bismol от 5,2 до 9,4 г в сутки через 7 дней применения вызвали энцефалопатию. Уровни висмута в крови составляли 200 мкг/л (норма
в) Лабораторные данные отравления висмутом. Методом выбора для количественного определения уровней висмута в моче, крови или сыворотке является или электротермическая атомно-абсорбционная спектрофотометрия (порог обнаружения 1 мкг/л), или масс-спектрометрия с гидридным генератором. Разработан метод высокоэффективной жидкостной хроматографии (ВЭЖХ) с обращенной фазой, с дериватизацией на колонке.
- Уровни в крови. Необходимо подтверждение достоверности полученных данных. Уровни в крови не являются надежным показателем нейротоксичности. Не выявлено взаимосвязи между уровнями висмута в крови и моче или концентрацией висмута в спинномозговой жидкости.
- Рентгенография брюшной полости. У пациентов с висмутовой энцефалопатией рентгенография брюшной полости может выявить наличие рентгеноконтрастного вещества в толстой кишке.
- Электроэнцефалограмма. При уровне висмута в крови ниже 150 мкг/л ЭЭГ обнаруживала признаки эпилепсии. При висмутовой интоксикации для ЭЭГ характерны низкое напряжение и диффузные двусторонние бета-частоты, максимальные в лобной и центральной областях и усиливаемые гипервентиляцией.
- Компьютерное томографическое сканирование. На КТ-сканограммах может выявляться увеличение плотности в области коры головного мозга и в базальных ядрах. Эта повышенная плотность бывает обусловлена непосредственно присутствием висмута, который является рентгеноконтрастным веществом. В одной серии наблюдений чрезмерное повышение плотности в базальных ядрах, мозжечке и коре головного мозга было особенно выраженным, когда концентрации висмута в крови превышали 2000 мкг/л.
- Pepto-Bismol. Субсалицилат висмута (ВСС), активный ингредиент Pepto-Bismol, представляет собой отличающуюся нерастворимостью соль трехвалентного висмута и салициловой кислоты. Каждая молекула содержит 58 % висмута и 42 % салицилата по массе. ВСС почти полностью гидролизуется в желудке с образованием оксихлорида висмута и салициловой кислоты. Висмут прочно связывается с поверхностью слизистой оболочки желудка и, возможно, обусловливает цитозащитные свойства Pepto-Bismol.
Диссоциация ВСС осуществляется главным образом в желудке. Салицилат всасывается в тонкой кишке. Там же недиссоциированный ВСС реагирует с другими анионами (бикарбонатами и фосфатами), образуя нерастворимые субкарбонат и фосфат висмута. В ободочной кишке недиссоциированный ВСС и другие соли висмута реагируют с сероводородом, выделяемым анаэробными бактериями, при этом образуется сульфид висмута, нерастворимая соль черного цвета, обусловливающая потемнение стула. Неразжевываемые и нерастворимые таблетки Pepto-Bismol рентгеноконтрастны.
г) Лечение отравления висмутом. При передозировках лечение преимущественно симптоматическое и поддерживающее. На ранних этапах, т. е. до связывания висмута тканями, могут быть эффективны хелатообразующие средства. D-пеницилламин, по-видимому, не ускоряет выведение висмута. Димеркапрол (БАЛ) стимулировал клиренс у двух пациентов с миоклонической энцефалопатией, обусловленной интоксикацией солями висмута. Димеркапто-1-пропансульфоновая кислота (ДМПС) вызывала десятикратное усиление мочевого клиренса висмута, при этом отмечалось ослабление клинических симптомов энцефалопатии.
Роль гемодиализа не оценивалась. Даже после значительных передозировок прогноз благоприятный. Основная терапевтическая мера при висмутовой энцефалопатии — удаление висмута из организма пациента. При миоклонических припадках могут помочь бензодиазепины или другие противосудорожные средства, но проводилось мало исследований, которые могли бы подтвердить целесообразность их применения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Bисмута трикалия дицитрат может назначаться при лечении эрозивно-язвенных поражений желудка и двенадцатиперстной кишки, вызванных приемом нестероидных противовоспалительных препаратов, а также в схеме эрадикации Helicobacter pylori. В статье описываются р
Bismuth subcitrate may be prescribed as a drug for treatment of erosive and ulcerative lesions of stomach and duodenum caused by non-steroid anti-inflammatory drugs, and also in the scheme of Helicobacter pylori eradication. This article describes the divergent effects of bismuth drugs, studies and metaanalyses in which these effects have been proven.
Биологическая роль висмута изучена слабо, ученые предполагают, что этот элемент индуцирует синтез низкомолекулярных белков, принимает участие в процессах оссификации, образует внутриклеточные включения в эпителии почечных канальцев. Современный уровень знаний не позволяет определенно говорить о какой-либо физиологической роли висмута в организме человека. Его поступление в организм с водой или пищей незначительно, т. к. всасывание висмута, поступившего в желудочно-кишечный тракт, крайне мало и составляет около 5%. Суточное поступление висмута в организм с продуктами питания составляет 0,02 мг, а с воздухом — 0,00001 мг.
Примерно в это же время в Германии были разработаны препараты висмута, в качестве комплексообразователя в которых применялись белковые или пептидные гидролизаты и их фракции (German Pat. № 117 269, German Pat. № 101 683, German Pat. № 202 955). Но они обладали явными недостатками — это ненормируемое высвобождение ионов висмута, (обусловленное значениями рН желудка), адсорбировались в верхних отделах ЖКТ, образуя соединения, обусловливающие проникновение ионов висмута во внутренние среды организма. Эти недостатки способствовали поиску новых эффективных и безопасных производных висмута.
Соединения висмута обладают противоспирохетозным действием, и механизм их действия сводится к тому, что ионы висмута, проникая в спирохеты, связывают сульфгидрильные группы (SН) их ферментов, приводя к нарушению жизнедеятельности и гибели возбудителей сифилиса. Подобные препараты вводятся внутримышечно, так как при приеме внутрь висмутсодержащие соединения практически не всасываются из пищеварительного тракта. Однако при парентеральном поступлении висмута в организм существует опасность поражения тех органов, в которых накапливаются ионы висмута. Токсическая и летальная дозы восемьдесят третьего элемента для человека не определены. Опасным считается хроническое поступление висмута в количествах 1–1,5 грамма в день. Значение солей висмута в медицине с течением времени возрастает. На основе галлата, тартрата, карбоната, трибромфенолята, субцитрата и субсалицилата висмута разработано множество лекарств. В лечебной практике применяются такие препараты, как Викалин, Викаир, Викрам*, Нео-Анузол, Висмутовая мазь*, Дерматол, Ксероформ, Пентабисмол*, Бисмутогви*, Де-Нол, Новобисмол и другие.
Предыдущие исследования определили, что сочетание висмута с тиоловыми (-SH, сульфгидрильными) соединениями, такие как, например, этандитиол висмута, улучшают антимикробную активность висмута, по сравнению с другими его солями. Поиск новых оптимизированных трансмиттеров висмута продолжается, о чем свидетельствует недавний патент на изобретение [5], описывающий получение и применение висмут-тиоловой композиции в качестве эффективного антибактериального агента.
Сегодня в России гастроэнтерологи наиболее широко применяют коллоидный субцитрат висмута, или, как его еще называют, висмута трикалия дицитрат (ВТД). Открытие Helicobacter pylori (H. pylori) в 1983 г. австралийцами J. Warren и B. Marshall совершило революцию в лечении язвенной болезни [6], оно возобновило интерес к соединениям висмута, так как было установлено, что соли висмута эффективно подавляют рост H. pylori в сочетании с антибиотиками или в комбинации с антибиотиками и кислотосупрессивными препаратами [7, 8]. Первое рандомизированное контролируемое исследование (РКИ) с применением висмута в антихеликобактерной терапии выявило, что висмут был эффективнее монотерапии эритромицином [9]. Другое РКИ в течение 6 недель сравнивало эффективность коллоидного субцитрата висмута против циметидина при H. pylori-положительной язвенной болезни двенадцатиперстной кишки, в результате висмут успешно эрадицировал H. pylori у 50% больных [10]. Следующее РКИ оценивало совместное применение коллоидного субцитрата висмута и циметидина, отдельно или в сочетании с тинидазолом, в результате было выявлено, что коллоидный субцитрат висмута и тинидазол достигли эрадикации H. pylori почти у 75% пациентов [11]. С добавлением второго антибиотика тетрациклина или амоксициллина частота эрадикации в более поздних РКИ превысила уже 80% [12–14]. Тем не менее, были выявлены некоторые проблемы, связанные с тройной терапией на основе висмута, — это большое количество таблеток, которые пациенты были обязаны принять, продолжительность терапии и побочные эффекты, например, изменение вкуса, тошнота и диарея. Систематический обзор и метаанализ A. Ford и соавт. убедительно свидетельствуют о том, что соединения висмута, используемые либо отдельно, либо в сочетании с антибиотиками и ингибиторами протонной помпы (ИПП) для эрадикации H. pylori, являются безопасными и хорошо переносятся [15].
Многочисленные научные исследования, проведенные на фоне применения висмута трикалия дицитрата при эрозивно-язвенных поражениях различной этиологии, показали, что препарат обладает широким спектром механизмов цитопротекции. ВТД снижает активность пепсина (на 20–30%); селективно связывается с белками дна язвы и создает защитный слой — барьер для диффузии H + , который препятствует повреждению области слизистой оболочки (СО) желудка, лишенной защитного эпителиального покрова; стимулирует локальный синтез простагландинов (в среднем на 50%); увеличивает секрецию слизи и гидрокарбонатов; усиливает местный кровоток; подавляет продукцию цитокинов клетками воспалительного инфильтрата; обеспечивает реконструкцию экстрацеллюлярного матрикса и полноценный ангиогенез; усиливает репаративный эффект, опосредованный эпидермальным фактором роста. Морфологически слизистая оболочка гастродуоденальной зоны после заживления язвы ближе к нормальной микроструктуре, чем при лечении другими средствами. Применение высоких доз ВТД стимулирует выработку простагландина Е2 в желудочной слизи, которая рассматривается как часть механизма, ускоряющего заживление язвенных поражений. Терапевтические дозы ВДТ вызывают устойчивую стимуляцию продукции простагландинов [17].
Механизм антибактериального действия висмута трикалия дицитрата связан не только с нарушением адгезии микроорганизмов к эпителию слизистой оболочки, но и с нарушением синтеза АТФ в бактериальной клетке. Так, в исследовании in vitro инкубация H. pylori с висмута трикалия дицитратом приводила к выраженному угнетению роста микроорганизма и его последующей гибели [18]. Благодаря антихеликобактерной активности препараты коллоидного висмута позволяют повысить или сохранить эффективность эрадикационной терапии, особенно в условиях растущей антибиотикорезистентности H. pylori. Антихеликобактерный моноэффект ВТД составляет в среднем 14–40%. Преимущество препарата состоит в том, что не существует естественной или приобретенной резистентности H. pylori к ионам висмута. Сочетание с антибиотиками увеличивает степень эрадикации до 50%, а сочетание двух базисных препаратов — ингибитора протонной помпы и висмута трикалия дицитрата — с двумя антибиотиками позволяет преодолеть резистентность штаммов H. pylori к производным нитримидазолов либо кларитромицину.
Интересные результаты представили C. Srinarong и соавт. — 7-дневная стандартная тройная терапия плюс ВТД и пробиотик обеспечили отличную эрадикацию H. pylori (100%) в районах с низкой его резистентностью к кларитромицину, таких как Таиланд, независимо от CYP2C19 генотипа возбудителя [19].
В последние годы показано значение окислительного стресса, потенцируемого бактериями H. pylori (особенно имеющими генотип CagA+/vacAs1), в развитии хронического гастрита [20]. Препараты висмута оказались способными улавливать свободные кислородные радикалы, образующиеся при окислительном стрессе и повреждающие СО желудка, что служит одной из составляющих их цитопротективного действия [21].
BTД хорошо зарекомендовал себя и как препарат, который с успехом может назначаться при лечении эрозивно-язвенных поражений желудка и двенадцатиперстной кишки, вызванных приемом нестероидных противовоспалительных препаратов (НПВП-ассоциированной гастропатии). Так, при сравнительном изучении эффективности применения ВТД и ранитидина заживление язв и множественных эрозий желудка и двенадцатиперстной кишки через 4 нед лечения было достигнуто у 84,6% больных, получавших ВТД, и лишь у 50% пациентов, получавших ранитидин [22]. В сравнительном исследовании по эффективности применения ВТД (в дозе 240 мг 2 раза в сутки) в комбинации со стандартной дозой омепразола (20 мг в сутки) и монотерапии омепразолом у больных с НПВП-ассоциированной гастропатией заживление эрозивно-язвенных поражений желудка и двенадцатиперстной кишки через 2 нед лечения было достигнуто соответственно у 56,7% и 30,3% больных, а через 4 нед — у 100% и 93,9% пациентов. Повышение уровня простагландинов в СО желудка, отмечавшееся на фоне приема ВТД, свидетельствовало о цитопротективном действии препарата [23, 24].
Благодаря известным антидиарейным свойствам, соединения висмута широко используются для лечения эпизодических поносов у детей и взрослых на протяжении целого столетия [25–28]. Ряд исследований подтвердили эффективность висмута субсалицилата в профилактике и лечении диареи (E. coli энтеротоксигенной) путешественника. Энтеротоксигенная E. coli обнаруживалась реже у тех путешественников, которые получали висмута субсалицилат, чем у тех, кто получали плацебо, доказывая, что висмута субсалицилат предотвращает диарею, уменьшая количество и подавляя размножение энтеротоксигенной E. coli [29].
Два исследования сообщили об эффективности лечения висмутом в клизмах при язвенном колите с поражением дистальных отделов. Клинико-лабораторное улучшение наблюдалось у 60% пациентов, резистентных к обычной терапии, а у 40% пациентов была достигнута полная ремиссия после 8 недель терапии [30]. Многоцентровое, двойное слепое, рандомизированное, сравнительное исследование показало, что при сравнении эффективности лечения висмутом в клизмах с клизмами 5-аминосалициловой кислоты был установлен эквивалентный терапевтический эффект при лечении левостороннего язвенного колита [31]. Пероральный висмут также эффективен при микроскопическом колите [32] и в качестве колостомического дезодоранта [33].
В дополнение к своим антибактериальным свойствам [34, 25], висмут также обладает противовоспалительными эффектами [36] при прохождении по кишечнику. Существуют экспериментальные данные, подтверждающие роль висмута в ингибировании активности индуцируемой синтазы оксида азота в эпителиальных клетках кишечника, а также в индукции гемоксигеназы-1, тем самым обуславливая терапевтический эффект при воспалительных и окислительных реакциях, связанных с воспалительными заболеваниями кишечника [37]. Еще одно экспериментальное исследование показало способность висмута поглощать кислород свободных радикалов в контексте химических повреждений слизистой желудка [38]. Учитывая эти антибактериальные и противовоспалительные механизмы, можно теоретически предположить, что висмут должен играть определенную роль в патогенетическом лечении острой и хронической диареи, как антибактериальный и антитоксический агент [39].
Сероводород, другие зловонные и токсичные соединения продуцируются бактериями толстой кишки при гниении белка. При умеренно тяжелой форме язвенного колита [40] сероводород участвует в ингибировании окисления бутирата слизистой толстой кишки, что делает слизистую оболочку более уязвимой к воспалительным агентам [41, 42]. Висмут, соединяясь с сероводородом, образует нерастворимый безвредный сульфид висмута и окрашивает кал в черный цвет [43].
Целью нашего оригинального исследования стала оценка сравнительных характеристик инфракрасных спектров (ИК-спектров) двух готовых лекарственных форм висмута. В исследовании проанализированы спектральные характеристики наиболее востребованных висмут-содержащих препаратов, а именно препаратов Де-Нол® (Нидерланды) и Новобисмол® (Россия). Активным действующим веществом этих препаратов является висмута трикалия дицитрат.
Спектральные характеристики получены с помощью инфракрасного фурье-спектрометра ФСМ-1202 (Россия). Фармакологически активная часть таблетированной формы смешивалась с бромидом калия (Fluka, Германия) в соотношении 1:100, и с помощью гидравлического пресса формировался диск. Измерение проводили в диапазоне 4000–400 см -1 , с разрешением 4 см -1 и числом сканов 25. Управление прибором и обработка данных осуществлялась с применением программы Fspec 4,0. Исследованные нами образцы имели идентичные инфракрасные спектры (рис.).
Спектральная характеристика образцов висмута трикалия дицитрата интересна с точки зрения спектральных характеристик комплексного соединения. Так, на спектре образцов можно отметить две характеристические широкие полосы поглощения 1579 и 1393 см -1 , обусловленные валентными симметричными и асимметричными колебаниями в СОО-фрагменте. Такой тип связей возникает в хелатном соединении между карбоксильными группами цитратных фрагментов и комплексообразователем висмутом. Именно данная хелатная форма обуславливает сдвиг полос поглощения соответствующий RСОO- и в обычных условиях прослеживаются около 1560 и 1410 см -1 . Необходимо отметить, что подобные смещения в ИК-области полос поглощения для комплексных соединений другого типа ранее описывались в литературе [44]. Полоса поглощения 1290 см -1 , обнаруженная у комплекса, по нашему мнению, обусловлена колебаниям С-О и О-Ме (где Ме — ионы калия или висмута). Именно ионы металлов обуславливают смещение деформационных (внеплоскостных) колебаний ОН (950–900 см -1 ) до значения 845 см -1 , что соответствует рассматриваемому висмутовому комплексу. Колебаниям С-С-связей соответствует полоса поглощения 910 см -1 . Соответственно полосы 1142, 1076, 1020 см -1 обусловлены валентными колебаниям С-О и фрагментам СН-О– [45].
Таким образом, данное исследование указывает на практически полную фармацевтическую эквивалентность исследованных нами препаратов Де-Нол® и Новобисмол®.
Литература
Е. Ю. Плотникова 1 , доктор медицинских наук, профессор
А. С. Сухих, кандидат медицинских наук
Читайте также:

