Что не является особенностью антибиотикотерапии при сепсисе
Обновлено: 15.04.2024
Антибактериальная терапия септического шока - выбор эффективного антибиотика
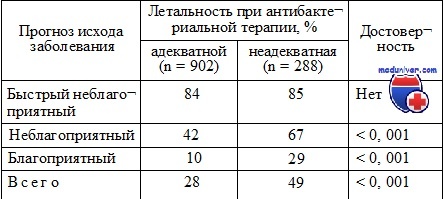
Адекватной антимикробной терапией септического шока считается та, хотя бы один компонент которой оказался активным в отношении возбудителя, выделенного из предполагаемого источника инфекции. Ретроспективные исследования применения адекватной антимикробной терапии в отношении ангиогенных инфекций, вызванных грамотрицательной флорой, указывают на снижение летальности пациентов в сравнении с теми, по отношению к которым по разным причинам применялась неадекватная антибактериальная терапия. В таблице представлены результаты анализа эффективности адекватной и неадекватной терапии в лечении больных сепсисом с различным прогнозом исхода заболевания. Прогноз заболевания определялся с помощью оценки тяжести состояния и наличия сопутствующей патологии.
Необходимо отметить, что аналогичные данные о влиянии адекватной и неадекватной антибактериальной терапии на летальность больных сепсисом, вызванным грамположительной флорой, весьма ограничены, тем не менее в отдельных исследованиях были выявлены различия в эффективности адекватной и неадекватной антибактериальной терапии.
В отношении адекватной терапии кандидемии (одной из форм инвазивного кандидоза) также имеются ограниченные данные, указывающие на важность проведения адекватной антигрибковой терапии. К 30-м суткам лечения летальность пациентов, получавших адекватную противогрибковую терапию (37 %), была достоверно ниже летальности пациентов, не получавших адекватной терапии (76 %). В отношении влияния на летальность раннего назначения противогрибковой терапии (раньше или позже 3 сут после диагностики инфекции) имеются противоречивые данные, не позволяющие сделать однозначного заключения.
Таким образом, адекватная антибактериальная терапия больных сепсисом, вызванным грамотрицательной, грамположительной флорой и кандидами, является фактором, достоверно снижающим летальность и предупреждающим развитие септического шока.
Эффективность адекватной и неадекватной антимикробной терапии больных сепсисом и септическим шоком
Сравнение монотерапии и комбинированной антимикробной терапии септического шока
Важной проблемой антибактериальной терапии сепсиса и септического шока является выявление преимуществ комбинированной терапии перед применением одного препарата. Преимущества комбинированной терапии обычно сводятся к трем основным аргументам:
1) комбинация препаратов обладает более широким спектром антимикробной активности по сравнению с одним препаратом. Этот аргумент становится особенно актуальным при проведении эмпирической терапии полимикробных инфекций, например, у больных абдоминальным сепсисом;
2) при применении 2 или более препаратов можно рассчитывать не только на аддитивный, но и на синергический эффект препаратов. Теоретически при применении синергических комбинаций может быть снижена доза препаратов, обладающих серьезными побочными эффектами;
3) комбинированная терапия приводит к снижению развития резистентности флоры и вероятности возникновения суперинфекции.
Сравнительные исследования лечения цефалоспоринами 3-й генерации и комбинацией полусинтетических бета-лактамов и аминогликозидов
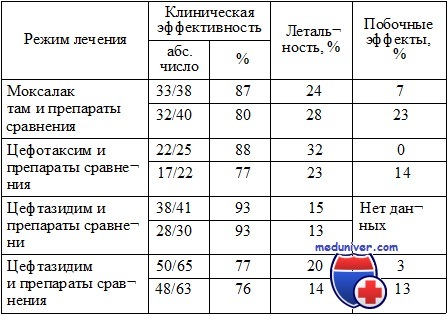
* Препаратами сравнения были комбинации полусинтетических бета-лактамных антибиотиков или цефалоспоринов 1-й генерации с аминогликозидами.
Впервые преимущества комбинированной терапии перед монотерапией были выявлены в 60—70 годах XX в. Эти преимущества заключались в более низкой летальности больных сепсисом при применении синергических комбинаций по сравнению с несинергическими. Появление новых препаратов более широкого спектра действия привело к тому, что эффективность комбинированной антибактериальной терапии оказалась равной эффективности одного современного препарата. Необходимо отметить, что дизайн этих исследований не удовлетворял современным требованиям, предъявляемым к исследованиям с доказательностью высокого уровня достоверности. В 70—90-е годы аналогичные данные были получены в отношении комбинации различных аминогликозидов и цефалоспорина 3-й генерации.
Некоторые исследователи пытались применять одновременно 2, 3 и более антибиотиков, однако экспансия не привела к повышению эффективности лечения и сопровождалась возрастанием токсических эффектов. Внедрение в клиническую практику антибиотиков, обладающих широким и ультрашироким спектром активности (цефалоспоринов 3—4-й генераций, карбапенемов) в отношении важнейших возбудителей тяжелых инфекций, снизило актуальность применения комбинированной терапии и показало высокую эффективность монотерапии современными препаратами.
Равная эффективность монотерапии цефалоспоринами 3—4-й генераций по сравнению с комбинацией полусинтетических бета-лактамных антибиотиков с одним из аминогликозидов была доказана при проведении четырех проспективных рандомизированных исследований. Результаты исследований, представленные в таблице, указывают на примерно равную клиническую эффективность, отсутствие различий в летальности и снижение количества побочных эффектов при применении монотерапии цефалоспоринами по сравнению с комбинированной терапией.
Сравнительные исследования карбапенемов и комбинации бета-лактамных антибиотиков и аминогликозидов
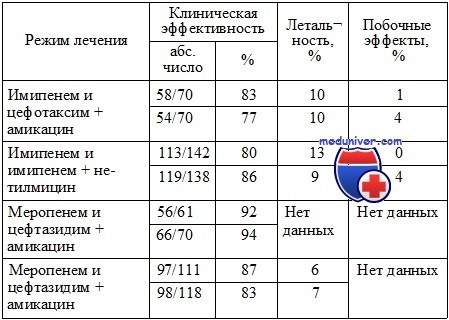
Равная эффективность и безопасность монотерапии карбапенемами по сравнению с комбинацией бета-лактамных антибиотиков и аминогликозидов была доказана при проведении четырех проспективных рандомизированных исследований.
Таким образом, синергические комбинации бета-лактамных полусинтетических антибиотиков в комбинации с аминогликозидами, по-видимому, обладают равной эффективностью с монотерапией современными бета-лактамными антибиотиками (цефалоспоринами 3—4-й генерации, карбапенемами). Тем не менее важная роль комбинированной терапии показана в лечении инфекций, вызванных высокорезистентной нозокомиальной флорой, в частности грамположительной, так как большинство бета-лактамных антибиотиков в этой ситуации оказываются неэффективными. Несмотря на это, проблема роста резистентности флоры не может быть решена исключительно применением комбинированной антибактериальной терапии.
Эмпирическая терапия септического шока противогрибковыми препаратами
С 80-х годов XX в. отмечается значительный рост заболеваемости грибковыми инфекциями, причем наиболее актуальными стали инфекции, вызванные грибами рода кандида. При инвазивных грибковых инфекциях, сопровождающихся фунгемией, доля возбудителей рода кандид достигает 45 %, однако до настоящего времени остается непонятным, как интерпретировать выделения грибов из нестерильных локусов — как подтверждение инфекции или как колонизацию. Это связано с тем, что клинические признаки кандидоза не обладают высокой специфичностью, а обычные культуральные методы, антигенные и биохимические маркеры не обладают высокой чувствительностью. С учетом того, что грибы в этиологической структуре сепсиса составляют не более 5 %, рутинное применение противогрибковых препаратов считается нерациональным.
Все сказанное выше относится к пациентам без иммунологических нарушений. Выделение возбудителей рода кандид из крови или из нормально стерильных сред у пациентов с иммуносупрессией следует трактовать как инвазивный кандидоз, требующий немедленного начала антибактериальной терапии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Для цитирования: Руднов В.А. Современные алгоритмы антибактериальной терапии сепсиса. РМЖ. 2004;24:1354.




Литература
1. Ibrahim E.H.,Sherman G., Ward S. et al. Chest 2000; 118:146–155.
2. Leibovici L.,Shraga I., Drucker M. et al. J Intern Med 1998;244:379–386.
3. Руднов В.А., Ложкин С.Н., Галеев Ф.С. и др. Клиническая микробио-
логия и антимикробная химиотерапия 2003; 5, №2:144–152.
4. Bochud P.Y.,Glauser M.P., Calandra T. Intensive Care Med. 2001;
27(suppl 1): 33–48.
5. Dellinger R.P., Carlet J.M., Masur H. et al. Suviving Sepsis
Campaign guidelines for management of sepsis and septic shock. Crit
Care Med 2004 32,4:858–873.
6. Сепсис в начале XXI века.Классификация, клинико–диагностическая
концепция и лечение. Патолого–анатомическая диагностика: Практиче-
ское руководство.–М.:Издательство НЦССХ им. А.Н.Бакулева РАМН,
2004.–130 с.
7. Сидоренко С.В.,Страчунский Л.С., Ахметова Л.И. и др. Антибиотики
и химиотер.1999; 44:7–16.
8. Страчунский Л.С.,Решедько Г.К., Эйдельштейн М.В. и др. Клиниче-
ская микробиология и антимикробная химиотерапия 2003; 5, №3:259–274.
9. Страчунский Л.С.,Решедько Г.К., Стецюк О.У. и др. Клиническая ми-
кробиология и антимикробная химиотерапия 2003; 5, №1: 36–46.
10. Renaud B. et al. Am J Respir Crit Care Med 2001;163:1584–1590
11. Opal S. et al. Crit Care Med 1999;27:1608 –1615
12. Cisneros J. Clin Infect Dis 1996;22:102 – 108
13. Chow J. Ann Intern Med 1991;115:585–591
14. Бейкин Я.Б. Шилова В.П.,Руднов В.А., Розанова С.М. и др. Микроб-
ный пейзаж и антибиотикотеризстентность госпитальной флоры реанима-
ционных отделений Екатеринбурга. Инф.письмо. Екатеринбург, 2004.
15. Решедько Г.К. Микробиологические основы клинического применения
аминогликозидов в стационарах России. Автореф дисс. докт мед на-
ук. Смоленск. 2004, 43с.
16. Gleason P., Meeehan T., Fine J. Arch Intern Med 1999;
159:2562–2572.
17. Paul M., Benuri – Silbiger I.,Soares–Veiser K.,Leibovici L.
BMJ,doi:10.1136/bmj.308028.520995.63(published 2 March 2004)
18. Craig A.W.,Ebert S.C. Antimicrob Agents Chemother
1992;36:2577–2583.
19. Бочоришвили В.Г. Сепсисология с основами инфекционной патоло-
гии.– Тбилиси.:Мецниереба, 1988.–806с.
20. Alvarez–Lerma F. et al. Intensive Care Med 2003;29(1S): A250
Ингибиторы циклооксигеназы при сепсисе. Антибактериальная терапия при сепсисе.
Арахидоновая кислота, входящая в состав липидов, при своем распаде образует эйкосаыоиды: тромбоксан (Тх А2), простагландины (PGE2), простациклин (PGI2), токсичные кислородные радикалы (ОН-, 2-). Совокупность действия эйкосаноидов выражается в повышении проницаемости клеточных мембран, образовании микротромбов, развитии воспалительной реакции, высвобождении эндогенного вазоконстриктора эндотелина, способствующего спазму легочных сосудов. К препаратам, способным ингибировать действие циклооксигеназы, относятся нестероидные противовоспалительные средства кеторолак (90 мг в сутки), диклофенак (150 мг в сутки).
Антагонисты опиоидных рецепторов
Установление роли опиоидных пептидов в патогенезе септического шока (возбуждение ц- и 5-рецепторов) послужило основанием для применения антагонистов опиатов. Применение налоксона способствуем увеличению артериального давления и снижению уровня лактата крови. В комплексе интенсивной терапии септического шока налоксон вводится в дозе 0,4-1,2 мг.
Антибактериальная терапия
Применение рациональной антибактериальной терапии является важным, но не первоочередным направлением в интенсивной терапии септического шока, т. к. направлено только на тех возбудителей, которые поступают в кровоток и существенно не влияют на первичный септический очаг.
Трудности подбора антибиотика в первые часы развития септического шока диктует необходимость применения эмпирической антибактериальной терапии с использованием препаратов с максимально широким спектром действия. Примечательно, что в случае высокой чувствительности возбудителя к антибактериальному препарату, выживаемость больных с септическим шоком возрастает в три раза.
Препаратами выбора при септическом шоке являются карбапенемы (имипинем, меронем), что связано с их ультрашироким спектром действия, низким уровнем приобретенной резистентности и возможностью использования у больных с синдромом мультиорганной дисфункции.
Многочисленными исследованиями установлено, что клиническая эффективность имипинема и меронема в равных суточных дозах одинакова, а монотерапия этими препаратами не уступает режиму комбинированной антибактериальной терапии (цефатоспорины III поколения + аминогликозиды 3 поколения + метронидазол, фторхинолоны + метронидазол).
Применение имипинема, в отличие от меронема, ограничено (особенно у больных с патологией ЦНС) возможностью развития судорожного синдрома, поэтому при инфекционном поражении ЦНС использование имипенема противопоказано.

Меронем назначается внутривенно болюсно с интервалом 8 часов, имипенем только в виде инфузии в течение 60 минут с интервалом 6-8 часов. Суточная доза меронема составляет 3,0 г, имипенема - 4,0 г.
Сочетание цефалоспоринов III поколения (цефтриаксон, цефоперазон) с аминогликозидами 3 поколения (амикацин, нетилмицин) показано при развитии на фоне септического шока ОПН, особенно в случае перитонеальной локализации септическго очага, т. к. цефтриаксон и цефоперазон выводятся из организма преимущественно с желчью, а введение аминогликозидов однократно в максимальной суточной дозе значительно снижает put нефротоксичности.
Цефтриаксон вводится внутривенно в дозе 30 мг/кг с последующими инъекциями по 1-2 г через 12 часов, цефоперазон - по 3 г каждые 6-8 часов. Максимальная суточная доза для амикацина составляет 15 мг/кг, для нетилмицина - 6 мг/кг.
При септическом шоке, развившемся на фоне панкреонекроза, показана комбинация ампициллина, гентамицина и метронидазола.
В случае анаэробного компонента инфекции (абдоминальный, акушерский урологический септический шок) целесообразна комбинация цефалоспоринов IV поколения (цефепим) с метронидазолом или клиндамицином (1 г 2-3 раза в сутки). Указанная комбинация обладает высокой антибактериальной активностью, широким спектром действия, минимальным количеством резистентных к ней P. aeruginosae, высокой устойчивостью к бета-лактамазам и по эффективности сопоставима с монотерапией карбапенемами.
Цефепим вводится внутривенно в дозе 2 г с последующими инъекциями по 1-2 г через 12 часов, метронидазол по 100 мл каждые 8 часов, клиндамицин - по 1 г через 6 часов.
Антибактериальная терапия септического шока, вызванного пневмонией тяжелого течения, проводится в зависимости от характера пневмонии.
При внебольничной пневмонии препаратом выбора являются цефалоспорины III поколения с макролидами. Указанная комбинация практически полностью перекрывает весь спектр возбудителей внегоспитальной пневмонии тяжелого течения.
Особенностью нозокомиальной пневмонии в ОРИТ является то, что она, как правило, развивается на фоне профилактического применения антибиотиков широкого спектра действия, а также у больных, находящихся на ИВЛ.
Развитие септического шока у больных с пневмонией, не получавших ранее антибактериальной терапии или находящихся на ИВЛ менее 5 суток, требует назначения цефалоспоринов III поколения без антипсевдомонадной активности (цефотаксим, цефтриаксон) или фторхинолонов (ципрофлоксацин, офлоксацин) в сочетании с аминогликозидами, а в случае их неэффективности - карбапенемов.
При развитии септического шока у больных на фоне предшествующей терапии антибиотиками или у больных, находящихся на ИВЛ более 5 суток, показано назначение антипсевдомонадных цефалоспоринов (цефаперазон, цефпирамид, цефтазидим) с аминогликозидами 3 поколения.
Септический шок, развившийся на фоне пневмонии с нейтропенией (количество нейтрофилов менее 500 в мкл), требует включения в комплекс интенсивной терапии сочетания цефалоспоринов III IV поколении с аминогликозидами 3 поколения, а в качестве резерва возможно использование тикарциллина или штерациллина с аминогликозидами.
При развитии урологического септического шока целесообразно использовать сочетание цефтриаксона (а при высоком риске синегнойноп инфекции - цефоперазона) с амикащшом.
Антибактериальная терапия менингококкового септического шока должна начинаться параллельно с мероприятиями по стабилизации показателей гемодинамики и нормализации газообмена. Средством выбора антибактериального лечения менингококкового септического шока является бензилпенициллин, т. к. Neisseria meningidis обладает высокой чувствительностью к этому препарату. Бензилпенициллин вводится внутривенно в дозе 200-500 тыс. Ед/кг в сутки.
При использовании больших доз бензилпенициллина или других антибактериальных препаратов, обладающих бактериоцидным эффектом, явления эндогенной интоксикации нередко стремительно нарастают, что получило название синдрома Яриша-Герцгеймера (увеличение концентрации эндотоксина в крови за счет выхода липополисахаридов из разрушенной микробной стенки).
С целью избежания подобной ситуации целесообразно использовать антибактериальные препараты, обладающие не бактерицидным, а бактериостатическим эффектом. В частности, левомицитина сукцинат, который при менингококков ом септическом шоке вводится в дозе 3,0-4,5 г в сутки.
В случае посттравматического или послеоперационного менингита, осложненного септическим шоком, препаратами выбора являются цефалоспорины III поколения в комбинации с ванкомицином, а в качестве альтернативы - комбинация меронема с ванкомицином.
Следует помнить, что некоторые препараты (гипертонические раствора глюкозы, ГКС) уменьшают проникновение антибиотиков через гематоэнцефалический барьер, а другие (кофеин, эуфиллин), наоборот, увеличивают.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Антибактериальная терапия септического шока - выбор эффективного антибиотика
Адекватной антимикробной терапией септического шока считается та, хотя бы один компонент которой оказался активным в отношении возбудителя, выделенного из предполагаемого источника инфекции. Ретроспективные исследования применения адекватной антимикробной терапии в отношении ангиогенных инфекций, вызванных грамотрицательной флорой, указывают на снижение летальности пациентов в сравнении с теми, по отношению к которым по разным причинам применялась неадекватная антибактериальная терапия. В таблице представлены результаты анализа эффективности адекватной и неадекватной терапии в лечении больных сепсисом с различным прогнозом исхода заболевания. Прогноз заболевания определялся с помощью оценки тяжести состояния и наличия сопутствующей патологии.
Необходимо отметить, что аналогичные данные о влиянии адекватной и неадекватной антибактериальной терапии на летальность больных сепсисом, вызванным грамположительной флорой, весьма ограничены, тем не менее в отдельных исследованиях были выявлены различия в эффективности адекватной и неадекватной антибактериальной терапии.
В отношении адекватной терапии кандидемии (одной из форм инвазивного кандидоза) также имеются ограниченные данные, указывающие на важность проведения адекватной антигрибковой терапии. К 30-м суткам лечения летальность пациентов, получавших адекватную противогрибковую терапию (37 %), была достоверно ниже летальности пациентов, не получавших адекватной терапии (76 %). В отношении влияния на летальность раннего назначения противогрибковой терапии (раньше или позже 3 сут после диагностики инфекции) имеются противоречивые данные, не позволяющие сделать однозначного заключения.
Таким образом, адекватная антибактериальная терапия больных сепсисом, вызванным грамотрицательной, грамположительной флорой и кандидами, является фактором, достоверно снижающим летальность и предупреждающим развитие септического шока.
Эффективность адекватной и неадекватной антимикробной терапии больных сепсисом и септическим шоком

Сравнение монотерапии и комбинированной антимикробной терапии септического шока
Важной проблемой антибактериальной терапии сепсиса и септического шока является выявление преимуществ комбинированной терапии перед применением одного препарата. Преимущества комбинированной терапии обычно сводятся к трем основным аргументам:
1) комбинация препаратов обладает более широким спектром антимикробной активности по сравнению с одним препаратом. Этот аргумент становится особенно актуальным при проведении эмпирической терапии полимикробных инфекций, например, у больных абдоминальным сепсисом;
2) при применении 2 или более препаратов можно рассчитывать не только на аддитивный, но и на синергический эффект препаратов. Теоретически при применении синергических комбинаций может быть снижена доза препаратов, обладающих серьезными побочными эффектами;
3) комбинированная терапия приводит к снижению развития резистентности флоры и вероятности возникновения суперинфекции.
Сравнительные исследования лечения цефалоспоринами 3-й генерации и комбинацией полусинтетических бета-лактамов и аминогликозидов

* Препаратами сравнения были комбинации полусинтетических бета-лактамных антибиотиков или цефалоспоринов 1-й генерации с аминогликозидами.
Впервые преимущества комбинированной терапии перед монотерапией были выявлены в 60—70 годах XX в. Эти преимущества заключались в более низкой летальности больных сепсисом при применении синергических комбинаций по сравнению с несинергическими. Появление новых препаратов более широкого спектра действия привело к тому, что эффективность комбинированной антибактериальной терапии оказалась равной эффективности одного современного препарата. Необходимо отметить, что дизайн этих исследований не удовлетворял современным требованиям, предъявляемым к исследованиям с доказательностью высокого уровня достоверности. В 70—90-е годы аналогичные данные были получены в отношении комбинации различных аминогликозидов и цефалоспорина 3-й генерации.
Некоторые исследователи пытались применять одновременно 2, 3 и более антибиотиков, однако экспансия не привела к повышению эффективности лечения и сопровождалась возрастанием токсических эффектов. Внедрение в клиническую практику антибиотиков, обладающих широким и ультрашироким спектром активности (цефалоспоринов 3—4-й генераций, карбапенемов) в отношении важнейших возбудителей тяжелых инфекций, снизило актуальность применения комбинированной терапии и показало высокую эффективность монотерапии современными препаратами.
Равная эффективность монотерапии цефалоспоринами 3—4-й генераций по сравнению с комбинацией полусинтетических бета-лактамных антибиотиков с одним из аминогликозидов была доказана при проведении четырех проспективных рандомизированных исследований. Результаты исследований, представленные в таблице, указывают на примерно равную клиническую эффективность, отсутствие различий в летальности и снижение количества побочных эффектов при применении монотерапии цефалоспоринами по сравнению с комбинированной терапией.
Сравнительные исследования карбапенемов и комбинации бета-лактамных антибиотиков и аминогликозидов

Равная эффективность и безопасность монотерапии карбапенемами по сравнению с комбинацией бета-лактамных антибиотиков и аминогликозидов была доказана при проведении четырех проспективных рандомизированных исследований.
Таким образом, синергические комбинации бета-лактамных полусинтетических антибиотиков в комбинации с аминогликозидами, по-видимому, обладают равной эффективностью с монотерапией современными бета-лактамными антибиотиками (цефалоспоринами 3—4-й генерации, карбапенемами). Тем не менее важная роль комбинированной терапии показана в лечении инфекций, вызванных высокорезистентной нозокомиальной флорой, в частности грамположительной, так как большинство бета-лактамных антибиотиков в этой ситуации оказываются неэффективными. Несмотря на это, проблема роста резистентности флоры не может быть решена исключительно применением комбинированной антибактериальной терапии.
Эмпирическая терапия септического шока противогрибковыми препаратами
С 80-х годов XX в. отмечается значительный рост заболеваемости грибковыми инфекциями, причем наиболее актуальными стали инфекции, вызванные грибами рода кандида. При инвазивных грибковых инфекциях, сопровождающихся фунгемией, доля возбудителей рода кандид достигает 45 %, однако до настоящего времени остается непонятным, как интерпретировать выделения грибов из нестерильных локусов — как подтверждение инфекции или как колонизацию. Это связано с тем, что клинические признаки кандидоза не обладают высокой специфичностью, а обычные культуральные методы, антигенные и биохимические маркеры не обладают высокой чувствительностью. С учетом того, что грибы в этиологической структуре сепсиса составляют не более 5 %, рутинное применение противогрибковых препаратов считается нерациональным.
Все сказанное выше относится к пациентам без иммунологических нарушений. Выделение возбудителей рода кандид из крови или из нормально стерильных сред у пациентов с иммуносупрессией следует трактовать как инвазивный кандидоз, требующий немедленного начала антибактериальной терапии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Для цитирования: Руднов В.А. Современные алгоритмы антибактериальной терапии сепсиса. РМЖ. 2004;24:1354.




Литература
1. Ibrahim E.H.,Sherman G., Ward S. et al. Chest 2000; 118:146–155.
2. Leibovici L.,Shraga I., Drucker M. et al. J Intern Med 1998;244:379–386.
3. Руднов В.А., Ложкин С.Н., Галеев Ф.С. и др. Клиническая микробио-
логия и антимикробная химиотерапия 2003; 5, №2:144–152.
4. Bochud P.Y.,Glauser M.P., Calandra T. Intensive Care Med. 2001;
27(suppl 1): 33–48.
5. Dellinger R.P., Carlet J.M., Masur H. et al. Suviving Sepsis
Campaign guidelines for management of sepsis and septic shock. Crit
Care Med 2004 32,4:858–873.
6. Сепсис в начале XXI века.Классификация, клинико–диагностическая
концепция и лечение. Патолого–анатомическая диагностика: Практиче-
ское руководство.–М.:Издательство НЦССХ им. А.Н.Бакулева РАМН,
2004.–130 с.
7. Сидоренко С.В.,Страчунский Л.С., Ахметова Л.И. и др. Антибиотики
и химиотер.1999; 44:7–16.
8. Страчунский Л.С.,Решедько Г.К., Эйдельштейн М.В. и др. Клиниче-
ская микробиология и антимикробная химиотерапия 2003; 5, №3:259–274.
9. Страчунский Л.С.,Решедько Г.К., Стецюк О.У. и др. Клиническая ми-
кробиология и антимикробная химиотерапия 2003; 5, №1: 36–46.
10. Renaud B. et al. Am J Respir Crit Care Med 2001;163:1584–1590
11. Opal S. et al. Crit Care Med 1999;27:1608 –1615
12. Cisneros J. Clin Infect Dis 1996;22:102 – 108
13. Chow J. Ann Intern Med 1991;115:585–591
14. Бейкин Я.Б. Шилова В.П.,Руднов В.А., Розанова С.М. и др. Микроб-
ный пейзаж и антибиотикотеризстентность госпитальной флоры реанима-
ционных отделений Екатеринбурга. Инф.письмо. Екатеринбург, 2004.
15. Решедько Г.К. Микробиологические основы клинического применения
аминогликозидов в стационарах России. Автореф дисс. докт мед на-
ук. Смоленск. 2004, 43с.
16. Gleason P., Meeehan T., Fine J. Arch Intern Med 1999;
159:2562–2572.
17. Paul M., Benuri – Silbiger I.,Soares–Veiser K.,Leibovici L.
BMJ,doi:10.1136/bmj.308028.520995.63(published 2 March 2004)
18. Craig A.W.,Ebert S.C. Antimicrob Agents Chemother
1992;36:2577–2583.
19. Бочоришвили В.Г. Сепсисология с основами инфекционной патоло-
гии.– Тбилиси.:Мецниереба, 1988.–806с.
20. Alvarez–Lerma F. et al. Intensive Care Med 2003;29(1S): A250
Читайте также:

