Что нового в инфекционных заболеваниях
Обновлено: 23.04.2024
В Российской Федерации ежегодно болеют гриппом и острыми респираторными вирусными инфекциями (ОРВИ) около 27–41 млн человек. Масштабы заболеваемости ОРВИ делают актуальным поиск новых способов их профилактики и лечения. Средства этиотропной терапии направлены против возбудителя заболевания, в данном случае против респираторных вирусов. Специфические противовирусные препараты воздействуют непосредственно на возбудителя инфекции, препятствуя его репродукции в организме. Один из подходов к терапии ОРВИ и гриппа заключается в применении препаратов, обладающих комбинированным действием, которые сочетают в себе этиотропное противовирусное, иммуномодулирующее, патогенетическое и симптоматическое действие. В ситуациях с неуточненным возбудителем и лабораторно подтвержденной вирусной микст-инфекцией следует отдавать предпочтение противовирусным препаратам широкого спектра действия. Отмечается увеличение доли новых и возвращающихся инфекций. Представлены основные принципы диагностики и терапии гриппа и ОРВИ. Большое значение в терапии ОРВИ и гриппа имеют препараты, способные оказывать воздействие как на возбудителя инфекции (уточненного или неуточненного), так и на проявления интоксикационно-воспалительного синдрома (лихорадка,
озноб, боль, отек, катаральные явления), например препарат энисамия йодид (Нобазит ® ).
Ключевые слова: ОРВИ, вирус гриппа, новые и возвращающиеся вирусные инфекции, противовирусные препараты, Нобазит ® .
Scientific Information Center For the Prevention and Treatment of Viral Infections, Moscow
In the Russian Federation, about 27-41 million people suffer from influenza and acute respiratory viral infections (ARVI) every year. The scale of the ARVI incidence makes it urgent to search for new ways of ARVI prevention and treatment. Facilities of etiotropic therapy are directed against the pathogen, in this particular case against respiratory viruses. Specific antiviral drugs act directly on the pathogen, preventing its reproduction in the body. One of the approaches to the ARVI treatment and influenza is the use of drugs with a combined effect, which consist of a combination of etiotropic antiviral, immunomodulatory, pathogenetic and symptomatic action. In situations with unspecified pathogen and laboratory-confirmed viral mixed infection, a broad-spectrum antiviral should be preferred. There is an increase in the proportion of new and recurring infections. The basic principles of diagnosis and treatment of influenza and ARVI. Of great importance in the treatment of ARVI and influenza are drugs that can affect both the pathogen (specified or unspecified) and the manifestations of intoxication-inflammatory syndrome (fever, chills, pain, oedema, catarrhal symptoms), for example, enisamium iodide (Nobazit ® ).
В статье приведены алгоритмы диагностики и терапии новых и возвращающихся респираторных вирусных инфекций

Классификация и диагностика острых респираторных инфекций и гриппа
Диагностика гриппа и ОРВИ
Лечение гриппа и ОРИ
Выводы
Грипп продолжает оставаться недостаточно предсказуемой и социально значимой инфекционной болезнью с ежегодными эпидемиями.
Ведущей возрастной группой, вовлекаемой в эпидемический процесс, являются дети в возрасте до 14 лет.
Осложнения эпидемического (ежегодного гриппа) регистрируются чаще среди лиц из группы риска (старше 60–65 лет, детей до 7 лет, беременных, лиц с хронической патологией).
Необходим тщательный мониторинг и постоянное изучение циркулирующих штаммов вируса, причин заболеваемости и смертности, в том числе случаев внегоспитальных пневмоний, ассоциированных с гриппом.
Обязательная ежегодная вакцинация от гриппа, в первую очередь в социально-возрастных и профессиональных группах высокого риска заражения с охватом не менее 75% населения.
Обязателен мониторинг эффективности программ вакцинопрофилактики.
Необходимо строгое соблюдение стандартов обследования и лечения больных гриппом и ОРВИ на всех этапах оказания медицинской помощи.
Использование препаратов по рекомендации врача для лечения пациентов с гриппом и ОРВИ должно быть основано на постулатах доказательной медицины. Среди этиотропных препаратов, которые применяются в России, Нобазит ® является эффективным и безопасным препаратом выбора, с клинически значимыми и доказанными преимуществами.
В настоящее время не существует универсального противовирусного препарата, способного защитить от всех респираторных патогенов, ответственных за возникновение гриппа и других ОРВИ, т. к. вирусы, в силу своей изменчивости, со временем вырабатывают резистентность, а также в связи с сочетанными вирусными и вирусно-бактериальными инфекциями. Этим и обусловлена потребность в препаратах, действующих не только на конкретные белки и ключевые структуры вируса, но и комплексно на клеточные и гуморальные иммунные механизмы противовирусной защиты, что важно в эру появления новых и возвращающихся вирусных инфекций [42].
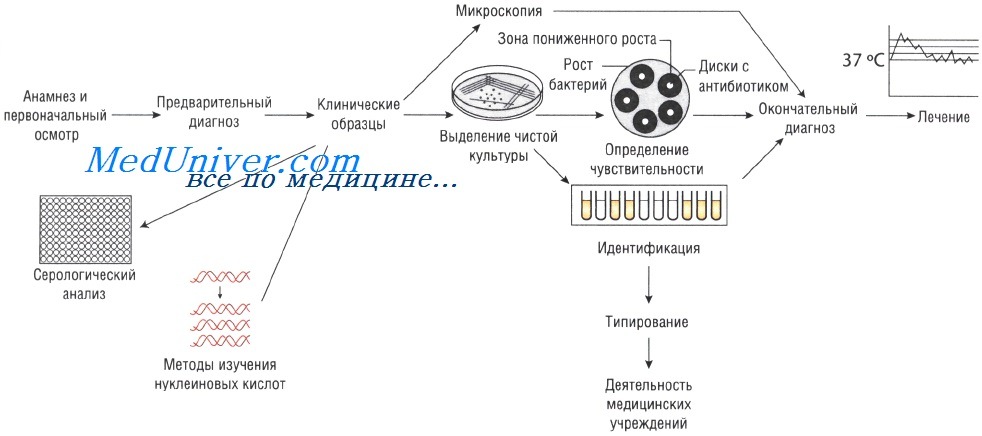
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

В докладе за 2007 год Всемирная организация здравоохранения предупредила: количество опасных для человечества болезней стремительно растет. Только новых инфекционных заболеваний в период между 1970-ми и 2007 годом было открыто более 40. С тех пор тенденция не просто сохранилась, а еще больше прибавила в темпе. Если в Международном классификаторе болезней, утвержденном ВОЗ в том же 2007 году (МКБ-10) по приблизительным подсчетам упоминалось около 14400 наименований расстройств, то в МКБ-11 (по предварительным данным вступит в силу в 2022 году) насчитывается уже примерно 55 тысяч болезней. Но исследователи опасаются, что к 2020-м годам перечень известных человечеству болезней еще больше увеличится.
Откуда берутся новые болезни
Еще не так давно человечество и знать не знало не только о СПИДе, птичьем и свином гриппах, Эболе, Зике, но и уже привычные для современных людей аллергия, ожирение, депрессия, онкология в ХХ веке были чем-то из ряда вон выходящим. Откуда берутся новые болезни? Этот вопрос интересует исследователей давно, и на сегодня рассматривается несколько версий.
По прогнозам ООН, к 2050 году население планеты достигнет примерно 10 миллиардов человек. Всем этим людям потребуется место для обитания и пища. А это значит что ускорятся процессы миграции, урбанизации и освоение новых, пока что не заселенных территорий.
Новые болезни могут быть вызваны следующими причинами:
- ранее неизвестными инфекционными агентами;
- уже известными агентами, которые распространились на новые, нехарактерные для себя территории, или начали поражать популяции, которые ранее были устойчивыми к возбудителям;
- агентами, чья роль в конкретных заболеваниях ранее не признавалась;
- повторным появлением инфекционных агентов, которые в прошлом вызывали болезни, но со временем частота заболеваний существенно снизилась, а теперь вновь возобновилась. Этот класс заболеваний известен как вновь возникающие инфекции.
Кроме того, существует вероятность возникновения болезней, вызванных патогенами, преднамеренно введенными в популяции людей, животных или растений. В таком случае говорят о биологическом оружии. Из известных на сегодня агентов, которые могут быть использованы в биотерроризме, самыми опасными считаются сибирская язва, оспа и туляремия.
Факторы, вызывающие появление новых инфекций
Существует множество факторов, которые ученые связывают с появлением новых инфекционных заболеваний. Некоторые из них являются результатом естественных процессов, таких как эволюция патогенов, однако часть из них это последствия деятельности человека.
Чтобы специалисты могли признать возникновение новой болезни, должно произойти как минимум два события. Во-первых, инфекционный агент должен проникнуть в организм уязвимого человека, а во-вторых, у возбудителя должна появиться возможность свободно распространяться, заражая новых людей.
Многие новые заболевания возникают, когда инфекционные агенты, ранее поражавшие исключительно животных, начинают передаваться людям. Это так называемые зоонозы. По мере роста численности населения и расширения географических границ обитания человека, повышается вероятность более тесного контакта с животными, которые являются потенциальными переносчиками инфекции.
Важным глобальным фактором, который может стать причиной очередной вспышки болезней, это приобретенная устойчивость возбудителей к противомикробным препаратам. Бактерии, вирусы и другие микроорганизмы со временем эволюционируют и вырабатывают резистентность к ранее действующим лекарственным средствам. Поэтому препараты, которые были эффективны в прошлом, со временем становятся неэффективными. Кроме того, неконтролируемое использование противомикробных средств человеком, без рекомендации врача, также приводит к развитию резистентности у возбудителей заболевания.
Изменение климата также все чаще называют фактором возникновения новых инфекционных заболеваний. Например, потепление позволило комарам (и заболеваниям, которые они переносят) расширить свой ареал и заселить регионы, где они раньше не встречались. В новых для себя условиях возбудители, переносимые насекомыми, начинают мутировать. В итоге человечество подвергается новому ранее неизвестному заболеванию.
Принцип формирования новых болезней

Грипп – яркий пример мутации вируса вследствие природного и человеческого фактора. Вирус гриппа характеризуется способностью генетически видоизменяться что приводит к развитию пандемий, так как иммунная система большинства людей не способна сопротивляться данному возбудителю.
Случаи ТОРС (SARS) и MERS (очень тяжелые респираторные заболевания) представляют собой еще один пример того, как быстро инфекционные заболевания могут распространяться по всему миру и поражать жителей регионов, для которых эти болезни являются совершенно новыми.
Еще один пример сравнительно нового инфекционного заболевания – ВИЧ. Считается, что впервые люди были инфицированы ВИЧ после тесного контакта с шимпанзе. Возможно, это случилось во время охоты на диких животных в изолированных регионах Африки. Не исключено, что затем ВИЧ распространился из сельских регионов в города, после чего и на другие континенты.
Последние открытия ученых
Candida auris

Candida auris является новым видом грибков, вызывающих инвазивный кандидоз (грибок проникает в кровь, поражает нервную систему, почки, печень, мышцы, суставы, костную ткань, селезенку, глаза). Уникальность этого гриба в том, что он отличается устойчивостью к большинству медпрепаратов. Его сложно обнаружить с помощью классических методов идентификации дрожжевых грибков, так как грибок маскируется под другие виды Candida. Он может выживать на поверхностях даже после обработки сильными дезинфицирующими средствами. Впервые грибок был обнаружен в Японии в 2009 году, но уже в 2016-м он достиг Азии, Европы и США. Очень быстро распространяется в Индии, Пакистане, Южной Африке, Кении, Колумбии и Венесуэле.
Elizabethkingia anophelis
Elizabethkingia anopheles – это новая для ученых бактерия, вызывающая неонатальный менингит. Первый случай болезни, спровоцированный этой бациллой, был зафиксирован в 2016 году в США. Аналогичные случаи были в Центральной Африке и Сингапуре. Из 61 подтвержденного случая инфицирования Elizabethkingia anopheles 21 закончился летально. На сегодня способы передачи и заражения инфекцией малоизучены.
Дисфория
Селфитис
Игровая зависимость
Клавиатурный тендинит
Новые генетические болезни
Российский генетик Надежда Максимова открыла и описала новое генетическое нарушение, которое вызывает смерть малышей. Причина болезни – генные мутации. Последствие – у малышей возникает необратимое нарушение метаболизма, из-за которого продолжительность жизни составляет не более трех лет.
В наши дни известно не меньше 600 болезней, спровоцированных мутацией человеческих генов. Одна из таких – синдром хронического мерцательного кишечного ритма. Болезнь открыта канадскими учеными. У больных одновременно диагностируют замедление сердечного ритма, требующее имплантации кардиостимулятора, и хроническую кишечную непроходимость, требующую полностью перевести пациента на парентеральное питание.
Новые фобии
Какие болезни могут угрожать человеку в ближайшем будущем
Даже самым опытным специалистам трудно с точностью предугадать, какие новые болезни еще могут угрожать человеку в ближайшем будущем, но некоторые опасности выглядят вполне реалистично.
Кишечная палочка, устойчивая к антибиотикам
О возможном возникновении бактерий, устойчивых к антибиотикам, специалисты говорят уже не одно десятилетие. Причиной этого называют злоупотребление антибиотиками как в медицине, так и в животноводстве. Также специалисты не советуют возлагать очень большие надежды на то, что будет разработан новый, более сильный антибиотик. Не существует бесконечного количества соединений, которые могут убивать бактерии, но при этом не вредить человеку. Исследователи из Университета Джорджа Вашингтона предполагают, что резистентная к антибиотикам бактерия E. Coli (кишечная палочка), возможно, и не станет причиной гибели цивилизации, но сделает человечество настолько же уязвимым, как и до открытия антибиотиков.
Смертельные болезни, вызываемые клещами
Болезнь Лайма, передаваемая клещами, уже давно вышла за свои географические рамки. В наши дни заболевание поражает людей даже в тех регионах, где раньше и не знали о его существовании. И с каждым годом ситуация только ухудшается, а возбудители, передаваемые клещами в ближайшем будущем могут мутировать.
Возбудители, которые переносятся москитами
То, что климат на планете меняется, известно каждому. На территориях, которые раньше были известны как засушливые, в последнее время все чаще идут теплые затяжные дожди. Это может привести к миграции москитов на новые земли. Изменение среды обитания комаров может привести к распространению новых заболеваний, вызванных мутировавшими патогенами.
Патогены из арктической вечной мерзлоты
Ученые предполагают, что в вечной мерзлоте хранятся невероятно опасные для человечества возбудители. Кстати, исследователи уже обнаружили в сибирском льду ДНК вируса, возраст которого около 30 тысяч лет. Ученые говорят, что глубокие океанические отложения и вечная мерзлота являются очень хорошими консервантами для микробов и вирусов. Поверхностные слои вечной мерзлоты тают и с каждым годом все быстрее, высвобождая заключенные в вечной мерзлоте микроорганизмы. Если самые опасные из них достигнут поверхности, это может закончиться эпидемией планетарного масштаба.
Заболевания иммунной системы, вызванные наночастицами
Наночастицы представляют собой микроскопические элементы натурального или синтетического происхождения. В наши дни их используют во всем: от фармацевтических препаратов до пищевых красителей. Тем не менее исследования показывают, что они могут непредсказуемо нарушать функции иммунной системы: усиливать ее или наоборот ингибировать. Более того, результаты некоторых исследований показывают, что наночастицы могут разрушать мембрану клеток и вызывать повреждение ДНК.
Специальность: терапевт, нефролог .
Общий стаж: 18 лет .
Образование: 1994-2000 гг. Ставропольская государственная медицинская академия .
Ключевые слова: грипп, COVID-19, пандемия, респираторно-синцитиальная инфекция, дети, лечение, римантадин, альгинат натрия.
Для цитирования: Усенко Д.В., Тхакушинова Н.Х., Шатурина Т.Т. и др. Острые респираторные инфекции и грипп в период пандемии COVID-19 — к чему готовиться в сезоне 2021–2022 гг.? РМЖ. Медицинское обозрение. 2021;5(11):721-727. DOI: 10.32364/2587-6821-2021-5-11-721-727.
D.V. Usenko 1 , N.Kh. Tkhakushinova 2,3 , T.T. Shaturina 2,3 , L.A. Ledenko 2,3 , O.V. Bevzenko 2,3
1 Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Moscow, Russian Federation
2 Kuban State Medical University, Krasnodar, Russian Federation
3 Specialized Clinical Children’s Infectious Hospital, Krasnodar, Russian Federation
This paper discusses the spread of the most common causative agents for respiratory viral infections, i.e., respiratory syncytial virus (RSV) and influenza virus (IV), during seasonal peaks and under the COVID-19 pandemic. The COVID-19 pandemic and epidemic control measures reduced the transmission of some respiratory viral pathogens. The authors specify the risks of changes in RSV epidemiology associated with restrictions and their lifting. Possible scenarios of virus "behavior" in 2021–2022 are represented. These scenarios include the return of variants registered at the end of 2019 and the risk of the emergence of a novel strain of zoonotic flu that may result in a novel viral pandemic. It was demonstrated that effective monitoring of causative agent circulation, timely specific prophylaxis (particularly in high-risk groups), and early effective antiviral therapy are crucial irrespective of the possible scenario of respiratory viral infection. Modern principles of com plex flu and acute respiratory viral infection treatment using an antiviral agent based on rimantadine and sodium alginate are addressed.
Keywords: flu, COVID-19, pandemic, respiratory syncytial infection, children, treatment, rimantadine, sodium alginate.
For citation: Usenko D.V., Tkhakushinova N.Kh., Shaturina T.T. et al. Acute respiratory infections and flu during the COVID-19 pandemic. What to expect in 2021–2022? Russian Medical Inquiry. 2021;5(11):721–727 (in Russ.). DOI: 10.32364/2587-6821-2021-5-11-721-727.
Пандемия новой коронавирусной инфекции (COVID-19) была объявлена ВОЗ 11 марта 2020 г. Ограничительные меры, развернутые с целью сокращения социальных контактов, широкое использование средств индивидуальной защиты, массовое обследование для выявления бессимптомных носителей SARS-CoV-2, развернутое во многих странах, в том числе и в Российской Федерации, позволили существенно снизить темпы распространения инфекции в первом году пандемии [1]. Достаточно быстро стало очевидным, что данные меры не только оказали положительное влияние на распространение SARS-CoV-2, но и значительно снизили циркуляцию других респираторных вирусов. Наиболее существенным явилось сокращение числа случаев гриппа и респираторно-синцитиальной вирусной инфекции с марта 2020 г. как в Северном, так и в Южном полушарии.
Респираторно-синцитиальная инфекция в период пандемии COVID-19
Респираторно-синцитиальный вирус (РСВ) является наиболее частой причиной острых инфекций нижних дыхательных путей в педиатрической популяции: почти 33,8 млн случаев среди детей в возрасте до 5 лет во всем мире, из которых более 3 млн (10%) требуют госпитализаций, а от 66 тыс. до 199 тыс. случаев заканчиваются летальным исходом. Из общего числа госпитализированных по поводу РСВ-инфекции более 40% составляют младенцы младше 2 мес. а 99% смертей происходят в развивающихся странах [2]. Однако РСВ является не только педиатрической проблемой, но и причиной заболеваемости и смертности среди пожилых людей (>65 лет) и пациентов с ослабленным иммунитетом [3].
Респираторно-синцитиальный вирус представляет собой оболочечный одноцепочечный РНК-вирус семейства Pneumoviridae, геном которого кодирует 11 белков, при этом внешние гликопротеины G и F являются основными вирусными антигенами [4]. В Северном полушарии сезон РСВ-инфекции начинается в ноябре и заканчивается в марте с пиками в январе и феврале, а в Южном полушарии он длится с июня по сентябрь. Эпидемические подъемы заболеваемости РСВ-инфекцией обусловлены сложным взаимодействием между климатом, вирусом и хозяином. Низкие температуры стабилизируют липидную оболочку РСВ, высокая влажность способствует осаждению тяжелых капель на поверхности и сохранению жизнеспособности вируса, а длительное пребывание в помещениях больших коллективов людей облегчает передачу РСВ [5, 6]. Факторами, способствующими ежегодным вспышкам РСВ-инфекции, является всеобщая восприимчивость, а также циркуляция в когортах наиболее восприимчивых лиц, что обеспечивает сохранение вируса в межсезонье.. Так, низкие концентрации РСВ могут выявляться в течение всего года у взрослых с хронической обструктивной болезнью легких (ХОБЛ) [7]. РСВ выявлялся в течение всего года также у детей с иммунодефицитными состояниями [8]. Эти резервуары РСВ обеспечивают непрерывную, низкоуровневую и бессимптомную репликацию вируса, которая при благоприятных климатических факторах вызывает местные эпидемии.. Одновременное выделение различных штаммов РСВ в отдаленных географических областях подтверждает гипотезу о том, что эпидемии обусловлены локально распространяющимися вариантами вируса, а не распространением одного вида между смежными районами [9].
Известно, что почти все дети переносят первую и наиболее тяжелую РСВ-инфекцию в возрасте до 2 лет, а в более позднем возрасте переносят заболевание в более легкой форме [10]. Основной причиной, объясняющей повторное инфицирование РСВ, является слабый и непродолжительный иммунный ответ: у младенцев иммунная система все еще развивается, а незрелость врожденного ответа может привести к недостаточному адаптивному ответу и неполноценной иммунологической памяти [11]. Наличие материнских антител IgG к РСВ у новорожденных и младенцев может быть очень важным фактором, но их роль все еще остается спорной. Присутствие антител IgG к РСВ у младенцев может влиять на вирус-индуцированную иммуногенность, но, с другой стороны, трансплацентарный перенос защитных материнских антител может помочь предотвратить тяжелые заболевания у младенцев [12, 13].
Разумно предположить, что ограничительные меры, принятые для уменьшения распространения SARS-CoV-2, повлияли на другие респираторные вирусы со схожими путями заражения. Основными вмешательствами на глобальном уровне были изоляция дома, социальное дистанцирование, а также гигиена рук и обязательное ношение масок для лица.. Все эти мероприятия способствуют снижению передачи РСВ аэрозольным путем, а также контактным — через грязные руки и предметы обихода.. Как в Европе, так и в Австралии было выявлено лишь несколько случаев инфицирования РСВ даже после отмены ограничительных мер, когда сохранялись только требования к социальному дистанцированию, мытью рук и обязательному ношению масок для лица. Роль закрытия школ в снижении частоты респираторных инфекций противоречива. Данные из США, где ведется активный контроль распространения РСВ, показали, что открытие школ не было связано с увеличением числа инфицированных РСВ [14, 15]. Аналогичные данные поступили из Финляндии, где уровень РСВ-инфекции оставался низким даже после открытия школ и детских садов весной 2020 г. Объяснение этого явления могло заключаться в том, что даже когда дети возвращались в школу, гигиена рук и социальное дистанцирование сохранялись.. Кроме того, детям с легкими респираторными симптомами (например, ринитом) было запрещено посещать школу, что снижало возможную циркуляцию вирусов, отличных от SARS-CoV-2. Более того, в отличие от риновируса, здоровые дети школьного возраста не являются основным резервуаром РСВ, обнаруживаемого круглый год только у взрослых с ХОБЛ или у детей с иммунодефицитом [16, 17]. Среди других факторов, способствующих снижению частоты выявления РСВ, может быть вирусная интерференция, описанная ранее при взаимодействии между вирусом гриппа и другими респираторными вирусами, и аналогичный процесс мог произойти между SARS-CoV-2 и РСВ [18]. Эта гипотеза подтверждается низким уровнем коинфекции SARS-CoV-2 и другими респираторными вирусами [19]. В отсутствие эпидемий крайне важно оценить, распространяется ли РСВ между бессимптомными резервуарами. Аналогичное снижение инфицирования было обнаружено и для вируса гриппа, что подтверждает, что ограничительные меры повлияли на респираторные вирусы с аналогичными путями заражения. Риновирус, однако, подвергался меньшему влиянию ограничений, и в последнее время сообщалось о росте его выявляемости в разных странах, что может быть, в частности, обусловлено безоболочечной структурой вируса, которая не изменяется при мытье рук, и наличием резервуаров среди детей.
Данные о распространенности РСВ в 2020–2021 гг. в Российской Федерации в целом совпадают с динамикой в других странах Старого и Нового Света (рис.. 1). В период ежегодного сезонного подъема заболеваемости ОРВИ доля РСВ варьировала от 3% до 6,2%. Введение локдауна 25.03.2020 совпало с сезонным снижением заболеваемости РСВ. Последующие 1,5 года наблюдения демонстрируют низкий уровень циркуляции возбудителя — в осенне-зимне-весенний период 2020–2021 гг. доля положительных результатов обследования методом ПЦР на наличие РНК РСВ не превышала 1,1%.
![Рис. 1. Динамика доли РСВ в структуре ОРВИ в 2020–2021 гг. по данным ПЦР-диагностики в базовых лабораториях двух национальных центров по гриппу ВОЗ в РФ (по [20]) Fig. 1. Changes in the proportion of RSV among ARIs in 2020-2021 based on PCR performed in b](https://www.rmj.ru/upload/medialibrary/953/721-1.jpg)
Какими бы ни были причины исчезновения РСВ в 2020 г., последствия в будущем могут быть непростыми. В Российской Федерации уже в осеннем сезоне 2021 г. частота обнаружения РСВ выросла до 4–6%, увеличилась и частота тяжелых форм РСВ-инфекции у госпитализируемых детей, что свидетельствует об активизации эпидемического процесса.. По данным D.A. Foley et al. [21], в Австралии средний возраст инфицированного РСВ населения (18,4 мес.) стал значительно выше, чем в предыдущие эпидемические сезоны. В этой публикации подчеркивается риск будущих изменений в эпидемиологии РСВ и возможность возникновения масштабных эпидемий, когда ограничительные меры будут отменены.. Снижение передачи РСВ приведет к увеличению восприимчивой когорты детей. Младенцы, рожденные от матерей, у которых не укрепился иммунитет к РСВ, не будут защищены. Таким образом, существует риск того, что, когда РСВ снова будет активно циркулировать, как в Западной Австралии, он обнаружит большую когорту иммунологически наивных людей и вызовет серьезные эпидемии. Согласно предсказаниям математической модели, чем дольше меры контроля будут сдерживать распространение РСВ, тем масштабнее будут эпидемии в будущем [22]. С учетом высокой смертности от РСВ-инфекции не только среди младенцев, но и среди пожилых людей необходимы усилия для предотвращения глобальной эпидемии РСВ-инфекции в будущем [23].
Грипп в период пандемии COVID-19
Современные принципы противовирусной терапии гриппа и ОРВИ

Препараты — ингибиторы нейраминидазы, осельтамивир и занамивир, эффективны только при инфекции вируса гриппа. Их раннее применение (в первые 48 ч от начала заболевания) способствует достоверному сокращению продолжительности всех основных симптомов гриппа. Осельтамивир разрешен к применению детям в возрасте старше 1 года, занамивир применяется в виде ингаляции через дискхалер в возрасте старше 5 лет. Препарат противопоказан лицам с бронхиальной астмой и при наличии бронхообструкции в анамнезе.
Одной из актуальных проблем противовирусной терапии респираторных инфекций является резистентность циркулирующих штаммов.. В настоящее время мониторинг ведется лишь в отношении вируса гриппа. Было установлено, что с ноября 2007 г. по март 2009 г. доля осельтамивир-резистентных штаммов среди подтипа H1N1 выросла до 100%, а доля штаммов, резистентных к адамантановым препаратам, достигала 90–100%. Однако появление в циркуляции пандемического штамма A(H1N1)pdm09 вытеснило осельтамивир-резистентные вирусы.
Одним из решений проблемы резистентности вируса гриппа к адамантановым препаратам (амантадин, римантадин) явилась их комбинация с альгинатом натрия, что позволило добиться как прямого противовирусного, так и интерферон-индуцирующего действия, активирующего неспецифическую противовирусную защиту, а также существенно снизить токсичность. В свете последних методических рекомендаций данный подход представляется оправданным, учитывая неспецифичность клинических проявлений респираторных инфекций различной этиологии. Полимерный препарат Орвирем ® (римантадин + альгинат натрия), разрешенный детям с 1 года, обладая свойствами римантадина, способствует подавлению репродукции вирусов гриппа типа А, РСВ и вирусов парагриппа, возбудителей краснухи и кори, а также гриппа типа В и коронавирусной инфекции [31, 32]. В оригинальных исследованиях было показано, что использование пептидов и некоторых других биологических молекул, введенных в адамантановый карбоцикл методами пептидного синтеза, может в значительной мере расширить поиск наиболее подходящего блокатора канала М2 вируса гриппа, тем самым решая проблему преодоления резистентности вирусов гриппа к адамантанам [33]. Полимерная форма противовирусного препарата на основе римантадина в сочетании с альгинатом натрия в виде сиропа позволяет значительно расширить спектр его фармакологических свойств, поскольку включенный в его состав альгинат натрия — низкомолекулярный модифицированный полисахарид, обладает иммуномодулирующими, адсорбирующими и дезинтоксикационными свойствами и дает возможность применять препарат при ОРВИ различной этиологии, способствуя усилению антитоксической активности и более продолжительной (в десятки раз), чем у римантадина, циркуляции в плазме крови [34].
Как было показано при изучении лечебной эффективности комбинации римантадина и альгината натрия, у пациентов с ОРВИ на 2-й день приема препарата имело место достоверное повышение содержания спонтанного и сывороточного IFN-α и -γ, а также (в 1,5 раза) активности их индуцированной продукции [35]. Указанная фармакологическая форма обеспечивает постепенное поступление препарата в кровь, пролонгированную циркуляцию в организме и создание постоянной концентрации препарата в крови. Это позволяет уменьшить дозировку и, следовательно, значительно сократить риск развития нежелательных явлений, определив его хорошую переносимость и высокую комплаентность.. Показана способность комбинации римантадина и альгината натрия оказывать лечебное действие не только при гриппе, но и при других ОРВИ, что было доказано и при лечении детей, в том числе раннего возраста (≥1 года) [36–38].
В настоящее время в качестве перспективной рассматривается комбинированная противовирусная терапия ОРВИ с использованием препаратов, обладающих разными механизмами и точками приложения противовирусного действия.
Заключение
Таким образом, острые респираторные инфекции в период пандемии COVID-19 не потеряли своей актуальности.. Регистрируемый сегодня сезонный подъем заболеваемости РСВ, в том числе в старших возрастных группах, — наглядный тому пример.. В отношении активности вируса гриппа в настоящее время возможны различные сценарии. Однако очевидно, что ключевым фактором успешности лечебных мероприятий является ранняя противовирусная терапия, направленная на различные этапы жизненного цикла респираторных вирусов, и оптимизация иммунологической реактивности.
Благодарность
Acknowledgment
The authors and Editorial Board are grateful to LLC Zentiva Pharma for providing full-text foreign articles required to write the review.
Сведения об авторах:
Усенко Денис Валериевич — д.м.н., ведущий научный сотрудник клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, заведующий образовательным центром; Россия, 111123, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0001-5232-7337.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует..
Статья поступила 23.08.2021.
Поступила после рецензирования 15.09.2021.
Принята в печать 08.10.2021.
About the authors:
Denis V. Usenko — Dr. Sc. (Med.), leading researcher of the Clinical Division of Infectious Disorders, Head of the Educational Center, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0001-5232-7337.
Nafiset Kh. Tkhakushinova — Dr. Sc. (Med.), Head of the Department of Children’s Infectious Disorders, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; Head Doctor, Specialized Clinical Children’s Infectious Hospital; 6/5, Krasnykh Partizan str., Krasnodar, 350012, Russian Federation; ORCID iD 0000-0002-1447-275х..
Tamara T. Shaturina — postgraduate student of the Department of Children’s Infectious Disorders, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; pediatrician, Head of the Organizational and Methodical Department, Specialized Clinical Children’s Infectious Hospital; 6/5, Krasnykh Partizan str., Krasnodar, 350012, Russian Federation; ORCID iD 0000-0002-1010-8272.
Larisa A. Ledenko — assistant of the Department of Children’s Infectious Disorders, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; Deputy Head Doctor for Medical Work, Specialized Clinical Children’s Infectious Hospital; 6/5, Krasnykh Partizan str., Krasnodar, 350012, Russian Federation; ORCID iD 0000-0002-2023-6382.
Oleg V. Bevzenko — C. Sc. (Med.), associate professor of the Department of Children’s Infectious Disorders, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; Deputy Head Doctor for Organizational and Methodical Work, Specialized Clinical Children’s Infectious Hospital’ 6/5, Krasnykh Partizan str., Krasnodar, 350012, Russian Federation; ORCID iD 0000-0002-0275-9817.
There is no conflict of interests.
Received 23.08.2021.
Revised 15.09.2021.
Accepted 08.10.2021.
Читайте также:

