Что такое экспериментальная инфекция
Обновлено: 22.04.2024
ГОНОРЕЯ — ГОНОРЕЯ. Содержание: Исторические данные. 686 Биология гонококка в организме. 6 87 Клинический иммунитет и реиифекция. 689 Лабораторный диагноз Г. 690 Г. как общее заболевание. 695 Общая патология… … Большая медицинская энциклопедия
ТУБЕРКУЛЕЗ — ТУБЕРКУЛЕЗ. Содержание: I. Исторический очерк. 9 II. Возбудитель туберкулеза. 18 III. Патологическая анатомия. 34 IV. Статистика. 55 V. Социальное значение туберкулеза. 63 VІ.… … Большая медицинская энциклопедия
ИММУНИТЕТ — ИММУНИТЕТ. Содержание: История и современ. состояние учения об И. . 267 И. как явление приспособления. 283 И. местный. 285 И. к животным ядам. 289 И. при протозойн. и спирохета, инфекциях . 291 И. к… … Большая медицинская энциклопедия
СЫПНОЙ ТИФ — СЫПНОЙ ТИФ. Содержание: Экспериментальный С. т. 182 Сыпнотифозный вирус. 185 Пути и способы распространения С. т. 188 Специфическая профилактика и серотерапия Ст. 192 Статистика и географическое… … Большая медицинская энциклопедия
ХИМИОТЕРАПИЯ — (Cheraotherapie, Chimiothe rapie), учение о закономерностях терап. воздействия на инфекционный (инвазионный, онкологический) процесс при помощи химически определенных веществ, обладающих специфическим сродством к возбудителю б ни (или ж ставшей… … Большая медицинская энциклопедия
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
Болезнь — I Болезнь (morbus) состояние организма, характеризующееся повреждением органов и тканей в результате действия патогенных факторов, развертыванием защитных реакций, направленных на ликвидацию повреждений; обычно сопровождается ограничением… … Медицинская энциклопедия
Список научных журналов ВАК Минобрнауки России c 2011 года — Это служебный список статей, созданный для координации работ по развитию темы. Данное предупреждение не ус … Википедия
КОКЛЮШ — КОКЛЮШ, (pertussis, tussis convulsiva), острая инфекционная б нь, характеризующаяся своеобразным судорожным кашлем и циклическим течением. Первое упоминание о К. относится к 1578 г., когда эпидемия К. с огромной смертностью имела место в Париже и … Большая медицинская энциклопедия
11. Биологический (экспериментальный) метод исследования, этапы, оценка. Лабораторные животные. Способы заражения.
Инфекционный процесс может быть искусственно воспроизведен путем заражения лабораторных животных: кроликов, морских свинок, белых крыс и мышей др.
Экспериментальное заражение животных проводится для:
изучения патогенности и вирулентности микроорганизмов;
выделения чистой культуры возбудителя из различных материалов;
воспроизведения экспериментальной инфекции;
испытания лечебного действия терапевтических препаратов и т.д.
Перед началом опыта животных отбирают, взвешивают и маркируют. Заражают животных накожно, внутрикожно, подкожно, внутримышечно, внутривенно, перорально, интраназально, интрацеребрально и внутрибрюшинно.
Бактериологическое исследование трупов животных
Для обнаружения микроорганизма, вызвавшего гибель животного, определение его локализации в организме и выделения чистой культуры возбудителя производят вскрытие зараженного животного сразу после гибели, соблюдая правила асептики. Данные вскрытия трупа протоколируют. Для приготовления мазков-отпечатков вырезают из печени, селезенки, почек небольшие кусочки ткани, берут их пинцетом и прикасаются к предметному стеклу поверхностью среза. Мазки-отпечатки фиксируют и окрашивают по Грамму. При микроскопии отмечают присутствие микроорганизмов в различных органах и тканях. При необходимости делают посевы из этих органов на питательные среды.
Понятие об инфекции, инфекционном процессе, инфекционной болезни.
Условия возникновения инфекционной болезни, ее особенности.
Роль микроорганизма в инфекционном процессе. Патогенность и вирулентность. Единицы измерения вирулентности.
Свойства микроорганизма, характеризующие его вирулентность.
Генетика патогенности и вирулентности.
Токсины бактерий. Свойства экзо- и эндотоксинов.
Понятие об инфицирующей (критической) дозе.
Пути распространения микробов по организму. Типы генерализованных инфекционных процессов.
Динамика инфекционного процесса.
Формы проявления инфекции.
Экспериментальный (биологический) метод исследования. Вскрытие трупов зараженных животных. Бактериоскопическое и бактериологическое исследование трупного материала
Лекция 7 Основы учения об инфекции
Выделяют 3 участника инфекционного процесса:
микроорганизм (его качество и количество определяет возникновение и специфичность инфекционного процесса);
макроорганизм (определяет его степень восприимчивости к данному инфекционному агенту);
факторы внешней среды (биологические и социальные; опосредованно влияют на микроорганизм и макроорганизм).
С биологической точки зрения инфекционный процесс ― проявление эволюционно-сложившегося взаимодействия между микро- и макроорганизмом, симбиоз (сожительство).
Несколько проявлений симбиотических взаимоотношений:
мутуализм ― оба сожителя не причиняют вреда друг другу, а наоборот приносят пользу (например, клубеньковые бактерии и бобовые растения); это взаимовыгодное сожительство;
комменсализм ― один из сожителей живет за счет другого, но не приносит ему вреда (например, нормальная микрофлора всех естественных биотопов организма человека);
истинный паразитизм ― один организм живет за счет другого и приносит ему вред.
Паразитизм возник, развивался и совершенствовался в процессе эволюции микроорганизмов.
Ступени эволюции паразитизма:
3 млрд. лет тому назад появились вначале сапрофиты (sapros ― гнилой, питаются мертвыми остатками);
они стали осваивать новые экологические ниши и стали полупаразиты и полусапрофиты (например, E. coli);
появились истинные организменные паразиты (C. diphtheriae ― существует только в организме);
факультативные внутриклеточные паразиты ― могут существовать в клетке и вне ее (возбудитель гонореи, менингококки);
облигатные внутриклеточные паразиты (риккетсии, хламидии, вирусы).
Роль микроорганизма в инфекционном процессе
Инфекционный процесс может вызвать только патогенный или условно-патогенный микроорганизм (patos ― страдание, genes ― рождающий).
Патогенность (болезнетворность) ― потенциальная способность микроорганизма вызывать инфекционный процесс у чувствительного к нему человека (животного).
Патогенность ― это видовой признак микроорганизма, генетически детерминированный. Этот признак отражает потенциальную способность микроорганизма проникать в макроорганизм (инфективность), размножаться и распространяться в нем (инвазивность), вызывая комплекс патологических реакций, возникающих при заболевании.
Условно-патогенные микроорганизмы ― это микроорганизмы, которые вызывают инфекционный процесс только при определенных условиях:
при попадании их в необычные биотопы (например E. coli в кровь),
при снижении реактивности макроорганизма.
Патогенность может быть реализована или нет. Это зависит от вирулентности.
Вирулентность ― мера патогенности, ее фенотипическое проявление.
Вирулентность имеет свои качественные и количественные характеристики. Это индивидуальный, а не видовой признак (молодые колонии ― более вирулентны, старые и R-формы колоний ― менее вирулентны);
Ослабление вирулентности микроорганизмов впервые было предпринято Луи Пастером (созданы живые вакцины против куриной холеры, сибирской язвы, бешенства). Целенаправленное ослабление вирулентности ― аттенуация.
Количественная характеристика вирулентности выражается дозами:
Dlm (Dosis letalis minima) ― минимальная смертельная доза ― количество микроорганизма (токсина), которое при введении чувствительному лабораторному животному в стандартных условиях вызывает гибель 95% животных через определенный срок;
LD50 ― количество возбудителя, которое вызывает гибель подопытных животных чувствительных видов в 50% случаев;
Dcl (Dosis certa letalis) ― абсолютно смертельная доза, гибель животных в 100% случаев;
ID (инфицирующая доза) ― количество возбудителя, способное вызвать инфекционный процесс в явной форме (т.е. инфекционное заболевание).
Факторы вирулентности (патогенности) микроорганизмов:
подвижность микроорганизма и хемотаксис;
адгезия и колонизация;
продукты метаболизма микроорганизмов;
продукты распада самих тканей организма под действием микроорганизмов.
Подвижность микроорганизма и хемотаксис ― позволяет микроорганизму пройти через защитные барьеры организма (холерный вибрион ― через кислое содержимое желудка).
Адгезия и колонизация
Адгезивность ― способность микроорганизмов адсорбироваться на чувствительных рецепторах клеток и расселяться по поверхностям клеток (т.е. колонизировать их). Этот специфический процесс связан с наличием комплементарных рецепторов со стороны микроорганизма и клетки хозяина.
У бактерий функцию факторов адгезии (адгезинов) выполняют пили, фимбрии, жгутики, компоненты клеточной стенки (пептидогликан, тейхоевые кислоты Гр+ бактерий, липополисахаридный слой Гр- бактерий). Уникальное строение адгезинов, свойственное определенным видам микроорганизмов, обуславливает высокую специфичность данного процесса. Этим объясняется способность одних микроорганизмов прикрепляться и колонизировать эпителий дыхательных путей, других ― кишечного тракта, третьих ― мочевыделительной системы и т.д.
Инвазия
Инвазивность ― способность микроорганизмов проникать в клетку ― пенентрация, ткань, размножаться и распространяться по организму, преодолевая тканевые и межтканевые барьеры.
Эту функцию выполняют ферменты инвазивности, которые входят в группу факторов/ферментов агрессии. К этим ферментам относятся: гиалуронидаза (расщепляет гиалуроновую кислоту соединительной ткани), нейраминидаза (расщепляет сиаловую кислоту), фибринолизин (растворяет сгустки фибрина), коллагеназа и другие.
Агрессия
Агрессивность ― это способность микроорганизмов противодействовать защитным силам организма. Факторами агрессии являются:
структурные компоненты микроорганизма (капсула ― защищает микроорганизм от фагоцитоза; липополисахаридный слой клеточной стенки Гр- микроорганизмов; пептидогликан, тейхоевые кислоты Гр+ бактерий);
протеины ― угнетают фагоцитоз: например, протеин А ― у стафилококков, протеин М ― у стрептококков;
поверхностные антигены (V и W-антигены у иерсиний чумы, Vi-антиген у S.Typhi, капсульный антиген у многих бактерий);
у C. diphtheriae и M. tuberculosis ― корд-фактор (токсический гликолипид);
у возбудителя сифилиса ― мукополисахаридный капсулоподобный чехол.
К факторам агрессии также относятся ферменты агрессивности: плазмокоагулаза (свертывает плазму крови), лецитовителлаза (лецитиназа) (расщепляет лецитин, содержащийся в оболочке клеток), ДНК-аза (вызывает деполимеризацию ДНК), протеаза (разрушает АТ), фибринолизин, фосфатаза.
Токсины микроорганизмов
Токсигенность ― способность микроорганизмов продуцировать экзотоксины (токсигенные микроорганизмы).
Токсичность ― это способность микроорганизмов продуцировать эндотоксины (токсичные микроорганизмы).
Сравнительная характеристика бактериальных токсинов
Экзотоксины
Эндотоксины
- продукты жизнедеятельности живых клеток
- действуют спустя латентный период
- обладают строгой специфичностью действия (поражают определенные органы и ткани)
- превращаются в анатоксины (т.е. под действием формалина токсин утрачивает свою ядовитость, сохраняя при этом иммуногенные свойства)
- полностью нейтрализуются антителами-антитоксинами
- продукты разрушения клеток
- липополисахаридный слой клеточной стенки грамотрицательных микроорганизмов
- действуют однотипно (оказывают общетоксическое действие)
- в анатоксины не переходят
- нейтрализация антителами неполная
Типы токсинов по механизму действия:
цитотоксины ― блокируют синтез белка (в клетке) на субклеточном уровне. Включают следующие группы: антиэлонгаторы, энтеротоксины, дермонекротоксины.
мембранотоксины ― повышают проницаемость мембран эритроцитов (гемолизины) и лейкоцитов (лейкоцидины), разрушая их.
функциональные блокаторы ― блокируют функции определенных тканевых систем. Этот тип токсинов включает: термолабильные и термостабильные энтеротоксины, токсиноблокаторы, нейротоксины.
эксфолиатины и эритрогенины ― влияют на процесс взаимодействия клеток между собой и межклеточными веществами. Эксфолиатины образуются некоторыми штаммами Staphylococcus aureus, эритрогенины ― Streptococcus pyogenes.
Экзотоксины ― продукты жизнедеятельности микробной клетки. Их продуцируют как Гр+, так и Гр- микроорганизмы.
Часто экзотоксины синтезируются в бактериальных клетках в виде неактивных предшественников ― протоксинов. Активация токсина путем протеолиза может осущестляться либо собственной бактериальной протеазой, либо протеазами макроорганизма. Такой тип экзотоксинов синтезируют Cl. tetani и Cl. botulinum.
Некоторые микроорганизмы продуцируют и экзо- и эндотоксины (например, энтеротоксигенные кишечные палочки).
Продукты метаболизма микроорганизмов, токсически действуют на организм. Выделяют 2 рода таких продуктов:
1) первично поражают клетки макроорганизма;
2) вызывают образование вторичных токсических продуктов после повреждения клеток, которые опосредовано действуют на макроорганизм ― например, микробная уреаза разлагает мочевину, образуется NH3.
Продукты распада самих тканей организма под действием микроорганизмов также оказывают токсическое действие на организм.
Особенности генетического контроля синтеза факторов патогенности бактерий
У бактерий обнаружены три типа генов, осуществляющих контроль синтеза факторов патогенности:
1) гены собственной хромосомы, контролируют:
образование пилей общего типа, участвующих в адгезии;
синтез ферментов ― гиалуронидазы и нейраминидазы, участвующих в инвазии;
М-протеин пиогенного стрептококка;
хромосомные tox-гены контролируют синтез холерогена у холерного вибриона, эксфолиативного токсина золотистого стафилококка, энтеротоксина Cl. perfringens.
2) гены, привнесенные плазмидами (Ent-плазмида ― обеспечивает синтез энтеротоксина у энтеротоксигенных штаммов E. coli; Hly-плазмида ― синтез гемолизина).
3) гены, привнесенные умеренными конвертирующими фагами (напр., синтез экзотоксина у C.diphtheriae контролируется привнесенными tox-генами коринефага).
Роль макроорганизма в инфекционном процессе.
Восприимчивость ― это генетически детерминированный признак, это способность реагировать на внедрение микроорганизма развитием инфекционного процесса; связана с реактивностью клеток.
Резистентность ― это устойчивость организма, которая обуславливается неспецифическими факторами антиинфекционной защиты. Факторы, ослабляющие защитные функции организма, способствуют распространению инфекции, а повышающие резистентность ― препятствуют ей.
Инфекционное заболевание ― одна из фаз развития инфекционного процесса (терминальная фаза), его крайняя степень проявления.
Особенности инфекционных заболеваний
1.Этиологичность (каждое инфекционное заболевание вызывается определенным возбудителем).
2. Контагиозность (заразность, заразительность).
3. Эпидемичность (тенденция к распространению). Могут быть:
спорадические заболевания ― единичные случаи заболевания в данном регионе;
эпидемии ― вспышки заболевания разного масштаба;
пандемии ― заболевание распространяется на обширные территории.
4. Специфичность локализации в определенных органах и тканях.
5. Специфичность механизмов передачи.
Механизм передачи ― способ перемещения возбудителя из зараженного организма в восприимчивый.
Факторы передачи ― элементы внешней среды, обеспечивающие перенос возбудителя из одного организма в другой (вода, пища, воздух, живые членистоногие, предметы окружающей обстановки).
Пути передачи ― конкретные элементы внешней среды или их сочетания, обеспечивающие попадание возбудителя из одного организма в другой в определенных внешних условиях.
Изучено влияние транслокации культивируемых и некультивируемых бактерий на развитие инфекционного процесса на фоне ожоговой болезни у кроликов породы шиншилла. Проведены клинические наблюдения и микробиологические исследования по выявлению циркуляции микробных популяций в организме экспериментальных животных после подкожного введения кроликам культивируемых и некультивируемых бактерий Pseudomonas aeruginosa и Staphylococcus aureus на фоне ожоговой травмы. Для заражения животных использовали смесь бактерий P. aeruginosa и S. aureus в концентрации 105 степени микробных клеток. Выявлены различия в клиническом течении ожоговой болезни в результате циркуляции в организме животных культивируемых и некультивируемых бактерий P. aeruginosa, а также транслокации E. coli из кишечника животных во внутренние органы, проявляющиеся, прежде всего, в сроках развития инфекционного процесса с летальным исходом. Наблюдалась транслокация бактерий из подкожных локусов и кишечника животных. Культивируемые бактерии вызывали гибель лабораторных животных на 12–14 сутки, а некультивируемые бактерии – в течение первых четырех суток с признаками поражения головного мозга. Выявленные сроки транслокации бактерий определяют тактику проведения лечебно-профилактических мероприятий у больных с тяжелой термической травмой.

1. Алексеев А.А. Актуальные вопросы организации и состояние медицинской помощи пострадавшим от ожогов в Российской Федерации / А.А. Алексеев, В.А. Лавров // II съезд комбустиологов России, 2-5 июня 2008 г.: сб. науч. тр. – М., 2008. – С. 3–5.
2. Алексеев А.А. Проблемы организации и состояние специализированной помощи обожженным в России / А.А. Алексеев, В.А. Жегалов, А.А. Филимонов, В.А. Лавров // Мат. I съезда комбустиологов России. – М., 2005. – С. 3–4.
3. Спиридонов Т.Г. Патогенетические аспекты лечения ожоговых ран // Рус. мед. журн. – 2002. – Т. 10, № 8–9. – С. 395–399.
4. Шаповал, С.Д. Выраженность печеночной недостаточности у больных сепсисом и ее коррекция в системе комплексного лечения // Вестник морской медицины. – 2001. – № 2(14). – С. 23–29.
5. Campbell, M.S. Real-time PCR analysis of Vibrio vulnificus from oysters / M.S. Campbell, A.C. Wright //Appl. Environ. Microbiol. – 2003. – Vol.69. – № 12. – Р. 7137–7144.
6. Алексеев, А.А. Актуальные вопросы организации и состояние медицинской помощи пострадавшим от ожогов в Российской Федерации / Алексеев А.А., Лавров В.А. // II съезд комбустиологов России 2–5 июня 2008 года: сб. науч. трудов. – М., 2008. – С. 3–5.
7. Ашкрафт, К.У. Детская хирургия: пер. с англ. Т.К. Немиловой / К.У. Ашкрафт, Т.М. Холдер. – СПб., Хардфорд, 1996. – 1 т. – 384 с.
10. Карпова, Л.С. Значение гетерогенности респираторно – сиинтиальных вирусных популяций в развитии эпидемиологического процесса / Л.С. Карпова, Т.И. Орлова, Т.И. Карпухин // Журн. микробиологии, эпидемиологии и иммунобиологии. – 1986. – № 4. – С. 67–74.
11. Лейдерман, И.Н. Синдром полиорганной недостаточности, метаболические основы // Вестн. интенсив, терапии. – 1999. – № 2. – С. 5–10.
12. Антонов А.Г. Байбарина Е.Н., Соколовская Ю.В. Объединенные диагностические критерии сепсиса у новорожденных // Вопросы гинекологии, акушерства и перинатологии. – 2005. – Т.4. – № 5–6. – С. 113–115.
14. Самсыгина Г.А. Антибактериальная терапия сепсиса у детей. Лекции по педиатрии. – М.: Медицина, 2005. – 524 с.
15. Самсыгина ГА. Дискуссионные вопросы классификации, диагностики и лечения сепсиса в педиатрии // Педиатрия. – 2003. – № 5. – С. 35–45.
16. Разина А.В. Влияние различных вариантов общей анестезии и операционной травмы на организм: автореф. дис. …канд. ветерен., наук. – Троицк, 2010. – 26 с.
17. Устройство для фиксации перевязочного материала на ожоговой поверхности экспериментального животного: пат. 133721 Рос.Федерации МПК А61D 3/00. Козлов Л.Б. с соавт.; патентообладатель Сахаров С.П., Козлов Л.Б, заявка № 2013119319 от 26.04.2013; опубл. 27.10.2013. Бюл. № 30.
18. Определитель бактерий Берджи. В 2-х т. пер. с англ. / под ред. Дж. Хоулта, Н.Крига, П. Снита, Дж. Стейли, С. Уилльямс. – М.: Мир, 1997. – Т. 1. – 432 с.; Т. 2 – 368 с.
19. Способ выделения некультивируемых бактерий стафилококка: пат. 2470074 Рос. Федерации МПК C12Q 1/04/ Козлов Л.Б. с соавт.; заявитель и патентообладатель Козлов Л.Б., Санников А.Г. – № 2011146052/10; заявл. 14.11.2011; опубл.20.12.2012. , Бюл. № 35.
21. Устройство для проведения экспериментов на кроликах: пат. 132314 Рос. Федерации МПК А01К 1/03/ Козлов Л.Б. с соавт.; патентообладатель Сахаров С.П., Козлов Л.Б, заявка № 2013119320 от 26.04.2013; опубл.20.09.2013. Бюл. № 26.
22. Алексеев, А.А. Ожоговая инфекция. Этиология, патогенез, диагностика и лечение: монография / А.А. Алексеев, М.Г. Крутиков, В.П. Яковлев – М.: Вузовская книга, 2010. – 416 с.
23. Гординская, Н.А. Значение микробиологического мониторинга в реабилитации тяжелообожженных / Н.А. Гординская, С.И. Пылаева, Е.В. Сабирова, Н.В. Абрамова // II съезд комбустиологов России 2–5 июня 2008 года: сб. науч. трудов. – М., 2008. – С. 82–83.
24. Роль факторов персистенции и вирулентности при микроэкологических изменениях в организме человека / Б.Я. Усвяцов и др. // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2006. – № 4. – С. 58–62.
26. Козлов, Л.Б. Роль микробных ассоциаций в инфекционной патологии человека/ Л.Б. Козлов, С.П. Сахаров, Е.В. Диц // Фундаментальные исследования. – 2013. – № 9. – С. 366–370.
27. Ожоговый сепсис: особенности развития и ранней диагностики / И.В. Шлык. Ю.С. Полушин, К.М. Крылов и др. // Вестник анестезиологии и реаниматологии. – 2009. – Т. 6. – № 5. – С. 14–24.
28. Хрулев С.В. Ожоговая травма с церебральными осложнениями у взрослых и детей: автореф. дис. … канд. мед. наук. – Нижний Новгород, 2009. – 30 с.
В общей структуре травматизма по данным ВОЗ ожоги занимают третье место в мире. Ежегодно в развитых странах регистрируется 290–300 ожогов на 100 тыс. населения. В Российской Федерации ежегодно около 500 тыс. населения получают ожоги, в том числе 29–46 % из них нуждаются в госпитализации [1, 2, 3], в 5–7 % случаев причиной гибели пациентов является патология головного мозга [4, 5]. Удельный вес детей, пострадавших от термической травмы, составляет 13,8–75,3 % с высоким процентом летальности [6, 7, 8, 9, 10, 11]. Одной из основных причин высокой летальности при ожоговой болезни является возникновение генерализованной инфекции с последующим развитием полиорганной недостаточности [12, 13, 14, 15].
В связи с развитием полиорганного патологического процесса, отсутствием единой тактики лечения инфекционных осложнений, возникающих при ожоговой болезни, возникает необходимость более детального изучения влияния патогенной и условно патогенной микрофлоры на развитие патологического процесса при ожоговой болезни и совершенствования методов лечения пациентов с тяжелой термической травмой.
1. В опытах на кроликах породы шиншилла выявить особенности течения инфекционного процесса, вызванного культивируемыми и некультивируемыми бактериями P. aeruginosa и S. aureus, на фоне ожоговой травмы, на основании клинических, микробиологических и гистологических исследований.
2. На модели экспериментальных животных, кроликов породы шиншилла, изучить влияние динамики транслокации культивируемых и некультивируемых бактерий на развитие инфекционного процесса.
3. Выявить особенности патологических изменений в организме лабораторных животных, вызванных культивируемыми и некультивируемыми бактериями на фоне ожоговой травмы.
Материалы и методы исследований
Динамику транслокации микробных популяций изучали в организме кроликов породы шиншилла. Под наблюдением находилось 2 группы животных по 16 кроликов в каждой группе. Одной группе животных на фоне ожоговой травмы вводили подкожно смесь культивируемых бактерий P. aeruginosa и S. aureus в концентрации 105 степени микробных клеток, а другой – некультивируемые бактерий P. aeruginosa и S.aureus в такой же концентрации. После предварительного наркоза по методике, предложенной А.В. Разиной [16], животным наносили термическую травму. Поверхность спины и боковые поверхности туловища кроликов погружали в водяную баню на 10 с при температуре 90 °С. Кролики получали ожоговую травму со степенью поражения IIIАБ. На ожоговой поверхности кроликов фиксировали перевязочный материал [17]. Средняя масса тела кроликов в исследуемых группах животных составила 2262,5 ± 28,4 и 2386,7 ± 48,5 грамм, а ожоговая поверхность – 15,98 ± 0,53 и 17,29 ± 0,4 % площади поверхности тела соответственно.
Для выявления преморбидного фона за кроликами до проведения опыта наблюдали в течение 21 дня. После карантина кроликов помещали в экспериментальные клетки собственной конструкции [21] и в течение 3 дней наблюдали за животными (процесс адаптации животных к новым клеткам). В виварии поддерживали температуру воздуха 24–26 °С в соответствии с приказом МЗ РФ № 267 от 19.06.2003 и требованиями Европейской конвенции (Страсбург, 1986) по содержанию, кормлению и уходу за подопытными животными, выводу их из эксперимента и последующей утилизации.
В период эксперимента за кроликами проводили наблюдение в течение 21 дня. У погибших животных проводили вскрытие и исследование следующих органов: почек, легких, печени и головного мозга. Определяли в органах концентрацию культивируемых бактерий. Из органов готовили гистологические срезы и определяли наличие патологических изменений в органах. Для гистологических исследований внутренние органы фиксировали в 10 % растворе нейтрального формалина. Гистологические срезы готовили методом заморозки и заливки в парафин. Гистологические препараты окрашивали гематоксилином и эозином, суданом III (выявление капель жира), по Pero, Бесту (выявление гранул гликогена), скопление фибрина определяли по методу Д.Д. Зербино.
Результаты исследования и их обсуждение
Анализ проведенных исследований показал, что наблюдались существенные отличия в сроках гибели животных после подкожного введения культивируемых и некультивируемых бактерий P. aeruginosa и S. aureus на фоне ожоговой травмы (рис. 1). Гибель животных после введения некультивируемых бактерий наблюдалась в период с 18 часов по 13 сутки и достигала 87,5 % от числа животных взятых в опыт. Четыре кролика погибло в течение 23-х часов. Через 56 часов погибало 62,5 % животных. После введения культивируемых бактерий гибель животных регистрировалась с 12 по 15 день после термической травмы. Погибало 75,0 % животных.
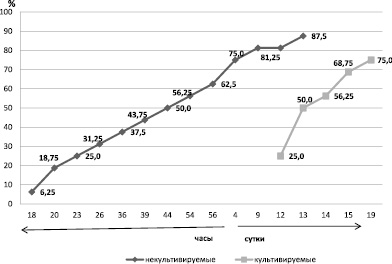
Рис. 1. Динамика гибели животных после подкожного введения культивируемых и некультивируемых бактерий S.aureus и P.aeruginosa на фоне ожоговой травмы
Микробиологические исследования внутренних органов животных показали, что у кроликов, погибших с 1 по 4 день после введения некультивируемых бактерий, инфекционный процесс был вызван культивируемыми бактериями P. aeruginosa. В печени кроликов, погибших в первый день инфекционного процесса, концентрация культивируемых P. aeruginosa составила 2,04 ± 0,3∙103 микробных клеток в 1 мл, а к 4-му дню болезни достигла 1,6 ± 0,06∙108 микробных клеток в 1 мл. Культивируемые бактерии S. aureus и E.coli в печени в течение первых суток выделить не удалось. Аналогичная тенденция увеличения концентрации P. aeruginosa отмечалась в легких и почках.
Микробиологические исследования внутренних органов животных после введения культивируемых бактерий P. aeruginosa и S. aureus на фоне ожоговой травмы показали, что в органах животных происходило увеличение концентрации P. aeruginosa в острой стадии ожоговой болезни.
У кроликов, погибших после подкожного введения культивируемых бактерий на фоне ожоговой травмы, температура тела повышалась за 4 дня до летального исхода до 39,8–40,7 °С, что характерно для развития инфекционного процесса.
Отмечались различия в типах температурных кривых у кроликов, инфицированных некультивируемыми бактериями на фоне термической травмы. У кроликов, погибших на 2–3 сутки, перед гибелью наблюдалось снижение температуры тела до 37,2–37,4 °С. Гибель кроликов в первые сутки (4 кролика) и снижение температуры тела кроликов перед гибелью характерно для шокового состояния. У кроликов, погибших на 4-е сутки, наблюдалась атипичная лихорадка с большими перепадами температуры в течение суток, достигающими 2–2,5 °С. Подобная динамика температурной кривой характерна для септических состояний. У животных, погибших на 11,0 ± 2,5 сутки, перед гибелью наблюдалось повышение температуры тела до 40,2–40,5 °С, что характерно для развития генерализованного инфекционного процесса.
Таким образом, температурная кривая у животных, инфицированных некультивируемыми бактериями, свидетельствует о различном патологическом процессе в организме животных в различные периоды ожоговой болезни.
Культивируемые бактерии на фоне ожоговой травмы вызывали клиническую симптоматику поражения желудочно-кишечного тракта на 12–15 день заболевания, а при введении некультивируемых бактерий в первые дни болезни у животных наблюдались симптомы поражения центральной нервной системы, в период с 4 дня болезни появилась клиническая симптоматика поражения желудочно-кишечного тракта.
При патологоанатомическом вскрытии животных, инфицированных некультивируемыми бактериями на фоне ожоговой травмы, отмечался отек головного мозга у 4 кроликов (28,6 %).
Клиническая симптоматика поражения головного мозга, развитие шокового состояния, гибель животных в течение первых двух суток и отек мозговой ткани при патологоанатомическом вскрытии согласуются с данными гистологических исследований. В гистологических срезах головного мозга погибших животных обнаружены признаки отека мягких мозговых оболочек, их утолщение, разрыхление волокнистых структур (рис. 2).
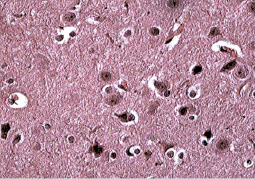
Рис. 2. Периваскулярный и перицеллюлярный отек головного мозга у кролика, погибшего после подкожного введения некультивируемых бактерий на фоне ожоговой травмы. Окр. ГЭ, х 40
В крупных оболочечных сосудах наблюдалось полнокровие, а в мелких – стаз. Наблюдался неравномерно выраженный перицеллюлярный отек мозговой ткани. В эндотелии сосудов наблюдались клетки с набухшими ядрами и со сморщиванием ядра вплоть до пикноза. Накапливались липиды в эндотелии сосудов и адвентициальных клетках. В отделах коры больших полушарий, мозжечка, в полосатом теле, ядрах зрительного бугра, субталамическом ядре Льюиса обнаружены различной формы некробиотические изменения нервных клеток. На рис. 2 видны дистрофически-дегенеративные изменения нервных клеток.
Анализ микробного пейзажа внутренних органов животных, инфицированных культивируемыми и некультивируемыми бактериями на фоне ожоговой травмы, согласуется с микробным пейзажем выделения культивируемых бактерий от больных с ожоговой болезнью. На ожоговой поверхности и в организме пациентов определялись условно-патогенные и патогенные бактерии, биопленкообразующие бактерии и их планктонная фракция, на поверхности ожоговой раны уже через 48 часов бактерии P. aeruginosa формировали биопленку [22, 23, 24, 25, 26].
В результате проведенных нами исследований установлено, что в различных стадиях инфекционного процесса в организме кроликов наблюдались изменения в соотношениях между количеством культивируемых и некультивируемых бактерий (рис. 3).
Непосредственно после введения некультивируемых бактерий при наличии благоприятных условий для размножения бактерий в организме кроликов происходил процесс перехода некультивируемых бактерий в культивируемое состояние. В остром периоде болезни в микробных популяциях преобладали культивируемые бактерии, а в период реконвалесценции происходило снижение в микробных популяциях концентрации культивируемых бактерий и увеличение количества некультивируемых бактерий.
В организме кроликов переход некультивируемых бактерий в культивируемое состояние происходил в течение 2–3 суток. В более поздний период наблюдался переход культивируемых бактерий в некультивируемое состояние под влиянием специфических и неспецифических защитных факторов макроорганизма. Бактерии теряли способность размножаться в различных биологических жидкостях животных. Формировалось определенное количество бактерий с признаками анабиоза.
На развитие патологических процессов в организме кроликов существенное влияние оказывала транслокация бактерий (рис. 4).
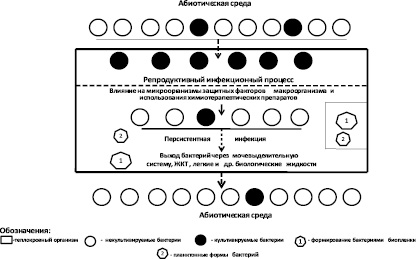
Рис. 3. Принципиальная схема изменчивости биопленкообразующих бактерий P. aeruginosa в организме кроликов породы шиншилла
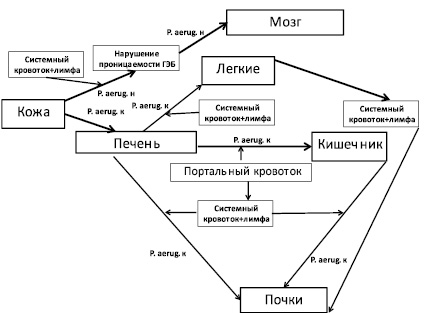
Рис. 4. Динамика транслокации P. aeruginosa в организме кроликов породы шиншилла после подкожного введения животным некультивируемых бактерий на фоне ожоговой травмы. Обозначения: P. aerug. н – некультивируемые бактерии P. aeruginosa; P. aerug. к – культивируемые бактерии P. aeruginosa
В течение первых двух суток некультивируемые бактерии P. aeruginosa из подкожных локусов при нарушении проницаемости гематоэнцефалитического барьера (ГЭБ) проникали в головной мозг животных.
Через 24–54 часа после подкожного введения некультивируемых бактерий P. aeruginosa лабораторным животным наблюдался переход их в культивируемое состояние и происходила транслокация культивируемых бактерий P. aeruginosa в печень из подкожных локусов. Из печени культивируемые бактерии P. aeruginosa проникали через портальный кровоток в легкие, почки и в кишечник.
Наличие культивируемых бактерий P. aeruginosa в выше перечисленных органах подтверждено результатами микробиологических исследований (табл. 1).
Динамика изменения концентрации культивируемых P. aeruginosa во внутренних органах животных, инфицированных некультивируемыми бактериями на фоне ожоговой травмы
Целью исследования была оценка противовирусной активности метилглюкаминовой соли акридонуксусной кислоты (препарат циклоферон) в отношении вирусов гриппа A/Swine/1976/31 (H1N1) в опытах in vivo.
В работе использовали препарат циклоферон в виде 12,5% водного раствора. Тамифлю (Этил (3R,4R,5S)-4-ацетамидо-5-амино-3-(1-этилпропокси)-1-циклогексен-1-карбоксилат фосфат, Hoffmann LaRoche, Швейцария).
Экспериментальная гриппозная инфекция
Для заражения животных была использована вируссодержащая аллантоисная жидкость куриных эмбрионов. Из нее готовили серию 10-кратных разведений на физиологическом растворе, после чего инфекционная активность вируса в заражающем материале была определена в отдельном эксперименте при помощи титрования по летальности на животных. Титр вируса рассчитывали по методу Рида и Менча (Am.J.Hyg.,1938,27:493-497).
Исследуемые препараты вводили животным внутрибрюшинно в объеме 0,2 мл в следующих дозах: циклоферон - 120 мг/кг, ремантадин - 50 мг/кг, тамифлю — 20 мг/кг веса животных. Препараты вводили по лечебно-профилактической схеме: за 24 часа и 1 час до заражения и через 24, 48 и 72 часа после заражения. В качестве плацебо контрольной группе животных вводили физиологический фосфатный буфер. В качестве отрицательного контроля использовали интактных животных, которые содержались в тех же условиях, что и опытные группы.
Вирусы вводили животным интраназально под легким эфирным наркозом в дозе 1 LD50. Наблюдение за животными осуществляли в течение 14 дней, т.е. срока, в течение которого при экспериментальном гриппе отмечается смертность животных. Ежедневно фиксировали смертность животных в контрольных и опытных группах. На основании смертности животных в группах рассчитывали процент летальности, индекс защиты (IP, отношение разницы процентов смертности в контрольной и опытной группах к проценту смертности в контрольной группе) и среднюю продолжительность жизни животных (из расчета 14 дней наблюдения).
В группе животных (n=10), получавших циклоферон, погибло 4 (40%), осталось в живых -6 (60%) особей. Средняя продолжительность их жизни составила 12.1 суток, индекс защиты- 30%. В группе животных (n=10), получавших тамифлю, погибло 3 (30%), осталось в живых 7 особей. Средняя продолжительность их жизни составила 12.2 суток, индекс защиты 47.5%. В контрольной группе мышей (n=14) погибло 8 особей, в живых осталось 6, смертность составила 57.1%. Средняя продолжительность их жизни составила 10.3 суток.
В группе животных (n=10), получавших ремантадин, погибло 2 особи (20%), осталось в живых 8 животных, средняя продолжительность жизни составила 13.4 суток, индекс защиты 65%.
Таким образом, по показателю средняя продолжительность жизни животных, циклоферон не уступает тамифлю (соответственно 12.1 и 12.2 суток). По показателю летальность (соответственно 40 и 30%) циклоферон незначительно (1 особь) уступает тамифлю. Индекс защиты на тамифлю составил 47.5, а на циклофероне - 30.0%, уступая тамифлю на 17.5%. Индекс защиты ремантадина против устойчивого вируса A/PR/8/34 составил 15-23%, тогда как циклоферона - 35-41%.
С учетом полученных экспериментальных данных целесообразно, с целью экстренной профилактики гриппа А рекомендовать прием указанных препаратов, а при тяжелом течении вирусной инфекции, рекомендовать комбинированный прием циклоферона и тамифлю в дозах, указанных в инструкции по их медицинскому применению.
Резюме
Актуальность Эпштейна - Барр вирусной инфекции объясняется широкой циркуляцией вируса Эпштейна - Барр среди детского и взрослого населения, его тропностью к иммунокомпетентным клеткам с пожизненной персистенцией после первичного инфицирования и полиморфизмом клинических проявлений от субклинических форм, инфекционного мононуклеоза до формирования онкологических, аутоиммунных гематологических заболеваний. Персистенция Эпштейна -Барр вируса приводит к подавлению клеточного звена иммунитета, снижению продукции интерферонов и факторов неспецифической защиты, что способствует реактивации персистирующей инфекции, чаще всего без мононуклеозоподобного синдрома, и появлению атипичных мононуклеаров в крови с формированием лимфопролиферативного, интоксикационного, астеновегетативного синдромов, длительного субфебрилитета, что диктует необходимость применения иммунокоррегирующей терапии. В статье приведен клинический случай, в котором изложены описание и анализ течения хронической Эпштейна - Барр вирусной инфекции у ребенка дошкольного возраста (5 лет 8 мес.) с отягощенным преморбидным фоном. Эпизоды реактивации хронической персистирующей инфекции протекали под маской острой респираторной инфекции с лимфопролиферативным синдромом, гнойного тонзиллита, гнойного аденоидита. Терапия, включавшая антибиотики, препараты с противовирусной активностью коротким курсом, бактериальные лизаты, физиотерапию, имела временный и непродолжительный эффект. В силу отсутствия полного мононуклеозоподобного синдрома в клинике и атипичных мононуклеаров в гемограмме обследование на Эпштейна - Барр вирусную инфекцию не проводилось до пятилетнего возраста, в связи с чем она не была верифицирована, и, соответственно, ребенок не получал адекватной иммунотропной терапии. Только в 5 лет 8 мес. при очередном эпизоде активации хронической Эпштейна - Барр вирусной инфекции в состав комплексной терапии был включен меглюмина акридонацетат, на фоне которого была достигнута хорошая клинико-лабораторная динамика. Описанный клинический случай демонстрирует эффективность включения в состав комплексного лечения Эпштейна - Барр вирусной инфекции меглюмина акридонацетата, обладающего противовирусным, иммуномодулирующим и противовоспалительным действиями, что позволило получить достаточно быструю положительную клиническую динамику купирования интоксикационно-лихорадочного и лимфопролиферативного синдромов в острый период, а в дальнейшем - и астеновегетативного синдрома и достигнуть перехода активной хронической Эпштейна - Барр вирусной инфекции в латентную форму.
Ключевые слова: острая респираторная инфекция, гнойный тонзиллит, гнойный аденоидит, лимфопролиферативный синдром, меглюмина акридонацетат, иммунотропная терапия.
Chronic Epstein-Barr viral infection in children: a clinical case
Svetlana P. Kokoreva, Veronika B. Kotlova®, Oleg A. Razuvaev
Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia
Abstract
The urgency of Epstein-Barr virus infection is explained by wide circulation of Epstein-Barr virus among children and adults, its tropism to immunocompetent cells with lifelong persistence after primary infection and polymorphism of clinical manifestations from subclinical forms, infectious mononucleosis to formation of oncological, autoimmune hematological diseases. Persistence of Epstein - Barr virus leads to suppression of cellular immunity, decreased production of interferons and nonspecific protection factors, which contributes to reactivation of persistent infection, most often without mononucleosis-like syndrome, and the appearance of atypical mononuclears in blood with the formation of lymphoproliferative, intoxication, astheno-vegetative syndrome, long-term subfebrile condition, which dictates the need for immunocorrective therapy. This article presents a clinical case describing and analyzing the course of a chronic Epstein-Barr virus infection in a preschool child (5 years 8 months) with a pre-morbid background. Episodes of reactivation of chronic persistent infection occurred under the mask of acute respiratory infection with lymphoproliferative syndrome, purulent tonsillitis, purulent adenoiditis. Therapy, including antibiotics, short-course antiviral agents, bacterial lysates, and physiotherapy, had a temporary and short-lived effect. meglumine acridonacetate. The described clinical case demonstrates the effectiveness of the inclusion of meglumine acridonacetate, which has antiviral, immunomodulatory and anti-inflammatory effects, in the complex treatment of Epstein-Barr virus infection, This allowed to obtain fairly rapid positive clinical dynamics of relieving intoxication and febrile and lymphoproliferative syndromes in the acute period, and subsequently - astheno-vegetative syndrome and achieve the transition of active chronic Epstein - Barr virus infection into a latent form.
Keywords: acute respiratory infection, purulent tonsillitis, purulent adenoiditis, lymphoproliferative syndrome, meglumine acridonacetate, immunotropic therapy.
Введение
Сегодня Эпштейна - Барр вирусная инфекция (ЭБВИ) представляет собой междисциплинарную проблему и активно изучается не только инфекционистами, но и врачами других специальностей: педиатрами, оториноларингологами, ревматологами, гематологами, онкологами, неврологами, иммунологами. Это объясняется тем, что вирус Эпштейна - Барр (ВЭБ) является одним из наиболее распространенных возбудителей, выявляемых как в детском возрасте, так и среди взрослого населения. По данным различных исследователей, инфицированность ВЭБ составляет 17,7% в периоде новорожденности и возрастает до 90% и выше у лиц старших возрастных групп 2. Являясь оппортунистической инфекцией, она в большинстве случаев протекает бессимптомно. Особенностью манифестных форм ЭБВИ является полиморфизм клинических симптомов, начиная от инфекционного мононуклеоза до фульминантных тяжелейших форм, аутоиммунных и онкологических заболеваний, реализующихся спустя годы после диагностированной ЭБВИ. Доказано, что манифестация клинических проявлений развивается при первичном инфицировании и реактивации персистирующей инфекции 4.
В случае адекватного иммунологического ответа первичное инфицирование приводит к формированию латентной формы инфекции - персистирующей неактивной ЭВБИ. Приравниваясь к здоровому носительству, она является естественным завершением иммунологических изменений. При снижении иммунитета происходит реактивация инфекции с манифестными проявлениями -активация персистирующей инфекции. При тяжелом течении могут формироваться органные поражения: менингоэнцефалит, миокардит, гепатит, гломерулонефрит и другие с возможным летальным исходом 8.
Но чаще в клинической практике встречаются варианты повторной реактивации ЭБВИ с неспецифической симптоматикой, когда при отсутствии остро развившегося полного мононуклеозоподобного синдрома и появления атипичных мононуклеаров в периферической крови, характерных для инфекционного мононуклеоза, возникают утомляемость, слабость, артралгии, головная боль, снижение памяти и внимания, депрессия, субфебрилитет. При этом принято говорить о хронической инфекции, если симптоматика сохраняется в течение полугода. Дети с хронической ЭБВИ имеют, как правило, отягощенный преморбидный фон, страдают хроническим тонзиллитом, хроническим аденоидитом; у них формируются различные варианты лимфопролиферативного синдрома, умеренно выраженный интоксикационный синдром, астенизация, может быть субфебрилитет; у этой категории больных отмечаются частые рекуррентные заболевания, что объясняется иммуносупрессивным воздействием ВЭБ 13.
Изучение форм ЭБВИ стало быстро развиваться благодаря возможностям современной лабораторной диагностики, которая позволяет оценить время инфицирования и активность инфекционного процесса [15, 16]. Для острой первичной инфекции типично появление ДНК вируса в крови и иммуноглобулинов М к капсидному антигену (аVCAJgM) и (или) иммуноглобулинов к раннему ЕА-антигену (аЕАIgG), которые циркулируют с третьей недели инфицирования, а также низкоавидных иммуноглобулинов к капсидному антигену (аVCAIgG). Со временем низкоавидные аVCAIgG трансформируются в высокоавидные, сохраняясь пожизненно. Начиная со второго месяца с момента заражения появляются антитела к ядерному антигену (аEBNAIgG). У части пациентов они сохраняются всю жизнь, у части -элиминируются. Положительный результат исследования полимеразной цепной реакции (ПЦР) крови не позволяет судить о форме инфекции, так как может регистрироваться как при первичном инфицировании, так и при реактивации персистирующей инфекции. На фоне высокоавидных аVCAIgG и (или) аEBNAIgG при реактивации персистирующей инфекции появляются капсидные антитела класса М и (или) ранние антитела. Давность инфицирования вне обострения инфекционного процесса подтверждается обнаружением высокоавидных аVCAIgG и аEBNAIgG. Положительные результаты ПЦР слюны могут быть у 15-25% здоровых серопозитивных людей. Это происходит в силу пожизненной персистенции вируса в В-лимфоцитах, которые, находясь в лимфоидной ткани миндалин при латентной инфекции или ее активации, дают положительный результат исследования [17].
Иммунокорригирующая терапия Эпштейна - Барр вирусной инфекции
На сегодняшний день общепринятых принципов этиотропного лечения ЭБВИ не разработано, так как препараты с противовирусной активностью не позволяют элиминировать возбудитель из организма, и основой лечения является симптоматическая и патогенетическая терапия. Однако длительная персистенция ВЭБ, приводящая к угнетению клеточного иммунитета, факторов неспецифической защиты, интерферон-продуцирующей функции лейкоцитов, свидетельствует о необходимости использования иммунокорригирующих препаратов [18, 23-26].
В педиатрической практике хорошо зарекомендовали себя индукторы эндогенного интерферона, в частности меглюмина акридонацетат (Циклоферон®), которые имеют ряд преимуществ по сравнению с экзогенными интерферонами. При их назначении не вырабатываются аутоантитела на собственный интерферон, время выработки стимулированных эндогенных интерферонов контролируется макроорганизмом, что не приводит к его передозировке. Кроме того, индукторы эндогенного интерферона имеют высокую биодоступность 30. Циклоферон® является низкомолекулярным индуктором интерферона и, соответственно, оказывает противовирусное, иммуномодулирующее, противовоспалительное действия, стимулируя синтез а- и у-интерферона, что способствует усилению Т-клеточного иммунитета - нормализации субпопуляций СD3-лимфоцитов, СD4-лимфо-цитов, NK-клеток и иммунорегуляторного индекса. Прямое действие меглюмина акридонацетата реализуется через нарушение репликации вируса, блокирование вирусной ДНК или РНК, увеличение дефектных вирусных частиц и снижение вирус-индуцированного синтеза белка [32, 33]. Его клиническая эффективность доказана у детей при острой респираторной вирусной инфекции (ОРВИ) и гриппе, так как на ранней стадии инфицирования он подавляет репликацию вируса, стимулирует и поддерживает уровень всех видов интерферона. Из всех индукторов интерферона Циклоферон является самым быстрым, вызывая продукцию интерферона через 2-72 ч после введения, реализуя таким образом противовирусный и иммуномодулирующий эффекты уже через 2-3 ч после приема 36. Наибольшую эффективность у детей препарат имеет при низком интерфероновом статусе 36. Доказано прямое противовирусное действие Циклоферона с подавлением размножения вируса на стадии репликации и вирусного потомства, его способность индуцировать синтез эндогенного интерферона в отношении герпетических вирусов, и показана его клиническая эффективность у детей при различных герпесвирусных инфекциях, в том числе и ЭБВИ 40. В качестве примера успешного использования иммуно-тропной терапии при герпесвирусной инфекции приводим клинической случай течения и исхода хронической ЭБВИ у ребенка дошкольного возраста.
Anamnesis vitae: ребенок от третьей беременности (в семье есть двое детей 8 и 10 лет), протекавшей с угрозой прерывания (терапия дюфастоном) на фоне хронической фетоплацентарной недостаточности, третьих срочных родов путем кесарева сечения. Вес при рождении -3260 г, оценка по Апгар - 7-8 баллов. По поводу конъюгационной гипербилирубинемии была переведена на второй этап выхаживания. С рождения находилась на искусственном вскармливании в связи с гипогалактией у матери. До года наблюдалась неврологом по поводу перинатального поражения нервной системы, профилактические прививки с 12 мес. Из перенесенных заболеваний мама отмечала нетяжелые ОРИ в 1,5 года и острую кишечную инфекцию в 2 года 4 мес.
Предварительный диагноз - острая респираторновирусная инфекция, осложненная аденоидитом. Синусит (?).
Динамика и исходы. В гемограмме лейкоцитоза нет -9,5 х 10 9 /л, абсолютный лимфомоноцитоз (п4%, с28%, л56%, м12%), СОЭ - 18 мм/час. Биохимические тесты без патологических изменений, СРБ - 3 мг (норма - 0-10). При рентгенологическом исследовании придаточных пазух носа данных по синуситу не выявлено. Получен отрицательный результат ПЦР-исследования мазков из носоглотки (респираторный скрин). Лор-врачом диагностирован гнойный аденоидит. По данным ультразвукового исследования органов брюшной полости выявлялись умеренная гепатомегалия, мезентериальная лимфаденопатия.
Терапия в отделении включала антибиотики (цефтриаксон парентерально), Виферон-1 per rectum 2 раза в сутки, симптоматические средства, физиолечение. На фоне проводимого лечения в течение трех суток состояние ребенка оставалось без убедительной клинической динамики: продолжала лихорадить, сохранялись интоксикационный и лимфопролиферативный синдромы. На четвертый день пребывания в стационаре результаты лабораторного обследования: ПЦР+ крови на ВЭБ, аVCAJgM+ и аVCAIgG+ авидность 100%, аEAIgG–, аEBNAIgG+, что позволило диагностировать реактивацию хронической ЭБВИ. К лечению добавлен Циклоферон в таблетках по схеме на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23-е сутки. На третий день у девочки нормализовалась температура, восстановился аппетит, улучшилось самочувствие. Стал менее выраженным лимфопролиферативный синдром: носовое дыхание более свободное, уменьшился насморк. На 10-й день лечения ребенок жалоб не предъявлял. При объективном осмотре меньше выражены гипертрофия небных миндалин 1-й степени, шейная лимфаденопатия (размеры лимфоузлов уменьшились до 0,5 см), гепатомегалия 1,5 см. Выписана с клиническим улучшением с рекомендацией продолжить прием Циклоферона по схеме.
Клинический диагноз - хроническая Эпштейна - Барр вирусная инфекция, реактивация: лимфопролиферативный синдром, обострение хронического аденоидита, астеновегетативный синдром.
При объективном осмотре сохранялась умеренная гипертрофия небных миндалин, пальпировались мелкие, 0,3-0,5 см, безболезненные подчелюстные, передне-и заднешейные лимфоузлы, гепатомегалия отсутствовала, клинических проявлений астеновегетативного синдрома не отмечалось. Гемограмма соответствовала возрастной норме. В лабораторных тестах отсутствовали маркеры активной ЭБВИ: ПЦР крови - ДНК ВЭБ не обнаружено, аVCAJgM отрицательные, аEAIgG отрицательные, обнаружены аVCAIgG с авидностью 100% и аEBNAIgG.
Рисунок. Этапы формирования у пациентки хронической Эпштейна - Барр вирусной инфекции
Figure. Stages of chronic Epstein - Barr virus infection development in a patient
Заключение
Описанный клинический пример демонстрирует течение хронической ЭБВИ у больной в возрасте 5 лет 8 мес. с развитием лимфопролиферативного и астено-вегетативного синдромов. При реактивации хронической ЭБВИ, протекавшей с клиническими проявлениями ОРИ, гнойного тонзиллита, применялись антибиотики, препараты интерферона, глюкокортикостероиды интраназально, физиотерапия с временным эффектом. Назначение Циклоферона в составе комплексного лечения позволило получить достаточно быструю положительную клиническую динамику купирования интоксикационно-лихорадочного и лимфопролиферативного синдромов в острый период, а в дальнейшем -и астеновегетативного синдрома и достигнуть перехода активной хронической ЭБВИ в латентную форму, что подтверждается отсутствием маркеров активности хронической инфекции в течение года после использования Циклоферона.
Информация об авторах:
Кокорева Светлана Петровна, д.м.н., доцент, заведующая кафедрой инфекционных болезней, Воронежский государственный медицинский университет имени Н.Н. Бурденко; 394036, Россия, Воронеж, ул. Студенческая, д. 10.
Котлова Вероника Борисовна, к.м.н., доцент кафедры инфекционных болезней, Воронежский государственный медицинский университет имени Н.Н. Бурденко; 394036, Россия, Воронеж, ул. Студенческая, д. 10.
Разуваев Олег Александрович, к.м.н., доцент кафедры инфекционных болезней, Воронежский государственный медицинский университет имени Н.Н. Бурденко; 394036, Россия, Воронеж, ул. Студенческая, д. 10.
Information about the authors:
Svetlana P. Kokoreva, Dr. Sci. (Med.), Associate Professor, Head of the Department of Infectious Diseases, Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia.
Veronika B. Kotlova, Cand. Sci. (Med.), Associate Professor of the Department of Infectious Diseases, Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia.
Oleg A. Razuvaev, Cand. Sci. (Med.), Associate Professor of the Department of Infectious Diseases, Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia.
Особенности течения и терапии респираторного микоплазмоза у детей в эпидемический сезон 2020-2021 гг.
Список литературы
References
Читайте также:

